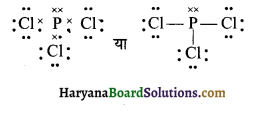
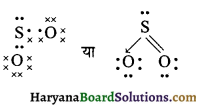
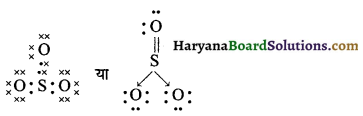
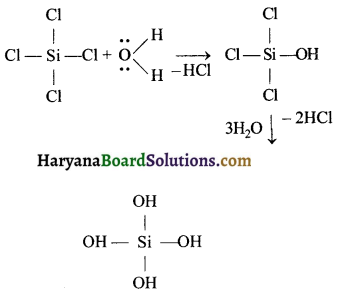
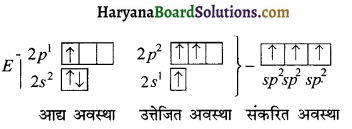
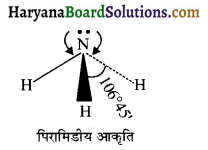
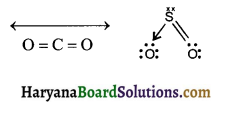
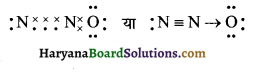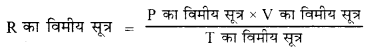HBSE 11th Class Chemistry Important Questions Chapter 5 द्रव्य की अवस्थाएँ
Haryana State Board HBSE 11th Class Chemistry Important Questions Chapter 5 द्रव्य की अवस्थाएँ Important Questions and Answers.
Haryana Board 11th Class Chemistry Important Questions Chapter 5 द्रव्य की अवस्थाएँ
बहुविकल्पीय प्रश्न
1. एक अज्ञात गैस तथा ऑक्सीजन गैस की विसरण गतियों का अनुपात 8: 10 है। अज्ञात गैस का अणुभार है-
(1) 64
(2) 25
(3) 32
(4) 50
उत्तर:
(4) 50
2. अणुओं की न्यूनतम संख्या निम्न में से किसमें होगी-
(1) 0.1 मोल SO2 में
(2) 11 लीटर SO2 में
(3) 22 ग्राम CO2 में
(4) 22.4 × 103 मिली SO2 में।
उत्तर:
(1) 0.1 मोल SO2 में
3. निम्नलिखित गैस में किसकी विसरण गति अधिकतम होगी?
(1) O2
(2) CO2
(3) NH3
(4) N2
उत्तर:
(3) NH3
4. 27°C पर एक गैस का दाब 90 सेमी है। स्थिर आयतन व – 173°C ताप पर गैस का दाब होगा-
(1) 30 सेमी
(2) 40 सेमी
(3) 60 सेमी
(4) 68 सेमी।
उत्तर:
(1) 30 सेमी
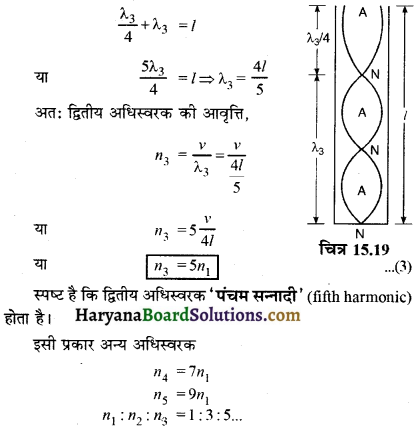
5. गैस A, गैस B से चार गुना भारी है। A तथा B के विसरण की दरों का अनुपात होगा-
(1) 4:1
(2) 1:4
(3) 2:1
(4) 1:2
उत्तर:
(4) 1:2
6. अणुओं की अधिकतम संख्या होगी-
(1) 16 g O2 में
(2) 16 g NO2 में
(3) 7 g N2 में
(4) 2 g H2 में।
उत्तर:
(4) 2 g H2 में।
7. 27°C पर 2 मोल N2 की गतिज ऊर्जा होगी—
(1) 5491.6 J
(2) 6491.6 J
(3) 7491°6 J
(4) 8882·4 J.
उत्तर:
(3) 7491°6 J
8. वान्डर वाल वास्तविक गैस आदर्श गैस की तरह व्यवहार करती है, किस शर्त पर –
(1) उच्च ताप, निम्न दाब पर
(2) निम्न ताप, उच्च दाब पर
(3) उच्च ताप, उच्च दाब पर
(4) निम्न ताप, निम्न दाब पर
उत्तर:
(1) उच्च ताप, निम्न दाब पर
9. CO2 के 1 मोल में निम्न में से क्या उपस्थित होता है-
(1) 6.02 x 1023 कार्बन परमाणु
(2) 6.02 x 1023 ऑक्सीजन परमाणु
(3) 18.1 × 1023 कार्बन डाई ऑक्साइड अणु
(4) कार्बन डाई ऑक्साइड के 5 ग्राम परमाणु।
उत्तर:
(1) 6.02 x 1023 कार्बन परमाणु
10. 0°C पर 1 लीटर के बल्ब में भरे 4 ग्राम O2 तथा 2 ग्राम H2 के मिश्रण का दाब है-
(1) 25.215 atm
(2) 31.205 atm
(3) 45.215 atm
(4) 15.210 atm.
उत्तर:
(1) 25.215 atm
11. गैस स्थिरांक ‘R’ निर्भर करता है-
(1) गैस के ताप पर
(2) गैस के आयतन पर
(3) गैस के मोलों की संख्या पर
(4) इनमें से किसी पर नहीं।
उत्तर:
(4) इनमें से किसी पर नहीं।
12. यदि गैस ‘A’ के विसरण की दर ‘B’ अपेक्षा पाँच गुंनी है तो A और B के घनत्व का अनुपात होगा-
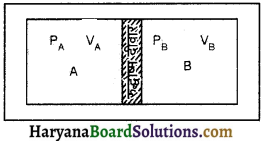
(1) 1/25
(2) 1/5
(3) 25
(4) 5
उत्तर:
(1) 1/25
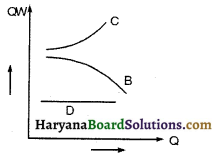
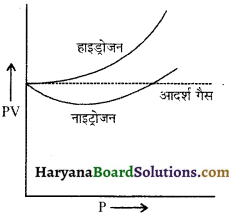
![]()
13. आदर्श गैस का सम्पीड्यता गुणांक होता है-
(1) 0
(2) 1
(3) 2
(4) 4.
उत्तर:
(2) 1
14. समान ताप और दाब पर निम्न गैसों में से किसकी सबसे अधिक प्रति मोल गतिज ऊर्जा होगी-
(1) H2
(2) O2
(3) CH4
(4) सबकी समान।
उत्तर:
(4) सबकी समान।
15. 300 K पर H2 की गतिज ऊर्जा X है। इस ताप पर D2 की गतिज ऊर्जा होगी-
(1) X
(2) X/2
(3) 2X
(4) उपरोक्त में से कोई नहीं।
उत्तर:
(1) X
16. गैसें आदर्श गैस व्यवहार से विचलित होती है क्योंकि उनके अण-‘
(1) नगण्य आयतन के होते हैं।
(2) उनमें आकर्षण बल होता हैं
(3) वे बहु- अणुक होते हैं
(4) एक-दूसरे से जुड़े नहीं होते।
उत्तर:
(2) उनमें आकर्षण बल होता हैं
17. निश्चित आयतन पर गैसों के निश्चित मोलों की संख्या के लिये, ताप में वृद्धि के साथ गैस के दाब में वृद्धि का कारण है-
(1) अणुओं के औसत वेग में वृद्धि
(2) मोलों की संख्या में वृद्धि
(3) अणुओं के आकर्षण में वृद्धि
(4) औसत मुक्त पक्ष में कमी।
उत्तर:
(1) अणुओं के औसत वेग में वृद्धि
18. निम्न में से गैस समीकरण है-
(1) \(\frac{\mathrm{P}_1 \mathrm{~V}_1}{\mathrm{P}_2 \mathrm{~V}_2}=\frac{\mathrm{T}_1}{\mathrm{~T}_2}\)
(2) \(\frac{\mathrm{V}_1 \mathrm{~T}_2}{\mathrm{P}_1}=\frac{\mathrm{V}_2 \mathrm{~T}_1}{\mathrm{P}_2}\)
(3) \(\frac{\mathrm{P}_1 \mathrm{~T}_1}{\mathrm{~V}_1}=\frac{\mathrm{P}_2 \mathrm{~T}_2}{\mathrm{~V}_2}\)
(4) \(\frac{\mathrm{V}_1 \mathrm{~T}_2}{\mathrm{~T}_1 \mathrm{~V}_2}=\mathrm{P}_1 \mathrm{P}_2\)
उत्तर:
(1) \(\frac{\mathrm{P}_1 \mathrm{~V}_1}{\mathrm{P}_2 \mathrm{~V}_2}=\frac{\mathrm{T}_1}{\mathrm{~T}_2}\)
19. एक गैस आदर्श व्यवहार की तरफ बढ़ती है-
(1) कम T एवं उच्च P पर
(2) उच्च T एवं कम P पर
(3) कम T एवं कम P पर
(4) उच्च T एवं उच्च P पर।
उत्तर:
(2) उच्च T एवं कम P पर
20. 5 लीटर के एक बंद फ्लास्क में 10 ग्राम हाइड्रोजन को 300 से 600K तक गर्म किया जाता है, कौन सा कथन सत्य है-
(1) टक्करों की दर बढ़ती है
(2) गैसीय अणुओं की ऊर्जा बढती है
(3) गैसों के मोलों की संख्या बढ़ती है।
(4) गैस का दाब बढ़ता है।
उत्तर:
(3) गैसों के मोलों की संख्या बढ़ती है।
21. स्थिर आयतन पर एक गैस के निश्चित मोलों की संख्या के लिये गैस का दाब, ताप वृद्धि के साथ बढ़ता है। इसका कारण है-
(1) औसत आण्विक गति में वृद्धि
(2) अणुओं के टक्करों की दर में वृद्धि
(3) आण्विक आकर्षण में वृद्धि
(4) माध्य मुक्त पथ में वृद्धि।
उत्तर:
(1) औसत आण्विक गति में वृद्धि
22. निम्न में से कौन सा कथन आदर्श गैस के सन्दर्भ में सत्यं नहीं है-
(1) यह द्रव में परिवर्तित नहीं की जा सकती है
(2) गैस के सभी अणु समान गति से चलते है
(3) अणुओं के बीच कोई पारस्परिक क्रिया नहीं होती है
(4) दिये गये ताप पर PV, गैस की मात्रा के समानुपाती होता है।
उत्तर:
(2) गैस के सभी अणु समान गति से चलते है
23. यदि P, V, M, T तथा R क्रमशः दाब, आयतन, मोलर द्रव्यमान, ताप तथा गैस स्थिरांक हैं तो एक आदर्श गैस का घनत्व होगा-
(1) \(\frac { RT }{ PM }\)
(2) \(\frac { P }{ RT }\)
(3) \(\frac { PM }{ RT }\)
(4) \(\frac { M }{ V }\)
उत्तर:
(3) \(\frac { PM }{ RT }\)
24. निम्न में से कौन सा सूत्र स्थिर दाब पर चार्ल्स के नियम का पालन करता है-
(1) V ∝ \(\frac { 1 }{ T }\)
(2) V ∝ \(\frac { 1 }{ T² }\)
(3) V ∝ T
(4) V = d
उत्तर:
(3) V ∝ T
25. स्थिर ताप पर आदर्श गैस के निश्चित द्रव्यमान में-
(1) दाब व आयतन का गुणनफल सदैव स्थिर रहता है
(2) दाब व आयतन का अनुपात सदैव स्थिर रहता है
(3) आयतन सदैव स्थिर रहता है
(4) दाब सदैव स्थिर रहता है।
उत्तर:
(1) दाब व आयतन का गुणनफल सदैव स्थिर रहता है
26. एक आदर्श गैस के एक मोल की आन्तरिक ऊर्जा है-
(1) \(\frac { 3 }{ 2 }\) RT
(2) \(\frac { 3 }{ 2 }\)
(3) \(\frac { 1 }{ 2 }\) RT
(4) \(\frac { 1 }{ 2 }\) KT
उत्तर:
(1) \(\frac { 3 }{ 2 }\) RT
27. निम्न में से कौन-सा गैस मिश्रण डाल्टन के आशिंक दाब नियम का पालन नहीं करता है-
(1) HCl तथा NH3
(2) N2 तथा O2
(3) O2 तथा CO2
(4) CO2 तथा He.
उत्तर:
(1) HCl तथा NH3
![]()
28. स्थिर ताप पर गैस को प्रसारित करने पर –
(1) दाब घटता है
(2) अणु की गतिज ऊर्जा स्थिर रहती है
(3) अणु की गतिज ऊर्जा घटती है
(4) गैस के अणुओं की संख्या बढ़ती है।
उत्तर:
(1) दाब घटता है
29. गैस स्थिरांक R तथा बोल्ट्जमैन स्थिरांक K में क्या सम्बन्ध है- यदि (NA = आवोगाद्रो संख्या)
(1) R = KNA
(2) RK = NA
(3) R + K = NA
(4) K = RNA
उत्तर:
(1) R = KNA
30. किस ताप को परम शून्य ताप कहते हैं।
(1 ) – 273°C
(2) – 273.15°C
(3) 0°C
(4) 1/273°C.
उत्तर:
(2) – 273.15°C
31. जल का क्वथनांक अपेक्षाकृत अधिक होता है। इसका कारण है-
(1) जल का आयनिक होना
(2) जल का सह-संयोजक होना
(3) जल में हाइड्रोजन बन्ध की उपस्थिति
(4) इनमें से कोई नहीं।
उत्तर:
(3) जल में हाइड्रोजन बन्ध की उपस्थिति
32. अणुओं के मध्य सबसे अधिक आकर्षण बल पाया जाता है-
(1) ठोस अवस्था में
(2) द्रव अवस्था में
(3) गैस अवस्था में
(4) कोलॉइडी अवस्था में।
उत्तर:
(1) ठोस अवस्था में
33. अणुओं के मध्य सर्वाधिक दूरी पायी जाती है-
(1) ठोस अवस्था में
(2) द्रव अवस्था में
(3) गैस अवस्था में
(4) कोलॉइडी अवस्था में।
उत्तर:
(3) गैस अवस्था में
34. यदि स्थिर ताप पर किसी गैस का आयतन बढ़ जाये तो यह क्या दर्शाती है-
(1) अणुओं की गतिज ऊर्जा में कोई परिवर्तन नहीं होता
(2) गैस के अणुओं की संख्या बढ़ जाती है।
(3) अणुओं की गतिज ऊर्जा में कमी आ जाती है
(4) गैस का दाब बढ़ जाता है।
उत्तर:
(1) अणुओं की गतिज ऊर्जा में कोई परिवर्तन नहीं होता
35. निम्न में से किसका पृष्ठ तनाव सर्वाधिक है-
(1) ऐथेनॉल
(2) मेथेनॉल
(3) जल
(4) बेन्जीन।
उत्तर:
(3) जल
अति लघु उत्तरीय प्रश्न
प्रश्न 1.
दाब का मात्रक क्या है?
उत्तर:
पास्कल (Pa)
प्रश्न 2.
वायुमण्डलीय दाब पास्कल में व्यक्त दाब से किस प्रकार सम्बन्धित है।
उत्तर:
1 atm = 1.013 x 105 Pa
प्रश्न 3.
ताप का केल्विन पैमाना सेल्सियस पैमाने से किस प्रकार सम्बन्धित है?
उत्तर:
K = t° C + 273
प्रश्न 4.
किसी गैस का परमशून्य ताप क्यों प्राप्त नहीं किया जा सकता है?
उत्तर:
इस ताप पर आने से पहले ही गैस द्रवीत हो जाती है।
प्रश्न 5.
R का मान क्या हैं?
उत्तर:
R = 0.0821 L atm K-1 mol-1
प्रश्न 6.
वायु दाब क्या है? इसकी SI इकाई लिखें।
उत्तर:
बर्तन के प्रति इकाई क्षेत्रफल पर गैस अणुओं द्वारा उत्पन्न बल वायु दाब – कहलाता है। इसकी SI इकाई पास्कल (Pa) है।
प्रश्न 7.
SI इकाई में गैस स्थिरांक R का मान बताइये।
उत्तर:
8.314 J K-1 mol-1
प्रश्न 8.
संपीड्यता गुणांक से आप क्या समझते हैं?
उत्तर:
Z = \(\frac { PV }{ RT }\)
प्रश्न 9.
वान डर वाल्स समीकरण लिखिये।
उत्तर:
\(\left[\mathrm{P}+\frac{a}{\mathrm{~V}_2}\right]\) (V – b) = 1 मोल के लिए
a तथा b वाण्डर वाल्स स्थिरांक हैं।
प्रश्न 10.
गैस मिश्रण के आंशिक दाब का गैस मिश्रण के कुल दाब से क्या सम्बन्ध है?
उत्तर:
P (कुल दाब) = P + P2 + P3 + ……..
इसका आंशिक दाब P1 = मोल अंश x कुल दाब।
प्रश्न 11.
वान डर वाल्स स्थिरांक तथा 6 का क्या महत्व है?
उत्तर:
स्थिरांक a की प्रबलता अन्तर- अणुक आकर्षण को बताती है। जबकि स्थिरांक 6 की प्रबलता गैस के अणुओं का आकार बताती है।
प्रश्न 12.
ऊँचाई के साथ (वायुमण्डल में) गुब्बारे का आकार क्यों बढ़ता है?
उत्तर:
ऊँचाई के बढ़ने पर वायुमण्डलीय दाब कम हो जाता है। अतः गुब्बारे की भीतरी वायु के आयतन प्रसार के कारण उसका आकार बढ़ जाता है।
प्रश्न 13.
कमरे के ताप पर He और हाइड्रोजन द्रवित नहीं होतीं, क्यों?
उत्तर:
इन गैसों का क्रान्तिक ताप कमरे के ताप से कम होता है।
प्रश्न 14.
क्रान्तिक ताप क्या है?
उत्तर:
वह ताप जिससे अधिक ताप पर कोई गैस द्रवित नहीं हो सकती दाब कितना भी अधिक हो, क्रान्तिक ताप कहलाता है।
प्रश्न 15.
क्रान्तिक दाब से क्या समझते हो?
उत्तर:
किसी गैस को उसके क्रान्तिक ताप पर द्रवित करने के लिये आवश्यक न्यूनतम दाब उस गैस का क्रान्तिक दाब कहलाता है।
प्रश्न 16.
क्रान्तिक आयतन से क्या समझते हो?
उत्तर:
क्रान्तिक दाब व क्रान्तिक ताप पर किसी गैस के 1 मोल का आयतन उस गैस का क्रान्तिक आयतन (V) कहलाता है।
प्रश्न 17.
श्यानता क्या है?
उत्तर:
द्रवों में होने वाले प्रवाह के विरूद्ध कार्यरत आवश्यक आन्तरिक प्रतिरोध द्रव की श्यानता कहलाती है।
प्रश्न 18.
जलीय तनाव क्या होता है?
उत्तर:
जल क्रिया न करने वाली गैसें (H2, O2, CH4) को जल के ऊपर संग्रहीत करने पर जार में वाष्प दाब भी उपस्थित रहता है। अतः हम शुष्क गैस का दाब ज्ञात नहीं करते हैं। बल्कि नम गैस का वाष्प दाब ज्ञात करते हैं। इस प्रकार जल वाष्प द्वारा लगाया गया दाब जलीय तनाव (aquous tension) कहलाता है।
प्रश्न 19.
आवोगाद्रो संख्या क्या है?
उत्तर:
समान ताप व दाब पर गैसों के समान आयतनों में उनके अणुओं की संख्या समान होती है। इसे NA से व्यक्त करते हैं। इसका मान 6.023 x 1023 होता है।
प्रश्न 20.
वास्तविक गैस का व्यवहार आदर्श गैस के समान कब होता है।
उत्तर:
कम वायु मण्डलीय दाब व उच्च तापमान पर।
प्रश्न 21.
त्रिक बिन्दु से क्या समझते हो?
उत्तर:
वह ताप जिस पर ठोस, द्रव तथा गैस एक साथ पाये जाते हैं, त्रिक बिन्दु कहलाता है।
प्रश्न 22.
किसी द्रव्य के गलनांक पर दाब का क्या प्रभाव पड़ता है?
उत्तर:
दाब बढ़ाने पर गलनांक बढ़ता है।
प्रश्न 23.
किस शर्त पर कोई गैस आदर्श व्यवहार में विचलन दर्शाती है?
उत्तर:
आदर्श गैस के व्यवहार विचलन कम ताप व उच्च दाब पर होता है।
प्रश्न 24.
H2 तथा He का द्रवीकरण बहुत जटिल है, क्यों?
उत्तर:
क्योंकि इनका क्रान्तिक ताप बहुत कम होता है।
प्रश्न 25.
ताप का कैल्विन पैमाना क्या होता है?
उत्तर:
T(K) = (t°C) + 273
प्रश्न 26.
आदर्श गैस के लिये संपीडक गुणांक कितना होता है?
उत्तर:
Z = \(\frac { PV }{ RT }\)
आदर्श गैस के लिये PV= RT अत: Z = 1
प्रश्न 27.
किस परिस्थिति में वास्तविक गैसें से आदर्श गैस की तरह व्यवहार करती हैं।
उत्तर:
कम दाब व उच्च ताप पर।
![]()
प्रश्न 28.
NH3, O2, CO2 तथा SO2 में किसकी विसरण दर अधिकतम होगी?
उत्तर:
NH3 की, क्योंकि इसका अणुभार सबसे कम है।
प्रश्न 29.
CO2 तथा N2O की विसरण गतियों में क्या अनुपात है?
उत्तर:
दोनों की विसरण गति समान होगी, क्योंकि दोनों का अणुभार समान है।
प्रश्न 30.
SO2, NH3, H2O तथा CO2 को द्रवीकरण की आसानी के घटते क्रम में लिखो?
उत्तर:
SO2 > NH3 > H2O > CO2
प्रश्न 31.
समताप रेखाएँ क्या हैं?
उत्तर:
स्थिर ताप पर P तथा V के बीच खींची गयी रेखायें।
प्रश्न 32.
मोलर आयतन से क्या अभिप्राय है?
उत्तर:
किसी ताप तथा दाब पर एक मोल गैस का आयतन मोलर आयतन कहलाता है। S. T.P पर इसका मान 22.4 लीटर होता है।
प्रश्न 33.
परम ताप पर गैसों का आयतन शून्य नहीं होता है, क्यों?
उत्तर:
परम ताप आने से पूर्व ही प्रत्येक गैस द्रवित हो जाती है। अत: गैसों के लिये PV = RT समीकरण परम ताप पर लागू नहीं होती है। इसके मान से कम होता है, क्यों?
प्रश्न 34.
अधिक दाब पर PV/RT का मान आदर्श गैसों के लिये
उत्तर:
क्षीण अन्तराणुक बलों के कारण।
प्रश्न 35.
CO तथा N2 की विसरण की दर समान होती है, क्यों?
उत्तर:
क्योंकि दोनों के अणुभार समान हैं।
प्रश्न 36.
ऑक्सीजन अणुओं के मध्य लगने वाले वाण्डर वाल्स बल को कौन-सा वान डर वाल्स बल कहेंगे?
उत्तर:
ऑक्सीजन अणु अध्रुवीय है, अतः इनके मध्य लगने वाले बल प्रकीर्णन बल अथवा लंडन बल कहलाते हैं।
प्रश्न 37.
दो स्थायी द्विध्रुव रखने वाले अणुओं के मध्य आकर्षण बलों को क्या कहते हैं?
उत्तर:
स्थायी द्विध्रुव रखने वाले अणुओं के मध्य आकर्षण बलों को द्विध्रुव-द्विध्रुव आकर्षण बल कहते हैं।
प्रश्न 38.
Cl2, Br2 तथा I2 अणुओं के मध्य लगने वाले वान डर वाल्स बलों का घटता क्रम है।
उत्तर:
जिन अणुओं का अणुभार ज्यादा होता है उन पर लगने वाले वान्डर वाल्स बलों का मान भी अधिक होता है अतः बलों का घटता क्रम है।
I2 > Br2 > Cl2.
प्रश्न 39.
Ne, Ar तथा Kr में किसका क्वथनांक सबसे कम होगा एवं क्यों?
उत्तर:
इन तीनों में Ne का क्वथनांक सबसे कम होगा क्योंकि इसका अणुभार सबसे कम है जिस कारण इस पर लगने वाले वान डर वाल्स बल के मान भी कम होंगे अतः क्वथनांक भी सबसे कम होगा।
प्रश्न 40.
दो शून्य द्विध्रुव रखने वाले अणुओं के मध्य आकर्षण बल कौन सा होगा?
उत्तर:
शून्य द्विध्रुव आघूर्ण रखने वाले अणुओं के मध्य लगने वाला आकर्षण बल लंडन बल या प्रकीर्णन बल कहलाता है।
प्रश्न 41.
वान डर वाल्स बलों में उत्पन्न ऊर्जा अणुओं के मध्य दूरी से किस प्रकार सम्बंधित है?
उत्तर:
माना कि ऊर्जा ‘E’ तथा अणुओं के मध्य दूरी यदि ‘r’ है तो E ∝ \(\frac{1}{r^6}\)
प्रश्न 42.
बॉयल नियम को परिभाषित कीजिए।
उत्तर:
बॉयल का नियम स्थिर ताप पर किसी गैस की निश्चित मात्रा का दाब उसके आयतन के व्युत्क्रमानुपाती होता है।
Ρ α \(\frac { 1 }{ V }\) (स्थिर T व n पर)
प्रश्न 43.
आयोगाद्रो संख्या क्या है? इसका मान लिखिए।
उत्तर:
किसी पदार्थ के एक मोल में उपस्थित पदार्थ के कणों की संख्या को आवोगाद्रो संख्या कहते हैं।
NA = 6.02 × 1023
प्रश्न 44.
आदर्श गैस समीकरण लिखें।
उत्तर:
PV = nRT
प्रश्न 45.
गैसों का अणु गति समीकरण लिखिए।
उत्तर:
गैसों का अण गति समीकरण
PV = \(\frac { 1 }{ 3 }\)mN\(\bar{u}\)²
यहाँ P = गैस का दाब
V= गैस का आयतन
m = गैस के अणु का द्रव्यमान
N = गैस के अणुओं की संख्या
\(\bar{u}\) = वर्ग माध्य मूल वेग।
प्रश्न 46.
वान्डर वाल्स समीकरण जो कि वास्तविक गैसों के लिये है, लिखें।
उत्तर:
\(\left(\mathrm{P}+\frac{a n^2}{\mathrm{~V}^2}\right)\) (V – nb) = nRT
प्रश्न 47.
वान डर वाल्स नियतांक ‘a’ तथा ‘b’ पर टिप्पणी दीजिए।
उत्तर:
‘a’ का मान गैस के अणुओं में अन्तराणुक आकर्षण का परिमाण है। ‘b’ का मान अपवर्जित आयतन को प्रदर्शित करता है जो कि गैस अणुओं के वास्तविक आयतन का चार गुना होता है।
प्रश्न 48.
गैसों के द्रवण में क्रान्तिक ताप का क्या महत्व है, समझाइये?
उत्तर:
वह ताप जिस पर या जिसके नीचे ताप पर किसी गैस को केवल दाब लगा कर द्रवित किया जा सकता हो, उसे गैस का क्रान्तिक ताप कहते हैं।
उदाहरण – CO2 का क्रान्तिक ताप 31°C है।
प्रश्न 49.
वाहनों के पहियों में गर्मियों में हवा का दबाव कम रख जाता है। क्यों?
उत्तर”
क्योंकि ताप अधिक होने पर गैस का दाब भी बढ़ जाता है।
प्रश्न 50.
जूल थॉमसन प्रभाव में आदर्श गैसों के ताप में कोई परिवर्तन नहीं होता, क्यों?
उत्तर:
क्योंकि आदर्श गैस के अणुओं के मध्य कोई भी आकर्षण बल नहीं होता है। इस कारण जूल थॉमसन प्रभाव में आदर्श गैसों के ताप में कोई परिवर्तन नहीं होता है।
प्रश्न 51.
क्या सभी गैसीय अणुओं की चाल समान होती है?
उत्तर:
नहीं, अणुओं की चाल अणुओं के अणुभार पर निर्भर करती है।
प्रश्न 52.
‘R’ का मान J K-1 mol-1 में क्या होता है?
उत्तर:
‘R’ का मान 8.314 J K-1 mol-1 होता है।
प्रश्न 53.
आण्विक टक्करों की प्रकृति क्या होती है?
उत्तर:
आण्विक टक्करों की प्रकृति पूर्णतः प्रत्यास्थ होती है।
प्रश्न 54.
द्रव के पृष्ठ तनाव पर ताप का प्रभाव बताइये?
उत्तर:
ताप बढ़ाने पर द्रव का पृष्ठ तनाव घट जाता है।
प्रश्न 55.
द्रव के क्वथनांक पर दाब का प्रभाव बताइये?
उत्तर:
दाब बढ़ाने पर द्रव का क्वथनांक बढ़ जाता है।
प्रश्न 56.
द्रव की श्यानता पर ताप का क्या प्रभाव होता है?
उत्तर:
ताप बढ़ाने पर द्रव की श्यानता घट जाती है।
प्रश्न 57.
R का मान cm³ bar K-1 mol-1 में बताएँ।
उत्तर:
R = 82.1 cm³ bar K-1 mol-1 होता है।
प्रश्न 58.
वास्तविक गैस क्या होती है?
उत्तर:
वे गैसें जो ताप एवं दाब की सभी परिस्थितियों में आदर्श गैस के व्यवहार को नहीं दर्शाती हैं, वास्तविक गैसें कहलाती हैं।
प्रश्न 59.
क्वथनांक को परिभाषित कीजिये।
उत्तर:
वह ताप जिस पर द्रव की सतह का वाष्पदाब वायुमण्डलीय दाब के बराबर हो जाता है। क्वथनांक कहलाता है।
प्रश्न 60.
विभिन्न तापों पर आदर्श गैसों के P व V का गुणनफल समान होता है या नहीं।
उत्तर:
भिन्न-भिन्न होता है।
प्रश्न 61.
बॉयल ताप को परिभाषित कीजिए।
उत्तर:
वह ताप, जिस पर कोई वास्तविक गैस दाब की अधिकतम परास में आदर्श गैस के समान व्यवहार करती है, बॉयल ताप कहलाता है।
प्रश्न 62.
क्या क्वथन वाष्पीकरण के समान है?
उत्तर:
नहीं, क्वथन व वाष्पीकरण समान नहीं होते हैं।
प्रश्न 63.
किस प्रकार के गैसीय मिश्रण के लिये डाल्टन का नियम उपयुक्त होता है?
उत्तर
अक्रियाशील गैसीय मिश्रण के लिए डाल्टन का नियम उपयुक्त होता है।
प्रश्न 64.
किन परिस्थितियों में बॉयल का नियम लागू होता है।
उत्तर:
गैस का ताप निश्चित होने पर बॉयल का नियम लागू होता है।
प्रश्न 65.
क्या CO एवं O2, के मिश्रण पर डाल्टन का आंशिक दाब नियम लगा सकते हैं?
उत्तर:
नहीं यह नियम उन गैसों पर लागू नहीं होता है जो आपस में क्रिया कर लेती हैं। CO तथा O2 क्रिया करके CO2 बनाती हैं।
प्रश्न 66.
CO2, ऑक्सीजन व नाइट्रोजन दोनों से भारी होती है फिर भी यह वायुमण्डल की निचली परत में नहीं होती है, क्यों?
उत्तर:
गैसों का विसरण पृथ्वी के गुरूत्वाकर्षण बल से स्वतन्त्र होता है। CO2 के अणु पूरे वायुमण्डल में फैले हुए होते हैं। अत: CO2 की निचली परत नहीं बना पाते हैं।
प्रश्न 67.
यदि आण्विक टक्करें प्रत्यास्थ नहीं होती तो गैस की आण्विक गति पर क्या प्रभाव पड़ता?
उत्तर:
यदि गैस के अणुओं के मध्य टक्करें अप्रत्यास्थ होती तो प्रत्येक टक्कर के दौरान अणुओं की गतिज ऊर्जा में कमी आ जाती तथा बार-बार टक्करों से गतिज ऊर्जा लगातार कम होती रहती और अन्त में अणुगति रुक जाती।
![]()
प्रश्न 68.
गर्म चाय या कॉफी को प्लेट में डालकर पिया जाता है, क्यों?
उत्तर:
वाष्पीकरण से ठंडक प्राप्त होती है। किसी भी द्रव का पृष्ठीय क्षेत्रफल बढ़ाने से वाष्पीकरण की दर बढ़ जाती है। चूँकि ‘प्लेट का क्षेत्रफल अधिक होता है अतः चाय या कॉफी का वाष्पीकरण भी तेजी से होगा और चाय या कॉफी जल्द ठण्डी हो जायेगी।
प्रश्न 69.
द्रव की बूँद गोल आकार की क्यों होती है?
उत्तर:
द्रव की प्रकृति न्यूनतम पृष्ठ क्षेत्रफल रखने की प्रवृत्ति होती है। चूँकि दिये हुए आयतन के लिये गोल बूँद का पृष्ठ क्षेत्रफल निम्नतम होता है अतः द्रव की बूँद गोल आकार की होती है।
प्रश्न 70.
ग्लिसरीन तथा जल में कौन अधिक श्यान है?
उत्तर:
ग्लिसरीन व जल में ग्लिसरीन अधिक श्यान है क्योंकि इसके अणुओं के मध्य हाइड्रोजन आबंधों की संख्या, जल के अणुओं के मध्य हाइड्रोजन आबन्धों की संख्या से काफी अधिक है।
प्रश्न 71.
H2, N2, O2, F2, He, Ne आदि गैसों को विसरण गति के बढ़ते क्रम में व्यवस्थित कीजिए।
उत्तर:
F2 < O2 < N2 < Ne < He <H2 (विसरण गति का बढ़ता क्रम)
प्रश्न 72.
ताप का केल्विन पैमाना सेल्सियस पैमाने की अपेक्षा अधिक बेहतर क्यों होता है?
उत्तर:
ताप का केल्विन पैमाना सेल्सियस पैमाने की अपेक्षा अधिक बेहतर है क्योंकि केल्विन पैमाने पर कोई भी ऋणात्मक ताप नहीं होता है।
प्रश्न 73.
मोल संख्या से आप क्या समझते हैं?
उत्तर:
गैस के मोलों की संख्या

प्रश्न 74.
NH3 तथा N2 में से किसमें ‘a’ का मान अधिक होगा एवं किसमें ‘b’ का मान अधिक होगा?
उत्तर:
(1) NH3 में ‘a’ का मान अधिक होगा क्योंकि NH3 अणुओं में अन्योन्य क्रिया इनकी ध्रुवीय प्रकृति और अणुओं में उपस्थित अन्तरा – आण्विक हाइड्रोजन बन्ध के कारण अधिक उच्च होगी।
(2) N2 में ‘b’ का मान अधिक होगा क्योंकि N2 अणुओं का आकार NH3 अणुओं की अपेक्षा अधिक होता है।
प्रश्न 75.
सामान्य ताप तथा दाब की दशाओं में आदर्श गैस का मोलर आयतन क्या होगा?
उत्तर:
सामान्य ताप तथा दाब की दशाओं में आदर्श गैस का मोलर आयतन 22.4 dm³ होता है।
प्रश्न 76.
क्या किसी गैस को परम शून्य ताप तक ठण्डा करना सम्भव है?
उत्तर:
किसी भी गैस को परम शून्य ताप तक ठण्डा करना असम्भव है। क्योंकि इस ताप को प्राप्त करने से पहले ही गैस द्रव में बदल जायेगी।
प्रश्न 77.
निम्न युग्मों में से उच्च वाष्प दाब वाला द्रव कौन सा है?
(1) ऐल्कोहॉल तथा ग्लिसरीन
(2) पेट्रोल तथा कैरोसीन
(3) पारा, जल
(4) जल, शहद
(5) ईथर, ऐल्कोहॉल
उत्तर:
द्रव का वाष्प दाब अणुओं के मध्य अन्तरा आण्विक आकर्षण बल के व्युत्क्रमानुपाती होता है।
अतः उच्च वाष्प दाब वाला पदार्थ है-
(1) ऐल्कोहॉल
(2) पेट्रोल
(3) जल
(4) जल
(5) ईथर।
प्रश्न 78.
किस परिस्थिती में वास्तविक गैस आदर्श गैस की तरह व्यवहार करती है?
उत्तर:
उच्च ताप व कम दाब पर वास्तविक गैस आदर्श गैस की तरह व्यवहार करती है।
प्रश्न 79.
बर्फ, जल तथा भाप के भौतिक गुणों में बहुत अधिक भिन्नता होती है। इन तीनों अवस्थाओं में जल का रासायनिक संघटन क्या है?
उत्तर:
जल का रासायनिक संघटन सभी में समान होगा अर्थात् H2O होगा।
प्रश्न 80.
द्रव्य की भिन्न-भिन्न अवस्थाओं को विभिन्न भौतिक नियमों द्वारा समझा जा सकता है। आपके अनुसार, द्रव्य की अवस्थाओं को निर्धारित करने वाले कारक कौन-कौन से हैं।
उत्तर:
दाब, ताप, द्रव्यमान तथा आयतन।
प्रश्न 81.
नाइट्रोजन तथा आर्गन का मोलर आयतन 273.15K तथा 1 atm दाब पर क्या होगा?
उत्तर:
22.4 L
प्रश्न 82.
दो भिन्न-भिन्न गैसें A तथा B को समान धारिता वाले दो भिन्न पात्रों में समान ताप तथा दाब पर भरा गया है। दाब को थोड़ा सा अधिक बढ़ाने पर गैस ‘A’ का द्रवीकरण हो जाता है परन्तु गैस B उच्च दाब लगाने पर भी द्रवित नहीं होती है। परन्तु यह ठंडी हो जाती है। इस प्रक्रम को समझायें
उत्तर:
गैस ‘A’ अपने क्रान्तिक ताप पर या उससे कम ताप पर है। परन्तु गैस ‘B’ अपने क्रान्तिक ताप से अधिक ताप पर उपस्थित है।
प्रश्न 83.
गैसों के अणु गतिक सिद्धान्त में एक तथ्य यह है कि गैसों के अणुओं के मध्य कोई भी आकर्षण बल नहीं होता है। यह तथ्य कहाँ तक सही है। क्या इस तथ्य के अनुसार आदर्श गैस का द्रवीकरण सम्भव है।
उत्तर:
यदि गैसों के अणुओं के मध्य कोई भी आकर्षण बल नहीं है तो आदर्श गैस का द्रवीकरण किसी भी प्रकार सम्भव नहीं है।
प्रश्न 84.
निम्न को उनके पृष्ठ तनाव के बढ़ते क्रम में व्यवस्थित करें ।
जल, एल्कोहॉल, हेक्सेन
उत्तर:
हेक्सेन < एल्कोहॉल < जल
प्रश्न 85.
जलीय तनाव तथा सूखी गैस के दाब में क्या सम्बन्ध है?
उत्तर:
Pसूखी गैस = Pकुल – जलीय तनाव
प्रश्न 86.
उस ऊर्जा का नाम लिखें जो पदार्थ के अणु या परमाणुओं की गति के कारण उत्पन्न होती है? इस ऊर्जा पर ताप बढ़ाने पर क्या प्रभाव पड़ता है?
उत्तर:
ऊष्मीय ऊर्जा, ताप बढ़ाने पर ऊष्मीय ऊर्जा बढ़ जाती है।
प्रश्न 87.
उन दो अन्तराआण्विक बलों के नाम लिखें जो कि HF की द्रव अवस्था में अणुओं के मध्य उत्पन्न होते हैं।
उत्तर:
- द्विध्रुव – द्विध्रुव अन्योन्य क्रिया
- हाइड्रोजन आबन्ध।
प्रश्न 88.
किसी गैस का संपीड्यता गुणांक ‘Z’ = \(\frac { PV }{ nRT }\) होता है,
(i) आदर्श गैस के लिये Z का मान क्या होगा।
(ii) बॉयल ताप से ऊपर का मान वास्तविक गैस के लिये क्या है?
उत्तर:
(i) Z = 1 (आदर्श गैस के लिये)
(ii) बॉयल ताप से ऊपर Z > 1 (वास्तविक गैस के लिये)
प्रश्न 89.
CO2 का क्रान्तिक ताप व क्रान्तिक दाब क्रमशः 30.98°C तथा 73 atm है। क्या 32°C ताप तथा 80 atm दाब पर CO2 गैस का द्रवीकरण सम्भव है।
उत्तर:
32°C ताप पर CO2 गैस का द्रवीकरण सम्भव नहीं है चाहे दाब 80 atm की क्यों न हो क्योंकि यह ताप क्रान्तिक ताप से बड़ा है।
लघु उत्तरीय प्रश्न
प्रश्न 1.
पृष्ठ तनाव को परिभाषित कीजिए।
उत्तर:
पृष्ठ तनाव (Surface tension) – “किसी द्रव की सतह पर एकांक लम्बाई में लगने वाला लम्बवत् बल पृष्ठ तनाव कहलाता है,” इसे ग्रीक अक्षर (γ) गामा से प्रदर्शित करते हैं।
S. I. पद्धति में पृष्ठ तनाव की इकाई न्यूटन प्रति मीटर (Nm-1) है।
प्रश्न 2.
श्यानता गुणांक को परिभाषित कीजिए।
उत्तर:
श्यानता गुणांक (Viscosity coefficient) – किसी द्रव का श्यानता गुणांक उसके प्रवाह के बीच उत्पन्न होने वाले अवरोध को कहते हैं।
यदि परतों का क्षेत्रफल A तथा वेग प्रवणता \(\frac { dV }{ dx }\), तो घर्षण बल F. ∝ A. \(\frac { dV }{ dx }\),
F = ηA. \(\frac { dV }{ dx }\),
η = समानुपातिक स्थिरांक है जिसे श्यानता गुणांक कहते हैं।
प्रश्न 3.
अक्रिस्टलीय ठोसों को अतिशीतित (Super cooled) द्रव मानते हैं। समझाइये।
उत्तर:
अक्रिस्टलीय ठोसों के अवयवी कण की कोई निश्चित आन्तरिक व्यवस्था या रचना न होने के कारण अक्रिस्टलीय ठोसों के अवयवी कण द्रवों की भाँति मन्द गति से बहते हैं रहते हैं। यही कारण है कि इन अक्रिस्टलीय ठोसों को अत्यधिक श्यानता वाला अतिशीतित (Super cooled) द्रव माना जाता है।
प्रश्न 4.
PV = nRT गैस समीकरण की व्युत्पति कीजिए।
उत्तर:
माना कि किसी ताप T तथा दाब P पर किसी गैस का आयतन V है।
बॉयल के नियम के अनुसार – स्थिर ताप पर
V ∝ \(\frac { 1 }{ P }\) या V = \(\frac { K }{ P }\)
यहाँ K = स्थिरांक
या PV = K … (i)
चार्ल्स के नियम के अनुसार – स्थिर दाब पर
V ∝ T V = KT
K = स्थिरांक
\(\frac { V }{ T }\) = K … (ii)
आवागाद्रो के नियम के अनुसार स्थिर ताप व दाब पर
V ∝ n
या \(\frac { V }{ n }\) = K स्थिरांक … (iii)
समीकरण (i), (ii) व (iii) को मिलाने पर
\(\frac { PV }{ nT }\) = स्थिरांक
तो \(\frac { PV }{ T }\) = nR
PV = RT यही समीकरण आदर्श गैस समीकरण है।
यहाँ R = स्थिरांक (गैस स्थिरांक या मोलर गैस स्थिरांक)
प्रश्न 5.
डाल्टन के आंशिक दाब नियम पर संक्षिप्त टिप्पणी कीजिए।
उत्तर:
डाल्टन का आंशिक दाब नियम (Dalton’s Law of Partial Pressure) – सन् 1801 में डाल्टन ने पारस्परिक रासायनिक अभिक्रिया न करने वाली गैसों को एक बन्द पात्र में लेकर गैसों के कुल दाब एवं उनके आंशिक दाबों में एक सम्बन्ध दिया जिसे डाल्टन का आंशिक दाब नियम कहा गया।
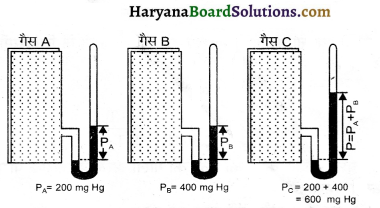
इस नियम के अनुसार, “जब दो या अधिक गैसों को (पारस्परिक अभिक्रिया न करने वाली) स्थिर ताप पर एक बन्द पात्र में लिया जाता है, तो गैसों के मिश्रण का कुल दाब उन घटक गैसों के आंशिक दाबों के योग के बराबर होता है।
डाल्टन के नियम अनुसार – स्थिर ताप व आयतन पर
P = PA + PB + PC
डाल्टन का आंशिक दाब नियम केवल आदर्श गैसों पर पूर्ण रूप से लागू होता है।
प्रश्न 6.
गैस के क्रान्तिक स्थिरांकों को परिभाषित कीजिए।
उत्तर:
क्रान्तिक स्थिरांक – क्रान्तिक ताप, क्रान्तिक दाब एवं क्रान्तिक आयतन सामूहिक रूप से गैस के क्रान्तिक स्थिरांक कहलाते हैं। इन्हें क्रमश: TC, PC, VC से प्रदर्शित करते हैं।
क्रान्तिक ताप (Critical temperature)-वह निश्चित ताप जिसके ऊपर किसी गैस को द्रव में परिवर्तित नहीं किया जा सकता है चाहे दाब कितना भी बढ़ा दिया जाये क्रान्तिक ताप कहलाता है।
उदाहरण – CO2 का क्रान्तिक ताप 31°C है।
क्रांतिक दाब (Critical Pressure) – क्रान्तिक ताप पर गैस जिस कम से कम दाब पर द्रवित हो जाती है, क्रान्तिक दाब कहलाता है। इसे PC से प्रदर्शित करते हैं।
उदाहरण – CO2 गैस का 31.1°C पर क्रान्तिक दाब 7.29 वायुमण्डल होता है।
क्रान्तिक आयतन (Critical volume) – क्रान्तिक ताप एवं दाब पर किसी गैस के एक मोल का आयतन क्रान्तिक आयतन कहलाता है। इसे VC से प्रदर्शित करते हैं।
उदाहरण – CO2 का क्रान्तिक आयतन 94 मि. लि. है।
![]()
प्रश्न 7.
वाष्प दाब का क्वथनांक पर क्या प्रभाव पड़ता है?
उत्तर:
वाष्प दाब का क्वथनांक पर प्रभाव – वाष्प दाब किसी भी द्रव के क्वथनांक पर प्रभाव डालता है।
उदाहरण – जल के सामान्य क्वथनांक पर जल का वाष्प दाब एक वायुमण्डलीय दाब के बराबर होता है। अगर बाहरी दाब एक वायुमण्डल दाब से कम है तो जल कम तापमान पर उबलेगा। यही कारण है कि पहाड़ों पर भोज्य पदार्थ कठिनाई से गलते हैं। प्रेशर कुकर में निकास पर वजन रखकर दाब को वायुमण्डलीय दाब से अधिक करके जल का क्वथनांक बढ़ा सकते हैं।
प्रश्न 8.
समझाइये कि किसी द्रव की श्यानता ताप के साथ क्यों घटती है?
उत्तर:
द्रव की श्यानता ताप बढ़ने के साथ घटती है, क्योंकि ताप बढ़ने के साथ अणुओं की गतिज ऊर्जा अधिक हो जाती है। गतिज ऊर्जा अधिक होने के कारण द्रव वेग अवरोधों को पार करके असानी से बहने लगते हैं। आर्हीनियस एवं गुजमान (Guzman) ने प्रयोगों के आधार पर द्रवों की श्यानता पर ताप के प्रभाव को प्रदर्शित करने के लिये समीकरण दिये हैं-
η = AeEa/RT
या \(\log \frac{\eta_1}{\eta_2}=\frac{E a}{2.303 R}\left[\frac{T_2-T_1}{T_1 T_2}\right]\)
प्रश्न 9.
जल काँच की सतह को गीला करता है, जबकि पारा नहीं करता समझाइये।
उत्तर:
पारा काँच की सतह को गीला नहीं करता क्योंकि पारे के अणुओं के मध्य लगने वाला अन्तराण्विक बल काँच की दीवार एवं पारे की सतह के मध्य लगने वाले आकर्षण बल से अधिक होता है। ऐसी दशा में पारा पात्र की दीवारों से दूर रहने की कोशिश करता है तथा केशिका नली में पारा नीचे गिरता है, इस प्रकार द्रव यानि पारा पात्र की दीवारों से नहीं चिपकता है।
प्रश्न 10.
द्रवित गैसों का उपयोग लिखिए।
उत्तर:
द्रवित गैसों का उपयोग (Uses of liquified gases) – द्रवित गैसों के उपयोग निम्नलिखित हैं-
- प्रयोगशाला में न्यून ताप उत्पन्न करने के लिए द्रवित गैसों का उपयोग करते हैं।
- द्रव फ्रीऑन (CCl2F2) आदि का उपयोग वातानुकूलन में प्रशीतक के रूप में किया जाता है।
- द्रव वायु का उपयोग रॉकेट व जैट वायुयान में ऑक्सीजन के मुख्य स्रोत के रूप में होता है।
- वेल्डिंग में द्रव ऑक्सीजन का उपयोग होता है।
- Cl2 का उपयोग जल में कीटनाशक के रूप में होता है।
- कुछ गैसों को मिश्रण से अलग करने के लिए द्रवण की सहायता ली जाती है।
उदाहरण – Ne तथा Ar को वायु से अलग करते हैं।
प्रश्न 11.
जब केशनलिका को पारे में डुबोया जाता है तो बाहर की तुलना में अन्दर पारे का स्तर कम होता है। क्यों ?
उत्तर:
पारे के स्तर के कम होने का कारण हम ससंजक (Cohesive) एवं आसंजक (Adhesive) बलों के आधार पर समझा सकते हैं। समान अणुओं के मध्य लगने वाला बल ससंजक जबर्कि असमान अणुओं के मध्य लगने वाला बल आसंजक कहलाता है। पारे में आसंजक बल ससंजक बलों की तुलना में कम होते हैं। इस कारण पारा काँच की सतह से अलग हो जाता है। तथा इसका स्तर कम हो जाता है।
प्रश्न 12.
काँच की केशनली में पानी का स्तर (maniscus) अवतल (Convcave) जबकि पारे का उत्तल (Convex) होता है, क्यों?
उत्तर:
जैसा कि हम जानते हैं कि अन्तरा-आण्विक बल अणुओं को पास-पास रखता है, परन्तु ऊष्मीय ऊर्जा अणुओं को एक-दूसरे से दूर रखती है। द्रव्य की तीन अवस्थाएँ ठोस, द्रव व गैस अणुओं के इस अन्तरा-आण्विक बलों तथा ऊष्मीय ऊर्जा के मध्य संतुलन का परिणाम हैं।
यदि ठोस को ऊष्मीय ऊर्जा दी जाती है तो यह ऊर्जा अणुओं को एक दूसरे से दूर करती है। अर्थात् उनके मध्य आकर्षण बल घट जाता है, इस प्रकार ठोस द्रव में परिवर्तित हो जाता है। अर्थात् इससे सिद्ध होता है कि ठोस और द्रव अवस्थायें एवं ऊष्मीय ऊर्जा का सन्तुलन अणुओं के मध्य अन्तरा-अणुक आकर्षण बल का परिणाम है। इसी प्रकार द्रव को हम ठोस में परिवर्तित कर सकते हैं इसके लिये ताप को कम किया जाता है जिससे ऊष्मीय ऊर्जा कम हो जाती है और अन्तरा-आण्विक आकर्षण बल बढ़ जाता है और द्रव ठोस में बदल जाता है।
गैसों को केवल दाब लगाकर अर्थात् संपीडित करके द्रव में नहीं बदला जा सकता है। गैस पर दाब लगाने पर अणु निकट तो आ जाते हैं परन्तु उनको इसी स्थिति में बनाये रखने के लिये ताप को कम किया जाता है अर्थात् ऊष्मीय ऊर्जा को कम करते हैं। किसी भी गैस के लिये एक निश्चित ताप होता है जिसके ऊपर वह गैस द्रवित नहीं हो सकती, चाहे दाब कितना ही अधिक हो। गैसों का यह ताप क्रान्तिक ताप (Critical Temperature) कहलाता है।
गैस, द्रव व ठोस का एक-दूसरे में परिवर्तन निम्न प्रकार समझा जा सकता है।
गैस अवस्था → द्रव अवस्था → ठोस अवस्था
अन्तरा-आण्विक आकर्षण बल को बढ़ने पर उपरोक्त परिवर्तन होता है।
गैस अवस्था ← द्रव अवस्था ← ठोस अवस्था
ऊष्मीय ऊर्जा घटाने पर उपरोक्त परिवर्तन होता है।
प्रश्न 13.
ईथर व एल्कोहॉल को ठण्डी जगह पर रखा जाता है क्यों ?
उत्तर:
ईथर व एल्कोहॉल दोनों द्रव प्रकृति में वाष्पशील होते हैं। इस कारण इनका क्वथनांक काफी कम होता है। ये उच्च ताप पर आसानी से वाष्पीकृत हो जाते हैं। अतः इनके वाष्पन को कम करने के लिये इन्हें ठण्डी जगह पर रखते हैं।
प्रश्न 14.
द्रव अमोनिया की बोतल को खोलने से पहले ठण्डा किया जाता है। क्यों ?
उत्तर:
द्रव अमोनिया की बोलल में अमोनिया को उच्च दाव लगाकर भरा जाता है। यदि बोतस को बिना उण्डा किए ही खोल दिया आये तो दाब में अचानक कमी होने के कारण गैस के अणुओं की गतिज ऊर्जा बहु जायेगी एवं वे अचानक तेजी के साथ बोतल से बाहर निकल आयेंगे। परिणामस्वरूप बोतल फट सकती है तथा कोई भी दुर्घंटा घटित हो सकती है। यदि बोतल को ठण्डा कर दें तो अणुओं की गतिज ऊर्जा नहीं बढ़ेगी तथा गैस धींरे-धीरे बाहर आयेगी व दुर्घटना की सम्भावना कम हो जायेगी।
प्रश्न 15.
ऊँची पहाड़ियों पर जल का क्वथनांक घट जाता है, क्यों?
उत्तर:
जैसे-जैसे हम ऊँचाई की ओर जाते है, वायुमण्डलीय दाब कम हो जाता है। अतः जल के वाष्पदाब को वायुमण्डलीय दाब (जो कि ऊँचाई पर कम हो जाता है) के समान लाने के लिये कम ताप की आवश्यकता होगी तथा जल का क्वथनांक भी कम हो जायेगा।
प्रश्न 16.
प्रेशर कुकर में खाना शीच्र पकता है, क्यों ?
उत्तर:
प्रेशर कुकर में वाष्पदाय अत्यधिक होता है अतः जल का क्वथनांक अधिक हो जाता है। अथात् जल अधिक ताप ग्रहण कर सकता है और प्रेशर कुकर का ताप अधिक हो जाता है, परिणामस्वरूप अन्दर रखे खाइ पदार्थ भी शीच्र पक जाते है।
ब्रुले पात्र में दाल या सख्जी बनाते समय ताप किसी भी स्तिति में 100°C से अधिक नहीं हो पाता है। जबकि प्रेशर कुकर में ताप 100°C से काफी ऊँचा हो जाता है।
प्रश्न 17.
सोडा वाटर की बोतलों को गर्मीं में फ्रिज में ही रखा जाता क्यों ?
उत्तर:
सोडा वाटर, CO2 गैस का पानी में विलयन होता है। विलयन बनाने के लिए गैस को उच्छ दाब पर पानी में प्रवाहित किया जाता है। चूँंक गैस जल में अघुलनशील है अतः उच्च दाब पर गैस आसानी से घुल जाती है। गर्मियों में जल में गैस की घुलनशीलता कम हो जाती हैं क्योंकि ताप में अधिकता घुलनशीलता को कम कर देती है। अतः गर्मियों में काँच की बोतल की सतह पर अधिक गैस उपस्थित होती है। द्रससे बोतल के अन्दर का दाब बढ़ जाता है तथा यह दाब बोताल सहन नहीं कर सकती और फट सकती है। इससे बचाने के लिये इन बोतलौं को या तो फ्रिज में रखते हैं या फिर पानी के अन्दर रखते हैं। ऐसा करने पर ताप घट ज्ञाता है व गैस की घुलनशीलता जल में बढ़ जाती है।
प्रश्न 18.
शुष्क एवं आर्द्र वायु में से कौन-सी भारी होती है?
उत्तर:
शुष्क वायु मुख्यत्तया नाइट्रोजन व ऑकसीकन तथा कुछ अन्य मात्रा में गैसों के द्वारा बनी होती है। शुष्क वायु में कुछ मात्रा जल वाध्य की भी होती है। जल वाष्प का वाण्प घनत्व N2 तथा O2 से कम होता है क्योंकि N2 का अर्विक द्रव्यमान 28, O2 का 32 तथा जल का 18 होता है। आर्द्र वायु में नाइट्रोजन एवं ऑक्सीजन के भारी अणु जल वाध्य के द्वारा प्रतिस्थापित हो जाते है। अतः शुष्क वायु, आद्र वायु से भारी होती है।
प्रश्न 19.
बॉयल के नियम का प्रायोगिक महत्व लिखें। अधवा बॉयल के नियम से बताइये कि दाब तथा घनत्व में क्या सम्बन्ध है?
उत्तर:
मात्रात्मक रूप से बॉयल का प्रयोग यह सिद्ध करता है कि गैस अत्यधिक संपीडित होती है, गैसों के अणुओं के मध्य अन्तरा-आणिवक स्थान अधिक होता है अतः इनके दिये गये द्रव्यमान को संपीडित करना अत्यधिक सरल होता है। दूसरे शब्दों में हम यह कह सकते हैं कि उच्च दाब पर गैस अधिक सघन हो जाती है तथा कम दाब पर इसकी सघनता काफी कम होती है।
ऊँचाई पर अर्थात् पहाड़ों पर दाब कम हो जाता है। इस कारण वायु भी सघन हो जाती है तथा साँस लेने में कठिनाई होती है।
बॉयल के नियम की सहायता से दाब तथा घनत्व के मध्य निम्न सम्बन्ध स्थापित होता है।
d = \(\frac { M }{ V }\), V = \(\frac { m }{ d }\)
बॉल नियम से,
PV = K
P x \(\frac { m }{ d }\) = K = स्थिरांक
यदि गैस का दाब P1 पर घनत्व d1, तथा दाब P2 पर घनत्व d2 है तो
P1V1 = P2 V2 से
P1\(\frac{m_1}{d_1}\) = P2\(\frac{m_2}{d_2}\) = K
\(\frac{p_1}{d_1}=\frac{p_2}{d_2}\) = K
या \(\frac { P }{ d }\) = K या P ∝ d
“स्थिर ताप पर किसी एक गैस की निश्चित मात्रा का दाब उसके घनत्व के समानुपाती होता है।”
प्रश्न 20.
गैसीय अणुओं के आण्विक वेग बन्दूक की गोली के वेग के तुल्य होते हैं, परन्तु गैसीय अणुओं की गन्ध शीघ्रता से प्राप्त नहीं होती है, क्यों?
उत्तर:
यह सत्य है कि गैसीय अवस्था में अणुओं का वेग अत्यधिक होता है जो कि बन्दूक की गोली के वेग से गतिमान रहते हैं। परन्तु इनकी गति सीधी रेखा में नहीं होती है। ये अणु आड़े-तिरछे (Zig- Zag) पथ पर गति करते हैं तथा एक-दूसरे से टकराते रहते हैं। इसी कारण गैसीय अणुओं की वास्तविक गति पर इनका हम तक पहुँचना सम्भव नहीं होता है। इस कारण इनकी गन्ध हम तक देर में पहुँचती है।
प्रश्न 21.
कारण स्पष्ट करें-
(1) द्रव की बूँद का आकार गोल होता है।
(2) केशिका नली को द्रव तल के सम्पर्क में लाने पर केशिका नली में द्रव चढ़ता अथवा उतरता है।
उत्तर:
(1) वर्षा की बूदों तथा मर्करी की बूदों का गोल आकार-बूँद का गोल आकार पृष्ठ तनाव (Surface Tension) के कारण ही होता है। यह तनाव द्रव पृष्ठीय क्षेत्रफल को कम करने की कोशिश करता है। तब द्रव का ऊर्जा स्तर निम्नतम होता है। यही कारण है कि वर्षा की बूँदे तथा मर्करी की बूँदे गोलाकार होती है।

(ii) केशनलिका में द्रव का चढ़ना-किसी द्रव को केशनलिका में भरने पर नली की दीवार तथा द्रव के मध्य लगने वाला आसंजक बल द्रव के सतही क्षेत्रफल को बढ़ाने का प्रयास करता है। जबकि पृष्ठ तनाव सतही क्षेत्रफल को कम करने की कोशिश करता है। इसी कारण नली में द्रव चढ़ता है। किसी भी नली में द्रव तब तक ऊपर चढ़ता है जब तक कि आसंजक एवं ससंजक बल पर लग रहा गुरूत्वाकर्षण बल सन्तुलित न हो जाये।
प्रश्न 22.
सार्वत्रिक गैस नियतांक का मान विभिन्न इकाइयों में लिखें।
उत्तर:
(i) सार्वत्रिक गैस नियतांक (R) का मान लीटर वायुमण्डल प्रति केल्विन प्रति मोल में
= 0.0821 L-atm K-1 mol-1
(ii) (R) का मान अर्ग प्रति केल्विन प्रति मोल में
= 8.314 × 107 erg K-1 mol-1
(iii) (R) का मान जूल प्रति केल्विन प्रति मोल में = 8·314 J K-1 mol-1
(iv) (R) का मान घन सेमी- बार प्रति केल्विन प्रति मोल में = 82.1 cm³ bar K-1 mol-1
(v) (R) का मान ली. बार प्रति केल्विन प्रति मोल में = 0.0831 L-bar.K-1 mol-1
(vi) (R) का मान कैलोरी प्रति केल्विन प्रति मोल में = 2 Cal K-1 mol-1
प्रश्न 23.
अणु गति सिद्धान्त के कुछ मुख्य अभिग्रहितों में निहित तथ्यों की विवेचना कीजिये।
उत्तर:
(1) अणु सीधे पथ पर गति नहीं करते
व्याख्या-अभिग्रहित के अनुसार गैसों के अणु निरन्तर गतिमान होते हैं। एक अणु सरल रेखा में गति करता हुआ दूसरे अणु के साथ टकराता है इससे पथ विचलित हो जाता है, चूँकि ये संघट्ट् बार-बार होते हैं; अतः अणु अपना मार्ग बदल देते हैं। इस कारण अणु सीधे पथ पर गति नहीं करते हैं।
(2) गैसों के अणुओं के मध्य प्रत्यास्थ संघट्ट होता है।
व्याख्या-प्रत्यास्थ संघट्ट का अर्थ होता है कि संघट्ट के पूर्व तथा पश्चात् अणुओं की ऊर्जा समान रहती है। संघट्ट में अणुओं के मध्य ऊर्जा का विनिमय (exchange) हो सकता है अर्थात् विशिष्ट अणु की ऊर्जा में परिवर्तन हो सकता है, परन्तु कुल ऊर्जा स्थिर बनी रहती है।
(3) गैसों के अणुओं के मध्य कोई अन्योन्य क्रिया नहीं होती है। व्याख्या कीजिए।
व्याख्या-सामान्य ताप एवं दाब पर गैस-कणों के मध्य कोई अन्योन्य क्रिया नहीं होती अर्थात् कणों के मध्य कोई आकर्षण तथा प्रतिकर्षण बल उपस्थित नहीं होता है। जब गैस का दाब और घटाया जाता है तथा ताप को स्थिर रखते हैं तो वह प्रसारित होती है। यह तभी सम्भव है जब अणुओं के मध्य आकर्षण एवं प्रतिकर्षण बल न हों। अत: गैसों के अणुओं के मध्य अन्योन्य क्रिया नहीं होती है।
आंकिक प्रश्न
प्रश्न 1.
25°C पर एक गैस का आयतन 400 ml है। दाब स्थिर रखने पर किस ताप पर उसका आयतन 600 ml हो जायेगा।
हल:
दिया गया है,
चार्ल्स के नियम से,
T1 = 25 + 273 = 298 K
T2 = ?
V1 = 400 ml
V2 = 600 ml
\(\frac{\mathrm{V}_1}{\mathrm{~T}_1}=\frac{\mathrm{V}_2}{\mathrm{~T}_2}\) (स्थिर दाब पर)
\(\frac{400}{298}=\frac{600}{T_2}\)
T2 = \(\frac { 600×298}{ 400 }\)
T2 = 447 K
T2 = 447 – 273 = 174°C
प्रश्न 2.
किसी गैस का आयतन 100 cm³ है और इसे 30% बढ़ाना हो तो स्थिर दाब पर गैस को कितना गर्म करना पड़ेगा, यदि प्रारम्भिक ताप 20°C है।
हल:
आयतन में वृद्धि = 30%
प्रारम्भिक आयतन (V1) = 100 cm³
प्रारम्भिक आयतन में आवश्यक वृद्धि
= \(\frac { 100×30 }{ 100 }\) = 30 cm³
अन्तिम आयतन (V) = 100 + 30 = 130 cm³
V1 = 100 cm³
T1 = 20 + 273 = 293 K
V1 = 130 cm³
T2 = ?
चार्ल्स के नियमानुसार,
\(\frac{\mathrm{V}_1}{\mathrm{~T}_1}=\frac{\mathrm{V}_2}{\mathrm{~T}_2}\) (स्थिर दाब पर)
\(\frac{100}{293}=\frac{130}{T_2}\)
T2 = \(\frac{130 \times 293}{100}\)
= 380.9 K
प्रश्न 3.
यदि किसी गैस के गुब्बारे में लगभग 5 लीटर हाइड्रोजन गैस 22°C ताप पर भरी गयी। यदि ताप बढ़ाकर 25°C कर दिया गया तो गुब्बारे का आयतन कितना हो जायेगा।
हल:
दिया गया है,
V1 = 5 लीटर, V2 = ?
T1 = 22 + 273
= 295 K
T2 = 25 + 273
= 298 K
चार्ल्स के नियमानुसार,
\(\frac{\mathrm{V}_1}{\mathrm{~T}_1}=\frac{\mathrm{V}_2}{\mathrm{~T}_2}\) (स्थिर दाब पर)
\(\frac{5}{295}=\frac{V_2}{298}\)
V2 = \(\frac{5 \times 298}{295}\)
= 5.051 L
प्रश्न 4.
एक गैस का नमूना 298 K ताप और 1 bar दाब 75 dm³ आयतन घेरता है। यदि समान ताप पर गैस के आयतन को 10dm³ तक कम कर दिया जाये तो कितना अतिरिक्त दाब लगाना पड़ेगा। हल:
दिया गया है,
P1 = 1 bar
P2 = ?
V1 = 75 dm³
V2 = 10 dm³
बॉयल नियम से,
PV1 = P2V2 (स्थिर ताप पर )
1 × 75 = P2 × 10
P2 = \(\frac{1 \times 75}{10}\)
P2 = 7.5 bar
अतिरिक्त दाब = 7.5 – 1
= 6.5 bar
![]()
प्रश्न 5.
रसोई गैस के एक सिलिण्डर में भरी गैस का दाब 25°C पर 11 bar है। यदि गैस सिलिण्डर की दाब वहन क्षमता 16 bar हो तो बताइये किस ताप पर सिलिण्डर फट जायेगा?
हल:
सिलिण्डर में गैस भरी है अतः गैस का आयतन स्थिर रहता है।
दिया गया है.
अधिकतम दाब ‘P1‘ = 16 bar
ताप ‘T1‘ = ?
गैस का दाब (P2) = 11 bar
ताप (T2) = 25 + 273 = 298 K
गै-लुसेक नियम से,
\(\frac{\mathrm{P}_1}{\mathrm{~T}_1}=\frac{\mathrm{P}_2}{\mathrm{~T}_2}\) (स्थिर ताप पर)
\(\frac{16}{T_1}=\frac{11}{298}\)
T1 = \(\frac{16 \times 298}{11}\)
T1 = 433.45 K
= 433.45 – 273
T1 = 160.45°C
प्रश्न 6.
गैस के किसी दिये हुए नमूने पर कितना दाब लगाया जाये कि वह अपने मूल आयतन के तीन चौथाई भाग तक दब जाये।
हल:
दिया गया है,
V1 = V
P1 = P
V2 = \(\frac { 3 }{ 4 }\)V
P2 = ?
बॉयल नियम से, P1V1 = P2V2 (स्थिर ताप पर )
P x V = P2 = P2 = \(\frac { 3 }{ 4 }\)V
P2 = \(\frac { 4 }{ 3 }\)P
अर्थात् लगने वाला दाब मूल दाब \(\frac { 4 }{ 3 }\) गुना होता है।
प्रश्न 7.
एक गैस 0.92 bar दाब पर 0.6 dm³ आयतन घेरती है। उस दाब की गणना कीजिये जिस पर उस गैस का आयतन अपने मूल आयतन के 20 प्रतिशत तक घटेगा, जबकि ताप स्थिर है।
हल:
दिया गया है,
P1 = 0.92 bar
P2 = ?
V1 = 0.6 dm³
V2 = मूल आयतन का 20% घट जाये
20% घटाव = \(\frac{0.6 \times 20}{100}\)
V2 = मूल आयतन – 20% आयतन
= 0.6 – 0.12
= 0.48 dm³
बॉयल के अनुसार,
P1V1 = P2V2 (स्थिर ताप पर)
0.92 × 0.6 = P2 x 0.48
P2 = \(\frac{0.92 \times 0.6}{0.48}\)
= 1.15 bar
प्रश्न 8.
नाइट्रोजन की एक निश्चित मात्रा का 0.99 bar दाब और 25°C ताप पर आयतन 250 cm है उस ताप की गणना कीजिए जिस पर आयतन 150 cm³ और दाब 2 bar हो ।
हल:
दिया गया है.
P1 = 0.99 bar
P2 = 2 bar
V1 = 150 cm³
V1 = 250 cm³
T1 = 25+ 273
= 298K
T2 = ?
गैस समीकरण से,
\(\frac{P_1 V_1}{T_1}=\frac{P_2 V_2}{T_2}\)
\(\frac{0.99 \times 250}{298}=\frac{2 \times 150}{T_2}\)
T2 = \(\frac{2 \times 150 \times 298}{0.99 \times 250}\)
T2 = 361.21 K
T2 =361.21 – 273
= 88.21 °C
उत्तर-ताप 88.21 °C होगा।
प्रश्न 9.
423 K ताप तथा 0.987 bar दाब पर ऑक्सीजन गैस का आयतन 12.0 dm³ पाया गया है। ऑक्सीजन के द्रव्यमान की गणना कीजिये।
हल:
दिया गया है.
P = 0.987 bar
V = 12.0 dm³
R = 0.0831 bar dm³ K-1 mol-1
T = 423K
n = ?
आदर्श गैस समीकरण से,
PV = nRT
n = \(\frac { PV }{ RT }\)
= \(\frac{0.987 \times 12.0}{0.0831 \times 423}\)
n = 0.336 mol
ऑक्सीजन गैस का मोलर द्रव्यमान = 32 g mol-1

उत्तर-ऑक्सीजन गैस का द्रव्यमान 10.782 है।
प्रश्न 10.
PV= nRT सूत्र से 1 g हाइड्रोजन दाब पर आयतन की गणना कीजिए (R = 0.0821 L-atm K-1 mol-1)
हल:
प्रश्नानुसार, मानक दाब (P) = 1 atm
मान परमताप (T) = 273 K
मानक ताप और
R = 0.821 L-atm K-1 mol-1

∴ मा. ता. दाब पर 1g हाइड्रोजन का आयतन = 11.22 L
प्रश्न 11.
11 g कार्बन डाइऑक्साइड का मा. ता. दा. पर कितना आयतन होगा?
(R = 0.0821 L-atm K-1 mol-1)
हल:

∵ मानक दाब (P) = 1 atm
मानक ताप (T) = 273 K
अब आदर्श गैस समीकरण PV = RT से,
V = \(\frac { nRT }{ P }\)
= \(\frac{0.25 \times 0.821 \times 273}{1}\)
∴ मा. ता. दा. पर 11g कार्बन डाइऑक्साइड का आयतन = 5.6 L
प्रश्न 12.
एक लीटर के फ्लास्क में 7.6 x 10-10 mm (Hg) के दाब पर ऑक्सीजन गैस उपस्थित है। फ्लास्क में 0°C ताप पर ऑक्सीजन के अणुओं की संख्या ज्ञात कीजिए।
हल:
आदर्श गैस समीकरण PV = nRT के लिए प्रश्नानुसार,
P = 7.6 x 10-10 mm (Hg)
= \(\frac{7 \cdot 6 \times 10^{-10} \mathrm{~mm}(\mathrm{Hg})}{760 \mathrm{~mm}(\mathrm{Hg})} \times 1 \mathrm{~atm}\)
= 1 × 10-12 atm
V = 1 L, R = 0.0821 L-atm K-1 mol-1
T = 0 + 273 = 273 K
∴ n = \(\frac { PV }{ RT }\)
= \(\frac{1 \times 10^{-12} \mathrm{~atm} \times 1 \mathrm{~L}}{0.0821 \mathrm{~L}-\mathrm{atm} \mathrm{K}^{-1} \mathrm{~mol}^{-1} \times 273 \mathrm{~K}}\)
= \(\frac{1 \times 10^{-12}}{0.0821 \times 273}\)
आवोगाद्रो के नियम के अनुसार 1 mol में अणुओं की संख्या = 6.022 x 1023
∴ ऑक्सीजन के अणुओं की संख्या
= n × 6.022 x 1023
= \(\frac{1 \times 10^{-12} \times 6.022 \times 10^{23}}{0.0821 \times 273}\)
= 2.69 x 1010
∴ ऑक्सीजन के अणुओं की संख्या = 2.69 × 1010
प्रश्न 13.
एक गैस 298 K ताप तथा 2 atm दाब पर 120 L आयतन घेरती है। जब इस गैस को 175 L निर्वातित कक्ष में स्थानान्तरित दें तो इस गैस के ताप की गणना कीजिये, यदि दाब प्रारम्भिक दाब का एक चौथाई हो जाता है।
हल:
दिया गया है,
T1 = 298 K
T2 = ?
P1 = 2 atm
P2 = 2 x \(\frac { 1 }{ 4 }\) = \(\frac { 1 }{ 2 }\) atm
V1 = 120 L
V2 = 175 L
गैस समीकरण से,
\(\frac{\mathrm{P}_1 \mathrm{~V}_1}{\mathrm{~T}_1}=\frac{\mathrm{P}_2 \mathrm{~V}_2}{\mathrm{~T}_2}\)
T2 = \(\frac{\mathrm{P}_2 \times \mathrm{V}_2 \times \mathrm{T}_1}{\mathrm{P}_1 \times \mathrm{V}_1}\)
= \(\frac{1 \times 175 \times 298}{2 \times 2 \times 120}\)
T2 = 108.64 K
T2 = 108.64 – 273
= – 164.35°C
उत्तर ताप 164.35 °C हो जायेगा।
प्रश्न 14.
27°C ताप पर 2.0 लीटर क्षमता के पात्र में नाइट्रोजन डाई ऑक्साइड के 1022 अणु भरे हुए हैं। पात्र में दाब की गणना कीजिये।
हल:
दिया गया है, T = 27 + 273 = 300 K
V = 2.0 L
R = 0.0821 L atm K-1 mol-1
P = ?
NO2 के मोलों की संख्या = \(\frac{10^{22}}{6.02 \times 10^{23}}\)
= \(\frac { 1 }{ 60.2 }\)
आदर्श गैस समीकरण से,
PV = nRT
P = \(\frac { nRT }{ V }\)
= \(\frac{1 \times 0.0821 \times 300}{60 \cdot 2 \times 2}\)
= 0.205 atm
उत्तर-पात्र में दाब 0.205 atm होगा।
प्रश्न 15.
एक गैस सिलेण्डर में शीतलक गैस भरी है। यह सिलेप्र 15 atm दाब सहन करने की क्षमता रखता है। इसका दाब मापक यन्त्र 27°C पर 12 atm दाब प्रदर्शित कर रहा है। भवन में अचानक आग
लग जाने से सिलेण्डर का ताप बढ़ने लगता है, किस ताप पर सिलेण्डर का विस्फोट हो जायेगा?
हल:
दिया गया है।
P1 = सिलेण्डर की क्षमता =15 atm
T1 = ? (वह ताप जिस पर सिलेण्डर फटेगा )
P2 = 12 atm
T2 = 27 + 273 = 300 K
हम जानते हैं।
\(\frac{P_1}{T_1}=\frac{P_2}{T_2}\)
\(\frac{15}{T_1}=\frac{12}{300}\)
T1 = \(\frac{300 \times 15}{12}\)
= 375 K
T1 = 375 – 273
= 102°C
उत्तर-विस्फोट का ताप 102°C
प्रश्न 16.
(i) किसी गैस के 3.8g ने 25°C ताप पर उतना ही आयतन ग्रहण किया जितना कि 0.18 g हाइड्रोजन ने 20°C ताप पर उसी दाब पर ग्रहण किया। उस गैस का अणुभार क्या है?
(ii) 27°C तथा 780cm दाब पर किसी गैस का आयतन 100 mL है तो N. T.P पर गैस का आयतन कितना होगा?
(iii) S. T.P पर किसी गैस के 0.2g का आयतन 55mL है तो इसका अणुभार बताएँ।
हल:
(i) दिया गया है,
w1 = 3.8 g
T1 = 25 + 273
= 298 K
W2 = 0.18g
T2 = 20 + 273
= 298 K
M2 = 2 g mol-1
हम जानते हैं कि,
PV = \(\frac { w }{ M }\)RT
यदि दाब व आयतन स्थिर है तो,
\(\frac{\mathrm{PV}}{\mathrm{R}}=\frac{w \mathrm{~T}}{\mathrm{M}}\) = स्थिरांक
अर्थात
\(\frac{w_1 \mathrm{~T}_1}{\mathrm{M}_1}=\frac{w_2 \mathrm{~T}_2}{\mathrm{M}_2}\)
\(\frac{3.8 \times 298}{\mathrm{M}_1}=\frac{0.18 \times 293}{2}\)
M1 = \(\frac{3.8 \times 298 \times 2}{0.18 \times 293}\)
M1 = 42.94 g mol-1
उत्तर-गैस का अणुभार 42.94g mol-1 है।
(ii) गैस समीकरण,
\(\frac{\mathrm{P}_1 \mathrm{~V}_1}{\mathrm{~T}_1}=\frac{\mathrm{P}_2 \mathrm{~V}_2}{\mathrm{~T}_2}\)
दिया गया है,
P1 = 780mm
P2 = 760 mm
T1 = 27 + 273 = 300 K
T2 = 273 K
V1 = 100ml
V2 = ?
V2 = \(\frac{\mathrm{P}_1 \times \mathrm{V}_1 \times \mathrm{T}_2}{\mathrm{P}_2 \times \mathrm{T}_1}\)
= \(\frac{780 \times 100 \times 273}{760 \times 300}\)
= 93.39 ml.
उत्तर-गैस का आयतन 93.39 ml होगा।
(iii) गैस के 55 ml का भार
= 0.2 g
S. T. P. पर गैस के 22400 ml का भार
= \(\frac{0 \cdot 2 \times 22400}{55}\)
= 81.45 g
S.T.P. पर 22400 mL गैस का भार = 1 ग्राम अणु भार
उत्तर-गैस का अणुभार = 81.45 g
![]()
प्रश्न 17.
एक गैस का ताप t K है किस ताप पर गैस का आयतन तथा दाब दोनों आधे हो जायेंगे। गणना कीजिये।
हल:
गैस समीकरण से,
\(\frac{\mathrm{P}_1 \mathrm{~V}_1}{\mathrm{~T}_1}=\frac{\mathrm{P}_2 \mathrm{~V}_2}{\mathrm{~T}_2}\)
दिया गया
T1 = tK
T2 = ?
P1 = Pmm
P2 = P/2
V1 = VmL
V2 = V/2
मान रखने पर,
\(\frac{P_1 V_1}{T_1}=\frac{P_2 V_2}{T_2}\)
T2 = \(\frac{\mathrm{P}_2 \mathrm{~V}_2 \mathrm{~T}_1}{\mathrm{P}_1 \mathrm{~V}_1}\)
T2 = \(\frac{\mathrm{P} \times \mathrm{V} \times \mathrm{t}}{2 \times 2 \times \mathrm{P} \times \mathrm{V}}\)
T2 = \(\frac { t }{ 4 }\)
T2 = 0.25/K
प्रश्न 18.
एक गुब्बारे में 600 mL गैस भरी हुई है। गुब्बारे में पंक्चर हो जाने के कारण 2.5 घण्टे के बाद इसमें 155ml गैस शेष बची जिसका दाब 745mm पाया गया। पंक्चर होने से पूर्व गुब्बारे में गैस का दाब ज्ञात कीजिये।
हल:
दिया गया है,
पंक्चर के बाद P1 = 745mm V1 = 155mL.
पंक्चर के पूर्व P2 = ? V2 = 600mL.
बॉयल के नियम से,
P1V1 = P2V2(स्थिर ताप पर )
745 x 155 = P2 × 600
P2 = \(\frac{745 \times 155}{600}\)
= 192.46 mm
उत्तर-पंक्चर से पूर्व गुब्बारे का दाब 192.46 mm है।
प्रश्न 19.
एक बर्तन जिसका आयतन 2.461 लीटर है में 27°C पर 0.3 मोल N2, 0.5 मोल He तथा 6.2 मोल O2 है। मिश्रण में गैसों का आशिक दाब ज्ञात करो।
हल:
प्रथम विधि
आदर्श गैस समीकरण से,
P = \(\frac { nRT }{ V }\) = 27 + 273300K,
R = 0.0821 L atm K-1 mol-1
V = 2.461 L
नाइट्रोजन गैस का आंशिक दाब,
PN2 = \(\frac{0.3 \times 0.0821 \times 300}{2.461}\)
= 3.002 atm
हीलियम गैस का आंशिक दाब,
P’He = \(\frac{0.5 \times 0.0821 \times 300}{2.461}\)
= 5.004 atm
ऑक्सीजन गैस का आंशिक दाब
P’O2 = \(\frac{6.2 \times 0.0821 \times 300}{2.461}\)
= 62.050 atm
द्वितीय विधि
मिश्रण उपस्थित कुल मोलों की संख्या
= 0.3 + 0.5 + 6.2
= 7 मोल
कुल दाब ‘PT‘ = \(\frac{n \times \mathrm{R} \times \mathrm{T}}{\mathrm{V}}\)
= \(\frac{7 \times 0.0821 \times 300}{2.461}\)
= 70.06 atm
आंशिक दाब = कुल दाब x मोल प्रभाज
नाइट्रोजन गैस का आंशिक दाब

हीलियम गैसे का आंशिक दाब
P’He = \(\frac{70 \cdot 06 \times 0.5}{7}\)
= 5.004 atm
ऑक्सीजन गैस का आंशिक दाब
P’O2 = \(\frac{70.06 \times 6.2}{7}\)
= 62.050 atm
प्रश्न 20.
एक पात्र में भरी हुयी H2 और N2 गैस के मिश्रण का दाब 750 bar है। यदि मिश्रण में N2 का आंशिक दाब 150 bar हो तो मिश्रण में H2 और N2 के अणुओं का अनुपात क्या होगा ?’
उत्तर:
मिश्रण का कुल दाब – 750 bar
N2 का आंशिक दाब (PN2) = 150 bar
H2 का आंशिक दाब (PH2) = 750 – 150 = 600 bar
आदर्श गैस समीकरण के अनुसार,
PN2 = \(\frac{n_{\mathrm{N}_2} \mathrm{RT}}{\mathrm{V}}\) = 150 bar
PH2 = \(\frac{n_{\mathrm{H}_2} \mathrm{RT}}{\mathrm{V}}\) = 600 bar
चूँकि आयतन V तथा ताप T समान हैं।
\(\frac{\mathrm{P}_{\mathrm{H}_2}}{\mathrm{P}_{\mathrm{N}_2}}=\frac{n_{\mathrm{H}_2}}{n_{\mathrm{N}_2}}\)
\(\frac{600}{150}=\frac{n_{\mathrm{H}_2}}{n_{\mathrm{N}_2}}\)
\(\frac{4}{1}=\frac{n_{\mathrm{H}_2}}{n_{\mathrm{N}_2}}\)
nH2 : nN2 = 4 : 1
प्रश्न 21.
एक मिश्रण में गैस A के 20g और गैस B के 1.4 g मिश्रित किये गये हैं। यदि A तथा B के मोलर द्रव्यमान क्रमशः 120 और 90 हैं तथा मिश्रण का कुल दाब 0.921 bar हो तो A तथा B का आशिक दाब ज्ञात कीजिये।
उत्तर:

प्रश्न 22.
पोटैशियम क्लोरेट (KClO3) की वह मात्रा ज्ञात कीजिये जिसे 28°C ताप तथा 750 mm of Hg दाब पर 2.5 लीटर ऑक्सीजन प्राप्त करने हेतु गर्म किया जाना चाहिये।
हल:
N.T.P. पर मुक्त ऑक्सीजन के आयतन की गणना।

67.2 L O2 मुक्त करने के लिये आवश्यक KClO3 की
मात्रा = 245 g
1.0 L O2 मुक्त करने के लिये आवश्यक
KClO3 की मात्रा = \(\frac { 245 }{ 67.2 }\)g
2.34 L O2 मुक्त करने के लिये आवश्यक KClO3 की मात्रा
= \(\frac{245 \times 2.34}{67 \cdot 2}\)
= 8.53g
प्रश्न 23.
जब 0.5 g जिंक चूर्ण (जो कि ZnO तथा Zn) से बना हुआ है, को तनु H2SO4 में घोला जाता है तो N. T. P. पर 150ml H2 गैस मुक्त होती है। जिंक चूर्ण में जिंक की प्रतिशतता ज्ञात कीजिये।
(जिंक का परमाणु द्रव्यमान = 65 g mol-1)
हल:
जिंक चूर्ण में उपस्थित Zn तथा ZnO दोनों ही तनु H2SO4 के साथ क्रिया करते हैं। परन्तु केवल Zn ही H2 गैस को मुक्त करती।
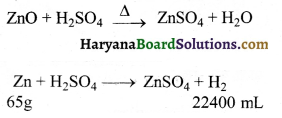
22400 mL H2 मुक्त करने ठीक करे लिये आवश्यक Zn = 65 g 150 mL

प्रश्न 24.
10.0 g शुद्ध मार्बल को हाइड्रोक्लोरिक अम्ल के साथ उपचारित करने पर 30°C ताप और 800mm पर CO2 का कितना आयतन प्राप्त होगा। यदि 30°C ताप पर जलीय तनाव 26.7 mm है।
हल:

100 g CaCO3 गर्म करने पर देता है
= 22400 mL CO2
10.0 g CaCO3 गर्म करने पर देगा
= \(\frac{22400 \mathrm{~mL} \times 10}{100}\) = 2240 ml
CO2 के आयतन की गणना-

प्रश्न 25.
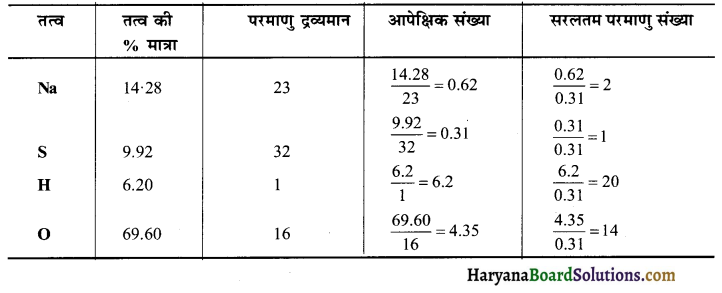
वान्डर वाल स्थिराकों तथा के मान क्रमश: 1.32 dm6 bar mol-2 तथा 0.0312 dm³ mol-1 हों तो ऑक्सीजन के लिये क्रान्तिक ताप तथा क्रान्तिक दाब का मान ज्ञात करें।
हल:
a = 1.32 dm6 bar mol-2
b = 0.0312 dm³ mol-1
R = 0.0821 dm³ bar mol-1 K-1
ऑक्सीजन का क्रान्तिक ताप
(TC) = \(\frac{8 a}{27 \mathrm{R} b}\)
= \(\frac{8 \times 1.32}{27 \times 0.0821 \times 0.312}\)
= 152.69 K
ऑक्सीजन का क्रान्तिक दाव
(PC) = \(\frac{a}{27 b^2}\)
= \(\frac{1.32}{27 \times(0.0312)^2}\)
= 50.22 bar
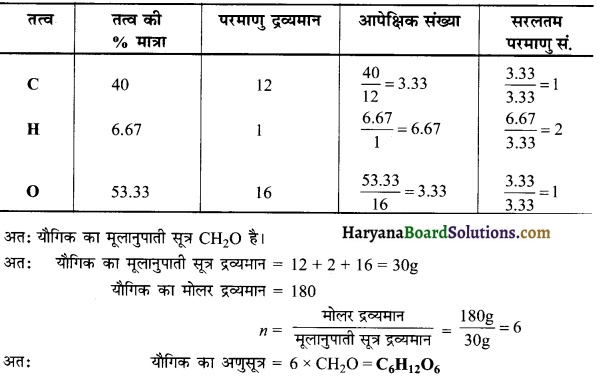
प्रश्न 26.
एक मोल वान्डर वाल गैस का °C तथा 100 atm दाब पर संपीडक गुणांक 0.5 है। गैस के अणुओं का आयतन नगण्य मानते हुए वान्डर बाल स्थिरांक ‘a’ की गणना कीजिए।
हल:
संपीडक गुणांक (Z) = \(\frac { PV }{ RT }\)
0.5 = \(\frac{100 \times V}{0.0821 \times 273}\)
V = 0.112 लीटर
वान्डर वाल समीकरण के अनुसार,
\(\left(\mathrm{P}+\frac{a}{\mathrm{~V}^2}\right)\) (V – b) = RT
यदि b नगण्य है तो,
\(\left[100+\frac{a}{(0 \cdot 112)^2}\right]\) [0.112 – 0] = 0.0821 × 273
a = 1.253 ली.² मोल-2 वायुमण्डल
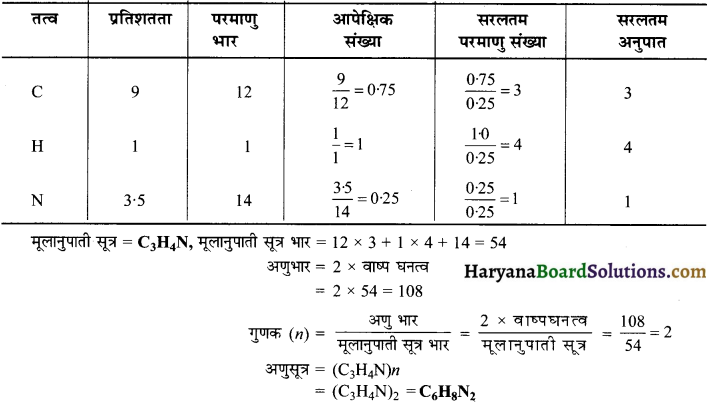
प्रश्न 27.
किसी गैस के 2 मोल 4 लीटर के फ्लास्क में 300 K पर 11 atm दाब दिखाते हैं। यदि ‘b’ का मान 0.05 लीटर / मोल है तो वान्डर वाल स्थिरांक ‘a’ का मान बताएँ।
हल:
दिया है,
P = 11 atm, V = 4, b = 0.05 L/mol, n = 2, T = 300 K

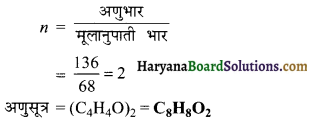
प्रश्न 28.
300 K तथा 40 atm दाब पर 1 मोल CO2, 0.4 लीटर आयतन घेरती है। इसका संपीडक गुणांक ज्ञात कीजिये ।
हल:
संपीडक गुणांक (Z) = \(\frac{\mathrm{PV}}{n \mathrm{RT}}\)
= \(\frac{40 \times 0 \cdot 4}{1 \times 0 \cdot 0821 \times 300}\)
Z = 0.65
प्रश्न 29.
एक निऑन-डाइऑक्सीजन मिश्रण में 70.6g डाइ-ऑक्सीजन तथा 167.5g निऑन है। यदि गैसों के मिश्रण का कुल दाब 25 bar हो तो मिश्रण में निऑन तथा डाइऑक्सीजन का आंशिक दाब क्या होगा ?
हल:
= \(\frac{70 \cdot 6 \mathrm{~g}}{32 \mathrm{~g} \mathrm{~mol}^{-1}}\)
= 2.21 mol
निऑन के मोलों की संख्या
= \(\frac{167 \cdot 5 \mathrm{~g}}{20 \mathrm{~g} \mathrm{~mol}^{-1}}\) = 8.375 mol
डाइऑक्सीजन के मोल अंश
= \(\frac{2 \cdot 21}{2 \cdot 21+8 \cdot 375}=\frac{2 \cdot 21}{10 \cdot 585}=0 \cdot 21\)
निऑन के मोल अंश
= \(\frac { 8.375 }{ 10.585 }\) = 0.79
(अन्य रूप में निऑन के मोल अंश = 1 – 0.21 = 0.79)
गैस का आंशिक दाब = मोल अंश x कुल दाब
ऑक्सीजन का आंशिक दाब
= 0.21× 25 bar = 5.25 bar
निऑन का आंशिक दाब
= 0.79 × 25 bar = 1975 bar