HBSE 11th Class Geography Important Questions Chapter 5 खनिज एवं शैल
Haryana State Board HBSE 11th Class Geography Important Questions Chapter 5 खनिज एवं शैल Important Questions and Answers.
Haryana Board 11th Class Geography Important Questions Chapter 5 खनिज एवं शैल
वस्तुनिष्ठ प्रश्न
भाग-I : सही विकल्प का चयन करें
1. निम्नलिखित में से कौन-सा प्राकृतिक पदार्थ शैल की रचना करता है?
(A) बालू और चीका
(B) बजरी और रोड़ी
(C) ग्रेनाइट
(D) उपर्युक्त सभी
उत्तर:
(D) उपर्युक्त सभी
2. आग्नेय शैलों को प्राथमिक शैलें इसलिए कहा जाता है क्योंकि
(A) ये भू-पृष्ठ पर सबसे ऊपर पाई जाती हैं।
(B) इनका भू-पृष्ठ पर सबसे अधिक विस्तार है
(C) इन शैलों का पृथ्वी पर सबसे पहले निर्माण हुआ था
(D) ये आर्थिक दृष्टि से सबसे महत्त्वपूर्ण शैलें हैं
उत्तर:
(C) इन शैलों का पृथ्वी पर सबसे पहले निर्माण हुआ था
3. ‘प्लूटो’ का अर्थ है-
(A) ग्रहों का देवता
(B) जल देवता
(C) अग्नि देवता
(D) पाताल देवता
उत्तर:
(D) पाताल देवता
![]()
4. अंतर्वेधी आग्नेय शैलों के संबंध में कौन-सा कथन असत्य है?
(A) पातालीय शैलें केवल उत्थापन अथवा पृथ्वी के ऊपरी भाग के अनाच्छादन के बाद ही नजर आती हैं
(B) पाताल के अन्दर शीघ्र ठण्डी होने के कारण इन शैलों के रवे अत्यन्त छोटे होते हैं
(C) पातालीय आग्नेय शैलों के उदाहरण गेब्रो व ग्रेनाइट हैं
(D) पातालीय शैलें अपने मूल स्थान पर मैग्मा के जम जाने से बनती हैं
उत्तर:
(B) पाताल के अन्दर शीघ्र ठण्डी होने के कारण इन शैलों के रवे अत्यन्त छोटे होते हैं
5. स्थलमण्डल के लगभग तीन-चौथाई भाग में कौन-सी शैलें पाई जाती हैं?
(A) अवसादी
(B) आग्नेय
(C) कायांतरित
(D) इनमें से कोई नहीं
उत्तर:
(A) अवसादी
6. भूगर्भ में मैग्मा का सबसे बड़ा व सबसे गहरा भण्डार क्या कहलाता है?
(A) लैकोलिथ
(B) फैकोलिथ
(C) बैथोलिथ
(D) स्टॉक
उत्तर:
(C) बैथोलिथ
7. मोड़दार पर्वतों की अपनति व अभिनति में हुए मैग्मा के लहरदार जमाव को क्या कहते हैं?
(A) सिल
(B) डाइक
(C) फैकोलिथ
(D) लैकोलिथ
उत्तर:
(C) फैकोलिथ
8. गन्ना व कपास के लिए उपजाऊ काली मिट्टी किस शैल के क्षरण से बनती है?
(A) बेसाल्ट शैलें
(B) बालू-प्रधान अवसादी शैलें
(C) ग्रेनाइट शैलें
(D) आब्सीडियन
उत्तर:
(A) बेसाल्ट शैलें
9. निम्नलिखित में से कौन-सी अवसादी शैल है?
(A) बलुआ-पत्थर
(B) अभ्रक
(C) ग्रेनाइट
(D) नाईस
उत्तर:
(A) बलुआ-पत्थर
10. ग्रेनाइट शैल को आप किस वर्ग में रखेंगे?
(A) पैठिक आग्नेय शैल
(B) मध्यवर्ती आग्नेय शैल
(C) पातालीय आग्नेय शैल
(D) बहिर्वेधी आग्नेय शैल
उत्तर:
(C) पातालीय आग्नेय शैल
![]()
11. रासायनिक क्रिया से बनी परतदार शैल का उत्तम उदाहरण है-
(A) जिप्सम
(B) बालू पत्थर
(C) शैल
(D) खड़िया
उत्तर:
(A) जिप्सम
12. निम्नलिखित में से कौन-सी आग्नेय शैल अंतर्वेधी है?
(A) लावा पठार
(B) गौण शंकु
(C) ज्वालामुखी शंकु
(D) डाइक
उत्तर:
(D) डाइक
13. किस मूल शैल से कायांतरित होकर हीरा बना?
(A) नीस
(B) बलुआ पत्थर
(C) कोयला
(D) ग्रेनाइट
उत्तर:
(C) कोयला
14. पैंसिल का सिक्का बनाने के लिए किस शैल का प्रयोग किया जाता है?
(A) स्लेट
(B) एस्बेस्टस
(C) कोयला
(D) ग्रेफाइट
उत्तर:
(D) ग्रेफाइट
भाग-II : एक शब्द या वाक्य में उत्तर दें
प्रश्न 1.
पृथ्वी के आंतरिक भाग में खनिजों का मूल स्रोत क्या है?
उत्तर:
मैग्मा।
प्रश्न 2.
खनिजों का निर्माण करने वाले तत्त्वों की संख्या बताइए।
उत्तर:
खनिजों का निर्माण करने वाले तत्त्वों की संख्या 8 है।
प्रश्न 3.
चट्टान बनाने वाले सामान्य खनिज कितने हैं?
उत्तर:
चट्टान बनाने वाले सामान्य खनिज 12 हैं।
प्रश्न 4.
भू-पर्पटी पर पाए जाने वाले खनिजों में सिलीकेट की प्रतिशत मात्रा कितनी है?
उत्तर:
भू-पर्पटी पर पाए जाने वाले खनिजों में सिलीकेट की प्रतिशत मात्रा लगभग 87 प्रतिशत है।
प्रश्न 5.
अधिसिलिक आग्नेय चट्टानों में सिलिका का प्रतिशत कितना होता है?
उत्तर:
अधिसिलिक आग्नेय चट्टानों में सिलिका का प्रतिशत लगभग 55 प्रतिशत होता है।
प्रश्न 6.
अल्पसिलिक आग्नेय चट्टान का एक उदाहरण दीजिए।
उत्तर:
बेसाल्ट/गेब्रो।
![]()
प्रश्न 7.
बेसाल्ट के अपक्षय से दक्षिणी भारत में पाई जाने वाली उपजाऊ काली मिट्टी का नाम क्या है?
उत्तर:
बेसाल्ट के अपक्षय से दक्षिणी भारत में पाई जाने वाली उपजाऊ काली मिट्टी का नाम रेगड़ है।
प्रश्न 8.
स्थिति के आधार पर आग्नेय चट्टानों के कितने प्रकार होते हैं?
उत्तर:
स्थिति के आधार पर आग्नेय चट्टानें दो प्रकार की होती हैं-
- बहिर्वेधी और
- अंतर्वेधी।
प्रश्न 9.
शैलें (चट्टानें) कितने प्रकार की होती हैं?
उत्तर:
तीन।
- याग्नेय शैलें
- अवसादी शैलें
- कायांतरित शैलें।
प्रश्न 10.
लाल रंग के बलुआ पत्थर से बनी किन्हीं दो प्रसिद्ध इमारतों के नाम बताइए।
उत्तर:
- दिल्ली का लाल किला
- फतेहपुर सीकरी का महल।
प्रश्न 11.
हिमानी द्वारा जमा किए गए अवसादों से बनी चट्टान का क्या नाम है?
उत्तर:
गोलाश्म मृत्तिका (Till)।
प्रश्न 12.
अवसादी चट्टानों में कौन-से दो खनिज ईंधन पाए जाते हैं?
उत्तर:
- कोयला और
- खनिज तेल।
प्रश्न 13.
पेन्सिल बनाने, धातु गलाने, परमाणु ऊर्जा संयन्त्रों के निर्माण तथा बिलियर्डस की मेज़ बनाने के लिए कौन-सी चट्टान का उपयोग किया जाता है?
उत्तर:
पेन्सिल बनाने, धातु गलाने, परमाणु ऊर्जा संयन्त्रों के निर्माण तथा बिलियर्ड्स की मेज़ बनाने के लिए ग्रेफाइट का उपयोग किया जाता है।।
प्रश्न 14.
अवसादी चट्टानें स्थलमण्डल के कितने प्रतिशत भाग पर विस्तृत हैं?
उत्तर:
अवसादी चट्टानें स्थलमण्डल के 75 प्रतिशत भाग पर विस्तृत हैं।
प्रश्न 15.
भारत में स्लेट किन-किन राज्यों में मिलती है?
उत्तर:
झारखण्ड, हिमाचल प्रदेश और हरियाणा में।
प्रश्न 16.
जिप्सम किस प्रकार की उत्पत्ति वाली चट्टान है?
उत्तर:
जिप्सम रासायनिक उत्पत्ति वाली चट्टान है।
![]()
प्रश्न 17.
जैविक उत्पत्ति वाली दो अवसादी चट्टानों के नाम बताइए।
उत्तर:
- चूने का पत्थर और
- कोयला।
प्रश्न 18.
रूपान्तरण कितनी गहराई पर और कितने तापमान पर होता है?
उत्तर:
धरातल से 12 से 16 कि०मी० की गहराई पर और 150°C से 800°C तापमान तक।
प्रश्न 19.
ग्रेफाइट का गलनांक कितना होता है?
उत्तर:
ग्रेफाइट का गलनांक 3500°C सेल्सियस होता है।
प्रश्न 20.
आग्नेय चट्टानों/शैलों की उत्पत्ति का स्रोत क्या है?
उत्तर:
आग्नेय चट्टानों की उत्पत्ति का स्रोत ज्वालामुखी उदभेदन है।
प्रश्न 21.
धरातल पर आते ही लावा तेजी से ठण्डा क्यों हो जाता है?
उत्तर:
क्योंकि वह वायुमण्डल के सम्पर्क में आ जाता है।
प्रश्न 22.
अधिसिलिक या अम्लीय आग्नेय चट्टानों में सिलिका की मात्रा कितनी होती है?
उत्तर:
65 से 85 प्रतिशत तक।
प्रश्न 23.
अल्पसिलिक या क्षारीय या पैठिक आग्नेय चट्टानों में सिलिका की मात्रा कितनी होती है?
उत्तर:
45 से 55 प्रतिशत तक।
प्रश्न 24.
पश्चिमी भारत में बेसाल्ट से घिरे विस्तृत प्रदेश का क्या नाम है?
उत्तर:
दक्कन ट्रैप।
प्रश्न 25.
तलछट को कठोरता से जोड़ने का काम कौन-से तत्त्व करते हैं?
उत्तर:
सिलिका और कैल्साइट।
प्रश्न 26.
यांत्रिक क्रिया द्वारा बनी अवसादी चट्टानों के उदाहरण दीजिए।
उत्तर:
काँग्लोमरेट, ब्रेसिया, शेल (Shale) तथा चीका मिट्टी।
प्रश्न 27.
वह कौन-सा मापक है जो खनिज कणों के आकार का कोटि-निर्धारण करता है?
उत्तर:
वेंटवर्थ (Wentworth) मापक।
प्रश्न 28.
स्थलजात पदार्थ (Terrigenous Material) क्या होते हैं?
उत्तर:
स्थल से प्राप्त होने वाला अवसाद जो समुद्रों में निक्षेपित होता है।
अति-लघूत्तरात्मक प्रश्न
प्रश्न 1.
उत्पत्ति के आधार पर अवसादी चट्टानें कितने प्रकार की होती हैं?
उत्तर:
उत्पत्ति के आधार पर अवसादी चट्टानें तीन प्रकार की होती हैं-
- यांत्रिक
- जैविक और
- रासायनिक।
प्रश्न 2.
चट्टानों का रूपान्तरण कितने प्रकार का होता है?
उत्तर:
चट्टानों का रूपांतरण तीन प्रकार का होता है-
- गतिक
- तापीय और
- क्षेत्रीय।
प्रश्न 3.
उत्पत्ति के आधार पर चट्टानों के कितने प्रकार हैं?
उत्तर:
उत्पत्ति के आधार पर चट्टानें तीन प्रकार की होती हैं-
- आग्नेय चट्टानें
- परतदार अथवा तलछटी चट्टानें
- कायान्तरित चट्टानें।
प्रश्न 4.
IGNEOUS’ शब्द कहाँ से आया है? इसका अर्थ भी बताइए।
उत्तर:
इग्नियस शब्द लातीनी (Latin) भाषा के ‘Ignis’ शब्द से बना है जिसका अर्थ है-आग (Fire)।
प्रश्न 5.
‘Plutonic’ शब्द कहाँ से आया है? इसका अर्थ भी बताइए।
उत्तर:
प्लूटोनिक शब्द ‘Pluto’ से बना है जिसका अर्थ है ‘पाताल देवता’।
प्रश्न 6.
गेब्रो तथा ग्रेनाइट की चट्टानों से रवे (Crystals) बड़े-बड़े क्यों बनते हैं?
उत्तर:
इन चट्टानों को पाताल के अन्दर ठण्डा होने में बहुत समय लग जाता है जिससे इन चट्टानों की रचना करने वाले रवे बड़े बनते हैं।
![]()
प्रश्न 7.
बेसाल्ट में रखे नहीं के बराबर होते हैं, क्यों?
उत्तर:
शान्त उद्गार से बनी इस चट्टान में लावा शीघ्र जम जाता है जिसमें इन चट्टानों के खनिजों के रवे लगभग नहीं बनते।
प्रश्न 8.
ज्वालामुखी काँच क्या होता है?
उत्तर:
यदि लावा बहुत शीघ्र ठण्डा हो जाए तो काँच जैसी चट्टानों का निर्माण होता है जिसे ज्वालामुखी काँच (Volcanic Glass) या आब्सीडियन कहा जाता है।
प्रश्न 9.
पातालीय, अधिवितलीय तथा बहिर्वेधी चट्टानों के दो-दो उदाहरण दीजिए।
उत्तर:
- पातालीय – ग्रेबो तथा ग्रेनाइट।
- अधिवितलीय या मध्यवर्ती – डोलेराइट तथा माइका पैग्मेटाइट।
- बहिर्वेधी – बेसाल्ट तथा आब्सीडियन।
प्रश्न 10.
बैथोलिथ क्या होता है?
उत्तर:
यह मैग्मा का सबसे बड़ा गुम्बदाकार जमाव होता है जो अत्यधिक गहराई में पाया जाता है।
प्रश्न 11.
लैकोलिथ क्या होता है?
उत्तर:
भू-गर्भ से धरातल की ओर बढ़ता हुआ विस्फोटक मैग्मा जब किन्हीं कारणों से धरातल पर नहीं पहुंच पाता तो वह परतदार चट्टानों में छतरीनुमा रूप ले लेता है जिसे लैकोलिथ कहते हैं।
प्रश्न 12.
स्टॉक किसे कहते हैं?
उत्तर:
छोटे आकार के बैथोलिथ को स्टॉक कहते हैं।
प्रश्न 13.
निर्माणकारी साधनों के आधार पर अवसादी चट्टानें कितने प्रकार की हैं?
उत्तर:
निर्माणकारी साधनों के आधार पर अवसादी चट्टानें तीन प्रकार की होती हैं-
- जलीय चट्टानें
- हिमनद निर्मित
- वायु निर्मित।
प्रश्न 14.
जलीय अवसादी चट्टानें कितने प्रकार की होती हैं?
उत्तर:
जलीय अवसादी चट्टानें तीन प्रकार की होती हैं-
- नदीकृत
- सरोवरी
- समुद्री।
प्रश्न 15.
काँग्लोमरेट क्या होता है?
उत्तर:
जब बालू के कणों के साथ गोल व चिकने रोड़े गारे के साथ आपस में जुड़ जाते हैं तो उसे काँग्लोमरेट कहते हैं।
प्रश्न 16.
चूना-प्रधान तथा कार्बन-प्रधान जैव अवसादी चट्टानों के दो-दो उदाहरण दीजिए।
उत्तर:
चूना-प्रधान अवसादी चट्टानें सेलखड़ी और खड़िया कार्बन-प्रधान अवसादी चट्टानें कोयला, पीट।
प्रश्न 17.
कार्बन की मात्रा के आधार पर कोयले की श्रेष्ठता का क्रम निर्धारित कीजिए।
उत्तर:
- पीट
- लिग्नाइट
- बिटुमिनस
- एन्थ्रेसाइट।
प्रश्न 18.
रासायनिक क्रिया से बनी निर्जेव अवसादी चट्टानों के तीन उदाहरण दीजिए।
उत्तर:
- सेंधा नमक (Salt Rock)
- जिप्सम व
- शोरा।
प्रश्न 19.
रूपान्तरण से आपका क्या अभिप्राय है?
उत्तर:
रूपान्तरण से अभिप्राय चट्टानों के रंग, रूप तथा रचना में बदलाव से है।
प्रश्न 20.
रूपान्तरण किन कारणों से होता है?
उत्तर:
चट्टानों का रूपान्तरण ताप और दबाव के कारण होता है।
प्रश्न 21.
रूपान्तरित होकर बलुआ पत्थर तथा चूने का पत्थर किन चट्टानों में बदल जाता है?
उत्तर:
बलुआ पत्थर क्वार्टज़ाइट में तथा चूने का पत्थर संगमरमर में।
प्रश्न 22.
शैल गठन से आपका क्या अभिप्राय है?
उत्तर:
चट्टानों में खनिजों के क्रिस्टलों का आकार तथा उनका प्रतिरूप (Pattern) शैल गठन कहलाता है।
प्रश्न 23.
शिलीभवन (Solidification) क्या होता है?
उत्तर:
महासागरों के नितलों पर दबाव के कारण अवसादी परतों का सघन और कठोर हो जाना शिलीभवन कहलाता है।
प्रश्न 24.
जीवांश (Humus) का अर्थ बताइए।
उत्तर:
मिट्टी में पाए जाने वाले जन्तु एवं वनस्पति के विघटित एवं अंशतः विघटित जैव पदार्थ जो मिट्टी के उपजाऊपन को बढ़ाते हैं, जीवांश कहलाते हैं।
प्रश्न 25.
जीवाश्म (Fosil) क्या होता है?
उत्तर:
परतदार चट्टानों के बीच जीव-जन्तुओं और वनस्पति के अवशेष या उनके छापों का मिलना, जीवाश्म होता है।
![]()
प्रश्न 26.
चट्टानों के गठन से आप क्या समझते हैं?
उत्तर:
चट्टानों की रचना करने वाले कणों का आकार, आकृति और एक-दूसरे से जुड़ने की व्यवस्था अर्थात् कणों का ज्यामितीय स्वरूप चट्टानों का गठन कहलाता है।
प्रश्न 27.
क्वाटर्ज क्या है और इसकी क्या विशेषता है?
उत्तर:
यह प्राकृतिक रवेदार सिलिका (बालू) है। यह कभी-कभी शुद्ध, स्वच्छ और रंगहीन कणों में मिलता है। इसके ऊँचे गलनांक के कारण उद्योगों में इसका बहुत उपयोग होता है।
प्रश्न 28.
रासायनिक संरचना के आधार पर आग्नेय चट्टानों के कितने भेद हैं?
उत्तर:
रासायनिक संरचना के आधार पर आग्नेय चट्टानों (अन्तर्वेधी और बहिर्वेधी दोनों) के दो वर्ग हैं-]
- अधिसिलिक या अम्लीय चट्टानें।
- अल्पसिलिक या क्षारीय या पैठिक चट्टानें।
प्रश्न 29.
खनिज की परिभाषा दीजिए।
उत्तर:
‘खनिज’ वे प्राकृतिक पदार्थ होते हैं जिनकी अपनी भौतिक विशेषताएँ तथा एक निश्चित रासायनिक बनावट होती है। अधिकांश खनिज ठोस, जड़ व अकार्बनिक अथवा अजैव पदार्थ होते हैं। चट्टानों की रचना विभिन्न खनिजों के संयोग से होती है। वॉरसेस्टर के अनुसार, “लगभग सभी चट्टानों में दो या दो से अधिक खनिज होते हैं।” कई बार चट्टान केवल एक खनिज से भी बनती है; जैसे चूना, पहाड़ी नमक, बालू-पत्थर इत्यादि। इसी आधार पर फिन्च व ट्रिवार्था ने कहा है, “एक या एक से अधिक खनिजों के मिश्रण से चट्टानों का निर्माण होता है।”
प्रश्न 30.
बहिर्वेधी आग्नेय चट्टानें क्या होती हैं?
उत्तर:
वे चट्टानें जो ज्वालामुखी क्रिया द्वारा धरातल के ऊपर आए लावा के ठण्डा होकर ठोस होने से बनती हैं बहिर्वेधी आग्नेय चट्टानें कहलाती हैं। इन्हें ज्वालामुखी चट्टानें भी कहा जाता है। काले या लाल रंग के गाढ़े द्रव्य के बहते हुए चादर के रूप में जमने के कारण इन चट्टानों को लावा स्तर (Lava flows) भी कहा जाता है।
प्रश्न 31.
आग्नेय चट्टानी पिण्ड क्या होते हैं?
उत्तर:
मैग्मा के ठोसावस्था में आने पर अनेक तरह के आग्नेय चट्टानी पिण्डों की रचना होती है। इनका नामकरण इनके रूप, आकार, स्थिति तथा आस-पास पाई जाने वाली चट्टानों के आधार पर किया जाता है। अधिकांश चट्टानी पिण्ड अन्तर्वेधी आग्नेय चट्टानों से बने हुए हैं।
प्रश्न 32.
गतिक रूपान्तरण क्या होता है? स्पष्ट कीजिए।
उत्तर:
पृथ्वी की आन्तरिक हलचलों के कारण चट्टानों में नमन (Bending) और वलन (Folding) आ जाते हैं। इससे चट्टानों पर भारी दबाव पड़ता है और परिणामस्वरूप चट्टानों के रूप व संघटन में परिवर्तन आ जाता है। इसे गतिक रूपान्तरण कहते हैं। इस प्रकार के रूपान्तरण से ग्रेनाइट का नीस तथा चिकनी मिट्टी व शैल का शिस्ट व स्लेट में कायान्तरण हो जाता है।
प्रश्न 33.
अधिसिलिक या अम्लीय आग्नेय चट्टानें क्या होती हैं?
उत्तर:
अधिसिलिक चट्टानों में सिलिका की मात्रा 65 से 85 प्रतिशत होती है। इन चट्टानों के शेष तत्त्वों में सोडियम, पोटाशियम व कैल्शियम के फेल्सपार नामक खनिजों की प्रधानता होती है। लोहे की कम मात्रा के कारण इन चट्टानों का घनत्व कम (लगभग 2.75) होता है तथा रंग भी हल्का होता है। ग्रेनाइट (अन्तर्वेधी) और आब्सीडियन (बहिर्वेधी) अधिसिलिक आग्नेय चट्टानों के प्रमुख उदाहरण हैं। .
प्रश्न 34.
अल्पसिलिक या क्षारीय या पैठिक आग्नेय चट्टानें क्या होती हैं?
उत्तर:
अल्पसिलिक आग्नेय चट्टानों में सिलिका की मात्रा 45 से 55 प्रतिशत तक होती है। इन चट्टानों के अन्य रचक तत्त्वों में लोहा व मैग्नीशियम के खनिजों की प्रधानता होती है, इसी कारण इन चट्टानों का रंग गहरा व घनत्व अधिक (लगभग 3) होता है। बेसाल्ट (बहिर्वेधी) और गेब्रो (अन्तर्वेधी) इसी वर्ग की चट्टानें हैं।
प्रश्न 35.
भारत में कायान्तरित चट्टानें कहाँ-कहाँ पाई जाती हैं?
उत्तर:
- शिस्ट व नीस दक्षिणी भारत, बिहार व राजस्थान के कुछ भागों में पाई जाती है।
- क्वार्टज़ाइट राजस्थान, झारखण्ड, मध्य प्रदेश व तमिलनाडु में पाया जाता है।
- संगमरमर राजस्थान के अलवर, अजमेर, जयपुर व जोधपुर में व मध्य प्रदेश में जबलपुर के निकट नर्मदा घाटी में पाया जाता है।
- स्लेट हरियाणा (रेवाड़ी, कुण्ड, अटेली, नारनौल), हिमाचल प्रदेश (काँगड़ा) तथा झारखण्ड में पाई जाती है।
प्रश्न 36.
चट्टानी चक्र से आपका क्या तात्पर्य है?
उत्तर:
आग्नेय और अवसादी चट्टानें ताप, दबाव, भू-संचलन व रासायनिक क्रियाओं के प्रभावाधीन रूपान्तरित चट्टानों में बदलती रहती हैं। जब चट्टानें अपने किसी वर्ग में स्थिर न रहकर परिस्थितियों के कारण अपना वर्ग बदलती रहती हैं, इसे चट्टानी चक्र कहते हैं। इसमें कोई भी चट्टान कोई भी रूप धारण कर सकती है।
प्रश्न 37.
ब्रेसिआ तथा काँग्लोमरेट का निर्माण किस प्रकार होता है?
उत्तर:
ब्रेसिआ तथा काँग्लोमरेट का निर्माण तलछटी चट्टानों से यान्त्रिक क्रिया द्वारा होता है। अपरदन क्रिया द्वारा पत्थरों तथा कंकड़ों का आकार गोल हो जाता है। जब ये पत्थर आपस में जुड़ जाते हैं तो उनसे काँग्लोमरेट का निर्माण होता है। ये पत्थर क्वार्ट्ज के कारण आपस में जुड़ते हैं। ब्रेसिआ का निर्माण पत्थरों के बीच गारा भर जाने के कारण जुड़ने से होता है। ब्रेसिआ में पत्थरों की आकृति नुकीली होती है।
प्रश्न 38.
निम्नलिखित चट्टानों का आग्नेय, अवसादी तथा रूपान्तरित चट्टानों में वर्गीकरण कीजिए-
(1) ट्रैप
(2) बेसाल्ट
(3) डोलेराइट
(4) क्वार्ट्ज़ाइट
(5) कोयला
(6) एन्थ्रासाइट
(7) चूनाश्म
(8) खड़िया
(9) संगमरमर
(10) चीका
(11) शैल
(12) नाइस
(13) शिस्ट
(14) बलुआ पत्थर
(15) ग्रेनाइट
(16) सेंधा नमक
(17) ब्रेसिआ
(18) फाइलाइट
(19) प्रवाल
(20) काँग्लोमरेट।
उत्तर:
| आग्नेय चट्टानें | अवसादी चट्टानें | रूपान्तरित चट्टानें |
| ट्रैप, बेसाल्ट, डोलेराइट ग्रेनाइट। | कोयला, चीका, एन्थ्रासाइट, शैल, चूना पत्थर, खड़िया, बलुआ पत्थर, सेंधा नमक, ब्रेसिआ, प्रवाल, काँग्लोमरेट। | क्वार्ट्रज़ाइट, संगमरमर, नाइस, शिस्ट, फाइलाइट। |
प्रश्न 39.
अवसादी चट्टानों के गुणों को नियन्त्रित करने वाले कारकों के नाम लिखिए।
उत्तर:
- उत्पत्ति क्षेत्र में उपस्थित शैलों के प्रकार
- उत्पत्ति क्षेत्र का वातावरण
- उत्पत्ति क्षेत्र एवं निक्षेपण क्षेत्र में भू-संचरण (Earth Movements)
- निक्षेपण क्षेत्र में वातावरण
- निक्षेपण के बाद तलछटों में हुए परिवर्तन।
लघूत्तरात्मक प्रश्न
प्रश्न 1.
आग्नेय चट्टान क्या है?
उत्तर:
आग्नेय शब्द की उत्पत्ति लैटिन भाषा के इग्निस (Ignis) शब्द से हुई है, जिसका तात्पर्य है कि अग्नि के समान गरम तप्त लावा के ठण्डे होने से इन चट्टानों का निर्माण हुआ। पृथ्वी अपनी उत्पत्ति के समय गरम, तरल एवं गैसीय पुंज थी, जो धीरे-धीरे ठण्डी हुई। ठण्डी एवं ठोस अवस्था में आने से इन चट्टानों का निर्माण हुआ। पृथ्वी पर सर्वप्रथम इन्हीं चट्टानों का निर्माण हुआ इसलिए इन्हें प्राथमिक चट्टानें भी कहते हैं। आग्नेय चट्टानें पृथ्वी के पिघले हुए पदार्थ (मैग्मा) के ठण्डा एवं ठोस हो जाने के कारण बनी हैं।
प्रश्न 2.
चट्टान बनाने वाले खनिज कौन-से होते हैं? इनकी रचना किन तत्त्वों से होती है?
उत्तर:
चट्टानों की रचना 2,000 विभिन्न खनिजों से हुई है। इनमें से केवल 12 खनिज ऐसे हैं जो पृथ्वी तल पर हर जगह पाए जाते हैं। प्रायः प्रत्येक खनिज में दो या दो से अधिक रासायनिक तत्त्व होते हैं। उदाहरणतः क्वार्टज़ दो तत्त्वों सीलिकॉन व ऑक्सीजन से मिलकर बना है। इसी प्रकार कैल्शियम कार्बोनेट कैल्शियम (चूना), कार्बन और ऑक्सीजन से बना रासायनिक यौगिक है। कुछ खनिज एक ही तत्त्व से बने हुए पाए जाते हैं; जैसे सोना, ताँबा, सीसा (Lead) व गन्धक इत्यादि। अधिकांश खनिजों की रचना आठ मुख्य रासायनिक तत्त्वों से हुई है। भू-पर्पटी के कुलं भार का 97.3% इन्हीं 8 तत्त्वों के कारण है। स्थलमण्डल के लगभग 87% खनिज सिलिकेट हैं।
प्रश्न 3.
धात्विक तथा अधात्विक खनिजों में आप कैसे अन्तर करेंगे?
उत्तर:
धात्विक खनिज (Metallic Minerals) वे होते हैं जिन्हें परिष्कृत किया जा सकता है। परिष्कृत करने पर उनका ‘धरातल चिकना (Smooth) व चमकीला हो जाता है। इनसे हमें धातुएँ प्राप्त होती हैं जिन्हें पीटकर चादर, तार इत्यादि विभिन्न आकारों में ढाला जा सकता है। लोहा, चाँदी, सोना, ताँबा, टीन, एल्यूमीनियम, जस्ता, मैंगनीज़ इत्यादि महत्त्वपूर्ण धात्विक खनिज हैं। अधात्विक खनिज (Non-metallic Minerals) वे होते हैं जिन्हें परिष्कृत नहीं किया जा सकता। इनमें धातु का अंश नहीं होता। इन्हें केवल खुरचकर या काटकर विभिन्न आकारों में परिवर्तित किया जा सकता है। कोयला, चूना-पत्थर, गन्धक, जिप्सम, नमक व खनिज तेल इत्यादि अधात्विक खनिजों के उदाहरण हैं।
प्रश्न 4.
“शैलें पृथ्वी के इतिहास के पन्ने हैं और जीवावशेष उसके अक्षर” स्पष्ट कीजिए।
अथवा
“शैलें पृथ्वी के इतिहास की जानकारी प्रदान करती हैं।” इस कथन को स्पष्ट कीजिए।
उत्तर:
भू-पृष्ठ का निर्माण शैलों से हुआ है। भू-वैज्ञानिक इतिहास के बारे में शैलें महत्त्वपूर्ण जानकारी प्रदान करती हैं। शैलों में खनिज पदार्थ पाए जाते हैं तथा इनसे मिट्टी का निर्माण होता है, जो प्राकृतिक पर्यावरण का एक महत्त्वपूर्ण तथा आवश्यक भाग है। शैलों की परतों में जीव-जन्तु तथा प्राकृतिक वनस्पतियों के अवशेष पाए जाते हैं। इन जीवावशेषों से पृथ्वी की उत्पत्ति तथा समय की जानकारी प्राप्त होती है। इसलिए यह कहना सत्य है कि शैलें पृथ्वी के इतिहास के पन्ने हैं और जीवावशेष उसके अक्षर हैं।
![]()
प्रश्न 5.
आग्नेय चट्टानों को प्राथमिक चट्टानें क्यों कहा जाता है? स्थिति के आधार पर आग्नेय चट्टानों को कितने भागों में बाँटा जा सकता है?
उत्तर:
स्थलमण्डल करोड़ों वर्ष पहले तरल पृथ्वी के ऊपरी भाग के कठोर हो जाने से बना है। इसलिए पृथ्वी पर सबसे पहले आग्नेय चट्टानों का निर्माण हुआ था। इसी आधार पर इन्हें प्राथमिक चट्टानें (Primary Rocks) भी कहा जाता है। अवसादी और रूपान्तरित चट्टानों की अन्य दो किस्में, आग्नेय चट्टानों पर पड़ने वाले प्राकृतिक कारकों के प्रभावों से बनती हैं।
स्थिति के आधार पर आग्नेय चट्टानों को दो वर्गों में बाँटा जा सकता है-
- अन्तर्वेधी आग्नेय चट्टानें
- बहिर्वेधी आग्नेय चट्टानें।
प्रश्न 6.
अन्तर्वेधी आग्नेय चट्टान से क्या अभिप्राय है? इसे कितने वर्गों में बाँटा जा सकता है?
उत्तर:
जब मैग्मा धरातल के ऊपर न पहुँचकर उसके नीचे ही अलग-अलग गहराइयों पर ठण्डा होकर ठोस रूप धारण कर लेता है तो इससे अन्तर्वेधी आग्नेय चट्टानों का निर्माण होता है। भू-पटल के नीचे गहराई के आधार पर अन्तर्वेधी चट्टानें दो प्रकार की होती हैं
- पातालीय चट्टानें
- अधिवितलीय चट्टानें।
प्रश्न 7.
पातालीय चट्टानें क्या होती हैं और इनकी क्या विशेषताएँ होती हैं?
उत्तर:
पातालीय चट्टानों का नामकरण ‘प्लूटो’ (Pluto) के नाम पर किया गया है, जिसका अर्थ होता है ‘पाताल देवता’। अतः ऐसी आग्नेय चट्टानें जो स्थलमण्डल में काफ़ी गहराई पर अपने मूल स्थान पर ही मैग्मा के जम जाने से बनती हैं, पातालीय चट्टानें कहलाती हैं। मैग्मा की विशाल राशि को पाताल के अन्दर ठण्डा होकर जमने में बहुत समय लग जाता है। फलस्वरूप इन चट्टानों की रचना करने वाले खनिजों के रवे (Crystals) बड़े-बड़े बनते हैं। पृथ्वी के ऊपरी भाग के अत्यधिक अनाच्छादन या उत्थापन (Uplifting) के बाद ही ये चट्टानें भू-तल पर प्रकट होती हैं। पातालीय आग्नेय चट्टानों का सबसे महत्त्वपूर्ण उदाहरण गेब्रो तथा ग्रेनाइट हैं। सामान्यतः ग्रेनाइट का रंग भूरा, लाल, गुलाबी व सफेद होता है।
प्रश्न 8.
आग्नेय चट्टानों की प्रमुख विशेषताएँ बताइए।
उत्तर:
आग्नेय चट्टानों की प्रमुख विशेषताएँ निम्नलिखित हैं-
- आग्नेय चट्टानें कठोर, ठोस व संहत (Compact) होती हैं, इसलिए ये टिकाऊ भी होती हैं।
- इन चट्टानों में परतें नहीं होती, बल्कि ये स्थूल होती हैं।
- इन चट्टानों में रन्ध्र (Pores) नहीं होते, अतः जल इनमें प्रवेश नहीं कर पाता।
- आग्नेय चट्टानें रवेदार होती हैं किन्तु रवों का आकार मैग्मा के ठण्डा होने की गति पर निर्भर करता है। अन्तर्वेधी आग्नेय चट्टानों के रवे बड़े और बहिर्वेधी चट्टानों के रवे छोटे होते हैं।
- तप्त और तरल द्रव्य से बनने के कारण इन प्राथमिक चट्टानों में जीवावशेष (Fossils) नहीं पाए जाते।
- इन चट्टानों का अपक्षय कम होता है। इनमें यान्त्रिक अपक्षय (Mechanical Weathering) की प्रक्रिया इनके सन्धि-तलों व भ्रंशों से आरम्भ होती है।
- इन चट्टानों में अनेक प्रकार के खनिज बहुतायत में पाए जाते हैं।
- सिलिका की मात्रा अधिक होने पर इन चट्टानों का रंग हल्का व सिलिका कम होने पर रंग गहरा हो जाता है।
प्रश्न 9.
आग्नेय चट्टानों का आर्थिक महत्त्व स्पष्ट कीजिए।
उत्तर:
- इन चट्टानों में आर्थिक महत्त्व के बहुमूल्य खनिज पदार्थों; जैसे सोना, चाँदी, हीरा, निकिल, प्लैटिनम, मैंगनीज़, लोहा, टीन, जस्ता, ग्रेफाइट, ताँबा, सीसा आदि के विशाल भण्डार पाए जाते हैं।
- ग्रेनाइट व बेसाल्ट चट्टानों का प्रयोग सड़क और भवन निर्माण में प्राचीनकाल से होता रहा है। भारत में अनेक भव्य किले, महल और मन्दिर आदि इन चट्टानों से बने हुए हैं।
- बेसाल्ट चट्टानों के क्षरण से उपजाऊ काली मिट्टी बनती है जो गन्ना और कपास जैसी फसलों के लिए श्रेष्ठ है।
- आग्नेय चट्टानों के क्षेत्र में खनिज मिश्रित गरम जल के स्रोत पाए जाते हैं।
प्रश्न 10.
अवसादी चट्टानें किस प्रकार बनती हैं?
अथवा
अवसादी चट्टानों की निर्माण प्रक्रिया समझाइए।
अथवा
“अवसादी चट्टानें अन्य चट्टानों से बनती हैं।” इस कथन को सिद्ध कीजिए।
उत्तर:
अपक्षय तथा अपरदन क्रिया द्वारा चट्टानें ट-फट कर छोटे-बड़े कणों में परिवर्तित होती रहती हैं जिसे अवसाद कहते हैं। बालू, मिट्टी, बज़री, रोड़ी इत्यादि अवसाद के विभिन्न रूप हैं। अनाच्छादन के साधन लाखों वर्षों तक इस अवसाद को परतों में जमा करते रहते हैं। कालान्तर में ये परतें ठोस होकर अवसादी चट्टानें बनती हैं। स्तरों में मिलने के कारण इन्हें स्तरित चट्टानें (Stratified Rocks) भी कहा जाता है। अवसाद के अतिरिक्त इन चट्टानों के निर्माण में पौधों और जानवरों के अवशेषों से उत्पन्न जीवांश (Humus) तथा घुलनशील तत्त्व भी योगदान देते हैं।
प्रश्न 11.
आग्नेय शैलों/चट्टानों का वर्गीकरण प्रस्तुत कीजिए।
उत्तर:
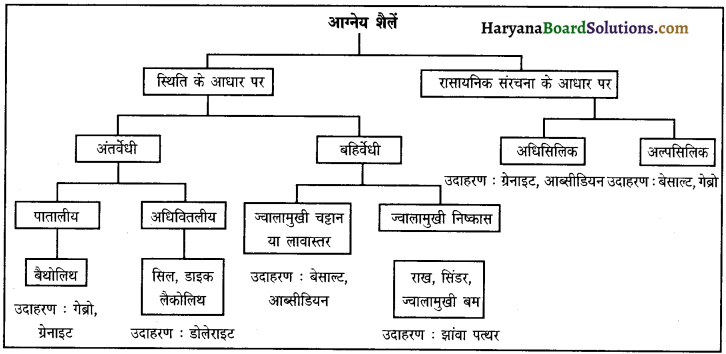
प्रश्न 12.
अवसादी शैलों का वर्गीकरण प्रस्तुत कीजिए।
उत्तर:
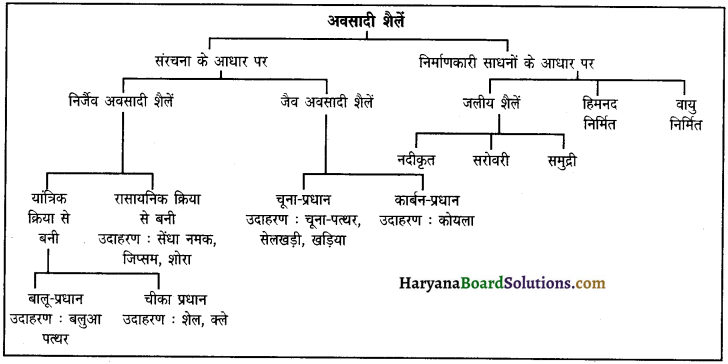
प्रश्न 13.
आग्नेय तथा रूपान्तरित चट्टानों में खनिज रवों की व्यवस्था लगभग एक-समान क्यों होती है?
उत्तर:
आग्नेय चट्टानों और रूपान्तरित चट्टानों का निर्माण लगभग एक समान परिस्थितियों में होता है। इन चट्टानों का निर्माण भू-तल के आन्तरिक भाग में होता है तथा इनके निर्माण में प्रमुख कारक मैग्मा है। आन्तरिक भाग में चट्टानें पिघली हुई अवस्था में होती हैं। जब इनसे आग्नेय चट्टानों का निर्माण होता है, तो इनके रवे ढेरों के रूप में बनते हैं, परन्तु जब दबाव तथा तापक्रम के कारण रूपान्तरित चट्टानों का निर्माण होता है, तो इनके रवे तहों में समानान्तर रूप में स्थिर रहते हैं।
प्रश्न 14.
जीवाश्म केवल अवसादी चट्टानों में ही सुरक्षित रहते हैं, न कि आग्नेय चट्टानों में। ऐसा क्यों होता है?
उत्तर:
प्राकृतिक वनस्पति तथा विभिन्न जीव-जन्तुओं के अवशेषों अथवा अस्थि-पिंजरों को जीवाश्म कहते हैं। जीवाश्म केवल अवसादी चट्टानों में ही सुरक्षित रहते हैं क्योंकि अवसादी चट्टानें परतदार होती हैं। इन परतों में जीवाश्म सुरक्षित रहते हैं तथा इनसे चट्टानों की उत्पत्ति के समय का ज्ञान होता है। जीवाश्म आग्नेय चट्टानों में सुरक्षित नहीं रह सकते, क्योंकि ये चट्टानें परतरहित होती हैं तथा इनके मूल पदार्थ मैग्मा की गर्मी के कारण ये जीवाश्म झुलस जाते हैं।
प्रश्न 15.
भू-पर्पटी में किन परिस्थितियों में खनिज तेल के भण्डार पाए जा सकते हैं? समीक्षा कीजिए।
उत्तर:
खनिज तेल सूक्ष्म सागरीय जीव-जन्तुओं और प्राकृतिक वनस्पति के गलने-सड़ने से अवसादी चट्टानों में पाया जाता है। इन चट्टानों की संरचना परतदार तथा विशेष प्रकार की होती है। खनिज तेल भू-पर्पटी में निम्नलिखित परिस्थितियों में पाया जाता है
- खनिज तेल तलछट के जमाव के कारण तलछटी चट्टानों में मिलता है।
- जब दो अप्रवेशीय चट्टानों के मध्य एक प्रवेशीय परत होती है।
- दो परतों के मध्य बलुआ पत्थर की परत से खनिज तेल का निर्माण होता है, क्योंकि गर्मी और दबाव के कारण बलुआ पत्थर में उपस्थित प्राकृतिक वनस्पति तथा जीव-जन्तुओं के अवशेष खनिज तेल में परिवर्तित हो जाते हैं।
- अवसादी चट्टानों में वलन होते हैं। खनिज तेल इन वलनों के शिखर से प्राप्त होता है।
- नदियों, घाटियों एवं डेल्टाई क्षेत्रों की अवसादी चट्टानों में खनिज तेल के विस्तृत भण्डार संचित हैं। उदाहरण के लिए, सम्पूर्ण उत्तरी भारत की चट्टानों में खनिज तेल मिलने की सम्भावनाएँ हैं।
प्रश्न 16.
अवसादी चट्टानों की प्रमुख विशेषताओं पर प्रकाश डालिए।
उत्तर:
अवसादी चट्टानों की प्रमुख विशेषताएँ निम्नलिखित हैं-
- अवसादी चट्टानें परतों में पाई जाती हैं।
- इन चट्टानों में रवे नहीं पाए जाते।
- इन चट्टानों में प्राणिज अवशेष (Fossils) पाए जाते हैं जो जीवन के विकास काल को प्रदर्शित करते हैं।
- ये चट्टानें अपेक्षाकृत नरम होती हैं। इन्हें चाकू से खुरचने पर इनमें से महीन कण झड़ते हैं।
- आग्नेय व कायान्तरित शैलों की तुलना में इनका अपक्षय व अपरदन आसानी से होता है।
- अवसादी चट्टानें सरन्ध्र होती हैं। इनमें जल सुगमता से प्रवेश कर सकता है।
प्रश्न 17.
“रूपान्तरित चट्टानें आग्नेय चट्टानों और अवसादी चट्टानों का ही परिवर्तित रूप है।” स्पष्ट कीजिए।
उत्तर:
ऐसी चट्टानें जो अन्य चट्टानों के रूप परिवर्तन द्वारा बनती हैं, रूपान्तरित चट्टानें कहलाती हैं। पी०जी० वॉरसेस्टर के घटन हए बिना गर्मी. दबाव तथा रासायनिक क्रियाओं के फलस्वरूप उनके रूप, बनावट व खनिजों का पूर्ण कायान्तरण हो जाता है, वे कायान्तरित चट्टानें कहलाती हैं। रूपान्तरण केवल आग्नेय व अवसादी शैलों का नहीं होता, बल्कि प्राचीन कायान्तरित शैलों का भी होता है जिसे पुनः रूपान्तरण या अति-रूपान्तरण कहा जाता है।
प्रश्न 18.
कायान्तरित चट्टानों का आर्थिक महत्त्व स्पष्ट कीजिए।
उत्तर:
- कायान्तरित चट्टानों में अनेक महत्त्वपूर्ण खनिज पाए जाते हैं; जैसे नीस, क्वार्टज़ाइट, ग्रेफाइट, एन्थ्रासाइट, स्लेट व संगमरमर इत्यादि।
- क्वार्टज़ाइट का प्रयोग काँच उद्योग में होता है क्योंकि यह एक कठोरतम खनिज है।
- स्लेट का प्रयोग छप्पर व फर्श बनाने के लिए तथा स्कूली बच्चों के लिखने के लिए होता है। बिलियर्ड्स की मेज़ मोटी स्लेट से बनाई जाती है।
- नीस व संगमरमर का प्रयोग इमारती पत्थर के रूप में किया जाता है। विश्व प्रसिद्ध ताजमहल संगमरमर का बना हुआ है।
- ग्रेफाइट का प्रयोग पेन्सिल का सिक्का बनाने तथा धातु गलाने की घड़िया (Crucible) बनाने के काम आता है। ग्रेफाइट का गलनांक $3500^{\circ}$ सेल्सियस होतां है। परमाणु बिजली-घरों के लिए ग्रेफाइट अनिवार्य है।
- रूपान्तरित चट्टानों में ही बहुमूल्य जवाहरात; जैसे रत, माणिक, नीलम इत्यादि उत्पन्न होते हैं।
- सेलखड़ी और टेल्क का प्रयोग टेलकम पाउडर जैसे सौन्दर्य प्रसाधन बनाने में किया जाता है।
![]()
प्रश्न 19.
तापीय अथ्वा स्पर्श रूपान्तरण क्या होता है?
उत्तर:
ऊँचे ताप के प्रभाव से चट्टानों में होने वाला रूपान्तरण तापीय रूपान्तरण कहलाता है। भू-गर्भ से ऊपर की ओर बढ़ता हुआ गरम मैग्मा अपने सम्पर्क में आने वाली स्थानीय शैलों को पिघलाकर या भूनकर उनके रूप, रंग, संरचना और गुणों में परिवर्तन ला देता है। इस तापीय रूपान्तरण से बलुआ पत्थर बदलकर क्वार्टज़ाइट, चूने का पत्थर बदलकर संगमसमर, चीका मिट्टी और शैल बदलकर स्लेट और बिटुमिनस कोयला बदलकर एंग्रासाइट और ग्रेफाइट बन जाते हैं। ये सभी परिवर्तन लगभग 50 से 80 डिग्री सेल्सियस तक होते हैं। 150 से 200 सेल्सियस में स्लेट पुनः कायान्तरित होकर फाइलाइट (Philite) में बदल जाती है।
प्रश्न 20.
खनिज संसाधरों का वर्गीकरण कीजिए-
उत्तर:
खनिज संसाधन निम्नलिखित वर्गों में बाँटे जाते हैं-
- आवश्यक संसाधन-आधारभूत संसाधनों के इस वर्ग से हमें जल तथा मृदा उपलब्ध होते हैं।
- ऊर्जा संसाधन-इनमें हमें जीवाशुमी ईंधन; जैसे कच्चा तेल, प्राकृतिक गैस, कोयला, तारकोल, बालू तथा परमाणु ईंधन; जैसे यूरेनियम, थोरियम तथा भूतापीय ऊर्जा उपलब्ध होती है।
- धात्विक संसाधन-इनमें हमें संरचनात्मक धातुएँ; जैसे लोहा, एल्यूमीनियम, टिटैनियम, सोना, प्लैटिनम तथा सैलियम इत्यादि प्राप्त होते हैं।
- औधोगिक संसाधन-औद्योगिक खनिजों से हमें 30 से अधिक पदार्थ प्राप्त होते हैं; जैसे बालू, नमक व एस्बेस्टस इत्यादि।
प्रश्न 21.
निम्नलिखित में अन्तर स्पष्ट कीजिए-
(क) खनिज तथा चट्टान
(ख) डाइक तथा सिल
(ग) आग्नेय तथा अवसादी चट्टारें।
उत्तर:
(क) खनिज तया चट्टान-
| खनिज (Mineral) | चट्टान (Rock) |
| 1. खनिज एक या अधिक तत्त्वों के योग से बनते हैं। प्रायः ये यौगिक रूप में मिलते हैं। | 1. चट्टान एक या अधिक खनिजों के मिश्रण से बनती हैं। |
| 2. खनिज प्राकृतिक अवस्था में पाया जाने वाला एक अजैविक पदार्थ है। | 2. चट्टान भू-पृष्ठ पर पाया जाने वाला जैविक और अजैविक, कठोर और नरम पदार्थ है। |
| 3. खनिजों की एक निश्चित रासायनिक संरचना होती है। | 3. चट्टानों की निश्चित रासायनिक संरचना नहीं होती। |
| 4. खनिजों से चट्टान बनती है। | 4. चट्टानों से भू-पर्पटी बनती है। |
| 5. लोहा, तांबा, सोना, अभ्रक, फेल्सपार आदि खनिजों के उदाहरण हैं। | 5. चूना पत्थर, बलुआ पत्थर, स्लेट, ग्रेनाइट आदि चट्टानों के उदाहरण हैं। |
(ख) डाइक तथा सिल
| डाइक | सिल |
| 1. इनका निर्माण भूतल के आन्तरिक भाग में मैग्मा के लम्बवत् रूप में दरारों में जम जाने के कारण होता है। | 1. इनका निर्माण भूतल के आन्तरिक भाग में मैग्मा के क्षैतिज परतों के मध्य दरारों में जम जाने के कारण होता है। |
| 2. यह अन्तर्वेधी आग्नेय शैल है। | 2. यह भी अन्तर्वेधी आग्नेय शैल है। |
| 3. ये भूतल के लम्बवत् बनते हैं। | 3. ये भूतल के समानान्तर क्षैतिज अवस्था में बनते हैं। |
(ग) आग्नेय तथा अवसादी चट्टानें
| आग्नेय चट्टानें | अवसादी चट्टानें |
| 1. आग्नेय शैलों का निर्माण लावा के ठण्डा तथा ठोस होने से होता है। | 1. अवसादी शैलों का निर्माण तलछट की परतों के निरन्तर जमने से होता है। |
| 2. ये शैलें ढेरों में मिलती हैं। | 2. ये शैलें परतदार होती हैं। |
| 3. इन शैलों में रवे मिलते हैं। | 3. इन शैलों में विभिन्न प्रकार के गोल कण मिलते हैं। |
| 4. इनमें जीवावशेष नहीं मिलते। | 4. इनमें प्राकृतिक वनस्पति तथा जीव-जन्तुओं के अवशेष मिलते हैं। |
निबंधात्मक प्रश्न
प्रश्न 1.
आग्नेय चट्टानें किसे कहते हैं? इनका वर्गीकरण कीजिए।
अथवा
विभिन्न आधारों पर आग्नेय चट्टानों का वर्गीकरण कीजिए।
उत्तर:
आग्नेय चट्टानों का अर्थ (Meaning of Igneous Rocks)-आग्नेय शब्द की उत्पत्ति लैटिन भाषा के इग्निस (Ignis) शब्द से हुई है, जिसका तात्पर्य है कि अग्नि के समान गरम तप्त लावा के ठण्डे होने से इन चट्टानों का निर्माण हुआ। पृथ्वी अपनी उत्पत्ति के समय गरम, तरल एवं गैसीय पुंज थी, जो धीरे-धीरे ठण्डी हुई। ठण्डी एवं ठोस अवस्था में आने से इन चट्टानों का निर्माण हुआ। पृथ्वी पर सर्वप्रथम इन्हीं चट्टानों का निर्माण हुआ इसलिए इन्हें प्राथमिक चट्टानें भी कहते हैं। आग्नेय चट्टानें पृथ्वी के पिघले हुए पदार्थ (मैग्मा) के ठण्डा एवं ठोस हो जाने के कारण बनी हैं।
आग्नेय चट्टानों का वर्गीकरण (Classification of Igneous Rocks)-आग्नेय चट्टानों का वर्गीकरण निम्नलिखित आधार पर किया जाता है
- स्थिति के आधार पर
- रासायनिक संरचना के आधार पर
I. स्थिति के आधार पर-स्थिति के आधार पर आग्नेय चट्टानों का वर्गीकरण इस प्रकार है-
1. बाह्य या बहिर्वेधी आग्नेय चट्टानें (Extrusive Ieneous Rocks) जब भू-गर्भ का तप्त एवं गरम मैग्मा धरातल पर आकर ठण्डा होता है तो बाह्य आग्नेय चट्टानों का निर्माण होता है। इन चट्टानों का प्रमुख उदाहरण बेसाल्ट है। प्रायद्वीपीय भारत के उत्तर:पश्चिमी क्षेत्र में इस प्रकार की चट्टानें पाई जाती हैं।
2. आन्तरिक या अन्तर्वेधी आग्नेय चट्टानें (Intrusive Igneous Rocks)-ज्वालामुखी उद्गार के समय जब भू-गर्भ का मैग्मा पृथ्वी के तल के नीचे दरारों में जम जाता है तो आन्तरिक आग्नेय चट्टानों का निर्माण होता है। भू-गर्भ में मैग्मा का जमाव दो विभिन्न स्थितियों में होता है, इसलिए इन्हें निम्नलिखित दो उपवर्गों में बाँटा जा सकता है
(i) पातालीय चट्टानें (Plutonic Rocks)-भू-गर्भ में अत्यधिक गहराई पर मैग्मा के जमाव द्वारा बनी चट्टानों को पातालीय चट्टानें कहते हैं। यहाँ मैग्मा के ठण्डा होने में पर्याप्त समय लगता है, इसलिए इनके रवे बड़े होते हैं। ग्रेनाइट तथा गेब्रो (Gabro) इनके प्रमुख उदाहरण हैं। ये आन्तरिक आग्नेय चट्टानों के बड़े-बड़े पिण्ड होते हैं, इन्हें बैथोलिथ कहते हैं। भारत में छोटा नागपुर के पठार, मध्य प्रदेश तथा राजस्थान में इसी प्रकार की चट्टानें पाई जाती हैं।
(ii) मध्यवर्ती चट्टानें (Hypabyssal Rocks)-जब भू-गर्भ का मैग्मा धरातल के ऊपर नहीं आ पाता और भू-गर्भ की चट्टानों हो जाता है तो उन्हें मध्यवर्ती आग्नेय चट्टानें कहते हैं। यदि लावे का जमाव लम्बवत् रूप में होता है तो उन्हें डाइक कहते हैं और यदि क्षैतिज रूप में हो तो उन्हें सिल कहते हैं।
II. रासायनिक संरचना के आधार पर रासायनिक संरचना के आधार पर आग्नेय चट्टानों को निम्नलिखित दो भागों में बाँटा जा सकता है
1. अम्लीय आग्नेय चट्टानें (Acid Igneous Rocks)-इनमें सिलिका की मात्रा 65% से अधिक होती है। इसके अतिरिक्त इन चट्टानों में सोडियम, पोटाशियम तथा एल्यूमीनियम आदि महत्त्वपूर्ण रासायनिक तत्त्व होते हैं। ग्रेनाइट, क्वार्ट्ज़ाइट, पेग्मैटाइट तथा राओलाइट इस प्रकार की चट्टानों के प्रमुख उदाहरण हैं।
2. क्षारीय आग्नेय चट्टानें (Basic Igneous Rocks) इनमें सिलिका की मात्रा 40% से 55% तक होती है। बेसाल्ट, गेब्रो तथा डोलेराइट इस प्रकार की चट्टानों के प्रमुख उदाहरण हैं।
प्रश्न 2.
आग्नेय चट्टानी पिण्डों से आपका क्या तात्पर्य है? विभिन्न आग्नेय चट्टानी पिण्डों का वर्णन करें।
उत्तर:
आग्नेय चट्टानी पिण्ड का अर्थ (Meaning of Masses of Igneous Rocks)-मैग्मा के ठोसावस्था में आने पर अनेक तरह के चट्टानी पिण्डों की रचना होती है। इनका नामकरण इनके रूप, आकार, स्थिति तथा आस-पास पाई जाने वाली चट्टानों के आधार पर किया जाता है। अधिकांश चट्टानी पिण्ड अन्तर्वेधी आग्नेय चट्टानों से बने हुए हैं।
आग्नेय चट्टानी पिण्डों के प्रकार (Types of Masses of lgneous Rocks)-आग्नेय चट्टानी पिण्डों के प्रकार निम्नलिखित हैं-
1. बैथोलिथ (Batholith) यह मैग्मा का सबसे बड़ा गुम्बदाकार जमाव है जो अत्यधिक गहराई में पाया जाता है। हज़ारों वर्ग कि०मी० क्षेत्र में विस्तृत इस पिण्ड का ऊपरी तल ऊबड़-खाबड़ तथा ढाल खड़ा होता है। इसकी मोटाई इतनी अधिक होती है कि इसके आधार पर पहुँच पाना कठिन होता है। अनाच्छादन के बाद इसका केवल ऊपरी भाग ही देखा जा सकता है। बैथोलिथ की जड में होते हैं। संयुक्त राज्य अमेरिका के इडाहो (Idaho) राज्य में 40 हजार वर्ग कि०मी० से भी ज्यादा क्षेत्र में फैला बैथोलिथ तथा पश्चिमी कनाडा में कोस्ट रेन्ज बैथोलिथ इसके प्रमुख उदाहरण हैं। बैथोलिथ मूलतः ग्रेनाइट चट्टानों के जमाव होते हैं।
2. स्टॉक (Stock)-छोटे आकार के बैथोलिथ को स्टॉक कहते हैं। स्टॉक की ऊपरी सतह का विस्तार 100 वर्ग कि०मी० से कम क्षेत्र में होता है। यह खड़ी अवस्था में होता है जिसका ऊपरी भाग अधिक विषम किन्तु गोलाकार होता है। इसकी अन्य विशेषताएँ बैथोलिथ जैसी होती हैं।
3. लैकोलिथ (Lacolith) भू-गर्भ से धरातल की ओर बढ़ता हुआ विस्फोटक मैग्मा जब किन्हीं कारणों से धरातल पर नहीं पहुँच पाता तो वह परतदार चट्टानों में छतरीनुमा रूप धारण कर लेता है। लैकोलिथ की निचली परत सीधी होती है जो नली के द्वारा मैग्मा भण्डार से जुड़ी होती है। लैकोलिथ बहिर्वेधी ज्वालामुखी पर्वत का अन्तर्वेधी प्रतिरूप है। उत्तरी अमेरिका के पश्चिमी भाग में अनेक लैकोलिथ देखने को मिलते हैं।
4. लैपोलिथ (Lapolith)-जब मैग्मा का जमाव धरातल के नीचे किसी अवतल आकार वाले उथले बेसिन में हो जाता है तब एक तश्तरीनुमा चट्टानी पिण्ड का निर्माण होता है, जिसे लैपोलिथ कहते हैं। इसका उदाहरण दक्षिण अफ्रीका के ट्रांसवाल क्षेत्र में मिलता है।
5. फैकोलिथ (Phacolith) मोड़दार पर्वतों की अपनति (Anticline) व अभिनति (Syncline) में मैग्मा के जमाव को फैकोलिथ कहते हैं। यह लहरदार आकृति का होता है।
6. सिल (Sill)-परतदार चट्टानों के बीच भू-पृष्ठ के समानान्तर मैग्मा से बनी अधिवितलीय चट्टान को सिल कहते हैं। इसकी मोटाई सैकड़ों मीटर तक होती है किन्तु एक मीटर से पतली सिल को शीट (Sheet) कहा जाता है।
7. डाइक (Dike or Dyke)-जब भू-तल के नीचे मैग्मा लम्बवत् जोड़ों या दरारों में जमता है तो डाइक कहलाता है। कठोर होने के कारण इस पर अपरदन का कम प्रभाव पड़ता है। आस-पास की चट्टानों के अपरदन द्वारा नष्ट होने पर डाइक एक खड़ी या झुकी विशाल दीवार की भान्ति दिखाई पड़ते हैं। डाइक कुछ मीटर से कई कि०मी० तक लम्बे व कुछ सेंटीमीटर से कई मीटर तक चौड़े होते हैं। झारखण्ड के सिंहभूम जिले में डोलेराइट के अनेक डाइक देखने को मिलते हैं।
उपर्युक्त अन्तर्वेधी आग्नेय चट्टानी पिण्डों के अतिरिक्त अनेक बहिर्वेधी आग्नेय चट्टानी पिण्ड भी पाए जाते हैं। इनसे महाद्वीपों और महासागरों की तली पर ज्वालामुखी पर्वतों और ज्वालामुखी पठारों का निर्माण होता है।
प्रश्न 3.
परतदार अथवा अवसादी चट्टानें किसे कहते हैं? इनका वर्गीकरण कीजिए।
अथवा
तलछटी चट्टानों या शैलों का वर्गीकरण करते हुए इसकी मुख्य किस्मों का विस्तारपूर्वक वर्णन कीजिए।
उत्तर:
अवसादी (परतदार) चट्टानों का अर्थ एवं परिभाषा (Meaning and Definition of Sedimentary Rocks) अपक्षय तथा अपरदन के विभिन्न साधनों द्वारा प्राप्त बड़ी मात्रा में अवसाद के जमने से बनी हुई चट्टानों को परतदार अथवा अवसादी चट्टानें अवसाद के परतों में जमने के कारण होता है। भूतल पर लगभग 75% चट्टानें अवसादी चट्टानें हैं। पी०जी० वॉरसेस्टर के अनुसार, “अवसादी शैल, धरातलीय चट्टानों के टूटे मलबे तथा खनिज एक स्थान से दूसरे स्थान पर एकत्रित होते रहते हैं जो धीरे-धीरे एक परत का रूप धारण कर लेते हैं।”
अवसादी चट्टानों का वर्गीकरण (Classification of Sedimentary Rocks)-अवसादी चट्टानों की निर्माण-विधि तथा संरचना के आधार पर इन्हें अग्रलिखित दो वर्गों में विभाजित किया जा सकता है
- जैव अवसादी चट्टानें (Organic Sedimentary Rocks)
- अजैव अवसादी चट्टानें (Inorganic Sedimentary Rocks)
I. जैव अवसादी चट्टानें (Crganic Sedimentary Racks)-जिन चट्टानों का निर्माण विभिन्न जीव-जन्तुओं या वनस्पति के जमाव द्वारा होता है, उन्हें जैव अवसादी चट्टानें कहते हैं। ये चट्टानें निम्नलिखित प्रकार की होती हैं-
(1) चूना प्रधान अवसादी चट्टानें (Calcareous Sedimentary Rocks) महासागरीय तथा सागरीय जल में विभिन्न प्रकार के जीव-जन्तु रहते हैं। इन जीव-जन्तुओं की मृत्यु के पश्चात् इनके अवशेष समुद्र की तलहटी में जमा होते रहते हैं जिनसे चूना प्रधान अवसादी चट्टानों का निर्माण होता है। चूना पत्थर, खड़िया, डालोमाइट तथा सेलखड़ी इनके प्रमुख उदाहरण हैं। प्रवाल भित्तियों या प्रवाल द्वीपों का निर्माण चूना-युक्त चट्टानों से होता है।
(2) कार्बनयुक्त अवसादी चट्टानें (Carbonaceous Sedimentary Rocks) इस प्रकार की चट्टानों का निर्माण जीव-जन्तुओं तथा प्राकृतिक वनस्पति द्वारा होता है। पृथ्वी में उथल-पुथल के कारण जीव-जन्तु तथा प्राकृतिक वनस्पति भू-तल के नीचे दब जाती है। भू-गर्भ के तापमान तथा ऊपरी चट्टानों के दबाव के कारण इन जीव-जन्तुओं और वनस्पतियों के अंश कालान्तर में कोयले के रूप में बदल जाते हैं जिसमें कार्बन की प्रधानता होती है। कार्बन की मात्रा के अनुसार पीट, लिग्नाइट, बिटुमिनस तथा एन्थ्रासाइट कोयले का निर्माण होता है।
(3) रासायनिक प्रक्रिया द्वारा बनी अवसादी चट्टानें (Chemically formed Sedimentory Rocks)-खारी झीलों या समुद्रों का पानी जलवाष्प बनकर उड़ जाता है तथा अवसाद नीचे रह जाते हैं जिससं अवसादी चट्टानें बनती हैं। रासायनिक प्रक्रिया द्वारा बनी चट्टानों के प्रमुख उदाहरण सेंधा नमक, जिप्सम तथा शोरा हैं।
II. अजैव अवसादी चट्टानें (Inorganic Sedimentary Rocks)-अपक्षय तथा अपरदन की क्रियाओं द्वारा चट्टानें टूटती-फूटती रहती हैं तथा उनका मलबा जमा होता रहता है। अजैव अवसादी चट्टानों को निम्नलिखित प्रकार से वर्गीकृत किया जा सकता है
- प्रधान अवसादी चट्टानें (Arenaceous Sedimentary Rocks)-इन चट्टानों का निर्माण बालू के कणों के संगठन से होता है। बलुआ पत्थर इनका प्रमुख उदाहरण है।
- चीका प्रधान अवसादी चट्टानें (Argillaceous Sedimentary Rocks)-इनका निर्माण चिकनी मिट्टी तथा दलदल के कठोर होने के कारण होता है।
![]()
प्रश्न 4.
अवसादी या परतदार चट्टानों की विशेषताओं तथा आर्थिक महत्त्व का वर्णन कीजिए।
उत्तर:
अवसादी चट्टानों की विशेषताएँ (Characterstics of Sedimentary Rocks) अवसादी चट्टानों की विशेषताएँ। निम्नलिखित हैं
- आग्नेय चट्टानों की तुलना में ये चट्टानें कोमल अथवा नरम होतो हैं।
- ये चट्टानें परतों के रूप में पाई जाती हैं।
- ये चट्टानें छिद्रमय होती हैं। बलुई चट्टानें अधिक छिद्रमय तथा चीका-युक्त चट्टानें कम छिद्रमय होती हैं।
- इन चट्टानों में जीव-जन्तुओं एवं वनस्पति के अवशेष पाए जाते हैं।
- ये चट्टानें रवे-रहित होती हैं।
- ये चट्टानें प्रवेश्य चट्टानें हैं।
अवसादी चट्टानों का आर्थिक महत्त्व (Economical Significance of Sedimentary Rocks)-अवसादी चट्टानों का महत्त्व निम्नलिखित कारकों पर आधारित है
- अवसादी चट्टानें उपजाऊ मिट्टी का अभूतपूर्व भण्डार हैं। उदाहरण के लिए, सतलुज, गंगा एवं ब्रह्मपुत्र के मैदान की उपजाऊ मिट्टी अवसादी चट्टानों की ही देन हैं।
- इन चट्टानों में शक्ति के प्रमुख स्रोत; जैसे कोयला तथा पेट्रोलियम मिलते हैं। उदाहरण के लिए, महानदी, कृष्णा तथा कावेरी नदियों के डेल्टाई क्षेत्रों में कोयले के भण्डार हैं तथा सम्पूर्ण उत्तरी भारत की अवसादी चट्टानों में खनिज तेल के भण्डार मिलने की सम्भावनाएँ हैं।
- उष्ण कटिबन्धीय क्षेत्रों में अवसादी चट्टानों के अपक्षय से बॉक्साइट, मैंगनीज, टिन आदि खनिजों के गौण अयस्क मिलते हैं।
- अवसादी चट्टानों में लौह-अयस्क, फास्फेट, इमारती पत्थर, कोयला तथा सीमेण्ट बनाने वाले पदार्थों के स्रोत मिलते हैं।
- इन चट्टानों में विभिन्न प्रकार के खनिज पदार्थ पाए जाते हैं।
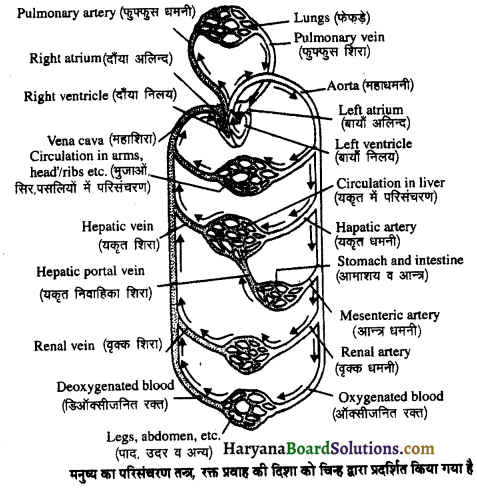
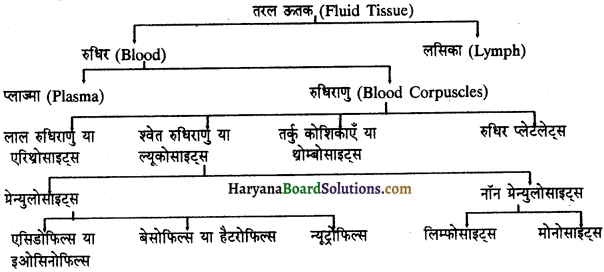
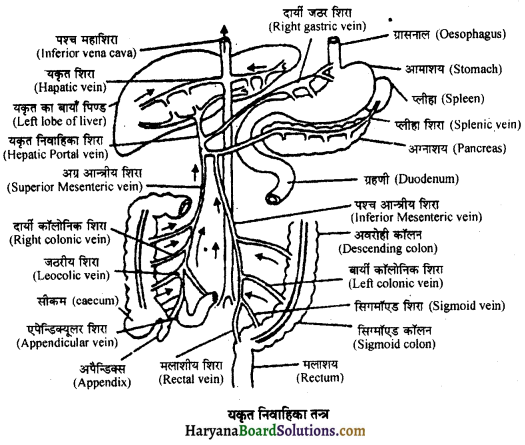
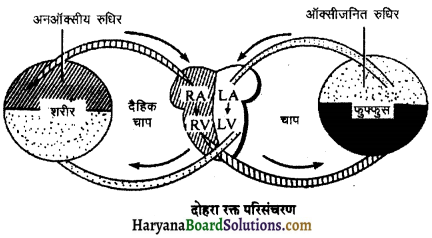
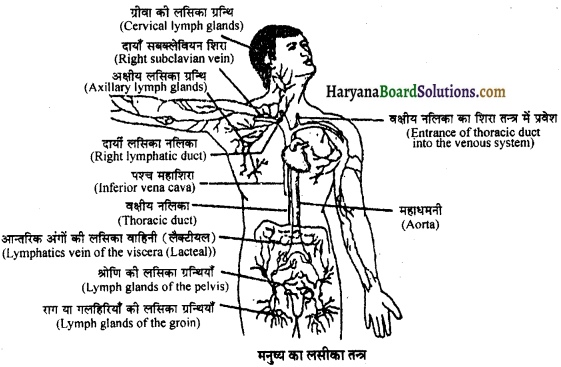
Read More:
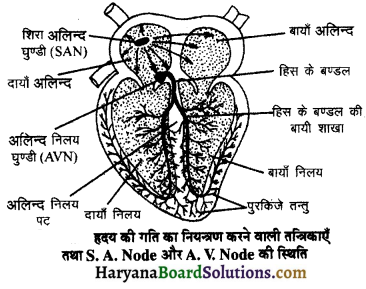
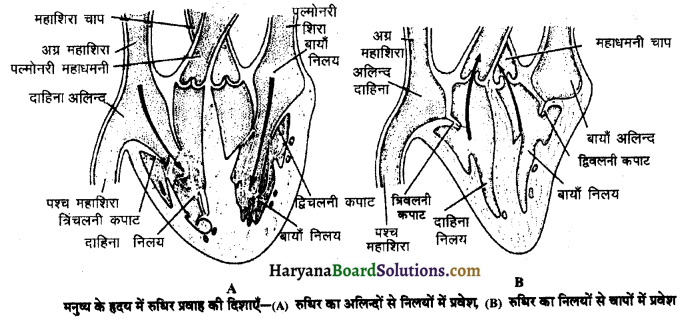
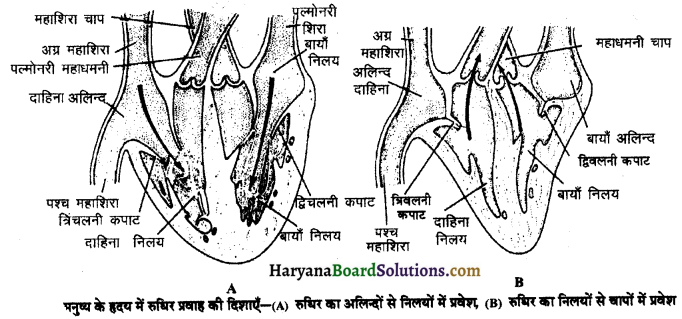 (2) अलिन्दों का प्रफुंचन (Atrial Systole)-जैसे ही अलिन्दों का अनुशिथिलन समाप्त होता है दोनों अलिन्द एक साथ संकुचित होते हैं। यह अवस्था निल़य प्रकुंचन कहलाती है जो लगभग 0.1 सेकण्ड तक रहती है। इस संकुचन के फलस्वरूप लगभग 25% ही रुधिर जो अलिन्दों में बचा रहता है, निलयों में आता है। इस प्रकार दोनों निलय रुधिर से पूर्णतया भर जाते हैं।
(2) अलिन्दों का प्रफुंचन (Atrial Systole)-जैसे ही अलिन्दों का अनुशिथिलन समाप्त होता है दोनों अलिन्द एक साथ संकुचित होते हैं। यह अवस्था निल़य प्रकुंचन कहलाती है जो लगभग 0.1 सेकण्ड तक रहती है। इस संकुचन के फलस्वरूप लगभग 25% ही रुधिर जो अलिन्दों में बचा रहता है, निलयों में आता है। इस प्रकार दोनों निलय रुधिर से पूर्णतया भर जाते हैं।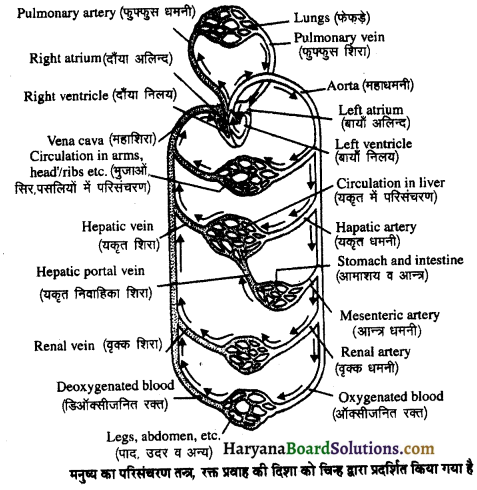


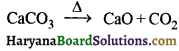
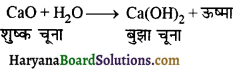
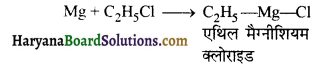


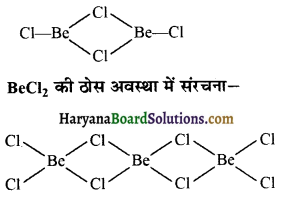




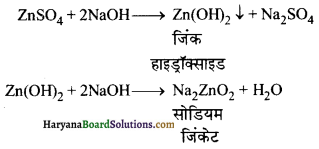
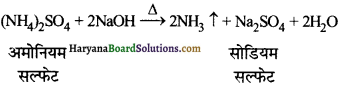













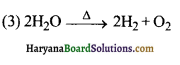
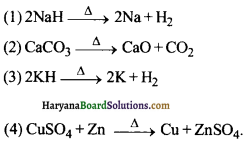

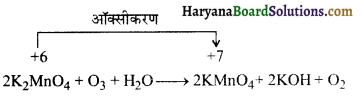
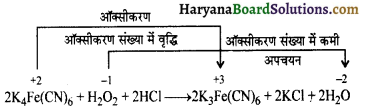


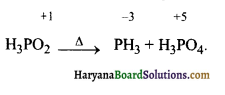




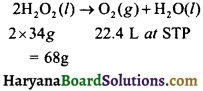



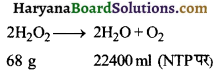

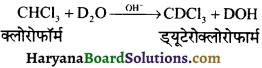

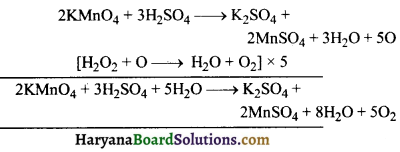
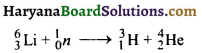



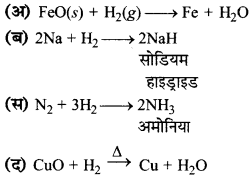
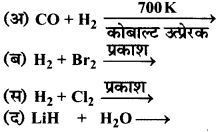
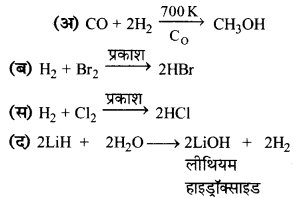

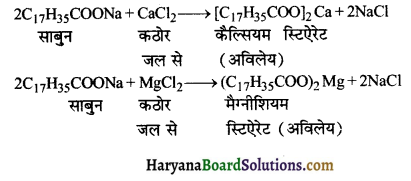

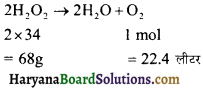

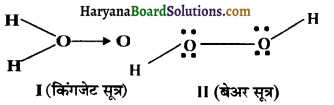
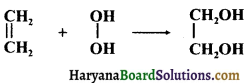
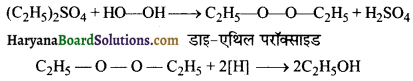

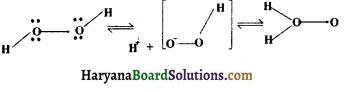
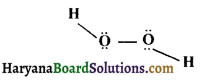

























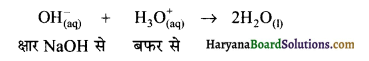
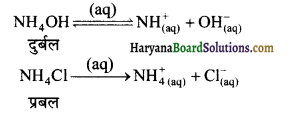

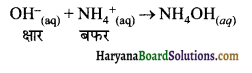
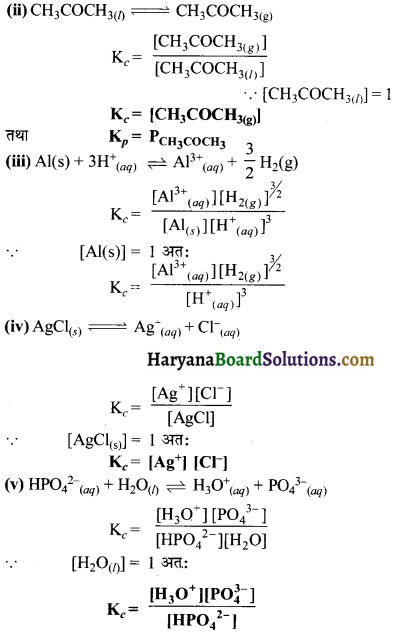

























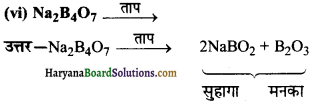

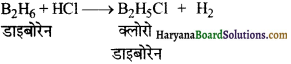
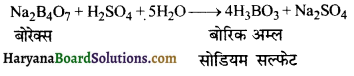
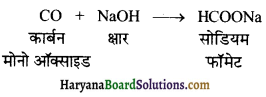
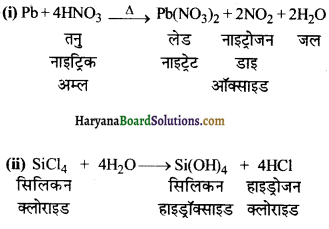
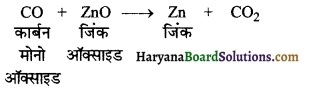
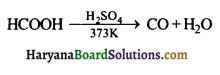


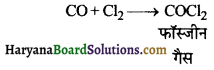

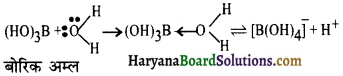


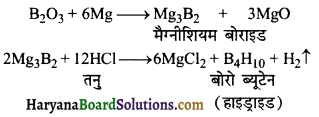


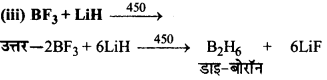

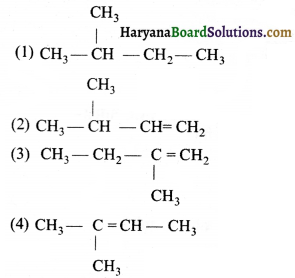
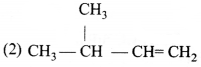
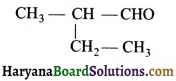
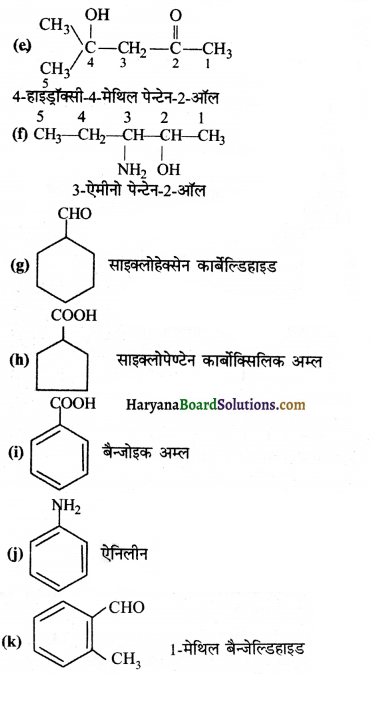
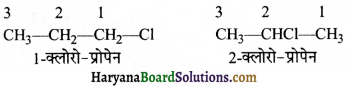
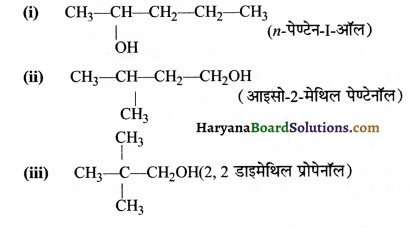
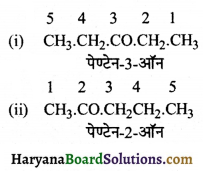
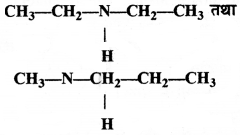
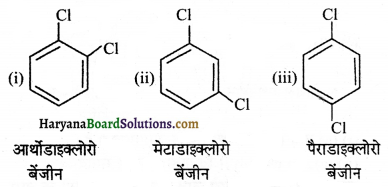
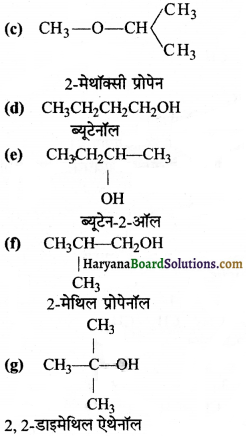
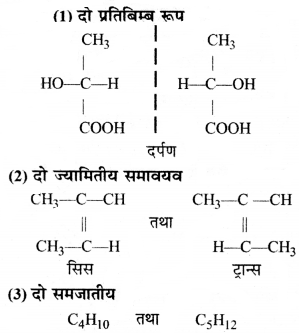
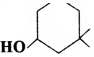 का I.U.P.A.C नाम है-
का I.U.P.A.C नाम है-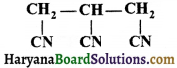
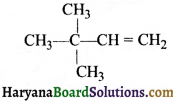
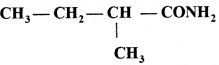 का I.U.P.A.C नाम है-
का I.U.P.A.C नाम है-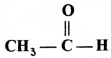 का I.U.P.A.C नाम है-
का I.U.P.A.C नाम है-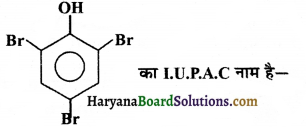
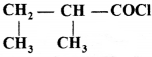 का I.U.P.A.C नाम है-
का I.U.P.A.C नाम है-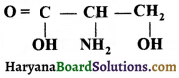
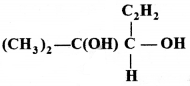 का I.U.P.A.C का नाम है-
का I.U.P.A.C का नाम है-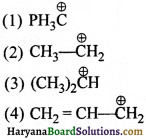
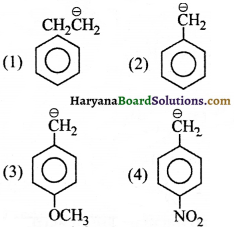
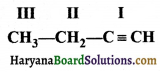
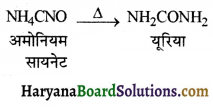
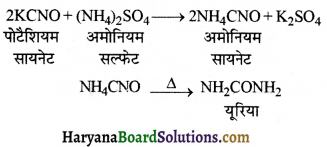
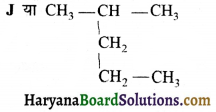
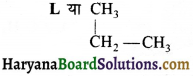
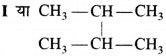
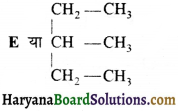
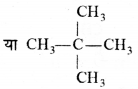
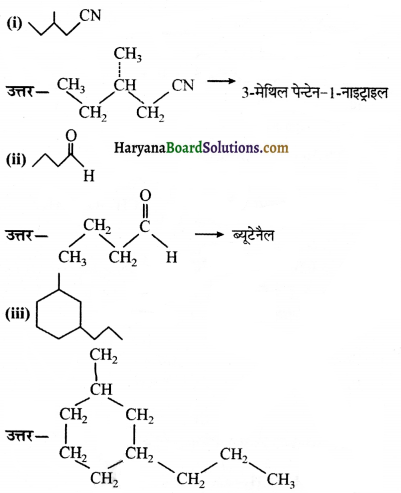

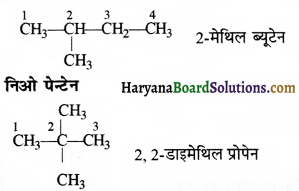
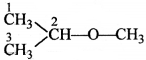
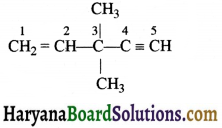
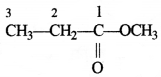
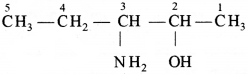
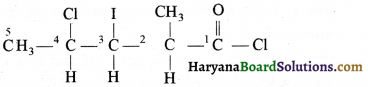
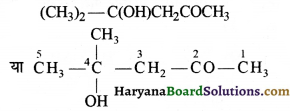

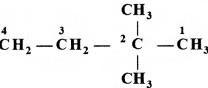
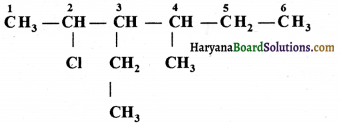
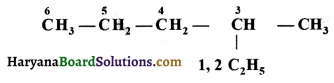
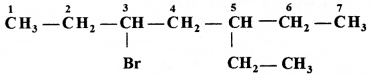
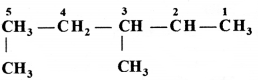
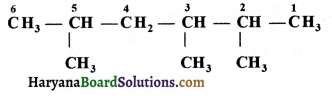
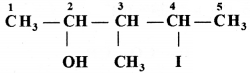
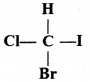
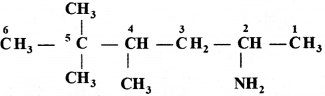
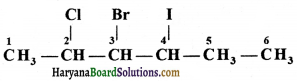
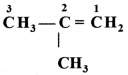
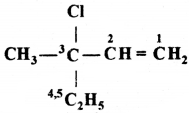
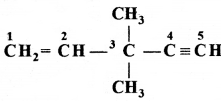
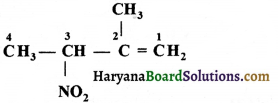
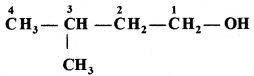
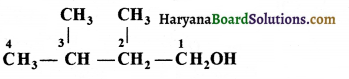
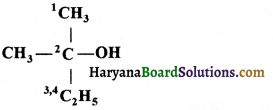
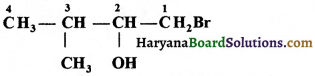
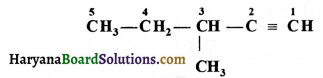
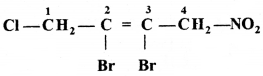
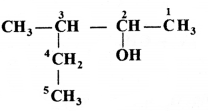
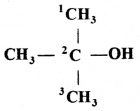
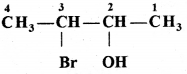
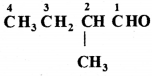
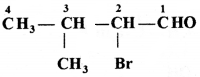
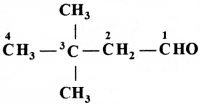
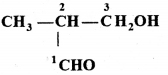
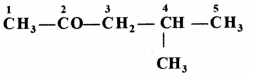
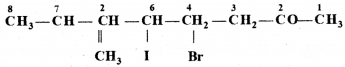
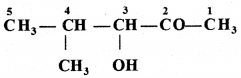
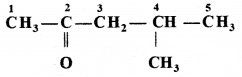
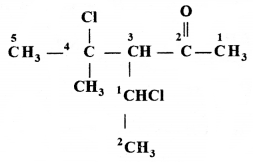
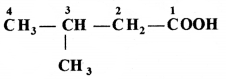
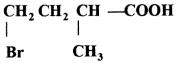
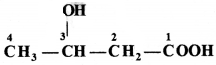
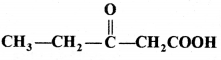
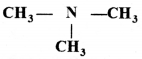
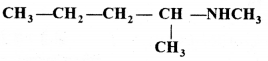
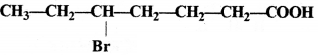
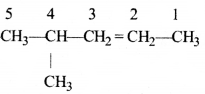
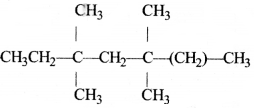
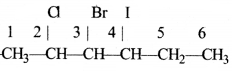

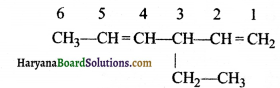
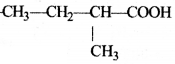
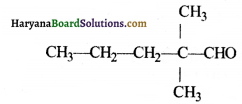
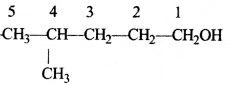
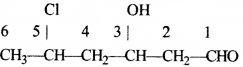
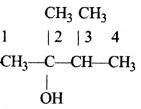
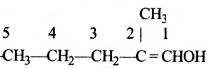
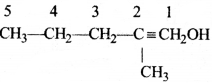
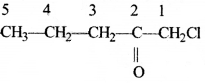
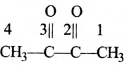
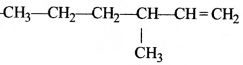
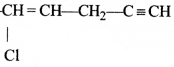
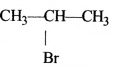
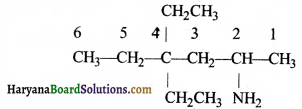

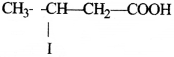
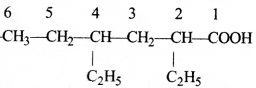
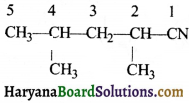
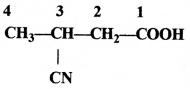

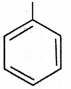

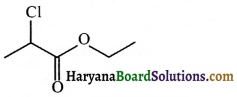
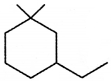
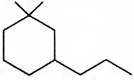
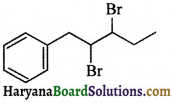
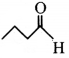
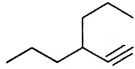
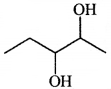
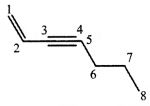
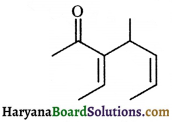
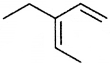
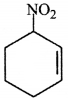
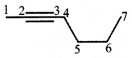
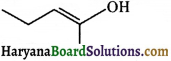
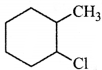
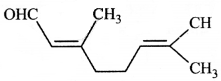
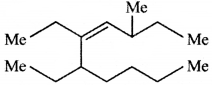
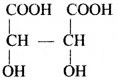
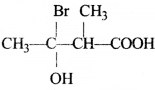
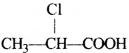
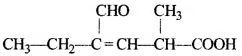
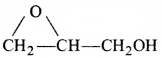

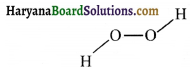
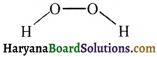
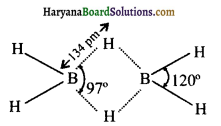
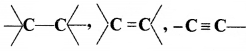 की बन्ध लम्बाई बताइए।
की बन्ध लम्बाई बताइए।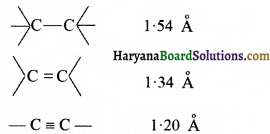
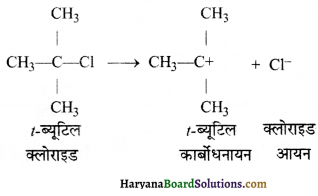

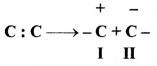





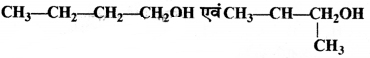
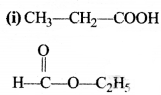
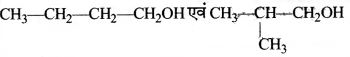
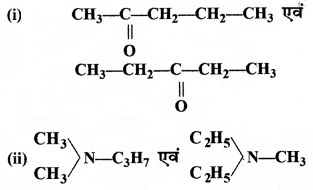
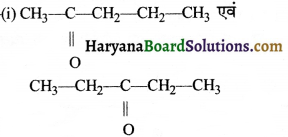

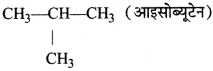



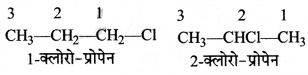







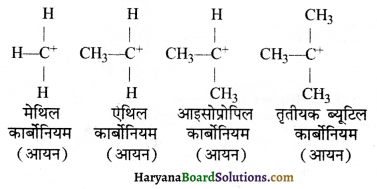
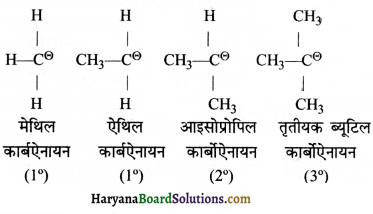
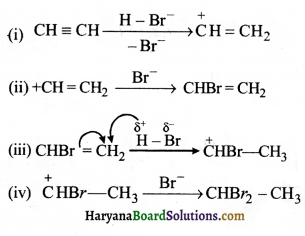
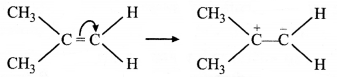
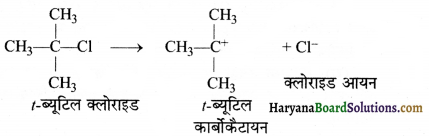
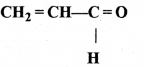
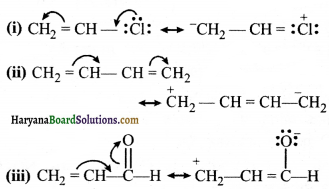
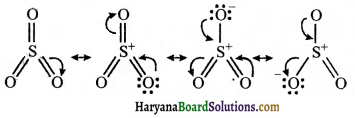









 = \(\frac { 73 }{ 73 }\) = 1
= \(\frac { 73 }{ 73 }\) = 1