Haryana State Board HBSE 11th Class Chemistry Important Questions Chapter 2 परमाणु की संरचना Important Questions and Answers.
Haryana Board 11th Class Chemistry Important Questions Chapter 2 परमाणु की संरचना
बहुविकल्पीय प्रश्न
1. परमाणु भार का आधुनिक आधार क्या है –
(1) O16 = 16.000
(2) C12 = 12.000
(3) साधारण O = 16.000
(4) H1 = 1.000.
उत्तर:
(2) C12 = 12.000
2. हाइड्रोजन परमाणु के आयनन से प्राप्त होगा-
(1) हाइड्राइड आयन
(2) हाइड्रोनियम आयन
(3) प्रोटॉन
(4) हाइड्रॉक्सिल आयन।
उत्तर:
(3) प्रोटॉन
3. न्यूट्रॉन की खोज में कठिनाई का कारण था-
(1) इसका आवेश रहित होना।
(2) इसका आवेश कम होना।
(3) इसका द्रव्यमान नगण्य होना।
(4) इसके आवेश तथा द्रव्यमान का अनुपात नगण्य होना।
उत्तर:
(1) इसका आवेश रहित होना।
4. जब एक इलेक्ट्रॉन L कोश से K कोश में कूदता है-
(1) ऊर्जा अवशोषित होती है।
(2) ऊर्जा निकलती है।
(3) ऊर्जा न तो अवशोषित होती है और न ही निकलती है।
(4) कभी ऊर्जा अवशोषित होती है तथा कभी निकलती है।
उत्तर:
(2) ऊर्जा निकलती है।
5. धनात्मक किरणों में e/m का मान सबसे अधिक किस गैस को लेने पर होगा-
(1) H2
(2) He
(3) N2
(4) O2
उत्तर:
(1) H2
6. α-कण का e/m… होता है प्रोटॉन के e/m का-
(1) दोगुना
(2) तीन गुना
(3) चार गुना
(4) बराबर।
उत्तर:
(1) दोगुना
7. 1 amu का मान होता है-
(1) 937 Mev
(2) 9310 MeV
(3) 931 Mev
(4) 127 MeV.
उत्तर:
(3) 931 Mev
8. सबसे हल्के नाभिक की तुलना में इलेक्ट्रॉन का द्रव्यमान होता है, लगभग-
(1) \(\frac { 1 }{ 80 }\)
(2) \(\frac { 1 }{ 800 }\)
(3) \(\frac { 1 }{ 1800 }\)
(4) \(\frac { 1 }{ 2800 }\)
उत्तर:
(3) \(\frac { 1 }{ 1800 }\)
![]()
9. निम्न में से उच्चतम तरंगदैर्ध्य वाली वैद्युत चुम्बकीय किरणें हैं-
(1) X – तरंगें
(2) अवरक्त तरंगें
(3) रेडियो तरंगें
(4) पराबैंगनी तरंगें।
उत्तर:
(3) रेडियो तरंगें
10. 4000 Å तरंगदैर्ध्य की किरणों तथा 2000 Å तरंगदैर्ध्य वाली किरणों के फोटॉनों की ऊर्जा का अनुपात है-
(1) \(\frac { 1 }{ 2 }\)
(2) \(\frac { 1 }{ 4 }\)
(3) 2
(4) 4
उत्तर:
(3) 2
11. न्यूट्रॉन के द्रव्यमान की कोटि है-
(1) 10-23 किग्रा.
(2) 10-24 किग्रा.
(3) 10-26 किग्रा.
(4) 10-27 किग्रा.
उत्तर:
(4) 10-27 किग्रा.
12. परमाणु नाभिक की त्रिज्या की कोटि है-
(1) 10-12 सेमी.
(2) 10-8 सेमी.
(3) 10-10 सेमी.
(4) 10-7 सेमी.
उत्तर:
(2) 10-8 सेमी.
13. रदरफोर्ड ने कणों के प्रकीर्णन प्रयोग में प्रथम बार दर्शाया कि परमाणु में होता है-
(1) इलेक्ट्रॉन
(2) प्रोटॉन
(3) नाभिक
(4) न्यूट्रॉन।
उत्तर:
(3) नाभिक
14. हाइड्रोजन स्पेक्ट्रम की कौन-सी श्रेणी दृश्य क्षेत्र में होगी-
(1) फुण्ड
(2) लाइमन
(3) बामर
(4) ब्रेकेट
उत्तर:
(3) बामर
15. न्यूनतम डी-ब्रॉग्ली तरंगदैर्ध्य सम्बन्धित है-
(1) इलेक्ट्रॉन से
(2) प्रोटॉन से
(3) CO2 अणु से
(4) SO2 अणु से।
उत्तर:
(4) SO2 अणु से।
16. हुण्ड के नियमानुसार किस तत्व में 6 अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं?
(1) Fe
(2) Co
(3) Ni
(4) Cr
उत्तर:
(4) Cr
17. 2p तथा 3p कक्षकों में अन्तर होता है-
(1) 7 के मान में
(2) के मान में
(3) आकृति में
(4) आकार में।
उत्तर:
(4) आकार में।
18. किसी कक्ष में कक्षकों की संख्या होती है-
(1) N²
(2) 2²
(3) 2l + 1
(4) 2 (2n + l).
उत्तर:
(1) N²
19. यदि l = 3 हो, तो m के कुल मानों की संख्या होगी-
(1) 2
(2) 3
(3) 5
(4) 7
उत्तर:
(4) 7
20. सन् 1932 में पॉजिट्रॉन की खोज की-
(1) चैडविक ने
(2) रदरफोर्ड ने
(3) सी. डी. एन्डरसन ने
(4) इनमें से कोई नहीं।
उत्तर:
(3) सी. डी. एन्डरसन ने
21. उत्सर्जित एवं अवशोषित ऊर्जा के मान को कहते हैं-
(1) गतिज ऊर्जा
(2) क्वाण्टा
(3) मुक्त ऊर्जा
(4) इनमें से कोई नहीं।
उत्तर:
(2) क्वाण्टा
22. ψ किसको प्रदर्शित करता है-
(1) तरंग फलन
(2) इलेक्ट्रॉन का द्रव्यमान
(3) तरंगदैर्ध्य
(4) आवृत्ति।
उत्तर:
(1) तरंग फलन
23. चार क्वाण्टम संख्याओं क्रमश: n, l, m तथा s के मानों के चार समूह दिये जा रहे हैं, कौन सा समूह गलत है-
(1) n = 2, 1 = 0, m = +1, s = \(\frac { 1 }{ 2 }\)
(2) n = 2, 1 = 1, m = – 1, s = + \(\frac { 1 }{ 2 }\)
(3) n = 3, 1 = 2, m = 0, s = – \(\frac { 1 }{ 2 }\)
(4) n = 3, 1 = 1, m = – 1, s = + \(\frac { 1 }{ 2 }\)
उत्तर:
(1) n = 2, 1 = 0, m = +1, s = \(\frac { 1 }{ 2 }\)
24. हाइड्रोजन परमाणु के निम्नलिखित में से कौन-से इलेक्ट्रॉनीय तल में फोटॉन का अवशोषण होगा न कि उत्सर्जन-
(1) 2s
(2) 2p
(3) 3s
(4) 1s
उत्तर:
(4) 1s
25. यदि बोर के प्रथम कक्ष की त्रिज्या r1 हो और तीसरे कक्ष की त्रिज्या r2 हो तो r1/r2 का मान है-
(1) 3
(2) 1/3
(3) 1/9
(4) 9
उत्तर:
(3) 1/9
26. हाइड्रोजन परमाणु He+ आयन तथा Li2+ आयन के क्रमश: प्रथम, द्वितीय तथा तृतीय बोर कक्षाओं की त्रिज्या का अनुपात है-
(1) 4 : 3 : 2
(2) 4 : 2 : 3
(3) 2 : 3 : 4
(4) 2 : 4 : 3
उत्तर:
(2) 4 : 2 : 3
![]()
27. हाइड्रोजन परमाणु तथा He+ आयन की प्रथम बोर कक्षाओं में इलेक्ट्रॉन के वेग का अनुपात है-
(1) 1 : 2
(2) 2 : 1
(3) 1 : 3
(4) 3 : 1
उत्तर:
(1) 1 : 2
28. किसी इलेक्ट्रॉन की ऊर्जा अधिकतम होती है-
(1) नाभिक पर
(2) आद्य अवस्था में
(3) प्रथम उत्तेजित अवस्था में
(4) नाभिक में अनन्त दूरी पर।
उत्तर:
(3) प्रथम उत्तेजित अवस्था में
29. निम्न में से कौन-सा कथन असत्य है-
(1) तरंगदैर्ध्य तरंग कण के संवेग के व्युत्क्रमानुपाती होता है
(2) परमाणु के कक्षक ऊर्जा के बढ़ते क्रम में भरते हैं।
(3) (n + l) नियम हुण्ड के नियम का ही एक भाग है।
(4) (n + l) नियम कक्षकों की ऊर्जा के बढ़ते क्रम को निर्धारित करता है।
उत्तर:
(1) तरंगदैर्ध्य तरंग कण के संवेग के व्युत्क्रमानुपाती होता है
30. क्वाण्टम संख्याओं के निम्न में से किस सेट के लिये इलेक्ट्रॉन की ऊर्जा अधिकतम होगी-
(1) 3, 2, +1, + \(\frac { 1 }{ 2 }\)
(2) 4, 2, -1, + \(\frac { 1 }{ 2 }\)
(3) 4, 1, 0, – \(\frac { 1 }{ 2 }\)
(4) 5, 0, 0, + \(\frac { 1 }{ 2 }\)
उत्तर:
(2) 4, 2, -1, + \(\frac { 1 }{ 2 }\)
31. g – उपकोश के लिये सही है-
(1) n = 5
(2) m = 3
(3) l = 4
(4) l = 5
उत्तर:
(3) l = 4
32. निम्न में से वह स्पीशीज कौन-सी है जो अनुचुम्बकीय नहीं है-
(1) Cl–
(2) Be–
(3) Ne2+
(4) As+
उत्तर:
(1) Cl–
33. परमाणु कक्षकों की ऊर्जा का सही आरोही क्रम है-
(1) 5p < 4f < 6s < 5d
(2) 5p < 6s < 4f < 5d
(3) 4f < 5p < 5d < 6s
(4) 5p < 5d < 4f < 6s.
उत्तर:
(2) 5p < 6s < 4f < 5d
34. समइलेक्ट्रॉनिक स्पीशीज है-
(1) F–, O2-
(2) F–, O+
(3) F–, O–
(4) F–, O2+.
उत्तर:
(1) F–, O2-
35. मुख्य क्वाण्टम = 4 के लिये, 1 = 3 वाले कक्षकों की कुल संख्या है-
(1) 3
(2) 7
(3) 5
(4) 9
उत्तर:
(1) 3
36. किसी एक इलेक्ट्रॉन के संवेग में अनिश्चितता 1 x 10-18 g cm है। उसकी वेग में अनिश्चितता निम्न में से क्या होगी-
(1) 1 × 108 cm s-1
(2) 1 × 1011 cms-1
(3) 1 x 109 cm s-1
(4) 1 × 106 cms-1.
उत्तर:
(3) 1 x 109 cm s-1
37. हीलियम आयन का लाइन स्पेक्ट्रम ………….. के अनुरूप होता है-
(1) हाइड्रोजन परमाणु
(2) Li+ आयन
(3) हीलियम परमाणु
(4) लीथियम परमाणु।
उत्तर:
(1) हाइड्रोजन परमाणु
38. समभ्रंश कक्षकों के किसी सेट में इलेक्ट्रॉन स्वयं को इस प्रकार वितरित करते हैं जिससे कि जहाँ तक सम्भव हो उनका प्रचक्रण बना रहे। यह कथन सम्बन्धित है-
(1) पाउली के अपवर्जन के सिद्धान्त से
(2) ऑफबाऊ के सिद्धान्त से
(3) हुण्ड के नियम से
(4) स्लाटर के नियम से।
उत्तर:
(3) हुण्ड के नियम से
39. निम्न में से कौन इलेक्ट्रॉन प्रायिकता फलन को निरूपित करता है-
(1) 4π drψ²
(2) 4π r² drψ
(3) 4π r² drψ²
(4) 4π drψ
उत्तर:
(3) 4π r² drψ²
40. निम्न में से गलत कथन पहचानिए :
(1) 4f एवं 5f कक्षक समान रूप से परिरक्षित होते हैं।
(2) d-ब्लॉक के तत्व आपस में अनियमित एवं अस्थिर रासायनिक गुणधर्म दर्शाते हैं।
(3) La एवं Lu से आंशिक पूरित d-कक्षक होते हैं और कोई अन्य आंशिक पूरित कक्षक नहीं होते
(4) विभिन्न लेन्थेनॉयडों का रसायन समरूप होता है।
उत्तर:
(1) 4f एवं 5f कक्षक समान रूप से परिरक्षित होते हैं।
41. px ऑर्बिटल में नोडल तलों की संख्या है-
(1) 1
(2) 2
(3) 3
(4) 0
उत्तर:
(1) 1
42. ऑफबाऊ सिद्धान्त का उल्लंघन करने वाले कक्षक का रेखाचित्र है-
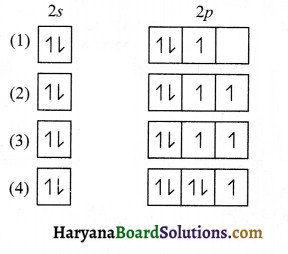
उत्तर:

43. चुम्बकीय क्वाण्टम संख्या बताती है–
(1) कक्षकों का आधार
(2) कक्षकों की आकृति
(3) अन्तरिक्ष में कक्षकों का दिशा विन्यास
(4) कक्षकों का ऊर्जा स्तर।
उत्तर:
(3) अन्तरिक्ष में कक्षकों का दिशा विन्यास
44. समान ऊर्जा वाले कक्षकों में होती है।
(1) समान ऊर्जा
(2) समान कार्य – फलन किन्तु भिन्न ऊर्जा
(3) भिन्न कार्य फलन किन्तु समान ऊर्जा
(4) समान कार्य – फलन।
उत्तर:
(4) समान कार्य – फलन।
45. 3p – कक्षकों में नोडों की संख्या है-
(1) 0
(2) 1
(3) 2
(4) 3.
उत्तर:
(2) 1
46. अपभ्रष्ट कक्षक वे होते हैं जिनमें-
(1) तरंग – फलन समान होते हैं।
(2) द्विक – विन्यास समान होते हैं
(3) ऊर्जा समान होती है
(4) (1) व (2) दोनों।
उत्तर:
(3) ऊर्जा समान होती है
![]()
47. इलेक्ट्रॉन का आवेश 4.8 x 10-10 es. u. होता है। Li3+ आयन पर आवेश की मात्रा है-
(1) 4.8 × 10-10 e.s.u.
(2) 9.6 × 10-10
(3) 1.44 × 10-9 e.s.u.
(4) 2.4 × 10-9 e.s.u.
उत्तर:
(3) 1.44 × 10-9 e.s.u.
48. इलेक्ट्रॉन की ऊर्जा निम्नतम होगी-
(1) निम्नतम कक्षा में
(2) उच्च कक्षाओं में
(3) मध्य कक्षाओं में
(4) तृतीय कक्षा में।
उत्तर:
(1) निम्नतम कक्षा में
49. कैथोड किरणों के सम्बन्ध में असत्य कथन है-
(1) ये किरणें ऊष्मीय प्रभाव उत्पन्न करती हैं
(2) ये ऋणावेशित होती हैं
(3) उच्च द्रव्यमान वाले तत्वों से टकराकर X – किरणें उत्पन्न करती हैं
(4) इनमें से कोई नहीं।
उत्तर:
(4) इनमें से कोई नहीं।
50. रदरफोर्ड के α-कणों के प्रकीर्णन सिद्धान्त से निष्कर्ष निकलता है कि-
(1) ऊर्जा तथा द्रव्यमान सम्बन्धित होते हैं
(2) नाभिक के अन्दर परमाणु का द्रव्यमान तथा आवेश रहता है।
(3) नाभिक में न्यूट्रॉन उपस्थित होते हैं।
(4) इनमें से कोई नहीं।
उत्तर:
(2) नाभिक के अन्दर परमाणु का द्रव्यमान तथा आवेश रहता है।
अति लघु उत्तरीय प्रश्न
प्रश्न 1.
एल्फा कण क्या है?
उत्तर:
एल्फा कण द्विधन आवेशित हीलियम का नाभिक है।
प्रश्न 2.
एक मोल इलेक्ट्रॉन का द्रव्यमान क्या है?
उत्तर:
6.023 x 1023 x 9.108 × 10-28 ग्राम।
प्रश्न 3.
नाभिक की खोज किसने की थी?
उत्तर:
रदरफोर्ड ने।
प्रश्न 4.
ऐनोड किरणों की प्रकृति किस पर निर्भर करती है?
उत्तर:
विसर्जन नली में भरी हुई गैस पर।
प्रश्न 5.
बोर का परमाणु मॉडल किस सिद्धान्त पर आधारित है?
उत्तर:
प्लांक के क्वाण्टम सिद्धान्त पर आधारित है।
प्रश्न 6.
बोर की गोलाकार कक्षाओं को क्या कहते हैं?
उत्तर:
ऊर्जा स्तर।
प्रश्न 7.
बोर की कक्षा को स्थाई कक्ष क्यों कहते हैं?
उत्तर:
क्योंकि स्थाई कक्षा में घूमते समय इलेक्ट्रॉन चुम्बकीय विकिरण के द्वारा ऊर्जा का ह्रास नहीं होता है।
प्रश्न 8.
इलेक्ट्रॉन का अधिकतम वेग कौन-से कक्ष में होता है?
उत्तर:
प्रथम कक्ष में।
प्रश्न 9.
किसी कक्ष में इलेक्ट्रॉन के संवेग का मान क्या होता है?
उत्तर:
mvr = \(\frac { nh }{ 2π }\)
प्रश्न 10.
किसी कक्ष की त्रिज्या का मान बताइए।
उत्तर:
r = 0.529 x \(\frac { n² }{ Z }\)Å
प्रश्न 11.
बोर त्रिज्या किसे कहते हैं?
उत्तर:
हाइड्रोजन की प्रथम कक्षा को बोर त्रिज्या कहते हैं?
प्रश्न 12.
ऊर्जा स्तरों को किन प्रतीकों से प्रदर्शित करते हैं?
उत्तर:
K, L, M, N, O, P, Q के द्वारा।
प्रश्न 13.
उत्सर्जित प्रकाश की आवृत्ति किस समीकरण के द्वारा ज्ञात करते हैं?
उत्तर:
∆E = hv = E2 – E1
प्रश्न 14.
बोर का परमाणु मॉडल किस प्रकार के परमाणु स्पेक्ट्रम की व्याख्या करता है?
उत्तर:
बोर का परमाणु मॉडल केवल H परमाणु, He+, Li2+ आदि एक इलेक्ट्रॉनीय परमाणुओं और आयनों के स्पेक्ट्रम की व्याख्या करता है।
प्रश्न 15.
प्लांक नियतांक h का मान क्या है?
उत्तर:
h = 6.62 × 10-27 अर्ग-सेकण्ड।
प्रश्न 16.
स्पेक्ट्रम क्षेत्र में मिलने वाली रेखाओं की आवृत्ति को ज्ञात करने का सूत्र बताइए।
उत्तर:
\(\overline{\mathcal{V}}\) = R\(\left(\frac{1}{n_1^2}-\frac{1}{n_2^2}\right)\) cm-1
प्रश्न 17.
यदि = 1, 2, 3 तथा 4 हो तो मुख्य ऊर्जा स्तरों के नाम बताइये।
उत्तर:
n = 1 K ऊर्जा स्तर
n = 2 L ऊर्जा स्तर
n = 3 M ऊर्जा स्तर
n = 4 N ऊर्जा स्तर
प्रश्न 18.
विकिरण की ऊर्जा और आवृत्ति में क्या सम्बन्ध है?
उत्तर:
E = hv = h\(\frac { c }{ λ }\)
प्रश्न 19.
3p-ऑर्बिटल में उपस्थित कुल कोणीय व वृत्तीय नोडों की कुल संख्या बतायें।
उत्तर:
3p-ऑर्बिटल के लिये, n = 3, l = 1
कोणीय नोडों (Angular nodes) की संख्या = 1 = 1
वृत्तीय नोडों (Radial nodes) की
संख्या = n – l – 1
= 3 – 1 – 1
= 1
![]()
प्रश्न 20.
परमाणु क्रमांक 24 वाले तत्व का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
परमाणु क्रमांक (24) = 1s², 2s², 2p6, 3s², 3p6, 3d5, 4s1
प्रश्न 21.
“अधिकांश तत्वों के परमाणु भार भिन्नात्मक होते हैं।” इस कथन को स्पष्ट कीजिए?
उत्तर:
तत्वों का परमाणु भार उनके समस्थानिकों के भार का औसत होता है, इस कारण अधिकांश तत्वों के परमाणु भार भिन्नात्मक होते हैं।
प्रश्न 22.
एक परमाणु M तथा इसके आयन M+ दोनों का द्रव्यमान समान क्यों होता है?
उत्तर:
क्योंकि दोनों में प्रोटॉन तथा न्यूट्रॉनों की संख्या समान होती है।
प्रश्न 23.
किसी तत्व ‘X’ के परमाणु के कौन-कौन से कण उसके द्रव्यमान के लिये मुख्य रूप से उत्तरदायी होते हैं?
उत्तर:
प्रोटॉन तथा न्यूट्रॉन किसी भी तत्व के परमाणु के द्रव्यमान के लिये मुख्य रूप से उत्तरदायी होते हैं।
प्रश्न 24.
“परमाणु विद्युत उदासीन होता है।” इस कथन को स्पष्ट कीजिए।
उत्तर:
परमाणु के नाभिक में प्रोटॉनों की संख्या व नाभिक के बाहर इलेक्ट्रॉनों की संख्या बराबर-बराबर होती है, इस कारण परमाणु विद्युत उदासीन होता है।
प्रश्न 25.
विसर्जन नलिका के प्रयोग में नली की दीवार पर चमक क्यों उत्पन्न होती है?
उत्तर:
विसर्जन नलिका के प्रयोग में नली की दीवार पर चमक कैथोड किरणों के टकराने के कारण उत्पन्न होती है।
प्रश्न 26.
विसर्जन नली में उपस्थित वह कौन-सा कण है, जिसके e/m का मान अधिकतम है?
उत्तर:
इलेक्ट्रॉन का e/m मान अधिकतम होता है।
प्रश्न 27.
विसर्जन नलिका धन किरणों का स्रोत क्या होता है?
उत्तर:
विसर्जन नलिका में धन किरणों का स्रोत नली में भरी गैस होती है।
प्रश्न 28.
परमाणु के तीन मूल कण कौन-कौन से होते हैं?
उत्तर:
परमाणु के तीन मूल कण इलेक्ट्रॉन, प्रोटॉन व न्यूट्रॉन होते हैं।
प्रश्न 29.
रदरफोर्ड के कणों के प्रकीर्णन प्रयोग में, α-कणों का स्रोत क्या है?
उत्तर:
Ra (रेडियम) या Po (पोलेनियम )
प्रश्न 30.
यह कैसे सिद्ध होता है कि परमाणु का अधिकांश भाग रिक्त या खोखला होता है।
उत्तर:
रदरफोर्ड के α- प्रकीर्णन प्रयोग में अधिकांश α-कण बिना विचलित हुये सीधे निकल जाते हैं, इससे यह सिद्ध होता है कि परमाणु का अधिकांश भाग रिक्त होता है।
प्रश्न 31.
किस प्रयोग से सिद्ध होता है कि परमाणु का समस्त द्रव्यमान उसके केन्द्र में स्थित होता है?
उत्तर:
रदरफोर्ड के α-प्रकीर्णन के प्रयोग से सिद्ध होता है कि परमाणु का समस्त द्रव्यमान उसके केन्द्र में स्थित होता है।
प्रश्न 32.
“परमाणु द्वारा ऊर्जा का उत्सर्जन क्वाण्टीकृत (Quantised) होता है।” इस तथ्य को सर्वप्रथम किसने प्रस्तावित किया था?
उत्तर:
“परमाणु द्वारा ऊर्जा का उत्सर्जन क्वाण्टीकृत होता है।” इस तथ्य को सर्वप्रथम बोर (Bohr) ने प्रस्तावित किया था।
प्रश्न 33.
इलेक्ट्रॉनों तथा प्रोटॉनों में से किसका वेग अधिक होगा यदि दोनों की तरंगदैर्ध्य समान है?
उत्तर:
जिसका भार कम होगा उसका वेग उतना ही अधिक होगा क्योंकि λ = \(\frac { h }{ mv }\) अतः इलेक्ट्रॉन का वेग अधिक होगा।
प्रश्न 34.
एक परमाणु नाभिक में 14 प्रोटॉन तथा 13 न्यूट्रॉन हैं। इसकी द्रव्यमान संख्या क्या होगी?
उत्तर:
द्रव्यमान संख्या = प्रोटॉन की + न्यूट्रॉन की
संख्या संख्या
= 14 + 13 = 27
द्रव्यमान संख्या = 27 है।
प्रश्न 35.
तत्व \({ }_{19}^{39} \mathrm{~K}\) में इलेक्ट्रॉन, प्रोटॉन तथा न्यूट्रॉन की संख्या बताएँ।
उत्तर:
इलेक्ट्रॉन की संख्या = परमाणु क्रमांक = 19 प्रोटॉन की संख्या = परमाणु क्रमांक = 19
न्यूट्रॉन की संख्या = द्रव्यमान संख्या – परमाणु क्रमांक
= 39 19 20
प्रश्न 36.
किसी तत्व के समस्थानिकों में क्या समानता होती है?
उत्तर:
समस्थानिकों में परमाणु क्रमांक समान होता है।
प्रश्न 37.
परमाणु के कौन से कण परमाणु भार के लिये उत्तरदायी होते हैं?
उत्तर:
प्रोटॉन तथा न्यूट्रॉन परमाणु भार के लिये उत्तरदायी होते हैं।
प्रश्न 38.
न्यूट्रॉन की खोज किसने की थी?
उत्तर:
न्यूट्रॉन की खोज सर जेम्स चेडविक ने की थी।
प्रश्न 39.
कौन-सा कण तत्वों के भिन्न-भिन्न प्रकार के समस्थानिकों के बनने का कारण होता है?
उत्तर:
न्यूट्रॉन तत्वों के समस्थानिकों के बनने का कारण होता है।
प्रश्न 40.
द्रव्यमान संख्या, न्यूट्रॉन की संख्या तथा परमाणु क्रमांक में क्या सम्बन्ध होता है।
उत्तर:
द्रव्यमान संख्या परमाणु क्रमांक + न्यूट्रॉन की संख्या
प्रश्न 41.
निम्नलिखित के पूर्ण प्रतीक लिखो।
(i) परमाणु संख्या 56 तथा द्रव्यमान संख्या 138 का नाभिक।
(ii) परमाणु संख्या 26 तथा द्रव्यमान संख्या 55 का नाभिक।
(iii) परमाणु संख्या 4 तथा द्रव्यमान संख्या 9 का नाभिक।
उत्तर:
(i) परमाणु संख्या 56 वाला तत्व Ba है। इसका प्रतीक \({ }_{138}^{56} \mathrm{Ba}\) है।
(ii) परमाणु संख्या 26 वाला तत्व Fe है। इसका प्रतीक \({ }_{55}^{26} \mathrm{Fe}\) है।
(iii) परमाणु संख्या 4 वाला तत्व Be है इसका प्रतीक \({ }_{9}^{4} \mathrm{Be}\) है।
प्रश्न 42.
एक गतिमान सूक्ष्म कण की तरंगदैर्ध्य तथा संवेग के मध्य सम्बन्ध बताइये। इस सम्बन्ध को किस नाम से जाना जाता है?
उत्तर:
λ = \(\frac { h }{ mv }\)
यहाँ λ = तरंगदैर्ध्य, h = प्लांक स्थिरांक
m = द्रव्यमान, v = वेग
उपर्युक्त सम्बन्ध डी-ब्रॉग्ली सम्बन्ध के नाम से जाना जाता है।
प्रश्न 43.
किसी कक्षा में इलेक्ट्रॉन के निश्चित पथ की बोर- अवधारणा में आये उस मूलभूत परिवर्तन का उल्लेख कीजिए, जिसका अवतरण हाइजेनबर्ग अनिश्चितता सिद्धान्त से हुआ।
उत्तर:
अनिश्चितता सिद्धान्त के अनुसार, इलेक्ट्रॉन का पथ सदैव प्रायिक होता है तथा यह स्थिर अथवा निश्चित नहीं होता जैसा कि बोर – अवधारणा में उल्लेखित है।
प्रश्न 44.
किसी गतिमान सूक्ष्म कण के वेग में परिवर्तन से इसकी तरंगदैर्ध्य पर प्रभाव पड़ता है। क्यों?
उत्तर:
तरंगदैर्ध्य, वेग के व्युत्क्रमानुपाती होती है (λ = \(\frac { h }{ mv }\)) इसका अर्थ है कि वेग बढ़ने पर, तरंगदैर्ध्य घटेगी तथा वेग कम होने पर बढ़ेगी।
![]()
प्रश्न 45.
क्या डी-ब्रॉग्ली सम्बन्ध केवल इलेक्ट्रॉन पर ही लागू किया जा सकता है?
उत्तर:
नहीं, यह सभी गतिमान सूक्ष्मतम कणों पर लागू किया जा सकता है।
प्रश्न 46.
बोर मॉडल के अनुसार, प्रत्येक स्थिर अवस्था की En निम्नलिखित व्यंजक द्वारा दी जा सकती है।
En = \(\frac { -1312 }{ n² }\) kJ mol-1
यहाँ से क्या तात्पर्य है?
उत्तर:
यहाँ n से तात्पर्य ऊर्जा स्तर से है।
प्रश्न 47.
प्रथम कक्ष के लिये बोर त्रिज्या का मान बताइये।
उत्तर:
प्रथम कक्ष के लिये,
r1 = 0.529 Å
r1 = 0.529 × 10-10 m
r1 = 5.29 × 10-11 m
प्रश्न 48.
बोर के अनुसार, H परमाणु के लिये पहले कक्ष की त्रिज्या का सूत्र क्या है?
उत्तर:
rn = r1 x n²
प्रश्न 49.
H- परमाणु से एक इलेक्ट्रॉन को निकालने के लिये कितनी ऊर्जा की आवश्यकता होगी?
उत्तर:
H- परमाणु से एक इलेक्ट्रॉन को निकालने के लिये 13-6ev की आवश्यकता होगी।
प्रश्न 50.
प्लांक नियतांक (h) का मान व इकाई बताइए।
उत्तर:
6.625 x 10-27 अर्ग सेकण्ड
प्रश्न 51.
कैसे प्रदर्शित होता है कि नाभिक धनावेशित होता है?
उत्तर:
इसे हम रदरफोर्ड के α-प्रकीर्णन प्रयोग द्वारा सिद्ध कर सकते हैं।
प्रश्न 52.
न्यूट्रॉन क्या है? यह प्रोटॉन से किस प्रकार भिन्न है?
उत्तर:
on1, न्यूट्रॉन उदासीन कण है, जबकि प्रोटॉन धनावेशित कण है।
प्रश्न 53.
प्रोटॉन तथा H-परमाणु में विभेद कीजिए।
उत्तर:
परमाणु में से एक इलेक्ट्रॉन निकलने के बाद शेष बची रचना प्रोटॉन कहलाती है।
प्रश्न 54.
एक परमाणु के नाभिक में 17 प्रोटॉन तथा 18 न्यूट्रॉन हैं तो इसकी संयोजकता तथा द्रव्यमान संख्या क्या होगी?
उत्तर:
यहाँ संयोजकता = 1.
द्रव्यमान संख्या प्रोटॉन की संख्या + न्यूट्रॉन की संख्या
= 17 + 18 = 35
प्रश्न 55.
“सभी फोटॉनों की ऊर्जा बराबर नहीं होती है” इस कथन की पुष्टि कीजिए।
उत्तर:
फोटॉन की कर्जा प्रकाश की तरंगदैर्ध्य पर निर्भर करती है।
E = \(\frac { hc }{ λ }\)
प्रश्न 56.
एक फोटॉन का द्रव्यमान क्या होगा?
उत्तर:
फोटॉन द्रव्यमान रहित ऊर्जा के पैकेट होते हैं। परन्तु इसके नगण्य द्रव्यमान को निम्न सूत्र द्वारा निकाल सकते हैं।
m = \(\frac { h }{ cλ }\)
प्रश्न 57.
निम्नलिखित तत्वों में किस प्रकार की समानता है?
\({ }_6^{14} \mathrm{C},{ }_7^{15} \mathrm{~N},{ }_8^{16} \mathrm{O}\)
उत्तर:
ये तत्व आपस में समन्यूट्रॉनिक हैं?
प्रश्न 58.
निम्नलिखित में प्रत्येक का उदाहरण दीजिये।
(i) \({ }_{17}^{35} \mathrm{Cl}\) का समस्थानिक
उत्तर:
\({ }_{17}^{35} \mathrm{Cl}\) का समस्थानिक \({ }_{17}^{35} \mathrm{Cl}\) है।
(ii) \({ }_{18}^{40} \mathrm{Ar}\) का समभारिक
उत्तर:
\({ }_{18}^{40} \mathrm{Ar}\) का समभारिक \({ }_{20}^{40} \mathrm{Ca}\) है।
(iii) \({ }_{7}^{15} \mathrm{N}\) का समन्यूट्रॉनिक
उत्तर:
\({ }_{7}^{15} \mathrm{N}\) का समन्यूट्रॉनिक \({ }_{8}^{16} \mathrm{O}\) है।
प्रश्न 59.
हाइड्रोजन के समस्थानिक लिखें।
उत्तर:
हाइड्रोजन के तीन समस्थानिक होते हैं :
- प्रोटियम \(\left({ }_1^1 \mathrm{H}\right)\)
- ड्यूटीरियम \(\left({ }_1^2 \mathrm{H}\right)\)
- ट्राइटियम \(\left({ }_1^3 \mathrm{H}\right)\)
प्रश्न 60.
इलेक्ट्रॉन की ऊर्जा को शून्य कब मानते हैं?
उत्तर:
जब इसकी नाभिक से दूरी अनन्त हो। इस समय इलेक्ट्रॉन तथा नाभिक के मध्य का आकर्षण बल शून्य हो जाता है तथा ऊर्जा भी शून्य हो जाती है।
प्रश्न 61.
एक फोटॉन तथा क्वाण्टम में क्या अन्तर है?
उत्तर:
क्वाण्टम निश्चित ऊर्जा (E = hv) का एक बन्डल होता है। इसका स्रोत कुछ भी हो सकता। जबकि फोटॉन, केवल प्रकाश के क्वाण्टम को कहते हैं।
प्रश्न 62.
कैथोड किरणें तभी उत्पन्न होती हैं जब डिस्चार्ज नली के अन्दर गैस का दाब बहुत-बहुत कम हो, क्यों?
उत्तर:
उच्च दाब पर नली में विद्युत धारा का प्रवाह नहीं हो पाता है। क्योंकि गैसें विद्युत की बहुत कम चालक होती हैं।
प्रश्न 63.
एक डिस्चार्ज नली में हाइड्रोजन गैस तथा दूसरी डिस्चार्ज नली में ऑक्सीजन गैस ली गयी है क्या कैथोड किरणों तथा ऐनोड किरणों में इलेक्ट्रॉन तथा धनायन समान होंगे या भिन्न।
उत्तर:
इलेक्ट्रॉन की संख्या तो समान होगी परन्तु धनायन समान नहीं होंगे।
प्रश्न 64.
जब α-कण सोने की पतली पत्नी पर टकराते हैं तो टकराने के पश्चात् कुछ α-कण वापस चले जाते हैं, यह क्या सिद्ध करता है?
उत्तर:
यह सिद्ध करता है कि परमाणु में अन्दर एक बहुत छोटा परन्तु भारी नाभिक उपस्थित होता है।
प्रश्न 65.
निम्नलिखित नाभिकों में से समस्थानिकों एवं समभारिकों को चुनिये-
(a) 10 प्रोटॉन + न्यूट्रॉन
(b) 10 प्रोटॉन +11 न्यूट्रॉन
(c) 19 प्रोटॉन + 23 न्यूट्रॉन
(d) 21 प्रोटॉन + 21 न्यूट्रॉन
उत्तर:
(a) तथा
(b) आपस में समस्थानिक जबकि
(c) व
(d) आपस में समभारिक है।
प्रश्न 66.
हाइड्रोजन के किस समस्थानिक में दो न्यूट्रॉन होते हैं।
उत्तर:
ट्राइट्रियम में \(\left({ }_1^3 \mathrm{H}\right)\) दो न्यूट्रॉन होते हैं।
![]()
प्रश्न 67.
द्रव्य की द्वैत प्रकृति की व्याख्या किस वैज्ञानिक ने की थी?
उत्तर:
डी-ब्रॉली ने।
प्रश्न 68.
अनिश्चितता का सिद्धान्त किस वैज्ञानिक की देन है?
उत्तर:
वर्नर हाइजेनबर्ग की
प्रश्न 69.
तरंग फलन को कैसे प्रदर्शित करते हैं?
उत्तर:
ψ(Psi, साई से)।
प्रश्न 70.
परमाणु की तरंग यान्त्रिक मॉडल अवधारणा का समीकरण क्या है?
उत्तर:
λ = \(\frac { h }{ p }\)
प्रश्न 71.
इलेक्टॉन अभ्र क्या है?
उत्तर:
परमाणु में इलेक्टॉन का ऋणावेश अभ्र के रूप में नाभिक के चारों ओर विसरित रहता है अभ्र का घनत्व उस क्षेत्र में अधिक रहता है जिसमें इलेक्ट्रॉन मिलने की प्रायिकता अधिक होती है।
प्रश्न 72.
पाउली का अपवर्जन नियम क्या है?
उत्तर:
एक ही परमाणु में उपस्थित किन्हीं दो इलेक्ट्रॉनों की चारों क्वाण्टम संख्याओं के मान समान नहीं हो सकते हैं।
प्रश्न 73.
n के किसी मान के लिये l का मान क्या होता है?
उत्तर:
(0) से (n – 1) तक।
प्रश्न 74.
दिगंशी क्वाण्टम संख्या l = 2 के लिये चुम्बकीय क्वाण्टम संख्या m के मान लिखिए।
उत्तर:
l = 2, m = 2, – 1, 0, + 1, + 2
प्रश्न 75.
s p d f उपकोशों में कितने कक्षक होते हैं?
उत्तर:
2l + 1 कक्षक होते हैं।
प्रश्न 76.
Sc (परमाणु क्रमांक 21) के अन्तिम इलेक्ट्रॉनों की चारों क्वाण्टम सख्याएं लिखिए।
उत्तर:
Sc का अन्तिम इलेक्ट्रॉन 3d1 है अतः n = 3, l = 2, m = – 2 = – 2
प्रश्न 77.
निम्न में से कौन से उपकोश सम्भव नहीं हैं?
1s, 1p, 2s, 3d, 3f
उत्तर:
1p तथा 3f उपकोश सम्भव नहीं हैं क्योंकि l का मान n से कम नहीं है-
n = 1 l = 1 lp
n = 3 l = 3 3f
प्रश्न 78.
परमाणु की निम्न संरचना को ठीक करके लिखिए।
1s², 2s², 2px², 2py0, 2pz0
उत्तर:
1s², 2s², 2px1, 2py1, 2pz0
प्रश्न 79.
किसी तत्व के परमाणु में इलेक्ट्रॉनों की संख्या व प्रोटॉनों की संख्या बराबर-बराबर होती है, परन्तु उसके परमाणु क्रमांक को केवल प्रोटॉनों के द्वारा परिभाषित किया जाता है, इलेक्ट्रॉनों के द्वारा नहीं, क्यों?
उत्तर:
एक परमाणु इलेक्ट्रॉनों को ग्रहण भी कर सकता है और उत्सर्जित भी कर सकता है, परन्तु परमाणु के अन्दर उपस्थित प्रोटॉनों की संख्या सदैव स्थिर रहती है।
प्रश्न 80.
यदि किसी परमाणु के नाभिक में न्यूट्रॉनों की संख्या में परिवर्तन किया जाये तो बनने वाले परमाणु का मूल परमाणु से सम्बन्ध क्या होगा?
उत्तर:
समस्थानिक होगा।
प्रश्न 81.
जब एक इलेक्ट्रॉन किसी भी उच्च कक्षा से दूसरी कक्षा (n = 2) में कूदता है तो प्राप्त होने वाले रेखीय स्पेक्ट्रम की श्रेणी को क्या कहा जाता है?
उत्तर:
बामर श्रेणी।
प्रश्न 82.
किसी कण की तरंगदैर्ध्य और संवेग के सम्बन्ध का सूत्र बतलाइए।
उत्तर:
λ = \(\frac { h }{ p }\) = \(\frac { h }{ mv }\)
प्रश्न 83.
किस उपकोश का आकार गोलाकार होता है?
उत्तर:
s-उपकोश का आकार गोलाकार होता है।
प्रश्न 84.
किसी परमाणु की कक्षा में कोणीय संवेग के क्वाण्टीकरण का निर्गमन किसने किया?
उत्तर:
डी-ब्रॉली ने सर्वप्रथम किसी परमाणु की कक्षा में कोणीय संवेग के क्वाण्टीकरण निर्गमन किया।
प्रश्न 85.
निम्न में से कौन-से ऑर्बिटल समभ्रंश (degenerate) हैं?
3dxy, 4dxy, 3dz², 3dyz, 4dyz, 4dz²
उत्तर:
3dxy, 3dz², 3dyz – समभ्रंश ऑर्बिटल
4dxy, 4dyz, 4dz² – समभ्रंश ऑर्बिटल
प्रश्न 86.
चौथी कक्षा में अधिकतम कितने इलेक्ट्रॉन आ सकते है?
उत्तर:
अधिकतम इलेक्ट्रॉनों की संख्या = 2n²
= 2(4)²
= 32 इलेक्ट्रॉन
प्रश्न 87.
पाउली के नियम को अपवर्जन नियम क्यों कहते हैं?
उत्तर:
पाउली के नियम को अपवर्जन नियम इसलिये कहते हैं क्योंकि यह नियम किसी कक्षक के अन्दर तीसरे इलेक्ट्रॉन की उपस्थिति की सम्भावना को वर्जित करता है।
प्रश्न 88.
सभी फोटॉनों की ऊर्जा समान नहीं होती है। टिप्पणी दें।
उत्तर:
फोटॉनों की ऊर्जा उसके तरंगदैथ्यों पर निर्भर करती है, जिसे हम निम्न सूत्र द्वारा ज्ञात कर सकते हैं।
E = \(\frac { hc }{ λ }\)
अतः फोटॉनों की ऊर्जा समान नहीं होती है।
प्रश्न 89.
किसी भी कक्षक में अधिकतम कितने इलेक्ट्रॉन उपस्थित रह सकते हैं?
उत्तर:
किसी भी कक्षक में विपरीत चक्रण वाले अधिकतम दो इलेक्ट्रॉन ही रह सकते हैं।
प्रश्न 90.
“समान स्थिन क्वाण्टम संख्या वाले इलेक्ट्रॉन एक ही कक्षक में नहीं रह सकते।” यह कथन किस नियम को बताता है।
उत्तर:
पाउली के अपवर्जन नियम को।
प्रश्न 91.
एक गतिमान कण की तरंगदैर्ध्य का निम्न सूत्र है, यह किस सिद्धान्त से है-
λ = \(\frac { h }{ p }\)
उत्तर:
डी ब्रॉग्ली सिद्धान्त से
प्रश्न 92.
“किसी परमाणु के अन्दर इलेक्ट्रॉन की स्थिति और वेग दोनों को एक साथ ठीक-ठीक निर्धारित करना असम्भव है।” यह कथन किस सिद्धान्त पर आधारित है?
उत्तर:
हाइजेनवर्ग का अनिश्चितता का सिद्धान्त।
प्रश्न 93.
“किसी परमाणु में स्थित किन्हीं भी दो इलेक्ट्रॉनों की चारों क्वाण्टम संख्याएँ समान नहीं हो सकतीं।” यह कथन किस वैज्ञानिक ने दिया था।
उत्तर:
पाठली ने।
![]()
प्रश्न 94.
यदि किसी परमाणु के नाभिक में न्यूट्रॉन की संख्या परिवर्तित हो तो अपने मूल परमाणु से उसका क्या सम्बन्ध होगा?
उत्तर:
यह समस्थानिक होगा।
प्रश्न 95.
किस वैज्ञानिक के अनुसार परमाणु की कक्षा में कोणीय संवेग क्वाण्टीकृत (quantised) होता है।
उत्तर:
बोर (Bohr) के अनुसार।
प्रश्न 96.
पाउली के अपवर्जन नियमानुसार d-उपकोश में अधिकतम कितने इलेक्ट्रॉन आ सकते हैं।
उत्तर:
दस।
प्रश्न 97.
कौन-सा प्रायोगिक प्रमाण इलेक्ट्रॉन के तरंग लक्षण का समर्थन करता है?
उत्तर:
डेविसन तथा जर्मर का इलेक्ट्रॉन विवर्तन वलयों पर आधारित प्रयोग इलेक्ट्रॉन के तरंग लक्षण का समर्थन करता है।
प्रश्न 98.
किसी गतिमान कण की तरंगदैर्ध्य क्या होगी यदि इसका वेग दोगुना कर दिया जाए।
उत्तर:
तरंगदैर्ध्य घटकर आधी रह जायेगी क्योंकि सूत्र के अनुसार, (λ = h/mv), यहाँ पर h तथा m दोनों ही नियतांक है।
प्रश्न 99.
गतिमान सूक्ष्म कण के वेग में परिवर्तन किसी कण की तरंगदैर्ध्य को कैसे प्रभावित करता है?
उत्तर:
तरंगदैर्ध्य वेग के व्युत्क्रमानुपाती होता है। (λ = \(\frac { h }{ mv }\))। इसका अर्थ है कि यदि वेग बढ़ता है तो तरंगदैर्ध्य घटता है और वेग घटाने पर तरंगदैर्ध्य बढ़ जाता है।
प्रश्न 100.
नोडल तल से क्या तात्पर्य है?
उत्तर:
नोडल तल वह तल होता है, जहाँ पर इलेक्ट्रॉन के पाये जाने की सम्भावना नगण्य होती है, अर्थात् यहाँ पर (ψ² = 0) होता है।
प्रश्न 101.
ψ² का भौतिक महत्व क्या है?
उत्तर:
ψ² किसी भी इलेक्ट्रॉन के पाये जाने की प्रायिकता को प्रदर्शित करता है। यदि ψ² का मान शून्य है तो वहाँ पर इलेक्ट्रॉन के पाये जाने की प्रायिकता भी शून्य होती है।
प्रश्न 102.
किसी भी नाभिक के चारों ओर इलेक्ट्रॉन की गति की गणना शुद्धता के साथ नहीं की जा सकती है, क्यों?
उत्तर:
क्योंकि नाभिक के चारों ओर गतिमान इलेक्ट्रॉन के वेग में अनिश्चितता होती है। यह नियम हाइजेनबर्ग के अनिश्चितता के सिद्धान्त के अनुसार होता है।
प्रश्न 103.
किसी कक्षक में उपस्थित दो इलेक्ट्रॉनों का चक्रण विपरीत क्यों होता है?
उत्तर:
किसी कक्षक में उपस्थित दो इलेक्ट्रॉनों का चक्रण विपरीत होता है क्योंकि समान्तर अथवा समान चक्रण के इलेक्ट्रॉन एक-दूसरे को प्रतिकर्षित करते हैं।
प्रश्न 104.
स्टार्क प्रभाव से क्या तात्पर्य है?
उत्तर:
स्टार्क प्रभाव – विद्युत क्षेत्र में स्पेक्ट्रमी रेखाओं का विपाटन (Splitting) स्टार्क प्रभाव कहलाता है।
प्रश्न 105.
जीमान प्रभाव से क्या तात्पर्य है?
उत्तर:
जीमान प्रभाव – चुम्बकीय क्षेत्र में स्पेक्ट्रमी रेखाओं का विपाटन (Splitting) जीमान प्रभाव कहलाता है।
प्रश्न 106.
ऊर्जा के क्वाण्टीकरण से क्या तात्पर्य होता है?
उत्तर:
ऊर्जा स्तरों की ऊर्जा के कुछ विशिष्ट मान होते हैं इन्हीं विशिष्ट मानों के कारण ही ऊर्जा का क्वाण्टीकरण होता है।
प्रश्न 107.
आवृत्ति से क्या तात्पर्य है?
उत्तर:
प्रति एकांक समय में किसी बिन्दु से होकर जाने वाली तरंगों की संख्या को आवृत्ति कहते हैं।
प्रश्न 108.
तरंगदैर्ध्य से क्या तात्र्त्य है?
उत्तर:
तरंगदैर्ध्य (Wave length) – दो समीपवर्ती शृंगों (Crests) गर्तौ (Troughs) के केन्द्रों के बीच की दूरी तरंगदैर्ध्य कहलाती है।
प्रश्न 109.
इलेक्ट्रॉनों की द्वैत प्रकृति (dual Nature) दर्शाने वाली दो परिघटनाओं के नाम बताइये।
उत्तर:
इलेक्ट्रॉनों की द्वैत प्रकृति निम्न परिघटनाओं द्वारा प्रदर्शित की जा सकती है।
- प्रकाश विद्युत प्रभाव
- विवर्तन
प्रश्न 110.
कृष्णिका विकिरण (Black body radiation) क्या है बताइए।
उत्तर:
कृष्णिका विकिरण (Black body Radiation ) – एक ऐसा आदर्श पिण्ड जो हर प्रकार की आवृत्ति की विकिरणों को उत्सर्जित तथा अवशोषित करता है, कृष्णिका (Black body) कहलाता है। इस कृष्णिका से उत्सर्जित होने वाला विकिरण कृष्णिका विकिरण (Black body Radiation) कहलाता है।
प्रश्न 111.
तरंग संख्या (Wave number) पर टिप्पणी दें।
उत्तर:
तरंग संख्या (Wave number) – प्रति एकांक लम्बाई में, तरंगदैर्ध्य की संख्या को तरंग संख्या (wave Number) कहते हैं। इसका मात्रक m-1 या cm-1 होता है।
प्रश्न 112.
विवर्तन क्या होता है?
उत्तर:
किसी बाधा के आ जाने के कारण, तरंग के पथ में होने वाला विचलन विवर्तन कहलाता है।
प्रश्न 113.
व्यतिकरण पर टिप्पणी दें।
उत्तर:
व्यतिकरण- एक समान आवृत्ति वाली दो तरंगें मिलकर एक ऐसी तरंग देती हैं जिसका त्रिविम में प्रत्येक बिन्दु पर विक्षोभ, प्रत्येक तरंग के उस बिन्दु पर विक्षोभ का
बीजगणितीय या सदिश योग होता है। तरंगों का इस प्रकार का संयोजन व्यतिकरण कहलाता है।
प्रश्न 114.
क्या क्रिकेट की एक गतिमान गेंद में तरंग लक्षण होता है?
उत्तर:
डी-ब्रॉग्ली के अनुसार, λ = h/mv होता है, चूँकि क्रिकेट की गेंद का द्रव्यमान अधिक होता है इस कारण इसके तरंगदैर्ध्य का मान बहुत कम होता है जिसे मापना सम्भव नहीं है। इस कारण गति करती हुई गेंद में तरंग लक्षण नहीं होता है।
प्रश्न 115.
क्या अनिश्चितता का सिद्धान्त किसी भी कण (छोटे अथवा बड़े) पर लागू होता है? स्पष्ट करें।
उत्तर:
नहीं। यह सिद्धान्त केवल सूक्ष्म कर्णो जैसे- इलेक्ट्रॉन, प्रोटॉन तथा न्यूट्रॉन आदि पर ही लागू होता है।
प्रश्न 116.
क्या एक हाथी तरंग-गति में चक्कर लगा सकता है? इसकी तरंग का भौतिक महत्व क्या होगा?
उत्तर:
हाँ, एक हाथी तरंग गति में चक्कर लगा सकता है, परन्तु इसकी द्रव्य तरंग का मान बहुत ही कम होगा जिसका कोई भौतिक महत्त्व नहीं होता है।
प्रश्न 117.
डी-ब्रॉग्ली सम्बन्ध की सार्थकता क्या है?
उत्तर:
डी-ब्रॉग्ली सम्बन्ध के द्वारा केवल अति सूक्ष्मकणों की द्वैत प्रकृति को समझ सकते हैं अर्थात् कणों में भी तरंग प्रकृति होती है। अर्द्धसूक्ष्म व वृहद कणों के कणीय लक्षण अधिक परन्तु तरंग लक्षण कम होते हैं। इन कणों के तरंगदैर्ध्य का मान इतना कम होता है कि उसको मापना सम्भव नहीं होता है।
प्रश्न 118.
यदि एक गतिशील इलेक्ट्रॉन तथा प्रोटॉन के तरंगदैर्ध्य समान हैं तो इनमें से किसकी गति अधिक होगी और क्यों?
उत्तर:
λ = \(\frac { h }{ mv }\) के अनुसार, द्रव्यमान तथा वेग में व्युत्क्रम सम्बन्ध है। प्रश्नानुसार इलेक्ट्रॉन तथा प्रोटॉन के h तथा λ का मान समान है। जिस कण का द्रव्यमान अधिक होगा उसका वेग कम होगा। अतः इलेक्ट्रॉन का वेग प्रोटॉन की तुलना में अधिक होगा क्योंकि इसका द्रव्यमान प्रोटॉन से कम होता है।
प्रश्न 119.
किसी तत्व के रेखीय स्पेक्ट्रम को उस तत्व का फिंगर प्रिन्ट कहा जाता है। इस तथ्य पर टिप्पणी दें।
उत्तर:
प्रत्येक परमाणु के लिये रेखीय स्पेक्ट्रम की तरंगदैर्ध्य का मान निश्चित होता है। अतः कोई भी तत्व उसके रेखीय स्पेक्ट्रम के द्वारा पहचाना जा सकता है। अतः तत्व के रेखीय स्पेक्ट्रम को उस तत्व का फिंगर प्रिन्ट कहते हैं।
प्रश्न 120.
क्या H-परमाणु के अन्दर इलेक्ट्रॉन की स्थिति निश्चित होती है?
उत्तर:
नहीं हाइजेनवर्ग के अनुसार किसी भी अतिसूक्ष्म कण जैसे- इलेक्ट्रॉन की स्थिति व संवेग का निर्धारण एक साथ ठीक-ठीक सम्भव नहीं है अतः H परमाणु के अन्दर इलेक्ट्रॉन की स्थिति निश्चित नहीं है।
प्रश्न 121.
वह कौन-सा प्रयोग है जिससे पदार्थ की तरंग तथा कणीय दोनों प्रकृति को सिद्ध किया जा सकता है?
उत्तर:
किसी एक प्रयोग के द्वारा पदार्थ की तरंग तथा कणीय प्रकृति सिद्ध नहीं की जा सकती है इसके लिये अलग-अलग प्रयोगों को करना पड़ता है परन्तु डी ब्रॉग्ली के सिद्धान्त के द्वारा पदार्थ की द्वैत प्रकृति को सिद्ध किया जा सकता है।
प्रश्न 122.
उन स्पेक्ट्री श्रेणियों के नाम बताइये जो कि विद्युत चुम्बकीय स्पेक्ट्रम के निम्नलिखित क्षेत्रों में प्रदर्शित होती है :
(i) दृश्य क्षेत्र
(ii) पराबैंगनी क्षेत्र
(iii) अवरक्त क्षेत्र
उत्तर:
(i) बामर श्रेणी
(ii) लाइमन श्रेणी
(iii) फुण्ड श्रेणी
![]()
प्रश्न 123.
उत्सर्जन स्पेक्ट्रम क्या होता है?
उत्तर:
उत्सर्जन स्पेक्ट्रम (Emission Spectrum) – उत्सर्जन स्पेक्ट्रम को उत्तेजित पदार्थों से उत्सर्जित विकिरणों के विश्लेषण से प्राप्त किया जा सकता है? यह चमकदार रंगीन रेखाओं से बनता है जो एक-दूसरे से काले बैण्डों द्वारा पृथक रहता है। यह स्पेक्ट्रम केवल उच्च ताप पर ही प्राप्त किया जाता है।
प्रश्न 124.
अधिशोषण स्पेक्ट्रम पर टिप्पणी दें।
उत्तर:
अधिशोषण स्पेक्ट्रम (Absorption Spectrum) – इसे गैसीय या विलयन अवस्था में पदार्थ में से सफेद प्रकाश गुजारकर प्राप्त किया जाता है। इसमें काली रेखायें प्राप्त होती हैं। जो कि रंगीन बैण्डों द्वारा पृथक्कृत रहती हैं। इसे कमरे के ताप पर ही प्राप्त किया जा सकता है।
प्रश्न 125.
विद्युत चुम्बकीय विकिरण पर टिप्पणी दें।
उत्तर:
विद्युत चुम्बकीय विकिरण (Electro-magnetic Spectrum)-ये वे विकिरण होते हैं, जो आकाश में दोलायमान विद्युत तथा चुम्बकीय विक्षोभ तरंगों के रूप में संचरण करते हैं। जैसे- अवरक्त, पराबैंगनी, दृश्य तथा X – किरणें।
प्रश्न 126.
निम्न में से कौन विद्युत क्षेत्र में से गुजारने पर विचलन (deflection) प्रदर्शित नहीं करेगा।
प्रोटॉन, कैथोड किरणें, इलेक्ट्रॉन, न्यूट्रॉन
उत्तर:
न्यूट्रॉन।
प्रश्न 127.
हाइड्रोजन परमाणु में केवल एक इलेक्ट्रॉन ही होता है। अतः यहाँ इलेक्ट्रॉनों के मध्य प्रतिकर्षण अनुपस्थित है। जबकि बहुइलेक्ट्रॉनिक परमाणुओं में इलेक्ट्रॉनों के मध्य बहुत अधिक प्रतिकर्षण होता है। अतः बहुइलेक्ट्रॉनिक परमाणुओं में समान मुख्य क्वाण्टम संख्या के लिये कक्षक में एक इलेक्ट्रॉन की ऊर्जा किस प्रकार प्रभावित होती है।
उत्तर:
हाइड्रोजन परमाणु में इलेक्ट्रॉन की ऊर्जा ‘n’ के मान से ज्ञात की जाती है जबकि बहुइलेक्ट्रॉनिक परमाणुओं में यह (n + 1) की सहायता से ज्ञात करते हैं। अतः दी गई मुख्य क्वाण्टम संख्या के लिये s, p, d तथा f कक्षकों के इलेक्ट्रॉनों की ऊर्जा भी भिन्न होती है।
प्रश्न 128.
निम्न में प्रत्येक का इलेक्ट्रॉनिक विन्यास लिखें तथा अयुग्मित इलेक्ट्रॉनों की संख्या भी बताएँ।
(i) Mn4+
(ii) Cr3+
(iii) Fe3+
(iv) Ni2+
(v) CO2+ +
(vi) Cu2+
उत्तर:
| इलेक्ट्रॉनिक विन्यास | युग्मित इलेक्ट्रॉनों की संख्या | |
| (i) 25Mn4+ | 1s², 2s², 2p6, 3s², 3p6, 3d³ | 3 |
| (ii) 24Cr3+ | 1s², 2s², 2p6, 3s², 3p6, 3d³ | 3 |
| (iii) 26Fe3+ | 1s², 2s², 2p6, 3s², 3p6, 3d5 | 5 |
| (iv) 28 Ni2+ | 1s², 2s², 2p6, 3s², 3p6, 3d8 | 2 |
| (v) 27CO2+ | 1s², 2s², 2p6, 3s², 3p6, 3d7 | 3 |
| (vi) 29Cu2+ | 1s², 2s², 2p6, 3s², 3p6, 3d9 | 1 |
प्रश्न 129.
नाइट्रोजन का आद्य अवस्था में 1s², 2s², 2px2, 2py1 इलेक्ट्रॉनिक विन्यास सही है या गलत और क्यों?
उत्तर:
यह इलेक्ट्रॉनिक विन्यास हुण्ड के नियम के अनुसार गलत है।
प्रश्न 130.
क्रोमियम (Z = 24 ) 1s², 2s², 2p6, 3s², 3p6, 3d4, 4s² इलेक्ट्रॉनिक विन्यास गलत है, क्यों?
उत्तर:
चूँकि अर्द्ध पूर्ण भरे उपकोश (half filled sub-shell ) अधिक स्थायी होते हैं। अत: Cr का इलेक्ट्रॉनिक विन्यास 1s², 2s², 2p6, 3s², 3p6, 3d5, 4s1 होता है।
प्रश्न 131.
कॉपर [Z = 29] का सम्भावित इलेक्ट्रॉनिक विन्यास [Ar] 3d9, 4s² होना चाहिये। जबकि इसका वास्तविक इलेक्ट्रॉनिक विन्यास [Ar] 3d104s1 है। स्पष्ट करो।
उत्तर:
क्योंकि पूर्ण भरी हुई उपकोश अधिक स्थायी होती है।
प्रश्न 132.
कोश तथा कक्षक दोनों में क्या समानता होती है?
उत्तर:
दोनों में ही ऊर्जा स्तर होते हैं।
प्रश्न 133.
परमाणु क्रमांक 20 तथा 22 का इलेक्ट्रॉनिक विन्यास लिखें।
उत्तर:
20Ca → 1s², 2s², 2p6, 3s², 3p6, 4s²
22Ti → 1s², 2s², 2p6, 3s², 3p6, 3d², 4s².
प्रश्न 134.
निम्न परमाणुओं के लिये चौथे उपकोश की ऊर्जा-स्तर का क्रम बताइए।
(1) H – परमाणु
(2) Br- परमाणु
उत्तर:
(1) H – परमाणु के लिये
4s = 4p = 4d = 4f
(2) Br-परमाणु के लिये
4f > 4d > 4p > 4s
प्रश्न 135.
Cu, Cu+ Cu2+ तथा Cu3+ का इलेक्ट्रॉनिक विन्यास लिखिये और निम्न का उत्तर दीजिए-
(1) इलेक्ट्रॉनों की कुल संख्या
(2) s-उपकोश में उपस्थित इलेक्ट्रॉनों की कुल संख्या
(3) p-उपकोश में उपस्थित इलेक्ट्रॉनों की कुल संख्या
(4) d उपकोश में उपस्थित इलेक्ट्रॉनों की कुल संख्या
(5) अयुग्मित इलेक्ट्रॉनों की कुल संख्या
(6) कुल स्पिन
(7) अनुचुम्बकीय अथवा प्रतिचुम्बकीय गुण
(8) अधिक स्थायी आयन
उत्तर:
इलेक्ट्रॉनिक विन्यास
29Cu – 1s², 2s², 2p6, 3s², 3p6, 3d10, 4s1
29Cu+ – 1s², 2s², 2p6, 3s², 3p6, 3d10
29Cu2+ – 1s², 2s², 2p6, 3s², 3p6, 3d9
29Cu3+ – 1s², 2s², 2p6, 3s², 3p6, 3d8
| गुण | Cu | Cu+ | Cu2+ | Cu3+ |
| 1. इलेक्ट्रॉन की कुल संख्या | 29 | 28 | 27 | 26 |
| 2. s-इलेक्ट्रॉनों की कुल संख्या | 7 | 6 | 6 | 6 |
| 3. p-इलेक्ट्रॉनों की कुल संख्या | 12 | 12 | 12 | 12 |
| 4. d-इलेक्ट्रॉनों की कुल संख्या | 10 | 10 | 9 | 8 |
| 5. अयुग्मित इलेक्ट्रॉन की संख्या | 1 | 0 | 1 | 2 |
| 6. कुल स्पिन = ±\(\frac { 1 }{ 2 }\) x अयुग्मित इलेक्ट्रॉन की संख्या | ±\(\frac { 1 }{ 2 }\) | 0 | ±\(\frac { 1 }{ 2 }\) | ±1 |
| 7. अनुचुम्बकीय (P) या प्रति चुम्बकीय (D) गुण | P | D | P | P |
8. इसमें Cu+ आयन अत्यधिक स्थायी होगा क्योंकि इसमें d-कक्षक पूर्ण रूप से भरे हुए हैं।
प्रश्न 136.
कार्बन परमाणु का इलेक्ट्रॉनिक विन्यास 1s², 2s1, 2px1, 2py1, 2pz1 है। इसका क्या अर्थ है?
उत्तर:
इसका अर्थ है कि कार्बन परमाणु उत्तेजित अवस्था में है।
प्रश्न 137.
Cr3+ आयन के d-उपकोश में उपस्थित इलेक्ट्रॉनों की संख्या क्या होगी?
उत्तर:
तीन (3); Cr3+ → 1s², 2s², 2p6, 3s², 3p6, 3d³
प्रश्न 138.
परमाणु क्रमांक 46 वाला तत्व इलेक्ट्रॉनिक विन्यास में अपवाद प्रदर्शित करता है। इस तत्व के 4d – उपकोश में कितने अयुग्मित इलेक्ट्रॉन होंगे।
उत्तर:
46Pd : 1s², 2s², 2p6, 3s², 3p6, 3d10, 4s², 4p6, 4d10

कुल अयुग्मित इलेक्ट्रॉन = 0
प्रश्न 139.
कैल्सियम तथा क्लोरीन का परमाणु क्रमांक 20 तथा 17 है। Ca 2+ तथा CI का इलेक्ट्रॉनिक विन्यास क्या होगा।
उत्तर:
Ca2+ में इलेक्ट्रॉन = 20 – 2 = 18;
Ca2+ : 1s², 2s², 2p6, 3s², 3p6
Cl– में इलेक्ट्रॉन = 17 + 1 = 18;
Cl– : 1s², 2s², 2p6, 3s², 3p6
प्रश्न 140.
‘किन-किन तत्वों में s-इलेक्ट्रॉन की कुल संख्या p-इलेक्ट्रॉन की कुल संख्या के बराबर होती है?
उत्तर:
8O → 1s², 2s², 2p4, (s तथा p में इलेक्ट्रॉन = 4)
12Mg → 1s², 2s², 2p6, 3s² (s तथा p में इलेक्ट्रॉन = 6)
प्रश्न 141.
Zn2+ तथा Sc2+ का इलेक्ट्रॉनिक विन्यास लिखें।
उत्तर:
30Zn2+ → 1s², 2s², 2p6, 3s², 3p6, 3d10
21Sc2+ → 1s², 2s², 2p6, 3s², 3p6, 3d1
![]()
प्रश्न 142.
नाइट्रोजन परमाणु का इलेक्ट्रॉनिक विन्यास 1s², 2s², 2px1, 2py1, 2pz1 होता है, 1s², 2s², 2p2x, 2p1y, नहीं क्यों।
उत्तर:
ऐसा हुण्ड के नियमानुसार होता है। इसके अनुसार समभ्रंश (degenerate) कक्षक पहले समान्तर इलेक्ट्रॉनिक चक्रण के साथ एकल रूप में भरते हैं। इसमें युग्मन नहीं होता है।
प्रश्न 143.
OF2 में ऑक्सीजन O2+ के रूप में होता है। इसका इलेक्ट्रॉनिक विन्यास लिखे।
उत्तर:
O2+ → 1s², 2s², 2p²
प्रश्न 144.
1s इलेक्ट्रॉन की ऊर्जा 2s इलेक्ट्रॉन से कम होती है क्योंकि?
उत्तर:
25 की तुलना में 1s इलेक्ट्रॉन नाभिक के अधिक समीप होते हैं जिससे इन पर आकर्षण बल अधिक होता है जिससे ऊर्जा कम हो जाती है।
प्रश्न 145.
कौन-सा कक्षक अदिशात्मक होता है?
उत्तर:
कक्षक अदिशात्मक होता है, क्योंकि इनका आकार गोलाकार होता है।
प्रश्न 146.
किस / कक्षक में चार पालियाँ (lobes) नहीं होती हैं।
उत्तर:
dz² में। इसमें केवल दो पालियाँ होती हैं।
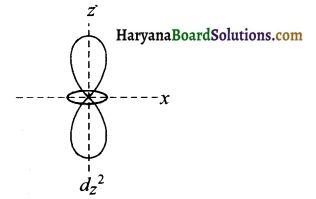
प्रश्न 147.
किस d-कक्षक में अक्षों के अनुदिश चार पालियाँ (lobes) होती हैं?
उत्तर:
dx²-y² में। इसमें x तथा y-अक्षों के अनुदिश चार पालियाँ होती है।
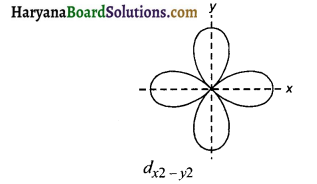
प्रश्न 148.
Px, Py तथा pz कक्षक की संरचना दें।
उत्तर:
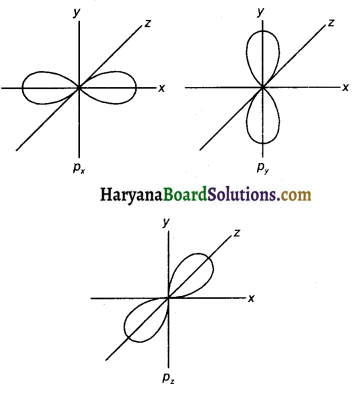
प्रश्न 149.
निम्नलिखित विन्यासों वाले तत्वों के नाम लिखें।
(1) 1s², 2s², 2p6
उत्तर:
निऑन (Ne)
(2) 1s², 2s² 2p6, 3s², 3p6, 3d², 4s²
उत्तर:
टाइटेनियम (Ti)
(3) 1s², 2s², 2p6, 3s², 3p1
उत्तर:
ऐलुमिनियम (AI)
(4) 1s², 2s², 2p6, 3s², 2p4
उत्तर:
सल्फर (S)
प्रश्न 150.
ऑफबाऊ सिद्धान्त का उपयोग करते हुए निम्न परमाणुओं की आद्य अवस्था का इलेक्ट्रॉनिक विन्यास लिखें।
(1) बोरॉन (Z= 5)
(2) कैल्सियम (Z = 20)
(3) रूबीडियम (Z= 37)
उत्तर:
(1) बोरॉन (Z = 5); 1s², 2s², 2p1
(2) कैल्सियम (Z = 20); 1s², 2s², 2p6, 3s², 3p6, 4s²
(3) रूबीडियम (Z = 37 ); 1s², 2s², 2p6, 3s², 3p6, 3d10, 4s², 4p6, 5s1
प्रश्न 151.
एक p-उपकोश में जिसमें Px, Py तथा Pz कक्षक उपस्थित होते हैं। यदि मात्र एक ही इलेक्ट्रॉन है तो इन तीनों कक्षकों में से इलेक्ट्रॉन किसमें रहेगा?
उत्तर:
इलेक्ट्रॉन Px, Py तथा Pz कक्षकों में से किसी में भी रह सकता है क्योंकि ये सभी समभ्रंश कक्षक होते हैं।
प्रश्न 152.
1s तथा 2s कक्षक गोलीय नोडों की संख्या में किस प्रकार भिन्न होते हैं?
उत्तर:
1s कक्षक में कोई नोड नहीं होता है जबकि 2s कक्षक में एक नोड उपस्थित होता है। क्योंकि गोलीय नोडों की संख्या (n – 1) के बराबर होती है जहाँ – मुख्य क्वाण्टम संख्या होती है।
प्रश्न 153.
किसी तत्व की द्रव्यमान संख्या उसके परमाणु क्रमांक की दोगुनी है। यदि 2 कक्षकों में 4 इलेक्ट्रॉन हों तो तत्व का इलेक्ट्रॉनिक विन्यास और नाम लिखें।
उत्तर:
तत्व का इलेक्ट्रॉनिक विन्यास 1s², 2s², 2p4 है। अर्थात् इसका परमाणु क्रमांक (Z = 8) और द्रव्यमान संख्या (A = 16) होती है। अतः तत्व ऑक्सीजन है।
प्रश्न 154.
2d तथा 35 कक्षक सम्भव क्यों नहीं हैं?
उत्तर:
चूँकि n = 2 के लिये l के 0 तथा 1 मान होते हैं अर्थात् n = 2 कक्ष में केवल s तथा p-कक्षक होते हैं यहाँ d-कक्षक उपस्थित नहीं होते। इसी प्रकार n = 3 के लिये l के 0, 1 तथा 2 मान होते हैं, इस कारण n = 3 कक्ष में f-कक्षकों की सम्भावना नहीं होती है।
प्रश्न 155.
4d तथा 5s कक्षकों में से पहले कौन-सा कक्षक भरेगा?
उत्तर:
4d तथा 5s-कक्षकों में से सर्वप्रथम 5s कक्षक भरा जायेगा। क्योंकि 5s कक्षक की ऊर्जा कम होती है। कक्षकों की ऊर्जा को (n + l) नियम द्वारा ज्ञात किया जा सकता है। जिस कक्षक के लिये (n + l) का मान कम होता है उसकी ऊर्जा भी कम होती है। अतः
5s – कक्षक के लिये
n + l = 5 + 0 = 5
4d-कक्षक के लिये,
n + l = 4 + 2 = 6
ऊर्जा का क्रम = 4d > 5s
अतः 5s कक्षक पहले भरा जायेगा।
प्रश्न 156.
2p-उपकोश में इलेक्ट्रॉन 2s-उपकोश की अपेक्षा अधिक होते हैं। क्यों?
उत्तर:
2s – उपकोश में केवल एक ही कक्षक होता है जिसमें (m = 0) होता है जबकि 2p-उपकोश में तीन कक्षक ( m = – 1, 0 + 1 ) होते हैं। चूँकि एक कक्षक में अधिकतम दो इलेक्ट्रॉन भरे जा सकते हैं अतः 2p-उपकोश में अधिकतम छह इलेक्ट्रॉन भरे जा सकते हैं। जबकि 25- उपकोश में अधिकतम दो इलेक्ट्रॉन ही भरे जा सकते हैं।
प्रश्न 157.
निम्न दिये गये क्वाण्टम संख्याओं के सेटों को ऊर्जा के घटते क्रम में व्यवस्थित कीजिए।
(A) n = 4, l = 0, me = 0, ms = ± \(\frac { 1 }{ 2 }\)
(B) 2 = 3, l = 1, me = 1,ms = – \(\frac { 1 }{ 2 }\)
(C) n = 3, l = 2, me = 0,ms = + \(\frac { 1 }{ 2 }\)
(D) n = 3, l = 0, me = 0,ms = – \(\frac { 1 }{ 2 }\)
उत्तर:
C > A > B > D
प्रश्न 158.
ऑक्सीजन परमाणु के 8वें इलेक्ट्रॉन के लिये चारों क्वाण्टम संख्याओं के मान बताइये।
उत्तर:
8O = 1s², 2s², 2p4
8वें इलेक्ट्रॉन की चारों क्वाण्टम संख्यायें,
(n = 2, l = 1, m = + 1, या – 1, s = + \(\frac { 1 }{ 2 }\) या – \(\frac { 1 }{ 2 }\))
प्रश्न 159.
पाउली के अपवर्जन नियम की सहायता से मुख्य क्वाण्टम संख्या तीन (n = 3) वाले कोश में भरे जा सकने वाले इलेक्ट्रॉनों की अधिकतम संख्या ज्ञात करें।
उत्तर:
इलेक्ट्रॉनों की अधिकतम संख्या = 2N²
= 2(3)²
= 18
प्रश्न 160.
l = 0, 1, 2, तथा 3 को क्रमशः किन अक्षरों के द्वारा प्रदर्शित किया जाता है।
उत्तर:
l = 0, 1, 2, तथा 3 के लिये क्रमश: s, p, d तथा f अक्षर होंगे।
प्रश्न 161.
n = 2, के लिये l और m के कुल मानों की संख्या की गणना कीजिए।
उत्तर:
के किसी भी मान के लिये l व m के कुल मानों की संख्या क्रमश: n तथा n² होती है।
प्रश्नानुसार, n = 2
अतः l के कुल मान = 2
तथा m के कुल मान = (2)² = 4
प्रश्न 162.
l = 3 के लिये m के सम्भावित मान लिखिए।
उत्तर:
l के किसी भी मान के लिये m के सम्भावित मान – l से + l तक होते हैं जिसमें शून्य भी होता है।
प्रश्नानुसार, l = 3
अत: m = – 3, – 2, 1, 0, + 1 + 2, + 3
प्रश्न 163.
सोडियम परमाणु के अन्तिम इलेक्ट्रॉन की चारों क्वाण्टम संख्याओं के मान लिखिये।
उत्तर:
11Na → 1s², 2s², 2p6 3s-1
n = 3, 1 = 0, m = 0, s = + \(\frac { 1 }{ 2 }\)
प्रश्न 164.
3p6 विन्यास में चौथे इलेक्ट्रॉन की चारों क्वाण्टम संख्याओं के मान लिखिये।
उत्तर:
3p6 के p-उपकोश को हम निम्न प्रकार प्रदर्शित कर सकते हैं।
चौथे इलेक्ट्रॉन के लिये,
n = 3, l = 1, m = + 1, s = – \(\frac { 1 }{ 2 }\)
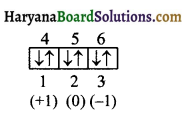
प्रश्न 165.
3d² इलेक्ट्रॉन के लिये n, l m तथा s क्वाण्टम संख्याओं के मान ज्ञात करें।
उत्तर:
3d² इलेक्ट्रॉन के लिये,
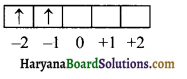
n = 3, l = 2, m = – 1, s = + \(\frac { 1 }{ 2 }\)
प्रश्न 166.
हीलियम के प्रथम इलेक्ट्रॉन की चारों क्वाण्टम संख्याएँ क्रमश: n = 1, l = 0, m = 0, s = + \(\frac { 1 }{ 2 }\) हो तो दूसरे इलेक्ट्रॉन की चारों क्वाण्टम संख्याएँ क्या होगीं?
उत्तर:
हीलियम के द्वितीय इलेक्ट्रॉन की क्वाण्टम संख्याएँ
n = 1, l = 0, m = 0, s = – \(\frac { 1 }{ 2 }\)
प्रश्न 167.
छठे ऊर्जा स्तर के लिये ‘l’ का मान क्या होगा?
उत्तर:
n = 6, l = 0, 1, 2, 3, 4, 5,
प्रश्न 168.
कौन-सा कोश है जिसमें प्रथम बार g-उपकोश आता है।
उत्तर:
पाँचवे कोश में प्रथम बार g उपकोश आता है।
प्रश्न 169.
n = 4 व l = 0 के लिए कक्षक कौन सा होता है?
उत्तर:
n = 4 व l = 0 के लिये 4s कक्षक होता है।
प्रश्न 170.
निम्नलिखित में से कौन-सा विन्यास आद्य अवस्था का और कौन-सा उत्तेजित अवस्था का है?
(i) 1s², 2s², 2p4
उत्तर:
आद्य अवस्था (Ground State )
(ii) 1s², 2s², 2p6, 3s1, 3p1
उत्तर:
उत्तेजित अवस्था (Excited state)
(iii) 1s2, 2s2, 2p6, 3s², 3p4
उत्तर:
आद्य अवस्था (Ground State )
(iv) 1s², 2s², 2p6, 3s², 3p6, 3d10, 4s²
उत्तर:
आद्य- अवस्था (Ground State)
(v) 1s², 2s², 2p6, 3s², 3p4, 3d1
उत्तर:
उत्तेजित अवस्था (Excited State)
प्रश्न 171.
कक्षकों के नाम लिखिये, जब
(1) n = 2, l = 0
(2) n = 3, l = 2
(3) n = 5, l = 1
(4) n = 4, l = 3
उत्तर:
(1) 2s
(2) 3d
(3) 5p
(4) 4f
प्रश्न 172.
किसी बहु – इलेक्ट्रॉन परमाणु के लिये g – उपकोश में कितने कक्षक उपलब्ध होते हैं।
उत्तर:
g-उपकोश के लिये l = 4, कक्षकों की कुल संख्या = (2l + 1) अत: कक्षकों की कुल संख्या
= 2 × 4 + 1
= 9
g – उपकोश में कुल 9 कक्षक उपस्थित होते हैं।
प्रश्न 173.
“dz² कक्षक के xy तल में इलेक्ट्रॉन का घनत्व शून्य होता है।” टिप्पणी दें।
उत्तर:
यह कथन सत्य नहीं है। dz² कक्ष के xy तल में भी इलेक्ट्रॉन घनत्व उपस्थित होता है जिसे वलय द्वारा दर्शाया जाता है।
प्रश्न 174.
dyz तथा dz² कक्षक आपस में किस प्रकार सम्बन्धित होते हैं?
उत्तर:
dyz तथा dz² कक्षक समान ऊर्जा के अर्थात् समभ्रंश (degenerate) कक्षक होते हैं। जबकि dyz कक्षक तल में होता है। जबकि dz² कक्षक y तथा 2 अक्षों में होता हैं।
प्रश्न 175.
n = 2 के लिये l तथा m के मान लिखें।
उत्तर:
n = 2, l = 0, 1, m = 1, 0, + 1
![]()
प्रश्न 176.
s, p तथा d उपकोशों को, उनमें उपस्थित इलेक्ट्रॉनों द्वारा अनुभव किये जाने वाले प्रभावी नाभिकीय आकर्षण के आधार पर बढ़ते क्रम में व्यवस्थित करें।
उत्तर:
जो उपकोश नाभिक के अत्यधिक पास होता है उस पर लगने वाला प्रभावी नाभिकीय आकर्षण बल भी उतना अधिक होता है, अतः बढ़ता हुआ क्रम है-
d < p < s
प्रश्न 177.
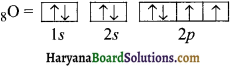
ऑक्सीजन परमाणु (Z = 8) में इलेक्ट्रॉन का वितरण आर्बिटल आरेख के द्वारा प्रदर्शित करें।
हल:
प्रश्न 178.
निकिल परमाणु दो इलेक्ट्रॉनों को त्याग कर Ni2+ आयन बनाता है। यदि निकिल का परमाणु क्रमांक 28 है तो निकिल किस उपकोश से इलेक्ट्रॉनों को त्यागेगा?
उत्तर:
Ni(28) = 1s² 2s² 2p6 3s² 3p6 4s² 3d8
Ni2+ = 1s² 2s² 2p6 3s² 3p6 3d8
निकिल s-उपकोश से इलेक्ट्रॉनों को त्यागेगा।
लघु उत्तरीय प्रश्न
प्रश्न 1.
प्रोटॉन तथा हाइड्रोजन परमाणु में क्या अन्तर है?
उत्तर:
प्रोटॉन परमाणु का अति सूक्ष्म मौलिक कण है जिस पर इकाई धनावेश होता है। हाइड्रोजन परमाणु में केवल एक इलेक्ट्रॉन और एक प्रोटॉन होता है। जब हाइड्रोजन परमाणु से इलेक्ट्रॉन निकल जाता है तो इकाई धनावेशित प्रोटॉन प्राप्त होता है।
प्रश्न 2.
समइलेक्ट्रॉनिक से आप क्या समझते हों?
उत्तर:
परमाणु धनायनों तथा ऋणायनों का वह समूह जिनका इलेक्ट्रॉनिक विन्यास समान होता है समइलेक्ट्रॉनिक कहलाते हैं।
- He, Li+, Be++ तथा B+++ समइलेक्ट्रॉनिक हैं क्योंकि प्रत्येक में 2, 2 इलेक्ट्रॉन हैं।
- O– –, F–, Ne, Na+, Mg++, Al+++ समइलेक्ट्रॉनिक हैं क्योंकि प्रत्येक में 10-10 इलेक्ट्रॉन हैं।
प्रश्न 3.
प्लांक सिद्धान्त की व्याख्या कीजिए।
उत्तर:
दृश्य प्रकाश, X – किरणें, पराबैंगनी किरणें, राडार किरणें, टेलीविजन तथा रेडियों तरंगे विद्युत चुम्बकीय विकिरण हैं। इन सभी विकिरण की तरंग प्रकृति होती है। विकिरण की तरंगदैर्ध्य तथा आवृत्ति में निम्न सम्बन्ध होता है-
c = vλ
प्रश्न 4.
प्लांक क्वाण्टम सिद्धान्त की व्याख्या कीजिए।
उत्तर:
जर्मन वैज्ञानिक मैक्स प्लांक (1901) ने विकिरण सम्बन्धित क्वाण्टम सिद्धान्त का प्रतिपादन किया जिसके अनुसार-
(i) जब कोई पिण्ड विकिरण के रूप में प्रकाश या ऊष्मीय ऊर्जा का उत्सर्जन या अवशोषण करता है तो वह ऐसा सतत् रूप में नहीं कर सकता है।
(ii) ऊर्जा का उत्सर्जन या अवशोषण निश्चित मात्रा के छोटे-छोटे बण्डलों अथवा पैकिटों के रूप में होता है जिन्हें क्वाण्टा कहते हैं
(iii) विकिरित ऊर्जा को फोटॉन भी कहते हैं।
यदि विकिरण की आवृत्ति v हो तो विकिरण के फोटॉन की ऊर्जा
E = hv = चूँकि v = \(\frac { c }{ λ }\)
अथवा
E = hc\(\overline{\mathcal{V}}\) चूँकि \(\overline{\mathcal{V}}\) = \(\frac { 1 }{ λ }\)
प्रश्न 5.
ऊर्जा के क्वाण्टीकरण से क्या तात्पर्य है?
उत्तर:
ऊर्जा के क्वाण्टीकरण से तात्पर्य यह है कि ऊर्जा स्तरों की ऊर्जा के कुछ विशिष्ट मान होते हैं।
प्रश्न 6.
s p d f उपकोशों में इलेक्ट्रॉनों की अधिकतम संख्या क्या है?
उत्तर:
किसी उपकोश में अधिकतम इलेक्ट्रॉन की संख्या 2 (2l + 1) होती है अतः उपकोश में 2, p उपकोश में 6, d उपकोश में 10 तथा f उपकोश में 14 इलेक्ट्रॉन होते हैं।
प्रश्न 7.
बोर के परमाणु मॉडल के दोष लिखिए।
उत्तर:
(1) बोर के परमाणु मॉडल द्वारा हाइड्रोजन तथा एक इलेक्ट्रॉन युक्त आयनों (जैसे-He+, Li2+, Be3+ ) के स्पेक्ट्रमों की व्याख्या तो की जा सकी किन्तु बहु- इलेक्ट्रॉन परमाणुओं और आयनों के स्पेक्ट्रमों की व्याख्या बोर सिद्धान्त के द्वारा न हो सकी।
(2) उच्च विभेदन क्षमता वाले स्पेक्ट्रोस्कोप द्वारा जाँच करने पर पाया गया कि हाइड्रोजन स्पेक्ट्रम में प्राप्त एकल सूक्ष्म रेखायें समूह से बनी हैं। इसकी व्याख्या बोर सिद्धान्त द्वारा न हो सकी।
(3) विकिरणों के परमाण्वीय स्रोत को चुम्बकीय क्षेत्र में रखने पर स्पेक्ट्रम की एकल रेखायें परस्पर सटी हुई अनेक रेखाओं में विभक्त हो जाती हैं। इसको जीमान प्रभाव कहते हैं। बोर सिद्धान्त इसकी व्याख्या न कर सका।
(4) वैद्युत क्षेत्र की उपस्थिति में भी स्पेक्ट्रम रेखाएँ अनेक सूक्ष्मतम रेखाओं में विभक्त हो जाती हैं। इसे स्टार्क प्रभाव कहते हैं। इस प्रभाव की व्याख्या भी बोर सिद्धान्त नहीं कर सका।
प्रश्न 8.
प्रोटॉन तथा इलेक्ट्रॉन में विभेद करें।
उत्तर:
प्रोटॉन तथा इलेक्ट्रॉन में विभेद
(Difference between Proton and Electron)
| प्रोटॉन (Proton) | इलेक्ट्रॉन (Electron) |
| 1. प्रोटॉन प्रत्येक परमाणु का इकाई धनावेशित कण है। | 1. इलेक्ट्रॉन प्रत्येक परमाणु का इकाई ऋणावेशित कण है। |
| 2. इसका आवेश + 1.603 × 10-19 कूलॉम या +4 808 × 10-10 esu होता है। | 2. इसका आवेश – 1603 x 10-19 कूलॉम या -4.808 x 10-10 esu होता है। |
| 3. इसका द्रव्यमान 1.6726 × 10-24 ग्राम होता है। | 3. इसका द्रव्यमान 9.1095 × 10-28 ग्राम होता है। |
| 4. प्रोटॉन की त्रिज्या 10-13 सेमी होती है। | 4. इलेक्ट्रॉन की त्रिज्या 2.8 × 10-13 सेमी होती है। |
| 5. प्रोटॉन परमाणु नाभिक में विद्यमान रहते हैं। | 5. इलेक्ट्रॉन परमाणु नाभिक से बाहर कक्षों में विद्यमान रहते हैं। |
| 6. इसको 1H1 या p से व्यक्त करते हैं। | 6. इसको -1e0 या e से व्यक्त करते हैं। |
प्रश्न 9.
नाभिक का संघटन बताइये।
उत्तर:
नाभिक का संघटन परमाणु के केन्द्रीय या मध्य भाग को केन्द्रक या नाभिक (Nucleus) कहते हैं। इस नाभिक में न्यूट्रॉन तथा प्रोटॉन उपस्थित होते हैं। प्रोटॉनों पर धनावेश जबकि न्यूट्रॉन उदासीन होते हैं। प्रोटॉनों पर धनावेश होने के कारण नाभिक धनावेशित होता है। नाभिक में उपस्थित प्रोटॉनों तथा न्यूट्रॉनों की संख्या का योग द्रव्यमान संख्या (Mass number) कहलाती है। नाभिक में उपस्थित कणों को (न्यूट्रॉन, प्रोटॉन आदि) न्यूक्लिऑन (Nucleons) कहते हैं। किसी तत्व का परमाणु भार उस तत्व की द्रव्यमान संख्या या उसमें उपस्थित न्यूक्लिऑनों की संख्या के लगभग बराबर होता है।
तत्व का परमाणु क्रमांक प्रोटॉनों की संख्या = इलेक्ट्रॉनों की संख्या परमाणु की द्रव्यमान संख्या
= न्यूक्लिऑन की संख्या व प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
प्रश्न 10.
कैथोड किरणों के चार गुण लिखिए।
उत्तर:
कैथोड किरणों के चार गुण निम्न प्रकार हैं।
- कैथोड किरणों में आयनन क्षमता होती है। जब कैथोड किरणें। किसी गैसीय माध्यम से गुजरती हैं तो उस गैस को आयनित कर देती हैं।
- कैथोड किरणों में भेदन क्षमता होती है। कैथोड किरणें ऐलुमिनियम जैसी धातु की पतली पत्नी के आर-पार निकल जाती हैं। यद्यपि ये मोटी पन्नियों द्वारा रोक ली जाती हैं।
- कैथोड किरणें सीधी रेखा में प्रवाह करती हैं।
- कैथोड किरणें जब जिंक सल्फाइड से लेपित काँच की सतह या पर्दे पर पड़ती हैं तो प्रतिदीप्ति उत्पन्न करती है।
प्रश्न 11.
फोटॉन तथा क्वाण्टम किस प्रकार भिन्न हैं?
उत्तर:
क्वाण्टम एक निश्चित परिमाण की ऊर्जा (जिसका मान E = hv होता है) का एक बण्डल होता है। क्वाण्टम को किसी भी स्रोत के द्वारा प्राप्त किया जा सकता है। जबकि फोटॉन केवल प्रकाश से सम्बन्धित ऊर्जा का क्वाण्टम ही होता है।
![]()
प्रश्न 12.
रदरफोर्ड के परमाणु मॉडल में क्या कमियाँ थीं?
उत्तर:
रदरफोर्ड परमाणु मॉडल की कमियाँ
(1) नील बोर ने बताया कि विद्युत चुम्बकीय सिद्धान्त के अनुसार ऋणावेशित इलेक्ट्रॉनों में गति के कारण लगातार ऊर्जा में क्षति होनी चाहिये, जिससे उनकी कक्षा की त्रिज्या लगातार कम होती जायेगी तथा अन्त में वे नाभिक में गिर जायेंगे। परन्तु ऐसा नहीं होता है। अतः रदरफोर्ड मॉडल परमाणु निकाय के स्थायित्व की व्याख्या नहीं कर सका।
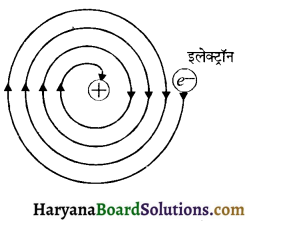
(2) यह सिद्धान्त यह नहीं बता पाया कि इलेक्ट्रॉन नाभिक के चारों ओर किस प्रकार व्यवस्थित होता है।
(3) रदरफोर्ड के मॉडल द्वारा परमाणु में उपस्थित इलेक्ट्रॉन तथा प्रोटॉन की संख्या की कोई जानकारी प्राप्त नहीं होती है।
(4) इस सिद्धान्त के अनुसार परमाणु स्पेक्ट्रम सतत् (Continuous ) होना चाहिये। परन्तु स्पेक्ट्रम में निश्चित आवृत्ति की कई रेखायें होती हैं। अतः रदरफोर्ड परमाणुओं के रैखिक स्पेक्ट्रम को नहीं समझा पाए।
प्रश्न 13.
सिद्ध करें कि इलेक्ट्रॉन एक सार्वत्रिक कण होता है।
उत्तर:
इलेक्ट्रॉन कैथोड किरणों के अवयव होते हैं। इन्हें विसर्जन नली के द्वारा प्राप्त किया जाता है। इसके अतिरिक्त इलेक्ट्रॉनों को प्राप्त करने के बहुत से अन्य स्रोत भी होते हैं। इसको प्राप्त करने के अन्य स्रोत निम्न प्रकार हैं-
- एक तप्त धात्विक तन्तु से।
- सक्रिय धातुओं; जैसे-सोडियम तथा पोटैशियम को पराबैंगनी किरणों के समक्ष लाने से।
- ß- किरणों के रूप में रेडियोऐक्टिव पदार्थों से।
चूँकि इलेक्ट्रॉन किसी भी स्रोत से प्राप्त किया गया हो, उसका द्रव्यमान, आवेश e/m आवेश समान रहता है। अत: इलेक्ट्रॉन को सार्वत्रिक कण (universal Particle) कहते हैं।
प्रश्न 14.
इलेक्ट्रॉन की द्वैत प्रकृति के बारे में डी-ब्रॉग्ली की विचारधरा लिखिए। इलेक्ट्रॉन के संवेग तथा तरंगदैर्ध्य में सम्बन्ध बताइए।
उत्तर:
डी – ब्रॉग्ली का इलेक्ट्रॉन की द्वैत प्रकृति का सिद्धान्त- डी- ब्रॉली ने सन् 1924 में बताया कि जब इलेक्ट्रॉन किरणपुंज को क्रिस्टलीय ठोस में से गुजारा जाता है, तो वह उसी प्रकार विवर्तित होता है जिस प्रकार प्रकाश किरणपुंज ग्रेटिंग से गुजरने पर विवर्तित होता है। ‘डी-ब्रॉली ने बताया कि इलेक्ट्रॉन दोहरी प्रकृति प्रदर्शित करता है। यह एक ही समय में कण एवं तरंग दोनों जैसा व्यवहार करता है।
आइन्सटीन के अनुसार,
E = mc² … (1)
यहाँ, m = पिण्ड का द्रव्यमान
c = वेग
प्लांक के अनुसार,
E = hv … (2)
यहाँ
h = प्लांक स्थिरांक
v = आवृत्ति
अतः समीकरण (1) व (2) से,
mc² = hv
mc² = h.\(\frac { c }{ λ }\)
mc = \(\frac { h }{ λ }\)
λ = \(\frac { h }{ mc }\) ∵(v = \(\frac { c }{ λ }\))
यदि फोटॉन की जगह और कोई कण हो तो,
λ = \(\frac { h }{ mv }\) (यहाँ = कण का वेग)
λ = \(\frac { h }{ p }\) (क्योंकि p = mv)
यही डी-ब्रॉग्ली समीकरण है।
प्रश्न 15.
हाइजेनबर्ग का अनिश्चितता का सिद्धान्त लिखिए।
उत्तर:
हाइजेनबर्ग का अनिश्चितता का सिद्धान्त (Heisenberg’s Uncertainity Principle): हाइजेनबर्ग ने सन् 1927 में द्वैत प्रकृति वाले कणों एवं विकिरणों के लिए अनिश्चितता का सिद्धान्त दिया। इस सिद्धान्त के अनुसार, “किसी भी कण की स्थिति (position) और संवेग (momentum) दोनों का एक साथ यथार्थ (exact ) निर्धारण असम्भव है।”
इस अनिश्चितता सिद्धान्त को गणितीय रूप में निम्नलिखित समीकरण द्वारा व्यक्त कर सकते है-
(∆p) (∆x) ≥ \(\frac { h }{ 4π }\) or ∆v ∆x ≥ \(\frac { h }{ 4πm }\)
यहाँ ∆p = किसी कण के संवेग की अनिश्चितता
∆x = किसी कण की स्थिति की अनिश्चितता
इस सिद्धान्त से स्पष्ट है कि यदि इलेक्ट्रॉन कण की स्थिति बिल्कुल ठीक-ठीक निर्धारित की जाती है तो उसके वेग में अनिश्चितता होगी और यदि इलेक्ट्रॉन तरंग का वेग बिल्कुल ठीक-ठीक निर्धारित किया जाता है, तो उसकी स्थिति में अनिश्चितता होगी।
प्रश्न 16.
डी-ब्रॉग्ली सम्बन्ध का क्या महत्व है?
उत्तर:
डी-ब्रॉग्ली सम्बन्ध का महत्व – इलेक्ट्रॉन के कोणीय संवेग \(\frac { h }{ 2π }\) का पूर्णांक गुणज क्यों होता है। बोर बरी इसे स्पष्ट नहीं कर पाये। परन्तु डी-ब्रॉग्ली के समीकरण mvr = \(\frac { nh }{ 2π }\) द्वारा इसे आसानी से समझा जा सकता है।
डी-ब्रॉली के अनुसार इलेक्ट्रॉन में तरंग का गुण विद्यमान रहता है। एक तरंग कला तभी रह सकती है जब उसकी परिधि तरंगदैर्ध्य λ की सरल गुणक हो।
अतः 2πr = nλ
r = कक्षा की त्रिज्या
n = 1, 2, 3, 4, ……. आदि
प्रश्न 17.
श्रोडिंगर का तरंग समीकरण क्या है? समझाइये।
उत्तर:
श्रोडिंगर का तरंग समीकरण- हाइजेनबर्ग के अनिश्चितता के सिद्धान्त एवं डी-ब्रॉग्ली की परिकल्पना के आधार पर श्रोडिंगर ने एक नया प्रतिरूप दिया। इस प्रतिरूप में इलेक्ट्रॉन के व्यवहार को एक तरंग समीकरण के रूप में प्रदर्शित किया गया है जिसे श्रोडिंगर समीकरण कहा गया।
\(\frac{\delta^2 \psi}{\delta x^2}+\frac{\delta^2 \psi}{\delta y^2}+\frac{\delta^2 \psi}{\delta z^2}+\frac{8 \pi^2 m}{h^2}(\mathrm{E}-\mathrm{V}) \psi\) = 0
यहाँ m = इलेक्ट्रॉन का द्रव्यमान
h = प्लांक नियतांक
E = इलेक्ट्रॉन की कुल ऊर्जा
V = इलेक्ट्रॉन की स्थितिज ऊर्जा
ψ = तरंग फलन (Wave function)
तथा x, y एवं z तीनों निर्देशांक हैं।
प्रश्न 18.
कक्ष एवं कक्षक में अन्तर बताइए।
उत्तर:
कक्ष एवं कक्षक में अन्तर:
| कक्ष (Orbit) | कक्षक (Orbital) |
| 1. इसकी अवधारणा बोर ने दी थी। | 1. यह तरंग यान्त्रिकी सिद्धान्त पर आधारित है। |
| 2. यह द्विविमीय पथ है जहाँ इलेक्ट्रॉन घूमते हैं। | 2. यह त्रिविमीय स्थान है जहाँ इलेक्ट्रॉन पाये जाने की सम्भावना सर्वाधिक होती है। |
| 3. कक्ष में इलेक्ट्रॉनों की अधिकतम संख्या 2n² होती है। | 3. कक्षक में केवल 2 इलेक्ट्रॉन पाये जाते हैं। |
| 4. कक्ष एक सुपरिभाषित वृत्ताकार मार्ग है। | 4. कक्षक की अवधारणा अनिश्चितता के सिद्धान्त पर आधारित है। |
| 5. कक्षों में दिशात्मक गुण नहीं होते हैं। | 5. s-कक्षक को छोड़कर सभी कक्षकों में दिशात्मक गुण होता है। |
प्रश्न 19.
हाइड्रोजन का स्पेक्ट्रम कैसे प्राप्त कर सकते हैं?
उत्तर:
हाइड्रोजन स्पेक्ट्रम, विसर्जन नली में अल्प दाब पर हाइड्रोजन गैस को नरकर, इसमें विद्युत विसर्जन प्रवाहित करके प्राप्त कर सकते हैं। इस प्रकार उत्सर्जित प्रकाश का विश्लेषण स्पेक्ट्रोस्कोप द्वारा ही सम्भव है। हाइड्रोजन स्पेक्ट्रम में निम्न श्रेणी प्राप्त होती हैं।
- लाइमन श्रेणी
- बामर श्रेणी
- पाश्चन श्रेणी
- ब्रेकेट श्रेणी
- फुण्ड श्रेणी।
प्रश्न 20.
पाउली के अपवर्जन नियम के अनुप्रयोग लिखिये।
उत्तर:
पाउली के अपवर्जन नियम के अनुप्रयोग निम्न प्रकार हैं।
- किसी भी मुख्य ऊर्जा स्तर में अधिकतम इलेक्ट्रॉनों की संख्या का मान 2n² होता है।
- किसी भी मुख्य ऊर्जा स्तर में उप-ऊर्जा स्तरों या उपकोश या सब-शैल (subshell) की कुल संख्या मुख्य ऊर्जा स्तर की मुख्य क्वान्टम संख्या ‘n’ के बराबर होती है।
- किसी मुख्य ऊर्जा स्तर में कुल कक्षकों की संख्या n² के बराबर होती है।
- एक कक्षक में दो इलेक्ट्रॉन होते हैं तथा इनका चक्रण विपरीत होता है।
प्रश्न 21.
इलेक्ट्रॉनों की द्वैत प्रकृति को स्पष्ट कीजिए।
उत्तर:
विभिन्न प्रयोगों द्वारा यह सिद्ध किया गया है कि परमाणु में चक्कर लगाने वाले इलेक्ट्रॉन में कण तथा तरंग दोनों के गुण व्यक्त करते हैं। इसकी पुष्टि निम्नलिखित तथ्यों द्वारा होती है।
(1) कैथोड किरणें (जिनमें केवल इलेक्ट्रॉन होते हैं) अपने मार्ग (पथ) में रखी हल्की वस्तु को चला सकती है। इससे सिद्ध होता है कि इलेक्ट्रॉनों में कण (Particle) के गुण होते हैं।
(2) प्रकाश किरणों की तरह इलेक्ट्रॉन किरण-पुंज भी विवर्तन (diffraction) और व्यतीकरण (interference) प्रक्रिया को प्रदर्शित करता है। इससे यह सिद्ध होता है कि इलेक्ट्रॉंनों में तरंग के गुण पाये जाते हैं। यह प्रयोग डेविसन तथा जर्मर (Davision and Germer) ने किया था। किसी भी एक प्रयोग द्वारा इलेक्ट्रॉनों के कण तथा तरंग प्रकृति को व्यक्त नहीं किया जा सकता हैं अतः इनमें कण तथा तरंग के गुणों को अलग-अलग प्रयोगों द्वारा ही व्यक्त किया जा सकता हैं।
प्रश्न 22.
वैद्युत चुम्बकीय तरंगें तथा द्रव्य तरंगों में अन्तर लिखें।
उत्तर:
| वैद्युत चुम्बकीय तरंगें | द्रव्य तरंगों |
| 1. सभी वैद्युत तरंगों का वेग प्रकाश के वेग के बराबर अर्थात् 3 x 108 ms-1 होता है। | 1. द्रव्य तरंगों का वेग प्रकाश के वेग से कम होता है। |
| 2. वैद्युत चुम्बकीय तरंगों की तरंगदैर्ध्य काफी अधिक होती है, और इसे निम्न सूत्र से व्यक्त करते हैं। λ = \(\frac { c }{ v }\) |
2. द्रव्य तरंगें अधिक छोटी तरंगदैर्ध्य की होती हैं। इनकी तरंगदैर्ध्य के मान को डी-ब्रॉग्ली सूत्र से व्यक्त करते हैं। λ = \(\frac { h }{ mv }\) |
| 3. इनकी ऊर्जाएँ क्वाण्टित होती हैं। | 3. इनकी ऊर्जाएँ क्वाण्टित नहीं होती हैं। |
| 4. इनकी तरंगदैर्ध्य स्पेक्ट्रम की सम्पूर्ण परास में होती है। | 4. इसकी तरंगदैर्ध्य बहुत ही अल्प होती है। |
| 5. सभी वैद्युत चुम्बकीय तरंगें समान वेग से गति करती है। | 5. द्रव्य तरंगें विभिन्न वेग से गति करती हैं। |
![]()
प्रश्न 23.
कण तथा तरंग में विभेद करें।
उत्तर:
| कण | तरंग |
| 1. कण स्थानीकृत होता है अर्थात् कोई कण पूर्ण परिभाषित स्थान ग्रहण करता है। | 1. ये स्थानीकृत नहीं होती हैं। अर्थात् से दिक् स्थान में फैली होती हैं। |
| 2. कोई भी दो कण दिक्स्थान में समान स्थान ग्रहण नहीं कर सकते। | 2. दो या दो से अधिक तरंगें दिक्स्थान में साथ-साथ रह सकती हैं। |
| 3. कणों को गिना जा सकता है। | 3. तरंगों को गिना नहीं जा सकता। |
| 4. यदि दो या दो से अधिक कण दिक् में समान क्षेत्र स्थान में उपस्थित हों तो उनका योग कणों की अलग-अलग संख्या के योग के बराबर होता है। | 4. दो या दो से अधिक तरंगें समान क्षेत्र में उपस्थित हों तो अध्यारोपण के कारण परिणामी तरंग वैयक्तिक तरंगों से या तो अधिक छोटी या फिर अधिक बड़ी हो सकती है। |
प्रश्न 24.
‘इलेक्ट्रॉन नाभिक में नहीं रह सकता।’ इस कथन पर टिप्पणी लिखिए।
उत्तर:
कोई इलेक्ट्रॉन नाभिक में नहीं रह सकता। यदि यह नाभिक में रह सकता तो इसके वेग में अनिश्चितता (∆v) का मान प्रकाश के वेग अर्थात् 3 x 108 ms-1 से कम होना चाहिये। अतः हम इलेक्ट्रॉन के वास्तविक ∆v की गणना करते हैं। यदि इलेक्ट्रॉन किसी नाभिक का हिस्सा हो तो, इसकी स्थिति में अनिश्चितता नाभिक के व्यास अर्थात् 10-15 से अधिक नहीं हो सकती। इलेक्ट्रॉन का द्रव्यमान 9.1 × 10-31 kg होता है अत:
∆x × ∆p = \(\frac { h }{ 4π }\)
Δx × m x Δν = \(\frac { h }{ 4π }\)
Δv = \(\frac{h}{4 \times \pi \times m \times \Delta x}\)
= \(\frac{6.6 \times 10^{-34} \mathrm{~kg} \mathrm{~m}^2 \mathrm{~s}^{-1}}{4 \times 3.14 \times\left(9 \cdot 1 \times 10^{-31} \mathrm{~kg}\right) \times\left(10^{-15} \mathrm{~m}\right)}\)
= 5.79 × 1010 ms1
चूँकि यह मान प्रकाश के वेग (3 x 108 ms-1) से बहुत अधिक है। इसका अर्थ है कि इलेक्ट्रॉन परमाणु के नाभिक में नहीं रह सकता है। अत: परमाणु में इलेक्ट्रॉन नाभिक से बाहर रहता है।
प्रश्न 25.
3s तथा 3p कक्षकों के नोडल तलों (Nodal Plane) को ज्ञात कीजिए।
उत्तर:
प्रत्येक कक्षक में दो प्रकार के नोडल तल होते हैं।
(i) कोणीय नोडल तल (Angular Nodal Plane) = l
(ii) वृत्तीय नोडल तल (Spherical Nodal Plane) = n – l – l
अत: कुल नोडल तल = l + (n – l – 1) = (n – 1)
3s कक्षकों के लिये
कोणीय नोडल तल = 0
वृत्तीय नोडल तल = 3 – 0 – 1 = 2
कुल नोडल तल = 0 + 2 = 2
3p-कक्षकों के लिये,
कोणीय नोडल तल = 1
वृत्तीय नोडल तल = 3 – 1 – 1 = 1
कुल नोडल तल = 1 + 1 = 2
प्रश्न 26.
एक तत्व के उदासीन परमाणु में 2K, 8L 10M तथा 2N इलेक्ट्रॉन हैं। इस तत्व के परमाणु में निम्न को ज्ञात करो।
(1) परमाणु क्रमांक
(2) कुल 5- इलेक्ट्रॉनों की संख्या
(3) कुल p-इलेक्ट्रॉनों की संख्या
(4) कुल d इलेक्ट्रॉनों की संख्या
(5) तत्व की संयोजकता
(6) अयुग्मित इलेक्ट्रॉनों की कुल संख्या।
उत्तर:
(1) परमाणु क्रमांक – इलेक्ट्रॉनों की संख्या (K + L + M + N कोश में)
= 22 + 8 + 10 + 2
= 22
(2) इलेक्ट्रॉनिक विन्यास = 1s², 2s², 2p6, 3s², 3p6 3d², 4s²
कुल s-इलेक्ट्रॉनों की संख्या = 2 + 2 + 2 + 2 = 8
(3) कुल p इलेक्ट्रॉनों की संख्या = 6 + 6 = 12
(4) कुल d-इलेक्ट्रॉनों की संख्या = 2
(5) तत्व की संयोजकता = + 2, + 3, + 4
(6) अयुग्मित इलेक्ट्रॉनों की संख्या = 2
प्रश्न 27.
निम्न परमाणु क्रमांक वाले तत्वों के पूर्ण इलेक्ट्रॉनिक विन्यास लिखें तथा इनका आवर्त सारणी में स्थान निर्धारित करें-
21, 24, 27
उत्तर:
(i) 21 → 1s², 2s², 2p6, 3s², 3P6, 3d1, 4s²
इसका आवर्त – IV है तथा वर्ग 3 (III B) है।
(ii) 24 → 1s², 2s², 2p6, 3s², 3p6, 3d5, 4s1
इसका आवर्त – IV है तथा वर्ग 6-(VI B) है।
(iii) 27 → 1s², 2s², 2p6, 3s², 3p6, 3d7, 4s²
इसका आवर्त – IV है तथा वर्ग-8 है।
प्रश्न 28.
निम्न क्वाण्टम संख्याओं की सहायता से कक्षकों के प्रतीक लिखिये।
(1) n = 3, l = 1 m = + 1
(2) n = 5, l = 2, m = – 1
उत्तर:
n, l तथा m के मान क्रमशः कोश, उपकोश तथा कक्षकों को व्यक्त करते हैं।
(1) n = 3 के लिये / 1 है तो यह p-उपकोश है।
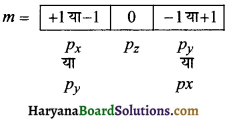
अतः प्रतीक 3px</sub< यां 3py
(2) n = 5 के लिये l = 2 अर्थात् (d-उपकोश)
अतः प्रतीक Sdyz या Sadxz
प्रश्न 29.
Sc (परमाणु क्रमांक 21) की मूल अवस्था (ground state) में अन्तिम इलेक्ट्रॉन के लिये चारों क्वाण्टम संख्याओं लिखिए।
उत्तर:
21Sc का इलेक्ट्रॉनिक विन्यास 1s², 2s², 2p6, 3s², 3p6, 3d1, 4s²
Sc के इलेक्ट्रॉनिक विन्यास में प्रयुक्त उपकोश में से 3d – उपकोश की ऊर्जा सबसे अधिक है। अतः अन्तिम इलेक्ट्रॉन 3d1 का होगा। 3d1 का अर्थ है कि तीसरे कोश की d-उपकोश में एक (1) इलेक्ट्रॉन है।
3d-उपकोश के लिये,

प्रश्न 30.
26Fe में d-ऑर्बिटल में उपस्थित छठे इलेक्ट्रॉन के लिये चारो क्वाण्टम संख्याओं के मान लिखें।
उत्तर:
Fe का इलेक्ट्रॉनिक विन्यास
Fe = 1s² 2s² 2p6 3s² 3p6 3d6 4s²
Fe-परमाणु के 3d – उपकोश में 6 – इलेक्ट्रॉन हैं।
अतः 3d उपकोश के लिये,
n = 3
l = 2
3d-उपकोश के लिये m तथा s के मान निम्न प्रकार निकाल सकते हैं।
m = – 2 या + 2
s = – \(\frac { 1 }{ 2 }\) या + \(\frac { 1 }{ 2 }\)
अर्थात् 3d6 के छठे इलेक्ट्रॉन के लिये,
n = 3, l = 2, m = – 2 या + 2
S = + \(\frac { 1 }{ 2 }\) या – \(\frac { 1 }{ 2 }\)
प्रश्न 31.
हाइड्रोजन परमाणु के 2s-कक्षक के लिए r के साथ त्रिज्य प्रायिकता घनत्व (R²) तथा त्रिज्य प्रायिकता फलन (4πr² R²) के परिवर्तन प्रदर्शित करने वाले वक्र खींचिए।
उत्तर:
हाइड्रोजन परमाणु के 2s – कक्षक के लिए r के साथ R² तथा 4πr²R² के परिवर्तन निम्नांकित चित्र में प्रदर्शित है-
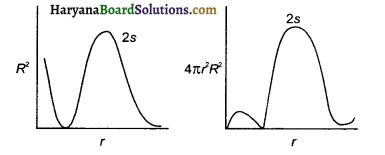
प्रश्न 32.
सत्य / असत्य बताइए।
(i) रदरफोर्ड के α-प्रकीर्णन प्रयोग ने सर्वप्रथम यह सिद्ध किया कि परमाणु में नाभिक होता है।
(ii) किसी परमाणु के नाभिक में इलेक्ट्रॉन व प्रोटॉन होते हैं।
(iii) H1 की अपेक्षा H² अधिक क्रियाशील है।
(iv) किसी तत्व के परमाणु तथा उसके एक परमाणुक आयन का परमाणु क्रमांक व परमाणु भार एक जैसा होता है।
(v) F– में इलेक्ट्रॉनों की संख्या Na+ से अधिक होती है।
(vi) किसी परमाणु के रासायनिक गुण उसके नाभिकीय आवेश के द्वारा निर्धारित होते हैं।
(vii) किसी परमाणु का वास्तविक द्रव्यमान उसमें उपस्थित इलेक्ट्रॉनों प्रोटॉनों व न्यूट्रॉनों के द्रव्यमानों के योग के बराबर होता है।
(viii) धन किरणें, ऐनोड से उत्पन्न होती हैं।-
(ix) भिन्न-भिन्न परमाणुओं से प्राप्त इलेक्ट्रॉनों का e/m अनुपात भिन्न होता है।
(x) किसी तत्व का मौलिक गुण परमाणु भार है न कि परमाणु क्रमांक।
उत्तर:
(i) सत्य
(ii) असत्य
(iii) असत्य
(iv) सत्य
(v) असत्य
(vi) असत्य
(vii) असत्य
(viii) असत्य
(ix) असत्य
(x) असत्य।
प्रश्न 33.
क्वाण्टम संख्याएँ किसे कहते हैं? ये कितने प्रकार की होती हैं? किसी परमाणु के कक्ष की आकृति तथा अभिविन्यास दर्शाने वाली क्वाण्टम संख्यायें आपस में किस प्रकार सम्बन्धित हैं? उदाहरण देकर समझाइये।
उत्तर:
क्वाण्टम संख्याएँ (Quantum Numbers) वे संख्याएँ जो किसी परमाणु में इलेक्ट्रॉनों की ऊर्जा व स्थिति का वर्णन करती हैं, क्वाण्टम संख्याएँ कहलाती हैं। क्वाण्टम संख्याएँ चार प्रकार की होती हैं-
1. मुख्य क्वाण्टम संख्या (Principal Quantum Number)—
मुख्य क्वाण्टम संख्या (n) इलेक्ट्रॉन के मुख्य ऊर्जा स्तर को प्रदर्शित करती है। किसी भी इलेक्ट्रॉन की ऊर्जा मुख्यतः n के मान पर निर्भर करती है। n का मान शून्य के
अतिरिक्त कोई भी पूर्णांक हो सकता है।
n के सम्भावित मान n = 1, 2, 3, 4, 5, …. ∞
n का मान इलेक्ट्रॉन कोश के आकार को निर्धारित करता है।
2. दिगंशी क्वाण्टम संख्या (Azimuthal Quantum Number ) –
दिगंशी क्वाण्टम संख्या l इलेक्ट्रॉन के उप ऊर्जा स्तर को प्रदर्शित करती है। l के मान मुख्य क्वाण्टम संख्या n पर निर्भर करते हैं। मुख्य क्वाण्टम संख्या n के लिए l के मान 0 से (n – 1) तक होते हैं।
l के सम्भावित मान l = 0 से (n – 1) तंक-
यदि n = 1, तो l = 0
n = 2, तो l = 0 और 1
n = 3, तो l = 0, 1, 2,
किसी n के लिए l के कुल मानों की संख्या n के बराबर होती हैं। l का मान उपकोशों की आकृति (shape) को निर्धारित करता है।
3. चुम्बकीय क्वाण्टम संख्या (Magnetic Quantum Number) – चुम्बकीय क्वाण्टम संख्या (m)-उप ऊर्जा स्तरों के आर्बिटलों को प्रदर्शित करती हैं। m के मान दिगंशी क्वाण्टम संख्या के मान पर निर्भर करते हैं। किसी l के लिए m के कुल मानों की संख्या (2l + l) होती है। अतः किसी उपकोश में आर्बिटलों की कुल संख्या (2l + 1) होती है।
m के सम्भावित मान m = – l से लेकर + l तक (शून्य सहित) –
यदि
l = 0 तो m = 0
l = 1, तो m = 1, 0, + 1
l = 2, m = – 2, – 1, 0, + 1, + 2
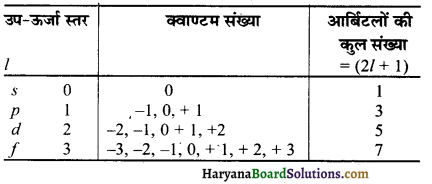
m का मान आर्बिटलों के अभिविन्यास (orientation) को निर्धारित करता है।
4. चक्रण क्वाण्टम संख्या (Spin Quantum Number) – यह क्वाण्टम संख्या इलेक्ट्रॉन के चक्रण की दिशा को प्रदर्शित करती है। किसी इलेक्ट्रॉन के चक्रण की दिशा दक्षिणावर्त (clockwise) या वामावर्त (anti-clock wise) हो सकती है। किसी m के लिए s का मान + \(\frac { 1 }{ 2 }\) और – \(\frac { 1 }{ 2 }\) होता है।
प्रश्न 34.
दिगंशी क्वाण्टम संख्या किसे कहते हैं? परमाणु की मुख्य क्वाण्टम संख्या तथा दिगंशी क्वाण्टम संख्या आपस में किस प्रकार सम्बन्धित हैं?
उत्तर:
दिगंशी क्वाण्टम संख्या (Azimuthal Quantum Number) – दिगंशी क्वाण्टम संख्या इलेक्ट्रॉन अक्ष की आकृति तथा उसके कोणीय संवेग (Angular momentum) को निर्धारित करती है। दिगंशी क्वाण्टम संख्या को l से प्रदर्शित करते हैं।
मुख्य क्वाण्टम संख्या (n) के लिए दिगंशी क्वाण्टम संख्या (l) के मान 0 से लेकर (n – 1) तक होते हैं। l के कुल मानों की संख्या n के बराबर होती है। उदाहरण-
n = 4 ∴ l = 0 से 3 (0, 1, 2, 3)
l का मान 0 1 2 3
उपकोश S P d f
किसी भी उपकोश में अधिकतम 2(2l + 1) इलेक्ट्रॉन हो सकते हैं तथा कक्षकों की संख्या (2l + 1) होते हैं।
प्रश्न 35.
(n + l) का नियम लिखिए। इस नियम के आधार पर विभिन्न कक्षकों की बढ़ती ऊर्जा का क्रम बताइये।
उत्तर:
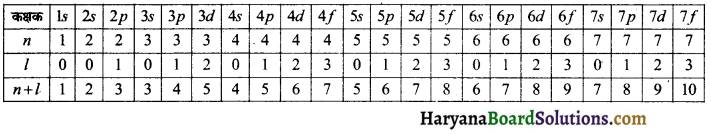
(n + l) का नियम-इस नियम के आधार पर विभिन्न कक्षकों की आपेक्षिक ऊर्जाओं की जानकारी प्राप्त होती है एवं इससे कक्षकों को भरने का क्रम निर्धारित होता है। ऊर्जा स्तरों एवं कक्षकों में इलेक्ट्रॉन उनकी ऊर्जा के अनुसार भरे जाते हैं। सर्वप्रथम निम्न ऊर्जा वाले कक्ष में इलेक्ट्रॉन भरे जाते हैं एवं इसके बाद उच्च ऊर्जा वाले कक्षक में इलेक्ट्रॉन भरे जाते हैं। यह नियम बोर – बरी ने दिया था।
इस नियम के अनुसार, “(n + l) का मान जिस कक्षक के लिए कम होता है, इलेक्ट्रॉन सर्वप्रथम उसी कक्षक में प्रवेश करता है।”
अत: इलेक्ट्रॉन उस कक्षक में पहले भरा जायेगा जिसके लिए (n + l) का मान न्यूनतम हो। यदि (n + l) का मान दो या अधिक कक्षकों के लिए समान है, तो नया इलेक्ट्रॉन उस कक्षक में प्रवेश करेगा जिसके लिए n का मान न्यूनतम हो। उदाहरण-3p कक्षक के लिए n = 3 तथा l = 1 होता है अत: (n + 1) = 3 + 1 = 4 होगा-
कक्षकों के लिए या उपकोशों के लिए ऊर्जा का क्रम इस प्रकार होगा ।
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p < 8s
प्रश्न 36.
(n + l) नियम की सहायता से निम्न प्रश्नों के उत्तर दें-
(a) निम्न ऑर्बिटलों को ऊर्जा के बढ़ते क्रम में व्यवस्थित करें।
(i) 1s, 2s, 3s, 2p
(ii) 4s, 3s, 3p, 4d
(iii) 5p, 4d, 5d, 4f, 6s
(iv) 5f, 6d, 7s, 7p
(b) निम्न में से किस ऑर्बिटल की ऊर्जा सबसे कम है?
4d, 4f, 5s, 5p
(c) निम्न में से किस ऑर्बिटल की ऊर्जा सर्वाधिक है?
5p, 5d, 5f, 6s, 6p
उत्तर:
(a) (i) 1s < 2s < 2p < 3s
(ii) 3s < 3p < 4s < 4d
(iii) 4d < 5p < 6s < 4f < 5d
(iv) 7s < 5f < 6d < 7p
(b) 5s की ऊर्जा सबसे कम है।
(c) 5f की ऊर्जा सर्वाधिक है।
आंकिक प्रश्न
प्रश्न 1.
एक तत्व का परमाणु क्रमांक 25 तथा द्रव्यमान 52 है। उसके नाभिक में न्यूट्रॉनों की संख्या ज्ञात कीजिए।
हल:
द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
52 = परमाणु क्रमांक + न्यूट्रॉनों की संख्या
52 = 25 + न्यूट्रॉनों की संख्या
न्यूट्रॉनों की संख्या = 52 – 25 = 27
प्रश्न 2.
\({ }_{17}^{36} \mathrm{Cl}\) में प्रोटॉनों, न्यूट्रॉनों तथा इलेक्ट्रॉनों की संख्या का परिकलन कीजिए।
हल:
\({ }_{17}^{36} \mathrm{Cl}\) में परमाणु क्रमांक = 17
द्रव्यमान संख्या =36
द्रव्यमान संख्या = परमाणु क्रमांक + न्यूट्रॉनों की संख्या
36 = 17 + न्यूट्रॉनों की संख्या
न्यूट्रॉनों की संख्या = 36 – 17 = 19
प्रोटॉनों की संख्या = इलेक्ट्रॉनों की संख्या = परमाणु क्रमांक = 17
प्रश्न 3.
समान परमाणु भार वाले दो तत्व X तथा Y के परमाणु क्रमांक क्रमश : 18 व 19 हैं। यदि X तत्व के नाभिक में 21 न्यूट्रॉन हैं तो तत्व Y में न्यूट्रॉनों की संख्या क्या होगी?
हल:
तत्व X तथा Y के परमाणु भार समान हैं अर्थात् ये समभारिक हैं।
परमाणु भार = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
या
परमाणु भार = परमाणु क्रमांक + न्यूट्रॉनों की संख्या
X तत्व के लिये,
परमाणु भार = परमाणु क्रमांक + न्यूट्रॉनों की संख्या
= 18 + 21
= 39
Y तत्व के लिये,
परमाणु भार परमाणु क्रमांक + न्यूट्रॉनों की संख्या
39 = 19 + न्यूट्रॉनों की संख्या
न्यूट्रॉनों की संख्या = 39 – 19
= 20
![]()
प्रश्न 4.
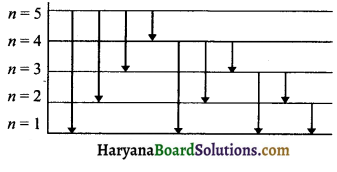
एक हाइड्रोजन परमाणु से इलेक्ट्रॉन पाँचवीं कक्षा से प्रथम कक्षा में कूदता है तो इसके स्पेक्ट्रम में कुल रेखाओं की कितनी संख्या प्राप्त होगी।
हल:
स्पेक्ट्रम में कुल रेखाओं की संख्या
= \(\frac{n(n-1)}{2}=\frac{5(5-1)}{2}\)
= \(\frac{5 \times 4}{2}\)
= 10
इन दस रेखाओं को निम्न प्रकार प्रदर्शित कर सकते हैं।
प्रश्न 5.
हाइड्रोजन परमाणु में n = 4 अवस्था से n = 2 अवस्था वाले संक्रमण के दौरान उत्सर्जित फोटॉन की आवृत्ति तथा तरंगदैर्ध्य की गणना कीजिए।
हल:
n2 = 4, n1 = 2
अतः इस संक्रमण से बामर श्रेणी में एक स्पेक्ट्रमी रेखा प्राप्त होती है।

प्रश्न 6.
Li2+ की प्रथम कक्षा से सम्बन्धित ऊर्जा की गणना कीजिए और बताइये इस कक्षा की त्रिज्या क्या होगी?
हल:

प्रश्न 7.
हाइड्रोजन परमाणु में एक इलेक्ट्रॉन चतुर्थ कक्ष से प्रथम कक्ष में कूदता है तो स्पेक्ट्रमी रेखा की आवृत्ति ज्ञात कीजिए।
हल:

प्रश्न 8.
निम्नलिखित सारणी को पूर्ण करें-
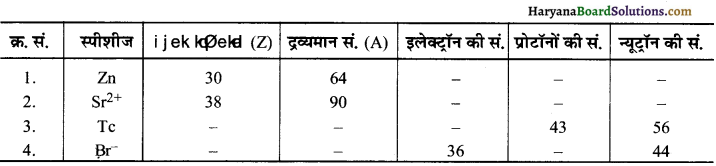
हल:
(1) Zn प्रोटॉनों की संख्या = परमाणु क्रमांक = 30
इलेक्ट्रॉन की संख्या = परमाणु क्रमांक = 30
न्यूट्रॉनों की संख्या = = द्रव्यमान सं. – परमाणु क्रमांक
= 64 – 30 = 34
(2) Sr2+ प्रोटॉनों की सं. = परमाणु क्रमांक = 38
इलेक्ट्रॉनों की सं. = परमाणु क्रमांक – 2
= 38 – 2
= 36
न्यूट्रॉनों की संख्या = द्रव्यमान सं. परमाणु क्रमांक
= 90 – 38 = 52
(3) Tc इलेक्ट्रॉन की सं. = प्रोटॉनों की सं. = 43
परमाणु क्रमांक = प्रोटॉनों की संख्या = 43
द्रव्यमान संख्या = प्रोटॉनों की सं. + न्यूट्रॉनों की संख्या
= 43 + 56
= 99
(4) Br– : Br में इलेक्ट्रॉनों की संख्या परमाणु क्रमांक से एक ज्यादा है।
परमाणु क्रमांक = इलेक्ट्रॉनों की संख्या – 1
= 36 – 1 = 35
प्रोटॉनों की संख्या = परमाणु क्रमांक = 35
द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
= 35 + 44
= 79
प्रश्न 9.
1eV ऊर्जा वाले फोटॉन की तरंगदैर्ध्य की गणना कीजिए।
उत्तर:
फोटॉन की ऊर्जा = lev
(E) = 1.602 × 10-19 J
प्लांक नियतांक (h) = 6.626 x 10-34 Js
प्रकाश का वेग = 3 x 108 m/s
E = hv
E = \(\frac { hc }{ λ }\)
λ = \(\frac { hc }{ E }\)
= \(\frac{6626 \times 10^{-34} \times 3 \times 10^8}{1.602 \times 10^{-19}}\)
λ = 12.41 × 107 m
λ = 12.41 × 10-7 x 1010 Å
= 12.41 × 10³ Å
प्रश्न 10.
वैद्युत चुम्बकीय विकिरणों की स्थिति में 1 = 6.24 x 1014 s-1 और v2 = 3.36 × 1014s-1 आवृत्तियों के संगत तरंगदैर्ध्य का अनुपात ज्ञात कीजिए।
हल:
चुम्बकीय विकिरण के लिये
λ = \(\frac{c}{v} \propto \frac{1}{v}\)
अतः
\(\frac{\lambda_1}{\lambda_2}=\frac{v_2}{v_1}\)
प्रश्नानुसार, v1 = 6.24 × 1014s-1
v2 = 3.36 × 1014s-1
\(\frac{\lambda_1}{\lambda_2}=\frac{3.36 \times 10^{14}}{6.24 \times 10^{14}}\)
\(\frac{\lambda_1}{\lambda_2}\) = 0.54
![]()
प्रश्न 11.
विकिरण के एक मोल फोटॉनों की ऊर्जा की गणना कीजिए, जिसकी आवृत्ति 5 x 1010s-1 है।
उत्तर:
एक फोटॉन की ऊर्जा (E) = hv
= 6.626 × 10-34 x 5 x 1010 J
= 33.13 × 10-24 J
एक मोल फोटॉनों की ऊर्जा
= एक फोटॉन की ऊर्जा आवोग्राद्रो संख्या
= 33.13 × 10-24 × 6.02 × 1023
= 19.93 J
प्रश्न 12.
नीले प्रकाश की तरंगदैर्ध्य 480 nm है। इस प्रकाश की आवृत्ति तथा तरंग संख्या ज्ञात कीजिये।
हल:
तरंगदैर्ध्य ( λ) = 480nm = 480 × 10-9 m

प्रश्न 13.
700 mm तरंगदैर्ध्य वाले प्रकाश के फोटॉन की ऊर्जा E हो तो 2E ऊर्जा वाले प्रकाश के फोटॉनों की तरंगदैर्ध्य क्या होगी ?
हल:
E = \(\frac { hc }{ λ }\) यहाँ hc नियतांक है तो
E ∝ \(\frac { 1 }{ λ }\) या E1λ1 = E2λ2
E1λ1 = E2λ2
E x 700 = 2E x λ2
λ = \(\frac { 700 }{ 2 }\)
= 350 nm
प्रश्न 14.
4000 Å तरंगदैर्ध्य का प्रकाश 2.0 eV कार्य फलन की धात्विक सतह पर डाला जाता है। ज्ञात कीजिये।
(i) फोटॉनों की ऊर्जा
(ii) फोटो इलेक्ट्रॉनों की गतिज ऊर्जा।
हल:
प्रकाश की तरंग दैर्ध्य (λ) = 4000 Å
= 4000 x 10-10 m = 4 × 10-7 m
कार्य फलन (h v0) = 2.0 ev
= 2.0 x 1.6 x 10-19 J
= 3.2 × 10-19 J
(i) फोटॉनों की ऊर्जा,
E = \(\frac{h c}{\lambda}\)
= \(\frac{6626 \times 10^{-34} \times 3 \times 10^8}{4 \times 10^{-7}}\)
= \(\frac{6626 \times 3 \times 10^{-34} \times 10^8}{4 \times 10^{-7}}\)
= 4.97 × 10-19 J
(ii) फोटो इलेक्ट्रॉनों की गतिज ऊर्जा,
hv = v0 = K.E.
\(\frac{h c}{\lambda}\) – v0 = K.E.
4.97 x 10-19 – 3.2 x 10-19 = K.E.
1.77 x 10-19 = K.E.
K.E. = 1.77 x 10-19 J
प्रश्न 15.
एक बल्ब 4500 Å की तरंगदैर्ध्य का प्रकाश उत्सर्जित करता है। यदि बल्ब 150 वॉट का है और उससे 8% ऊर्जा प्रकाश के रूप में उत्सर्जित होती है, तो प्रति सेकेण्ड में उत्सर्जित होने वाले फोटॉनों की संख्या ज्ञात कीजिये।
हल:
एक फोटॉन की ऊर्जा (E) = \(\frac { hc }{ λ }\)
यहाँ h = 6·626 × 10-34 J sec.
c = 3 x 108 m/sec
λ = 4500 Å = 4500 × 10-10 m
E = \(\frac { hc }{ λ }\)
E = \(\frac{6626 \times 10^{-34} \times 3 \times 10^8}{4500 \times 10^{-10}}\)
= 4.417 x 10-19 J
बल्ब के द्वारा उत्सर्जित ऊर्जा 150 x \(\frac { 8 }{ 100 }\)J
n x E = \(\frac { 150×8 }{ 100 }\)
n × 4.417 × 10-19 = \(\frac { 150×8 }{ 100 }\)
n = \(\frac{15 \times 8}{10 \times 4.417 \times 10^{-19}}\)
फोटॉनों की संख्या n = 27.17 x 1018
प्रश्न 16.
एक हाइड्रोजन परमाणु में इलेक्ट्रॉन की प्रथम बोर कक्षा में ऊर्जा – 13.12 x 105 J mol-1 है तो इलेक्ट्रॉन की तृतीय बोर कक्षा में उत्तेजित होने के लिये आवश्यक ऊर्जा की गणना कीजिए।
हल:
हम जानते हैं कि.
En = – \(\frac{13 \cdot 12 \times 10^5}{(n)^2}\) J mol-1
n = 1 के लिये,
E1 = – 13.12 x 105 J mol-1
n = 3 के लिये, E3 = \(\frac{-13.12 \times 10^5}{(3)^2}\) J mol-1
= \(\frac{-13.12 \times 10^5}{9}\)
= – 1.46 × 105 J mol-1
उत्तेजित होने के लिये आवश्यक ऊर्जा,
∆E = E3 – E1
= (- 1.46 x 105)-(-13.12 x 105)
= – 1.46 × 105 + 13.12 × 105
= 13.12 × 105 – 1.46 × 105
= (13.12 – 1.46) × 105
∆E = 11.66 × 105 J mol-1
प्रश्न 17.
N. T. P. परं 6.0 लीटर ऑक्सीजन में प्रोटॉनों का संख्या क्या होगी, जबकि केवल 0.16 समस्थानिकों का ही प्रयोग किया गया हो।
हल:
6.0 ली. ऑक्सीजन में अणुओं की संख्या ज्ञात करना,
22.4 ली. ऑक्सीजन में अणुओं की संख्या
= 6.02 × 1023
6.0 ली. ऑक्सीजन में अणुओं संख्या = \(\frac{6.02 \times 10^{23} \times 6.0}{22.4}\)
= 1.6125 × 1023
ऑक्सीजन परमाणुओं की संख्या
= 1.6125 × 1023 x 2
प्रत्येक ऑक्सीजन परमाणु में प्रोटॉनों की संख्या = 8
कुल प्रोटॉनों की संख्या
= 2 × 1.6125 × 8 × 1023
= 25.8 × 1023
प्रश्न 18.
105 वाट का एक बल्ब 400 nm वाली तरंगदैर्ध्य का एकवर्णी प्रकाश उत्सर्जित करता है। बल्ब द्वारा प्रति सेकेण्ड उत्सर्जित फोटॉनों की संख्या ज्ञात करें।
हल:
बल्ब की विद्युत शक्ति = 105 वॉट
= 105 जूल / सेकेण्ड
एक फोटॉन की ऊर्जा = E = hv
= \(\frac { hc }{ λ }\)
= \(\frac{6626 \times 10^{-34} \times 3 \times 10^8}{400 \times 10^{-9}}\)
= 4.969 × 10-19 J

प्रश्न 19.
यदि H-परमाणु के लिये किसी संक्रमण में 100 nim की तरंगदैर्ध्य निकलती है तो He+ परमाणु के लिये संगत संक्रमण की तरंगदैर्ध्य ज्ञात कीजिए।
हल:
H परमाणु के लिये
\(\frac{1}{\lambda_{\mathrm{H}}}=\mathrm{R}_{\mathrm{H}}\left[\frac{1}{\left(n_1^2\right)}-\frac{1}{\left(n_2^2\right)}\right]\) … (1)
He+ परमाणु के लिये
\(\frac{1}{\lambda_{\mathrm{He}^{+}}}=\mathrm{R}_{\mathrm{H}} \cdot \mathrm{Z}^2\left[\frac{1}{\left(n_1^2\right)}-\frac{1}{\left(n_2^2\right)}\right]\) … (2)
समीकरण (1) व (2) से में,
\(\lambda_{\mathrm{He}^{+}}=\frac{\lambda_{\mathrm{H}}}{\mathrm{Z}^2}\)
= \(\frac{100}{(2)^2}=\frac{100}{4}\)
= 25 nm
प्रश्न 20.
किसी तत्व के एक आयन में एक इलेक्ट्रॉन है। इस आयन की प्रथम बामर श्रेणी और प्रथम लाइमन श्रेणी के तरंगदैथ्यों का अन्तर 59.3 nm है। इस आयन का नाम बताइए।
उत्तर:
रिडबर्ग के अनुसार,
\(\frac{1}{\lambda}=\mathrm{R}_{\mathrm{H}}(Z)^2\left[\frac{1}{\left(n_1^2\right)}-\frac{1}{\left(n_2^2\right)}\right]\)
बामर श्रेणी की प्रथम लाइन लिये, n1 = 2, n2 = 3

दोनों तरंगदैयों का अन्तर 59.3 nm है।

अतः आयन Li2+ है।
प्रश्न 21.
जब 300 nm तरंगदैर्घ्य का विकिरण सोडियम धातु की सतह पर टकराता है तो 1.68 x 105 J mol-1 गतिज ऊर्जा वाले इलेक्ट्रॉन उत्सर्जित होते हैं सोडियम के इलेक्ट्रॉन के निष्कासन के लिए कम से कम कितनी ऊर्जा आवश्यक होगी? किसी प्रकाशित इलेक्ट्रॉन के उत्सर्जन के लिए अधिकतम तरंगदैर्ध्य क्या होगी?
हल:
फोटॉन की ऊर्जा (E) = hv = \(\frac { hc }{ λ }\)
∴ 300 nm (= 300 x 10-9 m) फोटॉन की ऊर्जा
= \(\frac{6.626 \times 10^{-34} \times 3 \times 10^8}{300 \times 10^{-9}}\)
E = 6.626 x 10-19 J
एक मोल फोटॉन की ऊर्जा
= 6.626 × 10-19 x 6.02 × 1023
= 3.99 x 105 J mol-1
सोडियम से एक मोल इलेक्ट्रॉनों के निष्कासन के लिए आवश्यक न्यूनतम ऊर्जा
= (3.991 – 1.68) x 105
= 2.31 × 105 J mol-1
एक इलेक्ट्रॉन के लिए आवश्यक न्यूनतम ऊर्जा
= \(\frac{2.31 \times 10^5}{6022 \times 10^{23}}\)
= 3.84×10-19 J
इसकी तरंगदैर्ध्य निम्नवत् होगी
λ = \(\frac { hC }{ E }\)
= \(\frac{6.626 \times 10^{-34} \times 30 \times 10^8}{3.84 \times 10^{-19}}\)
यह हरे रंग के प्रकाश से सम्बन्धित है।
![]()
प्रश्न 22.
एक कण की स्थिति व वेग में अनिश्चितता क्रमशः 10-2 मीटर व 5.27 x 10-24 मीटर सेकेण्ड है। इस कण के द्रव्यमान की गणना कीजिए।
उत्तर:
हाइजेनबर्ग के अनिश्चितता सिद्धान्त के नियमानुसार,

प्रश्न 23.
एक इलेक्ट्रॉन की स्थिति में अनिश्चितता ज्ञात करो, उसके वेग की अनिश्चितता का मान 5.7 x 107 सेमी प्रति सेकेण्ड है। इलेक्ट्रॉन का द्रव्यमान 9.1 × 10-28 ग्राम है।
उत्तर:

प्रश्न 24.
किसी इलेक्ट्रॉन की स्थिति और वेग में अनिश्चितता का गुणनफल ज्ञात कीजिए।
हल:
∆x, ∆v = \(\frac { h }{ 4π.m }\)
= \(\frac{6.626 \times 10^{-34}}{4 \times 3.14 \times 9.1 \times 9.1 \times 10^{-31}}\)
= 0.058 x 10-3
= 5.8 x 10-5 m² s-1
प्रश्न 25.
0.1 kg द्रव्यमान और 10 ms-1 वेग से गति कर रही एक गेंद की तरंगदैर्ध्य क्या होगी?
हल:
डी-ब्रॉग्ली समीकरण के अनुसार,
λ = \(\frac { h }{ mv }\)
= \(\frac{6.626 \times 10^{-34}}{0.1 \times 10}\)
λ = 6.626 × 10-34 m
प्रश्न 26.
एक इलेक्ट्रॉन का द्रव्यमान 9.1 x 10-31 kg है। यदि इसकी गतिज ऊर्जा 3.0 x 10-25 J है तो इसकी तरंगदैर्ध्य क्या होगी?
हल:

प्रश्न 27.
एक गेंद का द्रव्यमान 50g तथा गति 45 ms-1 है। यदि गति को 2% यथार्थता के अन्दर मापा जा सकता है तो इसकी स्थिति में अनिश्चितता की गणना कीजिए।
हल:
गति में 2% की अनिश्चितता,
= \(\frac { 45×2 }{ 100 }\)
= ∆v = 0.9 m/s
अनिश्चितता के सिद्धान्त के अनुसार,
∆x. m. ∆v = \(\frac { h }{ 4π }\)
∆x = \(\frac{h}{m . \Delta v \cdot 4 \pi}\)
यदि
h = 6.626 × 10-34. Js
m = 50g = 50 x 10-3 kg
= \(\frac{6.626 \times 10^{-34}}{50 \times 1 \times 4 \times 3.14 \times 10^{-3}}\)
= 0.0105 x 10-31
∆x = 1.05 x 10-33 m
प्रश्न 28.
बोर इलेक्ट्रॉन द्वारा अपनी तीसरी कक्षा में एक पूरे चक्कर में निर्मित तरंगों की संख्या ज्ञात कीजिए।
हल:
हम जानते हैं कि

यहाँ mv कोणीय संवेग है।
इस प्रकार बोर की तीसरी कक्षा के लिये कोणीय संवेग निम्न प्रकार है, (n = 3)
mvr = \(\frac { nh }{ 2π }\) = \(\frac { 3h }{ 2π }\) … (ii)
(mvr) का मान समीकरण (i) में रखने पर,
तरंगों की संख्या = \(\frac { 2π }{ h }\)(\(\frac { 3h }{ 2π }\))
तरंगों की संख्या = 3
अतः बोर की तीसरी कक्षा में तरंगों की संख्या = 3
प्रश्न 29.
उस इलेक्ट्रॉन की डी-ब्रॉग्ली तरंगदैर्ध्य की गणना कीजिए जिसका वेग प्रकाश के वेग के 1% के बराबर हो।
हल:
डी-ब्रॉग्ली के अनुसार,
λ = \(\frac { h }{ mv }\)
यहाँ
m = 9.1 × 10-31 kg
h = 6.626 × 10-34 J.s
इलेक्ट्रॉन का वेग (∆v) = प्रकाश के वेग का 1%
= \(\frac{3 \times 10^8 \times 1}{100}\)
= 3 × 108 × 0.1
= 3 x 106 ms-1
इलेक्ट्रॉन की तरंगदैर्ध्य (λ) = \(\frac { h }{ mv }\)
= \(\frac{6.626 \times 10^{-34}}{9.1 \times 10^{-31} \times 3 \times 10^6}\)
∆v = 2.43 x 10-10 m
प्रश्न 30.
100 g द्रव्यमान की एक बेस बॉल 3 x 10² cm s-1 के वेग से गतिमान है, यदि बेसबॉल की स्थिति को उस त्रुटी के अन्तर्गत मानें जो प्रयुक्त प्रकाश की तरंगदैर्ध्य (2000 Å) के परिमाण के तुल्य हो तो संवेग में अनिश्चितता की तुलना बेसबॉल के सम्पूर्ण संवेग से किस प्रकार की जा सकती है?
हल:
हम जानते हैं कि,
∆x. ∆p = \(\frac { h }{ 4π }\)
∆p = \(\frac{h}{4 \pi \times \Delta x}\)
∆p = \(\frac{6.626 \times 10^{-34}}{4 \times 3.14 \times 2000 \times 10^{-10}}\)
∆p = 0.264 x 10-27
= 2.64 × 10-28 kg ms-1
\(\frac { ∆p }{ p }\) की गणना दिया है
m = 100g = 100 x 10-3 kg.
v = 3 x 10² cm s-1
= 3 ms-1
संवेग (p) = m.v.
= 100 × 10-3 x 3
= 300 x 10-3 kg ms-1
\(\frac { ∆p }{ p }\) = \(\frac{264 \times 10^{-28}}{300 \times 10^{-3}}\)
= \(\frac{2.64 \times 10^{-28}}{0.3}\)
= 8.8 × 10-28
प्रश्न 31.
एक इलेक्ट्रॉन का वेग 30 ms-1 है जो कि 98.99% तक शुद्ध है। इसकी स्थिति ज्ञात करने में क्या अनिश्चितता होगी?
हल:
∆x. m ∆v = \(\frac { h }{ 4π }\)
∆x = \(\frac{h}{4 \pi \cdot m \cdot \Delta v}\)
दिया है, h = 6.626 × 10-34 J.s.
m = 9.1 × 10-31 kg

प्रश्न 32.
एक इलेक्ट्रॉन पुंज का विवर्तन क्रिस्टल के द्वारा हो सकता है। इलेक्ट्रॉन पुंज किस विभव की ली जाए कि उसकी तरंगदैर्ध्य का मान 1.54 Å हो जाये।
हल:
एक इलेक्ट्रॉन के लिये,

प्रश्न 33.
परमाणु क्रमांक, 34, 24 तथा 36 वाले परमाणुओं के लिये कुल स्पिन ज्ञात कीजिए।
हल:
परमाणु क्रमांक 34, 24 तथा 36 वाले परमाणुओं का इलेक्ट्रॉनिक विन्यास
34Se = 1s², 2s², 2p6, 3s², 3p6, 3d10, 4s², 4p4
(अयुग्मित इलेक्ट्रॉन) = 2
24Cr = 1s², 2s², 2p6, 3s², 3p6, 3d5, 4s1
(अयुग्मित इलेक्ट्रॉन) = 6
36Kr = 1s², 2s², 2p6, 3s², 3p6, 3d10, 4s², 4p6
(अयुग्मित इलेक्ट्रॉन) = 0
कुल स्पिन = ± \(\frac { 1 }{ 2 }\)x अयुग्मित इलेक्ट्रॉन की संख्या
34Se के लिये कुल स्पिन = ± \(\frac { 1 }{ 2 }\) × 2 = ± 1
24Cr के लिये कुल स्पिन = ± \(\frac { 1 }{ 2 }\) x 6 = ± 3
36Kr के लिये कुल स्पिन = ± \(\frac { 1 }{ 2 }\) x 0 = 0