Haryana State Board HBSE 11th Class Chemistry Important Questions Chapter 4 रासायनिक आबंधन तथा आण्विक संरचना Important Questions and Answers.
Haryana Board 11th Class Chemistry Important Questions Chapter 4 रासायनिक आबंधन तथा आण्विक संरचना
बहुविकल्पीय प्रश्न
1. सोडियम क्लोराइड के क्रिस्टल में हैं-
(1) सोडियम क्लोराइड अणु
(2) सोडियम और क्लोरीन परमाणु
(3) सोडियम आयन और क्लोराइड आयन
(4) (1) और (2) दोनों।
उत्तर:
(3) सोडियम आयन और क्लोराइड आयन
2. निम्न यौगिकों में वैद्युत संयोजक यौगिक कौन-सा है?
(1) HCl
(2) NH4Cl
(3) BCl3
(4) AlCl3 (निर्जल)।
उत्तर:
(2) NH4Cl
3. निम्न में से कौन-सा यौगिक अष्टक नियम का पालन नहीं करता है-
(1) कार्बन टेट्राक्लोराइड
(2) फॉस्फोरस पेन्टाक्लोराइड
(3) कैल्सियम ऑक्साइड
(4) बेरियम नाइट्रेट
उत्तर:
(2) फॉस्फोरस पेन्टाक्लोराइड
4. निम्न अणुओं में लुइस अम्ल कौन-सा है-
(1) CCl4
(2) BCl3
(3) PCl5
(4) NCl3
उत्तर:
(2) BCl3.
5. HE, HCl, HBr और HI के क्वथनांकों का सही क्रम है..
(1) HF > HCl > HBr > HI
(2) HI > HBr > HCl > HF
(3) HF >HI > HBr > HCl
(4) HCl > HBr > HI > HF
उत्तर:
(3) HF >HI > HBr > HCl
6. कार्बन, सिलिकन, मैग्नीशियम और ऐलुमिनियम के क्लोराइडों में उच्चतम गलनांक किस तत्व के क्लोराइड का है-
(1) C
(2) Si
(3) Mg
(4) Al
उत्तर:
(3) Mg
![]()
7. निम्न अणुओं में विषम इलेक्ट्रॉन अणु चुनिए-
(1) B2H6
(2) O2
(3) CO
(4) NO
उत्तर:
(4) NO
8. निम्न में से कौन-सा अणु अनुचुम्बकीय है-
(1) N2
(2) O2
(3) F2
(4) D2
उत्तर:
(2) O2
9. निम्न में से नाइट्रोजन अणु का सम इलेक्ट्रॉनी अणु कौन-सा है-
(1) NO
(2) CO
(3) H2O
(4) HCl
उत्तर:
(2) CO
10. निम्नलिखित में से किसमें आयनिक बन्ध है-
(1) CHCl3
(2) O2
(3) BaCl2
(4) CCl4
उत्तर:
(3) BaCl2
11. किस यौगिक में द्विध्रुव आघूर्ण शून्य होता है-
(1) CIF
(2) PCl3
(3) SiCl4
(4) CHCl3
उत्तर:
(3) SiCl4
12. वह यौगिक जिसमें ऋणायन आकार तथा धनायन आकार अनुपात न्यूनतम है।
(1) CsI
(2) Lil
(3) LiF
(4) CsF
उत्तर:
(4) CsF
13. वह अणु जिसमें एक अयुग्मित इलेक्ट्रॉन है-
(1) CO
(2) NO
(3) O2
(4) CsF.
उत्तर:
(2) NO
14. निम्नलिखित में से सर्वाधिक आयनिक गुणों से युक्त यौगिक है-
(1) HCl
(2) HBr
(3) HF
(4) HI.
उत्तर:
(3) HF
15. निम्नलिखित में से किस अणु पर अष्टक का नियम लागू नहीं होता-
(1) CO2
(2) H2O
(3) O2
(4) CO.
उत्तर:
(2) H2O
16. किस यौगिक में सर्वाधिक द्विध्रुव आघूर्ण होता है-
(1) CH3Cl
(2) CCl4
(3) CHCl3
(4) CH2Cl2
उत्तर:
(1) CH3Cl
17. कौन-सा बन्ध सबसे अधिक ध्रुवीय है
(1) Cl – F
(2) Br – F
(3) 1 – F
(4) F – F
उत्तर:
(3) 1 – F
18. किस बन्ध की बन्ध ऊर्जा अधिकतम होगी-
(1) आयनिक बन्ध
(2) सहसंयोजी बन्ध
(3) धात्विक बन्ध
(4) हाइड्रोजन बन्ध
उत्तर:
(1) आयनिक बन्ध
19. सह-संयोजक अणुओं का क्रिस्टल संरचना में होने का कारण है-
(1) द्विध्रुव द्विध्रुव आकर्षण
(2) स्थिर वैद्युत आकर्षण
(3) हाइड्रोजन
(4) वाण्डर वाल्स आकर्षण।
उत्तर:
(4) वाण्डर वाल्स आकर्षण।
20. निम्नलिखित में से कौन परिवर्तित संयोजकता दिखाता है-
(1) H
(2) Na
(3) Fe
(4) O.
उत्तर:
(3) Fe
![]()
21. सहसंयोजक बन्ध में ध्रुवता का कारण है-
(1) इलेक्ट्रॉन बन्धुता
(2) आयनन विभव
(3) विद्युत ऋणात्मकता
(4) परमाण्वीय आकार।
उत्तर:
(3) विद्युत ऋणात्मकता
22. BCl3 अणु समतलीय है क्योंकि इस अणु में बोरॉन है-
(1) sp³ – संकरित
(2) sp² – संकरित
(3) sp – संकरित
(4) संकरित नहीं है।
उत्तर:
(2) sp² – संकरित
23. निम्न में से कौन-सा अणु मुडी हुई आकृति का है-
(1) CO2
(2) O3
(3) N2O
(4) उपरोक्त में से कोई नहीं
उत्तर:
(2) O3
24. PCl5 अणु निम्नलिखित संकरण का परिणाम है-
(1) sp²d²
(2) sp³d
(3) spd³
(4) sp²d³
उत्तर:
(2) sp³d
25. किस अणु में अयुग्मित इलेक्ट्रॉन है-
(1) NO
(2) CN–
(3) O2
(4) CO
उत्तर:
(1) NO
26. निम्न में से किसकी संरचना रेखीय नहीं है–
(1) BeCl2
(2) SO2
(3) C2H2
(4) CO2.
उत्तर:
(2) SO2
27. NH3 का क्वथनांक PH3 की तुलना में अधिक होता है, क्योंकि
(1) NH3 का अणु भार अधिक है।
(2) NH3 में छाता प्रतिलोमन होता है।
(3) NH3 में आयनिक बन्ध है जबकि PH3 में सहसंयोजक बन्ध है।
(4) NH3 हाइड्रोजन बन्ध बनाता है।
उत्तर:
(4) NH3 हाइड्रोजन बन्ध बनाता है।
28. नाइट्रोजन अणु (N ≡ N) में नाइट्रोजन परमाणुओं के मध्य स्थित त्रिबन्ध में होते हैं-
(1) तीन σ-बन्ध
(2) दो σ-बन्ध तथा एक π बन्ध
(3) एक σ-बन्ध तथा दो π- बन्ध
(4) दो π-प्रबन्ध
उत्तर:
(3) एक σ-बन्ध तथा दो π- बन्ध
29. p – p कक्षक का अतिव्यापन निम्न में से किस अणु में उपस्थित हैं-
(1) हाइड्रोजन
(2) क्लोरीन
(3) हाइड्रोजन क्लोराइड
(4) हाइड्रोजन ब्रोमाइड।
उत्तर:
(2) क्लोरीन
30. बर्फ में एक जल के अणु द्वारा बनने वाले अधिकतम हाइड्रोजन बन्धों की संख्या है-
(1) 4
(2) 3
(3) 2
(4) 1.
उत्तर:
(1) 4
31. H – C ≡ C – CH = CH2 में C – C एकल बन्ध के कार्बन परमाणुओं का संकरण है-
(1) sp³ – sp³
(2) sp² – sp²
(3) sp – sp²
(4) sp³ – sp.
उत्तर:
(3) sp – sp²
32. BF3 में केन्द्रीय परमाणु की ज्यामिति व ऑर्बिटल के संकरण का प्रकार है-
(1) रेखीय, sp
(2) समतल त्रिकोणीय, sp²
(3) चतुष्फलीय, sp³
(4) पिरैमिडी, sp³.
उत्तर:
(2) समतल त्रिकोणीय, sp²
33. निम्न में से कौन-से अणु के केन्द्रीय परमाणु में sp²- संकरण होता है-
(1) BeF2
(2) BCl3
(3) C2H2
(4) NH3
उत्तर:
(2) BCl3
34. NO2– में नाइट्रोजन ऑक्सीजन बन्ध कोटि है-
(1) 1
(2) 1.33
(3) 1.5
(4) 2.
उत्तर:
(3) 1.5
35. CH3CHCCH2 अणु में क्रमश: C – 1 और C – 2 कार्बन परमाणुओं पर किस प्रकार का संकरण है?
(1) sp², sp
(2) sp³, sp²
(3) sp², sp²
(4) sp², sp³.
उत्तर:
(1) sp², sp
36. निम्न अणुओं में से किस अणु के केन्द्रीय परमाणु पर sp³ संकरण है-
(1) CO2
(2) SO2
(3) H2O
(4) N2O.
उत्तर:
(3) H2O
37. निम्न में से कौन-सा लूइस क्षारक है-
(1) BF3
(2) CH4
(3) H2O
(4) SiCl4.
उत्तर:
(3) H2O
38. SF में सल्फर पर संकरण है-
(1) sp
(2) sp²
(3) sp³d
(4) dsp².
उत्तर:
(3) sp³d
अति लघु उत्तरीय प्रश्न
प्रश्न 1.
NaCl अथवा KCl विद्युत संयोजी हैं, क्यों?
उत्तर:
क्योंकि क्षार धातुओं (Na अथवा K) तथा Cl की विद्युत ऋणात्मकता में आयनिक बन्ध बनने के लिये पर्याप्त अन्तर होता है।
प्रश्न 2.
उस यौगिक का सूत्र लिखो जिसमें अष्टक प्रसार होता है।
उत्तर:
PCl5
प्रश्न 3.
BeCl2, MgCl2, CaCl2 को सहसंयोजक गुणों में वृद्धि के क्रम में लिखो-
उत्तर:
CaCl2 < MgCl2 < BeCl2
प्रश्न 4.
अमोनिया एक सह-संयोजी यौगिक है, इसे जल में घोलने पर प्राप्त विलयन विद्युत का सुचालक है। क्यों?
उत्तर:
NH3+ H2O → NH4OH
NH4OH → NH4+ + OH–
अमोनिया के जलीय विलयन में NH4 तथा OH– आयन प्राप्त होने से यह विलयन विद्युत का सुचालक है।
प्रश्न 5.
PF5 होता है NF5 नहीं होता है, क्यों?
उत्तर:
N में रिक्त d कक्षक अनुपस्थित होने के कारण इसमें अष्टक का प्रसार नहीं हो पाता है अत: NF नहीं पाया जाता है।
प्रश्न 6.
उन दो अणुओं के सूत्र लिखिये जिनमें अष्टक प्रसार होता है।
उत्तर:
PCI5 तथा SF6
![]()
प्रश्न 7.
H2S रेखीय नहीं है जबकि BeH2 रेखीय है क्यों?
उत्तर:
H2S में s-परमाणु पर एकाकी इलेक्ट्रॉन युग्म की उपस्थि के कारण इसकी संरचना रेखीय नहीं होती है जबकि BeH2 में Be-परमाणु पर कोई एकाकी इलेक्ट्रॉन युग्म नहीं होता है अतः इसकी संरचना रेखीय होती है।
प्रश्न 8.
हाइड्रोजन तथा क्लोरीन की सहसंयोजक त्रिज्यायें क्रमशः 0.37Å तथा 0.99Å हैं। गैसीय HCl की आबन्ध लम्बाई बताएँ।
उत्तर:
बन्ध लम्बाई (0.37 + 0.99)/2
= 0.68 Å
प्रश्न 9.
BeCl2 का गलनांक BaCl2 से कम क्यों है?
उत्तर:
BeCl2 सहसंयोजक यौगिक है जबकि BaCl2 यौगिक आयनिक है। अतः BeCl2 का गलनांक कम होता है।
प्रश्न 10.
द्विध्रुव आघूर्ण क्या होता है?
उत्तर:
किसी ध्रुवित सहसंयोजक यौगिकों के दोनों ध्रुवों के मध्य की दूरी का एक ध्रुव के आवेश से गुणा करने पर प्राप्त मान द्विध्रुव आघूर्ण कहलाता है। यह एक सदिश राशि है।
द्विध्रुव आघूर्ण (μ) = d x q यहाँ d = दूरी, q = आवेश
प्रश्न 11.
दो धनायन तथा दो ऋणायन बताइये जिनकी इलेक्ट्रॉनिक संरचनाएँ Ne के समान हों।
उत्तर:
धनायन – Na+ तथा Mg2+
ऋणायन – F– तथा O2-
प्रश्न 12.
ठोस NaCl विद्युत का अचालक क्यों है?
उत्तर:
ठोस NaCl में Na+ तथा Cl– गतिमान नहीं हो पाते हैं। जिससे इनमें विद्युत का प्रवाह नहीं हो पाता है।
प्रश्न 13.
संयोजकता इलेक्ट्रॉन क्या है?
उत्तर:
तत्व के परमाणु के बाह्य कोश में उपस्थित इलेक्ट्रॉनों को उस परमाणु के संयोजकता इलेक्ट्रॉन कहते हैं। ये संयोजन अभिक्रिया में भाग लेते हैं।
प्रश्न 14.
आयनिक तथा सहसंयोजी यौगिकों में किसके गलनांक व क्वथनांक ऊँचे होते हैं तथा क्यों ?
उत्तर:
आयनिक यौगिकों के क्योंकि आयनिक यौगिकों में आयनों के बीच शक्तिशाली विद्युत स्थैतिक बल कार्य करते हैं।
प्रश्न 15.
विद्युत संयोजी यौगिक अवाष्पशील क्रिस्टलीय ठोस होते हैं क्यों?
उत्तर:
क्योंकि विद्युत संयोजी यौगिकों में आयनों के बीच शक्तिशाली विद्युत संयोजी बल होते हैं।
प्रश्न 16.
एकल बन्ध यौगिकों की अपेक्षा द्विबन्ध के यौगिक अधिक क्रियाशील होते हैं, क्यों?
उत्तर:
द्विबन्ध में π – बन्ध होता है जिसकी बन्धन ऊर्जा कम होती है, अतः यह अधिक क्रियाशील होते हैं।
प्रश्न 17.
ठोस सोडियम धातु में विद्युत प्रवाहित हो जाती है जबकि ठोस NaCl विद्युत कुचालक है, क्यों?
उत्तर:-
सोडियम धातु में गतिशील इलेक्ट्रॉन (mobile electrons) होते हैं जबकि ठोस NaCl में आयन गतिशील नहीं होते अतः यह विद्युत कुचालक है।
प्रश्न 18.
वैद्युत संयोजी यौगिकों का आयनन शीघ्र होता है क्यों?
उत्तर:
वैद्युत संयोजी यौगिकों के आयन वैद्युत स्थैतिक बलों के द्वारा बँधे रहते हैं। ध्रुवीय विलायक जब आयनों के बीच में आ जाता है तो विद्युत संयोजी बल क्षीण हो जाते हैं जिससे ये यौगिक आयनित हो जाते हैं।
प्रश्न 19.
निर्जल HCl विद्युत का कुचालक होता है जबकि जलीय HCl विद्युत का सुचालक होता है, क्यों ?
उत्तर:
जल की उपस्थिति में HCl का वियोजन H+ व Cl– में हो जाता है जबकि निर्जल HCl सहसंयोजी यौगिक है।
प्रश्न 20.
BaO तथा MgO में से किसका गलनांक उच्च होता है।
उत्तर:
BaO का गलनांक उच्च होता है क्योंकि BaO अधिक आयनिक है।
प्रश्न 21.
जल आयनिक यौगिकों के लिये एक अच्छा विलायक है, क्यों?
उत्तर:
जल का परावैद्युत स्थिरांक उच्च (81) होता है।
प्रश्न 22.
CHF का द्विध्रुव आघूर्ण CH3Cl` से ज्यादा होता है, क्यों?
उत्तर:
C-F बन्ध का द्विध्रुव आघूर्ण C-Cl बंध से अधिक होता है क्योंकि F की विद्युत ऋणात्मकता Cl से अधिक है।
प्रश्न 23.
LiCl कार्बनिक विलायकों में विलेय है, क्यों?
उत्तर:
LiCl में सहसंयोजी गुण होते हैं इसलिये यह कार्बनिक विलायकों में विलेय होता है।
प्रश्न 24.
Mg+ आयन नहीं बनता है जबकि Mg 2+ आयन बनता है, क्यों ?
उत्तर:
Mg+ की तुलना में Mg2+ स्थायी है क्योंकि इसका विन्यास उत्कृष्ट गैसों के समान होता है तथा इसके बाह्य कोश में आठ इलेक्ट्रॉन (स्थायी विन्यास) होते हैं।
प्रश्न 25.
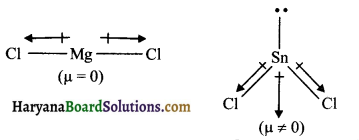
MgCl2 का द्विध्रुव आघूर्ण शून्य है जबकि SnCl2 का द्विध्रुव आघूर्ण शून्य नहीं होता है क्यों?
उत्तर:
MgCl2 में कोई भी एकाकी इलेक्ट्रॉन युग्म नहीं होता है। इस कारण इसकी आकृति रेखीय होती है। यहाँ पर कुल द्विध्रुव आघूर्ण शून्य हो जाता है। जबकि SnCl2 में एक एकाकी इलेक्ट्रॉन युग्म होने के कारण आकृति मुड़ी हुयी होती है तथा इस कारण कुल द्विध्रुव आघूर्ण शून्य नहीं हो पाता है।
प्रश्न 26.
AlCl3 सह संयोजी होता है, जबकि AlF3 आयनिक होता है क्यों?
उत्तर:
Cl– आयन F– से बड़ा है अतः फैजान के नियमानुसार बड़े ऋणायन की आकृति धनायन के प्रभाव में अधिक विकृत होती है अतः इसमें सहसंयोजी गुण आ जाता है। इस कारण AlCl3 सहसंयोजी जबकि AlF3, आयनिक होते हैं।
प्रश्न 27.
BeCl2 सहसंयोजी है जबकि BaCl2 आयनिक, क्यों?
उत्तर:
Ba+ आयन Be2+ आयन से बड़ा है। अतः फौजान के ‘नियमानुसार छोटे धनयन की आकृति ऋणायन के प्रभाव में अधिक विकृत होती है। अतः सहसंयोजी गुण आ जाता है। इस कारण BeCl2 सहसंयोजी जबकि BaCl2 आयनिक है।
प्रश्न 28.
H परमाणु H2 अणु बनाता है जबकि He2 ज्ञात नहीं है, क्यों?
उत्तर:
H-परमाणु का बाह्य कक्षक अपूर्ण (1 इलेक्ट्रॉन) होता है जबकि He – परमाणु का बाह्य कक्षक पूर्ण (2 इलेक्ट्रॉन) होता है। इस कारण H2 ज्ञात है He2 नहीं।
प्रश्न 29.
MgCl2, AlCl3, BeCl2 तथा CCl4 को बढ़ते आयनिक लक्षण के क्रम में लिखें।
उत्तर:
CCl4 < AlCl3 < BeCl2 < MgCl2 (आयनिक लक्षण)
प्रश्न 30.
सूखी बर्फ (dry Ice) क्या है। यह किस प्रकार का ठोस है।
उत्तर:
सूखी बर्फ CO2(s) को कहते हैं। यह एक आण्विक ठोस है।
प्रश्न 31.
त्रिकेन्द्रीय द्वि-इलेक्ट्रॉन बन्ध रखने वाले अणु का सूत्र लिखो।
उत्तर:
B2H6(बोरेन)
![]()
प्रश्न 32.
NaCl तथा CuCl में कौन अधिक सहसंयोजी है।
उत्तर:
CuCl अधिक सहसंयोजी है। यद्यपि Na+, Cu+ आयन से छोटा है किन्तु Cu+ की बाह्य कक्षा में 18 इलेक्ट्रॉन होते हैं।
प्रश्न 33.
क्षारीय मृदा धातुओं के हैलाइडों को घटते गलनांक के क्रम में लिखो।
उत्तर:
BaX2 > SrX2 > CaX2 > MgX2 > BeX2 (गलनांक)
प्रश्न 34.
NO2+, NO2– तथा NO3–, N-O बन्ध को लम्बाई के बढ़ते क्रम में लिखो।
उत्तर:
NO2+ < NO2– < NO3– (बन्ध लम्बाई)
प्रश्न 35.
उस बन्ध का नाम लिखें जो कि H2SO4 में तो है परन्तु H2O में नहीं है।
उत्तर:
उपसहसंयोजक बन्ध
प्रश्न 36.
NaCl, MgCl2 व AlCl3 को गलनांक के बढ़ते क्रम में लिखो।
उत्तर:
AlCl3 < MgCl2 < NaCl (गलनांक)
प्रश्न 37.
NaCl व CuCl में से जल में अधिक विलेय कौन है?
उत्तर:
NaCl जल में अधिक विलेय है क्योंकि यह आयनिक प्रकृति का है जबकि CuCl सहसंयोजक प्रकृति का है।
प्रश्न 38.
LiCl, LiBr, Lil, LiF को घटते सह संयोजी क्रम में लिखें।
उत्तर:
Lil > LiBr > LiCl > LiF (घटता सहसंयोजी क्रम)
प्रश्न 39.
LiCl, NaCl, KCl, RbCl, CsCl का घटता सहसंयोजी क्रम लिखें।
उत्तर:
LiCl > NaCl > KCl > RbCl > CsCl ( घटता सहसंयोजी क्रम)
प्रश्न 40.
SnCl3 व SnCl4 में से कौन अधिक सहसंयोजी है?
उत्तर:
फौजान के नियमानुसार जिस धनायन पर अधिक धनावेश होता है वह अधिक सहसंयोजी होगा। अत: SnCl4 अधिक सहसंयोजी है।
प्रश्न 41.
एक तत्व का इलेक्ट्रॉनिक विन्यास 1s² 2s² 2p6 3s² है। इसकी संयोजकता तथा इसके क्लोराइड का सूत्र लिखें।
उत्तर:
इस तत्व की संयोजकता = 2
क्लोराइड का सूत्र = MCl2
प्रश्न 42.
एक तत्व के उदासीन परमाणु में 17 इलेक्ट्रॉन व 18 न्यूट्रॉन होते हैं। इस परमाणु का इलेक्ट्रॉनिक विन्यास तथा संयोजकता लिखिये।
उत्तर:
1s² 2s² 2p6 3s² 3p5 तथा इसकी संयोजकता 1 होगी।
प्रश्न 43.
निम्नलिखित अणुओं में से आयनिक व सहसंयोजी अणुओं को छाँटिये।
(a) MgF2
(b) ClBr
(c) CBr4
(d) Cus
(e) C2H4
(f) PH3
उत्तर:
आयनिक यौगिक – MgF2, CuS
सहसंयोजी यौगिक – ClBr, CBr4, C2H2, PH3
प्रश्न 44.
HCl, H2O, NH3 में किसका क्वथनांक सर्वाधिक होता है?
उत्तर:
H2O, क्योंकि O की विद्युत ऋणात्मकता N से उच्च होती है। अत: H2O में बना H–बन्ध, NH3 में बने H-बन्ध से शक्तिशाली होता जबकि HCl में H-बन्ध नहीं बनता है।
प्रश्न 45.
अष्टक का प्रसार किस यौगिक में होता है?
उत्तर:
PF5, SF6, IF7 आदि में अष्टक का प्रसार होता है।
प्रश्न 46.
अपूर्ण अष्टक वाले यौगिकों के उदाहरण दीजिए।
उत्तर:
- BF3 (6 es)
- MgCl2 (4 es)
- BH3(6 es)
प्रश्न 47.
एक संयोजी तथा द्विसंयोजी धनायनों वाले तत्वों को बताएँ ?
उत्तर:
एक संयोजी = Na+, K+
द्विसंयोजी = O2-, S2-.
प्रश्न 48.
सहसंयोजक आबन्ध का सिद्धान्त किस वैज्ञानिक ने दिया था?
उत्तर:
लैंग्म्यूर ने सहसंयोजक आबन्ध का सिद्धान्त दिया।
प्रश्न 49.
फॉर्मल आवेश ज्ञात करने का सूत्र लिखें।
उत्तर:
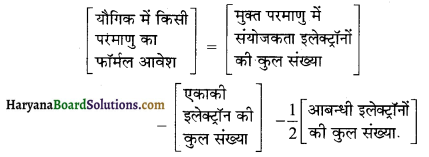
प्रश्न 50.
विषम इलेक्ट्रॉन युक्त अणुओं के उदाहरण लिखें।
उत्तर:
विषम इलेक्ट्रॉन युक्त अणु-
NO, NO2, ClO2, O2–
प्रश्न 51.
निम्न की आबन्ध कोटि बताएँ-
(1) H2 अणु में
(2) O2 अणु में
(3) N2 अणु में
(4) Cl2 अणु में
(5) CO अणु में
उत्तर:
आबन्ध कोटि बन्ध पर आधारित होती है। यह अणु में उपस्थित बन्धों की संख्या बताती है।
(1) H2 अणु में एकल बन्ध होता है। (H-H) इस कारण इसकी बन्ध कोटि एक होती है।
(2) O2 अणु में द्विबन्ध होता है। (O = O) इस कारण इसकी बन्ध कोटि दो होती है।
(3) N2 अणु में त्रि आबन्ध होता है। (N ≡ N) इस कारण इसकी बन्ध कोटि तीन होती है।
(4) Cl2 अणु में एकल आबन्ध होता है। (Cl – Cl) इस कारण इसकी बन्ध कोटि एक होती है।
(5) CO अणु को \(\mathrm{C} \stackrel{\leftarrow}{=}\)O से प्रदर्शित करते हैं। इस कारण इसमें बन्ध कोटि तीन होती हैं।
प्रश्न 52.
निम्नलिखित यौगिकों की लूइस संरचना बनाइये।
उत्तर:
MgCl2 की लूइस संरचना
(1) MgCl2 (मैग्नीशियम क्लोराइड)

(2) MgO (मैग्नीशियम ऑक्साइंड)
उत्तर:
MgO की लूइस संरचना

(3) Na2S (सोडियम सल्फाइड)
उत्तर:
Na2S की लूइस संरचना
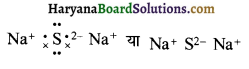
(4) AlF3 (एल्यूमिनियम फ्लोराइड)
उत्तर:
AlF3 की लूइस संरचना
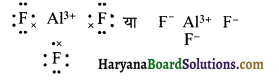
(5) KCN (पोटैशियम सायनाइड)
उत्तर:
KCN की लूइस संरचना

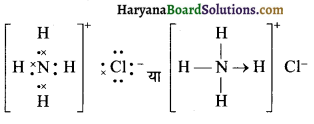
(6) NH4Cl (अमोनियम क्लोराइड)
उत्तर:
NH4Cl की लूइस संरचना
(7) HCN (हाइड्रोजन सायनाइड)
उत्तर:
HCN की लूइस संरचना

(8) H2O (जल)
उत्तर:
H2O की लूइस संरचना

(9) O3 (ओजोन)
उत्तर:
O3 की लूइस संरचना

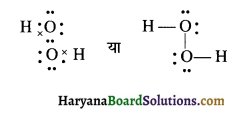
(10) H2O2 (हाइड्रोजन परॉक्साइड)
उत्तर:
H2O2 की लूइस संरचना
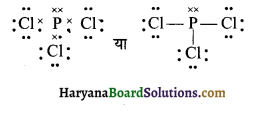
(11) PCl3 (फॉस्फोरस ट्राईक्लोराइड)
उत्तर:
PCl3 की लूइस संरचना
(12) CO (कार्बन मोनो ऑक्साइड)
उत्तर:
CO की लूइस संरचना

(13) CO2 (कार्बन डाईऑक्साइड)
उत्तर:
CO2 की लूइस संरचना

(14) N2O (नाइट्रोजन (I) ऑक्साइड)
उत्तर:
N2O की लूइस संरचना
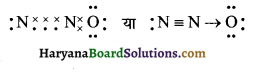
(15) N2O3 (नाइट्रोजन (III) ऑक्साइड)
उत्तर:
N2O3 की लूइस संरचना

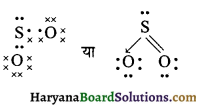
(16) SO2 (सल्फर डाईऑक्साइड)
उत्तर:
SO2 की लूइस संरचना
(17) SO3 (सल्फर ट्राई ऑक्साइड)
उत्तर:
SO3 की लूइस संरचना
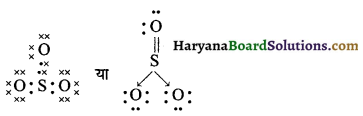
(18) SO2Cl2 (सल्फ्यूरिल क्लोराइड)
उत्तर:
SO2Cl2 की लूइस संरचना
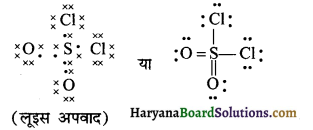
(19) H2 CO3 (कार्बोनिक अम्ल)
उत्तर:
H2CO3 की लूइस संरचना

(20) HNO3 (नाइट्रिक अम्ल)
उत्तर:
HNO3 की लूइस संरचना
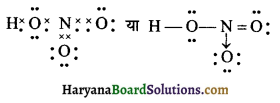
(21) H2 SO4 (सल्फ्यूरिक अम्ल)
उत्तर:
H2SO4 की लूइस संरचना
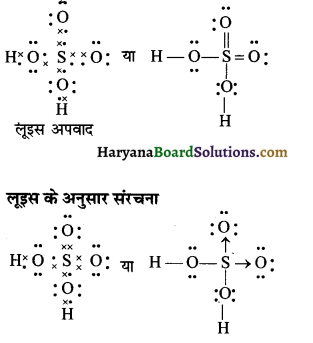
(22) CO32- (कार्बोनेट आयन)
उत्तर:
CO32- की लूइस संरचना
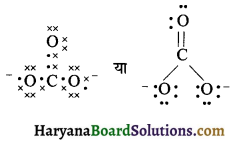
(23) NO2+ (नाइट्रिल आयन)
उत्तर:

(24) NO2– (नाइट्राइट आयन)
उत्तर:
लूइस संरचना

(25) NO3–(नाइट्रेट आयन)
उत्तर:
लूइस संरचना
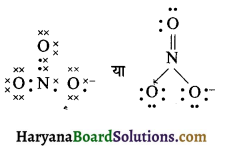
(26) SO42- (सल्फेट आयन)
उत्तर:
लूइस संरचना

प्रश्न 53.
तत्व की विद्युत संयोजकता से आप क्या समझते हैं?
उत्तर:
वह संयोजकता जिसमें किसी यौगिक के निर्माण में दो असमान परमाणुओं में से एक परमाणु बाह्यतम कोश के इलेक्ट्रॉन त्यागकर दूसरे परमाणु के बाह्यतम कोश को दे देता है जिससे कि दोनों परमाणुओं का निकटतम अक्रिय गैस विन्यास प्राप्त हो जाता है।
उदाहरण – NaCl में वैद्युत संयोजकता 1 है।
प्रश्न 54.
सोडियम धातु की तुलना में NaCl कठोर होता है, क्यों ?
उत्तर:
NaCl में Na+ तथा CH– आयनों के मध्य प्रबल आयनिक बन्ध उपस्थित होते हैं, जबकि सोडियम धातु में Na परमाणु के बीच दुर्बल धात्विक बल होते हैं। अत: NaCl कठोर होता है जबकि सोडियम धातु मुलायम उच्च होता है।
प्रश्न 55.
NaCl तथा MgO में किसकी जालक ऊर्जा का मान होती है।
उत्तर:
MgO की जालक ऊर्जा का मान उच्च होता है।
प्रश्न 56.
सहसंयोजी यौगिकों में होने वाली अभिक्रियायें सामान्यतः धीमी क्यों होती हैं ?
उत्तर:
सहसंयोजी यौगिकों की आबन्ध वियोजन ऊर्जा का मान उच्च होता है, इस कारण ये अभिक्रियायें धीमी होती हैं।
प्रश्न 57.
कार्बन – कार्बन आबन्ध में आबन्ध लम्बाई का क्या क्रम होता है ?
उत्तर:
C = C < C = C < C – C (आबन्ध लम्बाई)
1.20 Å 1.33 Å 1.54 Å
प्रश्न 58.
निम्न अभिक्रिया में आबंध कोटि (Bond order) पर क्या प्रभाव पड़ता है?
(i) N2 → N2+ + e–
(ii) O2 → O2+ + e–
उत्तर:
(i) N2 → N2+ + e–
इसमें N2 की बंध कोटि 3 तथा N+2 की बंध कोटि 2.5 है।
(ii) O2 → O2+ + e–
यहाँ O2 की बंध कोटि 2 तथा O+2 की बंध कोटि 2.5 है।
![]()
प्रश्न 59.
SO2 अणु में द्विध्रुव आघूर्ण होता है, क्या यह अणु रेखीय है ? कारण दें।
उत्तर:
नहीं यह अणु रेखीय नहीं हो सकता है क्योंकि यदि इसकी आकृति रेखीय होती तो इसके द्विध्रुव आघूर्ण का मान शून्य होता, जो कि नहीं है। अतः यह अणु रेखीय नहीं बंकित या मुड़ा हुआ होता है।
प्रश्न 60.
PCl5 तथा CH3+ में प्रत्येक पर फॉर्मल आवेश ज्ञात करो ?
उत्तर:
PCl5 में फॉर्मल आवेश
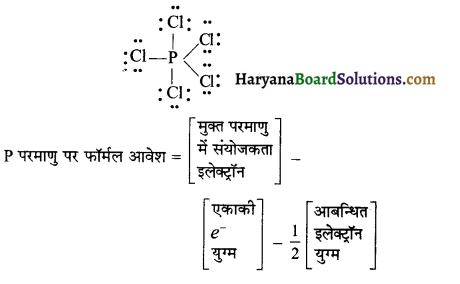
= 5 – 0 – \(\frac { 1 }{ 2 }\) x 10
= 5 – 5
= 0
प्रत्येक Cl परमाणु पर फॉर्मल आवेश
= 7 – 6 – \(\frac { 1 }{ 2 }\) x 2
= 7 – 6 – 1
= 0
CH3+ में फॉर्मल आवेश

C-परमाणु पर फॉर्मल आवेश
= – 4 – 0 – \(\frac { 1 }{ 2 }\) x 6
= 4 – 3
= 1
प्रत्येक H-परमाणु पर फॉर्मल आवेश
= 1 – 0 – \(\frac { 1 }{ 2 }\) x 2
= 1 – 1
= 0
प्रश्न 61.
N2 गैस को प्रायः अक्रिय वातावरण के रूप में उपयोग क्यों करते हैं?
उत्तर:
N2 गैस में त्रिबन्ध उपस्थित होता है जिस कारण इसकी बन्ध वियोजन ऊर्जा का मान भी अधिक होता है। चूँकि यह एक अति स्थायी गैस है अतः इसका उपयोग अक्रिय गैस के रूप में करते हैं।
प्रश्न 62.
NaCl, AgNO3 के साथ अवक्षेप देता है परन्तु CCl4 नहीं क्यों?
उत्तर:
NaCl एक आयनिक यौगिक है जबकि CCl4, एक सहसंयोजी यौगिक है। NaCl तथा AgNO3 को जल में घोलने पर दोनों ही आयनों में परिवर्तित हो जाते हैं जिसके कारण AgCl का श्वेत अवक्षेप आ जाता है परन्तु CCl4 जल में आयनीकृत नहीं होता अतः यह AgNO3 के साथ अवक्षेप नहीं देता है।
प्रश्न 63.
BaSO4 जल में अघुलनशील है यद्यपि यह एक आयनिक यौगिक है।
उत्तर:
BaSO4 की जालक ऊर्जा, जलयोजन ऊर्जा से अधिक होती है, इस कारण BaSO4 जल में आयनीकृत नहीं होता है और अघुलनशील है।
प्रश्न 64.
PCl5 में तीन P – Cl बन्ध की बन्ध वियोजन ऊर्जा अधिक है जबकि दो की कम क्यों ?
उत्तर:
PCl5 की आकृति त्रिभुजीय द्विपिरामिडी होती है। इसमें तीन P-Cl आबन्ध विषुवतीय तथा दो अक्षीय बन्ध होते हैं। अक्षीय आबन्ध विषुवतीय बन्धों की तुलना में लम्बे होते हैं। इस कारण दो अक्षीय आबन्धों की बन्ध ऊर्जा कम होती है।
प्रश्न 65.
N2, O2, Cl2, F2 को बढ़ती बन्ध ऊर्जा के क्रम में व्यवस्थित करें।
उत्तर:
F2 < Cl2 < O2 < N2 (बन्ध वियोजन ऊर्जा )
प्रश्न 66.
दो परमाणु आपस में मिलकर बन्ध क्यों बनाते हैं ?
उत्तर:
स्थायी इलेक्ट्रॉनिक विन्यास प्राप्त करने के लिये दो परमाणु आपस में मिलकर बन्ध बनाते हैं।
प्रश्न 67.
निम्न में प्रभावी आण्विक बलों को लिखें-
(i) KCIO3
(ii) हीरा
(iii) शुष्क बर्फ
(iv) ऐलुमिनियम
उत्तर:
(i) KClO3 – आयनिक बन्ध
(ii) हीरा – सहसंयोजक बन्ध
(iii) शुष्क बर्फ – वान डर वाल्स बल
(iv) ऐलुमिनियम – धात्विक बल ।
प्रश्न 68.
निम्न यौगिक में कुल σ तथा π बन्धों की संख्या बतायें-
(i) बेन्जीन (C6H6), (ii) C(CN)4, (iii) CH3COOH
उत्तर:
(i) 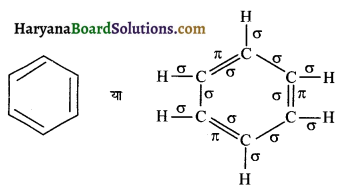
कुल सिग्मा बन्ध = 12
कुल पाई बन्ध = 3
(ii) 
कुल सिग्मा बन्ध = 8
कुल पाई बन्ध = 8
(iii) CH3COOH
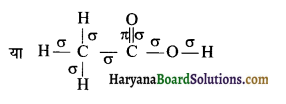
कुल सिग्मा बन्ध = 7
कुल पाई बन्ध = 1
प्रश्न 69.
निम्नलिखित को बढ़ते स्थायित्व के क्रम में, बन्ध वियोजन ऊर्जा के क्रम में तथा आबन्ध लम्बाई के क्रम में व्यवस्थित करें।
O2, O2+, O2–, O22-
उत्तर:
उपरोक्त अणुओं की बन्ध कोटि निम्न प्रकार है।
O2 = 2.0, O22- = 0.5, O2– = 1, O2+ = 25 अतः
(i) स्थायित्वका क्रम
O2+ > O2 > O2– > O22-
क्योंकि बन्ध कोटि α स्थायित्व
(ii) बन्ध वियोजन ऊर्जा का क्रम-
O2+ > O2 > O2– > O22-
क्योंकि बन्ध कोटि α बन्ध वियोजन ऊर्जा
(iii) आबन्ध लम्बाई का क्रम-
O22- > O2– > O2 > O2+

बन्ध कोटि α \(\frac{1}{\text { आबन्ध लम्बाई }}\)
प्रश्न 70.
VSEPR सिद्धान्त के आधार पर निम्न अणुओं की आकृति बताइये तथा केन्द्रीय परमाणु का संकरण लिखिये-
(1) H2O
2 आबन्धी युग्म तथा 2 एकाकी युग्म,
अतः आकृति = v-आकृति या मुड़ी हुयी आकृति
संकरण (H2O) = 2 + 6 = \(\frac { 8 }{ 2 }\) = 4 (sp³ संकरण)
(2) NH3
तीन आबन्धी युग्म तथा एक एकाकी युग्म, अतः आकृति पिरामिडी
संकरण (NH3) = 5 + 3 = \(\frac { 8 }{ 2 }\) = 4 (sp³ संकरण)
(3) BF3
तीन आबन्धी युग्म, अतः आकृति त्रिकोणीय समतलीय
संकरण BF3 = 3 + 3 x 7 = \(\frac { 24 }{ 8 }\) = 3 (sp² संकरण)
(4) BeF2
दो आबन्धी युग्म अतः आकृति = रेखीय
संकरण BeF2 = 2 + 2 × 7 = \(\frac { 16 }{ 8 }\) = 2 (sp संकरण)
(5) SF4
4 आबन्धी युग्म तथा । एकाकी युग्म, अतः आकृति ढेकुली या सी सॉ आकृति
संकरण SF4 = 6 + 4 × 7 = \(\frac { 34 }{ 8 }\)
= (4 + \(\frac { 2 }{ 2 }\) = 1)
= 5 (sp³d संकरण)
प्रश्न 71.
हीरा तथा ग्रेफाइट (कार्बन के अपररूप) में संकरण क्या होता है ?
उत्तर:
हीरा-sp³ संकरण
ग्रेफाइट-sp² संकरण
प्रश्न 72.
CH4, C2H6 व C2H6 की ज्यामिति आकृति क्या है ?
उत्तर:
CH4 व C2H6 की आकृति चतुष्फलकीय है जबकि C2H4 समतलीय त्रिकोणीय होता है।
प्रश्न 73.
BeCl3, BF3 व CH4 के अणुओं का आबन्ध कोण बतायें।
उत्तर:
(1) BeCl2 – रेखीय आकृति, अतः 180° कोण
(2) BF3 – त्रिकोणीय समतलीय, अतः 120° कोण
(3) CH4 – चतुष्फलकीय, अतः 109.5° कोण या 109° 28′ कोण
प्रश्न 74.
निम्नलिखित में कौन-से धातु आयन का इलेक्ट्रॉनिक विन्यास उत्कृष्ट गैस के समान नहीं होता?
(i) CuCl, (ii) CdO, (iii) TiO2, (iv) NaF
उत्तर:
(i) CuCl तथा
(ii) Cdo
प्रश्न 75.
कमरे के ताप पर H2O द्रव है, क्यों ?
उत्तर:
अन्तराअणुक H-बन्ध के कारण H2O द्रव है।
प्रश्न 76.
N2 तथा N2+ का आण्विक कक्षक इलेक्ट्रॉनिक विन्यास बताएँ तथा दोनों की ऊर्जा, लम्बाई व स्थायित्व की तुलना करें।
उत्तर:
N2 का आण्विक कक्षक इलेक्ट्रॉनिक विन्यास (N2 में कुल इलेक्ट्रॉनों की संख्या 14 है)।
(σ1s)² (σ*1s)² (σ2s)² (σ*2s)² (π2px)² (π2py)² (σ2pz)2
N2+ का आण्विक कक्षक इलेक्ट्रॉनिक विन्यास (N2+ में कुल इलेक्ट्रॉनों की संख्या 13 है)।
(σ1s)² (σ*1s)² (σ2s)² (σ*2s)² (π2px)² (π2py)² (σ2pz)1
N2 की आबन्ध कोटि = \(\frac { 10-4 }{ 2 }\)
= \(\frac { 6 }{ 2 }\) = 3
N2+ की आबन्ध कोटि = \(\frac { 9-4 }{ 2 }\)
= \(\frac { 5 }{ 2 }\) = 2.5
स्थायित्व का क्रम N2 > N2+
बन्ध वियोजन कर्जा N2 > N2+
आबन्ध दूरी N2+ > N2
प्रश्न 77.
क्या σ-आबन्ध की अनुपस्थिति में आबन्ध बन सकता है ?
उत्तर:
नहीं।
प्रश्न 78.
निम्नलिखित आयनन प्रक्रम का C में आबन्ध कोटि पर क्या प्रभाव पड़ता है?
C2 → C2+ + e–
उत्तर:
C2 से C2+ होने पर आबन्ध कोटि का मान घटता है क्योंकि C2 की आबन्ध कोटि 2 है जबकि C2+ की आबन्ध कोटि 1.5 है।
प्रश्न 79.
H2+, H2 व H2– सदस्यों को स्थायित्व के बढ़ते क्रम में व्यवस्थित करें।
उत्तर:
स्थायित्व का बढ़ता क्रम H2 > H2+ > H2–
प्रश्न 80.
Na2, N2–, N22- तथा N2+ सदस्यों को स्थायित्व के बढ़ते क्रम में व्यवस्थित करें।
उत्तर:
N2 > N22-> N2– > N22- (बढ़ता स्थायित्व क्रम)
प्रश्न 81.
हाइड्रोजन बन्ध के बनने में लगभग कितनी ऊर्जा प्राप्त होती है ?
उत्तर:
हाइड्रोजन बन्ध बनने में लगभग 6 से 10 kcal मोल ऊर्जा प्राप्त होती है।
प्रश्न 82.
हाइड्रोजन बन्ध की प्रबलता किस पर निर्भर करती है ?
उत्तर:
हाइड्रोजन बन्ध की प्रबलता तत्व की विद्युत ऋणात्मकता पर निर्भर करती है।
प्रश्न 83.
NH3 का क्वथनांक PH3 से अधिक है, क्यों?
उत्तर:
NH3 का क्वथनांक PH3 से अधिक होता है क्योंकि NH3हाइड्रोजन बन्ध बनाता है, परन्तु PH3 नहीं।
प्रश्न 84.
H2O द्रव है, जबकि H2S गैस है।
उत्तर:
H2O हाइड्रोजन बन्ध के द्वारा संगुणन करता है अतः यह कमरे के ताप पर द्रव अवस्था में पाया जाता है।
प्रश्न 85.
वर्ग 14 के तत्वों के हाइड्राइडों को उनके क्वथनांकों के बढ़ते क्रम में व्यवस्थित करें।
उत्तर:
CH4 < SiH4 < GeH4 < SnH4
![]()
प्रश्न 86.
वर्ग 15 के तत्वों के हाइड्राइडों को उनके क्वथनांकों के बढ़ते क्रम में व्यवस्थित करें।
उत्तर:
NH3 >> PH3 < AsH3 < SbH3 (क्वथनांकों का बढ़ता क्रम)
प्रश्न 87.
वर्ग 16 के तत्वों के हाइड्राइडों को उनके क्वथनांकों के बढ़ते क्रम में व्यवस्थित करे?
उत्तर:
H2O >> H2S < H2Se < H2Te
प्रश्न 88.
H2O की तुलना में HF में हाइड्रोजन बन्ध अधिक प्रबल होते हैं परन्तु फिर भी H2O का क्वथनांक (100°C), HF (19.5°C) से अधिक होता है, क्यों?
उत्तर:
HF में प्रत्येक F – परमाणु दो H – परमाणु से जुड़ता है परन्तु H2O में प्रत्येक O-परमाणु चार H-परमाणुओं से जुड़ता है। जिनमें दो हाइड्रोजन सहसंयोजक बन्ध द्वारा जबकि दो हाइड्रोजन H-बन्ध द्वारा जुड़ते हैं।
अत: H-F कम अणु जबकि H2O अधिक अणुओं द्वारा संगुणित होता है अत: H2O का क्वथनांक अधिक तथा HF का क्वथनांक कम होता है।
प्रश्न 89.
मेटा- जाइलीन में कितने सिग्मा तथा पाई बन्ध उपस्थित हैं।
उत्तर:
प्रश्न 90.
H2 एक स्थायी अणु है जबकि He2 एक अस्थायी अणु, क्यों?
उत्तर:
हाइड्रोजन परमाणु का इलेक्ट्रॉनिक विन्यास 1s1 व हीलियम का 1s² होता है जबकि H2 अणु में कुल दो इलेक्ट्रॉन होते हैं जो कि (σ1s) आण्विक कक्षक में भरते हैं, इस कारण इसकी बन्ध कोटि एक होती है।
हीलियम अणु में कुल चार इलेक्ट्रॉन होते हैं जो कि (σ1s) व (σ*1s) आण्विक कक्ष में प्रवेश करते हैं। इसकी बन्ध कोटि शून्य होती है। शून्य बन्ध कोटि यह बताती है कि He2 एक स्थाई अणु नहीं है।
प्रश्न 91.
निम्न में उस यौगिक को छाँटिये जिसके गुण (कोष्ठक में दिखाये गये) का मान अधिक है।
(1) NF3, NH3 (द्विध्रुव आघूर्ण)
(2) CO2, SiO2 (बन्ध कोण)
(3) NaCl, LiCl (आयनिक गुण)
(4) MgO, CaO (कठोरता)
(5) HF, HCl ( क्वथनांक)
उत्तर:
(i) NH3 > NF3 (द्विध्रुव आघूर्ण )
(ii) CO2 > SiO2 (बन्ध कोण)
(iii) NaCl > LiCI (आयनिक कोण)
(iv) MgO > CaO (कठोरता )
(v) HF > HCl ( क्वथनांक)
प्रश्न 92.
क्या π-बन्ध को घुमाना सम्भव है?
उत्तर:
π-बन्ध को घुमाना सम्भव नहीं है क्योंकि घुमाने पर बन्ध टूट जाता है।
प्रश्न 93.
निम्नलिखित दिये गये यौगिकों को उनके सही बन्ध क्रम के साथ जोड़िये।
| यौगिक | बन्ध कोण |
| BeCl2, H2O, BCl3, AlCl3, NH3, CCl4, SF6 | 180°, 109°28’, 104.5°, 107°, 120°, 90° |
उत्तर:
BeCl2 – 180°
H2O – 104.5°
BCl3 – 120°
AlCl3 – 120°
NH3 – 107°
CCl4 – 109°28′
SF6 – 90°
प्रश्न 94.
I2 गर्म करने पर ऊर्ध्वपातित हो जाती है क्यों?
उत्तर:
आयोडीन एक उच्च सहसंयोजी अध्रुवी यौगिक है, इसलिये इसका क्वथनांक तथा गलनांक बहुम कम होता है। इसलिये I2 गर्म करने पर ऊर्ध्वपातित हो जाती है।
प्रश्न 95.
H-बन्ध कितने प्रकार के होते हैं? इनमें से प्रबल हाइड्रोजन बन्ध कौन-सा है।
उत्तर:
H-बन्ध दो प्रकार के होते हैं।
- अन्तराअणुक हाइड्रोजन आबन्ध
- अन्त: अणुक हाइड्रोजन आबन्ध
इनमें अन्तराअणुक हाइड्रोजन आबन्ध अधिक प्रबल होते हैं।
प्रश्न 96.
निम्नलिखित में किसका द्विध्रुव आघूर्ण उच्च होगा तथा क्यों?
1- ब्यूटीन अथवा 1- ब्यूटाइन
उत्तर:
1- ब्यूटाइन का द्विध्रुव आघूर्ण उच्च होगा, क्योंकि यह
अधिक ध्रुवी है, इसमें sp-संकरित कार्बन परमाणु होता है जो कि अत्यधिक विद्युत ऋणात्मक है।
प्रश्न 97.
निम्नलिखित में कौन-सा बन्ध अधिक ध्रुवीय होगा ?
(a) B – Cl अथवा C – CI
(b) PF अथवा P – Cl
उत्तर:
(a) B – CI बन्ध अधिक ध्रुवीय है।
(b) P – F बन्ध अधिक ध्रुवीय है।
प्रश्न 98.
C6H4Br2 का द्विध्रुव आघूर्ण शून्य है। इसकी संरचना लिखें।
उत्तर:
C6H4Br2 एक p-समावयवी है। इसकी संरचना निम्न है।
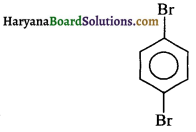
प्रश्न 99.
HF, HCl, HBr को विद्युत संयोजी लक्षणों के घटते क्रम में लिखें। इनकी विद्युत ऋणात्मकतायें निम्न हैं।
H = 2.1, F = 4.0, Cl = 3.0, Br = 2.8
उत्तर:
(i) बन्ध H – F के लिये
विद्युत ऋणात्मकता में अन्तर (XF – XH)
= 4.0 – 2.11.9
प्रतिशत आयनिक गुण = [16 (1.9) + 3.5 (1.9)²]
(ii) बन्ध HCl के लिये
= 43%
विद्युत ऋणात्मकता में अन्तर (XCl – XH)
= 3.0 – 2.10 = 0.9
प्रतिशत आयनिक गुण = [16(0.9) + 3.5(0.9)²]
= 17·2%
(iii) बन्ध HBr के लिये
विद्युत ऋणात्मकता में अन्तर XBr – XH = 2.8 – 2.1 = 0.7
प्रतिशत आयनिक गुण = [(16 x 0.7) + 3.5 × (0.7)²] = 12.9%
अतः विद्युत संयोजी या आयनी गुण का घटता क्रम
HF > HCl > HBr (आयनी गुण)
प्रश्न 100.
H2SO4 की अधिक श्यानता का कारण क्या है?
उत्तर:
H2SO4 की श्यानता H-बन्ध होने के कारण अधिक होती है।
प्रश्न 101.
शहद गाढ़ा क्यों होता है?
उत्तर:
शहद के गाढ़ा होने का कारण H-बन्ध है।
प्रश्न 102.
Cl – Cl बन्ध, Br – Br बन्ध से शक्तिशाली होता है, क्यों ?
उत्तर:
Cl – Cl बन्ध 3p – 3p कक्षकों के बीच अतिव्यापन होने के कारण बनता है, जबकि Br – Br बन्ध 4p – 4p कक्षकों के बीच अतिव्यापन से बनता है। 4p – कक्षकों के इलेक्ट्रॉन नाभिक से अधिक दूर होते हैं जिसके कारण बन्ध प्रबल नहीं बन पाते। यही कारण है कि Cl – CI बन्ध शक्तिशाली होते हैं।
प्रश्न 103.
O-नाइट्रोफीनॉल की अपेक्षा p-नाइट्रोफीनॉल कम वाष्पशील है, क्यों?
उत्तर:
O-नाइट्रोफीनॉल में अन्तः अणुक H-बन्ध होता हैं जबकि p-नाइट्रोफीनॉल में अन्तराअणुक H-बन्ध होता है।
लघु उत्तरीय प्रश्न
प्रश्न 1.
आयनिक बंध क्या है?
उत्तर:
आयनिक बंध विपरीत आवेशित आयनों के मध्य परस्पर लगने वाले आकर्षण बल के फलस्वरूप बने बन्ध को आयनिक बन्ध कहते हैं। आयनिक बंध को वैद्युत संयोजक बन्ध भी कहते हैं।
उदाहरण – मैग्नीशियम क्लोराइड का बनना।
जब मैग्नीशियम एवं क्लोरीन एक-दूसरे के सम्पर्क में आते हैं तो धनविद्युती तत्व मैग्नीशियम दो ऋण विद्युती तत्वों क्लोरीन को इलेक्ट्रॉन देकर धनायन एवं ऋणायन बनाता है इस प्रकार दोनों (धनायन एवं ऋणायन) का इलेक्ट्रॉनिक विन्यास निकटतम उत्कृष्ट गैस के स्थायी विन्यास के समान हो जाता है।
Mg → Mg2+ + 2e1
(2, 8, 2) (2,8)
Cl + e– →Cl–
(2, 8, 7) (2, 8, 8)
Mg2+ + 2Cl– → MgCl2
अतः मैग्नीशियम एवं क्लोरीन आयन स्थिर वैद्युत आकर्षण बल द्वारा बंधित हो जाते हैं।
प्रश्न 2.
जालक ऊर्जा किसे कहते हैं? जालक ऊर्जा को प्रभावित करने वाले कारकों के नाम लिखिए।
उत्तर:
जालक ऊर्जा (Lattice Energy) – ऊर्जा की वह मात्रा जो अनन्त दूरी पर स्थित धनावन एवं ऋणायन गैसीय अवस्था से एक मोल ठोस में बदलने पर निकलती है, जालक ऊर्जा कहलाती है।
A+(g) + Be+(g) + AB(s) + U (जालक ऊर्जा)
मेडुलंग समीकरण के द्वारा जालक ऊर्जा का मान ज्ञात कर सकते है-
U = \(\frac{N_A Z_1 Z_2 e^2}{r_1}(1-1 / n)\)
यहाँ NA – आवागाद्रो संख्या
A = मेडुलंग स्थिरांक
Z1.Z2 = आयनिक आवेश
n = बोर्न घातांक
r = आयनों के मध्य दूरी
e = इलेक्ट्रॉन पर आवेश
जालक ऊर्जा को प्रभावित करने वाले कारण निम्नलिखित हैं-
- आयनों का आकार
- क्रिस्टल संरचना
- आयनों का इलेक्ट्रॉनिक विन्यास
- आयनिक आवेश
- क्रिस्टल के सहसंयोजी गुण।
प्रश्न 3.
उपसहसंयोजक बंध से क्या समझते हो?
उत्तर:
उपसहसंयोजक बंध (Co-ordination Bond) – उपसहसंयोजक बंध में दो परमाणु साझे के इलेक्ट्रॉन युग्म द्वारा आपस में बंधे रहते हैं, लेकिन साझे का इलेक्ट्रॉन युग्म केवल एक परमाणु द्वारा ही दिया जाता है। इलेक्ट्रॉन युग्म देने वाले परमाणु को दाता परमाणु कहते हैं। इसी कारण उपसहंयोजक बंध को अर्द्धध्रुवीय या दाता बंध (Dative bond) भी कहते हैं।
उपसहसंयोजक बर्ष को तीर (→) से प्रदर्शित करते हैं।
(इलेक्ट्रॉन युग्म दाता) + (इलेक्ट्रॉन युग्म ग्राही) → उपसहसंयोजक यौगिक
![]()
प्रश्न 4.
बंधों के ध्रुवण से क्या तात्पर्य है?
उत्तर:
बंधों का ध्रुवण (Polarisation of bonds) – समान आवेश वाले आयन एक दूसरे को प्रतिकर्षित करते हैं, परन्तु विपरीत आवेश वाले आयन एक-दूसरे को आकर्षित करते हैं। इसी कारण आयनों का आकार पूरी तरह गोलाकार न होकर विकृत हो जाता है अतः
“धनायन एवं ऋणायन के पारस्परिक आकर्षण एवं प्रतिकर्षण के कारण उनके आकार में होने वाली विकृति ध्रुवण कहलाती है।”
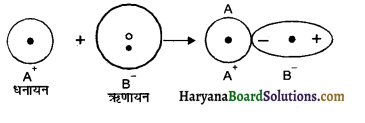
धनायन की त्रिज्या कम एवं नाभिकीय आवेश अधिक होने के कारण उसका इलेक्ट्रॉन अभ्र, नाभिक की ओर प्रबल रूप से आकर्षित अवस्था में होने के कारण ऋणायन को आसानी से ध्रुवित कर देता है।
प्रश्न 5.
ध्रुवण को प्रभावित करने वाले कारकों पर प्रकाश डालिए।
उत्तर:
ध्रुवण को प्रभावित करने वाले कारक निम्नलिखित हैं-
1. धनायन का आकार ऋणायन की विकृति धनायन के आकार पर निर्भर करती है। धनायन जितना छोटा होगा उतना ही अधिक प्रभावी ढंग से ऋणायन को विकृत करेगा।
उदाहरण-
BeCl2 < MgCl2 < CaCl < SrCl2 < BaCl2
गलनांक 405°C > 702°C > 772°C > 872°C < 960°C
धनायन का आकार कम होगा तो गलनांक भी कम होगा।
2. ऋणायन का आकार ऋणायन का आकार जितना छोटा होगा उसका ध्रुवण उतना ही कम होगा। ऋणायन का आकार छोटा होने पर गलनांक अधिक होता है।
उदाहरण-
CaF2 > CaCl2 > CaBr2 > Cal2
1372°C > 772°C > 730°C > 575°C
3. आयनों पर आवेश किसी भी आयन पर अधिक आवेश होने के कारण ध्रुवण अधिक होता है। यही कारण है कि Mg2+, Na+ से अधिक सहसंयोजक है।
4. आयनों का इलेक्ट्रॉनिक विन्यास धनायन का विन्यास उत्कृष्ट गैस के तुल्य होने के कारण यह नाभिक के आकर्षण बल का प्रभावी ढंग से परिरक्षण कर सकता है जिसके कारण धनायन आकार में छोटा हो जायेगा, अतः ध्रुवण अधिक होगा।
प्रश्न 6.
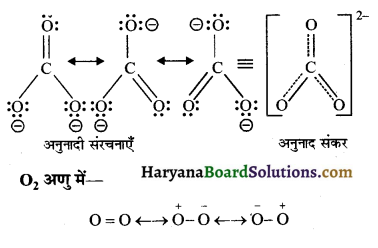
CO32- में एवं आक्सीजन (O2) अणु में अनुनादी संरचनाएँ बनाइये।
उत्तर:
CO32- में
प्रश्न 7.
आयनिक एवं सह-संयोजक यौगिकों की तुलना कीजिए।
उत्तर:
| आयनिक यौगिक | सहसंयोजक यौगिक |
| 1. आयनिक यौगिक प्राय: ठोस होते हैं। | ये ठोस द्रव एवं गैस तीनों हो सकते हैं। |
| 2. यह आयनों से मिलकर बना होता है। | यह अणुओं से मिलकर बना होता है। |
| 3. आयनिक बंध दिशात्मक नहीं होते हैं। | सहसंयोजक बंध में दिशात्मक गुण पाये जाते हैं। |
| 4. आयनिक यौगिक समांवयवता प्रदर्शित नहीं करते। | सह-संयोजक यौगिक समावयवता प्रदर्शित करते हैं। |
| 5. आयनिक यौगिक कठोर एवं भंगुर प्रकृति के होते हैं। | ये अपेक्षाकृत कमजोर, मृदु एवं गलनीय होते हैं। |
| 6. इनके गलनांक एवं क्वथनांक उत्व होते हैं। | इनके गलनांक एवं क्वथनांक निम्न होते हैं। |
| 7. ये ध्रुवीय विलायकों में विलेय होते हैं। | ये अध्रुवीय विलायकों में विलेय होते हैं। |
| 8. इनकी अभिंक्रियाएँ तीव्र गति से होती हैं। | इनकी अभिक्रियाएँ मन्द गति से होती हैं। |
प्रश्न 8.
SiCl4 का जल अपघटन होता है CCl4 का नहीं। समझाइए।
उत्तर:
CCl4 का जल अपघटन नहीं होता है, जबकि SiCl4 जल में अपघटित हो जाता है, क्योंकि Si के परमाणु में रिक्त कक्षक होता है एवं Si की अधिकतम सहसंयोजकता 6 होती है। इस कारण Si जल के अणुओं से अतिरिक्त बंध बनाता है जिससे SiCl4 एवं जल के अणु के मध्य दूरी कम हो जाती है एवं HCl का अणु आसानी से बन जाता है।
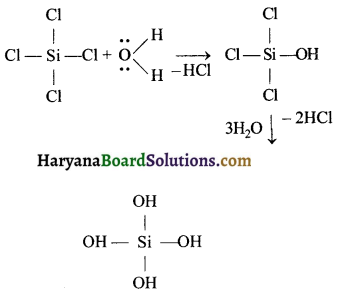
जबकि CCl4 के C के पास d कक्षक उपलब्ध नहीं रहते जिसके कारण C जल के साथ अतिरिक्त बंध नहीं बना सकता। इसलिए CCl4
जल में अविलेय रहता है।
प्रश्न 9.
ग्रेफाइट सहसंयोजक होते हुए भी विद्युत का सुचालक है, क्यों ?
उत्तर:
ग्रेफाइट की परतदार संरचना होती है। ग्रेफाइट की परत में प्रत्येक कार्बन परमाणु सहसंयोजक बंधों के द्वारा पास के तीन अन्य कार्बन परमाणुओं से जुड़ा रहता है। प्रत्येक कार्बन परमाणु पर एक इलेक्ट्रॉन स्वतन्त्र रहता है। यह इलेक्ट्रॉन गतिशील (Mobile) होता है। इस गतिशील इलेक्ट्रॉन की उपस्थिति के कारण ही ग्रेफाइट विद्युत का सुचालक है।
प्रश्न 10.
BF3 की संरचना समतल त्रिभुजीय है जबकि NH3 की पिरामिडीय है क्यों?
उत्तर:
BF3 की संरचना समतल त्रिभुजीय होती है, क्योकि BF3 में एक s – कक्षक एवं दो p-कक्षक संकरित होकर तीन नये sp² संकरित कक्षक बनाते हैं। अणु में बंध कोण का मान 120° होता है। BF3 में B के इलेक्ट्रॉनिक विन्यास के अनुसार-
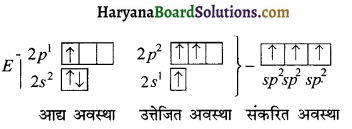
जबकि NH3में sp³ संकरण पाया जाता है। एक संकरित कक्षक में एकाकी इलेक्ट्रॉन युग्म होने के कारण बंधी इलेक्ट्रॉन युग्म से प्रतिकर्षण बढ़ जाता है जिसके कारण बंध कोण 109°28′ के बजाय 106° 45′ हो जाता है।
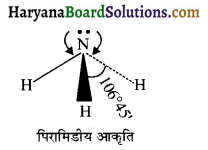
प्रश्न 11.
CO2 अध्रुवीय है, जबकि SO2 ध्रुवीय है, क्यों?
उत्तर:
CO2 ध्रुवीय बंध उपस्थित होने के बावजूद भी अध्रुवीय है, क्योंकि CO2 का द्विध्रुव आघूर्ण शून्य है जो यह प्रदर्शित करता है कि बंधों में ध्रुवणता होने के बावजूद भी सदिश योग के कारण एक द्विध्रुव, दूसरे द्विध्रुव को समाप्त कर देता है, जबकि SO2 में ऐसा नहीं होता है।
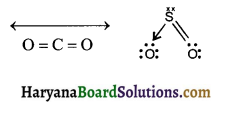
प्रश्न 12.
MgSO4 जल में विलेय है, जबकि BaSO4 अविलेय है, क्यों?
उत्तर:
MgSO4 की जल में विलेयता – MgSO4 के Mg 2+ आयन अपेक्षाकृत आकार में छोटे होते हैं जिसके कारण Mg2+ आयन प्रभावी क्रिस्टलन संकुचन के लिए जल के अणुओं से घिरा रहता है। जल के. अणुओं से घिरे होने कारण Mg2+ और SO42- के बीच लगने वाला आकर्षण बल अपेक्षाकृत कम हो जाता है। आकर्षण बल कम होने के कारण MgSO4 की जालक ऊर्जा, विलायक ऊर्जा से कम हो जाती है। अत: MgSO4 जल में विलेय होता है।
BaSO4 की अविलेयता – जब BaSO4 को जल में मिलाया जाता है तो जल की विलायक ऊर्जा, BaSO4 की जालक ऊर्जा की अपेक्षा कम होती है। इसी कारण BaSO4 जल में अविलेय है।
प्रश्न 13.
निम्नलिखित परमाणुओं के बीच बनने वाले बन्धों के प्रकार को स्पष्ट करें-
(1) दो परमाणु जिनकी विद्युत ऋणात्मकता समान है।
(2) दो परमाणु जिनकी विद्युत ऋणात्मकता में सूक्ष्म अन्तर है ।
(3) दो परमाणु जिनकी विद्युत ऋणात्मकता में अधिक अन्तर है।
उत्तर:
(1) जब दो परमाणुओं की विद्युत ऋणात्मकता समान होती है तो उनमें 100% सहसंयोजी बन्ध बनते हैं।
(2) जब दो परमाणुओं की विद्युत ऋणात्मकता में सूक्ष्म अन्तर होता है तो ध्रुवीय सहसंयोजक बन्ध बनते हैं जिनमें कुछ आयनिक लक्षण भी होते हैं।
(3) जब दो परमाणुओं की विद्युत ऋणात्मकता में अधिक अन्तर होता है तो विद्युत संयोजी बन्ध बनते है जिसमें कुछ सहसंयोजी लक्षण भी होते हैं।
प्रश्न 14.
NH3 में आबन्ध कोण PH3 से अधिक होता है, क्यों?
उत्तर:
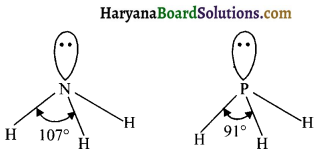
NH3 तथा PH3 दोनों ही वर्ग 15 के तत्वों के हाइड्राइड हैं। नाइट्रोजन की विद्युत ऋणात्मकता फॉस्फोरस से अधिक होती है। परिणामस्वरूप साझे के इलेक्ट्रॉन युग्म NH आबन्ध में नाइट्रोजन तत्व की ओर ज्यादा है। जबकि P-H आबंध में यह फॉस्फोरस तत्व की ओर कम है। अधिक विद्युत ऋणात्मकता होने के कारण नाइट्रोजन तत्व के चारों ओर इलेक्ट्रॉन घनत्व बढ़ जाता है। इस कारण प्रतिकर्षण भी बढ़ जाता है।
अत: NH3 में H – N – H में बन्ध 107° जबकि H – PH में यह 91° होता है।
![]()
प्रश्न 15.
एथेन का क्वथनांक मेथेन के क्वथनांक से अधिक होता है, क्यों ?
उत्तर:
एथेन अणुओं का आण्विक भार मेथेन से अधिक होता है। जिसका आण्विक भार अधिक होता है उसमें वाण्डर वाल आकर्षण बल भी अधिक होता है। इस कारण एथेन का क्वथनांक मेथेन से अधिक होता है।
प्रश्न 16.
निम्न युग्मों में से कौन अधिक सहसंयोजक है और क्यों ?
(1) CuO तथा Cus
(2) AgCl तथा AgI
(3) PbCl2 तथा PbCl4
(4) BeCl2 तथा MgCl2
उत्तर:
(1) CuS > CuO ; CuS अधिक सहसंयोजक है, S2- के बड़े आकार के कारण
(2) AgI > AgCl ; AgI अधिक सहसंयोजक है, I– के बड़े आकार के कारण
(3) PbCl4 > PbCl2; PbCl4 अधिक सहसंयोजक है, Pb4+- के छोटे आकार के कारण
(4) BeCl2 > MgCl2; BeCl2 अधिक सहसंयोजक है, Be2+ के छोटे आकार के कारण
प्रश्न 17.
KCl का द्विध्रुव आघूर्ण 3.336 × 10-29कूलॉम – मीटर (C-m) है जो व्यक्त करता है कि यह एक उच्च ध्रुवी अणु है। इस अणु में K+ तथा Cl– के बीच अन्तरपरमाण्विक दूरी 2.6 x 10-10m है। द्विध्रुव आघूर्ण की गणना कीजिए यदि प्रत्येक नाभिक पर एक मूलभूत इकाई के विपरीत आवेश स्थित हों। KCl की आयनिक प्रतिशतता का परिकलन भी कीजिए।
हल:
μ सैद्धान्तिक = q x d = 2.6 × 10-10 m × 1.602 × 10-19 C
= 4.1652 × 10-29 C-m

प्रश्न 18.
HF का द्विध्रुव आघूर्ण (1.98D), HCl के द्विध्रुव आघूर्ण (1.03D) से अधिक क्यों होता है?
उत्तर:
HCl की अपेक्षा HF अधिक ध्रुवी है; क्योंकि CI की अपेक्षा F अधिक विद्युत ऋणात्मक होता है। हम जानते हैं कि विद्युत ऋणात्मकता में अन्तर अधिक होने पर ध्रुवणता अधिक होती है अर्थात् द्विध्रुव आघूर्ण अधिक होता है।
प्रश्न 19.
LiH का द्विध्रुव आघूर्ण 1964 x 10-29Cm है तथा अणु में Li व H की अन्तरपरमाण्विक दूरी 1.596 Å है। LiH में आयनिक प्रतिशतता ज्ञात कीजिए।
हल:
दिया है,
= q x d
d = 1·596 Å = 1.596 × 10-10 m
q = 1.602 x 10-19 C
सैद्धान्तिक द्विध्रुव आघूर्ण = q x d
µ = 1.602 × 10-19 × 1.596 × 10-10
µ = 2.557 x 110-29C-m

प्रश्न 20.
निम्नलिखित में प्रत्येक की ठोस अवस्था पर विचार कीजिए –
(i) मेथेन
(ii) सीजियम क्लोराइड
(iii) जर्मेनियम
(iv) लीथियम
(v) आर्गन
(vi) बर्फ।
इनमें से कौन-सा निम्नलिखित का एक उदाहरण होगा-
(क) उच्च गलनांक, संजाल ठोस
(ख) अचालक ठोस जो गलित अवस्था में अच्छा चालक बन जाता है
(ग) उच्च विद्युत तथा ऊष्मीय चालकता का ठोस
(घ) वाण्डर वाल्स बलों द्वारा जुड़ा एक निम्न गलनांक वाला ठोस
(ङ) हाइड्रोजन युक्त ठोस।
उत्तर:
(क) जर्मेनियम
(ख) सीजियम क्लोराइड
(ग) लीथियम
(घ) आर्गन
(ङ) बर्फ।
प्रश्न 21.
BF3 में संकरण बताइये व संरचना दीजिए।
उत्तर:
sp² संकरण होता है।
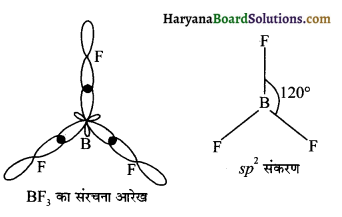
प्रश्न 22.
NH3 का विद्युत आघूर्ण NF3 से अधिक होता है, समझाइए।
उत्तर:
NH3 का विद्युत आघूर्ण NF3 से अधिक होता है, क्योंकि NH3 में N की विद्युत ऋणात्मकता अधिक होने के कारण N – H बंध का आघूर्ण N की ओर होता है एवं एकाकी इलेक्ट्रॉन युग्म का आघूर्ण तीनों N – H बंधों के परिणामी आघूर्ण की तरफ होता है। जिसके कारण NH3 का द्विध्रुव अधिक होता है, परन्तु NF3 में N की विद्युत ऋणता F से कम है जिस कारण N – F का बंध आघूर्ण F की तरफ होता है। इसलिए एकाकी इलेक्ट्रॉन युग्म का आघूर्ण N – F बंध आघूर्ण के विपरीत दिशा में होता है, जिसके कारण NF3 का द्विआघूर्ण कम होता है।
प्रश्न 23.
H2O द्रव है, जबकि HS गैस है तथा CO2 रेखीय एवं SO2 कोणीय हैं, क्यों?
उत्तर:
H2O के केन्द्रीय परमाणु पर उपस्थित बंधी इलेक्ट्रॉन युग्मों प्रतिकर्षण कम होता है। H2O में बंध कोण का मान 104°3′ होता है, जबकि H2S में बंधित इलेक्ट्रॉन युग्मों के मध्य अधिक प्रतिकर्षण होता है।
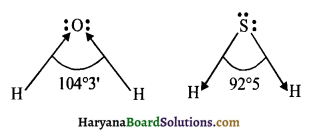
CO2 रेखीय है, क्योंकि CO2 के केन्द्रीय परमाणु C के चारों ओर बंध क्रम अधिकतम होता है, परन्तु SO2 में केन्द्रीय परमाणु S पर इलेक्ट्रॉन युग्मों की उपस्थिति के कारण उसकी संरचना कोणीय होती है।
प्रश्न 24.
निम्न को समझाइए।
(1) He2 अज्ञात है पर He2+ ज्ञात है, ऐसा क्यों?
उत्तर:
हम जानते हैं कि हीलियम परमाणु को 2He4 से प्रदर्शित करते हैं। He2+ का ज्ञात होने का तात्पर्य है कि हीलियम से दो इलेक्ट्रॉन निकलकर दूसरे किसी ग्राही तत्व के पास गये जबकि He2 का कोई तात्पर्य नहीं है।
(2) VSEPR में PCl5, ICl2 तथा NO3– की ज्यामिति का निर्धारण करो।
उत्तर:
VSEPR के अनुसार PCl5, ICl2 तथा NO3– की ज्यामिति निम्नलिखित है-
(i) PCl5, फॉस्फोरस पेन्टाक्लोराइड अणु में एक फॉस्फोरस परमाणु व पाँच क्लोरीन परमाणु सामान्य सहसंयोजक बंधों द्वारा जुड़े हुए हैं।
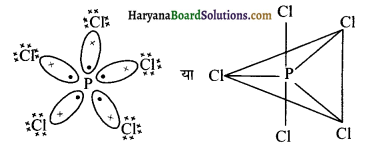
PCl5 की ज्यामिति पंचभुजीय द्विपिरामिडीय होगी एवं बंध कोण का मान 72° तथा 90° होगा।
(ii) ICl2 की ज्यामिति
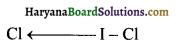
ICl2 का ज्यामिती रेखीय होगी।
(iii) NO3– की ज्यामिति-
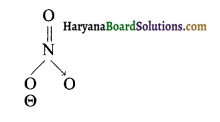
अत: NO3– की ज्यामिति समतल त्रिभुजाकार होगी।
प्रश्न 25.
SO2 में S की संकरण अवस्था तथा SO22- आयन की आकृति क्या होगी ?
उत्तर:
SO2 में सल्फर की संकरण अवस्था sp³ होगी एवं SO42- की ज्यामिति चतुष्फलकीय (tetrahedral) होगी।
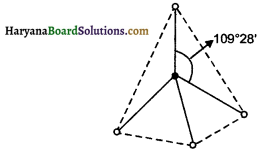
प्रश्न 26.
SF4 अणु की ज्यामिति ज्ञात कीजिए तथा इसमें एकाकी युग्म की स्थिति की विवेचना कीजिए।
उत्तर:
SF4 अणु की ज्यामिति – S में संयोजकता कोश आंशिक रूप से भरा रहता है (3s², 3p², 3d0)। अत: पर उपस्थित एकाकी
इलेक्ट्रॉन युग्म पर प्रतिकर्षण कम होने के कारण इलेक्ट्रॉन युग्म में प्रतिकर्षण कम होगा। जिससे बंध कोण प्रभावित रहता है।
S की परिवर्ती संयोजकता + 4 व + 6 हैं। अतः SF4 अणु की ज्यामिति इस प्रकार होगी-
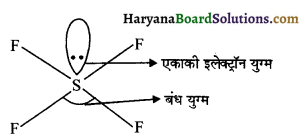
एकाकी इलेक्ट्रॉन युग्म केवल एक परमाणु से सम्बन्धित होता है। इलेक्ट्रॉन युग्म त्रिविम में फैला रहता है। SF4 अणु में केन्द्रीय परमाणु S के पास इलेक्ट्रॉन युग्म की संख्या एक होगी।
अतः प्रतिकर्षण के कारण इस अणु के बंध कोण में कमी आ जाती है। SF4 में sp³d संकरण पाया जाता है।