Haryana State Board HBSE 11th Class Chemistry Important Questions Chapter 6 ऊष्मागतिकी Important Questions and Answers.
Haryana Board 11th Class Chemistry Important Questions Chapter 6 ऊष्मागतिकी
बहुविकल्पीय प्रश्न
1. कौन-सी अभिक्रिया CO2(g) की सम्भवन ऊष्मा को प्रदर्शित करती है-
(1) CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
(2) CO(g) + \(\frac { 1 }{ 2 }\)O2(g) → CO2(g)
(3) C(ग्रेफाइट) + O2(g) → CO2(g)
(4) CO(g) + H2O(g) → CO2(g) + H(g)
उत्तर:
(3) C(ग्रेफाइट) + O2(g) → CO2(g)
2. सही क्रम चुनिये-
(1) 1 cal > 1 Joule > 1 erg
(2) 1 erg > 1 Joule > 1 cal
(3) 1 erg > 1 cal > 1 Joule
(4) 1 Joule > 1 cal > 1 erg.
उत्तर:
(1) 1 cal > 1 Joule > 1 erg
3. एक ऊष्माक्षेपी अभिक्रिया –
(1) होती है, केवल गरम करने पर
(2) ऊष्मा के अवशोषण से सम्पन्न होती है
(3) ज्वाला द्वारा सम्पन्न होती है
(4) ऊष्मा के उत्सर्जित होने से सम्पन्न होती है।
उत्तर:
(4) ऊष्मा के उत्सर्जित होने से सम्पन्न होती है।
4. मानक अवस्थाओं की स्थितियाँ हैं-
(1) 0°C तथा 1 atm
(2) 20°C तथा 1 atm
(3) 25°C तथा 1 atm
(4) 0°K तथा 1 atm.
उत्तर:
5. Cl(g) + e– → Cl–(q) के लिये ∆H का मान है-
(1) धनात्मक
(2) ऋणात्मक
(3) शून्य
(3) अनन्त।
उत्तर:
(2) ऋणात्मक
6. जब निकाय को उष्मा (q) दी जाये तथा निकाय के द्वारा w कार्य किया जाये तो ऊष्मागतिकी के प्रथम नियम का गणितीय रूप होता है-
(1) ∆E = q + w
(2) ∆E = q – w
(3) ∆E = q + w
(4) ∆E = – q – w.
उत्तर:
(2) ∆E = q – w
7. अभिक्रिया CO(g) + \(\frac { 1 }{ 2 }\)O2(g) के लिये कौन-सा कथन है-
(1) ∆H = ∆E
(2) ∆H < ∆E
(3) ∆H > ∆E
(4) उपर्युक्त में से कोई नहीं।
उत्तर:
(2) ∆H < ∆E
8. अभिक्रिया S + O2 → SO2 का एन्थैल्पी परिवर्तन है-
(1) धनात्मक
(2) ऋणात्मक
(3) शून्य
(4) उपर्युक्त में से कोई नहीं।
उत्तर:
(2) ऋणात्मक
![]()
9. निम्न में से कौन-सा कथन गलत है-
(1) कार्य एक अवस्था फलन है
(2) तापमान एक अवस्था फलन है
(3) अवस्था परिवर्तन पूर्ण रूप से निश्चित होता है यदि प्रारम्भिक तथा अन्तिम अवस्था निर्दिष्ट है
(4) कार्य निकाय की सीमा पर प्रतीत होता है।
उत्तर:
(1) कार्य एक अवस्था फलन है
10. CO2 की मानक मोलर सम्भवन एन्थैल्पी-
(1) शून्य के बराबर है
(2) गैसीय कार्बन की मानक मोलर दहन एन्थैल्पी के बराबर है।
(3) CO तथा O2 की मानक मोलर सम्भवन एन्थैल्पियों के योग के बराबर है।
(4) कार्बन (ग्रेफाइट) की मानक मोलर दहन एन्थैली के बराबर है।
उत्तर:
(4) कार्बन (ग्रेफाइट) की मानक मोलर दहन एन्थैली के बराबर है।
11. किसी अभिक्रिया की एन्थैल्पी परिवर्तन निर्भर नहीं करती है-
(1) अभिकारकों एवं उत्पादों की अवस्था पर
(2) अभिकारकों एवं उत्पादों की प्रकृति पर
(3) विभिन्न इण्टरमीडिएट अभिक्रियाओं पर
(4) अभिक्रिया की प्रारम्भिक एवं अन्तिम अवस्था की एन्थैल्पी परिवर्तन पर ।
उत्तर:
(3) विभिन्न इण्टरमीडिएट अभिक्रियाओं पर
12. किसी प्रक्रम को ऊष्मागतिकी रूप से उत्क्रमणीय समझा जाता है यदि –
(1) परिवेश और निकाय का एक-दूसरे में परिवर्तन हो
(2) परिवेश और निकाय ‘बीच कोई परिसीमा न हो
(3) परिवेश सदा निकाय में सन्तुलन में हो
(4) निकाय परिवेश में स्वतः परिवर्तित होता हो।
उत्तर:
(3) परिवेश सदा निकाय में सन्तुलन में हो
13. ऊर्जा की बड़ी मात्रा कौन प्रदर्शित करती है-
(1) कैलोरी
(2) जूल
(3) अर्ग
(4) इलैक्ट्रॉन वोल्ट।
उत्तर:
(1) कैलोरी
14. हेस का नियम सम्बन्धित है-
(1) अभिक्रिया होने पर ऊष्मा परिवर्तन से
(2) अभिक्रिया वेग से
(3) साम्य स्थिरांक से
(4) गैस के आयतन पर दाब के प्रभाव से।
उत्तर:
(1) अभिक्रिया होने पर ऊष्मा परिवर्तन से
15. ऊष्मागतिकी का प्रथम नियम स्पष्ट करता है-
(1) भार का संरक्षण
(2) ऊर्जा का संरक्षण
(3) भार एवं ऊर्जा दोनों के संरक्षण को
(4) उपर्युक्त में से कोई नहीं
उत्तर:
(2) ऊर्जा का संरक्षण
16. बन्द निकाय के लिये कौन-सा कथन सही है-
(1) निकाय अपने परिवेश के साथ ऊर्जा का विनिमय कर सकता है, द्रव्य का नहीं
(2) निकाय अपने परिवेश के साथ द्रव्य एवं ऊर्जा दोनों का विनियम कर सकता है
(3) निकाय अपने परिवेश के साथ न ऊर्जा का और न द्रव्य का विनिमय कर सकता है।
(4) निकाय अपने परिवेश के साथ द्रव्य का विनिमय कर सकता है, ऊर्जा का नहीं।
उत्तर:
(1) निकाय अपने परिवेश के साथ ऊर्जा का विनिमय कर सकता है, द्रव्य का नहीं
17. रुद्धोष्म परिवर्तन में विनिमय का ताप-
(1) स्थिर रहता है
(2) घटता है
(3) बढ़ता है
(4) घटता है या बढ़ता है।
उत्तर:
(4) घटता है या बढ़ता है।
18. हेस के नियम से गणना होती है-
(1) अभिक्रिया की एन्थैल्पी
(2) अभिक्रिया की एन्ट्रॉपी
(3) अभिक्रिया में किये गये कार्य की
(4) उपरोक्त सभी।
उत्तर:
(1) अभिक्रिया की एन्थैल्पी
![]()
19. अभिक्रिया N2 + 3H2 → 2NH3 निश्चित ताप एवं दाब पर होती है। यदि ∆H एवं ∆U अभिक्रिया की एन्बैल्पी तथा आन्तरिक ऊर्जा परिवर्तन हैं तो निम्न में से कौन सही है-
(1) ∆H > ∆U
(2) ∆H < ∆U
(3) ∆H = ∆U
(4) ∆H = 0.
उत्तर:
(2) ∆H < ∆U
20. वह निकाय जिसमें पदार्थ तथा ऊर्जा दोनों का अपने परिवेश से विनिमय होता है, कहलाता है-
(1) खुला तंत्र
(2) बंद तंत्र
(3) विलगित तंत्र
(4) समांगी तंत्र।
उत्तर:
(1) खुला तंत्र
21. एक ऊष्मागतिक मात्रा में है-
(1) ऊष्मीय परिवर्तनों के माप में प्रयुक्त की जाने वाली मात्रा
(2) वह मात्रा जिसका मान तंत्र की अवस्था पर निर्भर करता है
(3) वह मात्रा जो ऊष्मागतिकी में प्रयुक्त होती है
(4) वह मात्रा जो ऊष्मागतिकी नियमों का पालन करती है।
उत्तर:
(1) ऊष्मीय परिवर्तनों के माप में प्रयुक्त की जाने वाली मात्रा
22. एक निश्चित दाब पर किसी तंत्र द्वारा ऊष्मा Q अवशोषित की जाती है। ऊष्मा Q का मान निम्नलिखित में से किस के बराबर होगा-
(1) तंत्र के ऊर्जा परिवर्तन (U) के
(2) तंत्र के ऊर्जा एन्थल्पी परिवर्तन (∆H) के
(3) तंत्र के आयतन परिवर्तन (∆H) के
(4) उपर्युक्त में से किसी के नहीं।
उत्तर:
(2) तंत्र के ऊर्जा एन्थल्पी परिवर्तन (∆H) के
23. ऐसा परिवर्तन जिसमें निकाय का तापमान अपरिवर्तित रहता है, वह है-
(1) रुद्धोष्म परिवर्तन
(2) समतापी परिवर्तन
(3) उत्क्रमणीय परिवर्तन
(4) अनुत्क्रमणीय परिवर्तन।
उत्तर:
(2) समतापी परिवर्तन
24. किसी रासायनिक अभिक्रिया की स्थिर दाब पर ऊष्मा (Q) का मान किस के बराबर होता है-
(1) क्रियाफलों की आंतरिक ऊर्जा- क्रियाकारकों की आंतरिक ऊर्जा
(2) क्रियाकारकों की आंतरिक ऊर्जा- क्रियाफलों की आंतरिक ऊर्जा
(3) क्रियाफलों की एन्थेल्पी क्रियाकारकों की एन्यल्पी
(4) क्रियाकारकों की एन्थैल्पी क्रियाफलों की एन्थैल्पी।
उत्तर:
(3) क्रियाफलों की एन्थेल्पी क्रियाकारकों की एन्यल्पी
25. निश्चित आयतन पर एक रासायनिक अभिक्रिया में ऊष्मा परिवर्तन है-
(1) ∆H
(2) ∆P
(3) ∆E
(4) ∆V
उत्तर:
(3) ∆E
26. एन्थैल्पी को परिभाषित करते हैं-
(1) H + U/PV
(2) H = U + PV
(3) H = U(P + V)
(4) H = U – PV
उत्तर:
(2) H = U + PV
27. एक भारहीन पिस्टन द्वारा स्थिर ताप पर प्रसार ∆V है। यदि पिस्टन का दाब चरांक (variable) हो तो पिस्टन द्वारा किया गया कार्य निम्नलिखित होगा-
(1) W = PV
(2) W = ∆PAV
(3) W = शून्य
(4) इनमें से कोई नहीं।
उत्तर:
(4) इनमें से कोई नहीं।
28. स्वतः प्रक्रम के लिए कौन-सा कथन असत्य है-
(1) स्वतः प्रक्रम एक ही दिशा में होते हैं
(2) स्वतः प्रक्रम सदैव तेज गति से सम्पन्न होते हैं
(3) स्वतः प्रक्रम एक अनुत्क्रमणीय प्रक्रिया है
(4) स्वतः परिवर्तन पर तंत्र की आंतरिक ऊर्जा कम होती है।
उत्तर:
(2) स्वतः प्रक्रम सदैव तेज गति से सम्पन्न होते हैं
29. एक तन्त्र की एन्थैल्पी में परिवर्तन (∆H) निर्भर करता है-
(1) प्रारम्भिक अवस्था पर
(2) अन्तिम अवस्था पर
(3) प्रारम्भिक एवं अन्तिम दोनों अवस्थाओं पर
(4) उपरोक्त में से कोई नहीं।
उत्तर:
(3) प्रारम्भिक एवं अन्तिम दोनों अवस्थाओं पर
30. रासायनिक अभिक्रियाएँ स्वतः ही उस दिशा में सम्पन्न हो जाती
(1) जिस दिशा में मुक्त ऊर्जा की कमी होती है
(2) जिस दिशा में कोई उपयोगी कार्य नहीं हो
(3) जिस दिशा में मुक्त ऊर्जा में वृद्धि होती है
(4) इनमें से कोई नहीं।
उत्तर:
(1) जिस दिशा में मुक्त ऊर्जा की कमी होती है
31. स्थिर ताप एवं दाब पर रासायनिक अभिक्रिया में होने वाले ऊष्मा विनिमय को कहते हैं-
(1) आन्तरिक ऊर्जा
(2) ए-थैल्पी
(3) एन्ट्रॉपी
(4) मुक्त ऊर्जा।
उत्तर:
(2) ए-थैल्पी
32. एक अभिक्रिया में एन्थैल्पी परिवर्तन निर्भर नहीं करता है-
(1) अभिकारकों एवं उत्पादों की अवस्थाओं पर
(2) अभिकारकों एवं उत्पादों की प्रकृति पर
(3) अभिक्रिया के विभिन्न मध्यवर्ती चरणों पर
(4) अभिक्रिया की प्राथमिक एवं अंतिम एन्थैल्पी पर
उत्तर:
(3) अभिक्रिया के विभिन्न मध्यवर्ती चरणों पर
33. एक अच्छी तरह से बंद थर्मस फ्लास्क में कुछ बर्फ के टुकड़े (ice cube) रखे हुये हैं, यह उदाहरण है-
(1) बंद निकाय का
(2) खुले निकाय का
(3) विलगित निकाय का
(4) गैर- ऊष्मागतिकीय निकाय का।
उत्तर:
(3) विलगित निकाय का
34. स्थिर ताप एवं दाब पर एक रासायनिक अभिक्रिया में होने वाले ऊष्मा विनिमय को कहते हैं-
(1) आन्तरिक ऊर्जा
(2) एन्थैल्पी
(3) एन्ट्रॉपी
(4) मुक्त ऊर्जा।
उत्तर:
(2) एन्थैल्पी
35. मोलर एन्थैल्पी परिवर्तन में मानक (standard) शब्द इंगित करता है।
(1) 298 K ताप को
(2) 1 वायुमण्डलीय दाब को
(3) 298 K ताप एवं 1 वायुमण्डलीय दाब को
(4) सभी ताप व दाब को।
उत्तर:
(3) 298 K ताप एवं 1 वायुमण्डलीय दाब को
36. C-A, C-B, C-D और C-E बंधो की बंध वियोजन ऊर्जा क्रमश: 240, 382, 276 तथा 486 kJ mol-1 है। सबसे छोटा परमाणु कौन-सा होगा-
(1) A
(2) B
(3) D
(4) E.
उत्तर:
(4) E.
37. अभिक्रिया की एन्थैल्पी ∆H निम्न प्रकार प्रदर्शित की जा सकती है-
(1) ∆H = ∑Hp – ∑HR
(2) ∆H = dHp – dHR
(3) ∆H = \(\frac{\mathrm{dH}_{\mathrm{P}}}{\mathrm{dH}_{\mathrm{R}}}\)
(4) ∆H = \(\frac{\Sigma \mathrm{H}_{\mathrm{P}}}{\Sigma \mathrm{H}_{\mathrm{R}}}\)
उत्तर:
(1) ∆H = ∑Hp – ∑HR
![]()
38. निम्न में से किसके लिये ∆S° शून्य से अधिक है।
(1) CaO(s) + CO2(g) → CaCO3(s).
(2) NaCl(aq) → NaCl(s)
(3) NaNO3(s) → Na+(aq) + NO3(aq)
(4) N2(g) + 3H2(g) → 2NH3(g)
उत्तर:
(3) NaNO3(s) → Na+(aq) + NO3(aq)
39. एन्ट्रॉपी को ऊष्मागतिक प्राचल मानने पर यह किस प्रक्रम की स्वतः प्रवर्तिता का निर्धारक है-
(1) ∆S(निकाय) + ∆S(परिवेश) > 0
(2) ∆S(निकाय) – ∆S(परिवेश) > 0
(3) ∆S(निकाय) > 0
(4) ∆S(निकाय) > 0.
उत्तर:
(1) ∆S(निकाय) + ∆S(परिवेश) > 0
40. ऊष्माधारिता है-
(1) \(\frac { dq }{ dT }\)
(2) dq x dT
(3) ∑q x \(\frac { 1 }{ dT }\)
(4) उपर्युक्त में से कोई नहीं।
उत्तर:
(1) \(\frac { dq }{ dT }\)
अति लघु उत्तरीय प्रश्न
प्रश्न 1.
किस शर्त पर ΔH का मान ΔE के बराबर होगा?
उत्तर:
स्थिर ताप व आयतन पर।
प्रश्न 2.
Cl2 की विरचन एन्थैल्पी क्या है?
उत्तर:
शून्य।
प्रश्न 3.
एन्ट्रॉपी, मुक्त ऊर्जा को किससे व्यक्त करते हैं?
उत्तर:
एन्ट्रॉपी को 5 से तथा मुक्त ऊर्जा को G अथवा A से व्यक्त करते हैं।
प्रश्न 4.
Cv, Cp से आप क्या समझते हैं?
उत्तर:
Cv स्थिर आयतन पर ऊष्माधारिता है तथा Cp स्थिर दाब पर ऊष्माधारिता है।
प्रश्न 5.
थैल्पी एवं आन्तरिक ऊर्जा परिवर्तनों के बीच सम्बन्ध लिखिए।
उत्तर:
∆H = ∆E + P∆V या ∆H = ∆E + ∆ngRT।
प्रश्न 6.
हैस के नियम को प्रयोगात्मक रूप से सिद्ध किया जा सकता है या नहीं?
उत्तर:
नहीं।
प्रश्न 7.
ऊर्जा संरक्षण का नियम क्या है?
उत्तर:
ऊष्मागतिकी का प्रथम नियम ही ऊर्जा संरक्षण का नियम है।
प्रश्न 8.
बम कैलोरीमीटर क्या है?
उत्तर:
वह पात्र जिसमें रासायनिक अभिक्रिया में उत्पन्न या अवशोषित ऊष्मा की मात्रा को मापा जाता है, उसे बम कैलोरीमीटर कहते हैं।
प्रश्न 9.
निकाय कितने प्रकार के होते हैं?
उत्तर:
निकाय पाँच प्रकार के होते हैं-
समांगी निकाय, विषमांगी निकाय, खुला निकाय, बन्द निकाय, विलगित निकाय।
प्रश्न 10.
ऊर्जा किसे कहते ‘तथा यह कितने प्रकार की होती हैं?
उत्तर:
कार्य करने की क्षमता को ऊर्जा कहते हैं। यह दो प्रकार की होती है –
- बाहरी ऊर्जा एवं
- आन्तरिक ऊर्जा।
प्रश्न 11.
ऊष्मागतिकी के प्रथम नियम का गणितीय व्यंजक लिखिए।
उत्तर:
∆E = q + w
या
∆E = q – P∆V
प्रश्न 12.
खुला निकाय को परिभाषित कीजिए।
उत्तर:
वह निकाय जो परिवेश से ऊर्जा और द्रव्य दोनों का विलय कर सके, खला निकाय कहलाता है।
प्रश्न 13.
किसी निकाय की एन्बैल्पी उसकी आन्तरिक ऊर्जा से किस प्रकार सम्बन्धित है?
उत्तर:
∆H = ∆E + P∆V, जहाँ ∆H, ∆E और ∆V निकाय के एन्थल्पी, आन्तरिक ऊर्जा और आयतन में परिवर्तन है।
प्रश्न 14.
∆H को परिभाषित कीजिए तथा बताइए कि ∆H का चिह्न ऊष्माक्षेपी तथा उष्माशोषी अभिक्रिया में क्या होगा?
उत्तर:
∆H निकाय की एन्थल्पी में परिवर्तन है। स्थिर दाब पर निकाय द्वारा अवशोषित ऊष्मा को निकाय का एन्थैल्पी परिवर्तन कहते हैं। ऊष्माक्षेपी अभिक्रियाओं के लिए ∆H का मान ऋणात्मक तथा ऊष्माशोषी अभिक्रियाओं के लिए धनात्मक होता है।
प्रश्न 15.
समतापीय प्रक्रम से आप क्या समझते हैं?
उत्तर:
समतापीय प्रक्रम- स्थिर ताप पर किया जाने वाला प्रक्रम समतापीय प्रक्रम कहलाता है।
प्रश्न 16.
उस चरांक को बताइए जिसे समदाबीय प्रक्रम में स्थिर रखा जाता है।
उत्तर:
दाब।
प्रश्न 17.
किस प्रकार ऊर्ध्वपातन की एन्थैल्पी, गलन का वाष्पन की एन्थैल्पी से सम्बन्धित है।
उत्तर:
ऊर्ध्वपातन की एन्थेल्पी वाष्पन की ऊष्मा और गलन की ऊष्मा का योग होती है।
∆H(s) = ∆H(l) + ∆H(v)
प्रश्न 18.
उत्क्रमणीय प्रक्रम से आप क्या समझते हो?
उत्तर:
उत्क्रमणीय प्रक्रम-यदि किसी प्रक्रम में प्रक्रम को चलाने वाले बल की मात्रा विरोधी बल मात्रा से अत्यन्त सूक्ष्म मात्रा में अधिक तो विरोधी बल की मात्रा अत्यन्त सूक्ष्म बढ़ा देने से प्रक्रम उत्क्रमणीय हो जाता है, ऐसे प्रक्रम को उत्क्रमणीय प्रक्रम कहते हैं।
प्रश्न 19.
ऊष्माधारिता को परिभाषित कीजिए।
उत्तर:
किसी निकाय या द्रव्य के ताप को K बढ़ाने के लिए जितनी ऊष्मा की आवश्यकता होती है उसे उस निकाय की ऊष्माधारिता कहते हैं।
प्रश्न 20.
एक मोल ऐसीटोन को एक मोल जल की तुलना वाष्पीकृत होने के लिये कम ऊष्मा की आवश्यकता होती है, निम्न में से किस द्रव की वाष्पीकरण की ऊष्मा अधिक है?
उत्तर:
जिस द्रव के एक मोल को वाष्पीकृत होने के लिये कम ऊष्मा की आवश्यकता होती है उसके वाष्पीकरण की ऊष्मा भी कम होती है, अतः जल की वाष्पीकरण की ऊष्मा का मान अधिक होता है।
प्रश्न 21.
चक्रीय प्रक्रमं पद को समझाइए।
उत्तर:
चक्रीय प्रक्रम वह प्रक्रम जिसमें निकाय विभिन्न परिवर्तनों से गुजरता हुआ पुनः अपनी प्रारम्भिक अवस्था में आ जाये तो ऐसे प्रक्रम को चक्रीय प्रक्रम कहते हैं।
प्रश्न 22.
हेस का नियम क्या है?
उत्तर:
हेस का नियम – इस नियम के अनुसार यदि किसी रासायनिक अभिक्रिया या परिवर्तन को एक या अनेक पदों में दो या दो से अधिक विधियों द्वारा सम्पन्न किया जाये तो सम्पूर्ण परिवर्तन में उत्पन्न या अवशोषित ऊष्मा की मात्राएँ समान रहेंगी, चाहे परिवर्तन किसी भी ढंग से किया जाये।
प्रश्न 23.
तन्त्र पर कार्य किया जाता है तो तन्त्र की आन्तरिक ऊर्जा पर क्या प्रभाव पड़ेगा?
उत्तर:
बढ़ेगी
प्रश्न 24.
बन्दूक से छूटी गोली लक्ष्य से टकराने के बाद गर्म क्यों हो जाती है?
उत्तर:
लक्ष्य से टकराने पर गोली की गतिज ऊर्जा ऊष्मीय ऊर्जा में बदल जाने के कारण गोली इस ऊष्मा को अवशोषित करके गर्म हो जाती है।
प्रश्न 25.
किन परिस्थितियों में गैस की विशिष्ट ऊष्मा का मान शून्य तथा अनन्त होगा?
उत्तर:
रूद्धोष्म प्रक्रम में गैस की विशिष्ट ऊष्मा शून्य होती है तथा समतापी प्रक्रम में गैस की विशिष्ट ऊष्मा अनन्त होती है।
![]()
प्रश्न 26.
किसी ऊष्मागतिक निकाय की आन्तरिक ऊर्जा से आप क्या समझते हैं?
उत्तर:
किसी गैस के अणुओं की स्थानान्तरीय गतिज ऊर्जा, घूर्णीय गतिज ऊर्जा, कम्पनिक गतिज ऊर्जा तथा स्थितिज ऊर्जा का योग उस गैस के ऊष्मागतिक निकाय की आन्तरिक ऊर्जा कहलाती है।
प्रश्न 27.
एक आदर्श गैस को स्थिर ताप पर सम्पीडित किया जाता है। इसकी आन्तरिक ऊर्जा में क्या परिवर्तन होगा?
उत्तर:
आदर्श गैस की आन्तरिक ऊर्जा केवल ताप पर निर्भर करती है अतः इसकी आन्तरिक ऊर्जा में कुछ भी परिवर्तन नहीं होगा।
प्रश्न 28.
बर्फ को छूने से ठण्डा क्यों लगता है?
उत्तर:
क्योंकि बर्फ हमारे हाथ से ऊष्मा को ग्रहण कर लेती है।
प्रश्न 29.
बन्ध बनने में सदैव ऊष्मा का उत्सर्जन होता है, क्यों?
उत्तर:
बन्ध बनाते समय परमाणुओं में प्रबल आकर्षण के कारण सदैव ऊष्मा का उत्सर्जन होता है।
प्रश्न 30.
ब्रह्माण्ड की एन्ट्रॉपी लगातार बढ़ रही है, क्यों?
उत्तर:
बह्माण्ड में स्वतः प्रवर्तित अभिक्रियायें अधिक होती रहती हैं, अतः एन्ट्रॉपी का मान बढ़ता जा रहा है।
प्रश्न 31.
ऊर्जा में क्या परिवर्तन होता है जब कोई तेज गति करती हुयी कार लाल सिग्नल पर एकाएक रुकती है?
उत्तर:
कार की कुछ गतिज ऊर्जा, टायरों एवं ब्रेक पैड पर ऊष्मा में परिवर्तित होती है तथा कुछ कार को रोकने में कार्य करने में प्रयुक्त हो जाती है।
प्रश्न 32.
अभिक्रिया SO2 + \(\frac { 1 }{ 2 }\)O2 → SO3 में एन्बैल्पी परिवर्तन की प्रकृति क्या होगी?
उत्तर:
कम होगी, दहन ऊष्मा सदैव उत्सर्जित होती है।
प्रश्न 33.
एन्थल्पी एक विस्तीर्ण अथवा बाह्य गुण है। माना कि एक अभिक्रिया A → B की एक पथ की एन्थैल्पी का मान ∆rH1 है जबकि इसके दूसरे पथ की विभिन्न इन्टरमीडिएट पथों की एन्थेल्पी का मान ∆rH1, ∆rH2, ∆rH3 …. इत्यादि है तो बतायें कि ∆rH व ∆rH, ∆rH2 …….. इत्यादि के मध्य क्या सम्बन्ध है?
उत्तर:
हँस के नियमानुसार, ∆rH = ∆rH1 + ∆rH2 + ∆rH3 ….
प्रश्न 34.
जल के जमने की ऊष्माक्षेपी अभिक्रिया किस तापक्रम पर स्वतः अग्रसरित नहीं होगी।
उत्तर:
0°C से ऊपर।
प्रश्न 35.
ऊष्मागतिकी साम्यावस्था पर कौन-कौन सी साम्य अवस्थाएँ होती हैं।
उत्तर:
- तापीय साम्यावस्था
- रासायनिक साम्यावस्था
- यांत्रिक साम्यावस्था।
प्रश्न 36.
स्थिर दाब एवं स्थिर आयतन पर होने वाली अभिक्रियाओं में उत्सर्जित होने वाली ऊष्माओं को किन परिवर्तनों के द्वारा व्यक्त करते हैं?
उत्तर:
स्थिर दाब पर : ∆H
स्थिर आयतन पर : ∆U
प्रश्न 37.
Cp व Cv के मध्य अन्तर को एक सूत्र H = U + PV के द्वारा बताया जा सकता है 10 मोल आदर्श गैस के लिये Cp तथा Cv के मध्य अन्तर के मान को बतायें?
उत्तर:
Cp – Cv = nR
= 10 x 8.314 J
= 83.14 J
प्रश्न 38.
साम्यावस्था पर मुक्त ऊर्जा परिवर्तन (∆G) का मान क्या होगा?
उत्तर:
∆G = 0.
प्रश्न 39.
जल के हिमांक पर मुक्त ऊर्जा परिवर्तन का मान क्या होगा?
उत्तर:
∆G = 0 क्योंकि हिमांक साम्यावस्था (बर्फ जल) होती है।
प्रश्न 40.
किसी तत्व की उसकी मानक अवस्था में मानक एन्थैल्पी मान क्या होता है?
उत्तर:
किसी तत्व की उसकी मानक अवस्था में मानक एन्थैल्पी मान शून्य होता है।
प्रश्न 41.
किसी ईंधन की उच्च गुणवत्ता होने के लिये प्राथमिक आवश्यकता क्या है?
उत्तर:
किसी ईंधन की उच्च गुणवत्ता होने के लिये उसका ऊष्मीय मान अधिक होना चाहिये। ऊष्मा उत्सर्जित होगी अथवा अवशोषित ।
प्रश्न 42.
फ्लुओरीन का ऑक्सीजन में दहन होने पर अभिक्रिया
उत्तर:
यहाँ अभिक्रिया में ऊष्मा अवशोषित होती है।
प्रश्न 43.
उदासीनीकरण में निर्मुक्त ऊष्मा का प्रयोगात्मक मान, दुर्बल अम्लों एवं दुर्बल क्षारों में 13.7 kcal से कम आता है, क्यों?
उत्तर:
उदासीनीकरण में निर्मुक्त ऊष्मा का प्रयोगात्मक मान, दुर्बल अम्लों एवं दुर्बल क्षारों में 13.7 kcal से कम आता है क्योंकि उत्सर्जित ऊष्मा का कुछ भाग दुर्बल अम्ल का दुर्बल क्षार या दोनों के वियोजन में खर्च हो जाता है।
![]()
प्रश्न 44.
जल की एन्ट्रॉपी बर्फ से अधिक क्यों होती है?
उत्तर:
जल की एन्ट्रॉपी बर्फ से अधिक होती है क्योंकि जल के अणुओं की मुक्त गति के कारण यहाँ पर अव्यवस्था अधिक होती है। बर्फ में अणु ठोस अवस्था में रहने के कारण अधिक व्यवस्थित होते हैं।
प्रश्न 45.
NaCl के विलयन की ऊष्मा का मान धनात्मक होता है, क्यों?
उत्तर:
∆Hक्लिन = ∆Hआवन + ∆Hजलयोजन
∵ ∆Hजलयोजन का मान ऋणात्मक तथा ∆Hआयन का मान धनात्मक होता है तथा NaCl के ∆Hआयन का मान ∆Hजलयोजन से अधिक होता है अतः ∆Hविलयन का मान धनात्मक होता है।
प्रश्न 46.
सीसे के एक टुकड़े को हथौड़े से पीटा जाता है। क्या इससे सीसे की आन्तरिक ऊर्जा बढ़ेगी? क्या सीसे को बाहर से ऊष्मा दी गई?
उत्तर:
सीसे के टुकड़े पर बाहर से कार्य किया गया है अतः इसकी आन्तरिक ऊर्जा बढ़ेगी। सीसे को बाहर से कोई भी ऊष्मा नहीं दी गयी।
प्रश्न 47.
ठण्डे जल की बाल्टी में गर्म लोहे के टुकड़े को डालने से क्या जल की आन्तरिक ऊर्जा बढ़ेगी? क्या लोहे के टुकड़े ने कुछ कार्य किया?
उत्तर:
ठण्डे जल की बाल्टी में गर्म लोहे के टुकड़े को डालने पर ठण्डे जल के ताप में वृद्धि होगी, क्योंकि जल की आन्तरिक ऊर्जा बढ़ जाती है जल की आन्तरिक ऊर्जा में वृद्धि ऊष्मास्थानान्तरण के कारण होती है, कार्य के द्वारा नहीं अतः लोहे ने कुछ भी कार्य नहीं किया।
प्रश्न 48.
किन परिस्थितियों में गैस की विशिष्ट ऊष्मा का मान शून्य तथा अनन्त होता है।
उत्तर:
रुद्धोष्म प्रक्रम में गैस की विशिष्ट ऊष्मा शून्य होती है तथा समतापी प्रक्रम में गैस की विशिष्ट ऊष्मा अनन्त होती है।
प्रश्न 49.
एक आदर्श गैस को स्थिर ताप पर सम्पीडित किया जाता है। इसकी आन्तरिक ऊर्जा में क्या परिवर्तन होता है?
उत्तर:
आदर्श गैस की आन्तरिक ऊर्जा केवल ताप पर निर्भर करती है अतः इसकी आन्तरिक ऊर्जा में कुछ भी परिवर्तन नहीं होता है।
प्रश्न 50.
चक्रीय प्रक्रम क्या है?
उत्तर:
वह प्रक्रम जिसमें कोई निकाय विभिन्न अवस्थाओं से गुजरता हुआ अपनी प्रारम्भिक अवस्था में लौट जाता है, चक्रीय प्रक्रम कहलाता है (यहाँ ∆H0, ∆U = 0)।
प्रश्न 51.
क्या एक विलगित निकाय का ताप स्थिर रहता है?
उत्तर:
विलगित निकाय का ताप स्थिर रहता है, जबकि निकाय के भीतर कोई रासायनिक अथवा भौतिक क्रिया न हो रही हो।
प्रश्न 52.
वायुमण्डल की वायु ऊपर जाने पर ठण्डी क्यों हो जाती है?
उत्तर:
ऊपरी वायुमण्डल में दाब कम होता है अतः ऊपर जाने वाली हवा का प्रसार हो जाता है और इस प्रसार के दौरान वायु आन्तरिक ऊर्जा व्यय करके कार्य करती है जिससे इसका ताप गिर जाता है और वह ठण्डी हो जाती है।
प्रश्न 53.
साइकिल ट्यूब में हवा भरते समय पम्प गर्म क्यों हो जाती है?
उत्तर:
साइकिल ट्यूब में हवा भरते समय वायु का रूद्धोष्म सम्पीडन होता है और इस दौरान वायु पर किया गया सम्पूर्ण कार्य वायु की आन्तरिक ऊर्जा में वृद्धि करता है जिससे वायु व पम्प का ताप बढ़ जाता है।
प्रश्न 54.
उच्च दाब पर भरी गैस का एकाएक प्रसार होने पर उसका ताप कम क्यों हो जाता है?
उत्तर:
क्योंकि बाह्य कार्य करने में गैस की आन्तरिक ऊर्जा प्रयुक्त होती है।
प्रश्न 55.
जब एक आदर्श गैस का निर्वात में प्रसार होता है तो ऊष्मा न तो अवशोषित होती है और न ही निर्मुक्त, ऐसा क्यों?
उत्तर:
एक आदर्श गैस में उतरा अणुक बल अनुपस्थित होता है।
अत: जब गैस के आयतन प्रसार होता है तो कर्जा न तो अवशोषित होती है और न ही निर्मुक्त होती है।
प्रश्न 56.
किसी प्रक्रम के स्वतः प्रवर्तित होने के लिये ऊष्मागतिक शर्त बताइये।
उत्तर:
किसी प्रक्रम स्वतः प्रवर्तित होने के लिये,
∆G < 0 (-v e)
अर्थात् ∆H < 0 (- ve), ∆S > 0 (+ ve)
प्रश्न 57.
आन्तरिक ऊर्जा में क्या परिवर्तन होगा यदि कार्य निकाय द्वारा किया गया हो।
उत्तर:
यदि कार्य निकाय द्वारा किया गया हो तो आयतन में वृद्धि के कारण आन्तरिक ऊर्जा कम हो जायेगी।
प्रश्न 58.
आबन्ध ऊर्जा तथा आबन्ध वियोजन ऊर्जा कब बराबर होती है?
उत्तर:
आबन्ध ऊर्जा, द्विपरमाणुक अणु के लिये आबन्ध वियोजन ऊर्जा के बराबर होती है।
उदाहरण – H-H(g), Cl-Cl(g), O = O(g) आदि।
प्रश्न 59.
क्या बह्माण्ड की एन्ट्रॉपी स्थिर है।
उत्तर:
नहीं ब्रह्माण्ड की एन्ट्रॉपी स्थिर नहीं है यह लगातार बढ़ रही है।
प्रश्न 60.
ऊष्मागतिकी के प्रथम व द्वितीय नियम की संयुक्त परिभाषा लिखें।
उत्तर:
ब्रह्माण्ड की आन्तरिक ऊर्जा स्थिर है जबकि इसकी एन्ट्रॉपी लगातार बढ़ रही है।
प्रश्न 61.
हीरा व ग्रेफाइट में से किसकी एन्ट्रॉपी अधिक है?
उत्तर:
ग्रेफाइट की एन्ट्रॉपी अधिक है क्योंकि इसमें परतें उपस्थित हैं जो हीरे की अपेक्षा शिथिलता से बंधी होती हैं।
प्रश्न 62.
सभी सजीव निकाय खुले निकायों की तरह व्यवहार करते हैं, क्यों?
उत्तर:
क्योंकि इनको परिवेश के साथ द्रव्यमान और ऊर्जा दोनों का विनिमय करना पड़ता है।
प्रश्न 63.
ΔS = \(\frac { ΔH }{ T }\) कब वैध होता है।
उत्तर:
यह सम्बन्ध तभी वैध होता है जब निकाय साम्यावस्था में हो अर्थात् (ΔG = 0)।
प्रश्न 64.
आदर्श गैस के समतापी प्रसरण के लिये ΔU = 0 क्यों होता है?
उत्तर:
आन्तरिक ऊर्जा एवं आन्तरिक ऊर्जा में परिवर्तन दोनों ही ताप का कार्य हैं। चूँकि समतापी प्रक्रम में ताप नियत होता है अत: ΔU = 0 हो जाता है।
प्रश्न 65.
ऐसीटोन की मोलर वाष्पीकरण की ऊष्मा का मान जल की तुलना में कम होता है, क्यों?
उत्तर:
क्योंकि जल में प्रबल हाइड्रोजन आबन्ध पाये जाते हैं।
प्रश्न 66.
आन्तरिक ऊर्जा में क्या परिवर्तन होगा? यदि कार्य निकाय द्वारा किया गया हो?
उत्तर:
यदि कार्य निकाय द्वारा किया गया है तो आयतन प्रसरण होगा। इस प्रसरण के कारण आन्तरिक ऊर्जा कम हो जाती है।
प्रश्न 67.
हेस का नियम ऊष्मागतिकी के प्रथम नियम का पूरक है, कैसे?
उत्तर:
ऊष्मागतिकी का प्रथम नियम कहता है कि ऊष्मा न तो उत्पन्न की जा सकती है तथा न ही नष्ट हेस के नियम के अनुसार किसी प्रत्यक्ष या अप्रत्यक्ष प्रक्रिया के दौरान ऊष्मा ऊर्जा समान रहता है।
प्रश्न 68.
यदि किसी अभिक्रिया के लिये मानक मुक्त ऊर्जा में परिवर्तन शून्य हो तो अभिक्रिया का साम्य स्थिरांक क्या होगा?
उत्तर:
हम जानते हैं कि,
∆GΘ = – 2.303 RT log K
यदि ∆GΘ = 0 है तो
– 2.303 RT log K = 0
log K = 0
K = 1 होगा।
प्रश्न 69.
निम्नलिखित क्रियाओं में ऊष्माक्षेपी तथा ऊष्माशोषी अभिक्रियायें छाँटिये।
(1) माचिस का जलना।
(2) बर्फ का पिघलना।
(3) पिघली धातु का ठोस आकार ग्रहण करना।
(4) पोटैशियम की पानी से क्रिया।
(5) ईथर का वाष्पित होना।
उत्तर:
(1) माचिस का जलना ऊष्माक्षेपी
(2) बर्फ का पिघलना – ऊष्माशोषी
(3) पिघली धातु का ठोस आकार ग्रहण करना – ऊष्माक्षेपी
(4) पोटैशियम की पानी से क्रिया – ऊष्माक्षेपी
(5) ईथर का वाष्पित होना – ऊष्माशोषी
प्रश्न 70.
स्थिर दाब एवं स्थिर आयतन पर मोलर ऊष्मा धारिताओं का अन्तर कितना होता है?
उत्तर:
Cp – Cv = R
यह गैस नियतांक (R) के बराबर होता है।
प्रश्न 71.
‘निकाय द्वारा किये गये कार्य’ की प्रकृति क्या होती है?
उत्तर:
निकाय द्वारा किये गये कार्य की प्रकृति ऋणात्मक (- ve) होती है।
प्रश्न 72.
‘निकाय पर किये गये कार्य की प्रकृति’ क्या होती है?
उत्तर:
निकाय पर किये गए कार्य की प्रकृति धनात्मक (+ve) होती है।
प्रश्न 73.
निकाय द्वारा उत्सर्जित ऊष्मा की प्रकृति क्या होती है?
उत्तर:
निकाय द्वारा उत्सर्जित ऊष्मा की प्रकृति ऋणात्मक (-ve) होती है।
प्रश्न 74.
निकाय द्वारा अवशोषित ऊष्मा की प्रकृति क्या होती है?
उत्तर:
निकाय द्वारा अवशोषित ऊष्मा की प्रकृति धनात्मक (+ve) होती है।
प्रश्न 75.
कार्बन की सबसे स्थायी अवस्था कौन-सी होती है?
उत्तर:
कार्बन की सबसे स्थायी अवस्था ग्रेफाइट होती है।
प्रश्न 76.
12 ग्राम कार्बन, डायमण्ड तथा ग्रेफाइट अवस्थाओं में दहन करने पर अलग-अलग ऊष्मा उत्सर्जित करता है, क्यों?
उत्तर:
इनसे उत्सर्जित ऊष्माओं में अन्तर इस कारण होता है क्योंकि अभिक्रिया ऊष्माओं का मान क्रियाकारकों की भौतिक अवस्थाओं पर निर्भर करता है।
प्रश्न 77.
क्या कारण है कि स्थिर दाब पर होने वाली अभिक्रियाओं का अध्ययन, स्थिर आयतन की अपेक्षा अधिक महत्त्वपूर्ण होता है।
उत्तर:
क्योंकि स्वतः प्रवर्तित अभिक्रियाएँ वायुमण्डलीय दाब पर सम्पन्न होती हैं।
प्रश्न 78.
निकाय एवं परिवेश के बीच होने वाले लेन-देन कौन-कौन से हैं।
उत्तर:
निकाय एवं परिवेश के मध्य कार्य एवं ऊष्मा दोनों का लेन-देन होता है।
प्रश्न 79.
ठोस से द्रव बनते समय एन्ट्रॉपी में वृद्धि, द्रव से गैस बनते समय एन्ट्रॉपी में वृद्धि से कम क्यों होती है?
उत्तर:
गैस अवस्था में अणुओं के मध्य अव्यवस्था द्रव अवस्था के अणुओं के मध्य पायी जाने वाली अव्यवस्था (disorderness) की तुलना में अधिक होती है। इसी कारण ठोस से द्रव बनते समय एन्ट्रॉपी में वृद्धि, द्रव से गैस बनते समय एन्ट्रॉपी में वृद्धि से कम होती है।
प्रश्न 80.
क्या एन्थल्पी में कमी अर्थात् ऋणात्मक एन्बैल्पी सभी अभिक्रियाओं की स्वतः प्रवर्तिता का एकमात्र मापदण्ड है।
उत्तर:
नहीं बहुत सी ऐसी अभिक्रिया भी हैं जिसमें ∆H का मान धनात्मक होता है फिर भी वह स्वतः प्रवर्तित होती हैं, जैसे कि जल का वाष्पन, NaCl, NH4Cl आदि का ऊष्माशोषी अभिक्रिया के साथ जल में घुलना।
प्रश्न 81.
एक विलगित निकाय में माना कि दो आदर्श गैसों को समान ताप पर मिश्रित कर दिया जाता है। एन्ट्रॉपी में परिवर्तन का चिन्ह क्या होगा?
उत्तर:
गैसों को मिश्रित करने का अर्थ है कि दोनों के आयतन में वृद्धि हो रही है। इसके साथ-साथ गैसों के अणुओं के मध्य अव्यवस्था भी बढ़ रही है। इसका अर्थ है कि एन्ट्रॉपी बढ़ रही है। अर्थात् ∆S का मान धनात्मक हो जायेगा।
प्रश्न 82.
क्या यह सम्भव है कि किसी पदार्थ को ऊष्मा देने पर भी उसके ताप में वृद्धि न हो। उदाहरण देकर समझाइये।
उत्तर:
हाँ, पदार्थ के अवस्था परिवर्तन के समय (जैसे-बर्फ के गलते समय या जल के उबलते समय) निकाय ऊष्मा लेता है परन्तु उसका ताप नहीं बदलता, केवल स्थितिज ऊर्जा बदलती है।
![]()
प्रश्न 83.
क्या यह सम्भव है कि किसी निकाय को बिना ऊष्मा दिये अथवा उससे बिना ऊष्मा लिये ताप परिवर्तित हो जाये।
उत्तर:
हाँ, रूद्धोष्म परिवर्तन में बिना ऊष्मा दिये अथवा लिये ताप परिवर्तन हो जाता है। रूद्धोष्म सम्पीडन में ताप बढ़ता है, जबकि रुद्धोष्म प्रसार में ताप घटता है।
प्रश्न 84.
भाप का अति तप्त होना समदाबी प्रक्रम है अथवा समतापी प्रक्रम और क्यों?
उत्तर:
भाप का अतितप्त होना समदाबी प्रक्रम है, क्योंकि ऊष्मा लेकर अतितप्त होते समय तक ताप का दाब तो नियत रहता है, परन्तु भाप का ताप नियत नहीं रहता है।
प्रश्न 85.
0°C ताप की बर्फ को गरम करके 100°C ताप की भाप में परिवर्तित किया जाता है। बर्फ को भाप में बदलने की इस प्रक्रिया में होने वाले समतापीय परिवर्तनों को बताइये।
उत्तर:
0°C पर बर्फ से जल बनना तथा 100°C पर जल से भाष का बनना समतापीय परिवर्तन है।
प्रश्न 86.
किसी गैस की दो विशिष्ट ऊष्माएँ कौन-सी हैं और वे भिन्न-भिन्न क्यों हैं?
उत्तर:
गैस की दो विशिष्ट ऊष्मायें Cp तथा Cv हैं। Cp वायुमण्डलीय दाब के विरुद्ध कार्य करने तथा वृद्धि दोनों में प्रयुक्त होती है। जबकि Cv केवल ताप वृद्धि में प्रयुक्त होती है।
प्रश्न 87.
भाप की एन्ट्रॉपी जल से अधिक क्यों होती है?
उत्तर:
क्वथनांक पर जल तथा भाप दोनों एक साथ उपस्थित होते हैं तथा साम्यावस्था में रहते हैं। यद्यपि भाप की एन्ट्रॉपी अधिक होती है, क्योंकि इस अवस्था में H2O अणुओं की अव्यवस्था बढ़ जाती है तथा यह द्रव अवस्था से अधिक होती है।
प्रश्न 88.
निम्न में से अवस्था फलन एवं पथ फलन को छाँटिए।
एन्थल्पी, एन्ट्रॉपी, ताप, ऊष्मा, कार्य, मुक्त ऊर्जा
उत्तर:
अवस्था फलन-एन्थल्पी एन्ट्रॉपी, ताप, मुक्त ऊर्जा।
पथ फलन-ऊष्मा कार्य
प्रश्न 89.
298 K ताप पर अभिक्रिया N2O4(g) ⇌ 2NO2(g) के Kp का मान 0.98 है, बताइये कि अभिक्रिया स्वतः प्रवर्तित है या नहीं।
उत्तर:
∆rGΘ = – RT In Kp चूँकि Kp = 0.98 अत: ∆rGΘ का मान – ve होगा अतः अभिक्रिया स्वतः प्रवर्तित (spontaneous) है।
प्रश्न 90.
परिवेश की एन्बैल्पी के मान में बढ़त (increase) निकाय की एन्थैल्पी के मान में घटत (decrease) के बराबर होती है, बताइये कि क्या परिवेश व निकाय का ताप समान होगा यदि ये दोनों तापीय साम्य में हों।
उत्तर:
हाँ, यदि परिवेश व निकाय दोनों तापीय साम्यावस्था में है तो इन दोनों का ताप भी समान होगा।
प्रश्न 91.
दिया गया है कि दो गैसों को मिलाने पर ∆H = 0 हो जाता है। बताइये कि क्या इन गैसों का एक-दूसरे में विसरण एक बन्द पात्र में स्वतः होगा या नहीं।
उत्तर:
यह एक स्वतः प्रवर्तित प्रक्रम है क्योंकि, चाहे एन्थैल्पी में परिवर्तन शून्य (∆H = 0) ही क्यों न हो, यहाँ अव्यवस्था (disorderness) बढ़ रही है अर्थात् कारक एन्ट्रॉपी के मान में बढ़त प्रक्रम को स्वतः प्रवर्तित बना रही है।
लघु उत्तरीय प्रश्न
प्रश्न 1.
समांगी और विषमांगी निकाय में क्या अन्तर है?
उत्तर:
समांगी निकाय जब किसी निकाय में उपस्थित सभी द्रव्य समान प्रावस्था में हों या रासायनिक संगठन एक सा हो, तो वह निकाय समांगी निकाय कहलाता है।
उदाहरण-नमक का जलीय विलयन।
विषमांगी निकाय – यदि किसी निकाय में दो या दो अधिक प्रावस्थाएँ हों, तो वह निकाय विषमांगी निकाय कहलाता है।
उदाहरण-बर्फ व जल का मिश्रण।
प्रश्न 2.
एक परमाणुक आदर्श गैस के एक मोल सेम्पल (sample) को compression तथा expansion के एक चक्रीय प्रक्रम में लिया जाता है जिसे निम्न चित्र में प्रदर्शित किया गया है। पूरे चक्र के लिये
∆H का मान क्या होगा?
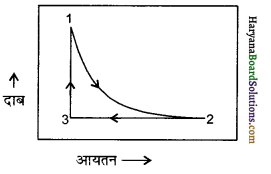
उत्तर:
चक्रीय प्रक्रम के लिए कुल एन्थैल्पी परिवर्तन का मान शून्य होता है अर्थात् ∆H(चक्रीय) = 0 ।
प्रश्न 3.
q तथा W से क्या समझते हो? इनमें क्या सम्बन्ध है?
उत्तर:
q तथा W दोनों ही बीजीय राशियाँ हैं। q निकाय द्वारा अवशोषित ऊष्मा है। W निकाय द्वारा परिवेश पर किया गया कार्य है।
अतः ऊष्मागतिकी के प्रथम नियमानुसार,
निकाय द्वारा अवशोषित ऊष्मा = निकाय की आन्तरिक ऊर्जा में वृद्धि निकाय द्वारा किया गया कार्य।
प्रश्न 4.
q तथा W के चिह्न किस प्रकार होते हैं?
उत्तर:
q तथा W के चिन्ह निम्न नियमानुसार होते हैं-
- यदि निकाय ऊष्मा अवशोषित करता है, तो q का मान धनात्मक (+) होता है और यदि निकाय ऊष्मा उत्सर्जित करता है, तो q का मान ऋणात्मक (-) होता है।
- यदि निकाय द्वारा वातावरण पर कार्य किया जाता है तो W का मानधनात्मक (+) होता है और यदि निकाय पर परिवेश (वातावरण) द्वारा कार्य किया जाता है, तो W का मान ऋणात्मक (-) होता है।
प्रश्न 5.
ऊष्माधारिता किसे कहते हैं?
उत्तर:
किसी निकाय या द्रव के ताप को 1 K बढ़ाने के लिए जितनी ऊष्मा की आवश्यकता होती है उसे उस निकाय की ऊष्माधारिता कहते हैं।
C = \(\frac{q}{\mathrm{~T}_2-\mathrm{T}_1}=\frac{q}{\Delta \mathrm{T}}\)
प्रश्न 6.
स्थिर आयतन पर ऊष्माधारिता (Cv) तथा स्थिर दाब पर ऊष्माधारिता (Cp) का सूत्र दर्शाइये।
उत्तर:
स्थिर आयतन पर ऊष्माधारिता
Cv = \(\left[\frac{q_v}{\mathrm{~T}_2-\mathrm{T}_1}\right]_{\mathrm{V}}=\left[\frac{q_v}{\Delta \mathrm{T}}\right]_{\mathrm{V}}\)
स्थिर दाब पर ऊष्माधारिता
Cp = \(\left[\frac{q_p}{\mathrm{~T}_2-\mathrm{T}_1}\right]_{\mathrm{V}}=\left[\frac{q_p}{\Delta \mathrm{T}}\right]_{\mathrm{P}}\)
प्रश्न 7.
एक सिलेण्डर में बन्द एक आदर्श गैस पर किया गया कार्य क्या होगा जब इसे एक constant बाह्य दाब Pext के द्वारा एक पद में सम्पीडित किया जाये। इसे निम्न चित्र में प्रदर्शित किया गया है?
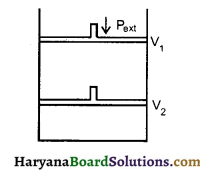
उत्तर:
जैसा कि बताया गया है कि Pext constant है यह एक अनुत्क्रमणीय सम्पीडन है।
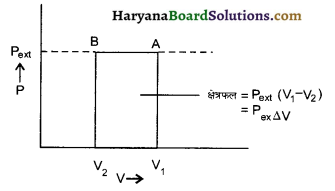
Wirv – Pext ∆V
= Pext (V1 – V2)
यह P – V के द्वारा ज्ञात किया जा सकता है यहाँ किया गया कार्य ABV2V1 का क्षेत्रफल है।
प्रश्न 8.
खुले व बन्द निकायों अन्तर स्पष्ट कीजिए।
उत्तर:
खुला निकाय – वह निकाय जो परिवेश से ऊर्जा व द्रव्य दोनों का ही विनिमय कर सके, वह खुला निकाय कहलाता है।
बन्द निकाय – वह निकाय जो अपने परिवेश से केवल ऊर्जा का ही आदान-प्रदान कर सके, पदार्थ का नहीं, वह बन्द निकाय कहलाता है।
प्रश्न 9.
ऊष्मागतिकी के प्रथम नियम की व्याख्या कीजिए।
उत्तर:
ऊष्मागतिकी का प्रथम नियम ऊष्मागतिकी का प्रथम नियम ऊर्जा संरक्षण का नियम कहलाता है। इस नियम के अनुसार ऊर्जा को न तो उत्पन्न किया जा सकता है और न ही नष्ट किया जा सकता है, किन्तु एक रूप से दूसरे रूप में परिवर्तित किया जा सकता है अर्थात् ब्रह्माण्ड की कुल ऊर्जा स्थिर रहती है।
इस नियम से यह स्पष्ट है कि जब एक प्रकार की ऊर्जा की कोई मात्रा मुक्त होती है, तो उसके तुल्य दूसरे प्रकार की ऊर्जा अवश्य प्रकट हो जाती है।
प्रश्न 10.
तन्त्र की आन्तरिक ऊर्जा क्या प्रभाव होगा यदि
(क) तन्त्र पर कार्य किया जाता है।
(ख) तन्त्र द्वारा कार्य किया जाता है।
उत्तर:
(क) जब किसी तन्त्र पर कार्य किया जाता है तो किसी तन्त्र की आन्तरिक ऊर्जा में कमी आती है। किसी तन्त्र की आन्तरिक ऊर्जा उस तन्त्र की भौतिक अवस्थाओं दाब, ताप आदि पर भी निर्भर करती है। आन्तरिक ऊर्जा उसके द्वारा परिवेश पर किये गये कार्य के अनुसार परिवर्तित होती रहती है।
(ख) जब किसी तन्त्र द्वारा कार्य किया जाता है तो तन्त्र की आन्तरिक ऊर्जा में वृद्धि होती है। आन्तरिक ऊर्जा में वृद्धि तभी सम्भव है जब ऊर्जा परिवर्तन ऊष्मा में रूपान्तरित न हुआ हो।
प्रश्न 11.
समतापीय तथा रुद्धोष्म प्रक्रम में क्या अन्तर है?
उत्तर:
समतापीय प्रक्रम – स्थिर ताप पर किया जाने वाला प्रक्रम समतापीय प्रक्रम कहलाता है। इस प्रक्रम में ताप स्थिर रखने के लिए तन्त्र अपने परिवेश से ऊष्मा का आदान-प्रदान करता है। यदि प्रक्रम ऊष्माक्षेपी है, तो मुक्त हुई ऊष्मा परिवेश को दे दी जाती है। यदि प्रक्रम ऊष्माशोषी हैं, तो परिवेश से ऊष्मा ले ली जाती है।
रुद्धोष्म प्रक्रम – इस प्रक्रम में निकाय अपने परिवेश से ऊष्मा का आदान-प्रदान नहीं करता है। इस प्रक्रम में निकाय के ताप में परिवर्तन सम्भव है। यदि प्रक्रम ऊष्माक्षेपी हैं, तो ताप में वृद्धि होगी तथा यदि प्रक्रम ऊष्माशोषी है, तो ताप में कमी हो जायेगी।
प्रश्न 12.
निम्नलिखित में ऊर्जा किस स्वरूप से किस स्वरूप में बदलती है।
(1) जुगनु का चमकना।
उत्तर:
रासायनिक ऊर्जा से प्रकाश ऊर्जा।
(2) रेडियो का बजना।
उत्तर:
विद्युत ऊर्जा से ध्वनि ऊर्जा।
(3) प्रकाश संश्लेषण।
उत्तर:
प्रकाश ऊर्जा से रासायनिक ऊर्जा।
(4) कोयले का जलना।
उत्तर:
रासायनिक ऊर्जा से प्रकाश ऊर्जा एवं ऊष्मा
(5) मेज को धकेलना।
उत्तर:
यान्त्रिक ऊर्जा से गतिज ऊर्जा।
(6) बल्ब का जलना।
उत्तर:
विद्युत ऊर्जा से प्रकाश ऊर्जा।
(7) विद्युत इंजन का चलना।
उत्तर:
विद्युत ऊर्जा से कार्य एवं ऊष्मा।
प्रश्न 13.
बहते जल में डूबे प्रतिरोधक में विद्युत धारा प्रवाहित की जाती है। प्रतिरोधक को निकाय मानते हुये बताएँ।
(1) क्या प्रतिरोधक में बाहर से ऊष्मा प्रवेश करती है?
(2) क्या जल में ऊष्मा प्रवेश करती है?
(3) क्या कार्य हुआ?
(4) यह मानकर कि प्रतिरोधक की अवस्था अपवर्तित रहती है।
इस प्रक्रम के लिये प्रथम नियम लागू कीजिये।
उत्तर:
(1) नहीं प्रतिरोधक में बाहर से ऊष्मा प्रवेश नहीं करती है।
(2) हाँ, जल में ऊष्मा प्रवेश करती है।
(3) हाँ, प्रतिरोधक (निकाय) पर कार्य हुआ।
(4) प्रथम नियमानुसार,
∆U = q + w
यहाँ पर
q = 0 (प्रतिरोधक के लिये)
w = + ve अत:
∆U = 0 + w
∆U = w
जल के लिये,
w = 0 अत: ∆U = q
अत: w = q
इससे सिद्ध होता है कि कार्य, जल की स्थानान्तरित ऊष्मा के बराबर है।
![]()
प्रश्न 14.
निकाय के मुक्त प्रसार से आप क्या समझते हैं? क्या मुक्त प्रसार के दौरान निकाय की आन्तरिक ऊर्जा अपरिवर्तित रहती है?
उत्तर:
यदि किसी निकाय जैसे-गैस का प्रसार प्रकार हो कि निकाय से बाहर जा सके न ही बाहर से निकाय में आ सके अर्थात् प्रसार रूद्धोष्म प्रकार का हो। यदि निकाय द्वारा या निकाय पर कोई माना दृढ़ दीवारों के द्वारा कार्य भी न हो तो इसे मुक्त प्रसार (Free expansion) कहते हैं।
माना दृढ़ दीवारों के द्वारा निर्मित तथा ऐस्बेस्टॉस से ढका एक बर्तन दो भागों में विभक्त है, एक में गैस भरी है तथा एक भाग निर्वातित है। जब विभाजक को अचानक जोड़ देते हैं तो गैस तेजी से निर्वस् में प्रवेश करती है तथा मुक्त रूप से फैलती है। यदि गैस की प्रारम्भिक तथा अन्तिम आन्तरिक ऊर्जाएँ Ui तथा Uf हों तो ऊष्मागतिकी के प्रथम नियम के अनुसार,
Uf – Ui = q + W
चूँकि पात्र ऊष्मा-रोधी है तथा प्रक्रम अचानक (sudden) होता है; अतः निकाय में न तो ऊष्मा प्रवेश करती है और न ही उससे बाहर निकलती है (q = 0)। इसके अतिरिक्त चूँकि गैस का प्रसार निर्वात् में होता है; अतः कोई कार्य भी नहीं होगा (W = 0)। इस प्रकार
Uf – Ui = 0
या Uf = Ui
अत: मुक्त प्रसार में प्रारम्भिक तथा अन्तिम आन्तरिक ऊर्जाएँ बराबर होती हैं अर्थात् आन्तरिक ऊर्जा अपरिवर्तित रहती है।
प्रश्न 15.
आन्तरिक ऊर्जा एक अवस्था फलन है इस कथन को स्पष्ट करें अथवा कथन ∆U = q + w में q तथा w अवस्था फलन नहीं है। परन्तु AU एक अवस्था फलन है। कारण स्पष्ट करें।
उत्तर:
हम जानते हैं कि स्थिर आयतन पर अवशोषित ऊष्मा आंतरिक ऊर्जा में परिवर्तन के तुल्य, अर्थात् ∆U = q, होती है परन्तु अधिकांश रासायनिक अभिक्रियांए स्थिर आयतन पर न होकर फ्लास्क, परखनली आदि में स्थिर वायुमण्डलीय दाब पर होती हैं।
इस स्थिति में निकाय पर होने वाले ऊष्मा परिवर्तन स्थिर आयतन से भिन्न होंगे। अतः स्थिर दाब. पर निकाय में होने वाले ऊष्मा परिवर्तन को
व्यक्त करने के लिए एक नया ऊष्मागतिक फलन एन्थैल्पी (H) की आवश्यकता होगी।
ऊष्मागतिकी समीकरण से,
व्यक्त करने के लिए एक नया ऊष्मागतिक फलन एन्थैल्पी (H) की आवश्यकता होगी।
ऊष्मागतिकी समीकरण से,
∆U = q – Pdv
स्थिर दाब पर,
∆U = q – Pdv
जहाँ
qp = निकाय द्वारा अवशोषित ऊष्मा
– Pdv = निकाय द्वारा किया गया प्रसरण कार्य
प्रारम्भिक अवस्था को 1 से एवं अंतिम अवस्था को 2 से प्रदर्शित करते हैं।
हम उपरोक्त समीकरण को इस प्रकार लिख सकते हैं-
U2 – U1 = qp – P (V2 – V1)
पुनः व्यवस्थित करने पर
qp = (U2 + PV2) – (U1 + PV1) … (i)
एक नया ऊष्मागतिकी फलन को परिभाषित कर सकते हैं, जिसे एन्थल्पी (ग्रीक शब्द ‘एन्थेल्पियन’, जिसका अर्थ ‘गरम करना’ या ‘अंतर्निहित ऊष्मा’ होता है) कहते हैं।
H = U + PV
अत: समीकरण (i) से,
q2 = H2 – H1 = ∆H
यद्यपि एक पथ आश्रित फलन है, तथापि qp पथ से स्वतंत्र है। स्पष्टत: H एक अवस्था फलन है (H.U. P एवं V का फलन है। ये सभी अवस्था फलन है)। इस प्रकार ∆H पथ स्वतंत्र राशि है।
स्थिर दाब पर परिमित परिवर्तनों के लिए इस प्रकार लिखा जा सकता है।
∆H = ∆U + ∆PV क्योंकि P स्थिरांक है, अतः हम लिख सकते हैं-
∆H = ∆U + P∆V … (ii)
उल्लेखनीय है कि जब स्थिर दाब पर ऊष्मा अवशोषित होती है, तो यथार्थ में हम एन्थैल्पी में परिवर्तन माप रहे होते हैं।
याद रखें कि ∆H = qp स्थिर दाब पर अवशोषित ऊष्मा है।
ऊष्माक्षेपी अभिक्रियाओं के लिए ∆H ऋणात्मक होता है, जहाँ अभिक्रिया के दौरान ऊष्मा उत्सर्जित होती है एवं ऊष्माशोषी अभिक्रियाओं के लिए ∆H धनात्मक होता है, जहाँ परिवेश से ऊष्मा का अवशोषण होता है।
वे निकाय, जिसमें केवल ठोस या द्रव प्रावस्थाएँ होती हैं में ∆H एवं ∆U के मध्य अंतर सार्थक नहीं होता, क्योंकि ठोस एवं द्रवों में गरम करने पर आयतन में कोई विशेष परिवर्तन नही होता। यदि गैयीय अवस्था हो, तो इनमें अंतर सार्थक हो जाता है। हम एक ऐसी अभिक्रिया पर विचार करते हैं, जिसमें गैसें शामिल हैं। स्थिर दाब एवं ताप पर VA गैसीय अभिक्रियकों का एवं VB गैसीय उत्पादों का कुल आयतन हो तथा nA गैसीय अभिक्रियकों एवं गैसीय उत्पादों के मोलों की संख्या हो, तो आदर्श गैस समीकरण के अनुसार-
pVA = nA RT
इस प्रकार
pVB = nB RT
PVB – PVA = nB RT – nA RT
P(VB – VA) = (nB – nA) RT
P∆V = ∆ngRT
यह ∆ng गैसीय उत्पादों के मोलों की संख्या एंव गैसीय अभिक्रियकों के मोलों की संख्या का अंतर है। समीकरण (iii) से P∆V का मान समीकरण (ii) में रखने पर
∆H = ∆U + ∆ng RT … (iv)
उपरोक्त समीकरण (iv) का उपयोग ∆H से ∆U या ∆U से AH का मान ज्ञात करने में किया जाता है।
प्रश्न 16.
निम्न प्रक्रम में एन्थैल्पी परिवर्तन को वक्र के द्वारा प्रदर्शित करें
(i) जमीन से छत तक एक पत्थर को फेंकना।
(ii) \(\frac { 1 }{ 2 }\) H2(g) + \(\frac { 1 }{ 2 }\)Cl2(g) ⇌ HClg
∆rHΘ = – 92.32 kJ mol-1
किस प्रक्रम में एन्थैल्पी परिवर्तन यह प्रदर्शित करता है कि प्रक्रम स्वतः प्रदर्शित है।
उत्तर:
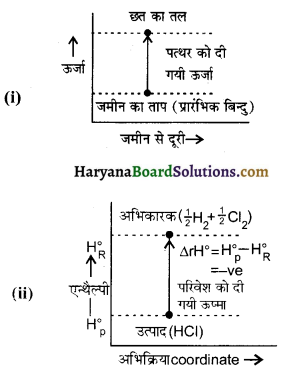
प्रक्रम (i) में ऊर्जा बढ़ रही है जबकि प्रक्रम (ii) में ऊर्जा घट रही है।
अतः प्रक्रम (ii) में एन्थैल्पी परिवर्तन स्वतः प्रवर्तित प्रक्रम सिद्ध करता है।
प्रश्न 17.
हीलियम तथा ऑक्सीजन गैसों के समान द्रव्यमानों को ऊष्मा की समान मात्राएँ दी जाती हैं, किसके ताप में अधिक वृद्धि होगी और क्यों?
उत्तर:
हीलियम एक परमाणुक जबकि ऑक्सीजन द्विपरमाणुक गैस है। इस कारण दी गई ऊष्मा हीलियम अणुओं की गतिज ऊर्जा में वृद्धि करेगी जबकि ऑक्सीजन गैस को दी गयी ऊष्मा अणुओं की गतिज ऊर्जा की वृद्धि करने में एवं घूर्णीय व कम्पनिक गतिज ऊर्जा बढ़ाने में प्रयुक्त होगी। अर्थात् दी गयी ऊष्मा का प्रयोग कई जगह होगा। इस कारण हीलियम के ताप में अधिक वृद्धि होगी, जबकि ऑक्सीजन गैस के ताप में कम वृद्धि होगी।
प्रश्न 18.
ऊष्मागतिकी में बाह्य कार्य तथा आन्तरिक कार्य में क्या अन्तर है? इनमें से कौन-सा महत्त्वपूर्ण है?
उत्तर:
जब कोई निकाय एक बल के अन्तर्गत विस्थापित होता है तो कुछ कार्य सम्पन्न होता है। इस कार्य का परिमाण बल तथा बल की दिशा में विस्थापन के घटक की गुणा के बराबर होता है। यदि सम्पूर्ण निकाय अपने परिवेश के विरुद्ध बल आरोपित करके विस्थापित होता है, तब निकाय द्वारा किया गया कार्य ‘बाह्य कार्य’ कहलाता है। उदाहरण के लिए-जब किसी सिलिण्डर में भरी गैस फैलती है तो वह बाह्य वातावरण के विरुद्ध पिस्टन को धकेलती है, तब गैस द्वारा पिस्टन पर ‘बाह्य कार्य’ किया जाता है।
इसके विपरीत जब निकाय के किसी एक भाग द्वारा उसी निकाय के दूसरे भाग पर कार्य किया जाता है, तब इसे ‘आन्तरिक कार्य’ कहते हैं। उदाहरण के लिए-जब कोई गैस फैलती है तो उसके अणुओं के बीच पारस्परिक आकर्षण के विरुद्ध कार्य किया जाता है। यह ‘आन्तरिक कार्य’ कहलाता है।
ऊष्मागतिकी में आन्तरिक कार्य का कोई महत्त्व नहीं है। केवल बाह्य कार्य जो निकाय तथा उसके परिवेश के बीच पारस्परिक क्रिया से सम्बन्ध रखता है, ऊष्मागतिकी में महत्त्वपूर्ण है।
प्रश्न 19.
क्या किसी निकाय द्वारा अधिकतम अव्यवस्था प्राप्त करना, स्वतः प्रवर्तिता की कसौटी है? एक प्रयोग द्वारा पुष्टि कीजिए।
उत्तर:
रासायनिक अभिक्रियाओं में अभिकारकों तथा उत्पादों की भौतिक अवस्था में परिवर्तन आने से इनके अणुओं की गति में अनियमितता अथवा अव्यवस्था आ जाती है। ऊष्माशोषी प्रक्रमों में ऊष्माशोषित ऊष्मा उत्पादों की गतिज ऊर्जा को अभिकारकों की तुलना में बढ़ा देती है। इससे इनकी मुक्त गति अथवा अनियमितता में वृद्धि हो जाती है। अतः निकाय द्वारा अधिकतम अव्यवस्था प्राप्त करना स्वतः प्रवर्तिता की कसौटी है। इसे निम्नलिखित प्रयोग द्वारा स्पष्ट किया जा सकता है-
प्रयोग द्वारा पुष्टि (Verification through an Experiment) – माना स्टॉप कॉर्क से सम्बद्ध दो समान क्षमता के पात्रों में ब्रोमीन (लाल-भूरी) तथा नाइट्रोजन (रंगहीन) गैसों की समान मात्राएँ भरी जाती हैं। जब स्टॉप कॉर्क बन्द होता है, दोनों गैसों के अणु अपने-अपने पात्रों में ही रहते हैं।
स्टॉप कार्क को खोलते ही दोनों पात्रों के अणु परस्पर मिल जाते हैं तथा दोनों पात्रों का रंग एकसमान हो जाता हैं यहाँ ऊर्जा-परिवर्तन लगभग उपेक्षणीय है, परन्तु अणुओं की गति के लिए उपलब्ध स्थान में वृद्धि होना निश्चित है। दूसरे शब्दों में हम कह सकते हैं कि एक पात्र में उपस्थित गैस के अणुओं का दूसरे पात्र में जाना इनकी मुक्त गति अथवा अव्यवस्था में वृद्धि लाता हैं अतः एक निश्चित दिशा में स्वतः प्रवर्तित प्रक्रम हो सकता है, जबकि परिवर्तन के परिणामस्वरूप स्पीशीज की अव्यवस्था में वृद्धि हो।
प्रश्न 20.
एक निश्चित अभिक्रिया के लिये एन्थैल्पी वक्र को निम्न चित्र में प्रदर्शित किया गया है। क्या इस चित्र के द्वारा स्वतः प्रवर्तिता का निर्धारण करना सम्भव है?
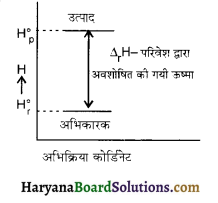
उत्तर:
नहीं, केवल एन्थैल्पी ही किसी अभिक्रिया की स्वतः प्रवर्तिता के लिये उत्तरदायी नहीं होती है क्योंकि यह अभिक्रिया ऊष्माशोषी है अर्थात् ऊर्जा का मान बढ़ रहा है। अन्य कारक जैसे एन्ट्रॉपी इत्यादि भी स्वतः प्रवर्तिता को बताने के लिये सम्मिलित किये जाते हैं।
प्रश्न 21.
एक एकल परमाण्विक गैस के एक मोल state (1) से state (2) तक expand हो रहे हैं जैसा कि चित्र में दिखाया गया है। 298K ताप पर गैस के expansion में (state 1 और state 2 तक) किये गये कार्य की गणना करें।
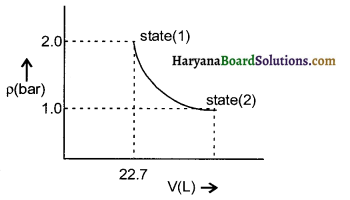
उत्तर:

विस्तृत उत्तरीय प्रश्न
प्रश्न 1.
ऊष्मागतिकी के प्रथम नियम को कथन देकर स्पष्ट कीजिए और इसके गणितीय व्यंजक की व्युत्पत्ति कीजिए।
उत्तर:
इस नियम के अनुसार, “ऊर्जा को न तो उत्पन्न किया जा सकता है और न ही नष्ट किया जा सकता है, लेकिन ऊर्जा को एक रूप से दूसरे रूप में परिवर्तित किया जा सकता है।” इस नियम को ऊष्मागतिकी का प्रथम नियम या ऊर्जा का संरक्षण नियम भी कहते हैं।
ऊष्मागतिकी के प्रथम नियम का गणितीय रूप जब किसी निकाय द्वारा ऊष्मा के रूप में ऊर्जा अवशोषित होती है तो उसका कुछ भाग निकाय की आन्तरिक ऊर्जा में वृद्धि करने में तथा शेष भाग निकाय द्वारा अपने वातावरण पर कार्य करने में व्यय हो जाता है। यह कार्य, प्रसारण का यान्त्रिक कार्य आदि हो सकता है।
माना कि किसी गैसीय निकाय की अवस्था A में आन्तरिक ऊर्जा UA है। यह निकाय ऊष्मा की कुछ मात्रा 9 अवशोषित कर अवस्था B में चला जाता है। अवस्था B में इसकी आन्तरिक ऊर्जा UB है। अत: निकाय की आन्तरिक ऊर्जा में वृद्धि होती है।
∆U = UB – UA
इस अवस्था परिवर्तन में निकाय द्वारा परिवेश पर किया गया कार्य W हो, तो ऊष्मागतिकी के प्रथम नियमानुसार ऊर्जा न तो उत्पन्न की जा सकती है और न ही नष्ट की जा सकती है यद्यपि इसे एक दूसरे रूप में परिवर्तित किया जा सकता है। अतः
निकाय द्वारा अवशोषित ऊष्मा निकाय की आन्तरिक ऊर्जा में वृद्धि + निकाय द्वारा किया गया कार्य (कार्य करने में व्यय ऊर्जा)
अर्थात्
q = AU + W
∆U = 9 – W … (i)
या q = AU + W
उपर्युक्त समीकरण किसी निकाय की आन्तरिक ऊर्जा, ऊष्मा एवं कार्य के मध्य सम्बन्ध को प्रदर्शित करती है तथा यह ऊष्मागतिकी के प्रथम नियम का गणितीय रूप है।
अतः ऊष्मागतिकी के प्रथम नियम को इस प्रकार परिभाषित कर सकते हैं कि किसी प्रक्रम में निकाय की ऊर्जा में कुल परिवर्तन U, निकाय द्वारा जब अवशोषित ऊष्मा q और निकाय द्वारा किये गये कार्य W के अन्तर के बराबर होता है।
जब निकाय में अनन्त सूक्ष्म परिवर्तन हो, तो उपर्युक्त समीकरण को निम्न रूप में लिखा जा सकता है।
dU = dq – dW
या dq = dU + dW
q तथा W के चिह्न-चूँकि q तथा W दो ही बीजीय राशियाँ हैं। अतः इनके चिन्ह निम्न प्रकार होते हैं।
1. यदि निकाय द्वारा ऊष्मा का अवशोषण होता है तो निकाय की ऊष्मा बढ़ जायेगी। अतः q का मान धनात्मक (+ ve) होता है तथा यदि निकाय द्वारा ऊष्मा उत्सर्जित (मुक्त) होती है, तो q का मान ऋणात्मक (- ve) होता है।
2. यदि निकाय पर परिवेश द्वारा कार्य किया जाता है, तो W का मान ॠणात्मक (-ve) होता है और यदि निकाय द्वारा परिवेश पर कार्य किया जाता है, तो W का मान धनात्मक (+ve) होता हैं।
प्रश्न 2.
(अ) ऊष्मागतिकी के उत्क्रमणीय तथा अनुत्क्रमणीय प्रक्रमों को समझाइए।
(ब) सिद्ध कीजिए कि स्थिर आयतन पर तन्त्र द्वारा अवशोषित ऊष्मा उसकी आन्तरिक ऊर्जा की वृद्धि के बराबर होती है।
उत्तर:
(अ) उत्क्रमणीय प्रक्रम-जब किसी निकाय का एक अवस्था से दूसरी अवस्था में परिवर्तन होता है, तब उस निकाय के किसी भी भाग में हुए समस्त परिवर्तनों की दिशा उलटने से निकाय पुन: अपनी प्रारम्भिक अवस्था में आ जाता है और परिवेश भी अपनी मूल अवस्था में आ जाता है।
यदि किसी प्रक्रम में प्रेरक बल की मात्रा विरोधी बल की मात्रा से अत्यन्त सूक्ष्म अधिक हो और विरोधी बल की मात्रा अत्यन्त सूक्ष्म बढ़ा देने से प्रक्रम उत्क्रमित हो जाये तो उस प्रक्रम को उत्क्रमणीय प्रक्रम कहते हैं।
अनुत्क्रमणीय प्रक्रम-वे प्रक्रम जो बहुत तीव्र वेग से होते हैं अतः स्वतः हों तो वे प्रक्रम अनुत्क्रमणीय प्रक्रम कहलाते हैं। उदाहरण-गैसों का आपस में मिश्रित होना, पदार्थ का किसी निकाय में घुल्लना, दूध से दही बनना आदि अनुत्क्रमणीय प्रक्रम हैं।
(ब) ∆U = 9 – W (ऊष्मागतिकी के प्रथम नियम के अनुसार)
एक चक्रीय प्रक्रम में जहाँ निकाय की प्रारम्भिक तथा अन्तिम अवस्थाएँ समान होती हैं U1 = U2 के होता है अत: ∆U का मान शून्य होगा।
∆U = 0
∆U का यह मान उपर्युक्त समीकरण में रखने पर,
q – W = 0
या
q =W
इस स्थिति में हम तन्त्र को जितनी ऊर्जा देंगे वह उतना ही कार्य करेगा। यदि कोई परिवर्तन स्थिर आयतन पर सम्पन्न कराया जाये तो उस प्रक्रम में कोई कार्य नहीं होता है। अतः उस स्थिति में W = 0 होगा। तब
∆U = qv
(जहाँ qv = स्थिर आयतन पर तन्त्र द्वारा अवशोषित ऊष्मा है।)
अतः स्थिर आयतन पर किसी तन्त्र द्वारा अवशोषित ऊष्मा उसकी आन्तरिक ऊर्जा में वृद्धि के बराबर होती है।
![]()
प्रश्न 3.
आन्तरिक ऊर्जा परिवर्तन व एन्थैल्पी परिवर्तन क्या है? ये आपस में किस प्रकार सम्बन्धित हैं? किस स्थिति में दोनों समान होते हैं?
उत्तर:
यदि कोई निकाय प्रारम्भिक अवस्था A से अन्तिम अवस्था B में परिवर्तित होता है तो उसकी आन्तरिक ऊर्जा में परिवर्तन ∆E निकाय की प्रारम्भिक और अन्तिम अवस्थाओं की आन्तरिक ऊर्जाओं पर
निर्भर करता है-
A → B
∆U = UB – UA
जहाँ UB और UA क्रमशः निकाय की प्रारम्भिक और आन्तरिक अवस्थाओं की आन्तरिक ऊजाएँ हैं तथा ∆U निकाय की आन्तरिक ऊर्जा में परिवर्तन है।
किसी निकाय की आन्तरिक ऊर्जा U और उसकी ऊर्जा PV का योग एन्थैल्पी या पूर्ण ऊष्मा H कहलाता है।
H = U + PV
जहाँ P बाह्य दाब और V निकाय का आयतन है। किसी निकाय की एन्थैल्पी उसकी अवस्था पर निर्भर करती है।
यदि स्थिर दाब P की परिस्थितियों में कोई निकाय अवस्था। से अवस्था 2 में बदलता है, तो उसकी एन्थैल्पी में परिवर्तन ΔH होगा-
ΔH = H2 – H1 = (U2 + PV2) – (U1 + PV1)
ΔH = (U2 – U1) + P (V2 – V1)
ΔH = ΔU + PΔV
जहाँ ΔH2, ΔU और ΔV निकाय के क्रमशः एन्थैल्पी, आन्तरिक ऊर्जा और आयतन में परिवर्तन हैं तथा P बाह्य दाब है। अतः किसी निकाय की एन्थैल्पी में परिवर्तन उसकी आन्तरिक ऊर्जा में वृद्धि तथा निकाय द्वारा दाब, आयतन तथा कार्य के योग के बराबर होता है।
प्रश्न 4.
कारण देते हुए समझाइए कि जिस अभिक्रिया में अभिकारक और उत्पाद ठोस अवस्था में हों, तो ΔH = ΔU होती है।
उत्तर:
जिस अभिक्रिया में अभिकारक और उत्पाद ठोस अवस्था में हों, वहाँ पर आयतन में परिवर्तन ΔV नगण्य होता है।
अतः स्थिर दाब व स्थिर आयतन पर अभिक्रिया ऊष्मा
ΔΗ = U + PAV
या
qp = qv + PΔV
गैस समीकरण के अनुसार
PV = nRT
यदि ताप व दाब स्थिर हो, तो
PΔV = Δng RT
Δng = np – nr
जहाँ Δng = उत्पाद के मोलों की संख्या – अभिकारक के मोलों की संख्या
अतः ΔH = ΔU + Δng RT
जहाँ
Δng = 0
ΔΗ = ΔU
अतः इस प्रकार की अभिक्रियाएँ, जिनमें अभिकारक तथा उत्पाद ठोस होते हैं, के लिए ΔH और ΔU के मान लगभग बराबर होते हैं।
प्रश्न 5.
अवस्था फलन पद को समझाइए।
उत्तर:
अवस्था फलन – निकाय के गुण जिनके मान निकाय की अवस्था पर निर्भर करते हैं, अवस्था फलन कहलाते हैं। ताप (T), दाब (P), आयतन (V), एन्थैल्पी (H), एन्ट्रॉपी (S), आन्तरिक ऊर्जा (U), मुक्त ऊर्जा (G अथवा A), मोलों की संख्या आदि ऊष्मागतिक फलन या अवस्था फलन हैं। अवस्था के किसी फलन में परिवर्तन केवल उसके प्रारम्भिक तथा अन्तिम अवस्था के फलन के मानों पर निर्भर करता है जो इस प्रकार हैं-
Δx अवस्था फलन = अन्तिम अवस्था फलन (x2) – प्रारम्भिक अवस्था फलन (x1)
Δx = x2 – x1
जहाँ x कोई अवस्था फलन है तथा x1 प्रारम्भिक अवस्था या अवस्था 1 में तथा x2 अन्तिम अवस्था या अवस्था 2 में अवस्था फलन है।
प्रश्न 6.
हैस का नियम क्या है? इसके दो अनुप्रयोग दीजिए।
उत्तर:
इस नियम के अनुसार, यदि किसी रासायनिक अभिक्रिया या परिवर्तन को एक या अनेक पदों में दो या दो से अधिक विधियों द्वारा सम्पन्न किया जाये तो सम्पूर्ण परिवर्तन में उत्पन्न या अवशोषित ऊष्मा की मात्राएँ समान रहेंगी चाहे परिवर्तन किसी भी ढंग से किया जाये।
हंस के नियम के अनुप्रयोग
- अभिक्रिया ऊष्मा का निर्धारण करने में,
- यौगिकों की दहन ऊष्मा की गणना करने में।
आंकिक प्रश्न
प्रश्न 1.
किसी निकाय को 100 J ऊष्मा देने पर निकाय द्वारा किया गया कार्य 40 J है। निकाय की आन्तरिक ऊर्जा में वृद्धि ज्ञात करें।
हल:
दिया गया है,
q = 100 J (ऊष्मा दी गयी है। )
w = – 40 J (कार्य किया गया है। )
∆U = q + w
= 100 + (- 40)
= 100 – 40
∆U = 60 J
प्रश्न 2.
प्रारम्भिक रूप से कक्ष ताप पर स्थित एक गैस के आयतन में स्थिर ताप पर 4.0 L से 12.0 L तक का प्रसरण (Expansion) होता है। गैस द्वारा किया गया कार्य ज्ञात कीजिये। यदि इसका प्रसार
(1) निर्वात् के विरुद्ध
(2) 1.2 atm नियत दाब के विरुद्ध हो।
हल:
(1) निर्वात् के विरुद्ध प्रसरण में किया कार्य,
W = – P∆V
निर्वात् में दाब ‘P’ = 0
तथा V2 = 12.0 L
V1 = 4.0L
W = – P∆V
= – 0 (12 – 4)
W = शून्य (निर्वात् के विरुद्ध किया गया कार्य शून्य है।)
(2) 1.2 atm नियत दाब के विरुद्ध कार्य,
P = 1.2 atm
W = – P∆V
= – P (V2 – V1)
= – 1.2 (12.0 – 4.0)
= – 9.6 L atm
= – 9.6 × 101.3 J
= – 973 J
प्रश्न 3.
स्थिर दाब और 300 K ताप पर मेथेन के विरचन की एन्थैल्पी – 78.84 kJ है। स्थिर आयतन पर विरचन की एन्थैल्पी क्या होगी ?
हल:
मेथेन के विरचन का समीकरण,
C(s) + 2H2(g) → CH4(g) ∆fH = – 78.84 kJ
∆ng = 1 – 2 = – 1 mol
R = 8.314 × 10-3 kJ mol-1 K-1
∆H = – 78.84 kJ
∆U = ?
∆H = ∆U + ∆ng RT
– 78.84 = ∆U + (- 1 x 8.314 x 10-3 x 300)
∆U = (- 78.84) – (- 1 x 8.314 x 10-3 x 300)
∆U = (- 78.84) + (2.494)
∆U = – 76.346 kJ
उत्तर-आन्तरिक ऊर्जा – 76.346 kiJ
प्रश्न 4.
जल वाष्प को आदर्श गैस मानने पर 100°C एवं 1 bar दाब पर 1 mol जल के वाष्पीकरण में परिवर्तन 41 kJ mol-1 पाया गया। आन्तरिक ऊर्जा परिवर्तन गणना कीजिये। जब,
(i) 1 mol जल को 1 bar दाब एवं 100°C पर वाष्पीकृत किया
(ii) 1 mol जल को बर्फ में परिवर्तित किया जाये।
हल:
(i) H2O(l) → H2O(g)
परिवर्तन के लिये,
∆H = ∆U + ∆ng RT
∆U = ∆H – ∆ng RT
मान रखने पर,
∆U = 41.00 – (1 x 8.314 x 10-3 x 373)
= 41 – 3.1011
= 37.898 kJ mol-1
(ii) H2O(l) → H2O(s)
यहाँ परिवर्तन के लिये आयतन में परिवर्तन अति न्यून है।
अत: हम
P∆V = ∆ng RT = 0
इस स्थिति में,
∆H ≅ ∆U
∆U = 41.00 kJ mol-1
प्रश्न 5.
27°C पर 2 मोल आदर्श गैस जिसका दाब 5 वायुमण्डल है का समतापी उत्क्रमणीय प्रसार दाब 1 वायुमण्डल होने तक किया जाता है। गैस द्वारा किये गये कार्य की गणना कीजिये।
हल:
दिया गया है-
T = 27 + 273 = 300 K
n = 2 mol
R = 8.314 JK-1 mol-1
P1 = 5 atm
P2 = 1 atm
W = – 2.303 nRT log \(\frac{P_1}{P_2}\)
= – 2.303 × 2 × 8.314 x 300 x log 5
= – 2.303 × 2 × 8.314 x 300 x 0.699
= – 8030.3 J या – 8.03 kJ
प्रश्न 6.
25°C ताप पर 5 मोल आदर्श गैस जो एक वायुमण्डलीय दाब पर है को उत्क्रमणीय रूप से आधे आयतन तक सम्पीडित किया जाता है किये गये कार्य और ऊष्मा की गणना कीजिये।
हल:
दिया गया है-
T = 25 + 273 = 298 K
n = 5 मोल
R = 8.314 JK-1 mol-1
V2 = \(\frac{V_1}{2}\)
W = – 2.303 × n × R x T x log \(\frac{V_2}{V_1}\)
= – 2.303 × 5 × 8.314 × 298 × log \(\frac{\frac{V_1}{2}}{V_1}\)
= – 2.303 × 5 × 8.314 × 298 × log \(\frac { 1 }{ 2 }\)
= 2.303 × 5 × 8.314 x 298 x log 2
= 2.303 × 5 × 8.314 x 298 x 0.3010
= 8587.3 J
W = 8.59 kJ
∴ प्रक्रम समतापी है इसलिये ∆U = 0
ऊष्मागतिकी के प्रथम नियम से,
∆U = q + w
q = – w
q = – 8.59 kJ
प्रश्न 7.
एक गैस का समतापी प्रसरण 1 वायुमण्डल दाब के विरुद्ध 5 dm³ से 10 dm³ तक होता है। इस प्रक्रम में गैस 500 J ऊष्मा ग्रहण करती है। आन्तरिक ऊर्जा परिवर्तन की गणना कीजिये।
हल:
दिया गया है-
P = 1 atm
∆V = (V2 – V1)
= (10 – 5) dm³
= 5 dm³
= 5L
w = – P∆V
w = – 1 × 5 L-atm
w = – 5 × 101.3 J
w = – 506.5 J
q = + 500 J
∆U = – q + w
∆U = 500 – 506.5
∆U = – 6.5 J
प्रश्न 8.
5 मोल आदर्श गैस को स्थिर दाब पर 27°C से 127°C तक गर्म किया जाता है।
(i) प्रसरण में किये गये कार्य की गणना कीजिये।
(ii) यदि गैस को उत्क्रमणीय रूप से 30°C ताप पर 2 atm से 1.4 atm तक प्रसारित किया जाये तो किये गये कार्य की गणना कीजिये।
हल:
(i) माना कि स्थिर दाब P है।
अत:
w = – P(V2 – V1)
गैस, आदर्श गैस है अतः

(ii) समतापी उत्क्रमणीय रूप से प्रसरण में किया गया कार्य-
w = – 2.303nRTlog\(\frac{P_1}{P_2}\)
= – 2.303 × 5 × 8.314 × 303 x log\(\frac{2}{1 \cdot 4}\)
= – 2.303 × 5 × 8.314 x 303 x log\(\frac { 20 }{ 14 }\)
= – 2.303 × 5 × 8.314 × 303 x log 1.4286
= – 2.303 x 5 x 8.314 x 303 x 0.1549
= – 4493.6 J
= – 4.4936 kJ
प्रश्न 9.
एक स्विमिंग पूल में 1 x 105 L जल भरा हुआ है। जल का ताप 20°C से 25°C करने के लिये कितने जूल ऊष्मा की आवश्यकता पड़ेगी। जल की विशिष्ट ऊष्मा धारिता 4.184 J°C है।
हल:
आवश्यक ऊष्मा = द्रव्यमान x विशिष्ट ऊष्माधारिता x ताप में वृद्धि
जल का द्रव्यमान w = घनत्व x आयतन
= \(\frac { 1g }{ cm³ }\) x 10 x 10 cm³
w = 108 g
विशिष्ट ऊष्माधारिता (C) = 4.184 J°C g
∆T = 25 – 20 = 5°C
q = M x s = ∆T
आवश्यक ऊष्मा = 108 x 4.184 × 5
= 2.092 × 109 J
= 2092 × 109 J
प्रश्न 10.
नियत आयतन पर एक प्रारम्भिक गैस की विशिष्ट ऊष्मा 0.321 Jg-1 है। यदि गैस का मोलर द्रव्यमान 45g mol-1 है तो गैस की परमाणुकता क्या होगी?
हल:
Cv = Cs x मोलर द्रव्यमा
= 0.321 × 45
Cv = 14.445 J mol-1
R = 8.314 J mol-1
Cp = Cv + R
= 14.445 + 8.314
= 22.759 J mol-1
परमाणुकता = \(\frac{\mathrm{C}_p}{\mathrm{C}_v}\)
परमाणुकता = \(\frac{\mathrm{C}_p}{\mathrm{C}_v}\)
= \(\frac{22 \cdot 759}{14 \cdot 445}\) g mol-1
= 1.6
अतः गैस की परमाणुकता = 1
![]()
प्रश्न 11.
निम्नलिखित समीकरण के अनुसार 1g ऑक्सीजन की अधिकता में 1 atm दाब एवं 298 K पर बम कैलोरीमीटर में दहन कराया जाता है।
C (ग्रेफाइट) + O2 (g) → CO2 (g)
अभिक्रिया के दौरान ताप 298 K से 299K तक बढ़ता है। यदि बम कैलोरीमीटर की ऊष्माधारिता 20.7 kJ/K हो तो उपर्युक्त अभिक्रिया के लिए 1 atm दाब एवं 298 K पर एन्यैल्पी परिवर्तन
क्या होगा?
हल:
माना अभिक्रिया से प्राप्त ऊष्मा 9 एवं कैलोरीमीटर की ऊष्माधारिता Cv है, तब कैलोरीमीटर द्वारा अवशोषित ऊष्मा,
q = Cv x ∆T
अभिक्रिया से प्राप्त ऊष्मा का मान समान होगा, परन्तु चिन्ह ऋणात्मक होगा क्योंकि निकाय (अभिक्रिया – मिश्रण) द्वारा प्रदत्त ऊष्मा कैलोरीमीटर द्वारा ग्रहण की गई ऊष्मा के तुल्य होगी।
q = – Cv x ∆T
= – 20.7 kJ/K × (299 – 298) k
= – 20.7 kJ
(यहाँ ऋणात्मक चिन्ह अभिक्रिया के ऊष्माक्षेपी होने को इंगित करता है)।
अत: 1g ग्रेफाइट के दहन के लिए ∆U = – 20.7 kJ
1 mol (12 g) ग्रेफाइट के दहन के लिए = \(\frac{\left(12 \cdot 0 \mathrm{~g} \mathrm{~mol}^{-1}\right) \times(-20 \cdot 7 \mathrm{~kJ})}{1 g}\)
= – 2.48 x 10² kJ mol-1
प्रश्न 12.
5g पदार्थ जिसका मोलर द्रव्यमान 24 gmol-1 है, का बम कैलोरीमीटर में 25°C ताप पर पूर्ण दहन किया जाता है। दहन के पश्चात् ताप में डिग्री की वृद्धि प्रेक्षित की गयी। यदि कैलोरीमीटर और जल की ऊष्माधारिता 20.7 kJ/K-1 हो तो ∆U की गणना करें।
हल:
qv = (- C.∆T)
5g पदार्थ के लिये ∆T = 1°
qv = – 20.7 x 1
= – 20.7 kJ
पदार्थ का मोलर द्रव्यमान
= 24 gmol-1 है
5g से उत्पन्न ऊष्मा = – 20.7 kJ
1 g से उत्पन्न ऊष्मा = \(\frac { -20.7 }{ 5 }\)
24g से उत्पन्न ऊष्मा =\(\frac { -20.7×24 }{ 5 }\)
∆U = – 99.36 kJ mol-1
प्रश्न 13.
बम कैलोरीमीटर में 2.5 g ऑक्टेन का ऑक्सीजन के आधिक्य में पूर्ण दहन किया जाता है। कैलोरीमीटर के ताप में 6.75K की वृद्धि प्रेक्षित की गई। यदि कैलोरीमीटर की ऊष्माधारिता 8.93 kJ K-1 हो तो विनियम की गई ऊष्मा और आन्तरिक ऊर्जा परिवर्तन की गणना कीजिये।
हल:
कैलोरीमीटर द्वारा ग्रहण की गई ऊष्मा
qv = (- C.∆T)
= 8.93 × 6.75
qv = 60.2775 kJ
(C8H18) ऑक्टेन का मोलर द्रव्यमान
= 8 × 12 + 18 × 1
= 96 + 18
= 114 g mol-1
– ∆U = Cv, ∆T \(\frac { M }{ m }\)
– ∆U = 8.93 × 6.75 × \(\frac { 114 }{ 2.5 }\)
∆U = – 2748.654 kJ mol-1
प्रश्न 14.
298 K से तथा एक वायुमण्डलीय दाब पर एक मोल बेन्जीन के पूर्ण ऑक्सीकृत होने पर 781 कि. कैलोरी ऊष्मा मुक्त होती है। स्थिर आयतन पर इस अभिक्रिया की ऊष्मा की गणना कीजिए।
हल:
बेन्जीन का ऑक्सीकरण निम्न समीकरण के अनुसार होता है।
\(\mathrm{C}_6 \mathrm{H}_{6(l)}+\frac{15}{2} \mathrm{O}_{2(\mathrm{~g})} \longrightarrow 6 \mathrm{CO}_{2(\mathrm{~g})}+3 \mathrm{H}_2 \mathrm{O}_{(l)}\)
∆H = – 781 कि. कैलोरी
गैसीय अभिकारक के मोलों की संख्या = \(\frac { 15 }{ 2 }\)
गैसीय उत्पाद के मोलों की संख्या = 6
∆n(g) = 6 – \(\frac { 15 }{ 2 }\) = – 1.5
∆H = – 781 कि. कैलोरी
= – 781000 कैलोरी
T = 298K
R = 1.987 Cal K-1 mol-1
∆U = ?
∆U = ∆H – ∆n(g)RT
= – 781000 – (1.5) × 1.987 × 208
= – 780.11 कि. कैलोरी
प्रश्न 15.
300 K तथा निश्चित आयतन पर 7.8 ग्राम बेन्जीन के पूर्ण दहन पर 327 कि. जूल ऊष्मा निकलती है। बेन्जीन की स्थिर दाब पर दहन ऊष्मा की गणना कीजिए।
हल:
7.8 ग्राम बेन्जीन के पूर्ण दहन की ऊष्मा
= – 327 kJ
1 ग्राम बेन्जीन द्वारा निकली ऊष्मा = \(\frac{327 \times 78}{7.8}\)
= 3270 kJ
\(\mathrm{C}_6 \mathrm{H}_{6(\mathrm{~g})}+\frac{15}{2} \mathrm{O}_{2(\mathrm{~g})} \longrightarrow 6 \mathrm{CO}_{2(\mathrm{~g})}+3 \mathrm{H}_2 \mathrm{O}_{(\mathrm{l})}\)
∆U = – 3270 kJ, ∆ng = 6 – 7.5 = (-1.5)
R = 8.314 × 10-3 kJ K-1 mol-1 T = 300K
∆H = ∆U + ∆ng RT
= – 3270 + (- 1.5 × 8.314 x 10-3 x 300)
= – 3270 – 3.7413
∆H = – 3273.741 kJ
प्रश्न 16.
निम्नलिखित आँकड़ों से C (डायमण्ड) → C ग्रेफाइट में संक्रमण की ऊष्मा की गणना कीजिए।
C डायमण्ड + O2(g) → CO2(g); ∆H = – 94.5 कि. कैलोरी
C ग्रेफाइट + O2(g) → CO2(g); ∆H = – 94.0 कि. कैलोरी
हल:
एक मोल C (डायमण्ड) C (ग्रेफाइट) में बदलने के लिए आवश्यक संक्रमण ऊष्मा
= – 94.5 – (- 94.0)
= – 94.5 + 94.0
= 0.5 कि. कैलोरी
प्रश्न 17.
निम्न अभिक्रिया के लिए 25° से. पर स्थिर दाब पर अभिक्रिया ऊष्मा तथा स्थिर आयतन पर अभिक्रिया ऊष्मा में अन्तर गणना कीजिए।
\(2 \mathrm{C}_6 \mathrm{H}_{6(\mathrm{~g})}+15 \mathrm{O}_{2(\mathrm{~g})} \longrightarrow 12 \mathrm{CO}_{2(\mathrm{~g})}+6 \mathrm{H}_2 \mathrm{O}_{(\mathrm{l})}\)
हल:
\(2 \mathrm{C}_6 \mathrm{H}_{6(\mathrm{~g})}+15 \mathrm{O}_{2(\mathrm{~g})} \longrightarrow 12 \mathrm{CO}_{2(\mathrm{~g})}+6 \mathrm{H}_2 \mathrm{O}_{(\mathrm{l})}\)
∆H – ∆V = P∆V
P∆V = ∆n(g) RT
∆n = 12 – 15 = (- 3)
R = 8.314 x 10³ कि. जूल डिग्री-1 मोल-1
T = 273 + 25 = 298
∆H – ∆V = (- 3) x 8.314 x 10-3 x 298
= – 7.432 कि. जूल
= – 7.432 kJ
प्रश्न 18.
निम्न अभिक्रिया के लिये मानक आन्तरिक ऊर्जा में परिवर्तन की गणना करो:
OF2(g) + H2O(g) → O2(g) + 2HF(g) 298K ताप पर OF2(g) + H2O(g) और HF(g) की सम्भवन की एन्थैल्पी क्रमशः + 20, – 250 और – 270 kJ mol हैं।
हल:

प्रश्न 19.
Fe2O3 (s) के सम्भवन (विरचन) की ऊष्मा – 824.2 kJ mol है। अभिक्रिया की ऊष्मा के परिवर्तन की गणना कीजिए।
हल:
4Fe (s) + 3O2 (g) → 2Fe2O3 (s)
∆rHΘ = ∑∆fHΘ(उत्पाद) – ∑∆fHΘ(अधिकारक)
= [2 × ∆fHΘ(Fe2O3)] – [ 4 × 4fHΘ Fe(s) + 3 × ∆fHΘO2(g)]
= (2 × – 824.2) – (4 × 0 + 3 × 0]
∆rHΘ = – 1648.4 kJ
प्रश्न 20.
ग्लूकोस का दहन निम्नलिखित समीकरण के अनुसार होता है-
C6H12O6(s) + 6O2(g) → 6CO2 (g) + 6H2O(l);
∆cHΘ = – 2900kJ mol-1
1.8 g ग्लूकोस के दहन में कितनी ऊष्मा निर्मुक्त होगी ?
हल:
C6H12O6(s) + 6O2(g) → 6CO2 (g) + 6H2O(l);
1 mol (180 g) ∆cHΘ = – 2900kJ mol-1
1 mol (180 g) ग्लूकोस के दहन में निर्मुक्त ऊष्मा = 2900 kJ
अत: 1.8 g ग्लूकोस के दहन में निर्मुक्त ऊष्मा
= \(\frac{2900}{180} \times 1.8\)
= 29 kaJ
![]()
प्रश्न 21.
यदि एक व्यक्ति अपने भोजन से प्रतिदिन 9000 kJ ऊर्जा प्राप्त करता है व सभी प्रकार से 11000kJ ऊर्जा प्रतिदिन खर्च करता है तो आन्तरिक ऊर्जा में प्रतिदिन कितना परिवर्तन होगा ? यदि खर्च ऊर्जा सुक्रोज (1500kJ प्रति 100 ग्राम) के रूप में संग्रहीत हो तो एक kg खर्च होने में कितने दिन लगेंगे। (जल हानि नगण्य मानें)।
हल:
आन्तरिक ऊर्जा में प्रतिदिन परिवर्तन
= 11000 – 9000
= 2000 kJ
ऊर्जा की हानि होगी क्योंकि ऊर्जा अधिक खर्च हुयी है।
100 ग्राम सुक्रोज से ऊर्जा
= 1500 kJ हानि
1000 ग्राम सुक्रोज से ऊर्जा
= \(\frac{1500 \times 1000}{100}\) हानि
= 15000 kJ हानि
15000 kJ ऊर्जा या 1000 ग्राम भार को खर्च करने के लिये
दिनों की संख्या = \(\frac { 15000 }{ 2000 }\) = 7.5 दिन
प्रश्न 22.
यदि मेथिल ऐल्कोहॉल की सम्भवन ऊष्मा 2041.2 कि. जूल तथा C H एवं OH बंधों की बन्ध ऊर्जाएँ क्रमशः 415.3 एवं 466.2 कि. जूल हों, तो CO बन्ध की बन्ध ऊर्जा की गणना करो।
हल:
मेथिल ऐल्कोहॉल की संरचना में तीन C-H बन्ध, एक O – H बन्ध है।
मैथिल ऐल्कोहॉल की सम्भवन ऊष्मा
∆H° = 2041.2 कि. जूल
अत: ∆HC – 0
= ∆H°(3∆HC – H + ∆HO – H)
=2041.2 – (3 × 415.8 + 466.2)
= 2041·2 (1713.6 – 327.6 कि. जूल उत्तर
प्रश्न 23.
298K पर CCl4(g) + H2O(g), CO2(g), HCl(g) की मानक सम्भवन ऊष्माएँ क्रमश: 25.5, 578, – 94.1 और – 22.1 kcal mol-1 हैं। निम्न अभिक्रिया के लिये ∆rHΘ की गणना कीजिये।
CCl4(g) + 2H2O(g) → CO2(g)(g) + 4HCl(g)
हल:
∆rHΘ = ∑∆fHΘ(उत्पाद) – ∑∆rHΘ(अभिकारक)
= [4 x ∆fHΘ(HCl) + ∆fHΘ(CO2)] – [∆fHΘ(CCl4) + 2 x ∆fHΘ H2O]
= [(4 × – 22.1) + (- 94.1)] – [25.5 + 2 × 57.8]
= [- 88.4 – 94·1] – [25.5 + 115.6]
= – 182.5 – 141.1
= – 323.6 kcalmol-1
प्रश्न 24.
\(\mathrm{C}_{(\mathrm{s})}+\mathrm{O}_{2(\mathrm{~g})} \longrightarrow \mathrm{CO}_{2(\mathrm{~g})} ; \quad \Delta \mathrm{H}=-94 \cdot 3 \mathrm{k} \text { Cal }\)
\(\mathrm{CO}(\mathrm{g})+\frac{1}{2} \mathrm{O}_2(\mathrm{~g}) \longrightarrow \mathrm{CO}_{2(\mathrm{~g})} ; \quad \Delta \mathrm{H}=-68 \cdot 0 \mathrm{k} \mathrm{Cal}\)
निम्नांकित अभिक्रिया में ∆H का मान बताएँ-
C(s) + \(\frac { 1 }{ 2 }\)O2(g) → CO(g)
हल:
दिया गया है,

उत्तर – दी गयी अभिक्रिया के ∆H का मान – 26.3 kCal है।
प्रश्न 25.
नीचे दिये गये आँकड़ों से Cl – Cl की बन्ध एन्थैल्पी ज्ञात कीजिये,
\(\mathrm{CH}_{4(\mathrm{~g})}+\mathrm{Cl}_{2(\mathrm{~g})} \longrightarrow \mathrm{CH}_3 \mathrm{Cl}_{(\mathrm{g})}+\mathrm{HCl}_{(\mathrm{g})}\)
∆rH = – 100.3 k J mol-1
C – H, C – Cl, H – Cl बन्धों की आबन्ध ऊर्जा क्रमशः 413, 326 तथा 431 kJ mol-1 है।
हल:
दी गयी समीकरण-
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)

प्रश्न 26.
अभिक्रिया
HCN(g) + 2H2(g) → CH3 NH2(g)
की ∆rH° का मान – 150kJ है। C ≡N की बन्ध एन्बैल्पी ज्ञात करें। यदि (C – H, H – H, N – H तथा C – N बन्धों की मानक बन्ध एन्थैल्पी क्रमशः 414, 435, 369 और 293 kJ mol-1 है।
हल:
अभिक्रिया
HCN(g) + 2H2(g) → CH3NH2(g)
को बन्धों के रूप में निम्न प्रकार लिख सकते हैं।

प्रश्न 27.
शुष्क ऐलुमिनियम क्लोराइड (Al2Cl6) की सम्भवन की एन्बैल्पी निम्न आँकड़ों से ज्ञात करो-
(i) 2Al(s) + 6HCl(aq) → Al2Cl6(aq) + 3H2(g); ∆H = – 1004.0 kJ
(ii) HCl(g) + Cl2(g) → 2 HCl(g); ∆H = – 183.9 kJ
(iii) HCl(g) + aq → HCl(aq); ∆H = – 73.2 kJ
(iv) Al2Cl6(s) + aq → Al2Cl6(aq); ∆H = 643.0 kJ.
हल:
ज्ञात करना है-
2Al(s) + 3H2(g) → Al2Cl6(s) ; ∆H = ?
समीकरण (ii) में 3 की गुणा करने पर तथा समीकरण (i) से जोड़ने
3H2(g) + 3Cl2(g) → 6HCl(g); ∆H = – 183.9 x 3 = – 551.7 kJ
2 Al(s) + 6HCl(aq) → Al2Cl6(aq) + 3H2(g); ∆H = – 1004.0 kJ
(जोड़ने पर )
2Al(s) + 6HCl(aq) + 3H2(g) + 3Cl2(g) → 6HCl(g) + Al2 Cl6(aq) + 3H2(g)
∆H = (- 551.7) + (- 1004.0)
= – 1555.7 kJ … (v)
समीकरण (iii) को 6 से गुणा करने पर तथा समीकरण (v) से जोड़ने पर

प्रश्न 28.
निम्नलिखित आँकड़ों की सहायता से N2O की अनुनादी ऊर्जा ज्ञात कीजिये-
∆fHΘ(N2O) = 82 kJ mol-1
N ≡ N, N = N, O = O, N ≡ O की बन्ध एन्बैल्पी क्रमश: 946, 418, 498 तथा 607 kJ mol-1 है।
हल:
अनुनादी ऊर्जा परिकलित ∆fH° प्रेक्षित ∆fH° प्रेक्षित ∆fH° (N2O) = 82 kJ mol-1
आँकड़ों से परिकलित ∆fH° ज्ञात करना है।
अभिक्रिया,

प्रश्न 29.
निम्न उत्क्रमणीय प्रक्रम हेतु एन्ट्रॉपी परिवर्तन ज्ञात करो। 1 atm दाब पर 100°C ताप पर 1 मोल द्रव जलवाष्प में बाष्पित होता है।
(H2O हेतु ∆Hvap = 2257 Jg-1)
हल:
∆Hvap = 2257 Jgl-1 = 2257 x 18
= 40626 J mol-1
क्योंकि H2O का मोलर द्रव्यमान = 18 g mol
Tb = 100°C + 273 = 373K
∆Hvap = \(\frac{\Delta \mathrm{H}_{\text {vap }}}{\mathrm{T}_{\mathrm{b}}}\)
= \(\frac { 40626 }{ 373 }\)
∆Hvap = 108.9 JK-1 mol-1
प्रश्न 30.
MgSO4 के सम्बन्ध में निम्न आँकड़े ज्ञात हैं;
∆H = 7.80 kJ mol-1 और ∆S = 70 J K-1 mol-1 इसका गलनांक ज्ञात करें।
हल:

प्रश्न 31.
निम्न अभिक्रियाओं हेतु प्रति मोल मुक्त ऊर्जा परिवर्तन ज्ञात करो।
(i) CaCO3 (s) → CaO(s) + CO2(g) 298K ताप पर
∆H = + 177.9 kJ, ∆S = 160.4 JK-1
हल:
दिया गया है.
∆H = 177.9 × 10³ J
∆S = 160.4 JK-1
T = 298K
∆G = ∆H – T∆S
= 177900 – 298 x 160.4
= 177900 – 47799.2
= 130100.8 J
= 130.1 kJ
(ii) 2NO2 (g) → N2O4 (g) 298K ताप पर
∆H = – 57.2 kJ
∆S = – 175.6 JK-1
हल:
दिया गया है,
∆H = – 57.2 × 10³ J
∆S = – 175.6 JK-1
T = 298K
∆G = ∆H – T∆S
= – 57200-(- 175.6 × 298)
= – 57200 + 52328.8
= – 4871.2 J
= – 4.871 kJ
![]()
प्रश्न 32.
अभिक्रिया,
2NO(g) + O2(g) → 2NO2(g) के लिये एन्थेल्पी तथा एन्ट्रॉपी परिवर्तन क्रमशः – 113.0 kJ mol-1 एवं 145 JK-1 mol-1 है। वह ताप ज्ञात कीजिये जिस पर
अभिक्रिया स्वतः प्रेरित हो।
हल:
हम साम्यावस्था का ताप ज्ञात कर सकते हैं

अग्र दिशा में या अभिक्रिया स्वतः प्रेरित हो इसके लिये तापमान अवश्य ही 779.3K से कम होना चाहिये।
प्रश्न 33.
400 K ताप पर निम्नलिखित अभिक्रिया के लिये साम्य स्थिरांक Kc क्या होगा ?
2NOCl(g) ⇌ 2NO(g) + Cl2(g)
दिया गया है 400 K ताप पर
∆H = 77.2 kJ mol-1
= 77.2 x 10³ J mol-1
और ∆S = 122 JK-1 mol-1 है।
हल:
∆G = ∆H T∆S
∆G = 77200 – 400 × 122
= (77200-48800)
∆G = 28400 J mol-1
अभिक्रिया के लिये साम्य स्थिरांक = ?
∆G = – 2.303 RT log Kc
∆G = 28.4 × 10³ J mol-1
R = 8.314 JK-1 mol-1
T = 400K
∆G = – 2.303 RT log Kc
log Kc = \(\frac{-\Delta \mathrm{G}}{2 \cdot 303 \mathrm{RT}}\)
= \(\frac{-28.4 \times 10^3}{2.303 \times 8.314 \times 400}\)
log Kc = 3.7081
Kc = Antilog (- 3.7081)
= Antilog [- 4 + 0.2919]
= Antilog (\(\bar{4}\).2919)
Kc = 1.958 × 10-4