Haryana State Board HBSE 11th Class Chemistry Important Questions Chapter 7 साम्यावस्था Important Questions and Answers.
Haryana Board 11th Class Chemistry Important Questions Chapter 7 साम्यावस्था
बहुविकल्पीय प्रश्न
1. एक रासायनिक अभिक्रिया A ⇌ B साम्य में कहलायेगी, जब –
(1) A पूर्णत: B में परिवर्तित होता है।
(2) A का B में ठीक 10% परिवर्तन होता है
(3) A का B में 50% परिवर्तन होता है
(4) A के B में परिवर्तन होने की दर और B के A में परिवर्तन होने की दर बराबर होती है।
उत्तर:
(4) A के B में परिवर्तन होने की दर और B के A में परिवर्तन होने की दर बराबर होती है।
2. A + 2B ⇌ C अभिक्रिया के लिए साम्य स्थिरांक का व्यंजक हैं-
(1) \(\frac{[\mathrm{A}][\mathrm{B}]^2}{[\mathrm{C}]}\)
(2) \(\frac{[\mathrm{A}][\mathrm{B}]}{[\mathrm{C}]}\)
(3) \(\frac{[\mathrm{C}]}{[\mathrm{A}][\mathrm{B}]^2}\)
(4) \(\frac{[\mathrm{C}]}{[\mathrm{A}][\mathrm{B}]}\)
उत्तर:
(3) \(\frac{[\mathrm{C}]}{[\mathrm{A}][\mathrm{B}]^2}\)
3. अभिक्रिया, A (ठोस) + 2B (गैस) ⇌ 3D (ठोस) + 2C (गैस) के लिए-
(1) Kp = Kc (RT)0
(2) Kp = Kc R² T²
(3) Kp = Kc(RT)
(4) Kp = Kc = R-2 T-2
उत्तर:
(1) Kp = Kc (RT)0
4. यदि अभिकारकों तथा उत्पाद की सान्द्रता दोगुनी कर दी जाय तो साम्य स्थिरांक Kc होगा –
(1) 2Kc
(2) \(\frac{K_c}{2}\)
(3) K²c.
(4) अपरिवर्तित
उत्तर:
(4) अपरिवर्तित
5. अभिक्रिया N2 + 3H2 ⇌ 2NH3 + X किलो जूल में अधिक अमोनिया बनाने के लिए आवश्यक शर्ते हैं-
(1) उच्च ताप और उच्च दाब
(2) कम ताप और उच्च दाब
(3) कम ताप और कम दाब
(4) उच्च ताप और कम दाब।
उत्तर:
(2) कम ताप और उच्च दाब
6. PCI5 = PCI3 + CI2 में यदि आयतन मूल आयतन का 16 गुना कर दिया जाये तो वियोजन की मात्रा हो जायेगी-
(1) 4 गुनी
(2) 1/4 गुनी
(3) 2 गुनी
(4) 1/2 गुनी।
उत्तर:
(1) 4 गुनी
7. यदि अभिक्रिया A + B ⇌ C + D में यदि A का सान्द्रण दोगुना तथा B का सान्द्रण आधा कर दिया जाये तो अभिक्रिया के वेग में क्या परिवर्तन होगा-
(1) दोगुनी वृद्धि
(2) घटकर आधी
(3) कोई परिवर्तन नहीं
(4) घटकर चौथाई।
उत्तर:
(3) कोई परिवर्तन नहीं
![]()
8. N2 + 3H2 ⇌ 2NH3 क्रिया में मानक ताप व दाब पर 68 ग्राम NH3 बनाने हेतु H2 का आवश्यक आयतन लेंगे-
(1) 67.2 लीटर
(2) 22.4 लीटर
(3) 134.4 लीटर
(4) 112.3 लीटर।
उत्तर:
(3) 134.4 लीटर
9. अभिक्रिया H2 + I2 ⇌ 2HI की साम्यावस्था में H2 व I2 की मोलर सान्द्रताएँ क्रमश: a तथा b हैं तथा HI के संश्लेषण की मात्रा x हो, तो साम्य स्थिरांक Kc का मान होगा-
(1) \(\frac{x^2}{(a-x)(b-x)}\)
(2) \(\frac{4 x^2}{(a-x)(b-x)}\)
(3) \(\frac{2 x^2}{(a-x)(b-x)}\)
(4) \(\frac{x^2}{4(a-x)(b-x)}\)
उत्तर:
(2) \(\frac{4 x^2}{(a-x)(b-x)}\)
10. अभिक्रिया PCI5 ⇌ PCI3 + CI2 में यदि x वियोजन की मात्रा हो तब Kp का मान होगा-
(1) \(\frac{x^2}{(1-x) P}\)
(2) \(\frac{x}{\left(1-x^2\right) P}\)
(3) \(\frac{x}{(1-x)^2 P}\)
(4) \(\frac{x^2 P}{\left(1-x^2\right)}\)
उत्तर:
(4) \(\frac{x^2 P}{\left(1-x^2\right)}\)
11. द्रव अनुपाती क्रिया के नियम का सत्यापन किसने किया—
(1) गोल्डबर्ग ने
(2) बोडेन्सटीन ने
(3) आरहीनियस ने
(4) ओस्टवाल्ड ने।
उत्तर:
(2) बोडेन्सटीन ने
12. यदि CH3COOK का वियोजन स्थिरांक 10-2 हो, तो CH3COOH का वियोजन स्थिरांक होगा-
(1) 10-2
(2) 10-12
(3) 10-14
(4) 10-16
उत्तर:
(2) 10-12
13. सोडियम सल्फेट का जलीय विलयन होता है-
(1) अम्लीय
(2) क्षारीय
(3) उदासीन
(4) उभयधर्मी।
उत्तर:
(1) अम्लीय
14. यौगिक जिसके जलीय विलयन की pH सबसे अधिक है-
(1) NH4 CI
(2) NH3CO3
(3) NaOH
(4) NaCI
उत्तर:
(3) NaOH
15. अल्प विलेय लवण AgCI की 26°C पर जल में विलेयता 1.25 × 10-5 मोल/लीटर है। इसका विलेयता गुणनफल होगा-
(1) 1.25 × 1010
(3) 1.56 x 1010
(2) 1.50 x 10-5
(4) 3.53 x 10-3
उत्तर:
(3) 1.56 x 1010
16. निम्न में से कौन सा युग्म समआयतन प्रभाव दर्शाता है-
(1) BaCl2 + Ba(NO)2
(2) KCl + HCl
(3) CH3COOH +CH3COONa
(4) AgCN + NaCN.
उत्तर:
(3) CH3COOH +CH3COONa
17. निम्न में से किस लवण का जल अपघटन होगा-
(1) KCI
(2) Na2SO4
(3) NaNO3
(4) KCN
उत्तर:
(4) KCN
18. किसी विद्युत अपघट्य के वियोजन की मात्रा निर्भर करती है-
(1) तापमान पर
(2) विलायक की प्रकृति पर
(3) सान्द्रता पर
(4) आयनों के आवेश पर
उत्तर:
(4) आयनों के आवेश पर
19. एक यौगिक में OH– तो नहीं है, लेकिन वह जल में घोलने पर क्षारीय विलयन देता है। वह यौगिक है-
(1) NH3
(2) CO2
(3) BCl3
(4) NH4Cl
उत्तर:
(1) NH3
20. किसी विद्युत अपघट्य का आयनन निर्भर करता है-
(1) विद्युत अपघट् की प्रकृति पर
(2) ताप पर
(3) विलायक की प्रकृति पर
(4) इन सभी पर
उत्तर:
(4) इन सभी पर
![]()
21. निम्न में से कौन-सा तथ्य गलत है-
(1) जलीय विघटन में आयन होते हैं
(2) सब आयन रंगीन होते हैं
(3) आयनों पर वैद्युत आवेश होता है
(4) आयनिक अभिक्रियाएँ क्षणिक होती हैं।
उत्तर:
(4) आयनिक अभिक्रियाएँ क्षणिक होती हैं।
22. पिघले हुए साधारण नमक में वैद्युत चालन होता है, क्योंकि उसमें होते हैं-
(1) मुक्त इलैक्ट्रॉन
(2) मुक्त आयन
(3) मुक्त परमाणु
(4) मुक्त अणु।
उत्तर:
(3) मुक्त परमाणु
23. प्रबल वैद्युत अपघट्य का अभिप्राय है कि-
(1) उसका आयनन अधिक होता है।
(2) उसकी जल में विलेयता अधिक होती है
(3) उसके आयन वैद्युत धारा को ले जाते हैं।
(4) धनायनों तथा ऋणायनों की संख्या समान होती है।
उत्तर:
(1) उसका आयनन अधिक होता है।
24. आहनियस का आयनन सिद्धांन्त असफल रहता है-
(1) अम्लों के लिए
(2) क्षारों के लिए
(3) लवणों के लिए
(4) प्रबल विद्युत अपघट्यों के लिए।
उत्तर:
(4) प्रबल विद्युत अपघट्यों के लिए।
25. निम्न में से कौन-सा वर्ग सदैव प्रबल विद्युत अपघट्य का कार्य करता है-
(1) अम्ल
(2) क्षार
(3) लवण
(4) जटिल यौगिक।
उत्तर:
(4) जटिल यौगिक।
26. एक विद्युत् अपघट्य के संतृप्त विलयन में एक निश्चित ताप पर यह स्थिर होता है-
(1) आयनिक गुणनफल
(2) विलेयता गुणनफल
(3) आयनिक स्थिरांक
(4) वियोजन स्थिरांक।
उत्तर:
(4) वियोजन स्थिरांक।
27. ऐसीटिक अम्ल और सोडियम ऐसीटेट के विलयन मिलाने पर ऐसीटिक अम्ल के वियोजन की मात्रा कम होने का कारण है-
(1) विलेयता गुणनफल
(2) आयनी गुणनफल
(3) उभय प्रतिरोधी क्रिया
(4) सम आयन प्रभाव।
उत्तर:
(3) उभय प्रतिरोधी क्रिया
28. एक वैद्युत अपघट्य का अवक्षेपण होता है, क्योंकि आयनों के सान्द्रण का गुणनफल-
(1) विलेयता से अधिक होता है
(2) विलेयता से कम होता है
(3) विलेयता गुणनफल से अधिक होता है
(4) विलेयता गुणनफल के बराबर होता है।
उत्तर:
(1) विलेयता से अधिक होता है
29. सिल्वर क्लोराइड का विलेयता गुणनफल 1.57 × 10-1 है। इसके संतृप्त विलयन में Cl– की सान्द्रता होगी-
(1) 12.5 × 105
(2) 1.57 × 105
(3) 1.25 × 10-5
(4) 0.125 × 105
उत्तर:
(4) 0.125 × 105
30. BaSO4 का विलेयता गुणनफल 1 × 10-10 है। इसके जलीय विलयन में SO42- आयन का सान्द्रण होगा-
(1) 1 × 10-5
(2) 1 × 105
(3) 2 × 10-5
(4) 1 × 107
उत्तर:
(1) 1 × 10-5
31. शुद्ध जल की मोलरता है-
(1) 55.4
(2) 18
(3) NH3
(4) OH–
उत्तर:
(1) 55.4
32. निम्न में तीव्र लुईस क्षार है-
(1) CH3–
(2) F–
(3) NH3
(4) OH–
उत्तर:
(3) NH3
33. निम्न में से कौन-सा लुईस अम्ल है
(1) OH–
(2) CH3COO–
(3) NH3
(4) BF3
उत्तर:
(4) BF3
34. निम्न में से कौन सा ब्रॉन्स्टेड अम्ल तथा ब्रॉन्स्टेड क्षारक दोनों का कार्य करता है-
(1) HSO4
(2) CH3NH2
(3) OH–
(4) NH4–
उत्तर:
(2) CH3NH2
35. CH3NH2 का संयुग्मी अम्ल है.
(1) CH3OH
(2) CH3NH3+
(3) CH3NH3
(4) CH3NH–
उत्तर:
(2) CH3NH3+
36. Cl– आयन किस अम्ल का संयुग्मी क्षारक है-
(1) HCl
(2) HOCl
(3) HClO3
(4) H3O+
उत्तर:
(1) HCl
37. निम्न में लुईस क्षार होता है-
(1) Cu2+
(2) Ag+
(3) CN–
(4) SO3
उत्तर:
(3) CN–
38. जब pH = 0 है, तो [H+] होगा-
(1) 0
(2) 1
(3) 7
(4) 14
उत्तर:
(1) 0
39. अम्लीय विलयन में OH+ आयन की सान्द्रता होगी
(1) > 10-7
(2) 10-7
(3) < 10-5
(4) इनमें से कोई नही।
उत्तर:
(1) > 10-7
40. यौगिक जिसका 0.1 M विलयन क्षारीय है-
(1) CH3COONH4
(2) NH4NO3
(3) NH4Cl
(4) CH3COOK
उत्तर:
(4) CH3COOK
41. निम्न में से कौन-सा जल अपघटित होगा-
(1) KCl
(2) NH4Cl
(3) K2SO4
(4) NaCl.
उत्तर:
(2) NH4Cl
42. ऐसीटिक अम्ल के जलीय विलयन में होता है-
(1) H+ तथा CH3COO–
(2) H3O+, CH3COO– तथा CH3COOH
(3) H+, H3O+ तथा CH3COO–
(4) CH3COO–, H+ तथा CH3COO–.
उत्तर:
(2) H3O+, CH3COO– तथा CH3COOH
43. NH2– का संयुग्मी अम्ल है-
(1) NH3
(2) NH2OH
(3) NH4–
(4) N2H4
उत्तर:
(1) NH3
![]()
44. निम्न में से कौन-सा बफर विलयन होता है-
(1) NaOH + NaCl
(2) HNO3 +KNO3
(3) HCl+ NaCl
(4) NH4Cl + NH4 OH.
उत्तर:
(4) NH4Cl + NH4 OH.
45. एक प्रबल अम्ल एवं प्रबल क्षार की उदासीनीकरण की ऊष्मा सदैव होती है-
(1) 13.7 kcal
(2) 9.6 kcal
(3) 6 kcal
(4) 11.4 kcal.
उत्तर:
(1) 13.7 kcal
46. दुर्बल क्षार एवं प्रबल अम्ल के लवण के जलीय विलयन की PH ज्ञात करने के लिये सही सम्बन्ध है-
(1) pH = 7 + \(\frac {1}{2}\) log Kb + \(\frac {1}{2}\) log C
(2) pH = 7 – \(\frac {1}{2}\) log Kb – \(\frac {1}{2}\) log C
(3) pH = 7 + \(\frac {1}{2}\) log Ka + \(\frac {1}{2}\) log C
(4) उपरोक्त में से कोई नहीं।
उत्तर:
(1) pH = 7 + \(\frac {1}{2}\) log Kb + \(\frac {1}{2}\) log C
47. निम्न में से क्षारीय लवण कौन-सा है-
(1) PbS
(2) PbCO3
(3) PbSO4
(4) 2 PbCO3.Pb (OH)2.
उत्तर:
(4) 2 PbCO3.Pb (OH)2.
48. दुर्बल अम्ल जिसका वियोजन स्थिरांक Ka तथा सान्द्रता C है, के विलयन में हाइड्रोजन आयन सान्द्रता होती है-
(1) \(\sqrt{\mathrm{K}_a \mathrm{/C}}\)
(2) C/Ka
(3) Ka C
(4) \(\sqrt{K_a \cdot C}\)
उत्तर:
(4) \(\sqrt{K_a \cdot C}\)
49. प्रबलतम ब्रॉन्स्टेड क्षार होगा-
(1) ClO–
(2) ClO2–
(3) ClO3–
(4) ClO4–
उत्तर:
(1) ClO–
50. 1 × 10-8 M – HCl विलयन की pH है-
(1) 6 व 7 के बीच
(2) 7 व 8 के बीच
(3) 8
(4) – 8.
उत्तर:
(1) 6 व 7 के बीच
51. 90°C पर शुद्ध जल में [H3O+] = 10-6 M है। इस ताप पर Kw का मान क्या है-
(1) 10-6
(2) 10-12
(3) 10-11
(4) 10-8
उत्तर:
(2) 10-12
52. निम्न में से किस विलयन की pH सर्वाधिक है-
(1) NH4Cl
(2) (NH4)2 SO4
(3) Na2 CO3
(4) Na NO3.
उत्तर:
(3) Na2 CO3
53. निम्न में से कौन सा अम्ल व क्षार दोनों की तरह कार्य करता है—
(1) SO42-
(2) H3O+
(3) CO32-
(4) HCO3–
उत्तर:
(4) HCO3–
54. लुईस संकल्पना के अनुसार निम्न में से कौन क्षार नहीं है-
(1) OH–
(2) Ag+
(3) NH3
(4) H–
उत्तर:
(2) Ag+
55. हाइड्रोक्लोरिक अम्ल के एक 10-3 M विलयन का pH होगा-
(1) 1.3
(2) 2.0
(3) 3·0
(4) 4.5.
उत्तर:
(3) 3·0
56. जल नहीं हो सकता-
(1) लूईस अम्ल
(2) लुईस क्षार
(3) ब्रॉन्स्टेड अम्ल
(4) ब्रॉन्स्टेड क्षार।
उत्तर:
(1) लूईस अम्ल
57. ऐथिल ऐसीटेट के जल अपघटन में स्व उत्प्रेरक है-
(1) C2H2OH
(2) CH3COOC2H5
(3) H2O
(4) CH3COOH.
उत्तर:
(4) CH3COOH.
58. न्यूनतम pH मान का जलीय विलयन है।
(1) पोटॅशियम नाइट्रेट
(2) कॉस्टिक सोडा
(3) सोडियम सायनाइड
(4) फेरिक क्लोराइड।
उत्तर:
(4) फेरिक क्लोराइड।
59. अम्लीय शक्ति का सही क्रम है-
(1) HClO < HClO2 < HClO3 < HClO4
(2) HClO4 < HClO < HClO2 < HClO3
(3) HClO2 < HClO3 < HClO4 < HClO
(4) HClO4 < HClO3 < HClO2 < HClO.
उत्तर:
(1) HClO < HClO2 < HClO3 < HClO4
60. एक विलयन के pH मान के लिये व्यंजक है-
(1) log [H+]
(2) log \(\frac{1}{\left[\mathrm{H}^{+}\right]}\)
(3) \(\frac{1}{\log \left[\mathrm{H}^{+}\right]}\)
(4) \(-\log \left[\frac{1}{\mathrm{H}^{+}}\right]\)
उत्तर:
(2) log \(\frac{1}{\left[\mathrm{H}^{+}\right]}\)
61. PbS2 के विलेयता गुणनफल के लिये व्यंजक है-
(1) [Pb2+] [S2-]²
(2) [Pb4+] [S2-]²
(3) [Pb2+] [2S2-]
(4) [2Pb4+] [S2-]²
उत्तर:
(2) [Pb4+] [S2-]²
62. H2S विलयन का pH है-
(1) >7
(2) <7
(3) 7
(4) 0
उत्तर:
(2) <7
63. HS– का संयुग्मी क्षार है-
(1) S2-
(2) H2S
(3) उपरोक्त दोनों
(4) दोनों में से कोई नहीं।
उत्तर:
(1) S2-
![]()
64. यदि 50°C पर pkw = 13.36 है तो इस ताप पर जल का pH मान क्या होगा-
(1) 7.00
(2) 6.68
(3) 7.63
(4) 6·00.
उत्तर:
(2) 6.68
65. निम्न अम्लों में से किसका pKa मान सबसे कम होगा-
(1) CH3 – CH2 – COOH
(2) (CH3)2 CHCOOH
(3) HCOOH
(4) CH3 – COOH.
उत्तर:
(3) HCOOH
66. PbCl2 का विलेयता गुणनफल Ksp है। इसकी विलेयता है-
(1) \(\sqrt{\mathrm{K}_{\mathrm{sp}}}\)
(2) \(\sqrt[3]{\mathrm{K}_{\mathrm{sp}}}\)
(3) \(\sqrt[3]{\mathrm{K}_{\mathrm{sp}} / 4}\)
(4) \(\sqrt{8 \mathrm{~K}_{\mathrm{sp}}}\)
उत्तर:
(3) \(\sqrt[3]{\mathrm{K}_{\mathrm{sp}} / 4}\)
67. A2X3 की विलयेता Y मोल ली.-1 है। इसका विलेयता गुणनफल है-
(1) 6Y4
(2) 64Y4
(3) 36Y5
(4) 108Y5
उत्तर:
(4) 108Y5
68. AgCl की 30°C पर विलेयता 1.5 x 10-3 gL-1 है। इसका विलेयता गुणनफल है।
(1) (1.5 × 10-3)²
(2) (1.05 × 10-5)²
(3) (1.05 x 10-3)²
(4) (1.5 × 10-3 × 143.5)².
उत्तर:
(2) (1.05 × 10-5)²
69. उच्च दाब निम्न अग्र अभिक्रिया में अनुकूलता प्रदान करेगा-
(1) H2(g) + I2(g) ⇌ 2HI(g)
(2) N2(g) + 3H2(g) ⇌ 2NH3(g)
(3) N2(g) + O2 (g) ⇌ 2NO(g)
(4) PCl5(g) ⇌ PCl3 (g) + Cl2 (g).
उत्तर:
(1) H2(g) + I2(g) ⇌ 2HI(g)
70. अग्र एवं विपरीत अभिक्रिया के लिए वेग स्थिरांक क्रमश: K1 एवं K2 हैं तो अभिक्रिया का साम्य स्थिरांक होता है-
(1) K1 x K2
(2) K2 – K1
(3) \(\frac{\mathrm{K}_1}{\mathrm{~K}_2}\)
(4) \(\frac{\mathrm{K}_1+\mathrm{K}_2}{\mathrm{~K}_1-\mathrm{K}_2}\)
उत्तर:
(3) \(\frac{\mathrm{K}_1}{\mathrm{~K}_2}\)
71. जब दो क्रियाकारक A एवं B संयोग के पश्चात् उत्पाद C एवं D देते हैं तो प्रारम्भिक अवस्था में अभिक्रिया भागफल (Reaction quotient, Q)-
(1) शून्य होता है
(2) समय के साथ बढ़ता है
(3) समय पर निर्भर नहीं करता
(4) समय के साथ कम होता है।
उत्तर:
(2) समय के साथ बढ़ता है
72. अभिक्रिया x + 3y → 2Z में x, y तथा z के साम्य सान्द्रण क्रमशः 2, 2 तथा 4 हैं। साम्य स्थिरांक का मान है-
(1) 1
(2) 2
(3) 3
(4) 4.
उत्तर:
(1) 1
73. MgCO3(s) ⇌ MgO (s) + CO2 (g) के लिए निम्न में से सही है-
(1) Kp = \(\frac{\mathrm{P}_{\mathrm{Mg}} \mathrm{O} \times \mathrm{P}_{\mathrm{CO}_2}}{\mathrm{P}_{\mathrm{MgCO}_3}}\)
(2) Kp = \(\frac{P_{\mathrm{Mgo}}+P_{\mathrm{CO}_2}}{\mathrm{P}_{\mathrm{MgCO}_3}}\)
(3) Kp = \(\frac{[\mathrm{Mgo}]\left[\mathrm{CO}_2\right]}{\left[\mathrm{MgCO}_3\right]}\)
(4) Kp = PCO2 ·
उत्तर:
(4) Kp = PCO2 ·
74. यदि N2 + 3H2 ⇌ 2NH3 के लिए साम्य स्थिरांक K तथा 2N2 + 6H2 ⇌ 4NH3 के लिए साम्य स्थिरांक K’ है तो K’ का मान होगा-
(1) K²
(2) \(\sqrt{K}\)
(3) \(\frac{1}{\sqrt{\mathrm{K}}}\)
(4) \(\frac{1}{K^2}\)
उत्तर:
(1) K²
75. HI के निर्माण के लिए साम्य स्थिरांक (K) का मान 50 है तो K का मान HI के वियोजन के लिए होता है-
(1) 50
(2) 5
(3) 0.2
(4) 0·02.
उत्तर:
(4) 0·02.
76. साम्य 2HI (g) ⇌ H2 (g) + I2 (g) के लिए निम्न में से सही है-
(1) Kp = Kc
(2) Kc = 2Kp
(3) Kp > Kc
(4) Kc = Kp (RT)².
उत्तर:
(1) Kp = Kc
77. 500°C पर उत्क्रमणीय अभिक्रिया N2(g) + 3H2(g) ⇌ 2 NH3(g) के लिए Kp का मान 1.44 x 10-5 है। जब आंशिक दाब वायुमण्डल (Atm) में पाया जाता है। यदि सान्द्रता मोल ली- 1 में है तो सम्बन्धित Kc का मान है-
(1) 1.44 × 10-5/ (0.082 × 500)²
(2) 1.44 x 105 / ( 8.314 × 773)-2
(3) 1.44 × 10-5/ (0.0821 × 773)²
(4) 1.44 x 10-5/ (0.0821 × 773)-2.
उत्तर:
(4) 1.44 x 10-5/ (0.0821 × 773)-2.
78. अभिक्रिया H2 + I2 ⇌ 2HI के लिए
(1) Kc = 2Kp
(2) Kc > Kp
(3) Kc = Kp
(4) Kc < Kp
उत्तर:
(3) Kc = Kp
79. इकाई आयतन में उपस्थित पदार्थ के ग्राम अणुओं की संख्या कहलाती है-
(1) सक्रियता
(2) नॉर्मल विलयन
(3) मोलर विलयन
(4) सक्रिय द्रव्यमान।
उत्तर:
(4) सक्रिय द्रव्यमान।
80. अभिक्रिया C(s) + CO2(g) ⇌ 2CO(g) के लिए साम्यावस्था पर CO2 एवं CO के आंशिक दाब क्रमश: 2.0 तथा 4.0 atm हैं। अभिक्रिया के लिए Kp होगा-
(1) 0.5
(2) 4.0
(3) 8.0
(4) 32.0
उत्तर:
(3) 8.0
अति लघु उत्तरीय प्रश्न
प्रश्न 1.
ताप बढ़ाने पर KNO3 की विलेयता बढ़ जाती है, जबकि Ca(OH)2 की विलेयता घट जाती है, क्यों?
उत्तर:
KNO3 का जल में घुलना ऊष्माशोषी अभिक्रिया है, जबकि Ca(OH)2 को विलेय करने पर ऊष्मा निकलती है। अतः ला शातेलिए के नियमानुसार ताप बढ़ाने पर KNO3 की विलेयता बढ़ती है तथा Ca(OH)2 की घटती है।
प्रश्न 2.
ताप बढ़ाने पर जल में लेड नाइट्रेट की विलेयता बढ़ती है, जबकि कैल्सियम ऐसीटेट की विलेयता घटती है, क्यों?
उत्तर:
लेड नाइट्रेट को जल में घोलने पर ऊष्मा अवशोषित होती है जबकि कैल्सियम ऐसीटेट को घोलने पर उत्सर्जित होती है।
प्रश्न 3.
“रासायनिक साम्य गतिक होता है?” इस कथन की व्याख्या कीजिए।
उत्तर:
उत्क्रमणीय रासायनिक अभिक्रिया में अग्र अभिक्रिया की दर घटती है, वहीं पश्च अभिक्रिया की दर बढ़ती जाती है। रासायनिक साम्यावस्था आने पर अग्र अभिक्रिया की दर पश्च अभिक्रिया की दर के बराबर हो जाती है, अर्थात् अभिक्रिया रुकती नहीं वरन् सतत रूप से दोनों ओर गतिक रहती है।
प्रश्न 4.
Cl2 की उपस्थिति में PCl5 के वियोजन की मात्रा कम हो जाती है, क्यों?
उत्तर:
PCl5 ⇌ PCl3 + Cl2; ला-शातेलिए के नियमानुसार, Cl2 की सान्द्रता बढ़ाने पर पश्च अभिक्रिया अधिक होगी जिससे PCl5 का वियोजन घट जायेगा।
प्रश्न 5.
FeCl3 के विलयन में NH4CNS मिलाने पर गहरा लाल रंग आ जाता है। इसमें NH4Cl विलयन मिलाने पर रंग गायब हो जाता है, क्यों?
उत्तर:
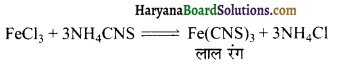
उपरोक्त विलयन में NH4Cl मिलाने पर पश्च अभिक्रिया तेजी से होती है तथा Fe(CNS)3 विघटित हो जाती है जिससे लाल रंग गायब हो जाता है।
प्रश्न 6.
अभिक्रिया, 2HI ⇌ H2 + I2 में दाब m गुना करने पर साम्य स्थिरांक पर क्या प्रभाव होगा?
उत्तर:
साम्य स्थिरांक पर दाब का कोई प्रभाव नहीं होता है।
प्रश्न 7.
नाइट्रिक ऑक्साइड के संश्लेषण में उच्च ताप अमोनिया के संश्लेषण में अपेक्षाकृत कम ताप प्रयुक्त किया जाता है, क्यों ?
उत्तर:
नाइट्रिक ऑक्साइड का संश्लेषण ऊष्माशोषी अभिक्रिया है। वहीं अमोनिया का संश्लेषण ऊष्माक्षेपी अभिक्रिया है।
प्रश्न 8.
सोडा वाटर की बोतल खोलने पर बुलबुले उठते हैं, क्यों?
उत्तर:
सोडा वाटर की बोतल खोलने पर दाब कम होने के कारण गैस की जल में विलेयता घट जाती है तथा गैस के तेजी से बाहर निकलने के कारण बुलबुले उठते हैं।
प्रश्न 9.
किस अभिक्रिया साम्य स्थिरांक के लिए अभिक्रिया पूर्णता की ओर अधिक होगी।
K = 1; K = 1010; K = 10-10
उत्तर:
K = 1010
प्रश्न 10.
Mg एवं Fe दोनों ही Cu2+ आयन को Cu में परिवर्तित कर देते हैं। यदि साम्यावस्थाएँ निम्न हों तो कौन अधिक सीमा तक Cu2+ को Cu में परिवर्तित करेगा।
Mg (g) + Cu2+ ⇌ Mg2+ Cu; Kc = 6 × 1090
Fe(s) + Cu2+ ⇌ Fe2+ + Cu; Kc = 3 x 1026
उत्तर:
Mg क्योंकि Kc अधिक होने पर अभिक्रिया पूर्णता की ओर अधिक होगी।
प्रश्न 11.
उत्क्रमणीय अभिक्रिया A + B ⇌ C + D का साम्य स्थिरांक लिखिए।
उत्तर:
Kc = \(\frac{[\mathrm{C}][\mathrm{D}]}{[\mathrm{A}][\mathrm{B}]}\)
प्रश्न 12.
(a) अभिक्रिया a + bB ⇌ cC + dD के लिए स्थिरांक का व्यंजक लिखिए।
(b) यदि उपरोक्त अभिक्रिया का साम्य स्थिरांक Kc = 5.0 x 10³ है तो अभिक्रिया CC + dD ⇌ C + dD के साम्य स्थिरांक की गणना कीजिए।
उत्तर:

प्रश्न 13.
N2 + 2O2 ⇌ 2NO2, Kc = 100 लीटर मोल हो तो निम्नलिखित अभिक्रियाओं के K1, K2 के मान ज्ञात कीजिए।
(i) 2NO2 ⇌ N2 + 2O2 तथा
(ii) NO2 ⇌ \(\frac {1}{2}\) N2 + O2
उत्तर:
(i) K1 = \(\frac{1}{K_c}=\frac{1}{100}\) = 10-2 मोल लीटर-1 ;
(ii) K1 = \(\sqrt{\frac{1}{K_c}}=\sqrt{\frac{1}{100}}\) = 10-1 मोल\(\frac {1}{2}\) लीटर\(\frac {1}{2}\)
![]()
प्रश्न 14.
विलेयता पर ताप का क्या प्रभाव होगा?
उत्तर:
- यदि पदार्थ को घोलने पर ऊष्मा निकलती है तो ताप बढ़ाने पर उसकी विलेयता घट जाती है।
- यदि पदार्थ को घोलने पर ऊष्मा शोषित होती है तो ताप बढ़ाने पर उसकी विलेयता बढ़ जाएगी।
प्रश्न 15.
अभिक्रिया N2 + O2 ⇌ 2NO के लिए साम्य स्थिरांक का व्यंजक लिखिए।
उत्तर:
Kc = \(\frac{[\mathrm{NO}]^2}{\left[\mathrm{~N}_2\right]\left[\mathrm{O}_2\right]}\) तथा Kc = \(\frac{4 x^2}{(a-x)(b-x)}\)
प्रश्न 16.
अभिक्रिया PCl5 ⇌ PCl3 + Cl2 के लिए Kp व Kc में सम्बन्ध स्थापित कीजिए।
उत्तर:
Kp = Kc x RT; ∵ ∆n = 1
प्रश्न 17.
ला – शातेलिए नियम किस अवस्था में लागू होता है।
उत्तर:
साम्यावस्था में।
प्रश्न 18.
m1A(g) + m2B(g) → n1C(g) + n2D(g) के लिए Kp तथा Kc के मध्य सम्बन्ध का समीकरण लिखिए।
उत्तर:
Kp = Kc\((\mathrm{RT})^{\left(n_1+n_2\right)-\left(m_1+m_2\right)}\)
प्रश्न 19.
निम्न में उत्क्रमणीय एवं अनुत्क्रमणीय अभिक्रियाएँ छाँटिए-
(a) चूना भट्टी में चूने का टूटना
(b) नौसादर का वायुमण्डल में ऊर्ध्वपातन
(c) NH का बन्द पात्र में टूटना
(d) KI में AgNO3 मिलाना।
उत्तर:
उत्क्रमणीय (c) अनुत्क्रमणीय: (a), (b), (d)
प्रश्न 20.
रासायनिक साम्य स्थापित करने में उत्प्रेरक का क्या योगदान है?
उत्तर:
रासायनिक साम्य शीघ्र स्थापित हो जाता है।
प्रश्न 21.
पहाड़ों पर बर्फ धीरे-धीरे पिघलती है, क्यों।
उत्तर:
ला-शातेलिए के नियम के अनुसार पहाड़ों पर दाब कम होता है अतः बर्फ ⇌ जल की साम्यावस्था उस ओर अधिक होती है जिधर आयतन अधिक होता है (जल में बर्फ की ओर) अतः बर्फ कम पिघलती है।
प्रश्न 22.
रासायनिक साम्य क्या है?
उत्तर:
रासायनिक साम्य अभिक्रिया की वह अवस्था जिसमें अग्र और विपरीत दोनों अभिक्रियाओं के वेग बराबर हो जाते हैं, रासायनिक साम्यावस्था कहलाती है।
प्रश्न 23.
सक्रिय द्रव्यमान का अर्थ स्पष्ट कीजिए।
उत्तर:
किसी भी पदार्थ के सक्रिय द्रव्यमान का अभिप्राय उसकी आण्विक सान्द्रता से होता है।

प्रश्न 24.
साम्य स्थिरांक की परिभाषा दीजिए।
उत्तर:
साम्य स्थिरांक-स्थिर ताप पर किसी उत्क्रमणीय अभिक्रिया की अग्र तथा विपरीत अभिक्रियाओं के वेग स्थिरांकों के अनुपात को साम्य स्थिरांक कहते हैं।
Kc = \(\frac{K_f}{K_b}\)
प्रश्न 25.
ऐसी अभिक्रिया का उदाहरण दीजिए जिनमें
(i) दाब बढ़ाने पर अधिक उत्पाद बनता हो
(ii) ताप बढ़ाने पर अधिक उत्पाद बनता हो।
उत्तर:
(i) N2(g) + 3H2 (g) ⇌ 2NH3 (g) + 22,400 कैलोरी
(ii) N2(g) + O2 (g) ⇌ 2NO (g) – 43,200 कैलोरी
प्रश्न 26.
किसी गैसीय साम्य पर क्या होगा जबकि ∆n का मान ऋणात्मक हो और दाब कम कर दिया जाये?
उत्तर:
∆n के ऋणात्मक मान का अर्थ क्रियाकारकों के कुल अणुओं की संख्या क्रियाफलों के कुल अणुओं की संख्या से अधिक है। अर्थात् गैसीय अभिक्रिया में दाब कम करने पर अभिक्रिया प्रतीप दिशा में विस्थापित होगी।
प्रश्न 27.
सामान्य अभिक्रिया aA + bB → lL + mM हेतु ∆n = (1+ m) – (a + b) का कितना मान हो कि साम्य पर दाब का कोई प्रभाव नहीं पड़े?
उत्तर:
∆n = 0 होने पर दाब परिवर्तन से साम्य पर कोई प्रभाव नहीं पड़ता है।
प्रश्न 28.
Kp व Kc में सम्बन्ध बताइए।
उत्तर:
Kp = Kc (RT)∆n
प्रश्न 29.
हैबर विधि में अमोनिया की अधिकतम लब्धि हेतु किन शर्तों का होना आवश्यक है?
उत्तर:
हैबर विधि द्वारा अमोनिया की अधिकतम लब्धि के लिए अनुकूल परिस्थितियाँ हैं-
- अधिकारकों (N2 तथा H2) की उच्च सान्द्रता
- उच्च दाब तथा कम ताप।
प्रश्न 30.
Kp तथा Kc के मात्रक बताइए।
उत्तर:
Kp का मात्रक bar है।
Kc का मात्रक mol/L है।
जब Kp = Kc(RT)∆n में ∆n = 0 होता है, तब ये विमा रहित हो जाते हैं।
प्रश्न 31.
सक्रिय द्रव्यमान को कैसे प्रकट करते हैं?
उत्तर:
इसे व्यक्त करने के लिए प्रतीक अथवा सूत्र को बड़े कोष्ठक [ ] में लिखा जाता है।
प्रश्न 32.
∆n के पृथक् मान रखकर Kp तथा Kc के मध्य सम्बन्ध स्थापित कीजिए।
उत्तर:
यदि ∆n=0 हो तो, Kp = kc
∆n = + 1 हो, तो Kp > Kc
∆n = – 1 हो, तो Kp > Kc
प्रश्न 33.
द्रव्य अनुपाती क्रिया के नियम का प्रयोग H2 तथा I2 पर ही क्यों किया गया?
उत्तर:
क्योंकि कमरे के ताप पर H2 तथा I2 क्रिया नहीं करते हैं, परन्तु उच्च ताप पर ये पूर्ण क्रिया करते हैं।
प्रश्न 34.
अभिक्रिया वेग की इकाई क्या है?
उत्तर:
मोल लीटर-1 सेकेण्ड-1 होती है।
प्रश्न 35.
Kc से क्या ज्ञात होता है?
उत्तर:
Kc को स्थिर सान्द्रता पर साम्य स्थिरांक कहते हैं।
प्रश्न 36.
∆n ऋणात्मक मान की एक अभिक्रिया लिखिए।
उत्तर:
N2 + 3H2 → 2NH3 (∆n = – 2 )
प्रश्न 37.
अभिक्रिया PCI5 → PCI3 + Cl2 में यदि वियोजन की मात्रा x है तो Kp का मान क्या होगा?
उत्तर:
Kp = \(\frac{x^2 P}{\left(1-x^2\right)}\)
प्रश्न 38.
अभिक्रिया 2SO2 + O2 → 2SO3 + 45,2000 cal. में अधिकतम SO3 प्राप्त करने के लिए आवश्यक परिस्थितियां कौन-सी हैं?
उत्तर:
- उच्च दाब
- निम्न ताप
- SO2 तथा O2 का अधिक सान्द्रण।
प्रश्न 39.
विद्युत अपघय से आप क्या समझते हो?
उत्तर:
वह पदार्थ जो जल में घोलने पर दो आवेशित भाग में टूट जाता है, विद्युत अपघट्य कहलाता है।
उदाहरणार्थ – NaCl, NH4Cl, CuSO4 आदि।
प्रश्न 40.
आयनन की मात्रा से आप क्या समझते हो?
उत्तर:
किसी विद्युत अपघट्य का वह अंश जो आयनीकृत होता है, उसे आयनन की मात्रा कहते हैं।
प्रश्न 41.
वह कौन-सा कारक है जिसका आयनन पर प्रभाव नहीं पड़ता है।
उत्तर:
दाब।
प्रश्न 42.
एक प्रबल अम्ल व प्रबल क्षार की उदासीनीकरण ऊष्मा कितनी होती है?
उत्तर:
13.7 कैलोरी।
प्रश्न 43.
अम्लों की सामर्थ्य किस पर निर्भर करती है ?
उत्तर:
अम्लों की सामर्थ्य उसके आयनन की मात्रा तथा जल में OH– आयनों के सान्द्रण पर निर्भर करती है।
प्रश्न 44.
क्षारों की सामर्थ्य किस पर निर्भर करती है?
उत्तर:
क्षारों की सामर्थ्य उसके आयनन की मात्रा तथा जल में OH– आयनों के सान्द्रण निर्भर करती है।
प्रश्न 45.
जल के आयनिक गुणनफल से आप क्या समझते हो? इसे किसके द्वारा व्यक्त करते हैं?
उत्तर:
स्थिर ताप पर जल में उपस्थित H+ तथा OH– आयनों के सान्द्रण के गुणनफल को जल का आयनिक गुणनफल कहते हैं। इसे Kw से प्रदर्शित करते हैं।
Kw = [H+][OH–]
प्रश्न 46.
K का मान कितना है?
उत्तर:
1 × 10-14 ग्राम आयन / लीटर
![]()
प्रश्न 47.
प्रबल अम्ल और दुर्बल क्षार के जल-अपघटनांक स्थिरांक का सूत्र दीजिए।
उत्तर:
Kw = \(\frac{\mathbf{K}_w}{\mathbf{K}_b}\)
प्रश्न 48.
दुर्बल अम्ल और प्रबल क्षार के जल अपघटनांक स्थिरांक का सूत्र दीजिए।
उत्तर:
Kh = \(\frac{\mathbf{K}_w}{\mathbf{K}_a}\)
प्रश्न 49.
दुर्बल अम्ल और दुर्बल क्षार के जल अपघटनांक स्थिरांक का सूत्र दीजिए।
उत्तर:
Kh = \(Kw = [latex]\frac{\mathbf{K}_w}{\mathbf{K}_b}\)
प्रश्न 50.
सम आयन प्रभाव क्या है?
उत्तर:
जब दो विद्युत अपघट्यों के विलयन में एक आयन समान होता है, तो कम आयनित विद्युत अपघट्य का आयनन कम हो जाता है। यही सम आयन प्रभाव कहलाता है।
प्रश्न 51.
जल का H+ आयन सान्दण कितना है?
उत्तर:
10-7 ग्राम आयन प्रति लीटर।
प्रश्न 52.
तनु जलीय विलयन में जल की मोलर सान्द्रता कितनी होती है?
उत्तर:
55.38 मोल प्रति लीटर।
प्रश्न 53.
जल का आयनन स्थिरांक कितना है?
उत्तर:
1.8 x 10-16
प्रश्न 54.
आरेनियस के आयनन सिद्धान्त के अनुसार अम्ल क्षार क्या है ?
उत्तर:
वे पदार्थ जो जल में H+ आयन देते हैं उन्हें अम्ल तथा जो पदार्थ जलीय विलयन में OH– आयन देते हैं, उन्हें क्षार कहते हैं।
प्रश्न 55.
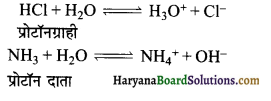
जल किस प्रकार का व्यवहार करता है?
उत्तर:
यह अम्ल तथा क्षारक दोनों प्रकार का व्यवहार करता है-
प्रश्न 56.
संयुग्मी अम्ल क्षार समीकरण दीजिए।
उत्तर:
अम्ल1 + क्षार2 → अम्ल2 + क्षार1
प्रश्न 57.
लुईस अम्ल कितने प्रकार होते हैं?
उत्तर:
- उदासीन
- विद्युत धनात्मक
प्रश्न 58.
लुईस क्षार कितने प्रकार के होते हैं?
उत्तर:
- उदासीन
- विद्युत ऋणात्मक।
प्रश्न 59.
ऐसे धनायन का नाम बताइये जो जलीय विलयन में अम्लीय हो?
उत्तर:
H3O+ आयन।
प्रश्न 60.
किसी विलयन में H+ आयनों की सान्द्रता का ऋणात्मक लॉग (log) क्या कहलाता है ?
उत्तर:
pH मान।
प्रश्न 61.
जल का pH मान कितना है?
उत्तर:
7
प्रश्न 62.
बफर विलयन क्या है?
उत्तर:
इन विलयनों के pH मान स्थिर होते हैं।
प्रश्न 63.
यदि जल में अम्ल मिलाया जाय तो आयनन गुणनफल पर क्या प्रभाव पड़ेगा?
उत्तर:
आयनन गुणनफल अपरिवर्तित रहेगा।
प्रश्न 64.
यदि स्थिर ताप पर हीलियम मिलायी जाये तो PCI5 के वियोजन पर क्या प्रभाव पड़ेगा?
उत्तर:
कोई प्रभाव नहीं होगा।
प्रश्न 65.
किसी लवण का Ksp मान अधिक है। यह क्या दर्शाता है?
उत्तर:
लवण अधिक घुलनशील है।
प्रश्न 66.
संयुग्मी अम्ल और संयुग्मी क्षार में क्या अन्तर है?
उत्तर:
संयुग्मी अम्ल और संयुग्मी क्षार एक प्रोटॉन के कारण भिन्न हैं।
प्रश्न 67.
BaCl2 के सान्द्र विलयन में HCl प्रवाहित करने पर सफेद अवक्षेप आता है।
उत्तर:
HCl की उपस्थिति में [CH–] का मान अधिक हो जाता है तथा विलयन में [Ba2+] [Cl–]² का मान BaCl2 के Ksp से अधिक हो जाने के कारण BaCl का अवक्षेपण होने लगता है।
[Ba2+] [Cl–]² (Ksp साम्य पर)
प्रश्न 68.
फैरिक क्लोराइड का जलीय विलयन रखने पर भूरे रंग का अवक्षेप प्राप्त होता है।
उत्तर:
Fe3+ + 3H2O → Fe (OH)3 + 3H+
फैरिक आयन के जल अपघटन विलयन में भूरे का Fe(OH)3 का अवक्षेप बन जाता है।
प्रश्न 69.
BaCl के विलयन से Ba2+ का भारात्मक विश्लेषण करते समय विलयन में H2SO4 की थोड़ी अधिक मात्रा मिलायी जाती है, क्यों?
उत्तर:
Ba2+ आयनों का पूर्ण अवक्षेपण करने के लिए H2SO4 कुछ अधिक मात्रा में मिलाया जाता है।
BaCl2 + H2SO4 → BaSO4 + 2HCl
प्रश्न 70.
Ca3(PO4)2 लवण HCI की उपस्थिति में जल में घुल जाता है।
उत्तर:
HCl, H3PO4 से प्रबल अम्ल होने के कारण Ca3(PO4)2 को अपघटित कर देता है।
Ca3(PO4)2 + 6HCl → 3CaCl2, 2H3PO4
प्रश्न 71.
बहु-प्रोटॉनीय अम्ल (Poly Protonic acid) किन्हें कहते हैं?
उत्तर:
वे अम्ल जो एक से अधिक प्रोटॉन देते हैं; बहु-प्रोटॉनीय अम्ल कहलाते हैं, जैसे- H2SO4, H3PO4, H2PO3 आदि।
प्रश्न 72.
बोरॉन के हैलाइडों को बढ़ती हुई अम्लीय प्रकृति के क्रम में कारण सहित व्यवस्थित कीजिए।
उत्तर:
BF3 < BCl3 < BBr3 < Bl3 ऐसा पश्च आबन्धन (back bonding) के कारण होता है।
प्रश्न 73.
अम्लीय बफर विलयन का उदाहरण दीजिए।
उत्तर:
CH3COOH + CH3COONa
प्रश्न 74.
NaCl, CuSO4 एवं KNO3 लवणों में से किस लवण का जल अपघटन होगा?
उत्तर:
CuSO4 का, NaCl व KNO3 प्रबल अम्ल प्रबल क्षार के लवण हैं।
प्रश्न 75.
pH पैमाने पर ताप बढ़ाने से क्या प्रभाव पड़ता है।
उत्तर:
pH पैमाना ताप बढ़ाने पर 0 से 14 की जगह 0 से 14 से कम हो जाता है।
प्रश्न 76.
धातु के दो ऑक्साइड लिखिए जो अम्लीय होते हैं।
उत्तर:
Mn2O7; CrO3
प्रश्न 77.
अधातुओं से प्राप्त उदासीन एवं उभयधर्मी ऑक्साइड कौन-कौन से हैं?
उत्तर:
उदासीन ऑक्साइड CO, N2O, NO: उभयधर्मी ऑक्साइड : H2O
प्रश्न 78.
Ag के हैलाइडों में जल में घुलनशील हैलाइड कौन-सा है?
उत्तर:
AgF
प्रश्न 79.
संयुग्मी अम्ल-क्षार के वियोजन स्थिरांकों में क्या सम्बन्ध होता है?
उत्तर:
Ka x Kb = Kw
प्रश्न 80.
BF3, NF3, AlCl3 तथा SnCl4 में कौन लुईस क्षार है?
उत्तर:
NF3
प्रश्न 81.
CH3COO–, NH4+, BF3 एवं SO3 में अम्ल एवं क्षार बताइए-
उत्तर:
अम्ल NH4+, BF3, SO3 क्षार CH3COO–
प्रश्न 82.
Ca के हैलाइडों में जल में अविलेय हैलाइड कौन-सा है?
उत्तर:
CaF2
प्रश्न 83.
क्या फिनॉल्फ्थलीन NH4OH के विलयन में गुलाबी रंग देगा?
उत्तर:
हाँ।
प्रश्न 84.
निम्नलिखित दशाओं में विलयन की प्रकृति बताइए।
(a) pH > 7
(b) pH < 7
(c) pH = 7
उत्तर:
(a) क्षारीय
(b) अम्लीय
(c) उदासीन।
प्रश्न 85.
हैलोजन अम्लों में कौन-सा अम्ल दो प्रकार के लवण बनाता है?
उत्तर:
हैलोजन अम्लों में HF दो प्रकार के लवण बनाता है। क्योंकि इसकी प्रकृति H2F2 बनाने की होती है। ऐसा हाइड्रोजन आबन्ध बनने के कारण होता है। यह दो लवण KHF2 तथा KF बनाता है।
प्रश्न 86.
विद्युत अपघटनी सुचालकों की चालकता पर ताप का क्या प्रभाव होता है?
उत्तर:
बढ़ जाती है।
प्रश्न 87.
किसी लवण का जलीय विलयन अम्लीय है अथवा क्षारीय, कैसे ज्ञात करोगे।
उत्तर:
लिटमस परीक्षण द्वारा लिटमस पेपर के नीला होने पर क्षारीय तथा लाल होने पर अम्लीय।
प्रश्न 88.
जल के आयनिक गुणनफल का मान क्या होता है?
उत्तर:
25°C पर Kw = 10-14
प्रश्न 89.
यदि किसी विलयन की pH 5-5 हो तो POH कितनी होगी ?
उत्तर:
POH = 8.5
प्रश्न 90.
साम्य से क्या तात्पर्य है?
उत्तर:
साम्य वह स्थिति है जिस पर अग्रगामी अभिक्रिया की दर पश्चगामी अभिक्रिया की दर के बराबर हो जाती है।
प्रश्न 91.
भौतिक साम्य क्या है? उदाहरण लिखिए।
उत्तर:
समान पदार्थ की दो विभिन्न भौतिक अवस्थाओं के मध्य स्थापित साम्यावस्था भौतिक साम्य कहलाती है।
उदाहरणार्थं -H2O(s) ⇌ H2O(l)
प्रश्न 92.
क्या साम्य एक खुले पात्र में प्राप्त हो सकता है, जबकि उत्पाद इससे निष्कासित सकते हों?
उत्तर:
नहीं; क्योंकि यदि उत्पाद पात्र से निष्कासित हो जाएँगे तो यह उत्क्रमणीय प्रक्रम नहीं होगा। अतः साम्यावस्था प्राप्त नहीं होगी।
प्रश्न 93.
अभिक्रिया
N2(g) + 3H2(g) ⇌ 2NH3(g)
के लिए Kc का व्यंजक लिखिए Kc की इकाई दीजिए।
उत्तर:
Kc = \(\frac{\left[\mathrm{NH}_3\right]^2}{\left[\mathrm{~N}_2\right]\left[\mathrm{H}_2\right]^3}\)
= \(\frac{\left(\mathrm{mol} \mathrm{L}^{-1}\right)^2}{\left(\mathrm{~mol} \mathrm{~L}^{-1}\right)\left(\mathrm{mol} \mathrm{L}^{-1}\right)^3}\)
= L² mol-2
प्रश्न 94.
उन कारकों के नाम बताइए जो किसी उत्क्रमणीय अभिक्रिया की साम्यावस्था को प्रभावित कर सकते हैं।
उत्तर:
- ताप
- दाब
- सान्द्रता
- उत्प्रेरक।
प्रश्न 95.
किस ताप पर ठोस तथा द्रव 1 atm दाब के अन्तर्गत साम्य में होंगे ?
उत्तर:
गलनांक अथवा हिमांक पर।
प्रश्न 96.
निम्नलिखित अभिक्रियाओं में दाब वृद्धि का क्या प्रभाव होगा?
(1) PCl5(g) ⇌ PCl3(g) + Cl2(g)
(2) N2 (g) + O2(g) ⇌ 2NO (g)
उत्तर:
(1) साम्य पश्चगामी अभिक्रिया में विस्थापित हो जाएगा।
(2) कोई प्रभाव नहीं पड़ेगा।
![]()
प्रश्न 97.
अभिक्रिया N2O4(g) ⇌ 2NO2(g) के लिए Kp का व्यंजक लिखिए।
उत्तर:
Kp = \(\frac{\left(\mathrm{P}_{\mathrm{NO}_2}\right)^2}{\left(\mathrm{P}_{\mathrm{N}_2 \mathrm{O}_4}\right)}\)
प्रश्न 98.
बन्द पात्र में होने वाली कौन-सी रासायनिक अभिक्रियाएँ साम्यावस्था प्राप्त करती हैं?
उत्तर:
बन्द पात्र में होने वाली उत्क्रमणीय रासायनिक अभिक्रियाएँ साम्यावस्था प्राप्त करती हैं।
प्रश्न 99.
H2(g) + I2(g) ⇌ 2HI (g), K = 49
अभिक्रिया HI (g) ⇌ \(\frac {1}{2}\) H2(g) + \(\frac {1}{2}\)I2(g) के लिए Kc का मान क्या है?
उत्तर:
K = \(\frac{[\mathrm{HI}]^2}{\left[\mathrm{H}_2\right]\left[\mathrm{I}_2\right]}\) = 49
K = \(\frac{\left[\mathrm{H}_2\right]^{1 / 2}\left[\mathrm{I}_2\right]^{1 / 2}}{[\mathrm{HI}]}=\frac{1}{\sqrt{K}}=\frac{1}{\sqrt{49}}=\frac{1}{7}\)
प्रश्न 100.
N2 + 3H2 ⇌ 2NH3 + ऊष्मा इस अभिक्रिया के लिए K का मान ताप बढ़ने पर किस प्रकार प्रभावित होगा?
उत्तर:
ताप बढ़ाने पर K का मान घट जाएगा।
प्रश्न 101.
गर्म शीतल पेय तथा ठण्डी शीतल पेय की बोतलों में से किसमें CO2 की अधिक मात्रा होगी और क्यों?
उत्तर:
ठण्डी बोतल में CO2 अधिक मात्रा में होगी, चूँकि द्रवों में गैसों की विलेयता ताप में कमी आने पर बढ़ जाती है।
प्रश्न 102.
एक उत्प्रेरक साम्यावस्था स्थिरांक को किस प्रकार प्रभावित करता है?
उत्तर:
साम्यावस्था स्थिरांक उत्प्रेरक द्वारा प्रभावित नहीं होता है।
प्रश्न 103.
आयनिक साम्यावस्था को परिभाषित कीजिए।
उत्तर:
किसी दुर्बल विद्युत अपघट्य के वियोजन के दौरान आयनों तथा अनायनित अणुओं के मध्य स्थापित साम्य, आयनिक साम्यावस्था कहलाता है।
प्रश्न 104.
वियोजन की मात्रा पर ताप वृद्धि का क्या प्रभाव होता है?
उत्तर:
वियोजन की मात्रा ताप वृद्धि पर बढ़ जाती है।
प्रश्न 105.
जलीय विलयन में HCN के आयनन के लिए, Ka का व्यंजक लिखिए।
उत्तर:
HCN + H2O ⇌ H3O+ + CN–
Ka = \(\frac{\left[\mathrm{H}_3 \mathrm{O}^{+}\right]\left[\mathrm{CN}^{-}\right]}{[\mathrm{HCN}]}\)
प्रश्न 106.
जल के आयनिक गुणनफल (Kw) से क्या तात्पर्य है?
उत्तर:
यह विशिष्ट ताप पर [H3O+] तथा [OH–] की सान्द्रता का गुणनफल स्थिरांक होता है।
K = [H3O+] [OH–]
= 1.0 × 10-14
प्रश्न 107.
विलेयता गुणनफल (Ksp) पर ताप का क्या प्रभाव होता है?
उत्तर:
Ksp ताप बढ़ाने पर बढ़ता है, चूंकि विलेयता बढ़ जाती है।
प्रश्न 108.
क्या pH = 2 पर Fe(OH)3 का अवक्षेप प्राप्त करना सम्भव है?
उत्तर:
नहीं क्योंकि FO(OH)3 प्रबल अम्लीय माध्यम में विलेय होगा।
प्रश्न 109.
किन परिस्थितियों के अन्तर्गत एक पदार्थ अपने विलयन से अवक्षेपित हो जाएगा?
उत्तर:
जब आयनिक गुणनफल, विलेयता गुणनफल से अधिक हो जाता है, तब अवक्षेप प्राप्त होता है।
प्रश्न 110.
सम-आयन प्रभाव किस प्रकार विद्युत अपघट्य की विलेयता को प्रभावित करता है?
उत्तर:
सम-आयनं प्रभाव के कारण विद्युत अपघट्यों की विलेयता घट जाती है।
प्रश्न 111.
क्षारीय बफर क्या है?
उत्तर:
क्षारीय बफर वह बफर है जिसका pH 7 से अधिक होता है। यह दुर्बल क्षारक तथा प्रबल अम्ल के साथ इसके लवण का मिश्रण होता है; जैसे-NH4 Cl + NH4 OH
प्रश्न 112.
अम्लों A, B, C, D के pKa मान 1.5, 3.5, 2.0 तथा 5.0 हैं। इनमें से कौन-सा प्रबलतम अम्ल है?
उत्तर:
pKa = 1.5 वाला अम्ल ‘A’ प्रबलतम अम्ल है; क्योंकि pKa का मान न्यूनतम होने पर अम्ल प्रबलतम होता है।
प्रश्न 113.
SO32- ब्रॉन्स्टेड क्षारक है अथवा अम्ल और क्यों?
उत्तर:
SO32- ब्रॉन्स्टेड क्षारक है, चूँकि प्रोटॉन (H+) ग्रहण करता है।
प्रश्न 114.
निम्नलिखित में से कौन-सा प्रबलतम अम्ल है-
CCl4, AlCl3, NCl3, OCl2
उत्तर:
AlCl3 प्रबलतम लूईस अम्ल है क्योंकि इसका अष्टक पूर्ण नहीं है।
प्रश्न 115.
बफर विलयन के दो अनुप्रयोग बताइए।
उत्तर:
- बफर विलयनों का प्रयोग दवाइयों में किया जाता है।
- बफर विलयन, रक्त के pH को नियन्त्रित करते हैं।
प्रश्न 116.
निम्नलिखित में से कौन-सा लूईस अम्ल है। परन्तु ब्रॉन्स्टेड अम्ल नहीं है-
HBrO3, SbCl3, HSO4–, AlF3
उत्तर:
SbCl3 तथा AlF3 लूईस अम्ल हैं परन्तु ब्रॉन्स्टेड अम्ल नहीं है।
प्रश्न 117.
निम्नलिखित में से कौन-सा प्रबलतम अम्ल है-
HCl, HClO3, HNO3, H2SO4, HClO4
उत्तर:
HClO4 प्रबलतम अम्ल है।
प्रश्न 118.
निम्नलिखित में से कौन-सा दुर्बलतम अम्ल है।
HClO4, HClO3, HClO2, HClO
उत्तर:
HClO दुर्बलतम अम्ल है।
प्रश्न 119.
निम्नलिखित में से कौन-सा प्रबलतम संयुग्मी क्षारक
CH3–, NH2–, OH–, F–
उत्तर:
CH3– प्रबलतम संयुग्मी क्षारक है।
प्रश्न 120.
HCN तथा NH+ के संयुग्मी क्षारक बताइए।
उत्तर:
HCN का संयुग्मी क्षारक CN– है तथा NH4+ का संयुग्मी क्षारक NH3 है।
प्रश्न 121.
ताप बढ़ाने पर जल के आयनिक गुणनफल पर क्या प्रभाव होगा?
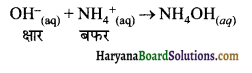
उत्तर:
ताप बढ़ाने इसमें वृद्धि होगी; क्योंकि जल का वियोजन एक ऊष्माशोषी प्रक्रम है।
प्रश्न 122.
द्रवों में गैसों की विलेयता पर दाब में वृद्धि का प्रभाव बताइए।
उत्तर:
द्रवों में गैसों की विलेयता दाव में वृद्धि होने पर बढ़ती है।
प्रश्न 123.
NH4OH के लिए Kb का मान 1.8 x 10-5 तथा CH3 NH2 के लिए 4.4 x 10-6 इनमें से कौन सा प्रबलतम क्षारक है और क्यों?
उत्तर:
CH3 NH2 प्रबलतम क्षारक होगा चूँकि इसके क्षारक वियोजन स्थिरांक का मान अधिक है।
प्रश्न 124.
निम्नलिखित दशाओं में विलयन की प्रकृति बताइए-
(i) pH < 7
(ii) pH > 7
उत्तर:
(i) अम्लीय
(ii) क्षारीय
प्रश्न 125.
बफर विलयन से क्या समझते हैं? निम्न में कौन-सा बफर विलयन है?
(1) KOH + HC
(2) HNO3 + KNO3
(3) CH3 COOH + CH3COONa
(4) HCI + NaCl.
उत्तर:
बफर विलयन (Buffer solution)-वे विलयन जिनकी अम्लीयता या क्षारीयता आरक्षित होती है, बफर विलयन कहलाते हैं।
CH3 COOH CH3 COO Na विलयन का मिश्रण बफर विलयन है।
प्रश्न 126.
जल के आयनिक गुणनफल की परिभाषा लिखिए। साधारण ताप पर जल के आयनिक गुणनफल मान लिखिए
उत्तर:
जल में विद्यमान H+ व OH– आयनों के सान्द्रण के गुणनफल को जल का आयनिक गुणनफल कहते हैं साधारण ताप पर इसका मान 1 x 10-14 होता है।
Kw = [H+] x [OH–]
प्रश्न 127.
किसी विलयन में विद्यमान हाइड्रोजन आयनों की सान्द्रता तथा उसके pH में क्या सम्बन्ध होता है? सूत्र द्वारा व्यक्त कीजिए।
उत्तर:
किसी विलयन के H+ आयन सान्द्रण व उसके pH मान में सम्बन्ध को निम्नलिखित सूत्र द्वारा व्यक्त किया जाता है-pH log10 [H+]
प्रश्न 128.
एक समीकरण दीजिए जो प्रदर्शित करता हो कि NH3 एक आरहीनियस क्षारक है?
उत्तर:
NH3 + H2O → NH4+ + OH–
उपर्युक्त समीकरण प्रदर्शित करता है कि NH3 एक आहनियस क्षारक है, चूंकि यह जलीय विलयन में OH– देता है।
प्रश्न 129.
H2O का संयुग्मी अम्ल तथा संयुग्मी क्षारक लिखिए।
उत्तर:
संयुग्मी अम्ल : H3O+ तथा
संयुग्मी क्षारक : OH+
प्रश्न 130.
प्रबल विद्युत अपघट्य के चार उदाहरण लिखिए?
उत्तर:
- NaCl
- H2SO4
- K2SO4
- Ba(OH)2
प्रश्न 131.
विशुद्ध विद्युत अपघय के दो उदाहरण दो-
उत्तर:
- NaCl
- KNO3
प्रश्न 132.
विभव विद्युत अपघट्य के दो उदाहरण लिखिए?
उत्तर:
- CH3 COOH
- HCN
प्रश्न 133.
चार क्षारों के pKb निम्न हैं।
| क्षार = | AOH | BOH | COH | DOH |
| PKb = | 4.0 | 4.5 | 5.0 | 5.5 |
अब pKb की सहायता से निम्न प्रश्नों के उत्तर दो-
(1) प्रबलतम क्षार है-
उत्तर:
AOH
(2) दुर्बलतम क्षार है-
उत्तर:
DOH
(3) इन क्षारों को बढ़ती सामर्थ्य के क्रम में व्यवस्थित कीजिए-
उत्तर:
DOH < COH < BOH < AOH
(4) कौन सा क्षार प्रबलतम संयुग्मी अम्ल देगा-
उत्तर:
DOH
(5) कौन सा क्षार दुर्बलतम संयुग्मी अम्ल देगा-
उत्तर:
AOH
प्रश्न 134.
निम्न यौगिकों में से कौन से यौगिक अप्रोटिक हैं-
H2O, BF3, CHCl3, HSO4–, NH4+, C6H6
उत्तर:
BF3, CHCl3, C6H6 अप्रोटिक यौगिक हैं क्योंकि इनमें प्रोटॉन नहीं हैं।
प्रश्न 135.
निम्न में से कौन से सदस्य उभय प्रोटिक हैं?
NH4+, H2O, H3O+, HSO4–, BF3,
उत्तर:
H2O, HSO4– उभय प्रोटिक है क्योंकि ये प्रोटॉन दे भी सकते हैं और प्रोटॉन ले भी सकते हैं।
प्रश्न 136.
H2O के आयनन स्थिरांक का मान क्या होगा?
उत्तर:
H2O ⇌ H+ + OH–
K = \(\frac{\left[\mathrm{H}^{+}\right]\left[\mathrm{OH}^{-}\right]}{\left[\mathrm{H}_2 \mathrm{O}\right]}=\frac{\mathrm{K}_w}{\left[\mathrm{H}_2 \mathrm{O}\right]}=\frac{1 \times 10^{-14}}{55 \cdot 4}\)
= 1.8 x 10-16
प्रश्न 137.
एक लीटर जल में हाइड्रोनियम आयनों की संख्या क्या होगी?
उत्तर:
एक लीटर जल में हाइड्रोनियम आयनों
की संख्या [H3O+] x NA (आवोगाद्रो संख्या)
= 1 × 10-7 x 6.02 x 1023
= 6.02 × 1016 आयन
प्रश्न 138.
एक विद्यार्थी शुद्ध जल में [OH–] = 5 × 10-7 ग्राम आयन / ली० ज्ञात करता है तो जल के आयनिक गुणनफल का मान क्या होगा?
उत्तर:
हम जानते हैं कि,
शुद्ध जल में [OH–] = [H+]
Kw = [OH–] = [H+] = [OH–]
= (5 x 10-7)²
Kw = 25 x 10-14 ग्राम मोल /ली०²
प्रश्न 139.
ऐसीटिक अम्ल जो कि एक दुर्बल विद्युत अपघट्य है, को 50 ग्राम मात्रा के जल के निम्न आयतनों में घोला-
(1) 1 ली०
(2) 10 ली०
(3) 100 ली०
(4) 1000 ली०
अब बताओ-
(1) कौन से विलयन की आयनन की मात्रा अधिकतम है?
उत्तर:
1000 ली० वाले विलयन की।
![]()
(2) कौन से विलयन में आयनन की मात्रा निम्नतम है?
उत्तर:
1 ली० वाले विलयन की।
(3) ऊपर दिये गये अम्लों को आयनन की मात्रा के आधार पर व्यवस्थित करें।
उत्तर:
(1 ली० < 10 ली० < 100 ली० < 1000 ली.) वाले विलयन।
प्रश्न 140.
सामान्य रक्त की pH कितनी होती है?
उत्तर:
सामान्य रक्त की pH 7.4 होती है।
प्रश्न 141.
समुद्री जल की pH कितनी होती है?
उत्तर:
समुद्री जल की pH 8.2 होती है।
प्रश्न 142.
CH3 COO– तथा OH– आयनों में से दुर्बल क्षार कौन सा है?
उत्तर:
OH– की तुलना में CH3COO– दुर्बल क्षार है।
प्रश्न 143.
यदि विलयन में HCl उपस्थित है तो H2S के आयनन पर क्या प्रभाव पड़ेगा?
उत्तर:
HCl की उपस्थिति में H2S का आयनन कम हो जायेगा।
प्रश्न 144.
साम्यावस्था पर ∆G का मान क्या होता है।
उत्तर:
साम्यावस्था पर ∆G का मान शून्य होता है।
प्रश्न 145.
यदि किसी अभिक्रिया के लिये Qc = K है तो यह क्या प्रदर्शित करता है।
उत्तर:
Qc = K प्रदर्शित करता है कि अभिक्रिया साम्यावस्था में है।
प्रश्न 146.
किसी संतृप्त विलयन का ताप बढ़ाने पर क्या होगा?
उत्तर:
किसी संतृप्त विलयन का ताप बढ़ाने पर यह असंतृप्त हो जायेगा।
प्रश्न 147.
किसी एक ऐसी अभिक्रिया का उदाहरण दो जिसका ताप बढ़ाने पर उत्पाद की मात्रा बढ़ती है।
उत्तर:
सभी ऊष्माशोषी अभिक्रियाओं का ताप बढ़ाने पर उत्पाद की मात्रा बढ़ जाती है।
उदाहरण-N2 + O2 ⇌ 2NO – ऊर्जा
प्रश्न 148.
किसी एक ऐसी अभिक्रिया का उदाहरण दो जिसका दाब बढ़ाने पर उत्पाद की मात्रा बढ़ जाती हो।
उत्तर:
N2 + 3H2 ⇌ 2NH3
उपरोक्त अभिक्रिया का दाब बढ़ाने पर उत्पाद की मात्रा बढ़ जाती है।
प्रश्न 149.
NH4Cl(s) ⇌ NH3 (g) + HCl(g) के लिये साम्य स्थिरांक व्यंजक लिखो,
उत्तर:
Kc = \(\frac{\left[\mathrm{NH}_3\right][\mathrm{HCl}]}{\left[\mathrm{NH}_4 \mathrm{Cl}\right]}\)
परन्तु [NH4Cl] = 1
Kc = [NH3] [HCl]
प्रश्न 150.
जल में HCI का आयनन निम्न अभिक्रियाओं के द्वारा होता है-
HCl(aq) + H2O(l) ⇌ H3O+(aq) + Cl–(aq)
इस आयनन में दो संयुग्मी अम्ल-क्षार युग्म को पहचाने।
उत्तर:
- HCl (अम्ल), Cl– (संयुग्मी क्षार)
- H2O (क्षार) H3O+ (संयुग्मी अम्ल)
प्रश्न 151.
चीनी के जलीय विलयन में से विद्युत का प्रवाह नहीं होता है। वरन् यदि इसमें NaCl को मिला दें तो यह विद्युत प्रवाह करता है। इस कथन को आप आयनन के रूप में किस प्रकार व्याख्यायित करेंगे।
उत्तर:
(i) चीनी एक अनअपघट्य है अतः इसका आयनन नहीं होता है जबकि NaCl पूर्ण रूप से जल में आयनित हो जाता है और Na+ तथा Cl– आयन प्रदान करता है जिसकी सहायता से विद्युत धारा प्रवाहित होती है।
(ii) NaCl की सान्द्रता को यदि बढ़ा दिया जाये तो अधिक मात्रा में Na+ तथा Cl– आयनों का निर्माण होगा और विद्युत का प्रवाह बढ़ जायेगा।
प्रश्न 152.
BF3 प्रोटॉन नहीं रखती है तब भी यह अम्ल की तरह व्यवहार कर NH3 से अभिक्रिया करती है। ऐसा क्यों? इन दोनों के मध्य किस प्रकार का बन्ध बनता है।
उत्तर:
BF3 एक इलेक्ट्रॉन न्यून यौगिक है अतः यह लूईस अम्ल की तरह व्यवहार करता है। NH3 के पास एक एकाकी इलेक्ट्रॉन युग्म होता है जिसे यह BF को दान करके उपसहसंयोजक बन्ध का निर्माण करता है।
(H3N → BF3)
प्रश्न 153.
दुर्बल क्षार MOH के आयनन स्थिरांक को निम्न व्यंजक के द्वारा व्यक्त करते हैं।
Kb = \(\frac{\left[\mathrm{M}^{+}\right]\left[\mathrm{OH}^{-}\right]}{[\mathrm{MOH}]}\)
कुछ दुर्बल क्षारों के, आयनन स्थिरांक के मानों को निम्न सारणी में दिया गया है।
क्षार – डाइमेथिल अमीन यूरिया पिरीडीन अमोनिया
Kb-5.4 x 104- 1.3 x 10-14 1.77 × 10-9 1.77 × 105
साम्यावस्था पर इनके क्षारों को वियोजन की घटती मात्रा के क्रम में व्यवस्थित करें। इनमें से कौन-सा क्षार प्रबलतम है।
उत्तर:
Kb का मान जितना अधिक होगा उस क्षार का आयनन भी उतना अधिक होगा अतः आयनन का क्रम है।
डाइमेथिल एमीन > अमोनिया > पिरीडीन > यूरिया
जिसका आयनन जितना अधिक होता है वह उतना अधिक प्रबल क्षार होता है? अतः डाइमेथिल एमीन प्रबल क्षार है।
प्रश्न 154.
दुर्बल क्षार का संयुग्मी अम्ल प्रबल होता है। निम्न संयुग्मी क्षारों की क्षारकता का घटता क्रम है।
OH–, RO–, CH3COO–, Cl–
उत्तर:
दिये गये क्षारों के संयुग्मी अम्ल हैं-H2O, ROH, CH3COOH, HCl
इनकी अम्लता का क्रम है HCl > CH3COOH > H2O > ROH
अतः संयुग्मी क्षारों की क्षारकता का क्रम है
Cl– < CH3COO– < OH– < RO–
या
RO– > OH– > CH3COO– > Cl–
प्रश्न 155.
निम्न को pH मान के बढ़ते क्रम में व्यवस्थित करें।
KNO3(aq) CH3COONa(aq), NH4Cl(aq), C6H5COONH4(aq)
उत्तर:
KNO3 (प्रबल अम्ल व प्रबल क्षार का लवण) अतः विलयन उदासीन, pH = 7
CH3COON (दुर्बल अम्ल – प्रबल क्षार का लवण) विलयन क्षारीय pH > 7
NH4Cl (प्रबल अम्ल दुर्बल क्षार का लवण) विलयन अम्लीय, pH < 7
C6H5COONH4 (दोनों दुर्बल परन्तु NH4OH, C6H5COOH की तुलना में थोड़ा प्रबल होता है) अतः pH-7 के लगभग परन्तु 7 से थोड़ा ज्यादा होगा।
अतः pH का क्रम है-NH4Cl < C6H5COONH4 > KNO3 < CH3COON
प्रश्न 156.
2HI(g) ⇌ H2(g) + I2(g) के लिये Kc = 1 x 10-4 दिये गये समय पर अभिक्रिया मिश्रण की सान्द्रता है।
[HI] = 2 × 10-5 mol, [H2] = 1 x 10-5 mol, [I2] = 1 × 10-5 mol
अभिक्रिया किस दिशा में जायेगी ?
उत्तर:
Q = \(\frac{\left[\mathrm{H}_2\right]\left[\mathrm{I}_2\right]}{[\mathrm{HI}]^2}=\frac{\left(10^{-5}\right) \times\left(10^{-5}\right)}{\left(2 \times 10^{-5}\right)^2}\)
= \(\frac {1}{4}\) = 0.25 = 2.5 x 10-1
चूँकि Q > K अत: अभिक्रिया प्रतीप दिशा में जायेगी।
लघु उत्तरीय प्रश्न
प्रश्न 1.
रासायनिक साम्य की विशेषताओं का उल्लेख कीजिए।
उत्तर:
रासायनिक साम्य की निम्न विशेषताएँ हैं-
- अग्र तथा विपरीत अभिक्रियाओं का वेग समान होता है।
- अभिकारकों तथा उत्पादों की मात्राएँ साम्य मिश्रण में स्थिर रहती हैं।
- ताप. दाब और सान्द्रण में परिवर्तन होने पर साम्य स्थिति बदल जाती है।
- साम्य गतिज होता है।
प्रश्न 2.
किसी उत्क्रमणीय रासायनिक अभिक्रिया की अग्र तथा विपरीत अभिक्रियाओं के साम्य स्थिरांकों में क्या सम्बन्ध है?
उत्तर:
यदि उत्क्रमणीय अभिक्रिया को निम्न प्रकार प्रदर्शित करें-
A + B ⇌ C + D
तब अग्र अभिक्रिया का साम्य स्थिरांक Kc = \(\frac{[\mathrm{C}][\mathrm{D}]}{[\mathrm{A}][\mathrm{B}]}\)
तथा विपरीत अभिक्रिया का साम्य स्थिरांक-
Kc’ = \(\frac{1}{\mathrm{~K}_c}\)
अतः किसी उत्क्रमणीय अभिक्रिया की अग्र तथा विपरीत अभिक्रियाओं के साम्य स्थिरांक एक-दूसरे के व्युत्क्रम होते हैं।
प्रश्न 3.
रासायनिक साम्य कितने प्रकार का होता है?
उत्तर:
रासायनिक साम्य निम्न दो प्रकार के होते हैं-
- समांगी गैसीय साम्य
- विषमांगी गैसीय साम्य।
(i) समांगी गैसीय साम्य वह साम्य जिसमें अभिकारक तथा क्रियाफल पदार्थ एक ही प्रावस्था में होते हैं और वह प्रावस्था गैसीय होती है उसे समांगी गैसीय साम्य कहते हैं।
समांगी गैसीय साम्य दो प्रकार का होता है।
(अ) वे अभिक्रियाएँ जिनमें रासायनिक परिवर्तन के फलस्वरूप अणुओं
की संख्या में परिवर्तन नहीं होता है, जैसे-
H2(g) + I2(g) ⇌ 2HI(g)
2HI(g) ⇌ H2(g) + I2(g)
(ब) वे अभिक्रियाएँ जिनमें रासायनिक परिवर्तन के फलस्वरूप अणुओं की संख्या में परिवर्तन होता है। जैसे-
PCl5(g) ⇌ PCl3(g) + Cl2
N2(g) + 3H2(g) ⇌ 2NH3(g)
(ii) विषमांगी गैसीय साम्य – इनमें अभिकारक और क्रियाफल भिन्न-भिन्न प्रावस्था में होते हैं, जैसे-
3Fe(s) + 4H2O(l) ⇌ Fe3O4(l) + 4H2(g)
प्रश्न 4.
अभिक्रिया N2 + O2 ⇌ 2NO – xcal साम्यावस्था में हो रही है। इस अभिक्रिया पर ताप, दाब एवं सान्द्रण में परिवर्तन का क्या प्रभाव पड़ता है।
उत्तर:
N2 + O2 ⇌ 2NO – x cal
इस अभिक्रिया ऊष्मा का शोषण होता है। अतः ताप बढ़ाने पर NO का अधिक उत्पादन होगा। अभिक्रिया में आयतन अपरिवर्तित रहता है। अतः दाब का कोई प्रभाव नहीं पड़ता है।
साम्य पर N2 तथा O2 का सान्द्रण बढ़ाने पर इनका आंशिक दाब बढ़ जायेगा। अतः साम्य स्थिरांक Kp का मान स्थिर रखने के लिए NO का सान्द्रण बढ़ जायेगा। अत: N2 या O2 के सान्द्रण वृद्धि इस साम्य में NO के अधिक उत्पादन में सहायक होगी।
प्रश्न 5.
निम्न अभिक्रिया के लिए साम्य स्थिरांक की गणना कीजिए।
2SO2 + O2 ⇌ 2SO3 +x k cal.
उत्तर:
2SO2 + O2 ⇌ 2SO3 + x k cal.
माना कि SO2 के दो ग्राम अणु तथा O2 का एक ग्राम अणु मिलकर SO3 के दो ग्राम अणु का निर्माण करते हैं। यदि साम्यावस्था पर 2x ग्राम SO3 प्राप्त होती है, तो

प्रश्न 6.
दाब बढ़ा देने पर जल के वाष्पीकरण पर क्या प्रभाव पड़ता है?
उत्तर:
जल धीरे-धीरे वाष्प में परिवर्तित होता है। जल के वाष्प में परिवर्तित होने पर आयतन में वृद्धि होती है एवं ताप का शोषण होता है।
जल ⇌ जल वाष्प – x cal
दाब बढ़ाने पर जो परिवर्तन होता है उसके प्रभाव को नष्ट करने के लिए साम्य उस दिशा में अग्रसर होता है जिस ओर आयतन में कमी होती है, क्योंकि वाष्पन के फलस्वरूप आयतन में वृद्धि होती है। अतः कुल वाष्प द्रव में परिवर्तित हो जायेगी और जल का वाष्पीकरण कम हो जायेगा। इसके विपरीत, दाब घटाने पर जल का वाष्पीकरण अधिक होगा।
![]()
प्रश्न 7.
बर्फ के पिघलने पर ताप तथा दाब का क्या प्रभाव पड़ता है? इसका कारण स्पष्ट करो।
उत्तर:
बर्फ के गलनांक पर बर्फ तथा जल में निम्नलिखित साम्यावस्था स्थापित होती है-
बर्फ (ठोस) ⇌ जल 80 कैलोरी /ग्राम
बर्फ के पिघलने पर ऊष्मा का शोषण होता है तथा आयतन में कमी होती है अतः इस साम्यावस्था पर ताप दाब के परिवर्तन का प्रभाव पड़ता है।
ताप का प्रभाव-ताप के प्रभाव से साम्यावस्था उस ओर विस्थापित हो जाती है जिस ओर ताप का अवशोषण होता है। अतः साम्यावस्था अग्रिम दिशा में विस्थापित होगी अर्थात् बर्फ का पिघलना बढ़ जायेगा।
दाब का प्रभाव-उपर्युक्त साम्य की अग्रिम दिशा में आयतन में कमी होती है। किसी तन्त्र पर दाब बढ़ने पर उसका आयतन कम होता है। अतः दाब में वृद्धि साम्यावस्था को उस ओर विस्थापित करेगी जिस ओर दाब वृद्धि का प्रभाव नष्ट होता है अर्थात् आयतन कम होता है। अतः साम्य अग्रिम दिशा में विस्थापित होगा।
अतः दाब में वृद्धि बर्फ के पिघलने में सहायक होती है।
प्रश्न 8.
निम्न अभिक्रियाओं पर दाब का क्या प्रभाव होगा, विवेचना कीजिए तथा इसके साम्यावस्था नियतांक (Kc) का परिकलन कीजिए-
(i) 2CO2 ⇌ 2CO + O2
(ii) N2 + O2 ⇌ 2NO
(iii) NH4Cl ⇌ NH3 + HCl
(iv) N2O4 ⇌ 2NO2
उत्तर:
(i) 2CO2 ⇌ 2CO + O2
Kc = \(\frac{[\mathrm{CO}]^2 \times\left[\mathrm{O}_2\right]}{\left[\mathrm{CO}_2\right]^2}\)
इस क्रिया में दाब अधिक रखने पर CO तथा O2 कम बनेगी, क्योंकि उत्पादों का आयतन बढ़ रहा है।
(ii) N2 + O2 ⇌ 2NO
Kc = \(\frac{[\mathrm{NO}]^2}{[\mathrm{~N}]_2\left[\mathrm{O}_2\right]}\)
यह क्रिया दाब के प्रभाव से मुक्त है क्योंकि आयतन में कोई परिवर्तन नहीं हो रहा है।
∆n = 0 है, अत: Kp = Kc
(iii) NH4Cl ⇌ NH3 + HCl
Kc = \(\frac{\left[\mathrm{NH}_3\right][\mathrm{HCl}]}{\left[\mathrm{NH}_4 \mathrm{Cl}\right]}\)
चूँकि आयतन बढ़ रहा है अतः NH4Cl का विघटन दाब बढ़ाने पर घट जाता है।
(iv) N2O4 ⇌ 2NO2
Kc = \(\frac{\left[\mathrm{NO}_2\right]^2}{\left[\mathrm{~N}_2 \mathrm{O}_4\right]}\)
चूँकि आयतन बढ़ रहा है अतः इस क्रिया में अधिक दाब बढ़ाने पर N2O4 का वियोजन कम होगा।
प्रश्न 9.
∆n की शून्य, धनात्मक तथा ऋणात्मक क्रियाओं की व्याख्या कीजिए।
उत्तर:
Kp = Kc(RT)∆n
यदि ∆n = 0 तो उत्पाद के अणुओं की संख्या क्रियाकारक के अणुओं की संख्या के बराबर होती है।
Kp = Kc(RT)0
Kp = Kc
उदाहरण – H2 + 12 ⇌ 2HI
N2 + O2 ⇌ 2NO
∆n = + ve होने पर उत्पाद के अणुओं की संख्या अभिकारकों के अणुओं की संख्या से अधिक होती है अर्थात्
Kp = Kc(RT)-∆n
Kp/Kc = (RT)+∆n
(RT)+∆n > 1
Kp/Kc > 1
उदाहरण – PCI5 ⇌ PCl3 + Cl2 ∆n = + 1
N2O2 ⇌ 2NO2; ∆n = + 1
∆N = – ve होने पर उत्पाद के अणुओं की संख्या, क्रियाकारकों के अणुओं से कम होती है अतः ∆n = – ve होने पर
kp = Kc(RT)-∆n
Kp/Kc = (RT)-∆n
1 > (RT)∆n
उदाहरण –
N2 + 3H2 ⇌ 2NH3; ∆n = – 2
2SO2 + O2 ⇌ 2SO3; ∆n = – 1
प्रश्न 10.
यदि P वायुमण्डल दाब पर PCI5 50% वियोजित हुआ तब KP का मान क्या होगा?
उत्तर:
KP = \(\frac{x^2 \mathrm{P}}{1-x}=\frac{(0.5)^2 \times \mathrm{P}}{1-(0.5)^2}\)
= \(\frac{0.25 \times P}{1-0.25}\)
= \(\frac{0.25 \mathrm{P}}{0.75}=\frac{\mathrm{P}}{3}\)
प्रश्न 11.
अभिक्रिया 2A (गैस) + B (गैस) ⇌ 3C (गैस) के लिए साम्य स्थिरांक का समीकरण लिखिए।
उत्तर:
2A + B ⇌ 3C
साम्यावस्था पर यदि अनुकूल आंशिक दाब PA, PB, PC हो तब
Kp = \(\frac{\left(P_C\right)^3}{\left(P_A\right)^2 \times P_B}\)
जहाँ Kp साम्य स्थिरांक है।
इसी प्रकार निम्न सामान्य गैसीय अभिक्रिया के लिए-
m1A + m2B + …….. ⇌ n.C
Kp = \(\frac{\mathrm{P}_{\mathrm{C}}^{m_1} \times \ldots}{\mathrm{P}_{\mathrm{A}}^{m_1} \times \mathrm{P}_{\mathrm{B}}^{m_2}}\)
प्रश्न 12.
PCl5 के PCI5 और Cl2 में वियोजन की मात्रा यदि x हो, तो साम्यावस्था पर PCl5 की कितनी मोल मात्रा होगी?
उत्तर:
माना PCl3 निम्न प्रकार से वियोजित हो रहा है।

माना एक ग्राम अणु PCl5 जिसका आयतन V लीटर है। यदि PCl5 के वियोजन की मात्रा है, तो साम्य मिश्रण में x ग्राम अणु PCl3 x, ग्राम अणु Cl2 तथा 1 – x ग्राम अणु PCl5 होंगे।
प्रश्न 13.
निम्न अभिक्रियाओं के लिए साम्य स्थिरांक का व्यंजक लिखिए-
(i) CaCO3(s)⇌ CaO(s) + CO2(g)
(ii) NH4Cl(s) ⇌ NH3(g) + HCl(g)
(iii) PCl5(g) ⇌ PCl3(g) + Cl2(g)
(iv) SO42-(aq) + Pb2+(aq) ⇌ PbSO4(s)
उत्तर:
(i) Kc = [CO2]
(ii) Kc = [NH3] [HCl]
(iii) Kc = [PCl3] [Cl2]
(iv) Kc = \(\frac{1}{\left.\left[\mathrm{SO}_4{ }^{2-}\right] \mathrm{Pb}^{2+}\right]}\)
प्रश्न 14.
ला – शातेलिये सिद्धान्त की व्याख्या कीजिए।
उत्तर:
ला-शातेलिये सिद्धान्त के अनुसार यदि साम्यावस्था निकाय में दाब, सान्द्रता अथवा ताप परिवर्तन किया जाये तो साम्य स्वतः ही उस दिशा में विस्थापित हो जाता है जिस ओर हटने से परिवर्तन का प्रभाव समाप्त हो जाये।
ला-शातेलिये नियम के अनुसार-
- साम्य निकाय का दाब बढ़ने पर साम्य उस दिशा में विस्थापित होता है जिधर आयतन घटता है।
- साम्य निकाय का ताप बढ़ने पर साम्य उस दिशा में विस्थापित होता जिधर ऊष्मा अवशोषित होती है।
- साम्य निकाय में उपस्थित किसी पदार्थ की सान्द्रता बढ़ाने पर साम्य उस दिशा में विस्थापित होता है जिधर उस पदार्थ की खपत होती है।
प्रश्न 15.
साम्यावस्था स्थिरांक को प्रभावित करने वाले कारकों की व्याख्या कीजिए।
उत्तर:
साम्यावस्था स्थिरांक निम्न कारकों द्वारा प्रभावित होता है-
(1) ताप ऊष्माशोषी अभिक्रियाओं के लिए ताप बढ़ने पर साम्यावस्था स्थिरांक (Kc) का मान बढ़ जाता है, जबकि ऊष्माक्षेपी अभिक्रियाओं के लिए Kc का मान घट जाता है।
(2) अभिक्रिया व्यक्त करने की विधि-यदि उत्क्रमणीय अभिक्रिया को A + B ⇌ C + D के रूप में व्यक्त करें तो साम्यावस्था स्थिरांक Kc = \(\frac{[\mathrm{C}][\mathrm{D}]}{[\mathrm{A}][\mathrm{B}]}\) तथा यदि इस अभिक्रिया को C + D ⇌ A + B के रूप में लिखें तो साम्यावस्था स्थिरांक Kc‘ = \(\frac{[\mathrm{C}][\mathrm{D}]}{[\mathrm{A}][\mathrm{B}]}\) होगा अर्थात्
Kc‘ = \(\frac{1}{\mathrm{~K}_c}\)
(3) रासायनिक अभिक्रिया की रससमीकरणमितिय – जब किसी रासायनिक अभिक्रिया को दो रससमीकरणमितीय समीकरणों के द्वारा व्यक्त किया जाता है तो दोनों स्थितियों में साम्य स्थिरांक का मान भिन्न होता है।
प्रश्न 16.
लुईस अवधारणा के अनुसार निम्न में से अम्ल-क्षार छाँटिये
S2-, H+, OH–, BF3, Ni2+, F–
उत्तर:
लुईस अम्ल – H+, BF3, Ni2+
लुईस क्षार S2- – OH–, F–
प्रश्न 17.
निम्न संयुग्मी अम्ल लिखिए-
HS–, NH3, H2PO4–, CH3NH2
उत्तर:
HS– का संयुग्मी अम्ल = H2S
NH3 का संयुग्मी अम्ल = NH4+
H2PO4– का संयुग्मी अम्ल = H3PO4
CH3NH2 का संयुग्मी अम्ल = CH3NH3+
प्रश्न 18.
आयनन प्रभावित करने वाले कोई तीन कारक लिखिए।
उत्तर:
आयनन को प्रभावित करने वाले तीन कारक निम्नलिखित
(i) ताप (Temperature) – ताप में वृद्धि करने पर आयनन की मात्रा में वृद्धि होती है, क्योंकि ताप बढ़ने पर आयनों के मध्य लगने वाले आकर्षण बल में कमी आती है।
α ∝ \(\frac{1}{\sqrt{\mathrm{C}}}\)
(iii) विलायक की प्रकृति (Nature of Solvent ) – अध्रुवीय विलायकों की तुलना में ध्रुवीय विलायकों द्वारा आयनन अधिक होता है। किसी विलायक का परावैद्युतांक स्थिरांक जितना अधिक होगा उसमें आयनन की मात्रा उतनी ही अधिक होगी।
प्रश्न 19.
साधारण नमक के संतृप्त विलयन में अवक्षेपण हेतु HCl गैस मिलायी जाती है, HCl अम्ल नहीं। कारण स्पष्ट कीजिए।
उत्तर:
क्योंकि किसी लवण के अवक्षेपण के लिए यह आवश्यक है कि विलयन में आयनों के सांद्रणों का गुणनफल (आयनिक गुणनफल) विद्युत अपघट्य के विलेयता गुणनफल से अधिक हो। यही कारण है कि साधारण नमक के संतृप्त विलयन में अवक्षेपण हेतु HCl गैस मिलायी जाती है, HCl अम्ल नहीं।
प्रश्न 20.
प्रबल अम्ल तथा दुर्बल क्षार से बने लवण विलयन का Kh तथा [H+] सान्द्रता ज्ञात करने का सूत्र व्युत्पन्न कीजिए।
उत्तर:
प्रबल अम्ल एवं दुर्बल क्षार से बने लवण विलयन का Kh तथा [H+] सांद्रता ज्ञात करने का सूत्र निम्न प्रकार है।
उदाहरणार्थ – NH4Cl
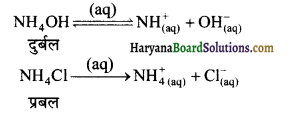
ऐसे लवणों का जल अपघटन निम्न समीकरण से प्रकट करते हैं-
NH4Cl + H2O ⇌ NH4OH + HCl
NH4+ + H2O ⇌ NH4OH + H+
यदि दुर्बल क्षार एवं प्रबल अम्ल के लवण BA के एक ग्राम मोल को V लीटर विलयन में विलेय किया जाये और जल अपघटन की मात्रा h हो, तो विलयन में साम्यावस्था निम्न प्रकार होगी-

प्रश्न 21.
द्वितीय समूह के विश्लेषण में एक छात्र तनु HCl के स्थान पर NH4OH मिला देता है। यदि विलयन में CdCl2 मौजूद हो, तो H2S गैस प्रवाहित करने पर अवक्षेप प्राप्त होगा या नहीं? अपने उत्तर का कारण भी लिखिए।
उत्तर:
द्वितीय समूह के विश्लेषण में तनु HCl स्थान पर NH4OH मिला दिया जाय तो विलयन में CdCl2 की उपस्थिति में H2S गैस प्रवाहित करने पर NH4OH की उपस्थिति में H+ आयन इसके OH– से क्रिया करके जल बनाते हैं। H+ आयन की सान्द्रता पर्याप्त रूप से कम हो जाती है और इस प्रकार S2- आयन की सांद्रता बढ़ जाती है जिससे कि आयनों की सान्द्रता का गुणनफल CaS के विलेयता गुणनफल से अधिक हो जाता है अत: Cd, Cds के रूप में अवक्षेपित हो जायेगा।
प्रश्न 22.
Mg (OH)2, NH4Cl में विलेय है, जबकि NaCl में अविलेय, कारण बताइए।
उत्तर:
किसी विद्युत अपघट्य की विलेयता उसके आयनीकरण की मात्रा बढ़ने से बढ़ती है। अत: Mg (OH)2, NH4Cl में विलेय है, तो यह स्पष्ट है कि Mg (OH)2 का आयनीकरण NH4Cl में बढ़ जाता है।
Mg (OH)2 ⇌ Mg 2+ +2OH–
NH4Cl ⇌ Cl– + NH4+
NH4+ आयन OH– से मिलकर दुर्बल विद्युत अपघट्य NH4OH बनाता है जिससे OH– आयनों की कमी हो जाती है। अत: Mg 2+ तथा OH– आयनों सान्द्राण का गुणनफल Mg (OH)2 की विलेयता गुणनफल से कम हो जाता है। इसीलिए Mg (OH)2 घुल जाता है।
NaCl के आयनीकरण से प्राप्त Na+आयन OH– आयनों से संयोग नहीं करेंगे, क्योंकि NaOH एक प्रबल विद्युत अपघट्य है जो आयनिक अवस्था में ही रहेगा। अतः अब OH– आयनों में कमी नहीं होगी और Mg(OH)2 का आयनीकरण नहीं बढ़ेगा तथा यह अविलेय रह जायेगा।
प्रश्न 23.
विलेयता गुणनफल किसे कहते हैं? CdS प्रकार के यौगिकों के लिए विलेयता तथा विलेयता गुणनफल के मध्य सम्बन्ध स्थापित कीजिए। तृतीय समूह के अवक्षेपण में NH4OH मिलाने के पहले NH4Cl क्यों मिलाया जाता है? कारण समझाइए।
उत्तर:
स्थिर ताप पर किसी विद्युत अपघट्य के संतृप्त विलयन में ठोस अपघट्य और विलयन में उपस्थित अवियोजित अणुओं तथा आयनों के मध्य साम्यावस्था रहती है। माना कि कोई विद्युत अपघट्य AB विलयन में है। विलयन संतृप्त है, तो अग्र साम्य स्थापित होगा-

निश्चित ताप पर ठोस का सक्रिय भार तथा विलयन में उपस्थित अवियोजित अणुओं व आयनों के सक्रिय भार भी स्थिर रहते हैं। अतः इस साम्यावस्था पर द्रव्य अनुपाती क्रिया का नियम लगाने पर
K = \(\frac{\left[\mathrm{A}^{+}\right]\left[\mathrm{B}^{-}\right]}{[\mathrm{AB}]}\)
या [A+][B–] = [AB] K = Ksp (स्थिरांक)
किसी भी संतृप्त विलयन में अवियोजित अणुओं की संख्या सदैव निश्चित रहती है।
इसका कारण K तथा [AB] का गुणनफल एक स्थिरांक [Ksp] है। अत: एक स्थिरांक होगा। इस स्थिरांक को विलेयता गुणनफल कहते हैं। विलेयता गुणनफल केवल संतृप्त विलयनों के लिए आयनिक गुणनफल है।
Ksp का मान विलयन के ताप पर निर्भर करता है। इसकी इकाई ग्राम अणु प्रति लीटर है।
अतः किसी विद्युत अपघट्य के संतृप्त विलयन में उपस्थित आयनों सान्द्र का गुणनफल स्थिर ताप पर स्थिर रहता है और इसे उस ताप पर विद्युत अपघट्य का विलेयता गुणनफल कहा जाता है।
विलेयता और विलेयता गुणनफल में सम्बन्ध
यदि किसी अल्प विलेय द्विअंगी (binary) विद्युत अपघट्य AB की विलेयता ग्राम अणु प्रति लीटर हो और वह लवण पूर्णतया आयनित हो रहा हो, तो A+ तथा B– आयनों का सान्द्रण ग्राम आयन प्रति लीटर होगा और AB का विलेयता गुणनफल s² होगा।

अर्थात् किसी अल्प विलेय द्विअंगी विद्युत अपघट्य की विलेयता उसकी विलेयता गुणनफल के वर्गमूल के बराबर होती है।
तृतीय समूह के अवक्षेपण में NH4OH मिलाने के पहले NH4Cl मिलाया जाता है, क्योंकि NH4OH एक दुर्बल विद्युत अपघट्य है। अतः इसमें NH4Cl मिलाने पर इसकी आयनन की मात्रा कम हो जाती है।
विलयन में NH4+ आयनों की सान्द्रता में वृद्धि होती है।
प्रश्न 24.
लवण का जल अपघटन से क्या तात्पर्य है? निम्न लवणों के जलीय विलयन की प्रकृति बताइए तथा अपने उत्तर का कारण भी समझाइए-
(i) CuSO4 (ii) Na2CO3 (iii) CH3COO NH4 लवण के लिए Kh, Kw, Ka तथा Kb में सम्बन्ध स्थापित कीजिए।
उत्तर:
लवण का जल अपघटन (Hydrolysis of Salt)-जब किसी लवण के अणुओं की जल के अणुओं के साथ क्रिया करायी जाती है, तो वह अपने संगत अम्ल तथा क्षार में विभक्त हो जाता है। यह प्रक्रिया लवण का जल अपघटन कहलाती है। यह एक उत्क्रमणीय प्रक्रिया है।
उदाहरण-
NaCl + H2O ⇌ HCl + NaOH
NH4Cl + H2O ⇌ HCl + NH4OH
Na2CO3 + H2O ⇌ H2CO3 + 2NaOH
(i) CuSO4 का जलीय विलयन अम्लीय होता है, क्योंकि विलयन में [H+] आयन की सान्द्रता [OH–] आयन की सान्द्रता से अधिक होती है।
अत: Cu2+ + 2H2O ⇌ Cu (OH)2 + 2H+
(ii) Na2CO3 का जलीय विलयन क्षारीय होता है, क्योंकि Na2CO3 प्रबल क्षारक एवं दुर्बल अम्ल का लवण है। Na2CO3 को जल में मिलाने पर कार्बोनेट आयन (CO32-) जल के अणुओं से क्रिया करके दुर्बल कार्बोनिक अम्ल (H2CO3) तथा मुक्त हाइड्रॉक्साइड आयन बनाते हैं जिससे विलयन में OH– आयनों की सान्द्रता H+ आयनों की सान्द्रता से अधिक हो जाती है तथा विलयन क्षारीय होता है।
CO32- + 2H2O ⇌ H2CO3 + 2OH–
(iii) CH3COONH4 का विलयन उदासीन होता है, क्योंकि यह दुर्बल क्षार NH4OH तथा दुर्बल अम्ल CH3COOH से मिलकर बना होता है।
CH3COONH4 + H2 ⇌ CH3COOH + NH4OH
Kh, Kw, Ka तथा Kb में सम्बन्ध
किसी लवण की जल अपघटन साम्यावस्था इस प्रकार होगी
B+ + A– + H2O ⇌ HA + BOH
यदि लवण BA के एक ग्राम मोल को एक लीटर विलयन में विलेय किया जाये तथा जल अपघटन की मात्रा h हो तो विलयन की साम्यावस्था निम्न होगी-

उपर्युक्त व्यंजक में सान्द्रता नहीं है, अतः जल-अपघटन की मात्रा सान्द्रता या तनुकरण पर निर्भर नहीं करती है।
लवण की जल-अपघटन साम्यावस्था निम्न होगी-
B+ + A– + H2O ⇌ HA + BOH
अतः Kh = \(\frac{[\mathrm{HA}][\mathrm{BOH}]}{\left[\mathrm{B}^{+}\right]\left[\mathrm{A}^{+}\right]}\) … (3)
जल का आयनिक गुणनफल Kw = [H+] [OH–] … (4)
दुर्बल अम्ल HA का वियोजन स्थिरांक निम्न होगा-
HA ⇌ H+ + A–
Ka = \(\frac{\left[\mathrm{H}^{+}\right]\left[\mathrm{A}^{-}\right]}{[\mathrm{HA}]}\) … (5)
दुर्बल क्षार BOH का वियोजन स्थिरांक निम्न होगा-
BOH ⇌ B+ + OH–
Kb = \(\frac{\left[\mathrm{B}^{+}\right]\left[\mathrm{OH}^{-}\right]}{[\mathrm{BOH}]}\)
समीकरण (4) में समीकरण (5) तथा समीकरण (6) का भाग देने पर,

प्रश्न 25.
दुर्बल अम्लों की आपेक्षिक सामर्थ्य क्या है?
उत्तर:
दो समान सान्द्रता वाले, दुर्बल अम्लों की आपेक्षिक सामर्थ्य उनके अपघटन स्थिरांकों के अनुपात का वर्गमूल होती है।
चूँकि किसी अम्ल की अपघटन की मात्रा उसकी हाइड्रोजन आयन देने की क्षमता की माप है, अतः यह उसकी सामर्थ्य की भी माप है। अतः

प्रश्न 26.
ब्रॉन्स्टेड लॉरी संकल्पना की उपयोगिता लिखो।
उत्तर:
ब्रॉन्स्टेड लॉरी संकल्पना की उपयोगिता (Advantages of Bronsted Lowry concept)-
- यह संकल्पना पदार्थों की अम्लीय तथा क्षारीय प्रकृति को उनके आयनों, जो कि विलयन में उपस्थित है, से सम्बन्धित नहीं करती। जैसे-HCl एक अम्ल इसलिए है कि वह प्रोटॉन (H+) आयन दे सकता है।
- इस संकल्पना को जल के अतिरिक्त अन्य प्रोटॉनी विलायकों जैसे NH3, CH3COOH आदि पर भी प्रयुक्त कर सकते हैं।
- यह सिद्धान्त लवणों के जल अपघटन पर प्राप्त विलयन की अम्लीय तथा क्षारीय प्रकृति की व्याख्या करने में भी सफल है।
प्रश्न 27.
अभिक्रिया H2(g) + I2(g) ⇌ 2HI(g) के लिये साम्य स्थिरांक की गणना करें।
उत्तर:
माना कि प्रारम्भ में a मोल H2, b मोल I2 लिये गये हैं। साम्यावस्था पर x मोल H2 तथा x मोल I2 के संयोग से 2x मोल HI बनते हैं। यदि अभिक्रिया मिश्रण का कुल आयतन V लीटर है तो,

क्योंकि दी गयी अभिक्रिया में उत्पादों एवं अभिकारकों की संख्या समान है अतः इसमें Kc तथा Kp के मान भी समान होगें।
प्रश्न 28.
ला-शातेलिए के सिद्धान्त के आधार पर निम्नलिखित की विवेचना कीजिए-
(1) जल में पोटैशियम नाइट्रेट की विलेयता पर ताप का प्रभाव।
(2) गैस की द्रव में विलेयता पर दाब का प्रभाव।
उत्तर:
(1) पोटैशियम नाइट्रेट को जल में घोलने पर ऊष्मा अवशोषित होती है।
KNO3 (s) + जल ⇌ KNO3 (aq) – X kcal
ला-शातेलिए के नियमानुसार ताप वृद्धि पर KNO3 की जल में विलेयता बढ़ेगी।
अतः जल में पोटैशियम नाइट्रेट की विलेयता ताप बढ़ाने से बढ़ती है।
(2) जब कोई गैस किसी द्रव में घोली जाती है तो उसके आयतन में कमी होती है, फलस्वरूप ला-शातेलिए के नियमानुसार उसकी विलेयता में दाब वृद्धि सहायक होगी; अतः दाब बढ़ाने पर द्रव में किसी गैस की विलेयता बढ़ती है।
प्रश्न 29.

अभिक्रिया साम्य पर ताप के प्रभाव की विवेचना कीजिए।
उत्तर:
यह एक ऊष्माक्षेपी अभिक्रिया है जिसमें अभिक्रिया के फलस्वरूप अभिकारकों का कुल आयतन कम हो जाता है और ऊष्मा निर्मुक्त होती है।

ला-शातलिए नियमानुसार, साम्यावस्था पर ताप बढ़ाने पर साम्य उस दिशा में परिवर्तित होगा जिसमें ऊष्मा का शोषण होता है। इसमें ताप वृद्धि पर CO2 का अधिक विघटन होगा; क्योंकि तन्त्र विपरीत दिशा की ओर अग्रसर होगा अर्थात् कम ऊष्मा उत्पन्न होगी जिससे CO2 का निर्माण अधिक होगा; अतः कम ताप पर CO2 का निर्माण अधिक होगा।
प्रश्न 30.
विद्युत वियोजन के सिद्धान्त के अनुसार सम-आयन प्रभाव की व्याख्या कीजिये।
उत्तर:
1. ला – शातेलिए सिद्धांत के अनुसार, यदि किसी लवण विलयन में किसी एक आयन की सांद्रता बढ़ाने पर आयन अपने विपरीत आवेश के आयन के साथ संयोग करेगा तथा विलयन से कुछ लवण तब तक अवक्षेपित होंगे, जब तक एक बार पुनः Ksp = Qsp न हो जाए।
2. यदि किसी आयन की सांद्रता घटा दी जाए, तो कुछ और लवण घुलकर दोनों आयनों की सांद्रता बढ़ा देते हैं ताकि फिर Ssp = Qsp हो जाए।
3. यह विलेय लवणों के लिए भी लागू हैं, सिवाय इसके कि आयनों की उच्च सांद्रता के कारण Qsp व्यंजक में मोलरता के स्थान पर हम सक्रियता (activities) का प्रयोग करते हैं। इस प्रकार सोडियम क्लोराइड के संतृप्त विलयन में HCl के वियोजन से प्राप्त क्लोराइड आयन की सांद्रता (सक्रियता) बढ़ जाने के कारण सोडियम क्लोराइड का अवक्षेपण हो जाता है। इस विधि से प्राप्त सोडियम क्लोराइड बहुत ही शुद्ध होता है।
4. इस प्रकार सोडियम अथवा मैग्नीशियम सल्फेट जैसी अशुद्धियों को दूर कर देते हैं।
5. भारात्मक विश्लेषण में किसी आयन को बहुत कम विलेयता वाले उसके अल्प विलेय लवण के रूप में पूर्ण रूपेण अवक्षेपित करने में भी सम आयन प्रभाव का प्रयोग किया जाता है।
6. इस प्रकार भारात्मक विश्लेषण में सिल्वर आयन का अवक्षेपण सिल्वर क्लोराइड के रूप में, फेरिक अम्ल का अवक्षेपण फेरिक हाइड्रॉक्साइड के रूप में तथा अवक्षेपण बेरियम आयन का बेरियम सल्फेट के रूप में कर सकते हैं।
7. दुर्बल अम्ल के लवणों की विलेयता कम pH पर बढ़ती है, क्योंकि कम pH पर ऋणायन की सांद्रता इसके प्रोटॉनीकरण के कारण घटती है, जो लवण की विलेयता को बढ़ा देता है। इससे Ksp = Qsp हमें दो साम्यों को एक साथ संतुष्ट करना होता है, अर्थात् Ksp = [M+] [X–],

अतः pH के घटने पर ‘f’ भी घटता है।
यदि दी गई pH पर लवण की विलेयता S हो, तो
Ksp = [S] [f S] = S² {Ka / (Ka + [H+])} एवं
S = {Ksp ([H+] + Ka) / Ka}1/2
अत: S, [H+] के बढ़ने या pH के घटने पर विलेयता बढ़ती है।
प्रश्न 31.
आरहीनियस के आयनन या विद्युत अपघटनी वियोजन सिद्धान्त को लिखें।
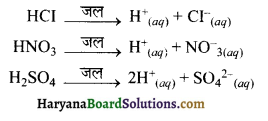
उत्तर:
सर्वप्रथम सन् 1887 में आरेनियस ने अम्ल व क्षार को निम्न प्रकार परिभाषित किया। आरेनियस के अनुसार,
अम्ल वे पदार्थ होते हैं जो जलीय विलयन में H+ आयन देते हैं।
उदाहरणार्थ-
प्रबल अम्ल जैसे-HCI, HNO3 व H2SO4 आदि।
दुर्बल अम्ल जैसे CH3COOH व H2CO3 भी अम्ल के उदाहरण हैं। ये भी जल में कुछ सीमा तक आयनित होते हैं व यहाँ पर साम्य भी स्थापित होता है।

| प्रबल अम्ल (Strong Acids) | दुर्बल अम्ल (Weak Acids) |
| परक्लोरिक अम्ल (HCIO4) | बोरिक अम्ल (H3BO3) |
| सलफ्यूरिक अम्ल (H2SO4) | हाइड्रोजन सल्फाइड (H2S) |
| हाइड्रोक्लोरिक अम्ल (HCl) | नाइट्रस अम्ल (HNO2) |
| हाइड्रोब्रोमिक अम्ल (HBr ) | हाइपोक्लोरस अम्ल (HCIO) |
| हाइड्रोआयोडिक अम्ल (HI) | फॉस्फोरिक अम्ल (H3PO4) |
| नाइट्रिक अम्ल (HNO3) |
क्षार वे पदार्थ होते हैं जो जलीय विलयन में OH– आयन देते हैं। OH– आयन भी जलीय विलयन में जलयोजित रूप में रहता है।
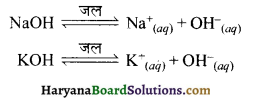
NH4OH तथा Al(OH)3 जैसे दुर्बल क्षार कम मात्रा में आयनित होते हैं।
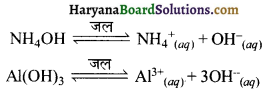
| प्रबल क्षार (Strong Bases ) | दुर्बल क्षार (Weak Bases) |
| लीथियम हाइड्रॉक्साइड (LiOH) | अमोनियम हाइड्रॉक्साइड (NH4OH) |
| सोडियम हाइड्रॉक्साइड (NaOH) | पिरीडीन (CHN) |
| पोटैशियम हाइड्रॉक्साइड (KOH) | ऐलुमिनियम हाइड्रॉक्साइड [Al(OH)3] |
| बेरियम हाइड्रॉक्साइड Ba(OH)2 | कैल्सियम हाइड्रॉक्साइड (Ca(OH)2] |
| सिजियम हाइड्रॉक्साइड (CsOH) | ऐमीन्स (R-NH2) |
| रुबिडियम हाइड्रॉक्साइड (RbOH) | ऐनिलीन (C6H5-NH2) |
आरेनियस के सिद्धान्त के अनुसार उदासीनीकरण में अम्ल के H+ आयन क्षार के OH– आयनों के साथ संयोग करके जल के एक उदासीन अणु का निर्माण करते हैं। उदासीनीकरण की इस अभिक्रिया में 13.7 kcal ऊर्जा निर्मुक्त होती है; अतः यह एक ऊष्माक्षेपी अभिक्रिया है।
H+(aq) + OH–(aq) ⇌ H2O(l); ∆H = – 13.7 kcal
किसी भी अम्ल व क्षार की प्रबलता उसके द्वारा विलयन में दिये गये H+ व OH– आयनों की प्रवृत्ति पर निर्भर करती है। उदाहरण के लिये, HCl व HCN में HCl प्रबल अम्ल है क्योंकि यह विलयन में अधिक H+ आयन देता है।
![]()
प्रश्न 32.
बफर विलयन किसे कहते हैं? ये कितने प्रकार के होते हैं? समझाइये।
उत्तर:
जैसा कि पहले बताया जा चुका है कि विलयन की उदासीन, अम्लीय या क्षारीय प्रकृति उसके pH मानों पर निर्भर करती है। यदि किसी विलयन में अम्ल या क्षार को डाल दिया जाये तो उसके pH मान में अन्तर आ जाता है।
परन्तु कुछ विलयन ऐसे होते हैं जिनके pH का मान स्थिर होता है। अतः ऐसे विलयन जिनके pH का मान निश्चित होता है एवं प्रबल अम्ल या क्षार की कुछ मात्रा डालने पर भी उनके pH मान में कोई भी परिवर्तन नहीं होता है तो ऐसे विलयनों को बफर विलयन (Buffer Solution) कहते हैं, यह क्रिया बफर क्रिया (Buffer Action) कहलाती है। बफर विलयन को वायु में खुला रंख देने पर भी pH का मान परिवर्तित नहीं होता। इन विलयनों के pH पर तनुता का कोई प्रभाव नहीं होता। बफर विलयनों को लम्बे समय तक रखने पर भी pH के मान में कुछ अन्तर नहीं होता।
बफर विलयन दो प्रकार के होते हैं-
(1) सरल बफर (Simple Buffers) – ये दुर्बल अम्ल एवं दुर्बल क्षार के लवण होते हैं।
उदाहरण-(NH4)2CO3, अमोनियम ऐसीटेट आदि।
(2) मिश्रित बफर (Mixed Buffers) मिश्रित बफर में दो संघटकों का मिश्रण होता है।
- अम्लीय बफर
- क्षारीय बफर
बफर विलयन बनाना (Preparation of Buffer Solution)-यदि pKa, pKb तथा साम्य स्थिरांक के मान ज्ञात हो तों हम वांछित pH का बफर विलयन बना सकते हैं।
(A) अम्लीय बफर (Acidic Buffer) – अम्लीय बफर बनाने के लिए हम दुर्बल अम्ल एवं उसके प्रबल क्षार से बने हुये लवण लेते हैं। जिसमें दुर्बल अम्ल व उसके प्रबल क्षार के लवण को सम मोलर मात्रा में मिलाया जाता है।
उदाहरण – (1) ऐसीटिक अम्ल (CH3 COOH) + सोडियम ऐसीटेट (CH3COONa)
(2) ऐसीटिक अम्ल (CH3COOH) + पोटैशियम ऐसीटेट (CH3COOK)
(3) फॉर्मिक अम्ल (HCOOH) + सोडियम फॉर्मेट (HCOONa) अम्लीय बफर की बफर क्रिया (Buffer Action of Acidic Buffer ) अम्लीय बफर की बफर क्रिया के अध्ययन के लिये ऐसीटिक अम्ल तथा सोडियम ऐसीटेट (CH3COONa) की सम मोलर सान्द्रताओं से बना बफर विलयन लेते हैं जलीय विलयन में CH3COOH दुर्बल वैद्युत अपघट्य होने के कारण इसका आयनन कम मात्रा में होता है, इस कारण साम्य स्थापित हो जाता है। जबकि लवण CH3COONa पूर्णत: आयनित हो जाता है। इसे हम निम्न अभिक्रियाओं के द्वारा प्रदर्शित कर सकते हैं।
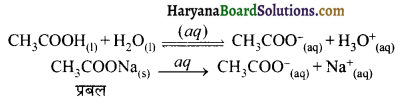
यदि वफर विलयन में प्रबल अम्ल जैसे HCl की थोड़ी सी मात्रा डाल दें तो यह आयनित होकर H3O– आयन देता है। H3O+ आयन विलयन की pH को बदल सकता है परन्तु H3O+ विलयन में पहले से उपस्थित CH3COO– आयनों के साथ संयोग करके CH3COOH बना लेता है। ऐसीटिक अम्ल दुर्बल विद्युत अपघट्य होने के कारण कम आयनित होता है।
![]()
इस प्रकार अम्लीय बफर में उपस्थित CH3COO– आयनों के कारण H3O+, CH3COOH में परिवर्तित हो जाता है तथा अम्लीय बफर में HCl मिलाने पर जो विलयन के pH पर प्रभाव पड़ना होता है वह प्रभाव नहीं पड़ पाता। इस प्रकार बफर विलवन में कुछ मात्रा में प्रबल HCI अम्ल डालने पर इसके pH में कोई परिवर्तन नहीं होता है।
इसी तरह माना कि बफर विलयन में हम कुछ मात्रा में NaOH क्षार को मिलाते हैं तो प्रबल क्षार NaOH आयनित होकर OH– आयन देता है जो कि विलयन की pH में परिवर्तन कर सकता है। परन्तु क्षार से प्राप्त OH– आयन विलयन में पहले से ही उपस्थित H3O+ से क्रिया करके जल में परिवर्तित हो जाता है।
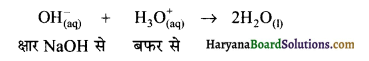
चूँकि जल एक दुर्बल वैद्युत अपघट्य है। अतः यह भी बहुत कम मात्रा में आयनित होता है अर्थात् बफर द्वारा दिये गये H3O+ आयनों ने क्षार से प्राप्त होने वाले OH– आयनों के प्रभाव को निरस्त कर देता है। इस प्रकार बफर विलयन में क्षार को कुछ मात्रा डालने पर भी उसके pH मान में परिवर्तन नहीं होता है।
यह याद रखने योग्य बात है कि बफर अपनी आरक्षित अम्लता को क्षार के विरुद्ध एवं आरक्षित क्षारकता को अम्ल के विरुद्ध काम में लाता है। इस प्रकार यह विलयन में pH में होने वाले परिवर्तन का विरोध करता है।
(B) क्षारीय बफर (Basic Buffer) – ये दुर्बल क्षार एवं इसके प्रबल अम्ल से बने लवण का मिश्रण होते हैं। यहाँ पर दोनों ही सम मोलर सान्द्रताओं में मिले होते हैं इसका उदाहरण निम्न प्रकार है।
उदाहरण –
- अमोनियम हाइड्रॉक्साइड (NH4OH) + अमोनियम क्लोराइड (NH4Cl)
- अमोनियम हाइड्रॉक्साइड (NH4OH) + अमोनियम नाइट्रेट (NH4NO3)
- अमोनियम हाइड्रॉक्साइड (NH4OH) + अमोनियम सल्फेट [(NH4)2SO4]
क्षारीय बफर की बफर क्रिया (Buffer Action of Basic Buffer) – क्षारीय बफर की बफर क्रिया के अध्ययन के लिये अमोनियम हाइड्रॉक्साइड (NH4OH) तथा अमोनियम क्लोराइड (NH4Cl) का उदाहरण लेते हैं। विलयन में दोनों सम मोलर सान्द्रताओं के अनुरूप मिलते हैं। जलीय विलयन में क्षार दुर्बल होने के कारण बहुत कम मात्रा में आयनित होता है जबकि लवण पूर्णतः आयनित होता है।
उपरोक्त विलयन में कुछ मात्रा में HCl डालने पर HCl आयनित होकर H3O+ आयन देता है जो विलयन में उपस्थित OH– आयनों से क्रिया करके H2O बनाता है।

अतः क्षारीय बफर से HCl का योग होने पर भी विलयन के pH के मान में कोई परिवर्तन नहीं होता है क्योंकि H2O एक दुर्बल वैद्युत अपघट्य है जो कि कम मात्रा में आयनित हो पाता है।
अब यदि क्षारीय बफर में कुछ मात्रा में क्षार (NaOH) डालते हैं तो यह आयनित होकर OH– आयनों को देता है ये OH– आयन विलयन में पहले से उपस्थित NH4+ आयनों से क्रिया करके NH4OH बनाते हैं जो कि दुर्बल क्षार होने के कारण कम मात्रा में आवनित होता है।
इस प्रकार अम्लीय एवं क्षारीय दोनों प्रकारों के बफर विलयनों में कुछ मात्रा में प्रबल अम्ल तथा प्रबल क्षार डालने पर भी pH का मान परिवर्तित नहीं होता है।
प्रश्न 33.
ऊष्मीय वियोजन व विद्युत वियोजन में अन्तर लिखें।
उत्तर:
| ऊष्मीय वियोजन | विद्युत वियोजन |
| 1. यौगिक को उ़च्च ताप पर गर्म करने पर ऊष्मीय वियोजन (thermal dissociation) होता है; जैसे- NH4Cl ⇌ NH3 + HCl |
यौगिकों को ध्रुवीय विलायक में घोलने पर विद्युत वियोजन होता है: जैसे- NaCl ⇌ Na+ + Cl– |
| 2. ऊष्मीय वियोजन में माध्यम आवश्यक नहीं है। | विद्युत वियोजन में जल या अन्य कोई आयनीकारक द्रव जैसा माध यम आवश्यक है। |
| 3. इस वियोजन में उदासीन अणु प्राप्त होते हैं। | इस वियोजन से विपरीत विद्युत आवेशयुक्त आयन प्राप्त होता है। |
| 4. भौतिक विधियों द्वारा पदार्थ तथा उसके वियोजन उत्पाद को पृथक किया जा सकता है। | पदार्थ को आयनन से भौतिक विधि द्वारा अलग नहीं किया जा सकता; क्योंकि आवेशित होने के कारण ये बँधे रहते हैं। |
| 5. तनुता का इस वियोजन की मात्रा पर प्रभाव नहीं पड़ता है। | तनुता से इस वियोजन की मात्रा बढ़ती है। |
प्रश्न 34.
वे गैसीय अभिक्रियाएँ जिनमें ∆n = 0 है, को प्रभावित करने वाले कारकों को बताएँ।
उत्तर:
(∆n = 0) रखने वाली गैसीय अभिक्रियाओं के साम्य पर निम्नलिखित कारक प्रभाव डालते हैं।
1. दाब (Pressure) दाब परिवर्तित करने पर साम्य पर कोई प्रभाव नहीं पड़ेगा क्योंकि अभिक्रिया में उत्पादों की संख्या व अभिकारकों की संख्या समान होती है। यहाँ पर Kp = Kc भी होता है। यदि साम्य मिश्रण पर दाब परिवर्तित कर दिया जाता है तो प्रत्येक क्रियाकारक और प्रत्येक उत्पाद का आंशिक दाब भी उसी अनुपात में परिवर्तित हो जाता है।
2. सान्द्रता (Concentration ) यदि साम्यावस्था पर अभिकारकों की सान्द्रता को बढ़ा दिया जाय तो अभिक्रिया दायीं तरफ विस्थापित होगी अर्थात् अधिक मात्रा में उत्पाद बनेंगे और उत्पादों की सान्द्रता बढ़ा दिया जिससे स्थिरांक का मान स्थिर रहता है।
जाय तो अभिक्रिया बार्यी तरफ विस्थापित होगी अर्थात् अधिक मात्रा में अभिकारक बनेंगे जिससे कि बढ़ायी गयी मात्रा उपयोग में लायी जा सके।
3. अक्रिय गैस का योग (Addition of Inert Gas) – साम्यावस्था पर अक्रिय गैस को मिलाने पर कोई प्रभाव नहीं होगा चाहे गैस को स्थिर दाब पर मिलाएँ चाहे इसे स्थिर आयतन पर मिलाएँ।
प्रश्न 35.
निम्न का कारण बतायें-
(i) तूफानी दिनों में कपड़े शीघ्र सूखते हैं।
(ii) आर्द्र दिनों में अधिक पसीना आता है।
उत्तर:
(i) जब गीले कपड़ों को सुखाया जाता है, तो कपड़े में से जल का वाष्पन होता है, और वातावरण की वायु संतृप्त होकर सूखने की प्रक्रिया में बाधा पहुँचाती है। तूफानी दिनों में वायु के प्रवाह के कारण आसपास की गीली वायु को शुष्क वायु विस्थापित कर देती है जिससे और आगे वाष्पन में सहायता मिलती है। अतः तूफानी दिनों में कपड़े शीघ्र सूखते हैं।
(ii) आर्द्र दिनों में वायु पहले से ही जल वाष्प से संतृप्त होती है। इसका अर्थ है कि शरीर के रोम कूपों से निकलने वाला पसीना वाष्पित नहीं हो पाता है। इस कारण आर्द्र दिनों में अधिक पसीना निकलता है।
आंकिक प्रश्न
प्रश्न 1.
निम्न समीकरणों के लिये साम्य नियतांक के व्यंजक लिखें-
(i) BaCO3(s) ⇌ BaO(s) + CO2(g)
(ii) CH3COCH3(l) ⇌ CH3COCH3(g)
(iii) Al(s) + 3H+(aq) ⇌ Al3+(aq) + \(\frac {3}{2}\)H2(g)
(iv) AgCl(s) ⇌ Ag+(aq) + Cl–(aq)
(v) HPO42-(aq) + H2O(l) ⇌ H3O+(aq) + PO43-(aq)
हल:
(i) BaCO3(s) ⇌ BaO(s) + CO2(g)
Kc = [CO2] तथा Kp = PCO2
प्रश्न 2.
निम्न अभिक्रियाओं में Kp तथा Kc में सम्बन्ध बतायें।
(1) N2(g) + 3H2(g) ⇌ 2NH3(g)
(2) H2(g) + I2(g) ⇌ 2HI(g)
(3) PCl5(g) ⇌ PCl3(g) + Cl2(g)
हल:
(1) N2(g) + 3H2(g) ⇌ 2NH3(g)
∆n = 2 – 4 = – 2
Kp = Kc(RT)∆n
Kp = Kc(RT)-2
(2) H2(g) + I2(g) ⇌ 2HI(g)
∆n = 2 – 2 = 0
Kp = Kc(RT)0
Kp = Kc
(3) PCl5(g) ⇌ PCl3(g) + Cl2(g)
∆n = 2 – 1 = 1
Kp = Kc(RT)∆n
Kp = Kc(RT)1
प्रश्न 3.
यदि किसी साम्य अभिक्रिया के लिये अग्र तथा पश्च अभिक्रियाओं के वेग स्थिरांक क्रमशः 2.38 10 तथा 8.15 × 10-5 हों तो इस अभिक्रिया के साम्य स्थिरांक की गणना करो।
हल:
साम्य स्थिरांक = \(\frac{\mathrm{K}_f}{\mathrm{~K}_b}\)
= \(\frac{2.38 \times 10^{-5}}{8.15 \times 10^{-5}}\)
= 2.92
प्रश्न 4.
298K ताप पर यदि निम्न अभिक्रिया के लिये साम्य स्थिरांक 2.0 x 1015 है।
Cu(s) + 2Ag+(aq) ⇌ Cu2+(aq) + 2Ag(s)
एक विलयन में जिसमें कॉपर कुछ सिल्वर आयनों को विलयन में से विस्थापित करता है, Cu2+ आयन की सान्द्रता 18 x 10-2mol L-1 है तथा Ag+ आयन की सान्द्रता 3.0 x 10-9 mol L– है। क्या यह निकाय साम्यावस्था में है।
हल:
अभिक्रिया

Qc का मान साम्य स्थिरांक के बराबर है अतः अभिक्रिया साम्यावस्था में होगी।
प्रश्न 5.
2 मोल PCl5 को 4 ली० के एक पात्र में गर्म किया गया। साम्यावस्था पर इसका वियोजन 50% PCl3 तथा Cl2 में हो गया। साम्य स्थिरांक की गणना करें।
हल:
साम्यावस्था पर PCl5 के वियोजित मोलों की संख्या x = 50%

प्रश्न 6.
10 मोल H2 की अभिक्रिया 5 मोल I2 से कराने पर 8 मोल HI उत्पन्न होता है तो अभिक्रिया के साम्य स्थिरांक की गणना करें।
हल:

प्रश्न 7.
ग्लाइकोलाइसिस में ग्लूकोज के फास्फो-राइलेशन के लिये ∆G° का मान 13.8 kJ /mol है। 298 K ताप पर Kc की गणना करो।
हल:

प्रश्न 8.
700 K ताप पर अभिक्रिया,
H2(g) + I2(g) ⇌ 2HI(g) के लिये K = 50.2 है।
0.50 atm HI तथा H2 एवं 12 में प्रत्येक के 0.02 atm से मिलकर बने मिश्रण में क्या कोई अभिक्रिया होगी। यदि ऐसा है तो क्या HI व्यय होगा या निर्मित होगा।
हल:
माना अभिक्रिया भागफल (Qp) = \(\frac{\left(\mathrm{P}_{(\mathrm{HI})}\right)^2}{\mathrm{P}_{\left(\mathrm{H}_2\right)} \mathrm{P}_{\left(\mathrm{I}_2\right)}}\)
= \(\frac{(0.50)^2}{(0.02)(0.02)}=\frac{0.5 \times 0.5}{0.02 \times 0.02}\) = 625
यहाँ पर Kp = 50·2 है जिससे सिद्ध होता है कि अभिक्रिया साम्यावस्था में नहीं है। साम्यावस्था प्राप्त करने के लिये HI का व्यय होगा।
प्रश्न 9.
1020 K ताप पर एक पात्र में 0.6 atm दाब पर CO2 है। कुछ CO2 ग्रेफाइट के योग पर CO में परिवर्तित हो जाता है। यदि साम्यावस्था पर कुल दाब 0.8 atm है तो Kp की गणना करो।
हल:
CO2(g) + C(s) ⇌ 2CO(g)
अभिक्रिया होने के पश्चात् माना CO2(g) के दाब में कमी = p atm
CO(g) की दाब वृद्धि = 2p atm
साम्यावस्था पर
कुल दाब = (0.6 – p + 2p) = 0.6 + p atm
वास्तविक दाब = 0.8 atm
0.6 + p = 0.8
p = 0.8 – 0.6
p = 0.2 atm
PCO = 2p = 2 × 0.2 = 04 atm ; PCO2 = 0.6 – p’
= 0.6 – 0.2 = 0.4 atm
Kp = \(\frac{\left(\mathrm{P}_{\mathrm{CO}}\right)^2}{\mathrm{P}_{\mathrm{CO}_2}}\)
Kp = \(\frac{0.4 \times 0.4}{0.4}\) = 0.4 atm
प्रश्न 10.
N2 + 2O2 ⇌ 2NO2 के लिये निश्चित ताप पर साम्य स्थिरांक के घटक लिखो तथा साम्य स्थिरांक के साम्य स्थिरांक 100 mol-1 L है। नीचे दी गयी अभिक्रियाओं के लिये अलग-अलग साम्य स्थिरांक के घटक लिखो तथा साम्य स्थिरांक के मान की गणना करो।
(i) 2NO2 ⇌ N2 + 2O2
(ii) NO2 ⇌ \(\frac {1}{2}\)N2 + 2O2
हल:
अभिक्रिया,
N2 + 2O2 ⇌ 2NO2 के लिये
K1 = \(\frac{\left[\mathrm{NO}_2\right]^2}{\left[\mathrm{~N}_2\right]\left[\mathrm{O}_2\right]^2}\) = 100 … (1)
अभिक्रिया,
2NO2 ⇌ N2 + 2O2 के लिये K2 = \(\frac{\left[\mathrm{N}_2\right]\left[\mathrm{O}_2\right]^2}{\left[\mathrm{NO}_2\right]^2}\) … (2)
समीकरण (2) के साम्य स्थिरांक को व्युत्क्रम करने पर

प्रश्न 11.
एक निश्चित ताप पर N2O4 का वाष्प घनत्व 30 पाया गया। N2O4 की वियोजन की प्रतिशत मात्रा ज्ञात करें।
हल:
N2O4 का अणु भार = 2 × 14 + 4 × 16 = 92
वाष्प घनत्व (D) = \(\frac {92}{2}\) = 46
N2O4 का वियोजन निम्न प्रकार होता है-
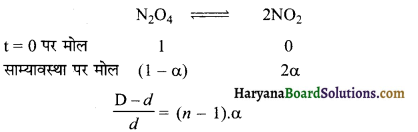
D = आरम्भ में वाष्प घनत्व = 46,
d = साम्यावस्था पर वाष्प घनत्व = 30
n = एक अणु के वियोजन से बने अणुओं की संख्या = 2, α, वियोजन की मात्रा
α.(n – 1) = \(\frac{D-d}{d}=\frac{46-30}{30}=\frac{16}{30}\)
α(2 – 1) = \(\frac {16}{30}\) = 0.533 = 53.3 %
![]()
प्रश्न 12.
अभिक्रिया CaCO3(s) ⇌ CaO(s) + CO2(g) के लिये 700°C ताप पर P = 1.20 atm है। यदि 20.0 g CaCO3 को 10 L के फ्लास्क में रखें तथा इसे 800°C तक गर्म करें तो साम्य पर CaCO3 की कितनी प्रतिशतता अनअभिक्रियाकृत (Unreacted) रहेगी।
हल:
CaCO3(s) ⇌ CaO(s) + CO2(g)
Kp = PCO2
= 1.20 atm
हम जानते हैं,
PV = nRT
n = \(\frac {PV}{RT}\)
= 0.15 मोल
निर्मित CO2 के मोलों की संख्या = 0.15 mol
वियोजित CaCO3 के मोल = 0.15 mol
प्रारम्भ में CaCO3 के मोलों की संख्या

अवियोजित बचे COCO3 की प्रतिशतता = 100 – 75 = 25%
प्रश्न 13.
सिद्ध करें कि 500 K ताप पर PCl5 का 50% वियोजन प्राप्त करने के लिये आवश्यक दाब आंकिक रूप से Kp के मान का तीन गुना होता है।
हल:

प्रश्न 14.
100 लीटर के पात्र में 1 मोल N2 तथा 3 मोल PCl5 को 227°C तक गरम किया गया। साम्यावस्था पर दाब 2.05 atm है। गैसों का आदर्श व्यवहार मानते हुए PCl5 की वियोजन मात्रा एवं अभिक्रिया PCl5 ⇌ PCl3 + Cl2 के लिए Kp की गणना कीजिए।
हल:
N2 के एक मोल के साथ PCl5 के 3 मोल गरम किए जाते हैं। तो यह PCl3 एवं Cl2 में वियोजित होता है। माना कि साम्यावस्था पर PCl5 के 3 मोल मैं से x मोल PCl3 एवं Cl2 में वियोजित होते हैं।

साम्यावस्था पर कुल मोलों की संख्या
(n) = 1 + 3 – x + x + x
n = 4 + x
साम्य दाब (P) = 2.05 atm
आयतन (V) = 100 litre
R = 0.0821 lit atm deg-1 mole-1
T = 227 + 273 = 500K
आदर्श गैस के लिए – PV = nRT
2.05 × 100 = (4 + x) x 0.0821 × 500
4 + x = 4.99
∴ x ≈ 1
PCl5 की वियोजन मात्रा (α)

प्रश्न 15.
250°C एवं 2 वायुमण्डल दाब पर PCl5 का 68.6% वियोजन होता है। इस ताप पर PCl5 के वियोजन से साम्य स्थिरांक की गणना कीजिए।
हल:
माना कि PCl5 के एक मोल को 250°C पर गर्म किया जाता है तो साम्यावस्था पर PCl5 के एक मोल में से \(\frac {68.6}{100}\) अर्थात् 0.686 मोल PCl3 एवं Cl2 में विभाजित हो जाते हैं।

साम्य पर मिश्रण के कुल मोलों की संख्या
= (1-0.686) + (0.686) + (0.686)
द्रव्य अनुपाती क्रिया नियम के अनुसार-
Kp = \(\frac{\left(\mathrm{P}_{\mathrm{PCl}_3}\right) \times\left(\mathrm{P}_{\mathrm{Cl}_2}\right)}{\left(\mathrm{P}_{\mathrm{PCl}_5}\right)}\)
साम्य पर मिश्रण में किसी पदार्थ का आंशिक दाब

प्रश्न 16.
200°C पर PCl5 का वाष्य घनत्व 70–2 पाया गया। इस ताप पर PCl5 के प्रतिशत वियोजन की गणना कीजिये (P– 31, Cl = 35.5)
हल:
PCl5 का अणुभार = 31 + 5 x (355) = 208.5
वियोजन से पूर्व

मिश्रण का प्रेक्षित वाष्प घनत्व (d) = 70.2
PCl5 के वियोजन का समीकरण-
PCl5 ⇌ PCl3 + Cl2
अत:
n = 2
α = \(\frac{\mathrm{D}-d}{d(n-1)}\)
= \(\frac{104 \cdot 25-70 \cdot 2}{70 \cdot 2(2-1)}\) = 0.485
प्रतिशत वियोजन = 100 x α
= 100 x 0.485 = 48.5 %
प्रश्न 17.
एक मोल C2H5OH एवं एक मोल CH3COOH की क्रिया कराने पर \(\frac {2}{3}\) मोल CH3COOC2H5 बनता है। अभिक्रिया के साम्य स्थिरांक की गणना कीजिए।
हल:

प्रश्न 18.
Al(OH)3 का विलेयता गुणनफल 43.2 × 10-11 mol4 L-4 इसकी जल में विलेयता ज्ञात करें।
हल:

प्रश्न 19.
0.01 M अमोनियम ऐसीटेट विलयन की जल अपघटन की मात्रा तथा उसके pH के मान की गणना कीजिये।
(Ka = 1.75 × 10-5, Kb = 1·8 × 10-5, Kw = 1.0 × 10-14)
हल:

प्रश्न 20.
0.01 M ऐनिलीन ऐसीटेट के विलयन में इसके जल अपघटन की मात्रा ज्ञात कीजिए। यदि ऐनिलीन तथा ऐसीटिक अम्ल के वियोजन स्थिरांक क्रमश: 4.6 x 10–10 तथा 1.8 x 10 हैं। यदि उपर्युक्त के एक लीटर विलयन में 5 लीटर जल मिला दिया जाए तो जल अपघटन की मात्रा में क्या परिवर्तन होगा ?
हल:
जल अपघटन की मात्रा
h = \(\sqrt{\frac{\mathrm{K}_w}{\mathrm{~K}_a \times \mathrm{K}_b}}\)
= \(\sqrt{\frac{1 \times 10^{-14}}{1.8 \times 10^{-5} \times 4.6 \times 10^{-10}}}\)
h का 1.0 से बड़ा मान सम्भव है अतः (1 – h) को h के बराबर नहीं माना जा सकता है।

अतः जल अपघटन की मात्रा 0.523 है।
जल अपघटन की मात्रा h का व्यंजक लवण की सान्द्रता या तनुता के पद से मुक्त है अतः 5 लीटर जल मिलाने पर भी जल अपघटन की मात्रा वही रहेगी।
प्रश्न 21.
अमोनियम हाइड्रॉक्साइड के विलयन में \(\frac {M}{100}\) हाइड्रॉक्सिल आयनों की सान्द्रता क्या होगी ?
(Kb = 1.8 x 10-5
हल:

प्रश्न 22.
1.5 x 10-5 M बेरियम क्लोराइड विलयन का 15 mL 1.0 x 10-5 M सोडियम सल्फेट विलयन के 35 mL के साथ मिलाया जाता है। क्या अवक्षेप बनेगा (BaSO4 का Ksp = 1 x 10-10)
हल:
उपरोक्त अभिक्रिया के लिये Ba2+ को BaCl2 द्वारा जबकि SO42- आयन को Na2SO4 विलयन द्वारा वियोजन के फलस्वरूप प्राप्त करते हैं।
मिलाने के बाद कुल आयतन 15 + 35 = 50ml
विलयन में Ba2+ की सान्द्रता =\(\frac {15}{50}\) = 0.3
विलयन में SO42- की सान्द्रता =\(\frac {35}{50}\) = 0.7
मिलाने से पहले [Ba2+] = 1.5 x 10+5M
मिलाने के बाद [Ba2+] = 0.3 x 1.5 x 10-5
= 0.45 × 10
मिलाने से पहले [SO42-] = 1.0 x 10-5 m )
मिलाने के बाद [SO42-] = 0.7 = x 1.0 x 10-5
= 0.7 x 10-5 M
आयनिक अगुणनफल [Ba2+] [SO42-]
= 0.45 × 10-5 × 0.7 × 10-5
= 0.45 x 0.7 x 10-5
BaSO4 के Ksp का मान 1 x 10-10 है।
चूँकि [आयनिक गुणनफल] < [विलेयता गुणनफल]
अतः BaSO4 अवक्षेपित नहीं होगा।
प्रश्न 23.
298 K ताप पर Mg (OH)2 की विलेयता 8.352 x 10-3 g/100ml है Mg(OH)2 का विलेयता गुणनफल क्या होगा?
हल:
Mg(OH)2 की विलेयता
= 8352 × 10-3 g/100ml.
= 83.52 × 10-3 g/L
Mg(OH)2 का मोलर द्रव्यमान
= 24 + 2 x 17
= 24 + 34
= 58g mol-1
Mg(OH)2 की विलेयता = \(\frac{83.52 \times 10^{-3}}{58}\)
= 1.44 x 10-3 mol L-1
Mg(OH)2 का विलेयता साम्य है
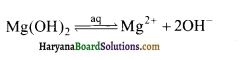
[Mg2+] = 144 x 10-3 mol L-1
[OH–] = 2 × 1.44 x 10-3 mol L-1
Ksp = [Mg2+] [OH–]²
= 144 x 10-3 x 2 x 1.44 x 10-3
= 4.1472 x 10-6 mol³ L-3
प्रश्न 24.
298 K ताप पर जल में AgCl की विलेयता 1.20 x 10-5mol L-1 है। इस ताप पर इसका विलेयता गुणनफल ज्ञात करो।
हल:
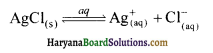
AgCl की विलेयता = 1.20 × 10-5 mol L-1
[Ag+] = 1.20 × 10-5 mol L-1
[Cl–] = 1.20 × 10-5 mol L-1
Ksp = [Ag+] [Cl–]
= 1.20 × 10-5 x 1.20 x 10-5
= 1.44 × 10-10 mol² L-5
प्रश्न 25.
0.2 मोल ऐसीटिक अम्ल को 0.20 मोल NaOH से 0.50 लीटर जल में उदासीन करने पर प्राप्त विलयन की pH ज्ञात करें।
(Ka = 1.8 × 10-5)
हल:
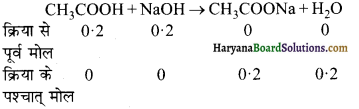
[CH3COONa] = \(\frac {0.2}{0.5}\) = 0.4 mol L-1
CH3COONa के जल अपघटन के कारण विलयन क्षारीय होगा.
CH3COO– + H2O ⇌ CH3COOH + OH–
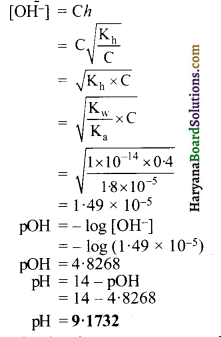
प्रश्न 26.
एक घोल में प्रत्येक Ph2+ तथा Zn2+ की सान्द्रता 0.01 M है। इनमें से केवल Ph2+ को अवक्षेपित करने के लिये H2S के सन्तृप्त घोल में कितना [H3O+] रखना चाहिये। (Kap (H2S) = 1.1 x
10-22 तथा Ksp (ZnS) = 1.0 × 10-21)।
हल:
ZnS अवक्षेपित न हो इसके लिये,
[Zn2+] [S2-] < Ksp (ZnS)
10-2[S2-] < 1.0 x 10-21
अतः [S²] = 10-19 वह अधिकतम सान्द्रता है जिस पर ZnS अवक्षेपित नहीं होगा या दूसरे शब्दों में कहें तो इस सान्द्रता शुरु हो जायेगा।
H2S ⇌ 2H+ + S2-
[H+]² [S2-] = 1.1 × 10-22
[H+]² = \(\frac{1.1 \times 10^{-22}}{10^{-19}}\)
[H+]² = 11 x 104-
[H+] = 3.3 x 10-2 mol L-1
अत: [H+] = 3.3 x 10-2 M है तो केवल Phs अवक्षेपित होगा ZnS नहीं
प्रश्न 27.
Pb(OH) की जल में विलेयता 6–7 10M है। Pb(OH)2 की pH = 8 के बफर विलयन में विलेयता ज्ञात करें।
हल:

प्रश्न 28.
pH = 9 के बफर विलयन को बनाने के लिये NH तथा NH4Cl की मात्रा की गणना करो, जबकि दोनों की मिश्रित सान्द्रता 0.6 मोल / L है। (pK (NH3) = 4.7)
हल:
माना कि (NH3 + NH4Cl) बफर विलयन में मोल NH3 के तथा b मोल NH4Cl के हैं।

b के मान को समीकरण 1 में रखने पर मोल
a + b = 0.6
a + 2a = 0.6
3a = 0.6
a = \(\frac {0.6}{3}\) = 0.2 मोल
b = 0.4 मोल
NH3 के मोल = 0.2, NH4Cl के मोल = 0.4
![]()
प्रश्न 29.
यदि HCl के 200 मिली जलीय विलयन (pH = 2) में NaOH का 300 मिली जलीय विलयन (pH = 12) मिला दिया जाये तो परिणामी pH क्या होगी?
हल:
[H+] [HCl] = 10-2
[OH–] = [NaOH] = 10-2 (∴ pH = 12; pOH = 2 )
विलयन में H+ के मिली मोल = 10-2 x 200
विलयन में OH– के मिली मोल = 10-2 x 300
विलयन में OH– के बचे मिली मोल
= (300 – 200) × 10-2
= 100 × 10-2 मिली मोल
[OH–] = \(\frac{100 \times 10^{-2}}{500}\)
कुल आयतन = 200 + 300 मिली
[OH ] = 0.2 × 10-2
pOH = 2.6989
pH = 14 – 2.6989
pH = 11.3011
प्रश्न 30.
10% अमोनिया (भार प्रतिशत विलयन) के विलयन का घनत्व 0.99 g / cm³ है। इस विलयन में OH– तथा H+ आयनों की सान्द्रता की गणना करें। (NH4+ के लिये Ka = 5.0 × 10-1010 M)
हल:

प्रश्न 31.
NaOCN के 0.002 M जलीय विलयन में जल अपघटनांक की प्रतिशतता ज्ञात कीजिये। HOCN के लिये (Ka = 3.33 × 10-4 M)
हल:

प्रश्न 32.
250 ml जलीय विलयन में Ca(OH)2 के कितने मोल होंगे यदि उस विलयन की pH = 10.65 हो। Ca(OH)2 का पूर्ण विघटन होता है।
हल:
माना कि 250ml जल में Ca(OH)2 के a मोल उपस्थित हैं।
Ca(OH)2 की मोलरता = \(\frac{a \times 1000}{250}\) = 4a
[OH–] = 2 × 4a
– log [OH–] = – log 8a
pOH = 3.35 = – log 8a
a = 5.58 × 10-5 mol/ 250ml.
प्रश्न 33.
\(\frac { N }{ 1000 }\) NaOH विलयन की pH कितनी होगी?
हल:
\(\frac { N }{ 1000 }\) NaOH ≈ \(\frac { N }{ 1000 }\) NaOH = 10-3N NOOH
∴ [NaOH] = -3 N
NaOH → Na+ + OH–
10-3N 10-3N
[OH–] = 10-3
[H+][OH–] = 10-14
[H+] = \(\frac{10^{-14}}{10^{-3}}\)
pH = – log [H+]
= – log 10-11
pH = 11
प्रश्न 34.
10-4 M HCl की pH क्या होगी?
हल:
HCl → H+ + Cl–
10-4M 10-4 M
[H+] = 10-4 M
pH = – log [H+]
= – log 10-4
pH = + 4
प्रश्न 35.
0.00001 M H2SO4 विलयन की pH क्या होगी।
हल:

प्रश्न 36.
किसी मोनोबेसिक अम्ल का pH मान 6.99 है। [H+] की सान्द्रता ज्ञात करें।
हल:
pH = 6.99
pH = – log [H+]
[H+] = Antilog (- pH)
= Antilog (- 6.99)
= Antilog (\(\bar { 7 }\).001)
[H+] = 1.023 x 10-7
प्रश्न 37.
0.001 M Ba(OH)2 विलयन की pH ज्ञात करें।
हल:

प्रश्न 38.
किसी 0.42 g प्रति लीटर वाले H2SO4 विलयन के pH की गणना करें।
हल:

प्रश्न 39.
0.2 M ऐसीटिक अम्ल के विलयन का pH मान ज्ञात करो। CH3COOH का वियोजन स्थिरांक Ka =1.8-5 है।
हल:
[H+] = C α ; α = \(\sqrt{\frac{\mathrm{K}_{\mathrm{a}}}{\mathrm{C}}}\)
α = \(\sqrt{\frac{1.8 \times 10^{-5}}{0 \cdot 2}}\)
α = \(\sqrt{9 \times 10^{-5}}\)
α = \(\sqrt{90 \times 10^{-6}}\)
α = 9.487 x 10-3
α = 0.0095
[H+] = C α
= 0·2 × 0.0095
= 0.0019 M
[H+] = 0.0019
pH = – log [H+]
= – log (0·0019)
pH = 2.72
प्रश्न 40.
यदि ऐसीटिक अम्ल का 0.001 M विलयन 5% वियोजित होता है तो इस विलयन की pH क्या होगी?
हल:
[CH3COOH] = 0.001 M
वियोजन मात्रा (α) = 5%
= \(\frac {5}{100}\) = 0.05
परन्तु ऐसीटिक अम्ल के लिये
[H+] = Cα
= 0·001 0·05
= 5 × 10-5
pH = – log [H+]
= – log 5 × 10-5
= – [log 5 + log 10-5]
= – [0·699 – 5]
pH = 4.301
![]()
प्रश्न 41.
50 ml 0.1 M NaOH तथा 50 ml 0.05M CH3COOH के मिश्रण की pH क्या होगी?
हल:
NaOH + CH3COOH → CH3COONa+ H2O
1M 1M
एक मोल NaOH, 1 मोल CH3COOH से क्रिया करता है।
NaOH के मिली मोलों की संख्या
= M x V
= 0.1 x 50
= 5 मिली मोल
CH3COOH के मिली मोलों की संख्या
= M × v
= 0.05 × 50
= 2.5 मिली मोल
NaOH के 5 मिली मोल एवं CH3COOH के 2.5 मिली मोल में अभिक्रिया होने के पश्चात् NaOH के 2.5 मिली मोल शेष रहते हैं।
अतः शेष बचे NaOH की मोलरता

प्रश्न 42.
एक निश्चित ताप पर यदि जल के आयनिक गुणनफल (Kw) का मान 25 x 10-14 हो तो pH की गणना करें।
हल:
Kw = 25 × 10-14
∴ [H+] = [OH–] ( जल उदासीन है)
[H+][OH–] = Kw
[H+] [H+] = 25 × 10-14
[H+]² = 25 × 10-14
[H+] = \(\sqrt{25 \times 10^{-14}}\) = 5 × 10-7
pH = log [H+] = – log 5 x 10-7
pH = – [log 5 + log 107]
pH = – [0.699 – 7]
pH = 6.301
प्रश्न 43.
एक विलयन का pH मान 3 है। इसे कितने गुना तनु किया जाये कि इसका pH मान 6 हो जाये।
हल:
आरम्भ में विलयन का pH = 3
[H+] = 10-pH
= 10-3
तनु करने के पश्चात् pH = 6,
[H+] = 10-pH = 10-6
अर्थात् विलयन में हाइड्रोजन आयन की सान्द्रता 10-3 से घटाकर 10-6 करने के लिये विलयन को 1000 गुना तनु करना होगा।