Haryana State Board HBSE 11th Class Physics Important Questions Chapter 12 ऊष्मागतिकी Important Questions and Answers.
Haryana Board 11th Class Physics Important Questions Chapter 12 ऊष्मागतिकी
अति लघु उत्तरीय प्रश्न (Very Short Answer Type Questions)
प्रश्न 1.
क्या विलगित निकाय का ताप परिवर्तित हो सकता है ?
उत्तर:
हाँ; रुद्धोष्म प्रक्रम में विलगित निकाय का ताप परिवर्तित हो सकता है।
प्रश्न 2.
संलग्न चित्र में किसी गैस के लिए P-Vवक्र AB व AC प्रदर्शित है। बताइये इनमें कौन सा वक समतापीय एवं कौन-सा टोम वक्र है ?
उत्तर:
समतापीय वक्र कम ढाल एवं रुद्धोष्म वक्र दाब (P) अधिक ढाल वाले होते हैं।
अतः
AB – समतापीय वक्र
एवं AC – रुद्धोष्म वक्र
प्रश्न 3.
यदि दो निकाय A व B किसी तीसरे निकाय C से अलग-अलग ऊष्मीय साम्य अवस्था में हैं तो A व B क्या आपस में भी ऊष्मीय साम्य अवस्था में होंगे ?
उत्तर:
हाँ; ऊष्मागतिकी के शून्यांकी के नियमानुसार ।
![]()
प्रश्न 4.
क्या ऊष्मागतिकी के प्रथम नियम से किसी क्रिया के होने की दिशा का ज्ञान हो सकता है ?
उत्तर;
नहीं।
प्रश्न 5.
मेयर का सम्बन्ध लिखिए ।
उत्तर:
मेयर सम्बन्ध = CP – CV= R
जहाँ CP = नियत दाब पर गैस की मोलर विशिष्ट ऊष्मा
CV = नियत आयतन पर गैस की मोलर विशिष्ट ऊष्मा
R = सार्वत्रिक गैस नियतांक
प्रश्न 6.
किसी आदर्श गैस के रुद्धोष्म प्रसार में P व V के मध्य सम्बन्ध लिखिए ।
उत्तर:
PVγ जहाँ γ = \(\frac{C_P}{C_V}\)
प्रश्न 7.
ऊष्मा इंजन की दक्षता की विमा क्या होती है ?
उत्तर:
ऊष्मा इंजन की दक्षता
η = \(\frac{W}{Q_1}\) जहाँ W= कृत कार्य; Q1 = स्रोत से ली गई ऊष्मा
∵ W एवं Q की विमाएँ समान है, अतः दक्षता η विमाहीन राशि है।
∴ η का विमीय सूत्र [ M°LOT]
प्रश्न 8.
समदाबीय प्रक्रम में निकाय की अवस्था परिवर्तन से दाब में क्या परिवर्तन होता है ?
उत्तर:
समदाबीय प्रक्रम में दाब नहीं बदलता है अतः दाब में परिवर्तन ∆P = 0
![]()
प्रश्न 9.
क्या किसी गैस के ताप में वृद्धि बिना ऊष्मा दिये की जा सकती है ?
उत्तर:
हाँ, रुद्धोष्म सम्पीडन में गैस पर किया गया कार्य निकाय का ताप बढ़ाता है क्योंकि कृत कार्य ऊष्मा में बदलकर आन्तरिक ऊर्जा में वृद्धि करता है।
प्रश्न 10.
ऊष्मागतिकी का शून्य नियम किस ऊष्मागतिकी चर को परिभाषित करता है ?
उत्तर:
ताप को ।
प्रश्न 11.
समतापीय व रुद्धोष्म प्रक्रम में किसी गैस की विशिष्ट ऊष्मा क्या होती है ?
उत्तर:
विशिष्ट ऊष्मा S = \(\frac{Q}{m.∆T}\)
समतापी प्रक्रम में ∆T = 0. ∴ S = ∞ (अनन्त)
रुद्धोष्म प्रक्रम में Q = 0 ∴ S = 0 (शून्य)
प्रश्न 12.
कार्नो चक्र किस प्रकार का प्रक्रम है ?
उत्तर:
कान चक्र उत्क्रमणीय चक्रीय प्रक्रम है।
प्रश्न 13.
कार्नो इंजन की दक्षता किस पर निर्भर करती हैं ?
उत्तर:
कान इंजन की दक्षता,
η = \(1-\frac{T_2}{T_1}\)
अतः दक्षता स्रोत के ताप (T1) व सिंक के ताप (T2) पर निर्भर करती है।
प्रश्न 14.
बन्दूक से चली गोली लक्ष्य से टकरा कर गर्म हो जाती है। क्यों ?
उत्तर:
लक्ष्य से टकराने पर गोली की गतिज ऊर्जा ऊष्मीय ऊर्जा में बदल जाती है, इसलिए गोली गर्म हो जाती है।
प्रश्न 15.
मोम का जलना कौन-सा परिवर्तन है ?
उत्तर:
मोम का जलना समतापी प्रक्रम है क्योंकि ताप नियत रहता है।
प्रश्न 16.
आन्तरिक ऊर्जा के कौन-कौन से स्वरूप हैं ?
उत्तर:
अणुओं की स्थानान्तरीय गतिज ऊर्जा, आन्तरिक घूर्णन ऊर्जा तथा काम्पनिक ऊर्जा; आन्तरिक स्थितिज ऊर्जा आदि ।
![]()
प्रश्न 17.
आदर्श गैस को स्थिर ताप पर संपीडित करने पर आन्तरिक ऊर्जा में क्या परिवर्तन होगा ?
उत्तर:
कोई परिवर्तन नहीं होगा क्योंकि आदर्श गैस की आन्तरिक ऊर्जा केवल ताप पर निर्भर करती है।
प्रश्न 18.
चक्रीय प्रक्रम से आप क्या समझते हैं ?
उत्तर:
वह प्रक्रम जिसमें कोई निकाय विभिन्न अवस्थाओं से होता हुआ पुनः अपनी प्रारम्भिक अवस्था में आ जाता है, चक्रीय प्रक्रम कहलाता है।
प्रश्न 19.
किसी गैस के रुद्धोष्म संपीडन में गैस के बाहर से कोई ऊष्मा नहीं दी जाती है पर गैस का ताप बढ़ जाता है क्यों ?
उत्तर:
रुद्धोष्म संपीडन में गैस पर किया गया कार्य ऊष्मा में बदल जाता है, इसीलिए गैस का ताप बढ़ जाता है।
प्रश्न 20.
स्थैतिक कल्प प्रक्रम से क्या तात्पर्य है ?
उत्तर;
किसी ऊष्मागतिक निकाय में चलने वाला कोई ऐसा प्रक्रम, जिसकी प्रत्येक स्थिति में निकाय बाह्य परिवेश के साथ तापीय व यान्त्रिक साम्य में रहता है, स्थैतिक कल्प प्रक्रम कहलाता है।
प्रश्न 21.
मुक्त निकाय किसे कहते हैं ?
उत्तर:
यह ऐसा निकाय होता है, जो बाह्य परिवेश ऊर्जा तथा पदार्थ दोनों का आदान-प्रदान कर सकता है
प्रश्न 22.
बन्द निकाय किसे कहते हैं ?
उत्तर:
ऐसा निकाय जो परिवेश के साथ केवल ऊर्जा का आदान-प्रदान कर सकता है, पदार्थ का नहीं बन्द निकाय कहलाता है।
प्रश्न 23.
समतापी प्रक्रम के उदाहरण दीजिए।
उत्तर:
बर्फ का गलना, ठोसों का पिघलना, द्रवों का उबलना आदि।
![]()
प्रश्न 24.
प्रावस्था समीकरण किसे कहते हैं ?
उत्तर:
किसी ऊष्मागतिक निकाय के लिए ऊष्मागतिक चरों (P., V, T) के मध्य सम्बन्ध को प्रावस्था समीकरण कहते हैं।
प्रश्न 25.
ऊष्मा इंजन क्या है ?
उत्तर:
ऊष्मा इंजन चक्र (cycle) में काम करने वाली एक ऐसी युक्ति है जो अविरत रूप से ऊष्मा को यान्त्रिक कार्य में परिवर्तित करती हैं।
प्रश्न 26.
ऊष्मा इंजन की दक्षता की परिभाषा लिखिए।
उत्तर:
किसी ऊष्मा इंजन द्वारा प्रदत्त यान्त्रिक कार्य (W) एवं इंजन द्वारा स्त्रोत से ली गई ऊष्मा (Q) के अनुपात को इंजन की दक्षता कहते हैं और इसे ” से व्यक्त करते हैं। अतः
η = \(\frac{W}{Q}\)
प्रश्न 27.
दो दिये गये तापों T1 तथा T2(T1 > T2) के मध्य कार्य करने वाले कार्यों की दक्षता बताइये।
उत्तर:
कानों इंजन की दक्षता
η = \(1-\frac{T_2}{T_1}\)
प्रश्न 28.
कार्नो इंजन की दक्षता किस राशि पर निर्भर करता है ?
उत्तर:
केवल उन तापों पर निर्भर करती है जिनके बीच कार्नो इंजन कार्य कर रहा है।
प्रश्न 29.
क्या कानों इंजन की दक्षता कार्यकारी पदार्थ पर निर्भर करती है ?
उत्तर:
नहीं।
![]()
प्रश्न 30.
ऊष्मा पम्प किसे कहते हैं ?
उत्तर:
किसी ठण्डे स्थान से ऊष्मा लेकर गर्म स्थान को देने वाली युक्ति को ऊष्मा पम्प कहते हैं।
प्रश्न 31.
T1वे T2(T1 > T2) के मध्य करने वाले प्रशीतक के निष्पादन गुणांक का सूत्र लिखिए ।
उत्तर:
कानों के आदर्श प्रशीतक का निष्पादन गुणांक
ß = \(\frac{T_2}{T_1-T_2}\)
प्रश्न 32.
ऊष्मागतिकी के द्वितीय नियम का क्लॉसियस का प्रकथन बताइये ।
उत्तर:
इस कथन के अनुसार कोई ऐसा प्रक्रम सम्भव नहीं है जिसके द्वारा बिना बाह्य कार्य के किसी शीतल वस्तु से किसी तप्त वस्तु की ऊष्मा स्थानान्तरित की जा सके।
प्रश्न 33.
ऊष्मागतिकी के द्वितीय नियम का केल्विन प्लांक कथन बताइये ।
उत्तर:
इस कथन के अनुसार ऐसा कोई प्रक्रम सम्भव नहीं है जो किसी ऊष्मा भण्डार से ली गयी ऊष्मा को पूर्णतः कार्य में बदल सके।
प्रश्न 34.
कोई ऊष्मा इंजन एक चक्र में स्रोत से Q1 ऊष्मा लेता है तथा सिंक को Q2 ऊष्मा दे देता है। इंजन की दक्षता बताइये ।
उत्तर:
ऊष्मा इंजन की दक्षता
η = (\(1-\frac{Q_2}{Q_1}\))
![]()
प्रश्न 35.
क्या कानों इंजन को व्यवहार में प्राप्त किया जा सकता है ?
उत्तर:
नहीं; यह एक आदर्श इंजन है जो व्यवहार में प्राप्त कर पाना में सम्भव नहीं है।
प्रश्न 36.
क्या किसी निकाय की सम्पूर्ण आन्तरिक ऊर्जा को कार्य में बदला जा सकता है ?
उत्तर:
नहीं।
लघु उत्तरीय प्रश्न (Short Answer Type Questions)
प्रश्न 1.
CP का मान CV से अधिक होता है, क्यों ?
उत्तर:
मोलर विशिष्ट ऊष्मा की परिभाषा से-

प्रश्न 2.
क्या किसी गैस को ऊष्मा दिये बिना उसके ताप में वृद्धि सम्भव है ?
उत्तर:
हाँ जब गैस का रुद्धोष्म संपीडन किया जाता है तो उसका ताप बढ़ जाता है।
प्रश्न 3.
सिद्ध कीजिए कि दो दिये गये तापों के बीच कार्य करने वाला कोई भी इंजन उन्हीं तापों के मध्य कार्य करने वाले उत्क्रमणीय इंजन से अधिक दक्ष नहीं हो सकता है।
उत्तर:
कार्नो प्रमेय (Carnot’s Theorem)
इस प्रमेय के अनुसार,
(अ) किन्हीं तापों T1 व T2 (T1 > T2) के मध्य कार्य करने वाले इंजन की दक्षता उन तापों के मध्य कार्य करने वाले कार्नो इंजन की दक्षता से अधिक नहीं हो सकती है अर्थात् कार्नो (उत्क्रमणीय) इंजन की दक्षता अधिकतम होती है।
(ब) किन्हीं दो तापों T1 व T2 के मध्य कार्य करने वाले सभी कार्नो उत्क्रमणीय इंजनों की दक्षता समान होती है चाहे कोई भी कार्यकारी पदार्थ लिया जाये।
प्रश्न 4.
भाप का अतितप्त होना समदाबी प्रक्रम है या समतापी और क्यों ?
उत्तर:
भाप का अतितप्त होना समदाबी प्रक्रम है, क्योंकि भाप को ऊष्मा देते रहने पर भाप ताप बढ़ता है लेकिन दाब नियत रहता है।
प्रश्न 5.
जब एक कार का पहाड़ी पर एक नियत चाल से नीचे उतरती है तो ब्रेक ड्रम गर्म हो जाते हैं क्यों ?
उत्तर:
नियत चाल से चलते रहने पर गतिज ऊर्जा तो नियत रहती है परन्तु . नीचे उतरने के कारण गुरुत्वीय स्थितिज ऊर्जा कम होती है जो आन्तरिक ऊर्जा में बदल जाती है जिसके कारण ड्रम गर्म हो जाते हैं।
![]()
प्रश्न 6.
किस निकाय को दी गयी ऊष्मा पूर्णतः कार्य में बदल जाती है ?
उत्तर-
समतापीय प्रक्रम में क्योंकि ताप समान रहने से आन्तरिक ऊर्जा नियत रहती है अर्थात्
dU = 0
dQ = dU + dW = 0 + dW
या dQ = dW
प्रश्न 7.
यदि गर्म वायु ऊपर उठती है, तो पहाड़ों की ऊंचाई पर समुद्र तल की अपेक्षा ठण्डी क्यों होती है ?
उत्तर:
समुद्र तल से ऊँचाई पर जाने से वायुदाब घटता है; अतः गर्म हवा के ऊपर उठने पर इसका रुद्धोष्म प्रसार होता है जिसके कारण ताप में कमी उत्पन्न होती है इसीलिए समुद्र तल की अपेक्षा पहाड़ों पर वायु ठण्डी होती है।
प्रश्न 8.
कार्नो इंजन में सिंक का ताप बढ़ने पर इंजन की दक्षता पर क्या प्रभाव पड़ेगा ?
उत्तर:
कार्नो इंजन की दक्षता η = \(1-\frac{T_2}{T_1}\)
स्पष्ट है कि सिंक का ताप T2 बढ़ने पर n का मान कम होगा।
![]()
प्रश्न 9.
क्या दो समतापी वक्र एक दूसरे को काट सकते हैं ?
उत्तर:
नहीं; क्योंकि यदि दो समतापी वक्र काटते हैं तो कटान बिन्दु पर दो भिन्न तापों पर गैस के दाब व आयतन समान होंगे जोकि सम्भव नहीं हैं।
प्रश्न 10.
परम शून्य ताप शून्य ऊर्जा का ताप नहीं होता है; समझाइये।
उत्तर:
अणुओं की स्थानान्तरीय गतिज ऊर्जा ही ताप का फलन होती है, जबकि ऊर्जा के अन्य रूप जैसे अन्तराणविक स्थितिज ऊर्जा अणुओं के मध्य लगने वाले आणविक बलों एवं आणविक दूरी पर निर्भर करती है। अतः परम शून्य ताप पर केवल अणुओं की स्थानान्तरीय गतिज ऊर्जा तो शून्य हो जाती है लेकिन आणविक ऊर्जा के अन्य रूप शून्य नहीं होते हैं। इस प्रकार परम शून्य ताप शून्य ऊर्जा का ताप नहीं है।
प्रश्न 11.
स्काई लैब पृथ्वी पर गिरते समय जल गई थी, क्यों ?
उत्तर:
वायुमण्डल में प्रवेश करने पर वायु के घर्षण के कारण स्काई लैब घर्षण के विरुद्ध कार्य होने के कारण गर्म होने लगी। जिससे उसका ताप बढ़ने लगा। जैसे-जैसे वह पृथ्वी के समीप आती गई, वायुमण्डल का घनत्व बढ़ने से घर्षण भी बढ़ता गया और फलस्वरूप ताप बढ़ते रहने से एक स्थिति में वह जलने लगी।
![]()
प्रश्न 12.
“उत्क्रमणीयता एक आदर्श इंजन की कसौटी है।” उक्त कथन की व्याख्या कीजिए।
उत्तर:
उत्क्रमणीय प्रक्रम में निकाय बाह्य परिस्थितियों में अल्प परिवर्तन से पुनः विपरीत क्रम में अपनी प्रारम्भिक स्थिति में लौट आता है फ्रान्सीसी इंजीनियर कार्नो ने उत्क्रमणीय क्रियाओं पर आधारित एक आदर्श इंजन की परिकल्पना की जिसको वास्तविक इंजन की सारी कमियों से मुक्त माना गया। इस प्रकार हम कह सकते हैं कि उत्क्रमणीयता एक आदर्श इंजन की कसौटी है, यहाँ यह भी उल्लेखनीय है कि आदर्श इंजन मात्र एक कल्पना है, यह व्यावहारिक नहीं है।
प्रश्न 13.
ऊष्मा इंजन की दक्षता की व्याख्या कीजिए।
उत्तर:
ऊष्मीय इंजन की कार्यविधि एवं दक्षता:
ऊष्मा इंजन में, कार्यकारी पदार्थ स्रोत से ऊष्मा ग्रहण कर, इस ऊष्मा का कुछ भाग कार्य के रूप में परिवर्तित कर देता है तथा शेष भाग सिंक को दे देता है एवं अपनी प्रारम्भिक अवस्था में लौट आता है। ऐसे परिवर्तनों की श्रेणी चक्र (cycle) कहलाती है। चक्र की बार-बार पुनरावृत्ति से कार्य सतत् रूप से मिलता रहता है।
माना कार्यकारी पदार्थ स्रोत से Q1 ऊष्मा लेता है तथा उसमें से Q2 ऊष्मा सिंक को दे देता है अतः कार्यकारी पदार्थ द्वारा अवशोषित ऊष्मा की मात्रा (Q1 – Q2) होगी। चूँकि कार्यकारी पदार्थ अपनी प्रारम्भिक स्थिति में लौट आता है अतः आन्तरिक ऊर्जा में परिवर्तन शून्य है।
इसलिए ऊष्मागतिकी के प्रथम नियम से,
dQ = dU + dW
लेकिन dU = 0
क्योंकि प्रारम्भिक तथा अन्तिम अवस्था एक ही है
∴ dQ = dW
या Q1 – Q2 = W …….(1)
इंजन की ऊष्मीय दक्षता (Thermal efficiency) कार्यकारी पदार्थ द्वारा एक चक्र में किये गये कुल कार्य तथा स्रोत से कार्यकारी पदार्थ द्वारा अवशोषित ऊष्मा का अनुपात होती है, अर्थात्
दक्षता (η) = \(\frac{\text { कार्य में परिवर्तित ऊष्मा }}{\text { स्रोत से अवशोषित ऊष्मा }}\)
या η = \(\frac{W}{Q_1}\)
η = \(\frac{Q_1-Q_2}{Q_1}\) (समी 1 से)
या η = \(1-\frac{Q_2}{Q_1}\) ……….(2)
समीकरण (2) से स्पष्ट है कि यदि Q2 = 0 तो η = 1 अर्थात् दक्षता 100% होगी। दूसरे शब्दों में, यदि एक ऐसा इंजन बनाया जाये, जो इस प्रकार कार्य करे कि कार्यकारी पदार्थ किसी भी चक्र में सिंक को कोई ऊष्मा न दे तो ऊष्मा का कार्य में शत-प्रतिशत रूपान्तरण हो जायेगा । परन्तु शत-प्रतिशत दक्षता का इंजन बनाना सम्भव नहीं है।
प्रश्न 14.
ऊष्मागतिकी क्या है ? ऊष्मागतिकी के शून्यांकी नियम की व्याख्या कीजिए तथा इसके महत्त्व पर प्रकाश डालिए।
उत्तर:
ऊष्मागतिकी का शून्यांकी नियम (Zeroth Law Of Thermodynamics):
इस नियम के आधार पर ताप की अविधारणा दी जाती है। इस नियम को समझने के लिए तीन निकाय A, B व C की कल्पना करते हैं निकाय A व B एक रुद्धोष्म दीवार से पृथक हैं और इनमें से प्रत्येक एक तीसरे निकाय C से एक सुचालक दीवार से सम्पर्क में हैं [ चित्र 12.3] 1 निकायों की अवस्थाएँ तब तक परिवर्तित होती हैं जब तक A व B दोनों निकाय C के साथ तापीय साम्य में नहीं आ जाते हैं।
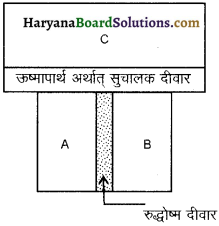
अब यदि A व B के बीच रुद्धोष्म दीवार को सुचालक दीवार से प्रतिस्थापित कर दी जाती है तथा C को A व B से किसी रुद्धोष्म दीवार से पृथक दिया जाता है। (चित्र 12.4 ) तब यह देखा जाता है कि A व B की अवस्थाएँ अब और नहीं बदलती हैं अर्थात् वे दोनों तापीय साम्य में होती है।
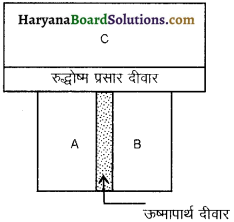
इससे ऊष्मागतिकी का शून्यांकी नियम दिया गया जिसके अनुसार, “यदि दो निकाय किसी अन्य तीसरे निकाय के साथ पृथक्-पृथक् रूप से तापीय साम्य में है तो वे परस्पर भी तापीय साम्य में होते हैं।
अतः यदि निकायों A, B व C के ताप यदि TA, TB E TC हों और TA = TC एवं TB = TC तो TA = TB।
यही ऊष्मागतिकी का शून्यांकी नियम है अतः ताप पदार्थ का वह गुण है जो यह बताता है कि कोई निकाय अपने पड़ोसी निकाय के साथ ऊष्मीय साम्य में है अथवा नहीं। इस प्रकार ऊष्मागतिकी का शून्यांकी नियम ताप की अवधारणा को प्रदर्शित करता है।
प्रश्न 15.
एक निकाय की ऊष्मा, – कार्य व आन्तरिक ऊर्जा की व्याख्या कीजिए।
उत्तर:
ऊष्मा, कार्य एवं आंतरिक ऊर्जा (Heat, Work And Internal Energy):
ऊष्मागतिकी का शून्यांकी नियम ताप की अवधारणा प्रदान करता है। और ताप किसी वस्तु की ऊष्णता या शीतलता का बोध कराता है। दो भिन्न ताप की वस्तुएँ जब सम्पर्क में लाई जाती हैं तो उच्च ताप की वस्तु से निम्न ताप की वस्तु की ओर ऊष्मा का प्रवाह होता है और यह तब तक होता रहता है, जब तक दोनों के ताप समान नहीं हो जाते हैं अर्थात् जब तक ‘ऊष्मीय साम्य’ स्थापित नहीं हो जाता है। यहाँ तापान्तर के कारण एक वस्तु से दूसरी वस्तु की ओर ऊर्जा का प्रवाह ऊष्मा कहलाता है। इस प्रकार का ऊष्मा स्थानान्तरण एक अयांत्रिक ऊर्जा स्थानान्तरण (Non- mechanical energy transfer) है।
उदाहरणार्थ- कोई पिण्ड चालन अथवा विकिरण द्वारा ऊर्जा का क्षय कर रहा है अर्थात् वह चालन अथवा विकिरण द्वारा ऊष्मा दे रहा है जो कि पिण्ड एवं वातावरण के तापान्तर पर निर्भर हो लेकिन यदि निकाय किसी अन्य विधि द्वारा बाह्य यांत्रिक बलों के विरुद्ध कार्य करने में ऊर्जा क्षय कर रहा हो तो हम कह सकते हैं कि ‘कार्य’ (Work) हो रहा है। अब ऊष्मा का अन्य सम्बन्धित राशियों जैसे – कार्य व आंतरिक ऊर्जा के मध्य सम्बन्ध की विवेचना करनी है। ऊष्मागतिकी में कार्य एवं ऊष्मा अत्यन्त महत्त्वपूर्ण हैं, अतः निम्नलिखित बातों का ध्यान आवश्यक है-
- कार्य व ऊष्मा निकाय की परिसीमा एवं निकाय की अवस्था बदलने पर उत्पन्न होते हैं।
- कार्य व ऊष्मा को परिवेश पर हुए प्रभाव द्वारा अभिव्यक्त किया जाता है।
- कार्य व ऊष्मा दोनों का धनात्मक एवं ऋणात्मक मान सम्भव हैं।
- चूँकि कार्य व ऊष्मा निकाय की अवस्था परिवर्तन की विधि मार्ग पर निर्भर करते हैं अर्थात् अवस्था फलन नहीं होते हैं। अतः इन्हें ऊष्मागतिकीय ‘अवस्था चर’ नहीं माना जा सकता है।
प्रश्न 16.
ऊष्मागतिकीय निकाय, ऊष्मागतिकीय चर राशियों व ऊष्मागतिकीय प्रक्रम से आप क्या समझते हैं ?
उत्तर:
ऊष्मागतिकीय निकाय (Thermodynamics System) : बहुत बड़ी संख्या में कणों का ऐसा निकाय जिसके ताप, दाब तथा आयतन के कुछ निश्चित मान हो अर्थात् जिसे ताप, दाब तथा आयतन के पदों में व्यक्त किया जा सके, ऊष्मागतिकीय निकाय कहलाता हैं उदाहरणार्थ – एक बर्तन में भरी गैस ये दो प्रकार के होते हैं-
- सूक्ष्म निकाय (Microscopic System): सूक्ष्म निकाय में कणों की संख्या बहुत कम होती है जिससे प्रत्येक कण का स्वतन्त्र रूप से अध्ययन किया जा सके, जैसे- एक परमाणु ।
- स्थूल निकाय (Macroscopic System): स्थूल निकाय में कणों की संख्या अत्यधिक होती है किसी पात्र में बन्द गैस स्थूल निकाय का उदाहरण है। इसमें अणुओं की संख्या अवोद्रो संख्या की कोटि की होती है।
प्रश्न 17.
साइकिल में हवा भरते समय पम्प गर्म हो जाता है, क्यों ?
उत्तर:
हवा भरते समय वायु का रुद्धोष्म संपीडन होता है, अतः यान्त्रिक कार्य ऊष्मा में बदल जाता है इसीलिए पम्प गर्म हो जाती है।
प्रश्न 18.
बन्द कमरे में बिजली का पंखा चलाने पर क्या कमरे की वायु ठण्डी हो जायेगी ?
उत्तर:
नहीं, बल्कि वायु गर्म हो जायेगी क्योंकि पंखा चलने पर वायु के अणुओं का वेग बढ़ने से उनकी गतिज ऊर्जा बढ़ेगी।
प्रश्न 19.
ठण्डे जल की बाल्टी में गर्म लोहे का टुकड़ा डाला गया। क्या जल की आन्तरिक ऊर्जा बढ़ेगी ? क्या लोहे ने कुछ कार्य किया ?
उत्तर:
जल की आन्तरिक ऊर्जा में वृद्धि होगी। यह वृद्धि ऊष्मा के स्थानान्तरण के कारण होती है इसीलिए लोहे के टुकड़े द्वारा कोई कार्य नहीं किया जाता है।
![]()
प्रश्न 20.
आदर्श गैस का नियत दाब पर 1°C ताप बढ़ने पर किये जाने वाले कार्य के लिए कितने कैलोरी ऊष्मा की आवश्यकता होती है ?
उत्तर:
एक मोल गैस पर किया गया कुल कार्य
∆W = ∆Q – ∆U
=CP. ∆T – CV ∆T
= (CP – CV) ∆T = R.∆T
यदि ∆T = 1°C
तो ∆W = R = 2 कैलोरी ।
प्रश्न 21.
यदि कमरे में रेफ्रीजरेटर का दरवाजा खुला रख दिया जाये तो बताइये कि क्या कमरा ठण्डा हो जायेगा ? या गर्म ?
उत्तर:
रेफ्रीजरेटर विपरीत दिशा में कार्यरत ऊष्मीय इंजन के समान है अर्थात् कम ताप वाली वस्तु से ऊष्मा ग्रहण करता है तथा उच्च ताप की वस्तु में ऊष्मा का परित्याग करता है। अतः कमरे से अवशोषित ऊष्मा की तुलना में अधिक ऊष्मा का परित्याग करेगा। अतः कमरा गर्म हो जायेगा।
प्रश्न 22.
यदि कार्नो के उत्क्रमणीय इंजन में ऊर्जा नष्ट या अपव्यय नहीं होती है तो इसकी दक्षता 100% से कम क्यों होती है ?
उत्तर:
कार्नो इंजन की दक्षता
η = \(1-\frac{T_2}{T_1}\)
जहाँ T1 → स्रोत का ताप एवं
T2 → सिंक का ताप
जब तक T1 एवं T2 के मान भिन्न रहेंगे तब तक \(\frac{T_2}{T_1}\) का मान कुछ न कुछ रहेगा और η का मान 100% से कम होगा। केवल एक स्थिति ऐसी है जब T2 = 0K हो तो η = 100% हो जायेगा और T2 = 0K प्राप्त करना सम्भव नहीं है।
प्रश्न 23.
संलग्न चित्र के अनुसार एक निकाय प्रारम्भिक अवस्था A से अन्तिम अवस्था B तक दो मार्गों अर्थात् प्रक्रमों I व II के द्वारा पहुँचता है। यदि इन प्रक्रमों के लिए आन्तरिक ऊर्जा में परिवर्तन ∆UI व ∆UII हो तो इन दोनों में क्या सम्बन्ध होगा और क्यों ?
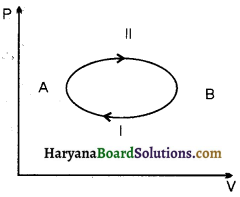
उत्तर:
∆UI = ∆UII
क्योंकि आन्तरिक ऊर्जा किसी स्थिति के लिए अद्वितीय फलन होती है और यह परिवर्तन के मार्ग पर निर्भर नहीं करती है।
प्रश्न 24.
संलग्न चित्र में प्रदर्शित सूचक आरेख में कुल कार्य की मात्रा का प्रकार (धनात्मक / ऋणात्मक) क्या होगा और क्यों ?
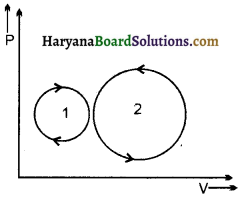
उत्तर:
चक्रीय प्रक्रम में किया गया कार्य बन्द वक्र के क्षेत्रफल से प्राप्त होता है। प्रक्रम (1) दक्षिणावर्त है अतः इसमें किया गया कार्य धनात्मक होगा और प्रक्रम (2) वामावर्त है अतः इसमें कृत कार्य ऋणात्मक होगा। चूँकि प्रक्रम (1) का क्षेत्रफल प्रक्रम (2) के क्षेत्रफल से कम है, अतः कुल कार्य ऋणात्मक होगा।
![]()
दीर्घ उत्तरीय प्रश्न (Long Answer Type Questions)
प्रश्न 1.
ऊष्मागतिकी के शून्यांकी, प्रथम व द्वितीय नियम की विस्तारपूर्वक व्याख्या कीजिए ।
उत्तर;
ऊष्मागतिकी का शून्यांकी नियम (Zeroth Law Of Thermodynamics):
इस नियम के आधार पर ताप की अविधारणा दी जाती है। इस नियम को समझने के लिए तीन निकाय A, B व C की कल्पना करते हैं निकाय A व B एक रुद्धोष्म दीवार से पृथक हैं और इनमें से प्रत्येक एक तीसरे निकाय C से एक सुचालक दीवार से सम्पर्क में हैं 1 निकायों की अवस्थाएँ तब तक परिवर्तित होती हैं जब तक A व B दोनों निकाय C के साथ तापीय साम्य में नहीं आ जाते हैं।

अब यदि A व B के बीच रुद्धोष्म दीवार को सुचालक दीवार से प्रतिस्थापित कर दी जाती है तथा C को A व B से किसी रुद्धोष्म दीवार से पृथक दिया जाता है। तब यह देखा जाता है कि A व B की अवस्थाएँ अब और नहीं बदलती हैं अर्थात् वे दोनों तापीय साम्य में होती है।

इससे ऊष्मागतिकी का शून्यांकी नियम दिया गया जिसके अनुसार, “यदि दो निकाय किसी अन्य तीसरे निकाय के साथ पृथक्-पृथक् रूप से तापीय साम्य में है तो वे परस्पर भी तापीय साम्य में होते हैं।
अतः यदि निकायों A, B व C के ताप यदि TA, TB व TC हों और TA = TC एवं TB = TC तो TA = TB।
यही ऊष्मागतिकी का शून्यांकी नियम है अतः ताप पदार्थ का वह गुण है जो यह बताता है कि कोई निकाय अपने पड़ोसी निकाय के साथ ऊष्मीय साम्य में है अथवा नहीं। इस प्रकार ऊष्मागतिकी का शून्यांकी नियम ताप की अवधारणा को प्रदर्शित करता है।
ऊष्मागतिकी का प्रथम नियम (First Law Of Thermodynamics):
ऊष्मागतिकी का प्रथम नियम दो भिन्न कथनों में निम्न प्रकार व्यक्त किया जाता है-
1. इस नियम के पहले कथन को ऊष्मा तथा कार्य की तुल्यता का नियम भी कहते हैं, इसके अनुसार जब ऊष्मा प्राप्त करने के लिए यांत्रिक कार्य किया जाता है तो कार्य की प्रत्येक इकाई द्वारा ऊष्मा की एक निश्चित मात्रा प्राप्त होती है। इसके विपरीत जब कार्य करने हेतु ऊष्मा दी जाती हैं तो इकाई कार्य प्राप्त करने के लिए ऊष्मा की समान मात्रा आवश्यक होती है अर्थात् कार्य एवं ऊष्मा एक दूसरे के तुल्य हैं। यदि W कार्य करने से Q ऊष्मा उत्पन्न होती है तो
W ∝ Q
या W =JQ
जहाँ J = 4.2 × 10³ Jkcal-1 होता है जिसे ऊष्मा का यांत्रिक तुल्यांक कहते हैं। उक्त नियम तभी सत्य है जब सम्पूर्ण कार्य ऊष्मा में या सम्पूर्ण ऊष्मा कार्य में परिणित हो रही हो।
2. इस नियम का दूसरा कथन ऊर्जा संरक्षण के नियम (Law of Conservation of Energy) पर आधारित है माना किसी निकाय को do ऊष्मा दी जाती है तो वह ऊष्मा दो रूपों में व्यय होती है- (i) अणुओं की आंतरिक ऊर्जा बढ़ाने में dU के रूप में और (ii) शेष भाग आन्तराण्विक आकर्षण बलों के विरुद्ध बाह्य कार्य करने में dW के रूप में इस प्रकार
dQ = dU + dW …………..(1)
इस समीकरण को ही ‘ऊष्मागतिकी का प्रथम नियम’ कहते हैं, अर्थात् “किसी निकाय को दी गई ऊष्मा आंतरिक ऊर्जा में वृद्धि एवं किये गये बाह्य कार्य के योग के बराबर होती है।” यह नियम ऊर्जा संरक्षण के नियम का ही प्रतिपादन है जिसके अनुसार, “ऊर्जा को न तो उत्पन्न कर सकते है। और न ही नष्ट कर सकते हैं, केवल इसका रूपान्तरण सम्भव है।” जब भी हमें एक प्रकार की ऊर्जा प्राप्त होती है तो किसी अन्य प्रकार की ऊर्जा लुप्त होती है।
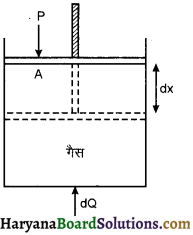
माना संलग्न चित्र के अनुसार एक घर्षण रहित पिस्टन युक्त पात्र में गैस भरी है। पिस्टन का अनुप्रस्थ परिच्छेद क्षेत्रफल A हैं और इस पर बाह्य दाब P कार्यरत है। यदि इस निकाय को dQ ऊष्मा दी जाती है। जिससे इसकी आंतरिक ऊर्जा में वृद्धि dU होती है और पिस्टन दाब P के विरुद्ध dx विस्थापन से विस्थापित होता है अतः बाह्य कार्य
dW = Fext × dx = P.A.dx
या dW = P.dV
जहाँ dV = A.dx आयतन में परिवर्तन
अतः dQ = dU + dW
ऊष्मागतिकी का द्वितीय नियम (Second Law Of Thermodynamics):
ऊष्मागतिकी का प्रथम नियम ऊर्जा संरक्षण के नियम पर आधारित है। यह ऊष्मा तथा कार्य की तुल्यता का नियम है अर्थात् कार्य का ऊष्मा में अथवा ऊष्मा का कार्य में रूपान्तरण होने पर कार्य की निश्चित मात्रा से निश्चित ऊष्मा उत्पन्न होती है या निश्चित ऊष्मा से कार्य की निश्चित मात्रा उत्पन्न होती है, परन्तु उपलब्ध ऊष्मा का कितना भाग यांत्रिक कार्य में परिवर्तित होता है एवं इसकी शर्तें व सीमाएँ क्या है ? इसकी जानकारी ऊष्मागतिकी का प्रथम नियम नहीं देता है।
उदाहरणार्थ – फर्श पर लुढ़कती हुई गेंद ऊष्मागतिकी के नियमानुसार उस समय रुक जायेगी जब उसकी सम्पूर्ण गतिज ऊर्जा (यांत्रिक ऊर्जा ) ऊष्मा में बदल जायेगी। परन्तु क्या इस प्रक्रिया का व्युत्क्रम अर्थात् फर्श पर रुकी हुई गेंद ऊष्मा अवशोषित करके गतिशील हो जायेगी ? इस प्रश्न का उत्तर स्पष्ट रूप से प्रथम नियम नहीं देता है। इस प्रकार किसी क्रिया के होने व न होने की जानकारी को प्राप्त करने के लिए अन्य नियम की आवश्यकता है जिसे ऊष्मागतिकी का द्वितीय नियम कहते हैं। यह नियम प्रथम नियम का पूरक है। ऊष्मागतिकी के द्वितीय नियम को विभिन्न वैज्ञानिकों ने भिन्न-भिन्न कथनों के रूप में प्रस्तुत किया है परन्तु व्यावहारिक दृष्टि से सभी कथन सत्य हैं। यहाँ हम दो कथनों पर विचार करेंगे जिनमें एक आन्तरिक ऊर्जा को कार्य में बदलने की सीमा के बारे में है और दूसरा ऊष्मा प्रवाह की दिशा के बारे में है।
1. केल्विन प्लांक का कथन (Statement of Kelvin Planck) : इस कथन के अनुसार, “इस प्रकार के इंजन का निर्माण सम्भव नहीं है, जो सम्पूर्ण चक्र में किसी वस्तु से ऊष्मा लेकर कार्यकारी निकाय में कोई परिवर्तन किये बिना उसे पूर्णतः कार्य में परिवर्तित कर दे।” अर्थात् कोई ऐसा ऊष्मा इंजन नहीं बन सका है, जो लोत से ली गई सम्पूर्ण ऊष्मा को कार्य में बदल सके और सिंक को कुछ भी न दे। दूसरे शब्दों में ऊष्मा के अविरल रूप से कार्य में बदलने के लिए ठण्डी वस्तु अर्थात् सिंक का होना आवश्यक है।
2. क्लासियस का कथन (Claussius’s Statement) : इस कथन के अनुसार, “किसी भी चक्रीय प्रक्रम में कार्यकारी पदार्थ द्वारा निम्न ताप वाली वस्तु से उच्च ताप वाली वस्तु की ओर ऊष्मा का प्रवाह नहीं हो सकता जब तक कि कार्यकारी पदार्थ पर बाह्य कार्य नहीं किया जाता है।” यह कथन प्रशीतक (refrigerator) के सिद्धान्त पर आधारित है जो ठण्डी वस्तु में से ऊष्मा अवशोषित कर गर्म वस्तु (कमरे की वायु) को प्रदान करता है, लेकिन इस कार्य को करने के लिए प्रशीतक में संपीडक (compressor) की आवश्यकता होती है अर्थात् बिना सम्पीडक की बाह्य सहायता के प्रशीतक वस्तुओं को ठण्डा नहीं कर सकता है।
![]()
प्रश्न 2.
समतापी व रुद्धोष्म प्रक्रम में अन्तर स्पष्ट करते हुए इन प्रक्रमों में किये गये कार्य की गणना कीजिए।
उत्तर:
समतापी प्रक्रम (Isothermal Process):
जब किसी ऊष्मागतिकीय निकाय में दाब (P), एवं आयतन (V) में परिवर्तन होता है, परन्तु ताप (T) नियत रहता है, तो ऐसे प्रक्रम को समतापी प्रक्रम कहते हैं। इस परिवर्तन के दौरान निकाय एवं परिवेश (Surroundings) के मध्य ऊष्मा का आदान-प्रदान आवश्यक है जब निकाय का प्रसार होता है तो निकाय द्वारा कार्य किया गया है, अतः इस कार्य के तुल्य ऊष्मा परिवेश से निकाय में आ जाती है जिससे निकाय का ताप नियत बना रहता है।
इसी प्रकार निकाय के संपीडन के समय निकाय पर किये गये कार्य के तुल्य ऊष्मा परिवेश से निकाय में आ जाती है। इससे निकाय का ताप नियत बना रहता है। इसी प्रकार निकाय के संपीडन के समय निकाय पर किये गये कार्य के तुल्य ऊष्मा निकाय से परिवेश को चली जाती है। यदि समतापीय परिवर्तन किसी भारहीन एवं घर्षण रहित पिस्टन युक्त सिलिण्डर में मौजूद किसी गैसीय निकाय के साथ पिस्टन की सहायता से किया जाता है तो समतापी प्रक्रम के लिए निम्नलिखित दो शर्तों को पूरा होना आवश्यक है-
(i) निकाय की परिसीमाएँ ( पिस्टन एवं सिलेण्डर) ऊष्मा की सुचालक होनी चाहिए ताकि उनसे होकर ऊष्मा का आदान-प्रदान हो सके।
(ii) परिवर्तन धीरे-धीरे होना चाहिए ताकि ऊष्मा के आदान-प्रदान के लिए पर्याप्त समय मिल सके।
मोल गैस के लिए आदर्श गैस समीकरण PV = nRT यदि n को नियत रखकर समतापी परिवर्तन किया जाता है, तो
अतः nRT = नियतांक
PV = नियतांक ……..(1)
उक्त समीकरण (1) को समतापी प्रक्रम का अवस्था समीकरण कहते हैं। यही बॉयल का नियम है, जिसके अनुसार,
P ∝ \(\frac{1}{V}\), V ∝ \(\frac{1}{P}\)
अर्थात् किसी निश्चित द्रव्यमान की गैस का स्थिर ताप पर दाब व आयतन परस्पर व्युत्क्रमानुपाती होते हैं।
प्रश्न 3.
समतापी प्रक्रम की व्याख्या कीजिए एवं इस प्रक्रम में कृत कार्य के लिए सूत्र स्थापित कीजिए।
उत्तर:
समतापी प्रक्रम में किया गया कार्य (Work done in an Isothermal Process):
माना किसी सिलेण्डर में n मोल आदर्श गैस का समतापीय प्रसार किया जाता है तो वह अपनी प्रारम्भिक अवस्था A(P1 V1) से अन्तिम अवस्था B(P2 V2) में पहुँच जाती है। यह प्रक्रम संलग्न सूचक आरेख चित्र में समतापी वक्र AB द्वारा प्रदर्शित किया गया है। यदि आयतन के सूक्ष्म परिवर्तन dV के लिए दाब को P पर नियत मान लें तो इस अन्तराल में कृत कार्य-

समी (1) व (2) समतापी प्रक्रम में n मोल आदर्श गैस के लिए किये गये कार्य को प्रदर्शित करते हैं। चूँकि समतापीय प्रक्रम के लिए अवस्था समीकरण
PV = नियतांक
अत: P dV + V.dP = 0
या V dP = -P dV
या \(\frac{d \mathrm{P}}{d \mathrm{~V}}=-\frac{\mathrm{P}}{\mathrm{V}}\)
अर्थात् समतापी प्रक्रम में P-V वक्र का ढाल (प्रवणता) ऋणात्मक होती है।
![]()
प्रश्न 4.
रुद्धोष्म प्रकरण के लिए अवस्था समीकरण के सूत्र का निगमन कीजिए।
उत्तर:
ऊष्मागतिकी के प्रथम नियम का रुद्धोष्म प्रक्रम में अनुप्रयोग (First Law of Thermodynamics Applied to Adiabatic Process)
(अ) P व V के मध्य रुद्धोष्म सम्बन्ध (Adiabatic Relation between P and V):
ऊष्मागतिकी के प्रथम नियम से-

यह समीकरण रुद्धोष्म प्रक्रम में दाब एवं आयतन में सम्बन्ध है। इसे ‘पायसन सम्बन्ध’ (Poisson’s relation) कहते हैं।
प्रश्न 5.
ऊष्मागतिकी का प्रथम नियम क्या है ? इसकी सहायता से आन्तरिक ऊर्जा की व्याख्या कीजिए।
उत्तर:
ऊष्मागतिकी का प्रथम नियम (First Law Of Thermodynamics):
ऊष्मागतिकी का प्रथम नियम दो भिन्न कथनों में निम्न प्रकार व्यक्त किया जाता है-
1. इस नियम के पहले कथन को ऊष्मा तथा कार्य की तुल्यता का नियम भी कहते हैं, इसके अनुसार जब ऊष्मा प्राप्त करने के लिए यांत्रिक कार्य किया जाता है तो कार्य की प्रत्येक इकाई द्वारा ऊष्मा की एक निश्चित मात्रा प्राप्त होती है। इसके विपरीत जब कार्य करने हेतु ऊष्मा दी जाती हैं तो इकाई कार्य प्राप्त करने के लिए ऊष्मा की समान मात्रा आवश्यक होती है अर्थात् कार्य एवं ऊष्मा एक दूसरे के तुल्य हैं। यदि W कार्य करने से Q ऊष्मा उत्पन्न होती है तो
W ∝ Q
या W =JQ
जहाँ J = 4.2 × 10³ Jkcal-1 होता है जिसे ऊष्मा का यांत्रिक तुल्यांक कहते हैं। उक्त नियम तभी सत्य है जब सम्पूर्ण कार्य ऊष्मा में या सम्पूर्ण ऊष्मा कार्य में परिणित हो रही हो।
2. इस नियम का दूसरा कथन ऊर्जा संरक्षण के नियम (Law of Conservation of Energy) पर आधारित है माना किसी निकाय को do ऊष्मा दी जाती है तो वह ऊष्मा दो रूपों में व्यय होती है- (i) अणुओं की आंतरिक ऊर्जा बढ़ाने में dU के रूप में और (ii) शेष भाग आन्तराण्विक आकर्षण बलों के विरुद्ध बाह्य कार्य करने में dW के रूप में इस प्रकार
dQ = dU + dW …………..(1)
इस समीकरण को ही ‘ऊष्मागतिकी का प्रथम नियम’ कहते हैं, अर्थात् “किसी निकाय को दी गई ऊष्मा आंतरिक ऊर्जा में वृद्धि एवं किये गये बाह्य कार्य के योग के बराबर होती है।” यह नियम ऊर्जा संरक्षण के नियम का ही प्रतिपादन है जिसके अनुसार, “ऊर्जा को न तो उत्पन्न कर सकते है। और न ही नष्ट कर सकते हैं, केवल इसका रूपान्तरण सम्भव है।” जब भी हमें एक प्रकार की ऊर्जा प्राप्त होती है तो किसी अन्य प्रकार की ऊर्जा लुप्त होती है।

माना संलग्न चित्र के अनुसार एक घर्षण रहित पिस्टन युक्त पात्र में गैस भरी है। पिस्टन का अनुप्रस्थ परिच्छेद क्षेत्रफल A हैं और इस पर बाह्य दाब P कार्यरत है। यदि इस निकाय को dQ ऊष्मा दी जाती है। जिससे इसकी आंतरिक ऊर्जा में वृद्धि dU होती है और पिस्टन दाब P के विरुद्ध dx विस्थापन से विस्थापित होता है अतः बाह्य कार्य
dW = Fext × dx = P.A.dx
या dW = P.dV
जहाँ dV = A.dx आयतन में परिवर्तन
अतः dQ = dU + dW
प्रश्न 6.
सूचक आरेख से क्या तात्पर्य है ? इसकी सहायता से बाह्य कार्य ज्ञात करने की प्रक्रिया समझाते हुए सिद्ध कीजिए कि बाह्य कार्य परिवर्तन के मार्ग पर निर्भर करता है।
उत्तर:
सूचक आरेख (Indicator Diagram):
किन्हीं दो चर राशियों द्वारा किसी ऊष्मागतिक निकाय की अवस्था का ग्राफीय प्रस्तुतीकरण निकाय का सूचक आरेख कहलाता है। यदि ग्राफ दाब व आयतन के मध्य खींचा जाये तो इस आरेख को P-V आरेख कहते हैं।
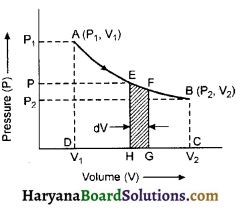
माना किसी गैसीय निकाय का प्रसार होता है और A [P1, V1] प्रारम्भिक तथा B [P2, V2] अन्तिम अवस्थाएँ हैं। प्रक्रम को चित्र में दिये गये सूचक आरेख में प्रदर्शित किया गया है। प्रक्रम के दौरान दाब एवं आयतन में होने वाले परिवर्तन रेखा AB के विभिन्न बिन्दुओं द्वारा प्रदर्शित होंगे।
पूरे प्रक्रम (A → B) के लिए कार्य ज्ञात करने लिए आकृति ABCD का क्षेत्रफल ज्ञात करना होगा। इसके लिए माना दाब P पर सूक्ष्म आयतन परिवर्तन dV के संगत कृत कार्य
dW = PV आकृति EFGH का क्षेत्रफल
अत: A से B तक परिवर्तन के दौरान कृत कुल कार्य
या W = आकृति ABCD का क्षेत्रफल
\(\mathrm{W}=\int d \mathrm{~W}=\int_{\mathrm{V}_1}^{\mathrm{V}_2} \mathrm{P} . d \mathrm{~V}\)
अत: PV वक्र तथा आयतन अक्ष के मध्य घिरे क्षेत्रफल से किसी प्रक्रम में गैस द्वारा किया गया कार्य सीधे प्राप्त हो जाता है।
ऊष्मा के समान कार्य भी पथ का फलन होता है। किसी निकाय द्वारा किया गया कार्य अथवा निकाय पर किया गया कार्य प्रारम्भिक एवं अन्तिम अवस्थाओं के प्रक्रम के पथ पर भी निर्भर करता है। उदाहरण के लिए चित्र में प्रदर्शित सूचक आरेख में प्रारम्भिक अवस्था से अन्तिम अवस्था तक परिवर्तन के तीन पथ (i) if (ii) ior (iii) ib प्रदर्शित किये गये हैं। इन तीनों मार्गों के लिए कृत कार्य विभिन्न प्रकार से किये गये छायांकित भागों के क्षेत्रफलों द्वारा प्राप्त होगा। चित्र से स्पष्ट है-
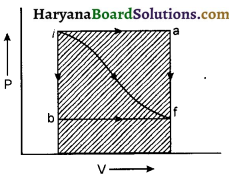
Wiaf > Wif > Wibf
स्पष्ट है कि दो निश्चित अवस्थाओं के एक अवस्था से दूसरी अवस्था तक पहुँचने में कृत कार्य अपनाये गये पथ पर निर्भर करता है।
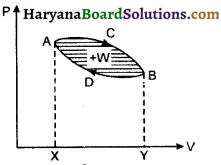
यदि परिवर्तन के दौरान विभिन्न प्रक्रमों से होते हुए निकाय पुन: अपनी प्रारम्भिक स्थिति में लौट आता है तो ऐसे प्रक्रम को ‘चक्रीय प्रक्रम’ (Cyclic Process) कहते हैं। चक्रीय प्रक्रम में किया कुल कार्य बन्द चक्र के क्षेत्रफल से प्राप्त होता है साथ ही साथ प्रक्रम यदि दक्षिणावर्त (clockwise) है तो कार्य धनात्मक एवं प्रक्रम यदि वामावर्त (anticlockwise) है तो कार्य ऋणात्मक होता है। उदाहरण के लिए चित्र में प्रारम्भिक अवस्था A से ACB एवं BDA होते हुए निकाय पुनः अवस्था A में लौट आता है। इन दो प्रक्रमों में प्रक्रम ACB में कृत कार्य
W1 = + आकृति ACBYXA का क्षेत्रफल
एवं प्रक्रम BDA में
W2 = – आकृति BDAXYB का क्षेत्रफल
अत किया गया कुल कार्य
W = W1 + W2
= + ACBYXA का क्षेत्रफल – BDAXYB का क्षेत्रफल
या W = + ACBDA का क्षेत्रफल
अर्थात् किया गया कार्य बन्द लूप के क्षेत्रफल के बराबर होता है। चित्र में प्रदर्शित प्रक्रम दक्षिणावर्त है अतः कुल कार्य धनात्मक मिला है। यदि प्रक्रम वामावर्त अर्थात् ADBCA होता तो कुल कार्य इतना ही होता परन्तु ऋणात्मक होता।
![]()
प्रश्न 7.
रुद्धोष्म प्रक्रम की व्याख्या कीजिए एवं इसमें कृत कार्य के सूत्र का निगमन कीजिए।
उत्तर:
रुद्धोष्म प्रक्रम (Adiabatic Process):
रुद्धोष्म प्रक्रम वह प्रक्रम है जिसमें निकाय के ताप (T), दाब (P) तथा आयतन (V) तीनों परिवर्तित हो सकते हैं, लेकिन निकाय की ऊर्जा अपरिवर्तित रहती है अर्थात् निकाय एवं परिवेश के मध्य ऊष्मा का कोई आदान-प्रदान नहीं होता है। निकाय एवं परिवेश के मध्य ऊष्मा का आदान प्रदान न हो सके, इसके लिए निम्न दो शर्तों का पूर्ण होना आवश्यक है- (i) निकाय की परिसीमाएँ (पिस्टन एवं सिलिण्डर) ऊष्मा की कुचालक होनी चाहिए ताकि उनसे होकर ऊष्मा का आदान-प्रदान न हो सके।
(ii) परिवर्तन शीघ्रता से होना चाहिए ताकि ऊष्मा के आदान-प्रदान के लिए पर्याप्त समय न मिल सके।
रुद्धोष्म प्रक्रम में किया गया कार्य (Work done in Adiabatic Process):
माना चित्र के अनुसार एक भारहीन एवं घर्षण रहित पिस्टनयुक्त सिलिण्डर में एक गैस के मोल मौजूद पिस्टन एवं सिलेण्डर दोनों ऊष्मा के कुचालक हैं। माना गैस का दाब P में पिस्टन का अनुप्रस्थ क्षेत्रफल A है। यदि पिस्टन ऊपर की ओर $d x$ दूरी पर विस्थापित होता है तो गैस द्वारा कृत कार्य
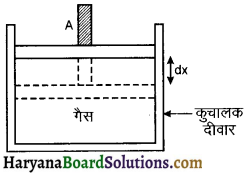
dW = F.dx = (P.A).dx
या dW = P.Adx = P.dV
जहाँ dV = A.dx = आयतन में परिवर्तन
अब माना गैस का रुद्धोष्म प्रसार प्रारम्भिक अवस्था (P1, V1, T1)$ से कम अवस्था (P2, V2, T2) तक होता है तो गैस द्वारा किया गया कुल
\(\mathrm{W}_{\text {रुद्धोष्म }}=\int d \mathrm{~W}=\int_{\mathrm{V}_1}^{\mathrm{V}_2} \mathrm{P} d \mathrm{~V}\)
रुद्धोष्म प्रक्रम में गैसीय निकाय “पायसन के नियम” (Poisson’s Law) का पालन करता है। जिसके अनुसार

यह समी. (4) n मोल आदर्श गैस द्वारा रुद्धोष्म प्रक्रम में किये गये कार्य को निरूपित करता है। स्पष्ट है कि जब T1 > T2 तभी W का मान धनात्मक होगा और यदि T1 < T2 तो Wरुद्धोष्म का मान ऋणात्मक होता है।
प्रश्न 8.
समआयतनीय एवं समदाबीय प्रक्रम की व्याख्या करते हुए इन प्रक्रमों में कृत कार्य की विवेचना कीजिए।
उत्तर:
समआयतनीय प्रक्रम (Isochoric Process):
ऐसा प्रक्रम जिसमें परिवर्तन के दौरान दाब (P) व ताप (T) में तो परिवर्तन होता है परन्तु आयतन नियत रहता है, सम आयतनीय प्रक्रम कहलाता है। अतः इस प्रक्रम में न तो गैस द्वारा कोई कार्य किया जाता है और न ही परिवेश द्वारा गैसीय निकाय पर कोई कार्य किया जाता है क्योंकि आयतन नियत होने से इस प्रक्रम में aV 0 होता है।
समआयतनीय प्रक्रम में ऊष्मागतिकी के प्रथम नियम (First Law of Thermodynamics Applied to Isochoric Process):
ऊष्मागतिकी का प्रथम नियम-
dQ = dU + dW
या dQ = dU + P.dV
∵ समआयतनीय प्रक्रम में आयतन नियत रहता है अतः $d V=0$
∴ P. dV = 0
अतः dQ = dU …………(1)
अर्थात् गैस द्वारा अवशोषित सम्पूर्ण ऊष्मा निकाय की आंतरिक ऊर्जा व उसके ताप को परिवर्तित करने में व्यय होती है।
∵ स्थिर आयतन पर मोलर विशिष्ट ऊष्मा-
\(\mathrm{C}_{\mathrm{V}}=\left(\frac{d \mathrm{Q}}{d \mathrm{~T}}\right)_{\mathrm{V}}\)
∴ dQ = CV.dT
अतः dQ = CV.dT ………….(2)
समदाबीय प्रक्रम (Isobaric Process):
ऐसा प्रक्रम जिसमें परिवर्तन के दौरान ताप (T) व आयतन (V) तो परिवर्तित होते हैं लेकिन दाब (P) नियत रहता है समदावीय प्रक्रम कहलाता है। अर्थात् जब पदार्थ की अवस्था परिवर्तित होती है तो दाब (P) नियत रहता है। उदाहरणार्थ- पानी का जमना (freezing of water); पानी का वाष्प बनना (formation of steam) इत्यादि ।
समदाबी प्रक्रम में किया गया कार्य (Work Done in an Isobaric Process):
माना नियत दाब (P) पर ऊष्मागतिकीय निकाय में मौजूद गैस का आयतन VI से V2 तक परिवर्तित होता है तो गैस द्वारा किया गया कार्य

चूँकि ताप परिवर्तन से आंतरिक ऊर्जा में परिवर्तन होता है। अतः समदाबीय प्रक्रम में अवशोषित ऊष्मा आंशिक रूप से आंतरिक ऊर्जा में वृद्धि करने तथा शेष ऊष्मा कार्य करने में व्यय होती है।
![]()
प्रश्न 9.
ऊष्मागतिकी के अध्ययन के आवश्यक महत्वपूर्ण पदों को परिभाषित कीजिए तथा ऊष्मीय साम्य की विवेचना कीजिए।
उत्तर:
ऊष्मागतिकी निकाय (Thermodynamic System):
ब्रह्माण्ड का वह भाग जिसमें विशाल संख्या में अणु, परमाणु, आयन, इलेक्ट्रॉन, प्रोटॉन, फोटॉन आदि मौजूद हों तथा जिसका चयन ऊष्मागतिकी अध्ययन के लिए किया गया हो, ऊष्मागतिकी निकाय कहलाता है।
ऊष्मागतिकी निकाय निम्नलिखित प्रकार के होते हैं-
(i) सूक्ष्म निकाय (Microscopic System) – सूक्ष्म निकाय में कणों की संख्या बहुत कम होती है, जिससे प्रत्येक कण का स्वतन्त्र रूप से अध्ययन किया जा सके। जैसे-एक परमाणु।
(ii) स्थूल निकाय (Macroscopic System) – स्थूल निकाय में कणों की संख्या अत्यधिक होती है। किसी पात्र में बन्द गैस स्थूल निकाय के रूप में होती है क्योंकि इसमें अणुओं की संख्या अवागाद्रो संख्या की कोटि की होती है।
(iii) खुला निकाय (Open System)-यदि निकाय एवं वातावरण (परिवेश) के मध्य ऊष्मा तथा पदार्थ दोनों का आदान-प्रदान होता है तो उसे खुला निकाय कहते हैं।
(iv) बन्द निकाय (Closed System) – यदि निकाय एवं परिवेश के मध्ग केवल ऊष्मा का आदान-प्रदान होता है (पदार्थ का नहीं) तो उस निकाय को बन्द निकाय कहते हैं।
(v) विलगित निकाय (Isolated System) – यदि निकाय एवं परिवेश के मध्य ऊष्मा एवं पदार्थ का कोई आदान-प्रदान नहीं होता है तो उसे विलगित निकाय कहते हैं।
(vi) समांगी निकाय (Homogeneous System) – यदि किसी ऊष्मागतिक निकाय में उपस्थित सभी भाग समान प्रावस्था में हो तो वह समांगी निकाय कहलाता है। उदाहरणार्थ-शुद्ध ठोस, शुद्ध द्रव, शुद्ध गैस इत्यादि।
(vii) विषमांगी निकाय (Heterogeneous System)-यदि किसी ऊष्मागतिक निकाय में दो या दो से अधिक प्रावस्थाएँ हो तो वह विषमांगी निकाय कहलाता है। उदाहरणार्थ-अघुलनशील द्रवों का मिश्रण इत्यादि।
तापीय साम्य (Thermal Equilibrium):
यदि दो ऊष्मागतिक निकायों के ताप समान हो, तो वे दोनों ऊष्मीय साम्यावस्था में कहे जाते हैं।
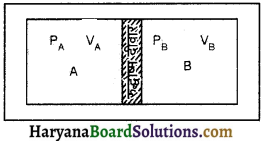
माना दो भिन्न पात्रों A व B में दो गैसें भरी हैं और उन गैसों का दाब व आयतन (PA, VA) व (PB, VB) हैं। चित्र के अनुसार दोनों पात्र रुद्धोष्म दीवार (ऊष्मारोधी) द्वारा पृथक किये गये हैं जिससे A व B के मध्य ऊष्मा का विनिमय नहीं हो पाता है। यहाँ पर (PA, VA) के किसी भी सम्भावित युग्म का मान (PB, VB) के किसी भी सम्भव युग्म के मान के साथ साम्यावस्था में होगा।
अब हम रुद्धोष्म दीवार के स्थान पर एक ऊष्मा पार्थ दीवार लेते हैं। उक्त दीवार ऊष्मा को एक निकाय से दूसरे निकाय में जाने देती है। इस समय हम पाते हैं कि निकाय A व B के स्थूल चर उस समय तक परिवर्तित होते हैं, जब तक दोनों निकाय साम्यावस्था की स्थिति प्राप्त नहीं कर लेते हैं। यह व्यवस्था चित्र में प्रदर्शित की गई है। माना कि A व B निकाय के चर परिवर्तित होकर (PA‘, VA‘) तथा (PB‘, VB‘) हो जाते हैं, ताकि नई अवस्था पुनः एक-दूसरे की साम्यावस्था में हो जाती हैं। यहाँ यह आवश्यक नहीं कि दोनों चर बदलें। इस समय निकाय A व B में ऊर्जा का प्रवाह नहीं होता है। ऐसी स्थिति में निकाय A व B ऊष्मीय साम्य में है।
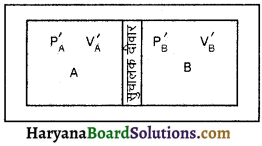
यहाँ यह उल्लेखनीय है कि ऊष्मागतिकी साम्य वह अवस्था है जब ऊष्मागतिकीय स्थूल निकाय के घर जैसे-दाब, ताप इत्यादि में समय के साथ परिवर्तन न हो। ये सामान्यतः तीन प्रकार के होते हैं-
(i) ऊष्मीय साम्य (Thermal Equilibrium) : ऊष्मीय साम्य वह अवस्था है, जब ऊष्मागतिकीय स्थूल निकाय के चर जैसे-दाब, ताप इत्यादि में समय के साथ परिवर्तन न हो।
(ii) रासायनिक साम्य (Chemical Equilibrium) : यदि किसी निकाय की रासायनिक संरचना समय के साथ नहीं बदलती है तो निकाय रासायनिक साम्य में होता है।
(iii) यांत्रिक साम्य (Mechanical Equilibrium) : यदि निकाय के विभिन्न हिस्सों तथा निकाय के परिवेश के मध्य किसी प्रकार के असन्तुलित बल कार्य नहीं करें तो निकाय परिवेश के साथ यांत्रिक साम्य में होता है।
![]()
प्रश्न 10.
कार्नो के उत्क्रमणीय इंजन की कार्यविधि लिखते हुए प्रत्येक प्रक्रम में किये गये कार्य को P-V वक्र द्वारा ज्ञात कीजिए तथा दक्षता का सूत्र व्युत्पन्न कीजिए।
उत्तर:
कार्नो चक्र (Cornat’s Cycle)
कार्नो इंजन की कार्य प्रणाली को संलग्न चित्र 12.21 की सहायता से समझा जा सकता है। इस चित्र में चार प्रक्रम प्रदर्शित हैं, जिनमें दो प्रक्रम समतापी एवं दो रुद्धोष्म हैं। इस चक्र को कार्नों चक्र कहते हैं।
अब हमें विस्तार से चारों चक्रों पर विचार करते हैं। माना सिलेण्डर में कार्यकारी पदार्थ का एक मोल है और प्रारम्भिक अवस्था $\mathrm{A}$ से प्रदर्शित है जहाँ दाब, आयतन एवं ताप क्रमशः P1, V1 व T1 हैं।
प्रक्रम 1 : समतापीय प्रसार (Isothermal Expansion): गैस सिलेण्डर को स्रोत पर रखकर पिस्टन के दाब को धीरे-धीरे कम करते हैं और गैस को प्रसारित होने दिया जाता है। इस प्रक्रिया के दौरान स्रोत नियत ताप T1 पर होता है। गैस के प्रसार के कारण गैस को बाह्य
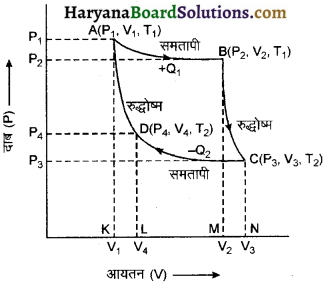
कार्य करना पड़ता है अतः उसका ताप कम होता है परन्तु सिलेण्डर का आधार ऊष्मा का सुचालक होता है। इसलिए आवश्यक ऊष्मा गैसीय निकाय स्रोत से ले लेता है और फलस्वरूप उसका ताप T1 पर नियत रहता है। अतः यह समतापीय प्रसार चक्र के AB भाग द्वारा प्रदर्शित है। माना निकाय द्वारा स्रोत से अवशोषित ऊष्मा Q1 है तथा ऊष्मागतिकी के प्रथम नियम से समतापीय प्रसार के लिए यह ऊष्मा बाह्य कार्य के बराबर होनी चाहिए क्योंकि समतापीय प्रक्रम में dU = 0 होता है। यहाँ पर B बिन्दु पर दाब, आयतन व ताप क्रमश: P2, V2 व T1 हैं। यदि किया गया कार्य W1 है अत:

प्रश्न 11.
ऊष्मागतिकी के द्वितीय नियम के केल्विन प्लांक व क्लासियस के कथनों को लिखिए तथा स्पष्ट कीजिए कि उक्त कथन एक-दूसरे के तुल्य है।
उत्तर:
ऊष्मागतिकी का द्वितीय नियम (Second Law Of Thermodynamics):
ऊष्मागतिकी का प्रथम नियम ऊर्जा संरक्षण के नियम पर आधारित है। यह ऊष्मा तथा कार्य की तुल्यता का नियम है अर्थात् कार्य का ऊष्मा में अथवा ऊष्मा का कार्य में रूपान्तरण होने पर कार्य की निश्चित मात्रा से निश्चित ऊष्मा उत्पन्न होती है या निश्चित ऊष्मा से कार्य की निश्चित मात्रा उत्पन्न होती है, परन्तु उपलब्ध ऊष्मा का कितना भाग यांत्रिक कार्य में परिवर्तित होता है एवं इसकी शर्तें व सीमाएँ क्या है ? इसकी जानकारी ऊष्मागतिकी का प्रथम नियम नहीं देता है।
उदाहरणार्थ – फर्श पर लुढ़कती हुई गेंद ऊष्मागतिकी के नियमानुसार उस समय रुक जायेगी जब उसकी सम्पूर्ण गतिज ऊर्जा (यांत्रिक ऊर्जा ) ऊष्मा में बदल जायेगी। परन्तु क्या इस प्रक्रिया का व्युत्क्रम अर्थात् फर्श पर रुकी हुई गेंद ऊष्मा अवशोषित करके गतिशील हो जायेगी ? इस प्रश्न का उत्तर स्पष्ट रूप से प्रथम नियम नहीं देता है। इस प्रकार किसी क्रिया के होने व न होने की जानकारी को प्राप्त करने के लिए अन्य नियम की आवश्यकता है जिसे ऊष्मागतिकी का द्वितीय नियम कहते हैं। यह नियम प्रथम नियम का पूरक है। ऊष्मागतिकी के द्वितीय नियम को विभिन्न वैज्ञानिकों ने भिन्न-भिन्न कथनों के रूप में प्रस्तुत किया है परन्तु व्यावहारिक दृष्टि से सभी कथन सत्य हैं। यहाँ हम दो कथनों पर विचार करेंगे जिनमें एक आन्तरिक ऊर्जा को कार्य में बदलने की सीमा के बारे में है और दूसरा ऊष्मा प्रवाह की दिशा के बारे में है।
1. केल्विन प्लांक का कथन (Statement of Kelvin Planck) : इस कथन के अनुसार, “इस प्रकार के इंजन का निर्माण सम्भव नहीं है, जो सम्पूर्ण चक्र में किसी वस्तु से ऊष्मा लेकर कार्यकारी निकाय में कोई परिवर्तन किये बिना उसे पूर्णतः कार्य में परिवर्तित कर दे।” अर्थात् कोई ऐसा ऊष्मा इंजन नहीं बन सका है, जो लोत से ली गई सम्पूर्ण ऊष्मा को कार्य में बदल सके और सिंक को कुछ भी न दे। दूसरे शब्दों में ऊष्मा के अविरल रूप से कार्य में बदलने के लिए ठण्डी वस्तु अर्थात् सिंक का होना आवश्यक है।
2. क्लासियस का कथन (Claussius’s Statement) : इस कथन के अनुसार, “किसी भी चक्रीय प्रक्रम में कार्यकारी पदार्थ द्वारा निम्न ताप वाली वस्तु से उच्च ताप वाली वस्तु की ओर ऊष्मा का प्रवाह नहीं हो सकता जब तक कि कार्यकारी पदार्थ पर बाह्य कार्य नहीं किया जाता है।” यह कथन प्रशीतक (refrigerator) के सिद्धान्त पर आधारित है जो ठण्डी वस्तु में से ऊष्मा अवशोषित कर गर्म वस्तु (कमरे की वायु) को प्रदान करता है, लेकिन इस कार्य को करने के लिए प्रशीतक में संपीडक (compressor) की आवश्यकता होती है अर्थात् बिना सम्पीडक की बाह्य सहायता के प्रशीतक वस्तुओं को ठण्डा नहीं कर सकता है।
प्रश्न 12.
कान प्रमेय का कथन लिखते हुए व्युत्पन्न कीजिए।
उत्तर:
कार्नो प्रमेय (Carnot’s Theorem)
इस प्रमेय के अनुसार,
(अ) किन्हीं तापों T1 व T2 (T1 > T2) के मध्य कार्य करने वाले इंजन की दक्षता उन तापों के मध्य कार्य करने वाले कार्नो इंजन की दक्षता से अधिक नहीं हो सकती है अर्थात् कार्नो (उत्क्रमणीय) इंजन की दक्षता अधिकतम होती है।
(ब) किन्हीं दो तापों T1 व T2 के मध्य कार्य करने वाले सभी कार्नो उत्क्रमणीय इंजनों की दक्षता समान होती है चाहे कोई भी कार्यकारी पदार्थ लिया जाये।
व्युत्पत्ति (Proof) : कार्नो प्रमेय के प्रथम कथन (अ) की उपपत्ति के लिए समान स्रोत (T1 K) व समान सिंक (T2K) के मध्य कार्य करने वाले दो इंजन लेते हैं जिनमें एक अनुत्क्रमणीय (irreversible) एवं दूसरा उत्क्रमणीय (reversible) है। दोनों इंजनों में कार्यकारी पदार्थ का चयन इस प्रकार किया जाता है कि दोनों इंजनों का प्रत्येक चक्र में किया गया कार्य (W) समान हो । अब यदि अनुत्क्रमणीय इंजन स्रोत (ताप T1) से Q1 ऊष्मा लेकर उसके एक भाग को कार्य (W) में बदलकर अर्थात् W कार्य करके शेष ऊष्मा (Q1 – W) सिंक (ताप T2) को दे देता है तो इस अनुत्क्रमणीय इंजन की दक्षता,
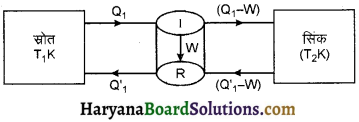
\(\eta_I=\frac{W}{Q_1}\) ……………..(1)
इसी प्रकार यदि उत्क्रमणीय इंजन समान ताप T1 पर स्रोत से I ऊष्मा लेकर W कार्य करके सिंक को (Q1‘ – W) ऊष्मा देता है, तो किये गये उत्क्रमणीय इंजन की दक्षता
\(\eta_R=\frac{W}{Q_1′}\) ……………..(2)
यहाँ पर माना कि ηI > ηR
अतः \(\frac{\mathrm{W}}{\mathrm{Q}}>\frac{\mathrm{W}}{\mathrm{Q}_1^{\prime}} \Rightarrow \frac{1}{\mathrm{Q}_1}>\frac{1}{\mathrm{Q}_1^{\prime}}\)
या Q1‘ > Q1
अर्थात् (Q1‘ – Q1) = एक धनात्मक संख्या
अब यदि चित्र के अनुसार दोनों इंजनों को इस प्रकार जोड़ते हैं कि अनुत्क्रमणीय इंजन (i) सीधी दिशा में और उत्क्रमणीय इंजन (R) विपरीत दिशा में कार्य करें तो उत्क्रमणीय इंजन अनुत्क्रमणीय इंजन द्वारा चलित एक प्रशीतक (Refrigerator) की भाँति कार्य करता है तथा यह T2 ताप पर सिंक से (Q1 – W) ऊष्मा लेकर और इस पर W कार्य किया जाता है। यहाँ T1 ताप पर यह स्रोत को Q1‘ ऊष्मा देता है। उत्क्रमणीय इंजन पर किये गये कार्य W की सीधे अनुत्क्रमणीय इंजन द्वारा पूर्ति होती है तथा अनुत्क्रमणीय इंजन तथा प्रशीतक (उत्क्रमणीय) एक स्वचालित युक्ति की भाँति कार्य करते हैं।
यहाँ पर स्रोत अनुत्क्रमणीय इंजन को Q1 ऊष्मा देता है तथा उत्क्रमणीय इंजन से Q1‘ ऊष्मा लेता है
स्रोत द्वारा ली गई ऊष्मा (Q1‘ – Q1)
इसी प्रकार अनुत्क्रमणीय इंजन सिंक को (Q1 – W) ऊष्मा देता है और उत्क्रमणीय इंजन सिंक से (Q1‘ – W) ऊष्मा लेता है। अतः
सिंक द्वारा ऊष्मा क्षय = (Q1‘ – W) – (Q1 – W)
= (Q1‘ – Q1)
Q1‘ > Q1 अत: (Q1‘ – Q1) धनात्मक राशि है।
इसका अर्थ यह है कि प्रत्येक चक्र में T2 (निम्न ताप) पर सिंक से (Q1‘ – Q1) ऊष्मा की मात्रा बिना किसी बाह्य ऊर्जा स्रोत की सहायता से उच्च ताप T1 पर स्रोत को स्थानान्तरित कर रही है जो कि ऊष्मागतिकी के द्वितीय नियम के अनुसार सम्भव नहीं है अर्थात् हमारी परिकल्पना ηI > ηR सम्भव नहीं है अतः हम कह सकते हैं कि समान तापों के मध्य कार्य कर रहे इंजनों में उत्क्रमणीय (कार्नो) इंजन की दक्षता अधिकतम होती है।
कान प्रमेय के द्वितीय कथन हेतु हम अनुत्क्रमणीय इंजन के स्थान पर एक अन्य उत्क्रमणीय इंजन (R’) लेते हैं अर्थात् दो समान तापों T1 (उच्च) व T2 (निम्न) के मध्य दो उत्क्रमणीय इंजन कार्य कर रहे हैं। अब यदि R इंजन की दक्षता (ηR) को इंजन (R’) की दक्षता (η’R) से अधिक मानें तो प्राप्त होने वाला परिणाम पुनः ऊष्मागतिकी के द्वितीय नियम का उल्लंघन होगा अर्थात् ऊष्मा का स्थानान्तरण बिना किसी बाह्य ऊर्जा स्रोत की सहायता के निम्न ताप से उच्च ताप की ओर होना सम्भव नहीं है। अत: ηR > η’R ठीक नहीं होगा। इसी प्रकार η’R > ηR माने तो समान परिणाम व उल्लंघन प्राप्त होता है कि ηR = η’R माने तो होना चाहिए।
इस प्रकार हम कह सकते हैं कि समान तापों के मध्य कार्य रहे सभी उत्क्रमणीय इंजनों की दक्षता समान होती है, चाहे कार्यकारी पदार्थ कुछ भी लिया गया हो।
![]()
प्रश्न 13.
ऊष्मागतिकी के प्रथम नियम का उल्लेख करते हुए गैसों की विशिष्ट ऊष्माओं का मेयर सम्बन्ध Cp – Cy = R प्राप्त कीजिए।
उत्तर:
CP व CV में मेयर सम्बन्ध (Mayer’s Relation Between CP And CV):
मोलर विशिष्ट ऊष्मा की परिभाषा से, नियत आयतन पर मोलर विशिष्ट ऊष्मा-

आंकिक प्रश्न (Numerical Questions)
ऊष्मागतिकी के प्रथम नियम पर आधारित
प्रश्न 1.
संलग्न चित्र में किसी आदर्श गैस के ऊष्मागतिकीय प्रक्रियाओं का दाब आयतन आरेख दर्शाया गया है। इससे A → B, B → C तथा C → A प्रक्रमों में अलग-अलग कृत कार्य तथा सम्पूर्ण चक्र ABCA में कृत कार्य ज्ञात कीजिए ।
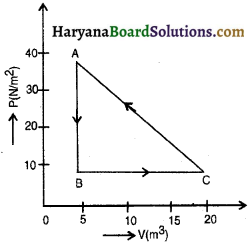
उत्तर:
शून्य, 150 जूल गैस द्वारा, 375 जूल गैस पर, 225 जूल गैस पर
प्रश्न 2.
एक ऊष्मागतिक प्रक्रिया में किसी गैस को 300 जूल ऊष्मा दी जाती है तथा गैस पर 200 जूल कार्य भी किया जाता है। गैस की आन्तरिक ऊर्जा में परिवर्तन ज्ञात कीजिए।
उत्तर:
500 जूल वृद्धि
![]()
प्रश्न 3.
चित्र में किसी आदर्श गैस के एक चक्रीय प्रक्रम का दाब – आयतन आरेख दर्शाया गया है। गैस की आन्तरिक ऊर्जा का मान अवस्था A में 150 जूल, अवस्था B में 100 जूल तथा अवस्था C में 2500 जूल है, तो ज्ञात कीजिए-
(i) प्रक्रम A → B में गैस द्वारा दी गई ऊष्मा,
(ii) प्रक्रम B → C में गैस द्वारा कृत कार्य,
(iii) प्रक्रम B → C में गैस द्वारा ली गई ऊष्मा ।
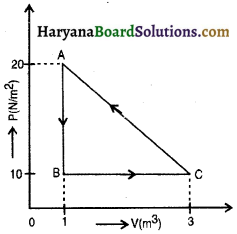
उत्तर:
(i) 50 जूल,
(ii) 20 जूल,
(iii) 170 जूल
प्रश्न 4.
1 cm³ जल उसके क्वथनांक पर 1671 cm³ आयतन भाप बनाने के लिए 540 कैलोरी ऊष्मा अवशोषित करता है। यदि वायुमण्डलीय दाब 1.013 × 105 N/m² है और ऊष्मा का यान्त्रिक तुल्यांक = 4.19 जूल / कैलोरी है, अन्तराण्विक बलों के विरुद्ध इस प्रक्रम में खर्च ऊर्जा ज्ञात कीजिए।
उत्तर:
500 कैलोरी
प्रश्न 5.
एक मनुष्य का द्रव्यमान 60 kg है। यदि उसे भोजन से 105 cal ऊष्मा मिलती हो एवं उसके शरीर की दक्षता 28% हो तो वह मनुष्य कितनी ऊँचाई तक चढ़ सकता है ? [g = 9.8ms-2; J = 4.2 J.cal-1]
उत्तर:
200m
प्रश्न 6.
शीशे की एक गोली 150 ms-1 की चाल से एक लक्ष्य से टकराकर रुक जाती है यदि 80% गतिज ऊर्जा गोली में रह जाती है तो गोली के ताप में वृद्धि ज्ञात कीजिए। शीशे की विशिष्ट ऊष्मा 30 cal. kg-1C-1 है। (J = 4.2J cal-1)
उत्तर:
71.43°C
प्रश्न 7.
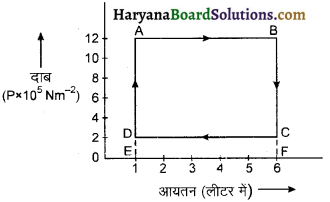
संलग्न चित्र में एक आदर्श गैस की ऊष्मागतिकी प्रक्रियाओं का P – V ग्राफ दिखाया गया है। इस ग्राफ से ज्ञात कीजिए-
(i) A → B
(ii) B → C
(iii) C → D
(iv) D → A प्रक्रमों में किया गया कार्य।
उत्तर:
(i) 6000; J
(ii) शून्य,
(iii) 1000J;
(iv) शून्य
![]()
प्रश्न 8.
ऊष्मागतिक प्रक्रम में किसी गैस के दाब में इस प्रकार परिवर्तन किया जाता है कि गैस के अणुओं के द्वारा 30J ऊष्मा निष्कासित होती है तथा गैस पर 10J का कार्य किया जाता है। यदि गैस की प्रारम्भिक ऊर्जा 40J हो तो अन्तिम आन्तरिक ऊर्जा का मान ज्ञात कीजिए।
उत्तर:
20 जूल
प्रश्न 9.
नियत वायुमण्डलीय दाब एवं 20°C प्रारम्भिक ताप वाले 1 kg द्रव्यमान के धातु के टुकड़े को 20000 J ऊष्मा दी जाती है। निम्न मानज्ञात कीजिए-
(a) ताप में परिवर्तन (b) कृत कार्य, (c) आन्तरिक ऊर्जा में परिवर्तन ।
[दिया है- विशिष्ट ऊष्मा = 400 J kg-1 °C-1, आयतन प्रसार गुणांक (y) = 9 × 10-5/°C
घनत्व = 9000 kg/m³, वायुमण्डल दाब = 105 N/m²]
उत्तर:
(a) 50°C,
(b) 0.05 J,
(c) 19999.95 J
समतापी प्रक्रम पर आधारित
प्रश्न 10.
O2 गैस के एक मोल का आयतन 0°C पर एवं वायुमण्डलीय दाब पर 22.4 लीटर है। उसको समतापीय रूप से संपीडित करते हैं जिससे आयतन 11.2 लीटर तक घट जाता है। उस प्रक्रम में किया गया कार्य ज्ञात कीजिए।
उत्तर:
1572.6 J
प्रश्न 11.
2 मोल आदर्श गैस का 27°C पर समतापी प्रसार किया जाता है जिससे उसका आयतन बढ़कर प्रारम्भिक आयतन का तीन गुना हो जाता है। गैस द्वारा कृत कार्य तथा अवशोषित ऊष्मा की मात्रा का परिकलन कीजिए। (R=8.31Jmol! K-1)
उत्तर:
5.48 × 103 J; 1.31 × 10° cal
प्रश्न 12.
किसी आदर्श गैस के 10 किलोग्राम अणुओं द्वारा कितनी ऊर्जा अवशोषित होगी यदि इसे 8 वायुमण्डलीय प्रारम्भिक दाब से 4 वायुमण्डलीय दाब तक स्थिर ताप 27°C पर प्रसारित किया जाए ?
उत्तर:
1.728107 J
रुद्धोष्म प्रक्रम पर आधारित
प्रश्न 13.
27°C पर एक आदर्श एवं एक परमाणु गैस के 2 मोल V आवतन घेरते हैं। गैस रुद्धोष्म प्रक्रम द्वारा 2V आयतन तक प्रसारित होती है। गणना कीजिए-
(i) गैस का अन्तिम ताप
(ii) गैस की आन्तरिक ऊर्जा में परिवर्तन
(ii) इस प्रक्रम में गैस द्वारा कृत कार्य ।
(R = 8.31 J. mole-1 K-1)
उत्तर:
(i) 189 K;
(ii) -2767.2 J;
(iii) 2767.23
प्रश्न 14.
एक पिस्टन किसी गैस सिलिण्डर को दो भागों में विभाजित करता है प्रारम्भ में पिस्टन को ऐसे दबाते हैं जिससे एक भाग में दाब P तथा आयतन 5V है तथा दूसरे भाग में दाब 8P तथा आयतन V है। अब पिस्टन को स्वतन्त्र छोड़ दिया जाता है। रुद्धोष्म तथा समतापी प्रक्रियाओं के लिए नये दाब तथा आयतन ज्ञात कीजिए। (γ = 1.5)
उत्तर:
(i) समतापी – \(\frac{13P}{6}\), \(\frac{48}{13}\) V एवं \(\frac{30}{13}\)
(ii) रुद्धोष्म प्रक्रम – 1.84P, \(\frac{8V}{3}\) एवं \(\frac{10V}{3}\)
प्रश्न 15.
एक आदर्श गैस जिसका प्रारम्भिक दाब P आयतन V तथा ताप T है, रुद्धोष्म प्रक्रिया द्वारा तब तक फैलती है जब तक कि आयतन बढ़कर 5.66 V तथा ताप गिरकर T/2 हो जाता है। (i) गैस की परमाणुकता क्या है ? (ii) प्रसार के दौरान गैस द्वारा किया गया कार्य प्रारम्भिक दाब P व आयतन V के फलन के रूप में ज्ञात कीजिए।
उत्तर:
(i) y = 1.4.
(ii) = PV
प्रश्न 16.
27°C पर एक आदर्श एवं एकपरमाणुक गैस के 3 मोल V आयतन घेरते हैं। गैस रुद्धोष्म प्रक्रम द्वारा 8 V आयतन तक प्रसारित होती है। गणना कीजिए-
(i) गैस का अन्तिम ताप,
(ii) गैस की आन्तरिक ऊर्जा में परिवर्तन तथा
(iii) इस प्रक्रिया में गैस द्वारा किया गया कार्य दिया है- सार्वत्रिक गैस नियतांक R = 8.31 जूल / मोल K
उत्तर:
(i) 75 K,
(ii) 5609.251,
(iii) 5609.25 J
मेयर सूत्र पर आधारित
प्रश्न 17.
सामान्य ताप व दाब पर मोल ऑक्सीजन गैस का आयतन 22.4 लीटर है। ऑक्सीजन की दोनों मोलर ऊष्मा धारिताओं की गणना कीजिए।
उत्तर:
CV = 20.755 J. mol-1 K-1; CP = 29.085 J. mol-1 K-1
प्रश्न 18.
एक कान इंजन की दक्षता 50% तथा इसके सिंक का ताप 27°C है। यदि इसकी दक्षता 10% बढ़ा दी जाये तब इसके स्रोत के ताप में कितनी वृद्धि हो जायेगी।
उत्तर:
140K
प्रश्न 19.
500K तथा 400K तापों के मध्य कार्य करने वाला कार्नो इंजन यदि प्रत्येक चक्र में स्रोत से 2000 cal ऊष्मा ग्रहण करता है तो गणना कीजिए-
(i) प्रत्येक चक्र में सिंक में विसर्जित ऊष्मा की मात्रा
(ii) प्रत्येक चक्र में इंजन द्वारा किया गया बाह्य कार्य
(iii) इंजन की दक्षता
उत्तर:
(i) 1600 cal;
(ii) 1680 J;
(iii) 20%
प्रश्न 20.
किसी कार्नो इंजन की दक्षता 100K व TK तथा 180K व 900K के लिए समान है तब T की गणना कीजिए।
उत्तर:
500K
प्रश्न 21.
हिमांक व वाष्पन के मध्य कार्य कर रहे कार्नो इंजन की दक्षता की गणना कीजिए।
उत्तर:
27%