Haryana State Board HBSE 11th Class Chemistry Important Questions Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता Important Questions and Answers.
Haryana Board 11th Class Chemistry Important Questions Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता
बहुविकल्पीय प्रश्न
1. तत्त्वों का प्रथम आवर्ती वर्गीकरण किसने प्रस्तुत किया था?
(1) डॉबेराइनर
(2) जे. ए. आर. न्यूलैण्ड
(3) डी. आई. मेण्डलीव
(4) लोथर मेयर।
उत्तर:
(3) डी. आई. मेण्डलीव
2. निम्न ऑक्साइडों में उभयधर्मी ऑक्साइड कौन-सा है?
(1) MgO
(2) Al2O3
(3) P2O5
(4) SiO2.
उत्तर:
(2) Al2O3
3. परमाणु क्रमांक 21 के तत्त्व का आवर्त सारणी में क्या स्थान है?
(1) आवर्त – 3, वर्ग II
(2) आवर्त – 4, वर्ग II
(3) आवर्त – 4, वर्ग III
(4) आवर्त – 3, वर्ग III.
उत्तर:
(3) आवर्त – 4, वर्ग III
4. दीर्घाकार आवर्त सारणी तत्त्वों के किस लक्षण पर आधारित है?
(1) संयोजकता
(2) परमाणु द्रव्यमान
(3) परमाणु आकार
(4) इलेक्ट्रॉनिक विन्यास
उत्तर:
(4) इलेक्ट्रॉनिक विन्यास
5. निम्न में से कौन-सा युग्म आवर्त सारणी एक ही आवर्त में है?
(1) Na, Ca
(2) Na, Cl
(3) Ca, Cl
(4) Hg, Sb.
उत्तर:
(2) Na, Cl
6. कैलिफोर्नियम तत्त्व निम्न परिवार का सदस्य है-
(1) ऐक्टिनॉइड श्रेणी
(2) क्षारीय धातु समूह
(3) क्षारीय मृदा समूह
(4) लैन्थेनॉइड श्रेणी।
उत्तर:
(1) ऐक्टिनॉइड श्रेणी
![]()
7. आवर्त सारणी को बनाने वाला मेण्डलीव था-
(1) फ्रेंच रसायनशास्त्री
(2) जर्मन रसायनशास्त्री
(3) डच रसायनशास्त्री
(4) रूसी रसायनशास्त्री।
उत्तर:
(4) रूसी रसायनशास्त्री।
8. आवर्त तालिका में निम्न में से किस तत्त्व की विद्युत ऋणात्मकता अधिकतम है?
(1) नाइट्रोजन
(2) ऑक्सीजन
(3) क्लोरीन
(4) फ्लुओरीन।
उत्तर:
(4) फ्लुओरीन।
9. Fe2+ (Fe की परमाणु संख्या = 26) में d- इलेक्ट्रॉनों की संख्या बराबर नहीं है
(1) Ne (प. सं. = 10) में p- इलेक्ट्रॉनों की
(2) Mg (प. सं. = 10) में p- इलेक्ट्रॉनों की
(3) Fe में d – इलेक्ट्रॉनों की
(4) Cl– (Cl की प. सं. = 17) में p- इलेक्ट्रॉनों की।
उत्तर:
(4) Cl– (Cl की प. सं. = 17) में p- इलेक्ट्रॉनों की।
10. सबसे हल्की धातु है-
(1) Li
(2) Mg
(3) Ca
(4) Na
उत्तर:
(1) Li
11. 3d – संक्रमण श्रेणी के तत्त्वों का परमाणु क्रमांक है-
(1) 22 से 30
(2) 21 से 30
(3) 21 से 31
(4) 21 से 291
उत्तर:
(2) 21 से 30
12. निम्न में से कौन अधिकतम अधात्विक गुण प्रदर्शित करेगा-
(1) Be
(2) B
(3) Mg
(4) Al
उत्तर:
(2) B
13. समइलेक्ट्रॉनिक सदस्यों की त्रिज्या-
(1) नाभिकीय आवेशों के बढ़ने के साथ बढ़ती है
(2) नाभिकीय आवेशों के बढ़ने के साथ घटती है
(3) पहले बढ़ती है और फिर घटती है
(4) सभी के लिए समान होती है।
उत्तर:
(2) नाभिकीय आवेशों के बढ़ने के साथ घटती है
14. निम्नलिखित ऑक्साइडों में से कौन-सा सर्वाधिक क्षारीय है?
(1) Na2O
(2) SiO2
(3) SO2
(4) Al2O3
उत्तर:
(1) Na2O
15. निम्न में कौन-सा तत्त्व अत्यधिक विद्युत धनात्मक है?
(1) Al
(2) Mg
(3) P
(4) S
उत्तर:
(2) Mg
![]()
16. Vth आवर्त में उपस्थित तत्त्वों की संख्या है—
(1) 18
(2) 32
(3) 8
(4) 24
उत्तर:
(1) 18
17. IIB के तत्त्व कहलाते हैं-
(1) सामान्य तत्त्व
(2) संक्रमण तत्त्व
(3) क्षारीय धातु
(4) क्षारीय मृदा धातु।
उत्तर:
(3) क्षारीय धातु
18. निम्नलिखित में से सबसे दुर्बल क्षार है-
(1) NaOH
(2) KOH
(3) Ca(OH)2
(4) Cu(OH)2
उत्तर:
(4) Cu(OH)2
19. निम्नलिखित यौगिकों में सर्वाधिक अम्लीय है—
(1) p2O5
(2) As2O3
(3) Sb2O3
(4) Bi2O3
उत्तर:
(1) p2O5
20. तत्त्वों में उच्चतम आयनन विभव (IE) किस तत्त्व का है-
(1) H
(2) He
(3) Hg
(4) Au
उत्तर:
(2) He
21. निम्न में उपधातु कौन-सी है-
(1) Zn
(2) Ge
(3) Sn
(4) Al
उत्तर:
(2) Ge
22. ज्ञाततत्त्वों में उच्चतम इलेक्ट्रॉन बन्धुता किस तत्त्व की है—
(1) H
(2) O
(3) F
(4) Cl.
उत्तर:
(4) Cl.
23. निम्न में उभयधर्मी ऑक्साइड कौन-सा है-
(1) BaO
(2) SnO
(3) SiO2
(4) Li2O.
उत्तर:
(2) SnO
24. C, N, P और SI तत्त्वों की विद्युत ऋणात्मकता के बढ़ने का क्रम है-
(1) C.N. Si. P
(2) N, Si, C, P
(3) Si. P. C.N
(4) P, Si, N. C.
उत्तर:
(3) Si. P. C.N
25. उदासीन ऑक्साइड है-
(1) CO
(2) ZnO
(3) SO2
(4) SnO2
उत्तर:
(1) CO
26. निम्न में से किसकी त्रिज्या सबसे बड़ी है-
(1) Na+
(2) O2-
(3) F–
(4) Mg2-
उत्तर:
(2) O2-
27. किस तत्त्व की द्वितीय इलेक्ट्रॉन बन्धुता शून्य होती है-
(1) Cl
(2) O
(3) S
(4) N.
उत्तर:
(1) Cl
28. निम्नांकित में लघुतम आयनिक त्रिज्या वाला आयन है-
(1) K+
(2) Ca2+
(3) Ti3+
(4) Ti4+
उत्तर:
(4) Ti4+
29. निम्नलिखित में सबसे बड़ा आयन कौन-सा है-
(1) Al3+
(2) Ba2+
(3) Mg2+
(4) Na+
उत्तर:
(2) Ba2+
![]()
30. त्रिज्या (radii) का सही क्रम है-
(1) N < Be < B
(2) F– < O2- < N3-
(3) Na < Li < K
(4) Fe3+ < Fe2 < Fe4+
उत्तर:
(2) F– < O2- < N3-
31. प्रथम आयनन विभव के सही क्रम वाला समूह है-
(1) K > Na > Li
(2) Be > Mg > Ca
(3) B > C > N
(4) Ge > Si > C.
उत्तर:
(2) Be > Mg > Ca
32. निम्न में से किसकी विद्युत ऋणात्मकता सर्वाधिक है-
(1) H
(2) E
(3) He
(4) Na.
उत्तर:
(2) E
33. निम्न में से सबसे अधिक आकार होगा –
(1) Li+
(2) Na+
(3) Mg2+
(4) Rb+
उत्तर:
(4) Rb+
34. निम्न में से किस तत्त्व की आयनन ऊर्जा अधिकतम है-
(1) [Ne] 3s2 3p1
(2) [Ne] 3s² 3p2
(3) [Ne] 3s² 3p²
(4) [Ar] 3d10, 4s² 4p²
उत्तर:
(3) [Ne] 3s² 3p²
35. निम्नलिखित में से किसकी श्रेणी के तत्त्वों की परमाणु त्रिज्या लगभग समान होगी-
(1) Li, Be, B, C
(2) Na, K, Rb, Cs
(3) F, Cl, Br, I
(4) Fe, Co, Ni, Cr.
उत्तर:
(4) Fe, Co, Ni, Cr.
36. विद्युत ऋणात्मकता का सही क्रम है-
(1) O+ > O > O–
(2) O > O+ > O–
(3) O+ > O– > O
(4) O+ > O > O+
उत्तर:
(1) O+ > O > O–
37. आयनन विभव का न्यूनतम मान है-
(1) हैलोजनों का
(2) अक्रिय गैस का
(3) क्षारीय मृदा धातुओं का
(4) क्षार धातुओं का।
उत्तर:
(4) क्षार धातुओं का।
38. फ्लुओरीन व निऑन की परमाणु त्रिज्याएँ (Å ) क्रमश: हैं-
(1) 0.72, 1.60
(2) 1.60, 1.60
(3) 0.72, 0.72
(4) इनमें से कोई नहीं।
उत्तर:
(1) 0.72, 1.60
39. आयोडीन स्पीशीज के आकार का सही क्रम है-
(1) I > I+ > I–
(2) I > I– > I+
(3) I+ > I– > I
(4) I– > I– > I+
उत्तर:
(4) I– > I– > I+
40. हैलोजन परिवार की विद्युत ऋणात्मकता का क्रम होता है-
(1) Cl > Br > F > I
(2) I > Br > Cl > F
(3 ) F> Cl > Br > I
(4) Br > Cl > F > I
उत्तर:
(3 ) F> Cl > Br > I
41. निम्न में से किस धातु की ऑक्सीकरण अवस्था एक से अधिक है-
(1 ) Na
(2) Mg
(3) Fe
(4) AL
उत्तर:
(3) Fe
42. N3-, O2- पर F– आयनों की आयनिक त्रिज्याओं के मान का सही क्रम है-
(1 ) N3- > O2- > F–
(2) N3- < O2- < F–
(3) N3- > O2- < F–
(4) N3- < O2- > F–
उत्तर:
(1 ) N3- > O2- > F–
43. आयनिक त्रिज्याओं का सही क्रम है-
(1) Ti4- < Mn3+
(2) 35Cl– < 37Cl–
(3) K+ < Cl–
(4) p3+ > p5+
उत्तर:
(4) p3+ > p5+
44. निम्न तत्त्वों में किस तत्त्व की परमाणु त्रिज्या सबसे कम होगी-
(1) N
(2) F
(3) Na
(4) K.
उत्तर:
(2) F
45. इलेक्ट्रॉन बन्धुता निर्भर करती है-
(1) परमाणु आकार
(2) नाभिकीय आवेश
(3) परमाणु क्रमांक
(4) परमाणु आकार तथा नाभिकीय आवेश दोनों पर।
उत्तर:
(4) परमाणु आकार तथा नाभिकीय आवेश दोनों पर।
46. K, Ca तथा Ba के द्वितीय आयनन विभव का घटता क्रम है-
K = 19, Ca = 20, Ba = 56
(1) K > Ca > Ba
(2) Ca > Ba > K
(3) Ba > K > Ca
(4) K > Ba > Ca
उत्तर:
(1) K > Ca > Ba
अति लघु उत्तरीय प्रश्न
प्रश्न 1.
किन्हीं दो प्रारूपी तत्त्वों (Typical elements) के नाम बताओ।
उत्तर:
Na और Mg.
प्रश्न 2.
किन्हीं दो सेतु तत्त्वों (Bridge elements) के नाम बताओ।
उत्तर:
Na और Mg.
प्रश्न 3.
किन्हीं दो संक्रमण तत्त्वों के नाम लिखें।
उत्तर:
- क्रोमियम (Cr)
- कॉपर (Cu).
प्रश्न 4.
ट्रान्स- यूरेनिक तत्त्वों के दो उदाहरण दीजिए।
उत्तर:
- Np
- Pul
प्रश्न 5.
d-ब्लॉक तत्त्वों को संक्रमण तत्त्व क्यों कहते हैं?
उत्तर:
ये तत्त्व – ब्लॉक व p-ब्लॉक तत्त्वों के बीच सेतु (Bridge) बनाते हैं।
प्रश्न 6.
परमाणु क्रमांक 58 से 71 तक के तत्त्वों को दुर्लभ मृदा तत्त्व (Rare earth elements) कहते हैं। क्यों?
उत्तर:
ये प्रकृति (Nature) में अल्प मात्रा में पाये जाते हैं।
प्रश्न 7.
बोरॉन (B) उपधातु (Metalloid) है। स्पष्ट कीजिए।
उत्तर:
बोरॉन में धातु व अधातु दोनों के गुण पाये जाते हैं।
प्रश्न 8.
प्रबलतम धात्विक प्रकृति वाला तत्त्व कौन-सा है?
उत्तर:
सीजियम (Cs).
प्रश्न 9.
एक तत्त्व (X) आवर्त सारणी के तीसरे वर्ग में है। इस तत्त्व के ऑक्साइड का सूत्र क्या होगा?
उत्तर:
X2O3.
प्रश्न 10.
डॉबेराइनर के त्रिक किन्हें कहा जाता है?
उत्तर:
डॉबेराइनर ने लगभग समान गुण-धर्म वाले अनेक तत्त्वों को तीन-तीन के समूह में उनके परमाणु भार में वृद्धि के क्रमानुसार रखा। इस प्रकार के समूह डॉबेराइनर के त्रिक कहलाते हैं।
प्रश्न 11.
मेण्डलीव की आधुनिक आवर्त सारणी में वर्गों तथा आवर्तों की संख्या लिखिए।
उत्तर:
मेण्डलीव की आवर्त सारणी में नौ वर्ग (समूह) तथा सात आवर्त हैं।
प्रश्न 12.
संक्रमण तत्त्वों के दो गुण लिखिए।
उत्तर:
- विभिन्न संयोजकताएँ प्रदर्शित करना।
- रंगीन संकर आयन बनाना।
प्रश्न 13.
दीर्घाकार आवर्त सारणी में कुल कितने वर्ग व आवर्त हैं?
उत्तर:
वर्ग – 18, आवर्त – 7.
![]()
प्रश्न 14.
p-ब्लॉक के एक तत्त्व की बाह्यतम कक्षा में चार (4) इलेक्ट्रॉन हैं। इस तत्त्व का वर्ग व नाम बताओ यदि यह तत्त्व तीसरे आवर्त का है।
उत्तर:
वर्ग-14 (IVA), नाम- सिलिकॉन (14Si).
प्रश्न 15.
आवर्त सारणी में फॉस्फोरस को किस आवर्त और किस समूह में रखा गया है?
उत्तर:
आवर्त सारणी में फॉस्फोरस को तृतीय आवर्त तथा वर्ग 15 में रखा गया है।.
प्रश्न 16.
आवर्त सारणी में प्रत्येक आवर्त किस क्वाण्टम संख्या के साथ प्रारम्भ होता है?
उत्तर:
मुख्यं क्वाण्टम संख्या (17).
प्रश्न 17.
मानव निर्मित तत्त्व किस श्रेणी से सम्बन्धित होते हैं?
उत्तर:
ऐक्टिनॉइड श्रेणी।
प्रश्न 18.
कार्बन के फ्लुओराइड का सूत्र लिखिए।
उत्तर:
CF4
प्रश्न 19.
द्वितीय आवर्त किस तत्त्व पर समाप्त होता है?
उत्तर:
निऑन (Ne)।
प्रश्न 20.
ns² np6 का इलेक्ट्रॉनिक विन्यास रखने वाले तत्त्व अक्रिय क्यों कहलाते हैं?
उत्तर:
क्योंकि इनकी संयोजी कक्षा पूर्ण रूप से भरी होती है।
प्रश्न 21.
f – ब्लॉक के तत्त्वों को f-ब्लॉक तत्त्व ही क्यों कहते हैं?
उत्तर:
क्योंकि इन तत्त्वों में अन्तिम विभेदी इलेक्ट्रॉन (n – 2 ) f उपकोश में प्रवेश करता है।
प्रश्न 22.
अर्द्ध-पूर्ण तथा पूर्ण कक्षक अधिक स्थायी होते हैं, स्पष्ट कीजिए।
उत्तर:
अर्द्ध-पूर्ण तथा पूर्ण इलेक्ट्रॉनिक विन्यास वाले कक्षकों की ऊर्जा निम्न होती है। अतः ये स्थायी होते हैं। इसके अतिरिक्त इनके विन्यास में सममिति पायी जाती है।
प्रश्न 23.
किन्हीं दो उभयधर्मी ऑक्साइड का उदाहरण दें।
उत्तर:
जल (H2O), बेरीलियम ऑक्साइड (BeO)।
प्रश्न 24.
तीन ऐसे तत्त्वों के नाम लिखें जिनके ऑक्साइड उभयधर्मी होते हैं?
उत्तर:
Al, As, Sb.
प्रश्न 25.
उत्कृष्ट गैसें आवर्त सारणी के किस समूह में रखी जाती हैं?
उत्तर:
शून्य वर्ग या समूह 18.
प्रश्न 26.
हैलोजनों को आवर्त सारणी के किस समूह में रखा गया हैं?
उत्तर:
समूह 17 में (VII A ).
प्रश्न 27.
क्षार धातुओं को आवर्त सारणी के किस समूह में रखा गया है?
उत्तर:
समूह 1 में (IA).
प्रश्न 28.
क्षारीय मृदा धातुओं को आवर्त सारणी के किस समूह में रखा गया है?
उत्तर:
समूह 2 में (IIA ).
प्रश्न 29.
आवर्त सारणी में p-ब्लॉक में तीसरे आवर्त में कुल तत्त्वों की संख्या क्या है?
उत्तर:
छ: (6).
प्रश्न 30.
s-ब्लॉक तत्त्वों में अधिकतम आयनन ऊर्जा वाला तत्त्व कौन-सा है?
उत्तर:
(Be) बेरीलियम।
प्रश्न 31.
d-ब्लॉक के तत्त्वों का सामान्य इलेक्ट्रॉनिक विन्यास क्या है?
उत्तर:
(n-1)d1 – 10 ns1-2.
प्रश्न 32.
क्षार धातुएँ प्रबल अपचायक क्यों होती क्यों है?
उत्तर:
क्योंकि क्षार धातुओं में इलेक्ट्रॉनों को त्यागने की प्रबल प्रवृत्ति होती है
प्रश्न 33.
हैलोजन प्रबल ऑक्सीकारक क्यों होते हैं?
उत्तर:
क्योंकि हैलोजनों में इलेक्ट्रॉनों को ग्रहण करने की प्रबल प्रवृत्ति होती है।
प्रश्न 34.
उन दो तत्त्वों के नाम लिखें, जिनके लिये मेण्डलीव ने आवर्त सारणी में स्थान छोड़ दिया था और जिनकी खोज बाद में हुई।
उत्तर:
स्कैण्डियम (Sc) तथा गैलियम (Ga).
प्रश्न 35.
92U के बाद के तत्त्व ट्रान्स- यूरेनिक तत्त्व कहलाते हैं।
उत्तर:
92U के बाद के तत्त्व कृत्रिम रूप से बनाये गये हैं, जिसके कारण इन तत्त्वों को ट्रान्स- यूरेनिक तत्त्व कहते हैं।
प्रश्न 36.
किन्हीं दो दुर्लभ मृदा तत्त्वों के नाम लिखो।
उत्तर:
- लैन्थेनम (La )
- सीरियम (Ce).
प्रश्न 37.
आवर्त सारणी में तत्त्वों का वर्गीकरण करने के लिये मेण्डलीव ने तत्त्वों के कौन से गुण का प्रयोग किया?
उत्तर:
परमाणु भार का।
प्रश्न 38.
लोथर मेयर वक्र के आधार पर तत्त्वों के गुण किसके आवर्ती फलन हैं?
उत्तर:
लोथर मेयर वक्र के आधार पर तत्त्वों के गुण सामान्यतः उनके परमाणु भारों के आवर्ती फलन होते हैं।
प्रश्न 39.
समान गुणों वाले तत्त्व एक ही वर्ग में क्यों रखे गये हैं?
उत्तर:
क्योंकि इनमें संयोजी इलेक्ट्रॉनों की संख्या समान होती है अथवा इलेक्ट्रॉनिक विन्यास समान होता है।
प्रश्न 40.
प्रारूपिक तत्त्व क्या हैं?
उत्तर:
s-ब्लॉक तथा p-ब्लॉक के तत्त्वों को सम्मिलित रूप से प्रारूपिक तत्त्व कहते हैं।
प्रश्न 41.
प्रथम बार तत्त्वों का आवर्ती वर्गीकरण किसने किया था?
उत्तर:
प्रथम बार तत्त्वों का आवर्ती वर्गीकरण इवानोविच मेण्डलीव ने किया था।
प्रश्न 42.
तत्त्वों के गुणों की आवर्तिता से आप क्या समझते हैं?
उत्तर:
एक नियमित अन्तर के बाद गुणों की पुनरावृत्ति होने को गुणों की आवर्तिता कहते हैं।
प्रश्न 43.
जिन तत्त्वों की सभी कक्षायें पूर्ण हैं वे कौन से तत्त्व हैं?
उत्तर:
वे तत्त्व अक्रिय गैसें हैं।
प्रश्न 44.
दुर्लभ तत्त्वों की संख्या कितनी है?
उत्तर:
कुल 14 तत्त्व, ये लैन्थेनॉइड हैं। (Ci से Cu तक)
प्रश्न 45.
दुर्लभ तत्त्वों के गुणों में अत्यधिक समानता क्यों पाई जाती है?
उत्तर:
इन तत्त्वों के सबसे बाहरी कोश का इलेक्ट्रॉनिक विन्यास समान होता है।
प्रश्न 46.
प्रत्येक आवर्त के अन्तिम तत्त्व कौन से हैं?
उत्तर:
प्रत्येक आवर्त के अन्तिम तत्त्व अक्रिय गैसें हैं।
प्रश्न 47.
मुद्रा धातुओं से क्या समझते हो?
उत्तर:
कॉपर, सिल्वर तथा गोल्ड को मुद्रा धातु कहते हैं क्योंकि इनका उपयोग मुद्राएँ बनाने में होता है।
प्रश्न 48.
आवर्त सारणी के भिन्न-भिन्न आवर्तों में तत्त्वों की संख्या भी भिन्न होती है, क्यों?
उत्तर:
क्योंकि प्रत्येक कोश में उपकोशों की संख्या अलग-अलग होती है तथा प्रत्येक आवर्त एक नये कोश के साथ भरना प्रारम्भ करता है इस प्रकार यह ns – np विन्यास पर पूर्ण हो जाता है।
प्रश्न 49.
f – ब्लॉक के तत्त्वों को अन्तः संक्रमण तत्त्व क्यों कहते हैं?
उत्तर:
f-ब्लॉक के तत्त्वों में अन्तिम इलेक्ट्रॉन (n – 2)f उपकोश में प्रवेश करता है। जबकि संक्रमण तत्त्वों में अन्तिम या विभेदी इलेक्ट्रॉन (- 1)d उपकोश में प्रवेश करता है।
![]()
प्रश्न 50.
क्षारीय मृदा तत्त्व क्या होते हैं?
उत्तर:
वे तत्त्व जिनके ऑक्साइड मृदा (सिलिका, SiO2) के समान गलनीय होते हैं तथा क्षारीय गुण व्यक्त करते हैं। क्षारीय मृदा तत्त्व कहलाते हैं, जैसे-Ca, Sr, Ba, Mg आदि।
प्रश्न 51.
MgO, Al2O3, Na, O, SO3 व p2O5 में सर्वाधिक क्षारीय ऑक्साइड कौन-सा है, और क्यों?
उत्तर:
Na, O सर्वाधिक क्षारीय ऑक्साइड है क्योंकि यह क्षारीय धातुओं का ऑक्साइड है।
प्रश्न 52.
सम- इलेक्ट्रॉनिक स्पीशीज में किसकी संख्या समान होती है?
उत्तर:
सम- इलेक्ट्रॉनिक स्पीशीज में इलेक्ट्रॉनों की संख्या समान होती है।
प्रश्न 53.
वर्ग 17 तथा वर्ग 18 के रेडियोऐक्टिव तत्त्वों के नाम लिखें।
उत्तर:
- ऐस्टेटीन (At) वर्ग-17
- रेडॉन (Rn) – वर्ग-18
प्रश्न 54.
122 परमाणु क्रमांक वाले तत्त्व का IUPAC नाम तथा प्रतीक क्या होगा?
उत्तर:
IUPAC के अनुसार 1 को un, 2 को bi कहते हैं। अत: 122 परमाणु क्रमांक वाले तत्त्व का नाम Unbibium (Ubb) होगा।
प्रश्न 55.
निम्नलिखित तत्त्वों को अधात्विक लक्षणों के बढ़ते हुए क्रम में व्यवस्थित कीजिए-
B, C, Si, N, F
उत्तर:
अधात्विक लक्षण का बढ़ता हुआ क्रम
Si < B < C < N < F
अधात्विक लक्षण आवर्त में बाएँ से दाएँ जाने पर बढ़ता है तथा समूह में ऊपर से नीचे आने पर घटता है।
प्रश्न 56.
निम्नलिखित तत्त्वों को धात्विक लक्षणों के बढ़ते क्रम में व्यवस्थित करें-
B, Al, Mg, K
उत्तर:
धात्विक लक्षणों का बढ़ता हुआ क्रम- B
प्रश्न 57.
निम्नलिखित आयनों को आकार के बढ़ते क्रम में व्यवस्थित कीजिए-
Be2+, Cl–, S2-, Na+, Mg2+, Br–
उत्तर:
बढ़ते हुए आकार का सही क्रम
Be2+ < Mg2+ < Na+ < Cl– < S2- < Br–
प्रश्न 58.
उन स्पीशीज का नाम लिखिए जो निम्न परमाणुओं या आयनों में से प्रत्येक की सम- इलेक्ट्रॉनिक स्पीशीज हैं-
(i) Na+ (ii) Cl– (iii) K+ (iv) Rb
उत्तर:
(i) Ne (ii) Ar (iii) Ca2+ (iv) Sr+.
प्रश्न 59.
एक तत्त्व तृतीय आवर्त में है। इसके संयोजी कोश में पाँच इलेक्ट्रॉन हैं। यह आवर्त सारणी के किस वर्ग से सम्बन्धित है?
उत्तर:
यह आवर्त सारणी के वर्ग 15 से सम्बन्धित है।
प्रश्न 60.
एक तत्त्व का इलेक्ट्रॉनिक विन्यास [Ar] 3d5 4s1 है। क्या यह s – ब्लॉक से सम्बन्धित है?
उत्तर:
नहीं, यह s – ब्लॉक से सम्बन्धित नहीं है। यह d – ब्लॉक का तत्त्व है।
प्रश्न 61.
निम्न संयोजी इलेक्ट्रॉनिक विन्यास वाले तत्त्वों के ब्लॉक लिखिए।
(i) 3s² 3p5
(ii) 3d10 4s2
(iii) 3p6 4s2
(iv) 4s1 3d5
उत्तर:
(i) 3s² 3p5 → p ब्लॉक के तत्त्व
(ii) 3d10 4s2 → d – ब्लॉक के तत्त्व
(iii) 3p6 4s2 → s – ब्लॉक के तत्त्व
(iv) 4s1 3d5 → d ब्लॉक के तत्त्व
प्रश्न 62.
जल में घुलनशील, सिल्वर हैलाइड कौन-सा है?
उत्तर:
जल में घुलनशील सिल्वर हैलाइड – AgF
प्रश्न 63.
जल में अघुलनशील सिल्वर हैलाइड कौन-सा है?
उत्तर:
जल में अघुलनशील सिल्वर हैलाइड – AgCl, AgBr, AgI।
प्रश्न 64.
जल में घुलनशील क्षारीय मृदा धातुओं के सल्फेटों के उदाहरण लिखिए।
उत्तर:
घुलनशील सल्फेट – BeSO4, MgSO4, BaSO4
प्रश्न 65.
जल में अघुलनशील सल्फेटों के उदाहरण दीजिए।
उत्तर:
अघुलनशील सल्फेट – CaSO4, SrSO4, BaSO4
प्रश्न 66.
उपधातुओं के कुछ उदाहरण लिखिए।
उत्तर:
सिलिकॉन (Si), आर्सेनिक (As), एन्टीमनी (Sb), टेलुरियम (Te).
प्रश्न 67.
p-ब्लॉक के तत्त्वों की कुल संख्या क्या है?
उत्तर:
p-ब्लॉक में कुल 30 तत्त्व होते हैं।
प्रश्न 68.
मेण्डलीव का पूरा नाम लिखिए।
उत्तर:
मेण्डलीव का पूरा नाम दमित्री इवानोविच मेण्डलीव था।
प्रश्न 69.
दुर्लभ मृदा धातुएँ किन्हें कहते हैं।
उत्तर:
वे धातुऐं जो पृथ्वी में पायी जाती हैं व इनकी उपलब्धता बहुत. ही कम मात्रा में होती है’ उन्हें दुर्लभ मृदा धातुएँ कहते हैं। ये f-ब्लॉक तत्त्व होते हैं। इन्हें अन्तः संक्रमण तत्त्व भी कहते हैं।
प्रश्न 70.
तीसरे आवर्त में 8 तत्त्व होते हैं, 18 तत्त्व नहीं, क्यों?
उत्तर:
तीसरा आवर्त 3s1 इलेक्ट्रॉन से भरना शुरू होता है और 3p6
प्रश्न 71.
प्रबलतम अधात्विक तत्त्व कौन-सा है?
उत्तर:
फ्लुओरीन (F) पर पूर्ण होता है।
प्रश्न 72.
अधिकतम इलेक्ट्रॉन बन्धुता वाला तत्त्व कौन-सा है?
उत्तर:
क्लोरीन (Cl)
प्रश्न 73.
एक तत्त्व की तृतीय इलेक्ट्रॉन बन्धुता शून्य (0) है। यदि यह तत्त्व तीसरे आवर्त का है तो इसका नाम लिखिए।
उत्तर:
नोवल गैसों की प्रथम इलेक्ट्रॉन बन्धुता लगभग शून्य होती है। सल्फर (S)
प्रश्न 74.
F, Cl, Br, I को बढ़ते हुए विद्युत ऋणात्मकता के क्रम में व्यवस्थित कीजिए।
उत्तर:
I < Br < Cl < F (विद्युत ऋणात्मकता)
प्रश्न 75.
इलेक्ट्रॉनिक विन्यास के आधार पर बतायें कि 15P31 आवर्त सारणी में कहाँ स्थित है?
उत्तर:
15P31 = 1s² 2s² 2p63s² 3p³.
आवर्त = तृतीय, ब्लॉक = p-ब्लॉक, वर्ग = 15 (VA)
प्रश्न 76.
सभी संक्रमण तत्त्व d-ब्लॉक के तत्त्व होते हैं परन्तु सभी d-block के तत्त्व संक्रमण तत्त्व नहीं कहलाते हैं। क्यों?
उत्तर:
वे सभी d-ब्लॉक के तत्त्व जिनकी मूल (आद्य) अवस्था अवस्था में 3d – कक्षक अपूर्ण भरित होते हैं, वे संक्रमण तत्त्व कहलाते हैं। परन्तु d-ब्लॉक के कुछ तत्त्व जैसे- Zn, Cd एवं Hg में 3d-कक्षक पूर्ण भरित होते हैं इन्हें संक्रमण तत्त्व नहीं माना गया है।
प्रश्न 77.
परमाणु क्रमांक 119 वाले तत्त्व की संयोजकता व ग्रुप बताएँ इसके बाह्यतम कोश का इलेक्ट्रॉनिक विन्यास तथा इसके ऑक्साइड का सामान्य सूत्र लिखें।
उत्तर:
समूह (group) = 1, संयोजकता = 1
बाह्यतम कोश का इलेक्ट्रॉनिक विन्यास = 8s1
ऑक्साइड का सूत्र = M2O
प्रश्न 78.
हैलोजनों को बढ़ती हुई विद्युत ऋणात्मकता के क्रम में लिखिये।
उत्तर:
I < Br < Cl< F (विद्युत – ऋणात्मकता का क्रम )
प्रश्न 79.
N की इलेक्ट्रॉन बन्धुता C से कम होती है, क्यों?
उत्तर:
क्योंकि N का इलेक्ट्रॉनिक विन्यास स्थायी होता है।
प्रश्न 80.
हैलोजन सबसे अधिक ऋण विद्युती होते हैं, क्यों।
उत्तर:
आवर्त में बायें से दायें चलने पर प्रभावी नाभिकीय आवेश बढ़ता है। अत: हैलोजनों की इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति भी बढ़ती है।
प्रश्न 81.
धातुओं के ऑक्साइड क्षारीय होते हैं, क्यों?
उत्तर:
क्योंकि धातुओं के ऑक्साइड जल से क्रिया करके क्षार बनाते हैं।
प्रश्न 82.
अधातुओं के ऑक्साइड अम्लीय होते हैं, स्पष्ट कीजिए।
उत्तर:
अधातुओं के ऑक्साइड जल से क्रिया करके अम्ल बनाते हैं।
प्रश्न 83.
एक तत्त्व की तृतीय इलेक्ट्रॉन बन्धुता का मान शून्य हो जाता है। यह तत्त्व तीसरे आवर्त में स्थित होता है। उस तत्त्व का नाम बताइये।
उत्तर:
सल्फर (S).
प्रश्न 84.
उत्कृष्ट गैसों में सहसंयोजक त्रिज्या नहीं होती है, कारण स्पष्ट कीजिए।
उत्तर:
चूँकि उत्कृष्ट गैसों के परमाणु परस्पर सहसंयोजक बन्ध नहीं बनाते हैं इसलिये उत्कृष्ट गैसें सहसंयोजक त्रिज्या नहीं बनाती हैं।
प्रश्न 85.
सबसे प्रबल अधात्विक लक्षण वाले तत्त्व का नाम बताओ?
उत्तर:
फ्लुओरीन (F).
प्रश्न 86.
SO2 की अपेक्षा SO2 प्रबल अम्लीय है, स्पष्ट कीजिए।
उत्तर:
किसी अधातु के ऑक्साइड में ऑक्सीकरण बढ़ने के साथ उसकी अम्लीय प्रकृति बढ़ती है। इस कारण SO2 ज्यादा अम्लीय है।
प्रश्न 87.
हैलोजन प्रबल ऑक्सीकारक क्यों हैं?
उत्तर:
क्योंकि हैलोजन के अन्दर इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति अधिकतम होती है।
प्रश्न 88.
हैलोजनों को उनकी घटती ऑक्सीकारक क्षमता के क्रम में लिखिये।
उत्तर:
F2 > Cl2 > Br2 > I2
प्रश्न 89.
उत्कृष्ट गैसों का परमाणु आकार हैलोजनों से अधिक क्यों होता है?
उत्तर:
उत्कृष्ट गैसों का परमाणु आकार हैलोजनों से अधिक होता है, क्योंकि वाण्डर वाल्स त्रिज्या सह संयोजी त्रिज्या से बड़ी होती है।
![]()
प्रश्न 90.
क्षार धातुओं की आयनन ऊर्जा निम्नतम क्यों होती है।
उत्तर:
इनका परमाणु आकार बड़ा होता है जिसमें संयोजी इलेक्ट्रॉनों तथा नाभिक के मध्य आकर्षण कम होता है।
प्रश्न 91.
सोडियम एक प्रबल धन विद्युतीय तत्त्व क्यों है?
उत्तर:
सोडियम की आयनन एन्थैल्पी कम है, क्योंकि यह एक इलेक्ट्रॉन निकाल कर धन आयन बनाता है, अतः यह प्रबल धन- विद्युतीय है।

प्रश्न 92.
निम्नलिखित तत्त्वों में से किस तत्त्व की प्रथम आयनन एन्यैल्पी सबसे कम है और क्यों?
Na, F, I, Mg
उत्तर:
Na, F, I, Mg में आयोडीन (I) की आयनन एन्थल्पी सबसे कम है, क्योंकि इसका आकार इन सबसे उच्च है।
प्रश्न 93.
प्रभावी नाभिकीय आवेश के मान में प्रयुक्त परिरक्षण नियतांक (σ) को ज्ञात करने का नियम किस वैज्ञानिक ने दिया था?
उत्तर:
स्लेटर ने।
प्रश्न 94.
प्रभावी नाभिकीय आवेश पर टिप्पणी दीजिए।
उत्तर:
नाभिकीय आवेश का वह भाग जिसे संयोजी इलेक्ट्रॉन महसूस करता है, प्रभावी नाभिकीय आवेश कहलाता है।
प्रश्न 95.
आवर्त में किस सदस्य के तत्त्वों का आकार सबसे कम होता है और क्यों?
उत्तर:
आवर्त में हैलोजन तत्त्वों का आकार सबसे कम होता है क्योंकि इनका प्रभावी नाभिकीय आवेश बहुत अधिक होता है।
प्रश्न 96.
आवर्त सारणी में स्थित संक्रमण तत्त्वों में आवर्त में Sc से Mn तक जाने पर आकार लगातार कमी होती जाती हैं, क्यों?
उत्तर:
क्योंकि Sc से Mn तक जाने पर नाभिकीय आकर्षण बल बढ़ता है। यह बल परिरक्षण प्रभाव से अधिक होता है। अतः आकार में लगातार कमी होती जाती है।
प्रश्न 97.
आवर्त सारणी में संक्रमण धातुओं में Mn, Fe, Co तथा Ni के आकार लगभग समान क्यों होते हैं?
उत्तर:
इन तत्त्वों में नाभिकीय आकर्षण बल तथा परिरक्षण प्रभाव दोनों आपस में तुल्य होते हैं, जिसके कारण Mn Fe Co तथा Ni के आकार लगभग समान होते हैं।
प्रश्न 98.
Cr तथा Mn धातु के एक-एक अम्लीय ऑक्साइड तथा उनके द्वारा प्राप्त अम्ल का नाम लिखिये।
उत्तर:
- Cr का अम्लीय ऑक्साइड CrO3 [क्रोमियम (VI) ऑक्साइड) होता है तथा इससे प्राप्त अम्ल H, Cro
- Mn का अम्लीय ऑक्साइड Mn2O7 [मँगनीज (VII) ऑक्साइड] होता है तथा इससे प्राप्त अम्ल HMnO4 है।
प्रश्न 99.
Cl2O7 किस अम्ल का अम्लीय ऐनहाइड्राइड है?
उत्तर:
Cl2O7 (क्लोरीन (VII) ऑक्साइड) HClO4 का अम्लीय ऐनहाइड्राइड है।
प्रश्न 100.
ZnO, N2O2, P2O5 तथा MgO को उनके बढ़ते हुए अम्लीय लक्षण के क्रम में लिखिए।
उत्तर:
MgO < Na2O < ZnO < p2O5.
(धातुओं के ऑक्साइड क्षारीय जबकि अधातुओं के ऑक्साइड अम्लीय होते हैं।)
प्रश्न 101.
Cl2O3, Cl2O तथा Cl2O5 ऑक्साइडों को उनकी अम्लीयता के बढ़ते क्रम में व्यवस्थित कजिए।
उत्तर:
जैसे-जैसे ऑक्सीकरण संख्या बढ़ती जाती है, वैसे-वैसे अम्लीयता भी बढ़ती जाती है। अतः अम्लीयता का क्रम निम्न प्रकार होगा-
(I) (III) (V)
Cl2O < Cl2O3 < Cl2O5
प्रश्न 102.
क्षार धातुओं में सबसे अधिक एवं सबसे कम आयनन ऊर्जा किसकी होती है?
उत्तर:
क्षार धातुओं में सबसे अधिक आयनन ऊर्जा II की तथा सबसे कम Cs की होती है।
प्रश्न 103.
क्षार धातुएँ प्रबल अपचायक तथा सबसे अधिक धन विद्युती होती हैं, स्पष्ट करें।
उत्तर:
क्षार धातुओं में इलेक्ट्रॉनं त्यागने की प्रवृत्ति अधिकतम होती हैं क्योंकि इनकी आयनन एन्थैल्पी बहुत कम होती है अतः ये प्रबल अपचायक होने के साथ-साथ सर्वाधिक धन विद्युती होती हैं।
प्रश्न 104.
हैलोजन की द्वितीय इलेक्ट्रॉन बन्धुता शून्य होती है, क्यों?
उत्तर:
हैलोजनों का इलेक्ट्रॉनिक विन्यास ns2 np5 होता है। अत: यह केवल एक इलेक्ट्रॉन ग्रहण कर ns² np6 का स्थायी विन्यास प्राप्त कर लेता है। इस विन्यास में अब दूसरा इलेक्ट्रॉन जोड़ना सम्भव नहीं होता है। अत: हैलोजन की द्वितीय इलेक्ट्रॉन बन्धुता शून्य होती है।
प्रश्न 105.
Cl– आयन का आकार Cl परमाणु से बड़ा क्यों होता है?
उत्तर:
Cl परमाणु के द्वारा एक इलेक्ट्रॉन ग्रहण कर लेने पर प्राप्त Cl– आयन में प्रभावी नाभिकीय आवेश कम हो जाता है एवं अन्तर इलेक्ट्रॉनिक प्रतिकर्षण बढ़ता है अतः संयोजी कक्ष बाहर की ओर फैल जाता है। इसलिए आकार बढ़ जाता है।
प्रश्न 106.
उत्कृष्ट गैसों का परमाणु आकार हैलोजनों से अधिक क्यों होता है?
उत्तर:
उत्कृष्ट गैसों का परमाणु आकार हैलोजनों से अधिक होता है क्योंकि वाण्डर वाल्स त्रिज्याएँ सहसंयोजी त्रिज्याओं से बड़ी होती हैं।
प्रश्न 107.
वर्ग के तत्त्व क्षार धातुएँ क्यों कहलाते हैं?
उत्तर:
वर्ग के तत्त्व क्षार धातुएँ इसलिये कहलाते हैं क्योंकि इनके ऑक्साइड जल में विलेय क्षार बनाते हैं तथा इनकी राख क्षारीय प्रकृति की होती हैं।
प्रश्न 108.
निम्नलिखित ऑक्साइडों में सर्वाधिक क्षारीय ऑक्साइड कौन-सा है?
Na, O, As, O BaO, Al, O.
उत्तर:
उपरोक्त ऑक्साइडों में सर्वाधिक क्षारीय ऑक्साइड Na2O है क्योंकि यह प्रथम समूह में उपस्थित है तथा प्रथम समूह के ऑक्साइड सर्वाधिक क्षारीय होते हैं।
प्रश्न 109.
Al की तुलना में Mg की ∆1H1 या IE1 अधिक क्यों होती है?
उत्तर:
Al के छोटे आकार एवं अधिक इसकी प्रथम आयनन ऊर्जा का मान नाभिकीय आवेश के कारण Mg से अधिक होने की आशा की जाती है परन्तु वास्तव में यह कम होती है क्योंकि Mg का इलेक्ट्रॉनिक विन्यास पूर्ण पूरित अर्थात् अधिक सममित होता है।
Mg के अन्तर कक्षा का इलेट्रॉनिक विन्यास 3s² है जिसका भेदन प्रभाव उच्च है। अतः IE1 ज्यादा होगी।
प्रश्न 110.
शून्य वर्ग की आयनन ऊर्जा आवर्त सारणी में अधिकतम क्यों होती है?
उत्तर:
पूर्णपूरित इलेक्ट्रॉनिक विन्यास (ns² np6) के कारण उत्कृष्ट गैसों में से एक इलेक्ट्रॉन को निकालना अत्यन्त मुश्किल होता है। अतः उत्कृष्ट गैसों की आयनन ऊर्जा सर्वाधिक होती है।
प्रश्न 111.
आवर्त सारणी में उच्चतम आयनन विभव किस तत्त्व का होता है?
उत्तर:
आवर्त सारणी में उच्चतम आयनन विभव He हीलियम का होता है क्योंकि इसका आकार छोटा होता है व इलेक्ट्रॉनिक विन्यास 1s² होता है। अतः इलेक्ट्रॉन को निकालने के लिये अत्यधिक ऊर्जा की आवश्यकता होती है।
प्रश्न 112.
निम्न को प्रथम आयनन एन्थैल्पी के घटते क्रम में व्यवस्थित करिए-
Mg, Al, P, S, Cl, Ne
उत्तर:
Ne > C1 > SP > Al > Mg (होना चाहिये।)
परन्तु यह गलत क्रम है क्योंकि P की आयनन एन्यैल्पी स्थाई अर्द्धपूर्ण विन्यास के कारण S से ज्यादा होनी चाहिये। इसी प्रकार Mg की Al से ज्यादा आयनन एन्थैल्पी होनी चाहिये। अतः सही क्रम होगा।
Ne > Cl > P > S > Mg > Al (सही क्रम)
प्रश्न 113.
Ga व Al की प्रथम आयनन एन्थैल्पी के मान लगभग समान क्यों होते हैं?
उत्तर:
निम्न परिरक्षण प्रभाव के कारण Al व Ga के आकार लगभग समान होते हैं। इस कारण इन दोनों तत्त्वों की प्रथम आयनन एन्थैल्पी के मान लगभग समान होते हैं।
प्रश्न 114.
क्षारीय मृदा धातुओं की इलेक्ट्रॉन लब्धि एन्थैल्पी लगभग शून्य क्यों होती है?
उत्तर:
पूर्ण भरे कक्षक ns² तथा इलेक्ट्रॉन ग्रहण करने की बहुत कम क्षमता के कारण क्षारीय मृदा धातुओं की इलेक्ट्रॉन बन्धुता शून्य होती है।
प्रश्न 115.
N व P की इलेक्ट्रॉन लब्धि एन्थैल्पी का मान क्रमशः C व SI से कम होता है, क्यों?
उत्तर:
NP में अर्द्धपूर्ण भरे कक्षक (ns² np³) होते हैं जो अधिक स्थायी होते हैं। अत: इनकी इलेक्ट्रॉन लब्धि एन्थैल्पी का मान C व Si से कम होता है।
N < C, P < Si
प्रश्न 116.
A की संयोजकता 3 व B की संयोजकता 2 है। A की विद्युत ऋणात्मकता का मान B से अधिक है तो यौगिक का सूत्र होगा।
उत्तर:
B3A2.
प्रश्न 117.
Li+, Mg2+, K+ तथा Al3+ को बढ़ती आयनिक त्रिज्या के क्रम में लिखिए।
उत्तर:
Li+ < Al3+ < Mg2+ < K+.
प्रश्न 118.
Na, Mg व AI को बढ़ते धन विद्युती क्रम में लिखिए।
उत्तर:
Al < Mg < Na (बढ़ता हुआ धन विद्युतीक्रम)।
प्रश्न 119.
N3-, Na+, F–, O2- व Mg2+ को आयनिक आकार के बढ़ते क्रम में व्यवस्थित करिए।
उत्तर:
Mg2+ < Na+ < F– < O2- < N3- (आयनिक आकार)
प्रश्न 120.
Cl–, S2-, Ca2+ व Ar को बढ़ते हुये आकार के क्रम में व्यवस्थित करिए।
उत्तर:
Ca2+ < Ar < Cl– < S2- (बढ़ते हुए आकार का क्रम)
![]()
प्रश्न 121.
CO2, N2O5, SiO2 व SiO3 को बढ़ते हुए अम्लीय लक्षण के क्रम में लिखिये।
उत्तर:
SiO2 < CO2 < N2O5 < SO3 (बढ़ते हुए अम्लीय लक्षणों का क्रम)
प्रश्न 122.
F, Cl, Br तथा I को उनकी इलेक्ट्रॉन बन्धुता बढ़ते क्रम में लिखिए।
उत्तर:
I < Br < F
प्रश्न 123.
6A12, 7B14, 8C16 तथा 9D19 को उनकी आयनन ऊर्जा के बढ़ते क्रम में व्यवस्थित करिए।
उत्तर:
A < C < B < D (आयनन ऊर्जा)
प्रश्न 124.
AsH3, NH3, PH3, BiH, तथा SbH3 को अपचायक क्षमता के बढ़ते क्रम में व्यवस्थित करिए।
उत्तर:
NH3 < PH3 < AsH3 < SbH3 < BiH3 (अपचायक क्षमता)
प्रश्न 125.
हैलाइड आयनों की अपचायक क्षमता का घटता क्रम लिखिए।
उत्तर:
I– > Br– > Cl– > F– (अपचायक क्षमता)
प्रश्न 126.
H2SO3 की अपेक्षा H2SO4 प्रबल ऑक्सी अम्ल होता है, क्यों?
उत्तर:
ऑक्सी अम्लों में ऑक्सीजन की संख्या बढ़ाने पर ऑक्सी अम्लों की तीव्रता भी बढ़ती जाती है। इस कारण HSO4 प्रबल ऑक्सी अम्ल है जबकि H2SO3 कम प्रबल ऑक्सी अम्ल है।
प्रश्न 127.
सबसे प्रबल अम्लीय ऑक्साइड कौन-सा होता है?
उत्तर:
Cl2O7 [क्लोरीन (VII) ऑक्साइड]
प्रश्न 128.
निम्नलिखित तत्त्वों को इलेक्ट्रॉन बन्धुता के बढ़ते क्रम में व्यवस्थित करिए-
Be, B, C, N, O, F, Ne.
उत्तर:
Ne < Be < N < B < C < O < F
(इलेक्ट्रॉन बन्धुता)
प्रश्न 129.
VII A वर्ग के तत्त्वों की क्रियाशीलता VIA वर्ग के तत्त्वों से अधिक होती है, क्यों?
उत्तर:
क्योंकि VII A वर्ग के तत्त्वों की इलेक्ट्रॉन बन्धुता VIA वर्ग के तत्त्वों से अधिक होती है। इसलिये VII A वर्ग के तत्त्व अधिक क्रियाशील होते हैं।
प्रश्न 130.
S की इलेक्ट्रॉन बन्धुता O से अधिक होती है, क्यों?
उत्तर:
O का आकार छोटा होता है। इस कारण इलेक्ट्रॉन घनत्व सल्फर से उच्च होता है जिससे आने वाला इलेक्ट्रॉन ऑक्सीजन के ऊपर अधिक इलेक्ट्रॉन घनत्व होने के कारण प्रतिकर्षण महसूस करता है।
अतः इलेक्ट्रॉन बन्धुत का मान कम हो जाता है जबकि सल्फर की इलेक्ट्रॉन बन्धुता अधिक हो जाती है। क्रम लिखिए।
प्रश्न 131.
द्वितीय आवर्त के तत्त्वों की इलेक्ट्रॉन बन्धुता का सही
उत्तर:
Be < Li < N < B < C < O < F (इलेक्ट्रॉन बन्धुता)
प्रश्न 132.
क्षारीय धातुओं के हाइड्रॉक्साइड प्रबलतम क्षारीय क्यों होते हैं?
उत्तर:
आयनन विभव के मान निम्नतम होने के कारण क्षारीय धातुओं के हाइड्रॉक्साइड प्रबलतम क्षारीय होते हैं।
प्रश्न 133.
क्षार धातुएँ (+1) ऑक्सीकरण अवस्था प्रदर्शित करती हैं? ये (+2) ऑक्सीकरण अवस्था प्रदर्शित नहीं करतीं, क्यों?
उत्तर:
क्योंकि क्षार धातुओं की प्रथम व द्वितीय आयनन एन्थैल्पी में अन्तर 16 eV से अधिक होता है।
प्रश्न 134.
Mg तत्त्व (+ 2) ऑक्सीकरण अवस्था प्रदर्शित करता है (+ 1) नहीं, क्यों?
उत्तर:
क्योंकि Mg तत्त्व के प्रथम व द्वितीय आयनन विभवों में अन्तर 11 eV से कम होता है।
प्रश्न 135.
HF, HCl, HBr तथा HI की अम्लीय प्रबलता का बढ़ता हुआ क्रम लिखिए।
उत्तर:
HF < HCl < HBr < HI (अम्लीय प्रबलता)
प्रश्न 136.
F2, Cl2, Br2 तथा I2 की बढ़ती हुयी क्रियाशीलता का क्रम लिखिए।
उत्तर:
I2 < Br2 < Cl2 < F2 (क्रियाशीलता)
प्रश्न 137.
Li, B तथा Be को प्रथम आयनन ऊर्जा के बढ़ते हुए क्रम में व्यवस्थित करिए।
उत्तर:
Li < B < Be (प्रथम आयनन विभव)
प्रश्न 138.
F2, N2, Cl2, तथा O2 को बढ़ती बन्ध लम्बाई के क्रम में व्यवस्थित करिए।
उत्तर:
N2 < O2 < F2 < Cl2 (बन्ध लम्बाई)
प्रश्न 139.
HClO, HClO2, HClO3, HClO4 को तापीय स्थायित्व के बढ़ते हुए क्रम में व्यवस्थित करिए।
उत्तर:
HClO < HClO2 < HClO3 < HClO4
(तापीय स्थायित्व )
प्रश्न 140.
N2, O2, F2 व Cl2 को बन्ध वियोजन ऊर्जा के बढ़ते हुए क्रम में व्यवस्थित करिए।
उत्तर:
F2 < C2 > O2 N2 (बन्ध वियोजन ऊर्जा)
प्रश्न 141.
O, O–, O2- को आयनिक त्रिज्या के बढ़ते क्रम में लिखिए।
उत्तर:
O < O– < O2- (आयनिक त्रिज्या)
प्रश्न 142.
Na+, O2-, F– को आयनिक त्रिज्या के बढ़ते क्रम में व्यवस्थित करिए।
उत्तर:
Na+ < F– < O2-.
प्रश्न 143.
निम्न युग्मों में से किसकी इलेक्ट्रॉन लब्धि एन्थैल्पी अपेक्षाकृत अधिक ऋणात्मक है-
(i) Br, Cl
(ii) F, Cl
(iii) O, S
(iv) O, O-
उत्तर:
(i) Cl
(ii) Cl
(iii) S
(iv) O.
लघु उत्तरीय प्रश्न
प्रश्न 1.
वर्ग 15 के तत्त्वों के हाइड्राइडों में N का हाइड्राइड (NH3) सबसे अधिक स्थायी होता है। क्यों ?
उत्तर:
वर्ग 15 के तत्त्वों में धन विद्युती गुण N से Bi तक बढ़ता जाता है। इस प्रकार N सर्वाधिक इलेक्ट्रॉन ऋणात्मकता वाला तत्त्व है। यहाँ NH3 में H एक विद्युतधनी तत्त्व है जबकि N विद्युतऋणी तत्त्व की भाँति कार्य करता है, विद्युत ऋणात्मकता में अन्तर के कारण इस NH3 एक स्थायी यौगिक हो जाता है।
प्रश्न 2.
आवर्त सारणी में लैन्थेनॉइडों और एक्टिनॉइडों की संख्या केवल 14-14 है, क्यों ?
उत्तर:
लैन्थेनॉइड तथा एक्टिनॉइड दोनों ही f-ब्लॉक के तत्त्व हैं, अर्थात् दोनों में ही अन्तिम इलेक्ट्रॉन f- उपकोश में प्रवेश करता है जिसमें अधिकतम 14 इलेक्ट्रॉन ही आ सकते हैं। इस कारण लैन्येनॉइडों व एक्टिनॉइडों में अधिकतम 14-14 तत्त्व होते हैं।
प्रश्न 3.
आवर्त सारणी में Ar (परमाणु भार 39.90) को K (परमाणु भार 39.10) से पहले क्यों रखा गया है?
उत्तर:
आधुनिक आवर्त सारणी में तत्त्वों को परमाणु क्रमांक के बढ़ते हुए क्रम में व्यवस्थित किया गया है। Ar का परमाणु क्रमांक (18) तथा K का परमाणु क्रमांक (19) है अत: Ar को K से पहले रखा गया है। Ar सक्रिय गैस तत्त्व है जो कि समूह 18 (शून्य) में आता है जबकि K एक क्षार धातु तत्त्व है इसे समूह l (IA) में रखा गया है।
प्रश्न 4.
सोडियम एक प्रबल धातु है जबकि क्लोरीन एक प्रबल अधातु है क्यों ?
उत्तर:
सोडियम (ns1) की आयनन ऊर्जा बहुत कम होती है। इस कारण सोडियम की प्रवृत्ति इलेक्ट्रॉन त्यागने की होती है। इस प्रवृत्ति के कारण यह एक प्रबल धातु है जबकि क्लोरीन का इलेक्ट्रॉनिक विन्यास (ns² np5) होता है। इसकी इलेक्ट्रॉन बन्धुता बहुत अधिक है। अतः इसकी प्रवृत्ति इलेक्ट्रॉन ग्रहण करने की होती है, अत: Cl एक प्रबल अधातु है।
प्रश्न 5.
आवर्त सारणी में एक नियमित अन्तर के बाद तत्त्व के गुणों की पुनरावृत्ति होती है। इस गुण को आवर्तिता (Periodicity) कहते हैं। इसका कारण स्पष्ट कीजिए।
उत्तर:
आधुनिक आवर्त सारणी में तत्त्वों को परमाणु क्रमांक के बढ़ते हुए क्रम में व्यवस्थित किया जाता है जिससे उनके इलेक्ट्रॉनिक विन्यास की पुनरावृत्ति होती है, इसे आवर्तिता कहते हैं। इलेक्ट्रॉनिक विन्यास में आवर्ती परिवर्तन (Periodic Change) ही तत्त्वों के गुणों में आवर्तिता का कारण है।
![]()
प्रश्न 6.
किसी वर्ग में ऊपर से नीचे आने पर तत्त्वों का ऑक्सीकारक गुण क्यों घट जाता है।
उत्तर:
वर्ग में ऊपर से नीचे की ओर आने पर आयनन विभव मान में कमी आती जिसके कारण इलेक्ट्रॉनों को त्यागने की प्रवृत्ति बढ़ती है अर्थात् अपचायक गुण बढ़ता है तथा ऑक्सीकारक गुण घट जाता है।
प्रश्न 7.
निम्न परमाणु क्रमांक वाले तत्त्वों में प्रत्येक का ब्लॉक व आवर्त क्या होगा ?
(1) 25
(2) 30
(3) 35
(4) 19
(5) 12
उत्तर:
(1) 25 = 1s² 2s² 2p6 3s² 3p6 3d5 4s²
ब्लॉक – d
आवर्त – चौथा (4)
वर्ग – सातवां (7)
(2) 30 = 1s² 2s² 2p6 3s² 3p6 3d10 4s²
ब्लॉक ⇒ d
आवर्त ⇒ चौथा (4)
वर्ग ⇒ बारहवां (12)
(3) 35 = 1s² 2s³ 2p6 3s² 3p6 3d10 4s² 4p5
ब्लॉक = p
आवर्त = चौथा (4)
वर्ग = 17
(4) 19 = 1s² 2s² 2p6 3s² 3p6 4s1
ब्लॉक – s
आवर्त चौथा – (4)
वर्ग प्रथम – (1)
(5) 12 = 1s² 2s² 2p6 3s²
ब्लॉक – s
आवर्त तृतीय – (3)
द्वितीय – (2)
प्रश्न 8.
निम्न में से प्रत्येक का नाम व परमाणु क्रमांक लिखिए।
(1) छठी उत्कृष्ट गैस (The sixth noble gas)
(2) तीसरी क्षार धातु (The third alkali metal)
(3) चौथा संक्रमण तत्त्व (The fourth transition element)
(4) चौथी हैलोजन (The fourth halogen)
उत्तर:
(1) Rn (परमाणु क्रमांक: 86)
(2) K (परमाणु क्रमांक 19)
(3) Cr (परमाणु क्रमांक 24)
(4) 1 (परमाणु क्रमांक : 53)
प्रश्न 9.
निम्न गुणों को क्रम में व्यवस्थित कीजिए-
(1) क्षार धातुओं के गलनांक
(2) हैलोजनों के क्वथनांक
(3) सोडियम हैलाइडों के गलनांक
(4) क्षार धातुओं के फ्लुओराइडों की घुलनशीलता।
उत्तर:
(1) Li > Na > KR > b > Cs.
(क्षार धातुओं के गलनांक)
(2) I2 > Br2 > Cl2 > F2
(हैलोजनों के क्वथनांक)
(3) NaF > NaCl > NaBr Nal
(सोडियम हैलाइडों के गलनांक)
(4) CsF > RbF > KF > NaF > LiF
(फ्लुओराइडों की घुलनशीलता)
प्रश्न 10.
यदि तत्त्वों के विन्यास निम्न प्रकार हैं तो प्रत्येक तत्त्व का ब्लॉक तथा वर्ग बताइए।
(i) 3s² 3p5
(ii) 3d10 4s²
(iii) 3s² 3p6 4s1
(iv) 6s² 4f3
उत्तर:
(i) p-ब्लॉक, वर्ग = 17
(ii) d-ब्लॉक, वर्ग = 12
(iii) ब्लॉक, वर्ग = 1
(iv) f-ब्लॉक, वर्ग = 3
प्रश्न 11.
एक तत्त्व का इलेक्ट्रॉनिक विन्यास 1s² 2s² 2p6, 3s² 3p6, 4s1 है तथा इसका परमाणु भार 39 है।
(i) इसके नाभिक में न्यूट्रॉनों की संख्या क्या होगी ?
(ii) इस तत्त्व का आवर्त सारणी में स्थान बताएँ।
(iii) इस तत्त्व का नाम व प्रतीक क्या है?
उत्तर:
(i) तत्त्व का परमाणु क्रमांक = 15
परमाणु भार = 39
न्यूट्रॉनों की संख्या = 39 – 19
= 20
(ii) आवर्त सारणी में इसका स्थान,
ब्लॉक s
आवर्त = 4
वर्ग = I (IA)
(iii) पोटैशियम (K)
प्रश्न 12.
निम्नलिखित परमाणु क्रमांकों के IUPAC नाम तथा प्रतीक लिखिए।
(1) 104
(2) 108
(3) 110
(4) 115
(5) 120
उत्तर:
| परमाणु क्रमांकों | संकेत | नाम |
| (1) 104 | Unq | अननिलक्वाडियम (Unnilquadium) |
| (2) 108 | Uuo | अननिलऑक्टियम (Unniloctium) |
| (3) 110 | Uun | अनअननिलियम (Ununnilium) |
| (4) 115 | Uup | अनअनपेन्टियम (Ununpentium) |
| (5) 120 | Ubn | अनबाईनिलियम (Unbinilium) |
प्रश्न 13.
किसी वर्ग में परमाणु क्रमांक वृद्धि के साथ गलनांक (m. pt.) तथा क्वथनांक (b.pt.) घटता है। स्पष्ट कीजिए।
उत्तर:
किसी वर्ग में परमाणु क्रमांक के बढ़ने पर प्रोटॉनों तथा इलेक्ट्रॉनों के मध्य आकर्षण बल का मान घटता है। जिसके फलस्वरूप उनकी अवस्था परिवर्तन में धीरे-धीरे कम ऊर्जा खर्च करनी पड़ती है। जिससे अवस्था परिवर्तन (ठोस से द्रव) कम तापक्रम पर होता है।
व्यय ऊर्जा ∝ तापक्रम
अतः किसी वर्ग में ऊपर से नीचे की ओर आने पर तत्त्वों के परमाणु क्रमांकों की वृद्धि के साथ गलनांकों तथा क्वथनांकों के मानों में कमी होती जाती है।
प्रश्न 14.
मेण्डलीव की आवर्त सारणी के सामान्य लक्षण लिखिए।
उत्तर:
मेण्डलीव की आवर्त सारणी के सामान्य लक्षण निम्नलिखित हैं।
- प्रत्येक आवर्त में तत्त्व अपने परमाणु भारों के बढ़ते हुए क्रम में व्यवस्थित हैं।
- एक ही समूह के सभी तत्त्वों के गुण-धर्म समान होते हैं।
- प्रत्येक आवर्त में बाएँ से दाएँ जाने पर तत्त्वों की ऋण विद्युत संयोजकता कम होती जाती है। जबकि धन विद्युत संयोजकता बढ़ती जाती है।
- तत्त्वों का परमाणु भार उसका मौलिक गुण होता है।
- आवर्त सारणी में रिक्त स्थानों के तत्त्वों के गुण-धर्मों को पहले ही बताया जा सकता है।
प्रश्न 15.
लघु आवर्त तथा दीर्घ आवर्त से क्या तात्पर्य है ? आवर्त सारणी में कितने लघु आवर्त तथा कितने दीर्घं आवर्त होते हैं।
उत्तर:
लघु आवर्त (Short Period) – जिन आवतों में तत्वों की संख्या 8 होती है, उन्हें लघु आवर्त कहते हैं।
दीर्घं आवर्त (Long Period) – जिन आवर्ती में तत्त्वों की संख्या 8 से अधिक होती है, उन्हें दीर्घ आवर्त कहते हैं।
आवर्त सारणी में प्रथम तीन आवर्त (प्रथम, द्वितीय व तृतीय) लघु आवर्त कहलाते हैं। इनमें प्रथम आवर्त दो तत्व हैं, जबकि द्वितीय व तृतीय आवर्त में आठ-आठ तत्त्व है। आवर्त सारणी में बाद के चार आवर्त (चतुर्थ, पंचम, षष्टम तथा सप्तम) दीर्घ आवर्त कहलाते हैं। इनमें चतुर्थ व पंचम आवतों में 18-18 तत्त्व हैं, जबकि षष्ठम आवर्त में 32 तत्त्व हैं और सप्तम आवर्त अपूर्ण है।
प्रश्न 16.
नये तत्त्वों की खोज में मेण्डलीव की आवर्त सारणी की क्या उपयोगिता है?
उत्तर:
मेण्डलीव ने अपनी मूल आवर्त सारणी में नये तत्त्वों के लिये ने. कई खाली स्थान छेड़ दिये थे तथा इन तत्त्वों के गुणों के बारे में जानकारी भी दी थी। इस सारणी के ज्ञान से ही नये तत्त्वों को खोजने में काफी सहायता मिली। इन तत्त्वों की खोज के बाद पाये गये इन तत्त्वों के गुण मेण्डलीव के द्वारा बताये गये गुणों के समान ही थे। उदाहरण-स्कैण्डियम (Sc), गैलियम (Ga), जर्मेनियम (Ge) आदि की खोज काफी समय बाद हुई थी।
प्रश्न 17.
आवर्त सारणी में किन तत्त्वों को प्रारूपी तत्त्व कहते हैं? उनके नाम लिखिए।
उत्तर:
प्रारूपी या प्रतिरूपी या निरूपक तत्त्व (Typical elements) द्वितीय एवं तृतीय आवर्त के तत्त्व प्रतिरूपी या निरूपक तत्त्व (representative or typical elements) कहलाते हैं ये तत्त्व अपने वर्गों में उपस्थित अन्य तत्त्वों का आदर्श प्रतिनिधित्व करते हैं। Li व Na प्रथम वर्ग (I group) के निरूपक तत्त्व हैं जबकि Be व Mg द्वितीय वर्ग (II group) के निरूपक तत्त्व हैं। इस प्रकार अन्य वर्गों के निरूपक तत्त्व निम्न प्रकार है।
| वर्ग (group) | I | II | III | IV | V | VI | VII |
| द्वितीय आवर्त | Li | Be | B | C | N | O | F |
| तृतीय आवर्त | Na | Mg | Al | Si | P | S | Cl |
प्रश्न 18.
सेतु तत्त्व (Bridge elements) कौन से तत्त्व होते हैं? टिप्पणी लिखिए।
उत्तर:
सेतु तत्त्व (Bridge elements) – तृतीय आवर्त (3rd period) में I से VII वर्ग के तत्त्व सेतु तत्त्व (Bridge elements) कहलाते हैं। ये तत्त्व अपने वर्ग के दोनों उपवर्गों (Sub-group) के तत्त्वों के मध्य एक सेतु (Bridge) का कार्य करते हैं। इनके अपने वर्ग के दोनों उपवर्गों (Sub-group) के तत्त्वों के गुणों से मिलते-जुलते हैं।
सेतु तत्त्वों (Bridge elements) के गुण उस उपवर्ग के तत्त्वों के गुणों से अधिक समानता रखते हैं जिनमें वे स्वयं उपस्थित होते हैं।
उदाहरणार्थ-
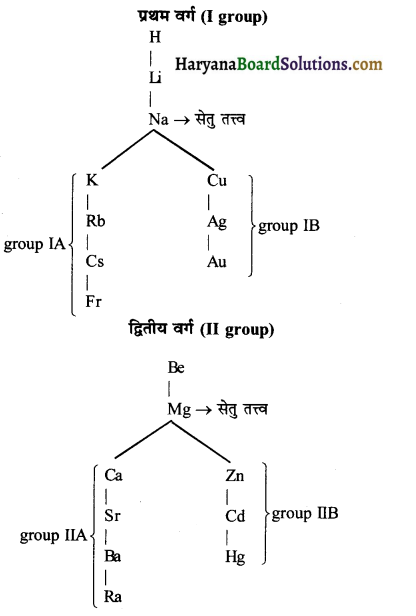
प्रश्न 19.
नॉर्मल तत्त्व (Normal Elements) किन्हें कहते हैं।
उत्तर:
नॉर्मल तत्त्व (Normal elements) – जिन तत्त्वों के गुण सेतु तत्त्वों के गुणों से अधिक समानता रखते हैं, उन्हें नॉर्मल या सामान्य तत्त्व कहते हैं। सेतु तत्त्व भी नॉर्मल तत्त्व होते हैं। सभी A उपवर्गों को नॉर्मल तत्त्व कहते हैं।
प्रश्न 20.
आवर्त सारणी का उपयोग करते हुए, निम्नलिखित युग्मों वाले तत्त्वों के संयोग से बने यौगिकों के अणु सूत्र की प्रागुक्ति कीजिए-
(क) सिलिकॉन एवं ब्रोमीन
(ख) ऐलुमीनियम एवं सल्फर
उत्तर:
(क) सिलिकॉन आवर्त सारणी के 14वें वर्ग का तत्त्व है जिसकी संयाजकता 4 है। ब्रोमीन, जो 17वें वर्ग (हैलोजन परिवार का सदस्य है) की संयोजकता । है अतः यौगिकों का अणुसूत्र SiBr4 होगा।
(ख) आवर्त सारणी में 13वें वर्ग का तत्त्व ऐलुमीनियम है जिसकी संयोजकता 3 है, सल्फर 16वें वर्ग का तत्त्व है जिसकी संयोजकता 2 है, अतः ऐलुमीनियम तथा सल्फर से बने यौगिकों का अणसूत्र AL2S3 होगा।
प्रश्न 21.
लीथियम किस तत्त्व के साथ विकर्ण सम्बन्ध प्रदर्शित करता है। उसका नाम तथा संकेत लिखें। विकर्ण समानता प्रदर्शित करने वाले दो गुणों का उल्लेख कीजिए।
उत्तर:
लीथियम मैग्नीशियम के साथ विकर्ण सम्बन्ध रखता है।
| IA | IIA |
| Li ( लीथियम) | Mg (मैग्नीशियम) |
विकर्ण समानता के कारण समान गुण-
(1) इनका परमाणु आकार लगभग समान होता है।
(2) इनकी विद्युत ऋणात्मकता लगभग समान है।
(3) इन दोनों तत्त्वों के कार्बोनेट ताप द्वारा समान रूप से अपघटित होते हैं।

प्रश्न 22.
कुछ तत्त्वों के इलेक्ट्रॉनिक विन्यास निम्नलिखित है
(i) 1s² 2s² p6 3s²
(ii) 1s² 2s² 2p5
(iii) 1st 2s² 2p6 3s² 3p²
(iv) 1s² 2s² p6 3s² 3p6
(v) 1s² 2s² 2p6 3s² 3p³
(vi) 1s² 2s² 2p6 3s² 3p6 3d5 4s1
उपर्युक्त इलेक्ट्रॉनिक विन्यास के आधार पर बताइये कि प्रत्येक कौन-सा तत्त्व है।
उत्तर:
(i) जिस तत्त्व का संयोजी कोश विन्यास ns² np5 होगा वह हैलोजन परिवार का तत्त्व होगा। अतः तत्त्व (ii) एक हैलोजन है।
(ii) जिस तत्त्व का संयोजी कोश विन्यास ns² होगा वह क्षारीय मृदा तत्त्व होगा अतः तत्त्व (i) क्षारीय मृदा तत्त्व है।
(iii) कार्बन परिवार के तत्त्वों का संयोजी कोश विन्यास ns np होता है अतः तत्त्व (iii) कार्बन परिवार का तत्त्व है।
(iv) जिस तत्त्व का संयोजी कोश विन्यास ns2 np6 होगा वह तत्त्व उत्कृष्ट गैस का तत्त्व होगा। अतः तत्त्व (iv) उत्कृष्ट गैसों का तत्त्व होगा।
(v) वे तत्त्व जिनका संयाजी कोश विन्यास ns² np3 होता है वह तत्त्व नाइट्रोजन परिवार का तत्त्व होगा। तत्त्व (vi) नाइट्रोजन परिवार का तत्त्व है।
(vi) संक्रमण तत्त्व का सामान्य इलेक्ट्रॉनिक विन्यास (n-1) d1-10 ns1-2 होता है अतः तत्त्व (v) एक संक्रमण तत्त्व है।
![]()
प्रश्न 23.
तत्त्वों को वर्गीकृत करने के लिये परमाणु क्रमांक, परमाणु भार की तुलना में एक अच्छा आधार क्यों है?
उत्तर:
तत्त्वों का परमाणु भार नाभिक से सम्बन्ध रखता है जो कि परमाणु के केन्द्र में उपस्थित होता है। लेकिन तत्त्वों के गुणधर्म इलेक्ट्रॉनिक विन्यास पर निर्भर करते हैं, जो कि परमाणु क्रमांक से सम्बन्धित होता है। इसलिए परमाणु क्रमांक तत्त्वों के वर्गीकरण के लिये परमाणु भार की तुलना में एक अच्छा आधार है।
प्रश्न 24.
निम्नलिखित पदों पर टिप्पणी दें-
(1) आवरण प्रभाव
(2) भेदन प्रभाव
(3) धात्विक गुण
उत्तर:
(1) आवरण प्रभाव (Screening effect)- संयोजी इलेक्ट्रॉन तथा नाभिक के बीच उपस्थित अन्तः इलेक्ट्रॉन, संयोजी या बाह्यतम इलेक्ट्रॉनों को नाभिक से परिरक्षित करते हैं। इसे आवरण या परिरक्षण प्रभाव कहते हैं जैसे-जैसे अन्तः इलेक्ट्रॉनों की संख्या बढ़ती जाती है। वैसे-वैसे आवरण प्रभाव भी बढ़ता जाता है।
(2) भेदन – प्रभाव (Penetration effect)-कक्षक की आकृति के कारण s-इलेक्ट्रॉन नाभिक का भेदन P d या f-इलेक्ट्रॉनों की तुलना में अधिक समीप से करते हैं तथा अधिक दृढ़ता से बँधे रहते हैं, इसे ही भेदन प्रभाव कहा जाता है।
भेदन क्षमता (Penetration Power) – s > p > d > f
(3) धात्विक गुण (Metallic Character) – इलेक्ट्रॉन को त्यागने की प्रवृत्ति धात्विक प्रकृति होती है अर्थात् जो धातु जितनी आसानी से इलेक्ट्रॉन त्याग देगी या जिस धातु की आयनन एन्थैल्पी का मान बहुत कम होगा, उसका धात्विक गुण उतना ही अधिक होगा।
अतः “धातुओं के वे गुण जिनके कारण उनमें सरलता से धनायन बनाने की प्रवृत्ति पाई जाती है तथा कुछ विशेष गुण जैसे-धात्विक चमक, तन्यता तथा आघातवर्धनीयता, ऊष्मा तथा विद्युत चालकता आदि होते हैं। धातुओं के धात्विक गुण कहलाते हैं।”
प्रश्न 25.
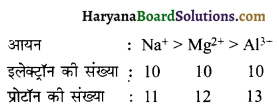
Na+, Mg2+ तथा Al3+ आयनों की आयनिक त्रिज्या का क्रम Na+ > Mg2+ > Al3+ होता है। कारण स्पष्ट करें।
उत्तर:
यदि आयनों में इलेक्ट्रॉनों की संख्या समान होती है तो आकार प्रोटॉनों की संख्या पर निर्भर करता है प्रोटॉन की संख्या अधिक होने पर प्रभावी नाभिकीय आवेश अधिक होगा तथा आकार उतना ही कम
हो जायेगा।
प्रश्न 26.
आर्वत सारणी के किसी वर्ग में तत्त्वों के परमाणु क्रमांकों की वृद्धि के साथ उनके निम्नलिखित गुणों में क्या परिवर्तन होता है?
(1) परमाणु आकार
(2) विद्युत ऋणात्मकता
(3) आयनन एन्बैल्पी
उत्तर:
(1) आवर्त सारणी के किसी भी वर्ग में तत्त्वों के परमाणु क्रमांकों की वृद्धि के साथ उनके परमाणु आकार में क्रमशः वृद्धि होती है।
(2) आवर्त सारणी के किसी भी वर्ग में तत्त्वों के परमाणु क्रमांकों की वृद्धि के साथ उनकी विद्युत ऋणात्मकता का गुण क्रमशः घटता है।
(3) आवर्त सारणी के किसी भी वर्ग में तत्त्वों की आयनन एन्थैल्पी परमाणु क्रमांक के बढ़ने के साथ घटती है।
प्रश्न 27.
निम्नलिखित प्रत्येक समूह में से उस परमाणु का चयन करें जिसकी आयनन ऊर्जा सर्वाधिक हो तथा उत्तर को स्पष्ट करें-
(1) F, O, N
(2) Mg, P, Ar
(3) B, Al, Ga
उत्तर:
(1) F की आयनन ऊर्जा सर्वाधिक होगी क्योंकि इसका आकार सबसे कम है जिसके परिणामस्वरूप इसका प्रभावी नाभिकीय आवेश उच्चतम होगा।
(2) स्थायी इलेक्ट्रॉनिक विन्यास के कारण Ar की आयनन एन्थैपी सर्वाधिक होगी।
(3) B, Al, Ga के समूह में B की आयनन एन्थैल्पी सर्वाधिक है क्योंकि इसका परमाणु आकार सबसे कम है तथा प्रभावी नाभिकीय आवेश सर्वाधिक है।
प्रश्न 28.
आयनन ऊर्जा के कुछ महत्त्वपूर्ण तथ्य लिखें।
उत्तर:
आयनन ऊर्जा के कुछ महत्त्वपूर्ण तथ्य निम्न प्रकार हैं-
(1) बाह्यतम कोश का स्थायी इलेक्ट्रॉनिक विन्यास होने के कारण अक्रिय गैसों की आयनन एन्यैल्पी अधिक होती है। उन आपनों की भी आयनन एन्थल्पी अधिक होती है जिनका इलेक्ट्रॉनिक विन्यास अक्रिय गैस जैसा होता है।
(2) एक ही कोश के विभिन्न उपकोशों से इलेक्ट्रॉन बाहर निकालने के लिये आवश्यक ऊर्जा का क्रम निम्न प्रकार है-
s > p > d > f.
(3) किसी आवर्त में क्षार धातुओं की आयनन एन्थेल्पी सबसे कम और अक्रिय गैसों की सर्वाधिक होती है।
(4) सभी ज्ञात तत्त्वों में से हीलियम की आयनन एन्थैल्पी सबसे अधिक व सीजियम (Cs) की आयनन एन्थैल्पी सबसे कम होती है।
(5) तत्त्व की प्रथम आयनन एन्थैल्पी का मान सदैव द्वितीय आयनन एन्थैल्पी से कम होता है।
प्रश्न 29.
तत्त्वों के निम्न युग्मों में से किसकी इलेक्ट्रॉन लब्धि एन्यैल्पी अपेक्षाकृत ऋणात्मक होती है।
(1) N या O (2) F या Cl (3) Be या B, उत्तर की व्याख्या करें।
उत्तर:
(1) O परमाणु की इलेक्ट्रॉन बन्धुता अधिक ऋणात्मक होती है क्योंकि इसके परमाणुओं को उत्कृष्ट गैस तत्त्व का विन्यास प्राप्त करने के लिए दो इलेक्ट्रॉनों की आवश्यकता होती है। जबकि नाइट्रोजन
का विन्यास सममित होता है। इसे इलेक्ट्रॉन की आवश्यकता नहीं होती है। इसकी इलेक्ट्रॉन बन्धुता धनात्मक होती है।
(2) Cl की इलेक्ट्रॉन बन्धुता अधिक ऋणात्मक होती है क्योंकि इसका आकार F से बड़ा होता है जिसके कारण अन्तः इलेक्ट्रॉन प्रतिकर्षण बल कम होता है। इससे आने वाला इलेक्ट्रॉन अधिक आकर्षण बल महसूस करता है और ऊर्जा ऋणात्मक हो जाती है।
(3) सममित विन्यास के कारण तत्त्व Be को इलेक्ट्रॉन लब्धि एन्थैल्पी का मान धनात्मक (+ 66 kJ mol-1) होती है किन्तु B की इलेक्ट्रॉन लब्धि एन्फैल्पी का मान ( 88kJ mol–) ऋणात्मक होता है क्योंकि इसका विन्यास सममित नहीं होता है अतः B की इलेक्ट्रॉन लब्धि ऊर्जा अधिक ऋणात्मक होती है।
प्रश्न 30.
सही मिलान करें-
| तत्त्व | गुण |
| 1. Cl | शून्य वर्ग से सम्बन्धित तत्त्व |
| 2. Br | संयोजी कोश में 6 इलेक्ट्रॉन वाला तत्त्व |
| 3. F | निम्नतम आयनन एन्थैल्पी वाला तत्त्व |
| 4. O | तत्त्व जो सर्वाधिक संख्या में यौगिक बनाता है |
| 5. Xe | वह तत्त्व जो कमरे के ताप पर द्रव है |
| 6. C | लघुतम आकार वाला तत्त्व |
| 7. Cs | उच्चतम ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी वाला तत्त्व |
उत्तर:
सही मिलान निम्न प्रकार है-
| तत्त्व | गुण |
| 1. Cl | उच्चतम ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी वाला तत्त्व वह तत्त्व जो कमरे के ताप पर द्रव है |
| 2. Br | लघुतम आकार वाला तत्त्व |
| 3. F | संयोजी कोश में 6 इलेक्ट्रॉन वाला तत्त्व |
| 4. O | शून्य वर्ग से सम्बन्धित तत्त्व |
| 5. Xe | तत्त्व जो सर्वाधिक संख्या में यौगिक बनाता है |
| 6. C | निम्नतम आयनन एन्थैल्पी वाला तत्त्व |
| 7. Cs | उच्चतम ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी वाला तत्त्व वह तत्त्व जो कमरे के ताप पर द्रव है |
विस्तृत उत्तरीय प्रश्न
प्रश्न 1.
आधुनिक आवर्त नियम क्या है? आवर्त सारणी के दीर्घ स्वरूप का संक्षिप्त वर्णन कीजिये। इस सारणी से क्या लाभ हैं।
उत्तर:
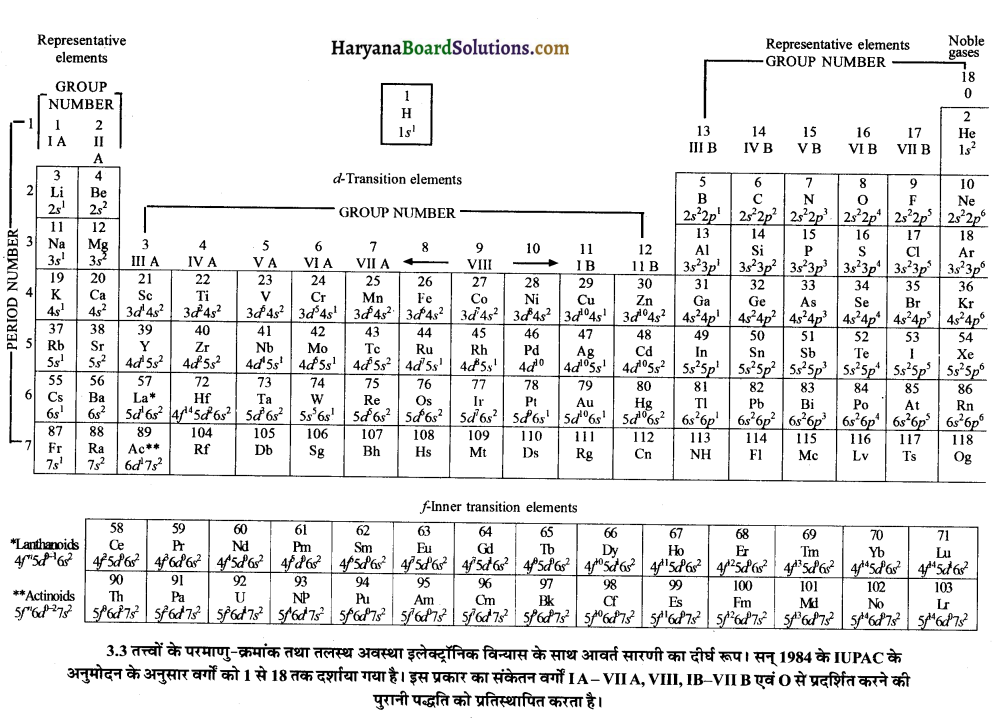
जब मेण्डलीव ने आवर्त सारणी का विकास किया, तब रसायनज्ञों को परमाणु की आन्तरिक संरचना का ज्ञान नहीं था। बीसवीं शताब्दी के प्रारम्भ में अवपरमाणुक कणों का विकास हुआ।
सन् 1913 में अंग्रेज भौतिकी वैज्ञानिक हेनरी मोजले ने तत्त्वों के अभिलाक्षणिक X- किरण स्पेक्ट्रमों में नियमितता पाई और देखा कि \(\sqrt{v}\) (जहाँ v, X-किरण की आवृत्ति है) और परमाणु क्रमांक (Z) के मध्य ग्राफ खींचने पर एक सरल रेखा प्राप्त होती है। परन्तु परमाणु भार व \(\sqrt{v}\) के आलेख में सरल रेखा प्राप्त नहीं होती है।
अतः मोजले ने बताया कि परमाणु भार की तुलना में परमाणु क्रमांक किसी तत्त्व के गुणों को दर्शाने में अत्यधिक सक्षम हैं। इसी के अनुसार मेण्डलीव के आवर्त नियम में परिवर्तन किया गया।
सन् 1913 में मोजले (Mosley) ने आधुनिक आवर्त नियम दिया जिसे आधुनिक आवर्त नियम (Modern Periodic Law) कहते हैं। इस नियम के अनुसार, “तत्त्वों के भौतिक तथा रासायनिक गुणधर्म उनके परमाणु क्रमांकों के आवर्ती फलन होते हैं।
अर्थात् यदि तत्त्वों को उनके परमाणु क्रमांकों के बढ़ते हुये क्रम में रखा जाये तो एक नियमित अन्तराल (Regular interval) के बाद समान गुणों की पुनरावृत्ति होती है और नियमित अन्तराल के बाद समान गुणों वाले तत्त्व की पुनरावृत्ति होती है ।
आधुनिक आवर्त नियम की सहायता से प्राकृतिक रूप से पाये जाने वाले 92 तत्त्वों में समानताएँ मिलीं। ऐक्टीनियम (Ac) और प्रोटोक्टीनियम (Pa) की भाँति नूप्ट्यूनियम (Np) और प्लूटोनियम (Pu) भी यूरेनियम के अयस्क पिच ब्लैंड में पाये गये। इन्हें भी बाद में आधुनिक आवर्त सारणी में स्थान दिया गया।
प्रश्न 2.
इलेक्ट्रॉनिक विन्यास के आधार पर तत्त्वों का वर्गीकरण किस प्रकार किया गया है? समझाइये।
उत्तर:
परमाणु संरचना वाले अध्याय में हम पढ़ चुके हैं कि किसी परमाणु में इलेक्ट्रॉन की पहचान क्वाण्टम संख्याओं से होती है। किसी परमाणु में विभिन्न उपकोशों व कक्षकों में इलेक्ट्रॉनों के वितरण को ही उसका इलेक्ट्रॉनिक विन्यास (Electronic configuration) कहते हैं। में इलेक्ट्रॉनिक विन्यास (Electronic Configuration in Periods).
आवर्त में इलेक्ट्रॉनिक विन्यास (Electronic Configuration in Periods):
दीर्घ आवर्त सारणी में तत्त्वों को उनके परमाणु क्रमांकों के बढ़ते हुए क्रम में व्यवस्थित किया गया है। इसलिए प्रत्येक तत्त्व में अपने से पहले वाले तत्त्व की तुलना में एक इलेक्ट्रॉन अधिक होता है। तत्त्वों का इलेक्ट्रॉनिक विन्यास मुख्य ऊर्जा तल, हुण्ड का नियम, पाऊली अपवर्जन सिद्धान्त (ऑफबाऊ सिद्धान्त) के आधार पर देते हैं।
आवर्त मुख्य ऊर्जा या बाह्य कोश के लिये n का मान बताता है। आवर्त सारणी में प्रत्येक उत्तरोत्तर आवर्त (Successive period) की पूर्ति अगले उच्च मुख्य ऊर्जा स्तर n = 1, n = 2 आदि से सम्बन्धित होती है।
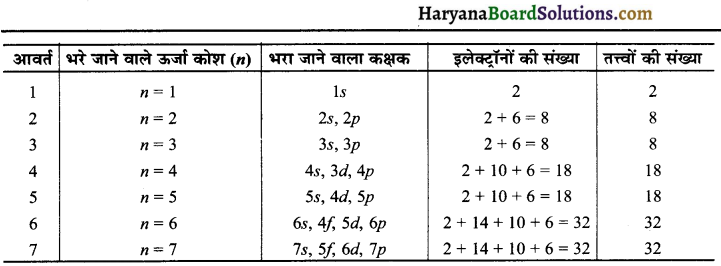
प्रत्येक आवर्त में तत्त्वों की संख्या, भरे जाने वाले ऊर्जा स्तर में उपलब्ध परमाणु कक्षकों की संख्या से दोगुनी होती है। अतः प्रत्येक आवर्त में उपलब्ध तत्त्वों की संख्या को निम्न प्रकार व्याख्यायित कर सकते हैं।
(1) प्रथम आवर्त (n = 1) का प्रारम्भ सबसे निचले स्तर (1s) के भरने से प्रारम्भ होता है। s-उपकोश में एक ही कक्षक होता है अतः इसमें 2 तत्त्व ही होते हैं। हाइड्रोजन जिसका विन्यास 1s है तथा हीलियम जिसका विन्यास 1s1 है। इस प्रकार प्रथम कोश (K-कोश) पूर्ण हो जाता है।
(2) दूसरे आवर्त (n = 2) का प्रारम्भ Li से होता है इसमें दो उपकोश s तथा p होते हैं। इस प्रकार इस आवर्त में कुल चार कक्षक उपस्थित होते हैं। अतः इसमें कुल 8 तत्त्व होते हैं। पहला लीथियम जिसका विन्यास (1s², 2s1) होता है। दूसरा बेरीलियम जिसका विन्यास (1s², 2s²) होता है। इसके बाद बोरॉन तत्त्व आता है जहाँ से शुरू करते हुये जब हम निऑन तत्त्व तक पहुँचते हैं, तो 2p कक्षक पूर्ण रूप से इलेक्ट्रॉनों से भर जाता है। इस प्रकार L-कोश निऑन तत्त्व के साथ (2s², 2p6) पूर्ण रूप से भर जाता है अतः दूसरे आवर्त में कुल आठ तत्त्व होते हैं।
(3) तीसरे आवर्त m = 3 का आरम्भ सोडियम (Na) के साथ होता है। जिसमें इलेक्ट्रॉन 35 कक्षक में जाता है। धीरे-धीरे 3s एवं 3p कक्षकों में इलेक्ट्रॉनों के भरने के पश्चात् तीसरे आवर्त में तत्त्वों की संख्या सोडियम से ऑर्गन तक कुल मिलाकर आठ होती है।
(4) चौथे आवर्त (n = 4), का प्रारम्भ पोटैशियम से होता है तथा इलेक्ट्रॉन 4s कक्षक में प्रवेश करना प्रारम्भ कर देता है। यहाँ महत्त्वपूर्ण बात यह है कि 4p कक्षकों के भरने से पहले 3d-कक्षक भरते हैं जो कि ऊर्जात्मक (Energetically) रूप से अनुकूल है। 3d-कक्षक प्रथम संक्रमण श्रेणी (First transition series) बनाते हैं।
यह श्रेणी स्केन्डियम (Sc, Z = 21) से प्रारम्भ होती है इनका विन्यास 301 452 होता है। 3d- श्रेणी जिंक (Zn, Z = 30) पर पूर्ण हो जाती है जिसकी इलेक्ट्रॉनिक विन्यास 3d104s² होता है। यह चौथा आवर्त 4p कक्षकों के भरने के साथ क्रिप्टॉन (Kr, Z = 36) पर समाप्त हो जाता है। इस प्रकार चौथे आवर्त में कुल मिलाकर 18 तत्त्व होते हैं।
(5) पाँचवें आवर्त (n 5) का प्रारम्भ रूबीडियम से होता है। यह आवर्त चौथे आवर्त के समान होता है। इसमें 4d संक्रमण श्रेणी आती है। यह संक्रमण श्रेणी इट्रियम (Ytrrium, Z 39) से शुरू होती है संक्रमण श्रेणी में इलेक्ट्रॉन भरने के पश्चात् 5p-कक्षकों में इलेक्ट्रॉन भरते हैं। तथा आवर्त जीनॉन पर खत्म हो जाता है। इस आवर्त में भी कुल 18 तत्त्व होते हैं।
(6) छठवें आवर्त (n = 6) में कुल 32 तत्त्व होते हैं। यहाँ उत्तरोत्तर इलेक्ट्रॉन क्रमश: 6s, 4f, 5d तथा 6p के कक्षकों में भरते हैं। इलेक्ट्रॉनों का भरना 4f-कक्षकों में सीरियम (Cerium Z = 58) से शुरू होता है तथा ल्यूटीशियम (Lutetium, Z = 71) पर समाप्त होता है। 4f इस श्रेणी 45 आन्तरिक संक्रमण श्रेणी या लैन्थेनॉइड श्रेणी (Inner transition series or Lanthanoid series) कहते हैं।
(7) सातवाँ आवर्त (n = 7) छठवें आवर्त के समान है, जिसमें इलेक्ट्रॉन उत्तरोत्तर 7s, 5f, 6d और 7p कक्षक में भरते हैं। इनमें कृत्रिम विधियों (Artificial methods) द्वारा मानव निर्मित रेडियोधर्मी तत्त्व (Radioactive elements) आते हैं। सातवां आवर्त परमाणु क्रमांक 118 वाले तत्त्व जिसकी खोज हो चुकी है के साथ पूर्ण होता है। यह तत्त्व उत्कृष्ट गैस परिवार से सम्बन्धित होगा। ऐक्टीनियम (Ac, Z = 89) के पश्चात् 14 इलेक्ट्रॉन 5f श्रेणी में भरते हैं। इस श्रेणी को 5f-आन्तरिक संक्रमण श्रेणी या ऐक्टिनॉइड श्रेणी (5f-inner transition series or Actinoid series) कहते हैं। उपरोक्त विवरण को संक्षिप्त रूप में हम निम्न सारणी द्वारा व्यक्त कर सकते हैं।
वर्ग में इलेक्ट्रॉनिक विन्यास (Electronic Configuration in Group):
एक ही वर्ग या ऊर्ध्वाधर स्तम्भ में उपस्थित तत्त्वों के संयोजकता कोश इलेक्ट्रॉनिक विन्यास समान होते हैं। इनके बाह्य कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या एवं गुणधर्मों में भी समानता होती है।
उदाहरणार्थ- क्षार धातुओं की संयोजकता कोश का विन्यास mst होता है। इस विन्यास से यह स्पष्ट होता है कि किसी तत्त्व के गुणधर्म उसके परमाणु क्रमांक पर निर्भर करते हैं, न कि उसके सापेक्षिक परमाणु द्रव्यमान पर।
प्रश्न 3.
मेण्डलीव की आवर्त सारणी की विवेचना कीजिए। इसके मुख्य दोष क्या हैं? इसकी उपयोगिता भी बताइये।
उत्तर:
रूसी रसायनज्ञ दमित्री मेण्डलीव ने सर्वप्रथम आवर्त सारणी को प्रतिपादित किया। इन्होंने बड़ी संख्या में तत्त्वों के रसायनिक गुणों का अध्ययन किया और सन् 1869 में आवर्त नियम को प्रस्तुत किया। इस नियम के अनुसार, “परमाणु भार तत्त्वों का मूल लक्षण है तथा तत्त्वों के भौतिक व रासायनिक गुण उनके परमाणु भारों के आवर्ती फलन होते हैं।”
यदि तत्त्वों को उनके परमाणु भारों के बढ़ते हुए क्रम से क्षैतिज पंक्तियों (Horizontal lines) में रखा जाये तो समान गुणों वाले तत्त्व एक नियमित अन्तराल (Regular interval) के बाद पुन: आते हैं। अर्थात् तत्त्वों के भौतिक एवं रासायनिक गुणधर्म (या तत्त्वों के गुण) की एक निश्चित अन्तराल (या आवर्त) के बाद पुनरावृत्ति होती है। नियमित अन्तराल के पश्चात् गुणों की इस प्रकार की पुनरावृत्ति को आवर्तिता (Periodicity) कहते हैं।
मेण्डलीव द्वारा तत्त्वों का वर्गीकरण निश्चित तौर पर लोथर मेयर के वर्गीकरण से अधिक विस्तृत था।
![]()
प्रश्न 4.
निम्न पर टिप्पणी लिखिए।
(1) डोबेराइनर त्रिक
(2) न्यूलैण्ड का अष्टक नियम
(3) लोथर मेयर का परमाण्वीय आयतन वक्र।
उत्तर:
मेण्डलीव की आवर्त सारणी की मुख्य उपयोगिताएँ निम्न प्रकार हैं-
1. तत्त्वों का व्यवस्थित अध्ययन (Systematic study of the elements)-मेण्डलीव ने प्रथम बार तत्त्वों को आवर्तों व वर्गों में व्यवस्थित किया। इन्होंने तत्त्वों को इस प्रकार से व्यवस्थित किया कि किसी विशेष वर्ग में एक समान गुणधर्मों वाले तत्त्व ही व्यवस्थित हुए। इस प्रकार इन्होंने लगभग 105 तत्त्वों को केवल 9 वर्गों में व्यवस्थित कर दिया।
2. तत्त्वों के गुणों का अध्ययन (Study of properties of elements)-मेण्डलीव की आवर्त सारणी में किसी तत्त्व विशेष का अध्ययन करने से ही उस समूह के अन्य सभी तत्त्वों का अध्ययन हो जाता है, क्योंकि एक ही समूह में स्थित सभी तत्त्वों के गुण समान होते हैं।
3. नये तत्त्वों की खोज (Discovery of new elements)मेण्डलीव की आवर्त सारणी अज्ञात तत्त्वों को खोजने में एवं उनके गुणधर्मो के अध्ययन करने में अत्यधिक उपयोगी सिद्ध हुई। मेण्डलीव ने उस समय के अज्ञात तत्त्वों के लिए आवर्त सारणी में रिक्त स्थान छोड़ दिया तथा उनके गुणों की भी भविष्यवाणी की थी जो कि बाद में सत्य सिद्ध हुई एवं इससे नये तत्त्वों की खोज में काफी सहायता मिली।
उदाहरणार्थ-मेण्डलीव की मूल आवर्त सारणी में बाद में खोजे गये तत्त्व स्कैण्डियम (Sc), गैलियम (Ga) और जर्मेनियम (Ge) के स्थान रिक्त छोड़े गये और उन्होंने इन्हें क्रमशः एका-बोरॉन (Eka-Boron), एका-ऐलुमिनियम (Eka-Aluminium) तथा एका-सिलिकॉन (EkaSilicon) कहा। मेण्डलीव ने इन नये तत्त्वों की पहचान ही नहीं की बल्कि इन तत्त्वों के कुछ भौतिक गुणधर्मों का भी ब्यौरा दिया जिसे सारणी 3.3 में सूचीबद्ध किया गया है।
सारणी 3.3 – मेण्डलीव द्वारा एका-ऐलुमिनियम (गेलियम) तथा एका सिलिकॉन (जर्मेनियम) तत्वों की प्रागुक्ति
| गुण | एका-ऐलुमिनियम (भविष्य सूचक तत्त्व) | गैलियम (खोजा गया तत्त्व) | एका-सिलिकॉन (भविष्य सूचक तत्त्व) | जर्मेनियम (खोजा गया तत्त्व) |
| परमाणु भार | 68 | 70 | 72 | 72.6 |
| घनत्व (g/cm³) | 5.9 | 5.94 | 5.5 | 5.36 |
| गलनांक/K | निम्न | 302.93 | उच्च | 1231 |
| ऑक्साइड का सूत्र | E2O3 | Ga2O3 | EO2 | GeO2 |
| क्लोराइड का सूत्र | ECl3 | GaCl3 | ECl4 | GeCl4 |
4. सन्देहपूर्ण परमाणु द्रव्यमानों का सुधार (Correction of doubtful atomic masses) मेण्डलीव की आवर्त सारणी की सहायता से बहुत से तत्त्वों के परमाणु भारों का सही निर्धारण किया गया। चूँकि आवर्त सारणी में किसी भी तत्त्व की स्थिति से उसकी संयोजकता ज्ञात की जा सकती है और उसका तुल्यांकी भार ज्ञात होने पर परमाणु भार ज्ञात किया जा सकता है।
परमाणु भार = तुल्यांकी भार x संयोजकता
यदि तत्त्वों की सही संयोजकता ज्ञात हो तो तत्त्व का सही परमाणु भार ज्ञात किया जा सकता है।
उदाहरणार्थ-सन् 1869 से पहले बेरीलियम (Be) का परमाणु भार 13.5 माना जाता था। इसकी गणना निम्न प्रकार की गयी थी।
परमाणु भार = तुल्यांकी भार x संयोजकता
= 4.5 x 3
= 13.5
इस परमाणु भार के अनुसार बेरीलियम (Be) की स्थिति मूल आवर्त सारणी में कार्बन तथा नाइट्रोजन के मध्य होनी चाहिए। परन्तु इस तत्त्व के गुणधर्म के अनुसार इसे वर्ग IIA के तत्त्वों Mg एवं Ca के साथ लीथियम व बोरॉन के मध्य होना चाहिए। अत: मेण्डलीव ने इसकी शुद्ध संयोजकता 2 मान कर इसका शुद्ध व सही परमाणु भार 9 निकला
परमाणु भार = 4.5 x 2 = 9
इसी प्रकार मेण्डलीव की मूल आवर्त सारणी की सहायता से कुछ अन्य तत्त्वों के सही परमाणु भारों को ज्ञात करने में सहायता मिली।
(2) अंग्रेज रसायनज्ञ जॉन एलेक्जेंडर न्यूलैण्ड ने सन् 1865 में अष्टक नियम (Law of octaves) को विकसित किया। इसके अनुसार, “जब तत्त्वों को उनके परमाणु द्रव्यमानों के बढ़ते हुए क्रम में व्यवस्थित किया जाता है तो प्रत्येक आठवाँ तत्त्व पहले तत्त्व से गुणधर्म में समानता रखता है।” यह सम्बन्ध उसी प्रकार का था, जैसा आठवें संगीत स्वर (Eight musical note) का सम्बन्ध प्रथम संगीत स्वर के साथ होता है। इसी कारण न्यूलैण्ड ने इसे ‘अष्टक का नियम’ नाम दिया।
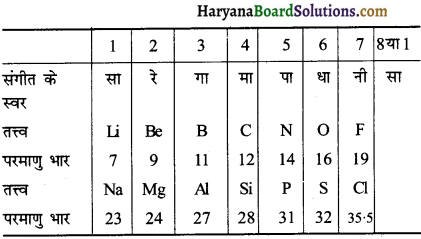
इस प्रकार यदि बोरॉन (B) से शुरूआत करें तो आठव्वॉं तत्त्व एलुमीनियम (Al) आता है और इन दोनों तत्त्वों के गुणधर्म आपस में समान हैं। सीमाएँ (Limitations)
- यह नियम केवल कैल्सियम तक ही सफल रहा। कैल्सियम के पश्चात् प्रत्येक आठवां तत्त्व अपने समूह में ऊपर आने वाले तत्त्व के समान गुणधर्म नहीं रखता था।
- अज्ञात तत्त्वों के लिए इस वर्गीकरण में कोई स्थान सुरक्षित नहीं रखा गया।
- यह नियम अधिक परमाणु भार वाले तत्त्वों पर लागू नहीं होता है।
- उत्कृष्ट गैसों (Noble gases) की खोज के पश्चात् यह नियम पूर्ण रूप से असफल हो गया क्योंकि अब नवाँ तत्त्व प्रथम तत्त्व के समान था न कि आठवाँ।
(3) जर्मन वैज्ञानिक लोथर मेयर (Lother Meyer) ने सन् 1869 में यह विचार दिया था। इसके अनुसार, “तत्त्वों के गुणधर्मों व परमाणु आयतन (परमाणु भार/घनत्व) के बीच एक घनिष्ठ सम्बन्ध होता है। लोथर मेयर ने तत्त्वों के परमाणु भार एवं परमाणु आयतनों के मध्य एक ग्राफ (वक्र) खींचा तथा बताया कि समान गुणधर्म वाले तत्त्व इस वक्र पर समान स्थितियों में आते हैं।”
इस प्रकार लोथर मेयर ने पाया कि परमाणु भारों की वृद्धि के साथ परमाणु आयतनों में नियमित समानता होती है अर्थात् यहाँ पर आवर्तिता (Periodicity) पायी जाती है।
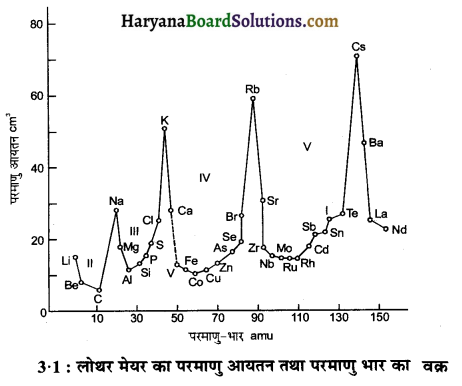
इस वक्र की कुछ विशेषताएँ निम्न प्रकार हैं-
- प्रबल विद्युतधनी तत्त्वों जैसे-क्षार, धातुओं ने वक्र में शिखर पर स्थान प्राप्त किया।
- कुछ कम विद्युतधनी तत्त्वों जैसे-क्षारीय मृदा धातुओं ने वक्र के अवरोही भाग में स्थान प्राप्त किया।
- विद्युतऋणी तत्त्व जैसे-हैलोजनों ने वक्र के चढ़ते हुए भाग में स्थान ग्रहण किया।
- आठवें समूह के तत्त्व वक्र के निचले भाग में स्थित हुए।