Haryana State Board HBSE 11th Class Chemistry Important Questions Chapter 8 अपचयोपचय अभिक्रियाएँ Important Questions and Answers.
Haryana Board 11th Class Chemistry Important Questions Chapter 8 अपचयोपचय अभिक्रियाएँ
बहुविकल्पीय प्रश्न
1. अपचयन का उदाहरण है-
(1) Sn2+ → Sn4+
(2) I– → I0
(3) [Fe(CN)6]3- → [Fe(CN)6]4-
(4) MnO42- → MnO4–.
उत्तर:
(3) [Fe(CN)6]3- → [Fe(CN)6]4-
2. निम्न में रेडॉक्स अभिक्रिया है-
(1) SnCl2 + 2FeCl3 → SnCl4 + 2FeCl2
(2) AgNO3 + HCl → AgCl + HNO3
(3) 2KI + Pb(NO3)2 → 2KNO3 + PbI2
(4) BaCl2 + H2SO4 → BaSO4 + 2HCl.
उत्तर:
(1) SnCl2 + 2FeCl3 → SnCl4 + 2FeCl2
3. अभिक्रिया Na2S2O3 + Br2 + H2O → Na2SO4 + S + 2HBr में ऑक्सीकरण पदार्थ है-
(1) Na2S2O3
(2) Br2
(3) H2O
(4) S.
उत्तर:
(2) Br2
4. निम्न में ऑक्सीकरण प्रक्रिया है-
(1) Fe3+ + e– → Fe2+
(2) I2 + 2e– → 2I–
(3) 2H+ + 2e– → H2
(4) Cu – 2e– → Cu2+
उत्तर:
(4) Cu – 2e– → Cu2+
5. ऑक्सीकरण – अपचयन अभिक्रिया में-
(1) ऑक्सीकारक इलेक्ट्रॉन देता है
(2) अपचायक इलेक्ट्रॉन ग्रहण करता है
(3) ऑक्सीकारक H+ ग्रहण करता है
(4) अपचायक इलेक्ट्रॉन देता है।
उत्तर:
(4) अपचायक इलेक्ट्रॉन देता है।
6. निम्न में ऑक्सीकरण – अपचयन अभिक्रिया कौन-सी है–
(1) KI + I2 → KI3
(2) Cu2+ + 4Cl– → [CuCl4]2-
(3) CO + Cl2 → COCl2
(4) Hg22+ + 2I– → Hg2I2
उत्तर:
(3) CO + Cl2 → COCl2
7. K2Cr2O7 में क्रोमियम का ऑक्सीकरण अंक है-
(1) -6
(2) -2
(3) +2
(4) +6.
उत्तर:
(4) +6.
8. क्लोरीन का उच्चतम ऑक्सीकरण अंक वाला यौगिक है-
(1) SO2Cl2
(2) HOCl
(3) COCl2
(4) CH2Cl2
उत्तर:
(2) HOCl
![]()
9. NH2OH तथा N3H में नाइट्रोजन की ऑक्सीकरण संख्याएँ क्रमश: है-
(1) -1, -1/3
(2) -1/3, -1
(3) 1/3, -1
(4) 1, 1/3.
उत्तर:
(1) -1, -1/3
10. S8 में सल्फर की संयोजकता है-
(1) 0
(2) 2
(3) 4
(4) 8
उत्तर:
(1) 0
11. [Fe(CN)6]3- मैं Fe का ऑक्सीकरण अंक है-
(1) – 3
(2) 0
(3) + 3
(4) + 6.
उत्तर:
(3) + 3
12. निम्न में स्वतः ऑक्सीकरण अपचयन अभिक्रिया (असमानुपातन अभिक्रिया) कौन-सी है?
(1) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
(2) Cl2 + 2NaOH → NaCl + NaOCl + H2O
(3) 2KI + Cl2 → 2KCl + I2
(4) Zn + 2NaOH → Na2ZnO2 + H2.
उत्तर:
(2) Cl2 + 2NaOH → NaCl + NaOCl + H2O
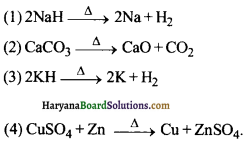
13. निम्न में से अपघटन अभिक्रिया कौन-सी है-
(1) C + O2 → CO2
(2) 3Mg + N2 → Mg3N2
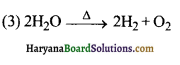
(4) CuSO4 + Zn → Cu + ZnSO4
उत्तर:
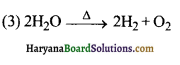
14. निम्न में से विस्थापन अभिक्रिया कौन-सी है?
उत्तर:

15. तत्वों की बढ़ती क्रियाशीलता का सही क्रम है-
(1) Ca < Na < Li
(2) Ni < Na < Ca
(3) Au < Mg < Zn
(4) Sn < Ag < Au.
उत्तर:
(2) Ni < Na < Ca
16. निम्न में से कौन सी अभिक्रिया का होना सम्भव नहीं है-
(1) Cu2+ + Zn → Zn2+ + Cu
(2) 2KBr + I2 → 2KI + Br2
(3) 2Ag+ + Cu → 2Ag + Cu2+
(4) Fe + H2SO4 → FeSO4 + H2.
उत्तर:
(2) 2KBr + I2 → 2KI + Br2
17. कॉपर सल्फेट के जलीय विलयन का प्लैटिनम इलेक्ट्रोडॉ के मध्य विद्यत अपघटन करने पर क्या होता है?
(1) कैथोड पर हाइड्रोजन और ऐनोड पर ऑक्सीजन मुक्त होती है
(2) कैथोड पर कॉपर जमा होता है और ऐनोड पर हाइड्रोजन निकलती है
(3) कैथोड पर ऑक्सीजन निकलती है और ऐनोड पर कॉपर जमा होता है
(4) सल्फ्यूरिक अम्ल का विलयन बनता है।
उत्तर:
(4) सल्फ्यूरिक अम्ल का विलयन बनता है।
18. K, Mg Fe और Zn धातुओं की अपचायक क्षमता बढ़ने है-
(1) K < Mg < Fe < Zn
(2) K < Mg < Zn < Fe
(3) Fe < Zn < Mg < K
(4) Zn उत्तर:
(3) Fe < Zn < Mg < K
19. निम्न में से किस धातु को उसके लवण के जलीय विलयन का विद्युत अपघटन करके प्राप्त किया जा सकता है-
(1) Al
(2) Ca
(3) Na
(4) Ag
उत्तर:
(4) Ag
20. विद्युत रासायनिक श्रेणी में Cu Zn, Mg, Fe धातुओं की घटती हुई अपचायक क्षमता का क्रम है-
(1) Mg, Fe, Zn, Cu
(2) Cu Zn, Fe, Mg.
(3) Zn, Mg Fe, Cu
(4) Mg, Zn, Fe, Cu.
उत्तर:
(4) Mg, Zn, Fe, Cu.
21. चार तत्वों A B C तथा D के मानक अपचयन विभव क्रमशः – 2.90, + 2.90, + 1.50, 0.74 तथा +0.34 वोल्ट हैं। इनमें सर्वाधिक प्रबल अपचायक है-
(1) A
(2) B
(3) C
(4) D
उत्तर:
(1) A
22. Al, Sr, Hg और Cu को अपचायक क्षमता का बढ़ता क्रम है-
(1) Al, Hg, Sr, Cu
(2) Hg, Cu, Al, Sr
(3) Hg, Al, Cu, Sr
(4) Cu, Hg. Al, Sr.
उत्तर:
(2) Hg, Cu, Al, Sr
23. निम्न में से कौन सी धातु अम्ल से हाइड्रोजन विस्थापित नहीं करती है-
(1) Fe
(2) Zn
(3) Cu
(4) Mg.
उत्तर:
(3) Cu
24. कौन-सा हैलोजन अम्ल श्रेष्ठ अपचायक है-
(1)HCl
(2) HBr
(3) HI
(4) HF.
उत्तर:
(3) HI
25. अपचायक के रूप में कार्य नहीं करने वाला ऑक्साइड है-
(1) ClO2
(2) SO2
(3) NO2
(4) CO2.
उत्तर:
(4) CO2.
26. K3[Cr(C2O4)3] मैं क्रोमियम की समन्वय संख्या तथा ऑक्सीकरण अंक क्रमश: है-
(1) 6+3
(2) 3 व 0
(3) 4 व +2
(4) 3 व + 3.
उत्तर:
(1) 6+3
![]()
27. कौन-सा पदार्थ ऑक्सीकारक या अपचायक के रूप में कार्य करने में सक्षम है-
(1) H2SO4
(2) SO2
(3) H2S
(4) HNO3.
उत्तर:
(2) SO2
28. ब्रोमीन जल SO2 से क्रिया करके बनाती है-
(1) H2O तथा HBr
(2) H2SO4 तथा HBr
(3) HBr तथा S
(4) S तथा H2O.
उत्तर:
(2) H2SO4 तथा HBr
29. अधोलिखित में कौन-सी अभिक्रिया में H2O2 अपचायक का कार्य करता है-
(1) 2FeCl2 + 2HCl + H2O2 → 2FeCl3 + 2H2O
(2) Cl2 + H2O2 → 2HCl + O2
(3) 2HI + H2O2 → 2H2O + I2
(4) H2SO3 + H2O2 → H2SO4 + H2O.
उत्तर:
(2) Cl2 + H2O2 → 2HCl + O2
30. K [Co(CO)4] में कोबाल्ट की ऑक्सीकरण संख्या है-
(1) +1
(2) +3
(3) -1
(4) – 3.
उत्तर:
(3) -1
31. अधोलिखित समीकरण में A के पर होगा-
2Fe3+(aq) + Sn2+(aq) → 2Fe2+(aq) + A
(1) Sn4+
(2) Sn3+
(3) Sn2+
(4) Sn0
उत्तर:
(1) Sn4+
32. अधोलिखित में से किस यौगिक में Mn की ऑक्सीकरण संख्या KIO4 में आयोडीन की ऑक्सीकरण संख्या के तुल्य है-
(1) पोटैशियम मँगनेट
(2) पोटैशियम परमैंगनेट
(3) मैंग्नस क्लोराइड
(4) मैग्नीज क्लोराइड।
उत्तर:
(2) पोटैशियम परमैंगनेट
33. ऐनायनों SO32-, S4O62- और S2O62- में सल्फर की ऑक्सीकरण अवस्थाओं का क्रम है-
(1) S2O62- < S2O42- < SO32-
(2) S2O42- < SO32- < S2O62-
(3) SO32-< S2O42- < S2O62-
(4) S2O62- < S2O62- < SO32-
उत्तर:
(2) S2O42- < SO32- < S2O62-
34. क्षारीय माध्यम में I–, MnO4– द्वारा ऑक्सीकृत होता है, प्रक्रिया में I– निम्न में परिवर्तित होता है-
(1) IO3–
(2) I2
(3) IO4–
(4) IO–
उत्तर:
(1) IO3–
35. [Ni (CO)4] मैं Ni की ऑक्सीकरण संख्या है-
(1) 0
(2)+2
(3)+3
(4)+4.
उत्तर:
(1) 0
36. निम्न में से कौन-सी अभिक्रिया रेडॉक्स अभिक्रिया है-
(1) Zn+2AgCN → 2Ag + Zn(CN)2
(2) CaC2O4 + 2HCl → CaCl2 + H2C2O4
(3) NaCl + KNO3 → NaNO3 + KCl
(4) Mg(OH)2 + 2NH4Cl → 2NH4OH + MgCl2.
उत्तर:
(1) Zn+2AgCN → 2Ag + Zn(CN)2
37. CHCl2 में कार्बन परमाणु की ऑक्सीकरण संख्या है-
(1) 3
(2) 2
(3) 5
(4) 0
उत्तर:
(4) 0
38. दी गयी अभिक्रिया में Br का व्यवहार है-
Br2 + H2O → HOBr + HBr
(1) केवल ऑक्सीकृत होती है
(2) अपचयित होती है
(3) दोनों व्यवहार दर्शाती है
(4) न ऑक्सीकृत होती है न अपचयित।
उत्तर:
(3) दोनों व्यवहार दर्शाती है
39. F2O में फ्लुओरीन व ऑक्सीजन की ऑक्सीकरण संख्याएँ क्रमशः
(1) -1,-2
(2) -1, +2
(3) -2,+2
(4) +2, -1.
उत्तर:
(2) -1, +2
40. विद्युत् रासायनिक श्रेणी में प्रबलतम अपचायक है-
(1) Li
(2) Na
(3) Cs
(4) Ra.
उत्तर:
(1) Li
41. KI तथा अम्लीय K2Cr2O7 के विलयन में बने अन्तिम उत्पाद Cr की ऑक्सीकरण अवस्था है-
(1) + 2
(2) +3
(3) +4
(4) +6.
उत्तर:
(2) +3
42. निम्न में से किसमें फॉस्फोरस की ऑक्सीकरण संख्या +3 है-
(1) फॉस्फोरस अम्ल
(2) पाइरोफॉस्फोरिक अम्ल
(3) ऑर्थोफॉस्फोरिक अम्ल
(4) मेटाफॉस्फोरिक अम्ल।
उत्तर:
(3) ऑर्थोफॉस्फोरिक अम्ल
43. H2S2O8 में S की ऑक्सीकरण संख्या है-
(1) +2
(2) +4
(3) +6
(7) +7
उत्तर:
(3) +6
44. SF6 में S की ऑक्सीकरण संख्या है-
(1) + 2
(2) +4
(3) +6
(4) +7
उत्तर:
(3) +6
45. KMnO4 में Mn की ऑक्सीकरण संख्या है-
(1) +4
(2) +5
(3) +6
(4) +7
उत्तर:
(4) +7
46. रेडॉक्स अभिक्रिया
2Hg2+ + Sn2+ → (A) + (B).
मैं उत्पाद (A) तथा (B) हैं-
(1) Hg+ और Sn
(2) Hg और Sn4+
(3) Hg22+ और Sn4+
(4) Hg22+ और Sn.
उत्तर:
(3) Hg22+ और Sn4+
47. CH4, CaH2 तथा H2 में हाइड्रोजन की ऑक्सीकरण संख्याएँ क्रमश: हैं-
(1) -1, +1, +1
(2) – 1, +1, 0
(3) +1, -1, 0
(4) -1, -1, +1.
उत्तर:
(3) +1, -1, 0
48. [Fe(CN)6]4- आयन में Fe की ऑक्सीकरण संख्या है-
(1) + 2
(2) +3
(3) +4
(4) +6.
उत्तर:
(1) + 2
49. मोर लवण है-
(1) सामान्य लवण
(2) संकर लवण
(3) अम्लीय लवण
(4) द्विक लवण
उत्तर:
(4) द्विक लवण
50. OF2 तथा H2O2 में ऑक्सीजन की ऑक्सीकरण संख्या है-
(1) -2,-1
(2) +2,-1
(3) +2+1
(4) -2, +1.
उत्तर:
(2) +2,-1
51. H2SO5 में सल्फर की ऑक्सीकरण संख्या है-
(1) +2
(2) +4
(3) +6
(4) +8.
उत्तर:
(3) +6
52. Mg2P2O7 तथा P4O74- में फॉस्फोरस की ऑक्सीकरण संख है-
(1) 5, 5
(2) 5, 2.5
(3) 2.5, 5
(4) -2.5, -5.
उत्तर:
(2) 5, 2.5
53. [Cu(NH3)4]2+ में Cu की ऑक्सीकरण संख्या है-
(1) + 2
(2) +3
(3) 0
(4) + 1.
उत्तर:
(1) + 2
54. तनु सल्फ्यूरिक अम्ल का प्लैटिनम इलेक्ट्रोड के साथ कैथोड अभिक्रिया में विद्युत अपघटन है-
(1) उपचयन
(2) अपचयन
(3) उपचयन एवं अपचयन दोनों
(4) उदासीनीकरण।
उत्तर:
(2) अपचयन
55. निम्नलिखित में से कौन-सा पदार्थ अपचायक के रूप में कार्य करता है-
14H+ + Cr2O72- + 3Ni → 2Cr3+ + 7H2O
(1) H2O
(2) Ni
(3) H+
(4) CO2O72-
उत्तर:
(2) Ni
56. अपचायक-
(1) इलेक्ट्रॉन ग्रहण करते हैं
(2) इलेक्ट्रॉन त्यागते हैं।
(3) प्रोटॉन ग्रहण करते हैं
(4) प्रोटॉन त्यागते हैं।
उत्तर:
(2) इलेक्ट्रॉन त्यागते हैं।
57. KMnO4 का तुल्यांकी भार, जब यह MnSO में परिवर्तित होता है, है-
(1) M/S
(2) M/6
(3) M/3
(4) M/2.
उत्तर:
(1) M/S
58. लोहे के गैल्वेनीकरण में प्रयुक्त होती है-
(1) Al
(2) Pb
(3) Zn
(4) Sn.
उत्तर:
(3) Zn
59. प्रबलतम अपचायक है–
(1) F
(2) Cl–
(3) Br–
(4) I–
उत्तर:
(4) I–
अति लघु उत्तरीय प्रश्न
प्रश्न 1.
निम्नलिखित में से वे पदार्थ छाँटकर लिखिए जो ऑक्सीकारक तथा अपचायक दोनों का कार्य कर सकते हैं-
O3, H2O2, FeCl2, HNO3, SO2
उत्तर:
ऑक्सीकारक व अपचायक पदार्थों के गुण O3 व H2O2 रखते हैं।
![]()
प्रश्न 2.
निम्नलिखित अभिक्रिया के ऑक्सीकारक तथा अपचायक पदार्थ कारण सहित लिखिए-
2K2MnO4 + O3 + H2O2 → 2KMnO4 + 2KOH + O2 ↑
उत्तर:
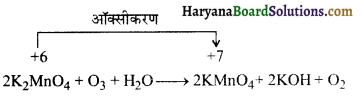
क्योंकि Mn की ऑक्सीकरण संख्या + 6 से बढ़कर 7 हो जाती है अत: K2MnO4 अपचायक है तथा ओजोन K2MnO4 को KMnO4 में ऑक्सीकृत करती है; अत: O3 ऑक्सीकारक है।
प्रश्न 3.
रेडॉक्स अभिक्रिया किसे कहते हैं? उदाहरण सहित बताइए।
उत्तर:
रेडॉक्स अभिक्रिया – जिन रासायनिक अभिक्रियाओं में एक पदार्थ का ऑक्सीकरण तथा दूसरे का अपचयन हो रहा हो वे अभिक्रियाएँ रेडॉक्स अभिक्रियाएँ कहलाती हैं।
उदाहरण – 2FeCl3 + SnCl2 → 2FeCl2 + SnCl4
प्रश्न 4.
अपचयन को उदाहरण सहित समझाइए।
उत्तर:
किसी पदार्थ द्वारा हाइड्रोजन या अन्य धन- विद्युती तत्व ग्रहण करने अथवा ऑक्सीजन या अन्य ऋण विद्युती तत्व त्यागने की प्रक्रिया अपचयन कहलाती है।
उदाहरण – Cl2 + H2 → 2HCl (क्लोरीन का अपचयन)
CuO + H2 → Cu + H2O (क्यूप्रिक ऑक्साइड का अपचयन)
प्रश्न 5.
ऑक्सीकारक क्या होते हैं? कुछ ऑक्सीकारकों के नाम लिखिए।
उत्तर:
किसी अभिक्रिया में जिन पदार्थों का अपचयन होता है उन्हें ऑक्सीकारक कहते हैं।
उदाहरण – KMnO4, K2Cr2O7, सान्द्र HNO3, तनु H2SO4.
प्रश्न 6.
ऑक्सीकरण को उदाहरण देकर समझाइए।
उत्तर:
किसी पदार्थ द्वारा ऑक्सीजन या अन्य ऋण- विद्युती तत्व ग्रहण करने अथवा हाइड्रोजन या अन्य धन विद्युती तत्व त्यागने की प्रक्रिया को ऑक्सीकरण कहते हैं।
उदाहरण-
- C + O2 → CO2 (कार्बन का ऑक्सीकरण)
- 2KI + Cl2 → I2 + 2KCI (KI का ऑक्सीकरण)
प्रश्न 7.
अपचायक क्या होते हैं? कुछ अपचायकों के नाम लिखिए।
उत्तर:
अभिक्रिया में जिन पदार्थों का ऑक्सीकरण होता है उन्हें अपचायक कहते हैं।
उदाहरण – 2FeCl3 + SnCl2 → 2FeCl2 + SnCl4
उपर्युक्त अभिक्रिया में SnCl2 अपचायक है क्योंकि SnCl2 का SnCl4 में ऑक्सीकरण हो रहा है।
प्रश्न 8.
कारण देते हुए ऑक्सीकरण संख्या के आधार पर बताइए कि निम्नलिखित अभिक्रिया में कौन-सा पदार्थ ऑक्सीकारक है?
2KI + Cl2 → 2KCl + I2↑
उत्तर:
अभिक्रिया 2 KI + Cl2 → 2KCl + I2
ऑक्सीकरण संख्या -1 0 -1 0
इसमें Cl2 की ऑक्सीकरण संख्या शून्य है और KCl में Cl की ऑक्सीकरण संख्या -1 है। यहाँ ऑक्सीकरण संख्या में कमी हो रही है; अत: Cl2 एक ऑक्सीकारक है।
प्रश्न 9.
इलेक्ट्रॉनीकरण किसे कहते हैं?
उत्तर:
वह प्रक्रिया जिसमें किसी परमाणु आयन अथवा अणु द्वारा एक या एक से अधिक इलेक्ट्रॉनों को ग्रहण किया जाता है उसे इलेक्ट्रॉनीकरण कहते हैं।
प्रश्न 10.
निम्नलिखित में से कौन ऑक्सीकारक तथा कौन अपचायक है?
2KI + Cl2 → 2KCl + I2
उत्तर:
यहाँ Cl2 ऑक्सीकारक है तथा KI अपचायक है।
प्रश्न 11.
निम्नलिखित अभिक्रिया में ऑक्सीकारक तथा अपचायक पदार्थ कारण सहित लिखिए-
2K4Fe(CN)6 + H2O2 + 2HCl → 2K3Fe(CN)6 + 2KCl + 2H2O
उत्तर:
अभिक्रिया
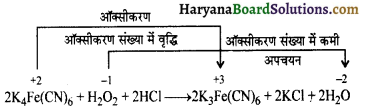
K4Fe(CN)6 मैं Fe की ऑक्सीकरण संख्या में 2 से +3 की वृद्धि हो रही है अत: K4Fe(CN)6 अपचायक है तथा H2O2 में ऑक्सीजन की ऑक्सीकरण संख्या -1 से -2 हो जाती है अत: H2O2 ऑक्सीकारक की भाँति कार्य करता है।
प्रश्न 12.
कारण सहित बताइए कि निम्नलिखित में से कौन-सी ऑक्सीकरण तथा कौन-सी अपचयन अभिक्रिया है?
(i) Fe → Fe2+ + 2e–
(ii) Sn4+ + 2e– → Sn2+
उत्तर:
अभिक्रिया (i) ऑक्सीकरण अभिक्रिया है; क्योंकि इसमें Fe का Fe2+ में ऑक्सीकरण (धनात्मक संयोजकता में वृद्धि हो रहा है। अभिक्रिया (ii) अपचयन अभिक्रिया है क्योंकि इसमें Sn4+ का Sn2+ में अपचयन (धनात्मक संयोजकता में कमी) हो रही है।
प्रश्न 13.
निम्नलिखित में प्लैटिनम की ऑक्सीकरण संख्या ज्ञात कीजिए-
[PtCl6]2-, (NH4)2PtCl6, PtCl4
उत्तर:
+ 4 + 4 + 4
प्रश्न 14.
निम्नलिखित में ऑक्सीजन की ऑक्सीकरण संख्या ज्ञात कीजिए-
F2O, Cl2O7, H2O2, NaOCl, O3
उत्तर:
+2, 2, 1, 2, 0
प्रश्न 15.
S8 अणु में सल्फर की संयोजकता और ऑक्सीकरण संख्या बताइए।
उत्तर:
संयोजकता 2
ऑक्सीकरण संख्या – 0
प्रश्न 16.
अभिक्रिया 3ClO– → 2Cl– + ClO3 किस प्रकार की अभिक्रिया है?
उत्तर:
असमानुपातन अभिक्रिया है; क्योंकि इसमें ClO– का ClO3– में ऑक्सीकरण तथा Cl– में अपचयन होता है।
प्रश्न 17.
असमानुपातन (disproportionation) अभिक्रिया किसे कहते हैं? एक उदाहरण दीजिए।
उत्तर:
वह अभिक्रिया जिसमें एक ही पदार्थ का ऑक्सीकरण व अपचयन होता हो, असमानुपातन अभिक्रिया कहलाती है।
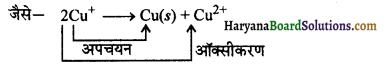
प्रश्न 18.
उन धातुओं और अधातुओं के बारे में बताइए जो असमानुपातन अभिक्रिया प्रदर्शित कर सकती हैं।
उत्तर:
(क) वे अधातुएँ जो परिवर्ती ऑक्सीकरण अवस्थाओं में रह सकती हैं, असमानुपातन अभिक्रिया प्रदर्शित कर सकती हैं। फॉस्फोरस, क्लोरीन तथा सल्फर ऐसी ही अधातुएँ हैं।
(ख) संक्रमण श्रेणी (d-ब्लॉक तत्व) से सम्बद्ध धातुएँ असमानुपातन अभिक्रियाएँ प्रदर्शित कर सकती हैं। उदाहरणार्थ- मैंगनीज, आयरन तथा कॉपर आदि।
प्रश्न 19.
निम्नलिखित ऑक्साइडों में से कौन-कौन से ऑक्साइड H2 द्वारा अपंचयित हो सकते हैं? कारण सहित समझाइए-
Na2O, MgO, Al2O3, CuO, Ag2O
उत्तर:
इनमें CuO तथा Ag2O हाइड्रोजन गैस द्वारा अपचयित होंगे; क्योंकि विद्युत्-रासायनिक श्रेणी में Fe या उससे नीचे रखी धातुओं के ऑक्साइड H2 द्वारा अपचयित हो जाते हैं; अतः
CuO + H2 → Cu↓ + H2O
Ag2O + H2 → 2Ag↓+ H2O
प्रश्न 20.
निम्नलिखित आयनों में से कौन-सा आयन ब्रोमीन द्वारा ऑक्सीकृत होगा-
F–, Cl–, I–
उत्तर:
फ्लुओरीन तथा क्लोरीन, ब्रोमीन से अधिक प्रबल ऑक्सीकारक हैं, परन्तु आयोडीन, ब्रोमीन से क्षीण ऑक्सीकारक है; अत: ब्रोमीन आयोडाइड आयन को आयोडीन में ऑक्सीकृत कर देगी-
2I– + Br2 → I2 + Br–
परन्तु यह फ्लुओराइड एवं क्लोराइड को ऑक्सीकृत नहीं करेगा।
प्रश्न 21.
लोहा, कॉपर सल्फेट विलयन से कॉपर को विस्थापित करता है, किन्तु सिल्वर नहीं करता, क्यों?
उत्तर:
क्योंकि लोहा विद्युत्-रासायनिक श्रेणी में Cu से ऊपर है; अत: CuSO4 से Cu को विस्थापित कर देता है, जबकि सिल्वर इस श्रेणी में कॉपर से नीचे है अत: यह CuSO4 से Cu को विस्थापित नहीं करता है।
Fe + CuSO4 → FeSO4 + Cu ↓
Ag + CuSO4 → कोई अभिक्रिया नहीं।
प्रश्न 22.
कारण सहित समझाइए कि निम्नलिखित अभिक्रिया सम्भव है अथवा नहीं-
Fe + H2SO4 → FeSO4 + H2 ↑
उत्तर:
अभिक्रिया Fe + H2SO4 → FeSO4 + H2↑ में Fc (जो विद्युत्-रासायनिक श्रेणी में हाइड्रोजन से ऊपर है) के परमाणु इलेक्ट्रॉन देने में सक्षम हैं; अत: Fe अम्ल H2SO4 में से H2 विस्थापित कर देगा, इसलिए यह क्रिया सम्भव है अर्थात् Fe का E°, H के E° से उच्च है।
प्रश्न 23.
दो धातुओं के नाइट्रेटों के नाम बताइए जो तेजी से गर्म करने पर धातु में अपघटित हो जाते हैं।
उत्तर:
विद्युत्-रासायनिक श्रेणी में सिल्वर या उससे नीचे के तत्वों के नाइट्रेट गर्म करने पर अपने तत्वों में अपघटित हो जाते हैं। इस प्रकार Ag, Pt आदि के नाइट्रेट ताप से अपघटित हो जाते हैं।
प्रश्न 24.
घटते हुए इलेक्ट्रोड विभव के अनुसार कुछ तत्व निम्नलिखित क्रम में हैं, बताइए इनमें से कौन-से तत्व अम्लों से हाइड्रोजन का विस्थापन कर सकते हैं-
Ba, Mg, Zn, H, Cu, Ag
उत्तर:
Mg का विस्थापन नहीं होगा; क्योंकि Zn का इलेक्ट्रोड विभव अर्थात् इलेक्ट्रॉन त्यागने की क्षमता Mg से कम है।
Sn का विस्थापन होगा; क्योंकि Zn की इलेक्ट्रॉन त्यागने की क्षमता अर्थात् इसका इलेक्ट्रोड विभव Sn से अधिक है; अत: Zn, विलयन में से Sn को विस्थापित कर देगा।
प्रश्न 25.
क्या विलयन में Zn द्वारा Mg या Sn का विस्थापन हो जायेगा?
उत्तर:
Mg का विस्थापन नहीं होगा; क्योकि Zn का इलेक्ट्रोड विभव अर्थात् इलेक्ट्रॉन त्यागने की क्षमता Mg से कम है।
Sn का विस्थापन होगा: क्योंकि Zn की इलेक्ट्रॉन त्यागने की क्षमता अर्थात् इसका इलेक्ट्रोड विभव Sn से अधिक है; अत: Zn, विलयन में से Sn को विस्थापित कर देगा।
प्रश्न 26.
विद्युत-रासायनिक श्रेणी के आधार पर समझाइए कि निम्नलिखित में से कौन-सी अभिक्रिया सम्भव है और क्यों?
(i) SnO + H2 → Sn + H2O
(ii) CaO + H2 → Ca + H2O
उत्तर:
विद्युत्-रासायनिक श्रेणी में Ca का स्थान Sn की अपेक्षा काफी पहले है; अत: Ca के लक्षण अधिक स्थायी होते हैं। इस कारण केवल अभिक्रिया (i) ही सम्भव है।
प्रश्न 27.
2KCI + I2 → 2KI + CI2 क्रिया होगी या नहीं?
उत्तर:
विद्युत्-रासायनिक श्रेणी में I2 का स्थान Cl2 से ऊपर है; अत: I2, KCI से Cl2 विस्थापित नहीं करेगी।
अभिक्रिया 2KCI + I2 2KI + Cl2 सम्भव नहीं है।
प्रश्न 28.
निम्नलिखित में से किस ऑक्साइड का हाइड्रोजन द्वारा अपचयन होता है?
Na2O, CaO, Al2O3, CuO, ZnO
उत्तर:
उन धातुओं के ऑक्साइडों का हाइड्रोजन द्वारा अपचयन होगा जो विद्युत्-रासायनिक श्रेणी में आयरन तथा कॉपर के बीच स्थित हैं; अत: केवल CuO का हाइड्रोजन द्वारा अपचयन होगा।
प्रश्न 29.
विद्युत् – रासायनिक श्रेणी के आधार पर बताइए कि लोहे की कीलों को CuSO4 विलयन में छोड़ देने पर उन पर ताँबा क्यों चढ़ जाता है?
उत्तर:
विद्युत्-रासायनिक श्रेणी में Cu का स्थान लोहे से नीचे है; अत: CuSO4 विलयन से लोहा, Cu को विस्थापित कर देता है जिसके फलस्वरूप विस्थापित Cu, लोहे की कीलों पर चढ़ जाता है।
CuSO4 + Fe – → FeSO4 + Cu ↓
प्रश्न 30.
लोहे पर निम्नलिखित धातुओं में से किसकी परत चढ़ाई जा सकती है?
Mg, Cu, Ag
उत्तर:
लोहे पर Cu तथा Ag की परत चढ़ाई जा सकती है; क्योंकि इन तत्वों का इलेक्ट्रोड विभव धनात्मक है। इसके विपरीत Mg की परत लोहे पर नहीं चढ़ाई जा सकती; क्योंकि इसका इलेक्ट्रोड विभव Fe से कम है।
प्रश्न 31.
जिंक तनु हाइड्रोक्लोरिक अम्ल से क्रिया करता है, जबकि ताँबा नहीं। कारण सहित स्पष्ट कीजिए।
उत्तर:
Zn का इलेक्ट्रोड विभव H के इलेक्ट्रोड विभव से उच्च है। इस कारण जिंक तनु HCl से हाइड्रोजन पृथक् करता है।
Zn + 2HCI → ZnCl2 + H2 ↓
जबकि कॉपर का इलेक्ट्रोड विभव हाइड्रोजन के इलेक्ट्रोड विभव से कम है; इस कारण यह तनु HCl से हाइड्रोजन विस्थापित नहीं करता है।
प्रश्न 32.
कौन-सी धातुएँ तनु H2SO4 से हाइड्रोजन विस्थापित नहीं करती हैं?
उत्तर:
विद्युत्-रासायनिक श्रेणी में हाइड्रोजन से ऊपर अर्थात् वे धातुएँ, जिनका मानक इलेक्ट्रोड विभव (E°) व ऋणात्मक होता है तनु H2SO4 से हाइड्रोजन विस्थापित कर देती हैं; जैसे- Zn, Fe, K आदि। इसके विपरीत हाइड्रोजन से नीचे अर्थात् धनात्मक मानक इलेक्ट्रोड विभव वाली धातुएँ; जैसे – Cu, Ag आदि अम्ल से H2 विस्थापित नहीं कर पाती हैं।
प्रश्न 33.
भाप को अपघटित करने वाली धातुओं के नाम लिखिए।
उत्तर:
विद्युत्-रासायनिक श्रेणी में वे धातुएँ, जो हाइड्रोजन से ऊपर हैं, जलवाष्प को अपघटित कर देती हैं और हाइड्रोजन मुक्त करती हैं। जैसे – Fe, Zn, Na आदि।
प्रश्न 34.
निम्न तत्वों को उनकी बढ़ती क्रियाशीलता के क्रम में समझाइए –
Al, Ag, Fe, Ca, Cu
उत्तर:
Ag < Cu < Fe < Al < Ca प्रश्न 35. निम्नलिखित धातुओं को उनकी घटती हुई अपचायक क्षमता के क्रम में लिखिए- Fe, Na, Cu, Zn उत्तर: विद्युत्-रासायनिक श्रेणी में Na का स्थान Zn से ऊपर है, Zn का स्थान Fe से ऊपर हैं, Fe का Cu से ऊपर है। अतः श्रेणी में धातुओं की आक्सीकृत होने की प्रवृत्ति ऊपर से नीचे की ओर घटती है। इनकी घटती हुई अपचायक क्षमता निम्न प्रकार है- Na > Zn > Fe > Cu
![]()
प्रश्न 36.
निम्नलिखित हैलोजनों को उनकी बढ़ती हुई ऑक्सीकारक क्षमता के क्रम में लिखिए-
I2, Cl2, Br2, F2
उत्तर:
I2 < Br2 < Cl2 < F2
प्रश्न 37.
निम्नलिखित हैलोजन अम्लों को उनकी बढ़ती हुई अपचायक क्षमता के क्रम में लिखिए-
HCl, HI, HF, HBr
उत्तर:
HF < HCl < HBr < HI
प्रश्न 38.
निम्नलिखित अभिक्रिया सम्भव है या नहीं-
Cu + H2SO4 → CuSO4 + H2
उत्तर:
सम्भव नहीं है, क्योंकि Cu की ऑक्सीकृत होने की प्रवृत्ति हाइड्रोजन से दुर्बल है।
प्रश्न 39.
क्या कारण है सोडियम साधारण ताप पर जल से क्रिया करता है जबकि मैग्नीशियम केवल उच्च ताप पर क्रिया करता है?
उत्तर:
मैग्नीशियम के पृष्ठ पर ऑक्साइड की रक्षी परत होती है। तथा साधारण ताप पर Mg की जल से अभिक्रिया मन्द होती है।
प्रश्न 40.
एक सेल में जिंक की छड़, जिंक आयन के घोल में तथा कॉपर की छड़ क्यूप्रिक आयन के घोल में डुबी हुई हैं। दोनों छड़ों को तार से जोड़ने पर इलेक्ट्रोडों पर क्या क्रियाएँ होंगीं?
उत्तर:
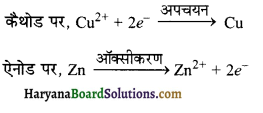
क्योंकि कॉपर का मानक अपचयन विभव धनात्मक है।
प्रश्न 41.
सिल्वर नाइट्रेट के विलयन में कॉपर डालने से विलयन का रंग नीला हो जाता है, क्यों?
उत्तर:
कॉपर सिल्वर आयनों को सिल्वर में अपचयित कर देता है और स्वयं Cu2+ आयनों में ऑक्सीकृत हो जाता है जिसका रंग नीला होता है।
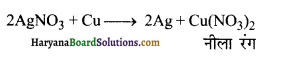
प्रश्न 42.
Sn2+, Fe2+ और I– को बढ़ती हुई अपचायक क्षमता के अनुसार क्रमबद्ध कीजिए।
उत्तर:
Fe2+ + I– + Sn2+
प्रश्न 43.
निम्न में से कौन-सा ऑक्साइड H2 द्वारा अपचयित हो सकता है और क्यों?
Al2O3, MgO, CuO, Na2O, Ag2O
उत्तर:
CuO और Ag2O, क्योंकि Cu और Ag हाइड्रोजन से दुर्बल अपचायक हैं।
प्रश्न 44.
कॉपर सल्फेट के जलीय विलयन में लोहे की छड़ डालने पर विलयन का नीला रंग धीरे-धीरे क्यों गायब हो जाता है? समझाइए।
उत्तर:
CuSO4 + Fe → FeSO4 + Cu
क्योंकि Cu2+ आयन, Fe से विस्थापित होकर Cu बनाता है।
प्रश्न 45.
लीथियम हाइड्राइड (LiH) में लीथियम तथा हाइड्रोजन की ऑक्सीकरण संख्या बताइए।
उत्तर:
LiH में Li की ऑक्सीकरण संख्या (+1) तथा हाइड्रोजन की ऑक्सीकरण संख्या (- 1) है।
प्रश्न 46.
Na2O में सोडियम की ऑक्सीकरण संख्या क्या होगी?
उत्तर:
Na2O (माना सोडियम की ऑक्सीकरण संख्या x है )
2 × x + (- 2 ) = 0
या 2x = + 2
∴ x = + 1
प्रश्न 47.
[Fe(CO)5] में Fe की ऑक्सीकरण संख्या क्या है?
उत्तर:
[Fe(CO)5] में Fe की ऑक्सीकरण संख्या शून्य (0) है।
प्रश्न 48.
निम्न में से कौन-सा ऑक्साइड गर्म करने पर अपघटित होगा?
Ag2O, CO, MgO तथा ZnO
उत्तर:
केवल Ag2O ही गर्म करने पर अपघटित होता है।
प्रश्न 49.
क्या लोहे पर Mg की परत चढ़ सकती है?
उत्तर:
लोहे पर Mg की परत नहीं चढ़ सकती है क्योंकि Fe2+ या Fe3+ आयनों में से कोई भी Mg से क्रिया नहीं करता है।
प्रश्न 50.
चाँदी के तार को CuSO4 विलयन में डालने पर क्या प्रभाव पड़ेगा?
उत्तर:
चाँदी के तार को CuSO4 में डालने पर कोई प्रभाव नहीं पड़ेगा।
प्रश्न 51.
Zn की छड़ को CuSO4 विलयन में डालने पर विलयन का नीला रंग धीरे-धीरे गायब क्यों हो जाता है?
उत्तर:
Zn की छड़ को CuSO4 विलयन में डालने पर Zn, CuSO4 से क्रिया करती है जिसके कारण Cu2+ आयन Cu में परिवर्तित हो जाते हैं तथा ZnSO4 बनने लगता है। ZnSO4 रंगहीन होता है, इस कारण विलयन का नीला रंग गायब हो जाता है।
प्रश्न 52.
निम्न समीकरण को पूरा कीजिए-
P + OH– + …….. H2PO2– + PH3
उत्तर:
4P + 3OH– + 3H2O → 3H2PO2– + PH3
यह एक असमानुपातन अभिक्रिया है।
प्रश्न 53.
निम्न समीकरण को सन्तुलित कीजिए-
I2 + OH– → I– + IO3– + H2O
उत्तर:
3I2 + 6OH– → 5I– + IO3– + H2O
प्रश्न 54.
Cu की छड़ को AgNO3 विलयन में डालने पर विलयन का रंग नीला क्यों हो जाता है?
उत्तर:
Cu की छड़ को AgNO3 में डालने पर Cu(NO3)2 बनने के कारण विलयन का रंग नीला हो जाता है क्योंकि Cu2+ आयनों का रंग नीला होता है।
प्रश्न 55.
ताँबे के तार को AgNO3 में डालने पर क्या अभिक्रिया होती है?
उत्तर:
Cu + 2AgNO3 → Cu (NO3)2 + 2Ag.
प्रश्न 56.
KMnO4 में सभी परमाणुओं की ऑक्सीकरण संख्या का योग क्या होगा?
उत्तर:
शून्य।
प्रश्न 57.
संयोजकता एवं ऑक्सीकरण संख्या में एक प्रमुख अन्तर बताइए।
उत्तर:
संयोजकता पूर्ण होती है जबकि ऑक्सीकरण संख्या आंशिक भी हो सकती है।
प्रश्न 58.
SO2 के सम्पर्क में अम्लीकृत K2Cr2O का कागज ले जाने पर यह हरा हो जाता है, क्यों?
उत्तर:
अम्लीय माध्यम में SO2, K2 Cr2O को Cr2 (SO4)4 में अपचयित कर देती है जो हरे रंग का होता है।
प्रश्न 59.
एक द्विधात्विक यौगिक में एक धातु तथा एक अधातु है। किसकी ऑक्सीकरण संख्या धनात्मक होगी?
उत्तर:
धातु की।
प्रश्न 60.
दो धातुओं से बने यौगिक में किसकी ऑक्सीकरण संख्या धनात्मक होगी?
उत्तर:
कम विद्युत् ऋणात्मक तत्व की।
प्रश्न 61.
निम्नलिखित को ऑक्सीकरण संख्या के बढ़ते क्रम में व्यवस्थित कीजिए-
HXO, HXO3, HXO2, HXO4
उत्तर:
HXO < HXO2 < HXO3 < HXO4.
प्रश्न 62.
निम्न समीकरण में ऑक्सीकारक तथा अपचायक छाँटें-
PCl3 + Cl2 → PCI5
उत्तर:
सभी की ऑक्सीकरण संख्या निम्न हैं-

प्रश्न 63.
स्वत: रेडॉक्स अभिक्रिया का एक उदाहरण दीजिए।
उत्तर:
2Cu → Cu + Cu2+
प्रश्न 64.
P4 में फॉस्फोरस की सामान्य संयोजकता व ऑक्सीकरण संख्या बताइए।
उत्तर:
3 तथा 0.
प्रश्न 65.
CH4, CaH2, H2, HCl में हाइड्रोजन (H) की ऑक्सीकरण संख्या बताइए।
उत्तर:
CH4 = + 1
CaH2 = – 1
H2 = 0
HCl = + 1
![]()
प्रश्न 66.
CH4, CH3Cl, CH2Cl2, CHCl3 और CCl4 में कार्बन
की ऑक्सीकरण संख्याएँ बताइए।
उत्तर:
CH4 = – 4
CH3Cl = – 2
CH2Cl2 = 0
CHCl3 = + 2
CCl4 = + 4
प्रश्न 67.
Zn + Fe2+ → Zn2+ + Fe में किसका ऑक्सीक हो रहा है तथा किसका अपचयन?
उत्तर:
Zn का ऑक्सीकरण तथा Fe2+ का अपचयन।
प्रश्न 68.
N, S तथा Cl की न्यूनतम ऑक्सीकरण संख्या क्या होगी?
उत्तर:
न्यूनतम ऑक्सीकरण संख्या = समूह संख्या – 8
N = 5 – 8 = – 3
S = 6 – 8 = – 2
प्रश्न 69.
फ्लोरीन की ऑक्सीकरण संख्या सदैव – 1 है, क्यों?
उत्तर:
क्योंकि यह सर्वाधिक विद्युत् ऋणात्मक तत्व है, इसकी ऑक्सीकरण संख्या सदैव ऋणात्मक होगी तथा
न्यूनतम ऑक्सीकरण संख्या = 7 – 8
= – 1
प्रश्न 70.
MnCl2, MnO2 तथा KMnO4 को ऑक्सीकरण संख्या के बढ़ते क्रम में व्यवस्थित कीजिए।
उत्तर:
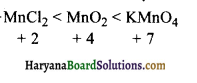
प्रश्न 71.
क्लोरीन की न्यूनतम ऑक्सीकरण संख्या व अधिकतम ऑक्सीकरण संख्या का उदाहरण दीजिए।
उत्तर:
न्यूनतम ऑक्सीकरण संख्या वाला यौगिक = NaCl
अधिकतम ऑक्सीकरण संख्या वाला यौगिक = Cl2O7
प्रश्न 72.
KMnO4 → K2MnO4 में KMnO4 तथा K2 MnO4 का तुल्यांकी भार बताइए।
उत्तर:

प्रश्न 73.
[Fe (SCN)]2+ में Fe की ऑक्सीकरण संख्या क्या है।
उत्तर:
+ 3.
प्रश्न 74.
वैद्युत रासायनिक सेल में ऐनोड ऋणावेशित क्यों होता है?
उत्तर:
वैद्युत रासायनिक सेल में ऐनोड ऋणावेशित होता है क्योंकि ऐनोड पर इलेक्ट्रॉन मुक्त होते हैं।
प्रश्न 75.
मानक हाइड्रोजन इलेक्ट्रोड को उत्क्रमणीय इलेक्ट्रोड क्यों कहते हैं?
उत्तर:
मानक हाइड्रोजन इलेक्ट्रोड उत्क्रमणीय इलेक्ट्रोड कहलाते हैं। क्योंकि वैद्युत रासायनिक सेल में यह ऐनोड तथा कैथोड दोनों की तरह व्यवहार करता है।
प्रश्न 76.
गैल्वेनी सेल में वैद्युत ऊर्जा का स्रोत क्या होता है?
उत्तर:
गैल्वेनी सेल में, रेडॉक्स अभिक्रिया स्वतः प्रवर्तित प्रकृति की होती है। अभिक्रिया में मुक्त ऊर्जा (∆G) के रूप में ऊर्जा निकलती है। यही ऊर्जा वैद्युत ऊर्जा में रूपान्तरित हो जाती है।
प्रश्न 77.
इलेक्ट्रॉनिक संकल्पना के अनुसार ऑक्सीकरण क्या है?
उत्तर:
अभिक्रिया के दौरान ऑक्सीकरण में किसी स्पीशीज द्वारा एक या एक से अधिक इलेक्ट्रॉन का निष्कासन होता है। हरण दीजिए।
प्रश्न 78.
असमानुपातन अभिक्रिया का एक उदाहरण है।
उत्तर:
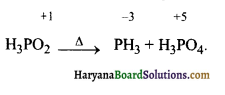
चूँकि P की ऑक्सीकरण संख्या में कमी के साथ-साथ वृद्धि भी हो रही है। इसलिए यह एक असमानुपातन अभिक्रिया का उदाहरण है।
प्रश्न 79.
(CN)– आयन में कार्बन की ऑक्सीकरण संख्या क्या है?
उत्तर:
(CN)–
x – 3 = – 1
∴ x = + 2
प्रश्न 80.
N2O, NO और N2O5 में से कौन-सा HNO3 का एनहाइड्राइड है?
उत्तर:
HNO3 का एनहाइड्राइड N2O5 है और यह निम्न प्रकार बनता है-
2HNO3 → N2O5 + H2O
प्रश्न 81.
सोडियम अमलगम (Na-Hg) में सोडियम की ऑक्सीकरण अवस्था क्या है?
उत्तर:
सोडियम अमलगम साधारणतः दो धातुओं से मिलकर बना एक समांगी मिश्रण है तथा इसमें कोई भी रासायनिक अभिक्रिया नहीं होती है। दोनों धातुएँ मूल अवस्था में होती हैं तथा इसकी ऑक्सीकरण अवस्थाएँ शून्य होती हैं।
प्रश्न 82.
विरंजक चूर्ण में क्लोरीन की ऑक्सीकरण संख्या क्या है?
उत्तर:
विरंजक चूर्ण का रासायनिक सूत्र निम्न है –

इसमें Cl की ऑक्सीकरण अवस्था – 1 है।
प्रश्न 83.
ऑक्सीकरण अभिक्रिया में तत्व के ऑक्सीकरण अंक में क्या परिवर्तन होता है?
उत्तर:
ऑक्सीकरण अभिक्रिया में तत्व के ऑक्सीकरण अंक में वृद्धि होती है-
Fe2+ → Fe3+ + e–
प्रश्न 84.
KO2 (पोटैशियम सुपरऑक्साइड) में ऋणायन पर आवेश व ऑक्सीजन में ऑक्सीकरण संख्या होगी।
उत्तर:
KO2 पोटैशियम का सुपर ऑक्साइड है-
KO2 → K+ + O2+
ऋणायन पर आवेश – 1 होगा, ऑक्सीजन में ऑक्सीकरण संख्या – 1/2 होगी।
प्रश्न 85.
Fe0.94O में Fe की ऑक्सीकरण संख्या है?
उत्तर:
Fe0.94O
x × 0.94 + 1 × (- 2) = 0
या 0.94x – 2 = 0
या 0.94x = 2
∴ x = \(\frac { 200 }{ 94 }\)
लघु उत्तरीय प्रश्न:
प्रश्न 1.
ऑक्सीकरण व अपचयन अभिक्रियाओं में अन्तर बताइए।
उत्तर:
ऑक्सीकरण तथा अपचयन में अन्तर
Table
प्रश्न 2.
निम्नलिखित अभिक्रियाओं में किस पदार्थ का ऑक्सीकरण और किस पदार्थ का अपचयन हो रहा है, बताइए ?
(i) \(\mathrm{PbS}+4 \mathrm{O}_3 \longrightarrow \mathrm{PbSO}_4+4 \mathrm{O}_2\)
(ii) \(\mathrm{SO}_2+2 \mathrm{H}_2 \mathrm{O}+\mathrm{Cl}_2 \longrightarrow 2 \mathrm{HCl}+\mathrm{H}_2 \mathrm{SO}_4\)
(iii) \(\mathrm{H}_2 \mathrm{~S}+\mathrm{I}_2 \longrightarrow 2 \mathrm{HI}+\mathrm{S}\)
(iv) \(2 \mathrm{KMnO}_4+3 \mathrm{H}_2 \mathrm{SO}_4+5 \mathrm{HNO}_2 \longrightarrow \mathrm{K}_2 \mathrm{SO}_4+2 \mathrm{MnSO}_4+3 \mathrm{H}_2 \mathrm{O}+5 \mathrm{HNO}_3\)
उत्तर:
(i) PbS का ऑक्सीकरण तथा O3 का अपचयन।
(ii) SO2 का ऑक्सीकरण तथा Cl2 का अपचयन।
(iii) H2S का ऑक्सीकरण तथा l2 का अपचयन।
(iv) HNO2 का ऑक्सीकरण तथा KMnO4 का अपचयन।
![]()
प्रश्न 3.
नीचे दी गई अभिक्रियाओं में पहचानिए कि किसका ऑक्सीकरण हो रहा है और किसका अपचयन ?
(i) \(\mathrm{H}_2 \mathrm{~S}_{(g)}+\mathrm{Cl}_{2(g)} \longrightarrow 2 \mathrm{HCl}_{(g)}+\mathrm{S}_{(\mathrm{s})}\)
(ii) \(3 \mathrm{Fe}_3 \mathrm{O}_{4(s)}+8 \mathrm{Al}_{(s)} \longrightarrow 9 \mathrm{Fe}_{(s)}+4 \mathrm{Al}_2 \mathrm{O}_{3(s)}\)
(iii) \(2 \mathrm{Na}_{(s)}+\mathrm{H}_{2(g)} \longrightarrow 2 \mathrm{NaH}_{(s)}\)
उत्तर:
(i) H2S का ऑक्सीकरण हो रहा है; क्योंकि हाइड्रोजन से ऋणविद्युती तत्व क्लोरीन का संयोग हो रहा है या धर्नविद्युती तत्व हाइड्रोजन का सल्फर से निष्कासन हो रहा है। हाइड्रोजन के संयोग के कारण क्लोरीन का अपचयन हो रहा है।
(ii) ऑक्सीजन के संयोग के कारण ऐलुमिनियम का ऑक्सीकरण हो रहा है। ऑक्सीजन के निष्कासन के कारण फेरोसोफेरिक ऑक्साइड (Fe3O4) का अपचयन हो रहा है।
(iii) विद्युत् ऋणात्मकता की अवधारणा के सावधानी-पूर्वक अध्ययन से हम यह निष्कर्ष निकालते हैं कि सोडियम ऑक्सीकृत तथा हाइड्रोजन अपचयित होता है।
प्रश्न 4.
H2O2 एक ऑक्सीकारक व अपचायक पदार्थ है। एक-एक समीकरण द्वारा कथन की पुष्टि कीजिए।
उत्तर:
माना \(2 \mathrm{KI}+\mathrm{H}_2 \mathrm{O}_2 \longrightarrow 2 \mathrm{KOH}+\mathrm{I}_2 \uparrow\)
इस अभिक्रिया में KI ऑक्सीकृत होकर I2 देता है, जबकि H2O2 का अपचयन होता है; अतः इस क्रिया में H2O2 ऑक्सीकारक का कार्य करता है।
माना \(\mathrm{Ag}_2 \mathrm{O}+\mathrm{H}_2 \mathrm{O}_2 \longrightarrow 2 \mathrm{Ag} \downarrow+\mathrm{H}_2 \mathrm{O}+\mathrm{O}_2 \uparrow\)
इस अभिक्रिया में Ag2O अपचयित होकर Ag बनाता है। इसलिए यह अपचयन की क्रिया है जिसमें H2O2 एक अपचायक है।
प्रश्न 5.
ओजोन एक ऑक्सीकारक और अपचायक पदार्थ है। एक-एक समीकरण द्वारा इस कथन की पुष्टि कीजिए।
अथवा
निम्नलिखित अभिक्रियाओं में किसमें ओजोन ऑक्सीकारक तथा किसमें अपचायक का कार्य करती है? कारण सहित स्पष्ट कीजिए।
\(\mathrm{PbS}+4 \mathrm{O}_3 \longrightarrow \mathrm{PbSO}_4+4 \mathrm{O}_2 \uparrow\)
\(\mathrm{H}_2 \mathrm{O}_2+\mathrm{O}_3 \longrightarrow \mathrm{H}_2 \mathrm{O}+2 \mathrm{O}_2 \uparrow\)
उत्तर:
यदि ओजोन की किसी पदार्थ से क्रिया होने पर उस पदार्थ में ऑक्सीकरण संख्या में वृद्धि (PbS का PbSO4 में ऑक्सीकरण होने पर S की ऑक्सीकरण संख्या -2 से +6 हो जाती है) होती है तो उस पदार्थ का ऑक्सीकरण होता है। लेड सल्फाइड, ओजोन की क्रिया से लेड सल्फेट में ऑक्सीकृत हो जाता है; अतः इस अभिक्रिया में ओजोन ऑक्सीकारक है।
\(\mathrm{PbS}+4 \mathrm{O}_3 \longrightarrow \mathrm{PbSO}_4+4 \mathrm{O}_2 \uparrow\)
इसी प्रकार, यदि ओजोन की क्रिया से किसी पदार्थ से ऑक्सीजन पृथक् हो जाए तो ओजोन अपचायक होती है; जैसे-निम्नांकित अभिक्रिया में ओजोन अपचायक है; क्योंकि इसमें H2O2 के H2O में परिवर्तन पर ऑक्सीजन की ऑक्सीकरण संख्या -1 से घटकर -2 हो जाती है; अतः इसमें H2O2 ऑक्सीकारक का कार्य करता है।
\(\mathrm{H}_2 \mathrm{O}_2+\mathrm{O}_3 \longrightarrow \mathrm{H}_2 \mathrm{O}+2 \mathrm{O}_2 \uparrow\)
उपर्युक्त अभिक्रियाओं से स्पष्ट है कि ओजोन ऑक्सीकारक तथा अपचायक दोनों की तरह व्यवहार करती है।
प्रश्न 6.
कारण सहित बताइए कि निम्नलिखित में कौन-सा ऑक्सीकारक तथा कौन-सा अपचायक है?
\(2 \mathrm{I}^{-}+\mathrm{H}_2 \mathrm{O}_2 \longrightarrow 2 \mathrm{OH}^{-}+\mathrm{I}_2 \uparrow\)
अथवा
कारण देते हुए बताइए कि निम्नांकित अभिक्रिया मे कौन-सा पदार्थ अपचायक है?
\(2 \mathrm{KI}+\mathrm{H}_2 \mathrm{O}_2 \longrightarrow 2 \mathrm{KOH}+\mathrm{I}_2 \uparrow\)
उत्तर:
उपर्युक्त समीकरण को इस प्रकार भी लिखा जा सकता है-
\(2 \mathrm{I}^{-}+\mathrm{H}_2 \mathrm{O}_2 \longrightarrow 2 \mathrm{OH}^{-}+\mathrm{I}_2 \uparrow\)
IMG
क्योंकि आयोडीन (I) की ऑ. सं. में -1 से 0 तक वृद्धि तथा ऑक्सीजन (O) की ऑ सं. में -1 से -2 तक कमी हो रही है; अतः H2O2 ऑक्सीकारक तथा I2 अपचायक है।
प्रश्न 7.
निम्नलिखित अभिक्रियाओं में H2O2 किसमें ऑक्सीकारक तथा किसमें अपचायक का कार्य करता है?
(i) \(\mathrm{Cl}_2+\mathrm{H}_2 \mathrm{O}_2 \longrightarrow 2 \mathrm{HCl}+\mathrm{O}_2 \uparrow\)
(ii) \(2 \mathrm{KI}+\mathrm{H}_2 \mathrm{O}_2 \longrightarrow 2 \mathrm{KOH}+\mathrm{I}_2 \uparrow\)
उत्तर:
(i) IMG
इस अभिक्रिया में H2O2 अपचायक है; क्योंकि O की ऑ. सं. में -1 से 0 की वृद्धि हो रही है।
(ii)IMG
इस अभिक्रिया में H2O2 ऑक्सीकारक है; क्योंकि O की ऑ. सं. -1 से -2 तक घट रही है।
प्रश्न 8.
कारण देते हुए बताइए कि निम्नलिखित अभिक्रिया में कौन-सा पदार्थ ऑक्सीकारक है ?
(i) \(2 \mathrm{FeCl}_3+\mathrm{H}_2 \mathrm{~S} \longrightarrow 2 \mathrm{FeCl}_2+2 \mathrm{HCl}+\mathrm{S} \downarrow\)
(ii) \(\mathrm{SnCl}_2+\mathrm{HgCl}_2 \longrightarrow \mathrm{SnCl}_4+\mathrm{Hg} \downarrow\)
उत्तर:
IMG
इस अभिक्रिया में FeCl3 में Fe की ऑ. सं. +3 है तथा FeCl2 में Fe की ऑ. सं. +2 है; क्योंकि ऑ. सं. में कमी हो रही है; अत: FeCl3 ऑक्सीकारक है।
(ii) IMG
इस अभिक्रिया में HgCl2 में Hg की ऑ. सं. +2 है तथा Hg में Hg की ऑ. सं. 0 (शून्य) है; क्योंकि ऑ. सं. में कमी हो रही है; अत: HgCl2 ऑक्सीकारक है।
प्रश्न 9.
निम्नलिखित अभिक्रियाओं में किसमें SO2 ऑक्सीकारक तथा किसमें अपचायक का कार्य करती है?
(i) \(2 \mathrm{Mg}+\mathrm{SO}_2 \longrightarrow 2 \mathrm{MgO}+\mathrm{S} \downarrow\)
(ii) \(2 \mathrm{SO}_2+\mathrm{O}_2 \longrightarrow 2 \mathrm{SO}_3 \uparrow\)
उत्तर:
(i) IMG
यहाँ SO2 में S की ऑ. सं. +4 तथा सल्फर में S की ऑ. सं. 0 है अर्थात् ऑ. सं. में कमी हो रही है; अतः इसमें SO2 का S में अपचयन होता है और SO2 ऑक्सीकारक की भाँति कार्य करती है।
(ii) IMG
यहाँ SO2 में S की ऑ. सं. +4 तथा SO3 में S की ऑ. सं. +6 है अर्थात् ऑ. सं. में वृद्धि हो रही है; अतः इस क्रिया में SO2 अपचायक की भाँति कार्य करती है।
प्रश्न 10.
निम्नांकित अभिक्रियाओं में ऑक्सीकारक और अपचायक बताइए। कारण भी दीजिए-
(i) \(2 \mathrm{FeCl}_3+\mathrm{SnCl}_2 \longrightarrow 2 \mathrm{FeCl}_2+\mathrm{SnCl}_4\)
(ii) \(2 \mathrm{FeCl}_3+2 \mathrm{KI} \longrightarrow 2 \mathrm{FeCl}_2+2 \mathrm{KCl}+\mathrm{I}_2 \uparrow\)
(iii) \(\mathrm{H}_2 \mathrm{SO}_3+2 \mathrm{H}_2 \mathrm{~S} \longrightarrow 3 \mathrm{~S} \downarrow+3 \mathrm{H}_2 \mathrm{O}\)
(iv) \(2 \mathrm{Cu}^{2+}+4 \mathrm{I}^{-} \longrightarrow 2 \mathrm{CuI}+\mathrm{I}_2 \uparrow\)
उत्तर:
IMG
उपर्युक्त अभिक्रिया में Sn की ऑक्सीकरण संख्या में +2 से +4 की वृद्धि हो रही है; अतः SnCl2 अपचायक है तथा Fe की ऑ. सं. में + 3 से +2 की कमी हो रही है; अत: FeCl3 एक ऑक्सीकारक है।
(ii) IMG
उपर्युक्त अभिक्रिया में FeCl3 ऑक्सीकारक है; क्योंकि यह KI (जिसमें I की ऑ. सं. -1 है) को I2 (जिसकी ऑ. सं. शून्य है) में ऑक्सीकृत कर देता है और KI एक अपचायक है; क्योंकि यह FeCl3 (जिसमें Fe की ऑ. सं. +3) को FeCl2 (जिसमें Fe की ऑ. सं. +2) में अपचयित कर देता हैं।
(iii) IMG
उपर्युक्त अभिक्रिया में क्योंकि H2S में S की ऑ. सं. में -2 से 0 तक वृद्धि तथा H2SO3 में S की ऑ.सं. में +4 से 0 तक कमी हो रही है; अतः इस अभिक्रिया में H2SO3 ऑक्सीकारक तथा H2S अपचायक है।
(iv) IMG
प्रश्न 28.
अभिक्रिया \(\mathrm{Cl}_{2(g)}+2 \mathrm{I}^{-} \longrightarrow \mathrm{I}_{2(s)}+2 \mathrm{Cl}^{-}\) के लिए E0cell का मान नीचे दी गई अर्द्ध्र- अभिक्रियाओं की सहायता से ज्ञात करिए-
\(\mathrm{Cl}_{2(\mathrm{~g})}+2 e^{-} \longrightarrow 2 \mathrm{Cl}^{-}\) E0 = + 1.36V
\(\mathrm{I}_{2(\mathrm{~g})}+2 e^{-} \longrightarrow 2 \mathrm{I}^{-}\) E0 = +0.54V
उत्तर:
\(\mathrm{E}_{\text {cell }}^0=\mathrm{E}_{\text {(cathode) }}^0-E_{(\text {Anode) }}^0\)
= \(\mathrm{E}_{\mathrm{Cl}_2 / \mathrm{Cl}^{-}}^0-\mathrm{E}_{\mathrm{I}_2 / \mathrm{I}}^0\)
= 1.36 -(+ 0.54)
= 0.82 V
![]()
प्रश्न 29.
Zn2+, Mg2+ और Na+ के लिए मानक अपचयन विभव के मान क्रमशः -0.76V, -2.37 V तथा -2.71V हैं।
अतः निम्न में से सर्वाधिक शक्तिशाली ऑक्सीकारक कौन-सा है ?
Zn2+, Mg2+ य| Na+
उत्तर:
उपर्युक्त लिखे आयनों में से Zn2+ सर्वाधिक शक्तिशाली ऑक्सीकारक है क्योंकि इसके मानक अपचयन विभव का मान सबसे अधिक है अतः यह आसानी से इलेक्ट्रॉन ग्रहण कर सकता है।
प्रश्न 30.
निम्नलिखित अभिक्रिया गैल्वनिक सेल में विद्युत् का उत्पादन करती है-
\(2 \mathrm{Fe}^{3+}+2 \mathrm{Cl}^{-} \longrightarrow 2 \mathrm{Fe}^{2+}+\mathrm{Cl}_2\)
इस सेल में ऐनोड और कैथोड पर होने वाली अभिक्रियाओं को लिखिए। इसके साथ-साथ ऐनोड और कैथोड की प्रवृत्ति बताइए तथा सेल आरेख लिखिए।
उत्तर:
IMG
सेल में ऐनोड पर ऑक्सीकरण होता है तथा यह-ve terminal होता है जबकि कैथोड पर अपचयन होता है तथा यह + ve terminal का कार्य करता है।
सेल आरेख- \(\mathrm{Cl}^{-}\left|\mathrm{Cl}_2 \| \mathrm{Fe}^{3+}\right| \mathrm{Fe}^{2+}\)
प्रश्न 31.
निम्नलिखित धातुओं को उनकी ऑक्सीकृत होने की घटती हुई प्रवृत्ति के क्रम में लिखिए-
Zn, Cu, Mg, Ag
उत्तर:
विद्युत् रासायनिक श्रेणी में धातुओं की इलेक्ट्रॉन त्याग करने की अर्थात् ऑक्सीकृत होने की प्रवृत्ति ऊपर से नीचे की ओर घटती है। विद्युत् रासायनिक श्रेणी में Mg का स्थान Zn के ऊपर, Zn का स्थान Cu के ऊपर और Cu का स्थान Ag के ऊपर है। अतः इन धातुओं की ऑक्सीकृत होने की प्रवृत्ति घटने का क्रम होगा-
Mg > Zn > Cu > Ag
प्रश्न 32.
कॉपर का मानक इलेक्ट्रोड विभव +0.34 V और जिंक का मानक इलेक्ट्रोड विभव -0.76 V है। इन दोनों इलेक्ट्रोडों को परस्पर जोड़ने से बने गैल्वेनिक सेल का E.M.F. कितना होगा ? सेल अभिक्रिया की समीकरण लिखिए।
उत्तर:
\(\mathrm{E}_{\text {cell }}^0=E_{(\text {cathode) }}^0-\mathrm{E}_{\text {(Anode) }}^0\)
\(\mathrm{E}_{\text {cell }}^0=\mathrm{E}_{\mathrm{Cu}^{2+} / \mathrm{Cu}}^0-\mathrm{E}_{\mathrm{Zn}^{2+} / \mathrm{Zn}}^0\)
= + 0.34 – (-0.76)
∴ E0cell = + 1. 10 V
IMG
प्रश्न 33.
मानक इलेक्ट्रोड विभव को परिभाषित कीजिए। इलेक्ट्रोड विभव तथा मानक इलेक्ट्रोड विभव में सम्बन्ध बताइए।
उत्तर:
मानक इलेक्ट्रोड विभव (Standard electrode potential) – 25°C पर किसी धातु की छड़ उसके किसी लवण के एक मोलर (1 M) सान्द्रता वाले विलयन में डुबोने से उस धातु की सतह पर धनात्मक या ऋणात्मक आवेश आ जाता है; इस कारण धातु तथा आयनों के बीच जो विभवान्तर उत्पन्न होता है, उसे मानक इलेक्ट्रोड विभव (standard electrode potential) कहते हैं। मानक इलेक्ट्रोड विभव को E0 से व्यक्त करते हैं। इसका मात्रक भी वोल्ट होता है।
IMG
इलेक्ट्रोड विभव व मानक इलेक्ट्रोड विभव में सम्बन्ध (Relation between electrode potential and standard electrode potential)—माना इलेक्ट्रोड क्रिया निम्नलिखित प्रकार से है-
\(\mathrm{M}^{n+}+n e^{-} \longrightarrow \mathrm{M}\)
नेर्नस्ट समीकरण के अनुसार,
\(\mathrm{E}=\mathrm{E}^0+\frac{0-0591}{n} \log _{10}\left[\mathrm{M}^{n+}\right]\)
\(\mathrm{E}=\mathrm{E}^0-\frac{0 \cdot 0591}{n} \log _{10} \frac{1}{\left[\mathrm{M}^{n+}\right]}\)
जहाँ, E = इलेक्ट्रोड विभव, E0 = मानक इलेक्ट्रोड विभव, n = इलेक्ट्रोड क्रिया में भाग लेने वाले इलेक्ट्रॉनों की संख्या तथा [Mn+]= धातु आयनों की मोलर सान्द्रता।
किसी विलयन की सान्द्रता [Mn+] = 0 होगी।
अत: 25°C पर इलेक्ट्रोड विभव (E) = मानक इलेक्ट्रोड विभव (E0)
प्रश्न 34.
कुछ अर्द्ध-अभिक्रियाओं के E0 निम्न प्रकार हैं।
\(\mathrm{I}_2+2 e^{-} \longrightarrow 2 \mathrm{I}^{-;} \mathbf{E}^0=+0.54 \mathrm{~V}\)
\(\mathrm{Cl}_2+2 e^{-} \longrightarrow 2 \mathrm{Cl}^{-;} \mathrm{E}^0=+1.36 \mathrm{~V}\)
\(\mathrm{Fe}^{3+}+e^{-} \longrightarrow \mathrm{Fe}^{2+;} \mathbf{E}^0=+0 \cdot 76 \mathrm{~V}\)
\(\mathrm{Ce}^{4+}+e^{-} \longrightarrow \mathrm{Ce}^{3+;} \mathrm{E}^0=+1 \cdot 6 \mathrm{~V}\)
\(\mathrm{Sn}^{4+}+2 e^{-} \longrightarrow \mathrm{Sn}^{2+;} \mathbf{E}^0=+0 \cdot 15 \mathrm{~V}\)
उपर्युक्त विभवों के आधार पर निम्नलिखित प्रश्नों के उत्तर दीजिए-
प्रश्न (a). क्या Fe3+ द्वारा Ce3+ का ऑक्सीकरण हो सकता है ? कारण सहित समझाइए।
उत्तर:
नहीं, क्योंकि Ce3+ का मानक इलेक्ट्रोड विभव अधिक है।
प्रश्न (b). क्या I2 क्लोरीन को KCl में से विस्थापित कर सकती है?
उत्तर:
नहीं। क्योंकि I2 का मानक इलेक्ट्रोड विभव कम है।
प्रश्न (c). SnCl2 और FeCl3 विलयनों को मिलाने पर क्या अभिक्रिया होगी? समीकरण लिखिए।
उत्तर:
\(2 \mathrm{FeCl}_3+\mathrm{SnCl}_2 \rightarrow 2 \mathrm{FeCl}_2+\mathrm{SnCl}_4\)
प्रश्न (d).
उपर्युक्त अर्द्ध सेल अभिक्रियाओं में सबसे प्रबल ऑक्सीकारक और सबसे प्रबल अपचायक कौन-सा है ?
उत्तर:
प्रबल ऑक्सीकारक- Ce4+
प्रबल अपचायक- Sn2+
प्रश्न (e). FeCl3 विलयन डालने पर क्या KI विलयन से आयोडीन मुक्त होगी?
उत्तर:
हाँ आयोडीन मुक्त होगी।
प्रश्न 35.
(i) कुछ पदार्थों के अपचयन विभव निम्नवत् हैं, इनमें सबसे प्रबल ऑक्सीकारक तथा सबसे प्रबल अपचायक बताइए-
IMG
इन इलेक्ट्रोड विभवों के आधार पर निम्नलिखित प्रश्नों के उत्तर दीजिए-
(क) क्या Fe2+ आयन Cu2+ आयन को अपचयित कर सकता है ?
(ख) निम्नांकित में से सबसे प्रबल अपचायक है-
Cu+, Fe2+, Hg+, Br–
उत्तर:
(i) जो पदार्थ जितना अधिक प्रबल ऑक्सीकारक होता है उसका अपचयन विभव उतना-ही अधिक धनात्मक या कम ऋणात्मक होता है तथा जो पदार्थ अधिक प्रबल अपचायक होता है, उसका अपचयन विभव कम धनात्मक या अधिक ऋणात्मक होता है; अतः
(क) Sn2+, Mn2+, I+ तथा Fe2+ अपचायकों मे से सबसे प्रबल अपचायक Sn2+ है; क्योंकि इसका अपचयन विभव सबसे कम धनात्मक है।
(ख) Sn4+, MnO4–, I2 तथा Fe3+ अपचायकों में से सबसे प्रबल ऑक्सीकारक MnO4– है; क्योंकि इसका अपचयन विभव सबसे अधिक धनात्मक है।
(ii) (क) Fe2+ आयन Cu2+ आयन को अपचयित कर देगा; क्योंकि अपचायक Fe2+ का इलेक्ट्रोड विभव ऑक्सीकारक Cu2+ से अधिक है। अभिक्रिया समीकरण (b) में से (a) को घटाने पर,
\(\mathrm{Fe}^{2+} \longrightarrow \mathrm{Fe}^{3+}+e^{-} ; \mathrm{E}^0=-0.77\) वोल्ट
\(\mathrm{Cu}^{+} \longrightarrow \mathrm{Cu}^{2+}+e^{-} ; \mathrm{E}^0=-1 \cdot 5\) वोल्ट
या \(\mathrm{Fe}^{2+}+\mathrm{Cu}^{2+} \longrightarrow \mathrm{Cu}^{+}+\mathrm{Fe}^{3+} ; \mathrm{E}^0=-0.73\) वोल्ट
प्रश्न 36.
(i) निम्नलिखित सम्भव अभिक्रियाओं की सहायता से Mg, Zn, Cu तथा Ag को उनके घटते हुए इलेक्ट्रोड विभव के क्रम में लिखिए-
\(\mathrm{Cu}+2 \mathrm{Ag}_{(\mathrm{aq})}^{+} \longrightarrow \mathrm{Cu}^{2+}{ }_{(a q)}+2 \mathrm{Ag}\)
\(\mathrm{Mg}+\mathrm{Zn}^{2+}{ }_{(a q)} \longrightarrow \mathrm{Mg}^{2+}{ }_{(a q)}+\mathrm{Zn}\)
\(\mathrm{Zn}+\mathrm{Cu}^{2+}{ }_{(a q)} \longrightarrow \mathrm{Zn}^{2+}{ }_{(a q)}+\mathrm{Cu}\)
(ii) कुछ अर्द्ध-अभिक्रियाओं के इलेक्ट्रोड विभव इस प्रकार हैं-
\(\mathrm{Fe}_{(a q)}^{3+}+e^{-} \longrightarrow \mathrm{Fe}_{(a q)}^{2+}\); E0 = + 0.76 वोल्ट
\(\mathrm{Ce}_{(a q)}^{4+}+e^{-} \longrightarrow \mathrm{Ce}_{(a q)}^{3+}\); E0 = + 1.60 वोल्ट
कारण देते हुए बताइए कि क्या Fe3+ से Ce4+ ऑक्सीकृत हो सकता है?
(iii) इलेक्ट्रोड अभिक्रियाओं-
(a) \(\mathrm{Zn}(s) \longrightarrow \mathrm{Zn}^{2+}{ }_{(a q)}+2 e^{-}\); E0 = 0.76 वोल्ट
(b) \(\mathrm{Cu}(s) \longrightarrow \mathrm{Cu}^{2+}{ }_{(a q)}+2 e^{-}\); E0 = -0.337 वोल्ट में कारण सहित बताइए कि
\(\mathrm{Zn}_{(s)}+\mathrm{Cu}_{(a q)}^{2+} \longrightarrow \mathrm{Zn}_{(a q)}^{2+}+\mathrm{Cu}_{(s)}\) का होना सम्भव है या नहीं ?
उत्तर:
(i) विद्युत्-रासायनिक श्रेणी के अनुसार तत्वों का घटता इलेक्ट्रोड विभव क्रम निम्नवत् है-
Mg > Zn > Cu > Ag
(ii) इन अर्द्ध-सेल अभिक्रियाओं में Fe3+ का Fe2+ में अपचयन विभव, Ce4+ के Ce3+ में अपचयन विभव से अधिक है। नियमानुसार उच्च विभव का अपचायक कम विभव के ऑक्सीकारक से क्रिया करेगा; अत: Fe3+ से Ce4+ ऑक्सीकृत नहीं होगा।
(iii) प्रश्नानुसार,
IMG
इस क्रिया में Zn अपचायक का कार्य करता है तथा कॉपर ऑक्सीकारक का कार्य करता है। Zn का E0, Cu के E0 से उच्च है; अतः नियमानुसार उच्च Eo का अपचायक कम E0 के ऑक्सीकारक से ही क्रिया कर सकता है; अतः निम्नलिखित अभिक्रिया सम्भव है-
\(\mathrm{Zn}_{(s)}+\mathrm{Cu}_{(a q)}^{2+} \longrightarrow \mathrm{Zn}_{(a q)}^{2+}+\mathrm{Cu}_{(s)}\)
![]()
प्रश्न 37.
H2S केवल अपचायक की तरह कार्य करता है जबकि SO2 अपचायक तथा ऑक्सीकारक दोनों की भाँति कार्य कर सकता है, क्यों ?
उत्तर:
H2S में सल्फर की ऑक्सीकरण संख्या का मान -2 है जबकि SO2 में सल्फर की ऑक्सीकरण संख्या +4 है। H2S में सल्फर की ऑक्सीकरण संख्या बढ़ तो सकती है परन्तु यह घट नहीं सकती है अत: H2S केवल अपचायक की भाँति कार्य करता है। जबकि SO2 में सल्फर की ऑक्सीकरण संख्या घट भी सकती है तथा बढ़ भी सकती है।
इसी कारण SO2 की ऑक्सीकरण संख्या बढ़ तो सकती है परन्तु यह घट नहीं सकती है अत: H2S केवल अपचायक की भाँति कार्य करता है। जबकि SO2 में सल्फर की ऑक्सीकरण संख्या घट भी सकती है तथा बढ़ भी सकती है। इसी कारण SO2 अपचायक तथा ऑक्सीकारक दोनों की भाँति कार्य कर सकता है। अपचायक तथा ऑक्सीकारक दोनों की भाँति कार्य कर सकता है।
प्रश्न 38.
निम्नलिखित रेडॉक्स अभिक्रियाओं की अर्द्ध-अभिक्रियाओं को लिखिए-
(i) \(2 \mathrm{Fe}_{(a q)}^{3+}+2 \mathrm{I}_{(a q)}^{-} \longrightarrow \mathrm{I}_{2(s)}+2 \mathrm{Fe}_{(a q)}^{2+}\)
(ii) \(2 \mathrm{Na}_{(s)}+\mathrm{Cl}_{2(g)} \longrightarrow 2 \mathrm{NaCl}_{(s)}\)
(iii) \(\mathrm{Zn}_{(s)}+2 \mathrm{H}_{(a q)}^{+} \longrightarrow \mathrm{Zn}^{2+}{ }_{(a q)}+\mathrm{H}_{2(g)}\)
उत्तर:
(i) \(2 \mathrm{Fe}^{3+}{ }_{(a q)}+2 \mathrm{I}^{-}{ }_{(a q)} \rightarrow \mathrm{I}_{2(s)}+2 \mathrm{Fe}^{2+}{ }_{(a q)}\) की अर्द्ध अभिक्रियाएँ निम्न हैं-
ऑक्सीकरण अर्द्ध-अभिक्रिया-
\(2 \mathrm{I}_{(a q)}^{-} \longrightarrow \mathrm{I}_{2(s)}+2 e^{-}\)
अपचयन अर्द्ध-अभिक्रिया
\(2 \mathrm{Fe}^{3+}(a q)+2 e^{-} \longrightarrow 2 \mathrm{Fe}^{2+}(a q)\)
(ii) \(2 \mathrm{Na}_{(s)}+\mathrm{Cl}_{2(g)} \longrightarrow 2 \mathrm{NaCl}_{(s)}\) की अर्द्ध अभिक्रियाएँ निम्न हैं-
ऑक्सीकरण अर्द्ध-अभिक्रिया-
\(2 \mathrm{Na}_{(s)} \longrightarrow 2 \mathrm{Na}_{(a q)}^{+}+2 e^{-}\)
अपचयन अर्द्ध-अभिक्रिया-.
\(\mathrm{Cl}_{2(g)}+2 e^{-} \longrightarrow 2 \mathrm{Cl}^{–}(a q)\)
(iii) \(\mathrm{Zn}_{(s)}+2 \mathrm{H}_{(a q)}^{+} \longrightarrow \mathrm{Zn}_{(a q)}^{2+}+\mathrm{H}_{2(g)}\) की अर्द्ध अभिक्रियाएँ निम्न हैं-
ऑक्सीकरण अर्द्ध-अभिक्रिया-
\(\mathrm{Zn}_{(s)} \longrightarrow \mathrm{Zn}^{2+}{ }_{(a q)}+2 e^{-}\)
अपचयन अर्द्ध-अभिक्रिया-
\(2 \mathrm{H}_{(a q)}^{+}+2 e^{-} \longrightarrow \mathrm{H}_{2(g)}\)
प्रश्न 39.
निम्नलिखित रेडॉक्स अभिक्रिया के लिए,
\(\mathrm{Mn}+\mathrm{CuSO}_4 \longrightarrow \mathrm{MnSO}_4+\mathrm{Cu}\)
(i) ऑक्सीकरण एवं अपचयन अर्द्ध-अभिक्रियाएँ लिखिए।
(ii) कौन-सी स्पीशीज अपचायक की भाँति तथा कौन-सी ऑक्सीकारक की भाँति कार्य करेगी ?
(iii) अभिक्रिया में SO42- आयन की क्या भूमिका है ?
उत्तर:
(i) ऑक्सीकरण अर्द्ध-अभिक्रिया-
\(\mathrm{Mn} \longrightarrow \mathrm{Mn}^{2+}+2 e^{-}\)
अपचयन अर्द्ध-अभिक्रिया-
\(\mathrm{Cu}^{2+}+\mathrm{SO}_4^{2-}+2 e^{-} \longrightarrow \mathrm{Cu}+\mathrm{SO}_4^{2-}\)
(ii) यहाँ पर Mn अपचायक की भाँति कार्य करता है क्योंकि इससे इलेक्ट्रॉन मुक्त होते हैं। Cu2+ आयन ऑक्सीकारक की भाँति कार्य करता है, क्योंकि यह इलेक्ट्रॉन ग्रहण करता है।
(iii) SO42- आयनों की प्रवृत्ति उभयनिष्ठ होती है। यह रेडॉक्स अभिक्रिया में किसी भी प्रकार की कोई भूमिका नहीं निभाते हैं। इन्हें दर्शक आयन (spectator ions) कहते हैं।
प्रश्न 40.
निम्नलिखित यौगिकों में जीनॉन की ऑक्सीकरण संख्या बताइए-
XeF4, XeOF2, XeO2F2, XeF6
उत्तर:
(i) XeF4 (यदि x जीनॉन की ऑक्सीकरण संख्या है)
x + 4 × -1 = 0
∴ =+4
(ii) XeOF2 (यदि x जीनॉन की ऑक्सीकरण संख्या है)
x + (-2) + 2 × (-1) = 0
या x – 4 = 0
∴ x = +4
(iii) XeO2F2 (यदि x जीनॉन की ऑक्सीकरण संख्या है)
x + 2 × (-2) + 2 × (-1) = 0
या x – 4 – 2 = 0
∴ x = +6
(iv) XeF6 (यदि x जीनॉन की ऑक्सीकरण संख्या है)
x + 6 × (-1) = 0
या x – 6 = 0
∴ x = +6
प्रश्न 41.
निम्नलिखित आयनों के लिए असमानुपातन अभिक्रियाएँ लिखिए-
(i) ClO–
(ii) ClO2–
(iii) ClO3–
उत्तर:
(i) ClO– के लिए असमानुपातन अभिक्रिया-
IMG
(ii) ClO2– के लिए असमानुपातन अभिक्रिया-
IMG
(iii) ClO3– के लिए असमानुपातन अभिक्रिया-
IMG
प्रश्न 42.
निम्न अभिक्रियाओं को आयन इलेक्ट्रॉन विधि द्वारा सन्तुलित करें-
(1) \(\mathrm{FeCl}_3+\mathrm{H}_2 \mathrm{~S} \longrightarrow \mathrm{FeCl}_2+\mathrm{HCl}+\mathrm{S}\)
(2) \(\mathrm{Cu}+\mathrm{HNO}_3 \longrightarrow \mathrm{Cu}\left(\mathrm{NO}_3\right)_2+\mathrm{NO}+2 \mathrm{H}_2 \mathrm{O}\)
(3) \(\mathrm{KI}+\mathrm{Cl}_2 \longrightarrow \mathrm{KCl}+\mathrm{I}_2\)
(4) \(\mathrm{MnO}_2+\mathrm{HCl} \longrightarrow \mathrm{MnCl}_2+\mathrm{H}_2 \mathrm{O}+\mathrm{Cl}_2\)
(5) \(\mathrm{H}_2 \mathrm{~S}+\mathrm{HNO}_3 \longrightarrow \mathrm{H}_2 \mathrm{SO}_4+\mathrm{NO}_2+\mathrm{H}_2 \mathrm{O}\)
उत्तर:
(1) \(\mathrm{H}_2 \mathrm{~S}+2 \mathrm{FeCl}_3 \longrightarrow 2 \mathrm{FeCl}_2+2 \mathrm{HCl}+\mathrm{S}\)
(2) \(3 \mathrm{Cu}+8 \mathrm{HNO}_3 \longrightarrow 3 \mathrm{Cu}\left(\mathrm{NO}_3\right)_2+2 \mathrm{NO}+4 \mathrm{H}_2 \mathrm{O}\)
(3) \(2 \mathrm{KI}+\mathrm{Cl}_2 \longrightarrow 2 \mathrm{KCl}+\mathrm{I}_2\)
(4) \(\mathrm{MnO}_2+4 \mathrm{HCl} \longrightarrow \mathrm{MnCl}_2+\mathrm{Cl}_2+2 \mathrm{H}_2 \mathrm{O}\)
(5) \(\mathrm{H}_2 \mathrm{~S}+8 \mathrm{HNO}_3 \longrightarrow \mathrm{H}_2 \mathrm{SO}_4+8 \mathrm{NO}_2+4 \mathrm{H}_2 \mathrm{O}\)
![]()
प्रश्न 43.
कॉपर एवं सिल्वर इ्केक्ट्रोडों के मध्य एक सेल निम्न प्रकार हैं-
IMG
उत्तर:
= E0सेल = E0कैथोड – E0ऐनोड
= \(\mathrm{E}_{\mathrm{Ag}^{+} / \mathrm{Ag}}^0-\mathrm{E}_{\mathrm{Cu}^{2+} / \mathrm{Cu}}^0\)
= 0.80 = 0.34
= 0.46 V