Haryana State Board HBSE 11th Class Chemistry Important Questions Chapter 1 रसायन विज्ञान की कुछ मूल अवधारणाएँ Important Questions and Answers.
Haryana Board 11th Class Chemistry Important Questions Chapter 1 रसायन विज्ञान की कुछ मूल अवधारणाएँ
बहुविकल्पीय प्रश्न
1. एक मोल ऑक्सीजन में, ऑक्सीजन के अणुओं की संख्या होगी –
(1) 1
(2) 100
(3) 6·023 × 1023
(4) 0.6023 x 1023.
उत्तर:
(3) 6·023 × 1023
2. तुल्यांकी भार का मात्रक होता है-
(1) ग्राम
(2) किलोग्राम
(3) ग्राम प्रति लीटर
(4) इनमें से कोई नहीं
उत्तर:
(4) इनमें से कोई नहीं
3. NTP पर प्रत्येक गैस के एक ग्राम अणु भार का आयतन –
(1) 224 लीटर होता है
(2) 224 c. c. होता है
(3) 2.24 लीटर होता है
(4) 22.4 लीटर होता है।
उत्तर:
(4) 22.4 लीटर होता है।
4. 44 ग्राम CO2 में उपस्थित अणुओं की संख्या है-
(1) 12 × 1023
(2) 3 × 1010
(3) 6 × 1023
(4) 1 × 1023
उत्तर:
(3) 6 × 1023
5. मानक ताप तथा दाब पर 0.25 मोल अमोनिया गैस का आयतन है-
(1) 2-24 लीटर
(2) 5.6 लीटर
(3) 11.2 लीटर
(4) 22.4 लीटर।
उत्तर:
(2) 5.6 लीटर
6. एक धातु के क्लोराइड का सूत्र MCl3 है और धातु का तुल्यांकी भार 9 है। तत्व का परमाणु भार होगा-
(1) 9
(2) 18
(3) 27
(4) 3
उत्तर:
(3) 27
![]()
7. किसी तत्व की परमाणुकता प्रकट करती है—
(1) तत्व का परमाणु क्रमांक
(2) तत्व का परमाणु भार
(3) तत्व की आवोगाद्रो संख्या
(4) तत्व के अणु में उपस्थित परमाणुओं की संख्या।
उत्तर:
(4) तत्व के अणु में उपस्थित परमाणुओं की संख्या।
8. 111 ग्राम CaCl2 में आयनों की कुल संख्या होगी –
(1) एक मोल
(2) दो मोल
(3) तीन मोल
(4) चार मोल।
उत्तर:
(3) तीन मोल
9. वायु है-
(1) यौगिक
(2) मिश्रण
(3) तत्व
(4) इनमें से कोई नहीं।
उत्तर:
(2) मिश्रण
10. एक मोल H2O में हैं-
(1) 6.02 × 1023 ऑक्सीजन के परमाणु
(2) 6.02 x 1023 हाइड्रोजन के परमाणु
(3) 18.1 × 1020 H2O के परमाणु
(4) H2O के 3 ग्राम अणु।
उत्तर:
(1) 6.02 × 1023 ऑक्सीजन के परमाणु
11. ऑक्सेलिक अम्ल (C2O4H2. 2H2O) का तुल्यांकी भार क्या है, यदि इसका अणु भार 126 है?
(1) 98
(2) 63
(3) 196
(4) 126
उत्तर:
(2) 63
12. पदार्थों का कौन सा युग्म गुणित अनुपात के नियम की व्याख्या करता है?
(1) CO तथा CO2
(2) H2O तथा D2O
(3) NaCl तथा NaBr
(4) MgO तथा Mg (OH)2
उत्तर:
(1) CO तथा CO2
13. MnSO4 का तुल्यांकी भार, अणु भार का आधा हो जाता है, जब यह परिवर्तित होता है-
(1) Mn2O3 में
(2) MnO2 मैं
(3) MnO4– मैं
(4) MnO42- में
उत्तर:
(4) MnO42- में
14. मोल X तथा 9 मोल Y निम्न क्रिया के अनुसार क्रिया करके बनाते हैं-
X + 2Y → Z
Z के कितने मोल बनेंगे ?
(1) 5 मोल Z
(2) 8 मोल 7
(3) 14 मोल Z
(4) 4 मोल Z
उत्तर:
(4) 4 मोल Z
15. 27 ग्राम एल्युमिनियम ऑक्सीजन के कितने ग्राम से पूर्णतः अभिक्रिया करेगी?
(1) 8 ग्राम
(2) 16 ग्राम
(3) 32 ग्राम
(4) 24 ग्राम।
उत्तर:
(4) 24 ग्राम।
16. चूने के पत्थर (CaCO) की कितनी मात्रा CaO के 56 किग्रा. देगी।
(1) 1000 किग्रा.
(2) 56 किग्रा.
(3) 2 किग्रा.
(4) 100 किग्रा.
उत्तर:
(4) 100 किग्रा.
17. Na2CO3 के 5-3 ग्राम 500 मिली में घुले हैं। विलयन की मोलरता होगी-
(1) 0.1 M
(2) 0.2 M
(3) 0.3 M
(4) 1.0 M
उत्तर:
(1) 0.1 M
18. निम्न में से अणुओं की न्यूनतम संख्या किसमें होगी?
(1) 0.1 मोल CO2 में
(2) 11 लीटर CO2 में
(3) 22 ग्राम CO2 मैं
(4) 22.4 x 10³ मिली CO2 में
उत्तर:
(1) 0.1 मोल CO2 में
![]()
19. NaOH में ऑक्सीजन का प्रतिशत है-
(1) 40
(2) 16
(3) 8
(4) 1
उत्तर:
(1) 40
20. शुद्ध जल की मोलरता होती है.
(1) 55.6
(2) 50
(3) 100
(4) 18
उत्तर:
(1) 55.6
21. अणुओं की न्यूनतम संख्या निम्न में से किसमें है?
(1) I मोल SO2 में
(2) SO2 गैस के 1 × 1023 अणुओं में
(3) S. T.P. पर 11.2 लीटर SO2 मैं
(4) सभी में समान है।
उत्तर:
(3) S. T.P. पर 11.2 लीटर SO2 मैं
22. अणुओं की सबसे अधिक संख्या उपस्थिति है।
(1) 28 ग्राम CO मैं
(2) 36 ग्राम जल में
(3) 54 ग्राम N2O5 में
(4) 46 ग्राम C2H5OH में
उत्तर:
(2) 36 ग्राम जल में
23. 560 ग्राम Fe में उपस्थित परमाणुओं की संख्या होगी-
(1) 70 ग्राम नाइट्रोजन की दोगुनी
(2) 20 ग्राम हाइड्रोजन की आधी
(3) (1) तथा (2) दोनों सही हैं
(4) उपरोक्त में से कोई नहीं।
उत्तर:
(3) (1) तथा (2) दोनों सही हैं
24. यदि जल का घनत्व 1 ग्राम / सेमी³ है, तो जल के एक अणु का आयतन होगा-
(1) 18 सेमी.³
(2) 22400 सेमी
(3) 6.02 x 10-23 सेमी³
(4) 3.0 x 10-23 सेमी³
उत्तर:
(4) 3.0 x 10-23 सेमी³
25 00300 में सार्थक अंकों की संख्या है-
(1) एक
(2) दो
(3) तीन
(4) चार।
उत्तर:
(3) तीन
26. 0.05 g भार वाले जल की बूँद में H2O अणुओं की संख्या है-
(1) 1.5 × 1023
(2) 1.672 × 1021
(3) 1.5 x 1020
(4) 6.02 × 1022
उत्तर:
(2) 1.672 × 1021
27. निश्चित ताप एवं दाब के अधीन विभिन्न गैसों के समान आयतन में होता है-
(1) समान घनत्व
(2) समान द्रव्यमान
(3) समान परमाणु
(4) समान अणु
उत्तर:
(4) समान अणु
28. मैग्नीशियम फॉस्फेट, Mg3 (PO4)2 के कितने मोल में 0-25 मोल ऑक्सीजन परमाणु होंगे?
(1) 0.02
(2) 3·125 x 10-2
(3) 1.25 x 10-2
(4) 2.5 × 10-2
उत्तर:
(2) 3·125 x 10-2
29. सल्फर का एक परमाणु कार्बन के एक परमाणु से कितने गुना भारी होता है?
(1) 32 गुना
(2) 12 गुना
(3) \(\frac { 8 }{ 3 }\) गुना
(4) \(\frac { 12 }{ 32 }\) 32 गुना।
उत्तर:
(3) \(\frac { 8 }{ 3 }\) गुना
30. निम्नलिखित के द्रव्यमानों का सही अवरोही क्रम क्या है?
(i) ऑक्सीजन के 6.022 x 1023 परमाणु
(ii) H2S के 1.0 × 1023 अणु
(iii) ऑक्सीजन के 6.022 x 1023 अणु
(1) (i) > (ii) > (iii)
(2) (i) > (iii) > (ii)
(3) (iii) > (i) > (ii)
(4) (ii) > (i) > (iii)
उत्तर:
(3) (iii) > (i) > (ii)
31. 294.406, 280.208 एवं 24 के योग का सही लिखा गया उत्तर होगा-
(1) 598.61
(2) 599
(3) 598.6
(4) 598.614
उत्तर:
(2) 599
32. मोललता की इकाई है-
(1) मोल्स
(2) मोल्स/ किग्रा.
(3) मोल्स / लीटर
(4) ग्राम/लीटर।
उत्तर:
(2) मोल्स/ किग्रा.
33. मोल अंश की इकाई है-
(1) मोल्स
(2) मोल्स / किग्रा.
(3) ईकाई नहीं होती
(4) मोल्स / लीटर।
उत्तर:
(3) ईकाई नहीं होती
34. यदि NA आवागाद्रो संख्या है, तो 4.2 g नाइट्राइड आयन (N3-) में संयोजक इलेक्ट्रॉनों की संख्या है-
(1) 4.2 NA
(2) 2.4 NA
(3) 1.6 NA
(4) 3.2 NA
उत्तर:
(2) 2.4 NA
35. एक विद्यार्थी की लम्बाई 64.25 इंच है, इसकी लम्बाई फीट में होगी-
(1) 5.345 फीट
(2) 5 फीट
(3) 5.3 फीट
(4) 5.34 फीट।
उत्तर:
(1) 5.345 फीट
36. समस्थानिक होते हैं-
(1) न्यूट्रॉनों की संख्या में भिन्न
(2) प्रोटॉनों की संख्या में भिन्न
(3) उपर्युक्त दोनों
(4) उपर्युक्त में से कोई नहीं।
उत्तर:
(3) उपर्युक्त दोनों
37. एक परमाण्वीय द्रव्यमान इकाई (amu) का मान है-
(1) 166 × 10-24 ग्राम
(2) 1.66 × 10-27 ग्राम
(3) 1.008 ग्राम
(4) इनमें से कोई नहीं।
उत्तर:
(3) 1.008 ग्राम
38. कैल्सियम का परमाणु भार 40 है। यदि इसकी संयोजकता दो हो तो कैल्सियम का तुल्यांक भार होगा
(1) 20
(2) 40
(3) 10
(4) 80
उत्तर:
(1) 20
39. किसमें सबसे अधिक परमाणु हैं ?
(1) 24 g C – 12
(2) 56g Fe – 56
(3) 27 g Al – 23
(4) 108 g Ag – 108.
उत्तर:
(1) 24 g C – 12
40. CO के 6.022 x 1024 अणुओं में ऑक्सीजन के ग्राम अणुओं की संख्या है-
(1) 10 ग्राम मोल्स
(2) 5 ग्राम मोल्स
(3) 1 ग्राम मोल
(4) 0.5 ग्राम मोल
उत्तर:
(2) 5 ग्राम मोल्स
![]()
41. अभिव्यक्ति के किस ढंग में विलयन की संघनन क्षमता इसके तापमान से स्वतन्त्र होती है-
(1) मोलरता
(2) नॉर्मलता
(3) फॉर्मलता
(4) मोललता।
उत्तर:
(4) मोललता।
42. एक मोलल विलयन वह होता है जिसमें विलेय का एक मोल होता है –
(1) 1000 g विलायक में
(2) एक लीटर विलायक में
(3) एक लीटर विलयन में
(4) 22-4 लीटर विलयन में।
उत्तर:
(1) 1000 g विलायक में
43. 0.635 ग्राम कॉपर में उपस्थित परमाणुओं की संख्या होगी-
(1) 6·023 x 10-23
(2) 6·023 × 1023
(3) 6.023 x 1022
(4) 6·023 × 1021.
उत्तर:
(4) 6·023 × 1021.
44. यौगिक C66H122 के एक अणु का भार है—
(1) 1.4 × 10-21 ग्राम
(2) 1.09 × 1023 ग्राम
(3) 5.025 x 1023 ग्राम
(4) 16.023 x 1023 ग्राम।
उत्तर:
(1) 1.4 × 10-21 ग्राम
45. CO के 14 g के लिये असत्य कथन है-
(1) यह N.T.P. पर 2.24 लीटर घेरता है
(2) यह CO के \(\frac { 1 }{ 2 }\) मोल के लगभग है
(3) यह CO और N2 के समान मोलों के लगभग है
(4) यह CO के 3.01 × 1023 अणुओं के लगभग है।
उत्तर:
(1) यह N.T.P. पर 2.24 लीटर घेरता है
अति लघु उत्तरीय प्रश्न
प्रश्न 1.
रसायन के दो लाभ बताइए।
उत्तर:
- खाद्य पदार्थों की पैदावार बढ़ाने में।
- चिकित्सा क्षेत्र में।
प्रश्न 2.
रसायन का विनाशकारी रूप क्या है?
उत्तर:
परमाणु बम, हाइड्रोजन बम, विषैली गैसें जैसे मस्टर्ड गैस, टी. एन. टी. आदि रसायन के विनाशकारी रूप हैं।
प्रश्न 3.
रसायन विज्ञान के सिद्धान्तों का व्यावहारिक उपयोग किन-किन क्षेत्रों में होता है?
उत्तर:
रसायन विज्ञान के सिद्धान्तों का व्यावहारिक उपयोग मौसम विज्ञान, नाड़ी तन्त्र और कम्प्यूटर प्रचालन में होता है।
प्रश्न 4.
द्रव्य क्या है?
उत्तर:
द्रव्य वह वस्तु है जिसमें आयतन और द्रव्यमान होता है।
प्रश्न 5.
द्रव्य के सूक्ष्म कण को क्या कहते हैं?
उत्तर:
द्रव्य के सूक्ष्म कण को परमाणु कहते हैं।
प्रश्न 6.
द्रव्य भौतिक रूप में कितनी अवस्थाओं में पाया जाता है?
उत्तर:
द्रव्य भौतिक रूप में ठोस, द्रव तथा गैस तीन अवस्थाओं में पाया जाता है।
प्रश्न 7.
द्रव्य को विभिन्न अवस्थाओं में परिवर्तित किया जा सकता है या नहीं?
उत्तर:
ताप और दाब की परिस्थितियों के परिवर्तन द्वारा द्रव्य की इन तीनों अवस्थाओं को एक-दूसरे में परिवर्तित किया जा सकता है।
प्रश्न 8.
ऐसे द्रव्य का नाम बताइए जो द्रव्य की तीनों अवस्थाओं में पाया जाता है?
उत्तर:
जल।
प्रश्न 9.
मिश्रण क्या है?
उत्तर:
किसी मिश्रण में दो या दो से अधिक घटकों का अनुपात अनिश्चित होता है।
प्रश्न 10.
यौगिक किसे कहते हैं?
उत्तर:
यौगिक एक शुद्ध समांगी पदार्थ है जो दो या दो से अधिक तत्वों के निश्चित अनुपात में संयोग करने पर प्राप्त होता है।
प्रश्न 11.
निम्नलिखित को शुद्ध पदार्थ और मिश्रण के रूप में वर्गीकृत कीजिये।
(i) ग्रेफाइट, (ii) दूध, (iii) गैसोलीन, (iv) ऑक्सीजन, (v) आसुत जल, (vi) पीतल, (vii) सोडियम क्लोराइड, (viii) लोहा, (ix) इस्पात, (x) शर्बत, (xi) 24 कैरेट गोल्ड, (xii) ग्लूकोज, (xiii) 22 कैरेट गोल्ड, (xiv) शहद, (xv) बुझा हुआ चूना।
उत्तर:
शुद्ध पदार्थ – ग्रेफाइट, ऑक्सीजन, आसुत जल, सोडियम क्लोराइड, लोहा, 24 कैरेट गोल्ड, ग्लूकोज, बुझा हुआ चूना।
मिश्रण – दूध, गैसोलीन, पीतल, इस्पात, शर्बत, 22 कैरेट गोल्ड, शहद।
प्रश्न 12.
निम्नलिखित को तत्व, यौगिक और मिश्रण में वर्गीकृत कीजिये-
(1) गन्धक का तेजाब, (2) कोल्ड ड्रिंक, (3) चीनी, (4) संगमरमर, (5) टिन, (6) लैड, (7) आयोडीन युक्त खाद्य लवण, (8) नल का पानी, (9) हीरा, (10) दूध, (11) सीमेन्ट, (12) सिलिका, (13) प्लास्टर ऑफ पेरिस, (14) निकिल।
उत्तर:
तत्व – टिन, लैड, हीरा, निकिल।
यौगिक-गंधक का तेजाब, चीनी, संगमरमर, सिलिका, प्लॉस्टर ऑफ पेरिस ।
मिश्रण – कोल्डड्रिंक, आयोडीन युक्त खाद्य लवण, नल का पानी, दूध, सीमेंट।
प्रश्न 13.
विज्ञान की किस शाखा के अन्तर्गत पदार्थ के अणुओं तथा परमाणुओं से सम्बन्धित ज्ञान प्राप्त किया जाता है?
उत्तर:
रसायन विज्ञान के अन्तर्गत पदार्थ के अणुओं तथा परमाणुओं से सम्बन्धित अध्ययन किया जाता है। नहीं ।
प्रश्न 14.
किस द्रव्य का अवस्था आयतन निश्चित होता है, आकार
उत्तर:
द्रव का आयतन निश्चित होता है, आकार नहीं।
प्रश्न 15.
जल में नमक का मिश्रण विलयन क्यों है, जबकि तेल और जल का मिश्रण विलयन नहीं है?
उत्तर:
जल में नमक का मिश्रण विलयन है क्योंकि नमक व जल दोनों आपस मे मिलकर एक समांगी मिश्रण बनाते हैं अतः ये विलयन का निर्माण करते हैं। जबकि जल और तेल आपस में मिलकर असमांगी मिश्रण बनाते हैं अतः ये विलयन नहीं है।
प्रश्न 16.
वायु को कभी-कभी विषमांगी मिश्रण क्यों माना जाता है?
उत्तर:
वायु को कभी-कभी विषमांगी मिश्रण माना जाता है, जब उसमें धूल के कण उपस्थित हों।
प्रश्न 17.
निम्न को धातुओं एवं अधातुओं में वर्गीकृत कीजिए-
(i) आर्गन, (ii) पोटैशियम, (III) हीलियम, (iv) पारा, (v) हीरा, (vi) सिलिकन, (vii) सीसा (Hg), (viii) मैग्नीशियम (Mg)
उत्तर:
धातुएँ पौटेशियम, पारा, सीसा (Hg), मैग्नीशियम (Mg)।
अधातुएँ-आर्गन, हीलियम, हीरा, सिलिकन।
प्रश्न 18.
किसी एक पर्यावरण प्रदूषक का नाम लिखें।
उत्तर:
क्लोरो फ्लुओरोकार्बन (फ्रिऑन)।
प्रश्न 19.
किस द्रव्य अवस्था का आयतन तथा आकार दोनों ही अनिश्चित होते हैं।
उत्तर:
गैस का आयतन तथा आकार दोनों ही अनिश्चित होते हैं।
![]()
प्रश्न 20.
किस द्रव्य अवस्था का आयतन व आकार दोनों ही निश्चित होते हैं?
उत्तर:
ठोस का आयतन तथा आकार दोनों ही निश्चित होते हैं।
प्रश्न 21.
द्रव्य की किस अवस्था में अन्तरा अणुक अवकाश सबसे अधिक व किस अवस्था में सबसे कम होता है।
उत्तर:
द्रव्य की गैस अवस्था में अन्तरा अणुक अवकाश सबसे अधिक व ठोस अवस्था में अन्तरा अणुक अवकाश सबसे कम होता है।
प्रश्न 22.
अणु एक-दूसरे को किस विशेष आकर्षण बल द्वारा आकर्षित करते हैं?
उत्तर:
अणु एक-दूसरे को अन्तरा अणुक आकर्षण बल द्वारा आकर्षित करते हैं।
प्रश्न 23.
जल की गैसीय अवस्था वाष्प कहलाती है जबकि अमोनिया की गैसीय अवस्था गैस क्यों?
उत्तर:
उन पदार्थों की गैसीय अवस्था वाष्प कहलाती है जो कि कमरे के ताप पर द्रव होते हैं। चूँकि जल कमरे के ताप पर द्रव होता है अतः इसकी गैसीय अवस्था वाष्य कहलाती है परन्तु अमोनिया कमरे के ताप पर द्रव नहीं होती अतः इसकी गैसीय अवस्था गैस कहलाती है।
प्रश्न 24.
निम्न में से समांगी व असमांगी मिश्रण छॉटिये धुआँ, बादल, काष्ठ, नल का पानी
उत्तर:
समांगी मिश्रण धुआँ, बादल, काष्ठ। असमांगी मिश्रण नल का पानी।
प्रश्न 25.
लोहे का बुरादा एवं गन्धक का चूर्ण किस प्रकार का मिश्रण है।
उत्तर:
लोहे का बुरादा एवं गंधक का चूर्ण एक विषमांगी मिश्रण है।
प्रश्न 26.
मूल मात्रकों को व्यक्त करने के लिए कौन-सी पद्धति पूरे संसार में अपनाई जा रही है?
उत्तर:
मूल मात्रकों को व्यक्त करने के लिए पूरे संसार में अन्तर्राष्ट्रीय पद्धति (S. I.) अपनाई जा रही है।
प्रश्न 27.
मात्रकों की अन्तर्राष्ट्रीय पद्धति क्या है?
उत्तर:
मात्रकों की अन्तर्राष्ट्रीय पद्धति (फ्रांसीसी में Le system international d’ units) S. I. (एस. आई.) कहा जाता है को सन् 1960 में भार और माप के ग्यारहवें सर्व सम्मेलन (Conference Generale des Poios at Measures. CGPM) में स्वीकृत किया गया था।
प्रश्न 28.
कौन-सा संस्थान भारतीय राष्ट्रीय मापन के मानकों का अनुरक्षण करता है?
उत्तर:
भारत में मापन के मानकों के अनुरक्षण का कार्य राष्ट्रीय भौतिकी प्रयोगशाला, नई दिल्ली द्वारा किया जाता है।
प्रश्न 29.
अन्तर्राष्ट्रीय प्रणाली में कितने मूल मात्रक हैं?
उत्तर:
अन्तर्राष्ट्रीय प्रणाली में सात मूल मात्रक हैं।
प्रश्न 30.
ताप का ऋणात्मक मान किस पैमाने पर सम्भव होता है तथा किस पर नहीं?
उत्तर:
0°C से कम ताप (अर्थात् ऋणात्मक मान) सेल्सियस पैमाने पर तो सम्भव है परन्तु केल्विन पैमाने पर ताप का ऋणात्मक मान सम्भव नहीं है।
प्रश्न 31.
मानक किलोग्राम को परिभाषित करने के लिए पेरिस (फ्रान्स) के सैवरेस में सन्दर्भ सिलिण्डर प्लेटिनम- इरीडियम का ही क्यों है?
उत्तर:
प्लेटिनम- इरीडियम रासायनिक अभिक्रिया के प्रति निष्क्रिय है।
प्रश्न 32.
लम्बाई का मात्रक क्या है?
उत्तर:
लम्बाई का SI मात्रक मीटर है।
प्रश्न 33.
एक माइकॉन में कितने मीटर होते हैं?
उत्तर:
10-6 मीटर।
प्रश्न 34.
एक मीटर में कितने एंग्स्ट्रॉम होते हैं?
उत्तर:
1010 एंग्स्ट्रॉम
प्रश्न 35.
एक सौर दिन में कितने सेकण्ड होते हैं?
उत्तर:
86400 सेकण्ड
प्रश्न 36.
प्रकाश वर्ष किस राशि का मात्रक है?
उत्तर:
दूरी का मात्रक है।
प्रश्न 37.
ऊर्जा का SI मात्रक क्या है?
उत्तर:
जल।
प्रश्न 38.
घनत्व का S. I मात्रक क्या है?
उत्तर:
kg/m³।
प्रश्न 39.
निम्न मात्रक कौन-सी भौतिक राशि दर्शाते हैं?
(i) kg m²s-2
(ii) kg m2-2
उत्तर:
(i) बल
(ii) कार्य।
प्रश्न 40.
आधार मात्रक व परिशुद्ध मात्रक में अन्तर बताइए।
उत्तर:
आधार मात्रक वे मात्रक हैं जो दूसरी भौतिक राशियों से प्राप्त होते हैं। परिशुद्ध मात्रक आधार मात्रकों से प्राप्त होते हैं।
प्रश्न 41.
मूल राशियाँ क्या हैं?
उत्तर:
वे भौतिक राशियाँ जो एक-दूसरे से स्वतन्त्र होती है। मूल राशियाँ कहलाती हैं ये राशियाँ अन्य राशियों पर निर्भर नहीं करती हैं।
प्रश्न 42.
व्युत्पन्न मात्रक क्या हैं?
उत्तर:
वे मात्रक जो मूल मात्रकों की सहायता से प्राप्त किये जाते हैं, व्युत्पन्न मात्रक कहलाते हैं।
प्रश्न 43.
जूल, मीटर किलोग्राम, किलोग्राम / मीटर सेकण्ड तथा ऐम्पियर में कौन-कौन मूल मात्रक हैं?
उत्तर:
मूल मात्रक किलोग्राम, सेकण्ड एम्पियर।
व्युत्पन्न मात्रक – जूल, किलोग्राम / मीटर।
प्रश्न 44.
माइकॉन से क्या समझते हो?
उत्तर:
इसे μ(म्यू) से प्रदर्शित करते हैं। इसके द्वारा अति सूक्ष्म जीवाणुओं के आकार को व्यक्त करते हैं।
1 माइक्रॉन = 106 मीटर
प्रश्न 45.
एंग्स्ट्रॉम (Å) क्या है?
उत्तर:
इसके द्वारा नाभिक का आकार तथा प्रकाश की तरंगदैर्ध्य मापी जाती है। इसे Å से प्रदर्शित करते हैं
1 एंग्स्ट्रॉम (Å) = 10-4
माइक्रॉन = 10-10 मीटर
प्रश्न 46.
एक परमाणु की त्रिज्या 10-10 m है। इसका माइक्रोमीटर में मान बताइये?
उत्तर:
10-10 m = \(\frac{10^{-10}}{10^{-6}}\) = 10-4 माइक्रोमीटर
चूँकि 1 माइक्रोमीटर = 10-6 मी.
प्रश्न 47.
वेनेडियम धातु लोहे के साथ मिलकर मिश्रधातु बनाती है। वेनेडियम का घनत्व 5.96g/cm³ है इसका SI मात्रक क्या होगा?
उत्तर:
S. I. मात्रक MKS पद्धति अर्थात् मी. किग्रा. सेकण्ड पद्धति, अतः वैनेडियम का घनत्व 5.96 kg/m³
प्रश्न 48.
40 कैलोरी को जूल में परिवर्तित कीजिए।
उत्तर:
1 कैलोरी = 4.2 जूल
अतः 40 कैलोरी = 4.2 x 40 जूल = 168.0 जूल
प्रश्न 49.
निम्न भौतिक राशियों की SI मात्रक लिखें।
(i) क्षेत्रफल, (ii) घनत्व, (iii) वेग, (iv) त्वरण (v) दाब,
(vi) सान्द्रता (vii) आवृत्ति, (viii) विद्युत आवेश, (ix) ऊर्जा (x) बल।
उत्तर:
| भौतिक राशियाँ | S. I मात्रक |
| (i) क्षेत्रफल | वर्ग मीटर (m²) |
| (ii) घनत्व | किग्रा. प्रति घनमीटर (kg/m²) |
| (iii) वेग | मीटर प्रति सेकण्ड (m/s) |
| (iv) त्वरण | मीटर प्रति सेकण्ड² (m/s²) |
| (v) दाब | पास्कल या न्यूटन / मी.² (N/m²) |
| (vi) सान्द्रता | मोल / मी.³ (mol/m³) |
| (vii) आवृत्ति | हर्ट्ज (Hz या s-1) |
| (viii) विद्युत आवेश | कूलॉम या एम्पियर सेकण्ड (As) |
| (ix) ऊर्जा | जूल (kgm² s-2) |
| (x) बल | न्यूटन (kgm/s²) |
प्रश्न 50.
एक मील में कितने किलोमीटर व कितने मीटर होते हैं?
उत्तर:
एक मील में 1.6 किलोमीटर एवं 1609.3 मीटर होते हैं।
प्रश्न 51.
एक इंच में कितने मीटर होते हैं?
उत्तर:
एक इंच में 2.54 x 10-2 मीटर होते हैं।
प्रश्न 52.
एक अर्ग में कितने जूल होते हैं?
उत्तर:
एक अर्ग में 10-7 जुल होते हैं।
प्रश्न 53.
निम्न को मीटर में परिवर्तित करें
(1) माइक्रोमीटर (2) गीगा मीटर, (3) पिको मीटर, (4) सेन्टीमीटर।
उत्तर:
(1) एक माइक्रोमीटर = 10-6 मीटर
(2) एक गीगा मीटर = 109 मीटर
(3) एक पिको मीटर = 10-12 मीटर
(4) एक सेन्टी मीटर = 10-2 मीटर
प्रश्न 54.
2 फीट 2 इंच को S.I. इकाई में व्यक्त कीजिए।
उत्तर:
1 फीट 12 इंच
2 फीट 2 इंच 26 इंच
1 इंच = 2.54 x 10-2 मी.
26 इंच = 2.54 × 10-2 × 26
= 66.04 × 10-2 मी.
प्रश्न 55.
0.000213 सेमी. को वैज्ञानिक पद्धति में लिखें।
उत्तर:
2.13 x 10-4 सेमी. अथवा 2.13 x 10-6 मीटर।
प्रश्न 56.
20°C को फारेनहाइट में परिवर्तित कीजिए।
उत्तर
°F = \(\frac { 9 }{ 5 }\) (°C) + 32
°F = \(\frac { 9 }{ 5 }\) × 20 + 32
= 36 + 32 – 68
अत: 20°C = 68°F
प्रश्न 57.
10°F को सेन्टीग्रेड में परिवर्तित कीजिए।
उत्तर:
°F = \(\frac { 9 }{ 5 }\) (°C) + 32
10 = \(\frac { 9 }{ 5 }\)(°C) + 32
10 – 32 = \(\frac { 9 }{ 5 }\)(°C)
– 22 = \(\frac { 9 }{ 5 }\)(°C) =
(°C) = – \(\frac { 22×5 }{ 9 }\) = – 12.22
10°F = – 12.22°C
प्रश्न 58.
किसी माप को लिखने की वैज्ञानिक विधि क्या है?
उत्तर:
किसी माप को 10 की घात में लिखने की विधि को वैज्ञानिक विधि कहते हैं।
प्रश्न 59.
मापन में सार्थक अंक से आप क्या समझते हैं?
उत्तर:
सार्थक अंक वे अर्थपूर्ण अंक होते हैं जो निश्चित रूप से ज्ञात होते हैं।
प्रश्न 60.
0.00018 को चर घातांकी संकेतन में लिखिए।
उत्तर:
1.8 × 104
प्रश्न 61.
परिशुद्धता और यथार्थपरकता से आप क्या समझते हैं?
उत्तर:
परिशुद्धता किसी राशि के विभिन्न मापनों व सामीप्य को व्यक्त करती है। यथार्थपरकता किसी विशिष्ट प्रायोगिक मान के वास्तविक मान से मेल रखने को व्यक्त करती है।
प्रश्न 62.
7.00g तथा 70g में क्या अन्तर है?
उत्तर:
700g में तीन सार्थक अंक हैं जबकि 70g में दो सार्थक अंक हैं। अतः प्रथम माप द्वितीय माप की तुलना में अधिक परिशुद्ध है।
प्रश्न 63.
इलेक्ट्रॉन के द्रव्यमान में सार्थक अंक बताइये।
उत्तर:
इलेक्ट्रॉन का द्रव्यमान = 9.108 × 10-31kg
सार्थक अंक = 4 (चार)
प्रश्न 64.
निम्नलिखित संख्याओं को चार सार्थक अंकों सहित लिखिए।
(i) 7.024572
(ii) 2.6206 x 10³
उत्तर:
(i) 7.025
(ii) 2.621 × 10³
प्रश्न 65.
निम्नलिखित गणनाओं के परिणाम उपयुक्त सार्थक अंकों में व्यक्त कीजिए।
(i) \(\frac{3.24 \times 0.8606}{5.006}\)
(ii) 943 × 0.00345
उत्तर:
(i) \(\frac{3.24 \times 0.8606}{5.006}\) में तीनों संख्याओं में सार्थक अंक तीन, चार और चार हैं। अतः उपर्युक्त सार्थक अंकों में परिणाम 0.557 है।
(ii) 9.43 × 0-00345 का मान उपर्युक्त सार्थक अंकों में 0.0325 है।
प्रश्न 66.
निम्नलिखित संख्याओं में सार्थक अंकों की संख्या बताइये?
(i) 46.8, (ii) 0.00203, (iii) 3.630, (iv) 80.00
उत्तर:
(i) 46.8 में सार्थक अंकों की संख्या 3 है।
(ii) 0.00203 में सार्थक अंकों की संख्या 3 है।
(iii) 3.630 में सार्थक अंकों की संख्या 4 है।
(iv) 80.00 में सार्थक अंकों की संख्या 4 है।
प्रश्न 67.
निम्नलिखित में कितने सार्थक अंक उपस्थित हैं?
(i) 6000.0, (ii) 126,00, (iii) 4003, (iv) 2091, (v) 0.020, (vi) 52-82, (vii) 200
उत्तर:
(i) 60000 में पाँच सार्थक अंक हैं।
(ii) 126,00 में पाँच सार्थक अंक हैं।
(iii) 4003 में चार सार्थक अंक हैं।
(iv) 2091 में चार सार्थक अंक हैं।
(v) 0.020 में दो सार्थक अंक हैं।
(vi) 52.82 में चार सार्थक अंक हैं।
(vii) 200 में एक, दो व तीन सार्थक अंक हैं।
प्रश्न 68.
निम्न को वैज्ञानिक निरूपण में व्यक्त कीजिए-
(i) 0.0012, (ii) 213,0000, (iii) 2002, (iv) 600.0, (v) 5000, (vi) 7216:3
उत्तर:
(i) 0.0012 = 1.2 x 10-3
(ii) 213,0000 = 2.13 × 106
(iii) 2002 = 2.002 x 10³
(iv) 600.0 = 6.00 x 10²
(v) 5000 = 5.0 × 10³
(vi) 7216.3 = 7.2163 × 10³
प्रश्न 69.
C-12 के एक परमाणु का भार ग्राम में क्या है?
उत्तर:
1.992648 × 10-23 g ≈ 1.99 × 10-23 g.
![]()
प्रश्न 70.
निम्न में से किस संख्या में सबसे अधिक सार्थक अंक हैं?
(i) 0.00423,
(ii) 4.8032,
(iii) 5.123
उत्तर:
उपर्युक्त संख्याओं में से 4-8032 में सर्वाधिक सार्थक अंक 5 हैं।
प्रश्न 71.
योग कीजिए-
(i) 92.8 + 2.02 + 10.222
(ii) 77.85 + 14.10 + 8.3
उत्तर:
(i) 92.8 + 2.02 + 10.222 = 105.042
= 105.0 (सार्थक अंक के नियमानुसार)
उत्तर:
105.0
(ii) 77.85 + 14.10 + 8.3 = 100.25
= 100.2 (सार्थक अंक के नियमानुसार)
उत्तर:
100.2
प्रश्न 72.
घटाव कीजिए-
(i) 5.16 – 0.015
(ii) 237.5 – 16.92
(iii) 0.08638 – 0.0604
उत्तर:
(i) 5.16 – 0015 = 5.145 = 5.14
(सार्थक अंक के नियमानुसार )
(ii) 237.5 – 16.92 = 220.58 = 220.6
(सार्थक अंक के नियमानुसार)
(iii) 0.08638 – 0.0604 = 0.02598 = 0.0260
(सार्थक अंक के नियमानुसार)
प्रश्न 73.
गुणा कीजिए –
(i) 210 x 120
(ii) 5.02 x 1023
(iii) 0.06204 x 296.4 x 1.002
उत्तर:
(i) 210 x 120 = 25200
= 2.52 x 104
(ii) 5.02 x 1023 = 5.02 x 1023
(iii) 0.06204 × 296.4 x 1.002 = 18.425433 = 18.4
प्रश्न 74.
निम्नलिखित को तीन सार्थक अंकों के रूप में व्यक्त कीजिए।
(i) 6.5089
(ii) 32.1912
(iii) 8.721 × 1024
(iv) 30000.
उत्तर:
(i) 6.5089 तीन सार्थक अंकों के रूप में 6.51
(ii) 32.1912 तीन सार्थक अंकों के रूप में 32.2
(iii) 8.721 x 104 तीन सार्थक अंकों के रूप में 8.72 × 104
(iv) 30000 तीन सार्थक अंकों के रूप में, 3.00 x 104
प्रश्न 75.
निम्नलिखित गणनाओं में कितने सार्थक अंक हैं?
(i) \(\frac{312.21 \times 0.0212 \times 0.01323}{0.3454}\)
(i) 5 × 2.138
(iii) 0.112 + 0.8932 + 0.0123
उत्तर:
(i) चूँकि इसमें न्यूनतम परिशुद्ध अंक (0.0212) में तीन सार्थक अंक है अतः उत्तर में तीन सार्थक अंक होने चाहिये।
(ii) दूसरे अंक (2-138) में चार सार्थक अंक हैं, अतः उत्तर में चार सार्थक अंक होने चाहिये
(iii) इस स्थिति में दशमलव स्थानों की न्यूनतम संख्या तीन है अतः उत्तर में तीन सार्थक अंक होने चाहिये।
प्रश्न 76.
किसी भी संख्या में किस स्थिति में शून्य को सार्थक नहीं माना जाता है।
उत्तर:
जब किसी संख्या में शून्य प्रथम गैर शून्य अंक के बाँयीं ओर लिखा हो तो वह सार्थक नहीं रहता है।
उदाहरण 0.014 में दोनों शून्य सार्थक नहीं हैं।
प्रश्न 77.
बताइये निम्न में से कौन-सा मापन अधिक यथार्थ है? 5.0g या 5.00g.
उत्तर:
5.0 g तथा 500g में से 500g अधिक यथार्थ है क्योंकि इसमें मापन दशमलव के बाद दो स्थानों तक किया जा सकता है।
प्रश्न 78.
चरघातांकी संकेतन या वैज्ञानिक संकेतन से क्या तात्पर्य है?
उत्तर:
जब किसी संख्या को N x 10n के रूप में व्यक्त किया जाता है, तो इस संकेतन को चरघातांकी संकेतन या वैज्ञानिक संकेतन कहते हैं। यहाँ N दशमलव के बार्थी तरफ एक गैर-शून्य अंक वाली संख्या है।
यहाँ n = पूर्णांक, जिसे घातांक (exponent) कहते हैं।
प्रश्न 79.
S. I मात्रक मीटर से क्या तात्पर्य है?
उत्तर:
मीटर (Metre) मीटर एक सेकण्ड के 1/299,792,458 वें समयान्तराल के दौरान निर्वात् में प्रकाश द्वारा तय किये गये पथ की लम्बाई होती है।
प्रश्न 80.
S. I मात्रक किलोग्राम को परिभाषित करें।
उत्तर:
किलोग्राम (Kilogram ) यह प्रारूपी ( Prototype) किलोग्राम के द्रव्यमान के बराबर होता है वास्तव में यह फ्रांस में भार और माप के अन्तर्राष्ट्रीय ब्यूरो में संग्रहित प्लेटिनम ब्लॉक का द्रव्यमान है।
प्रश्न 81.
तत्व द्रव्यमान के किस अनुपात में संयोग करते हैं
उत्तर:
स्थिर अनुपात के नियम के अनुसार।
प्रश्न 82.
द्रव्य की अविनाशिता का नियम किसने दिया था?
उत्तर:
यह नियम लोमोनोसोव ने 1756 ई. में दिया था।
प्रश्न 83.
amu से आप क्या समझते हैं?
उत्तर:
amu को परमाणु द्रव्यमान इकाई कहते हैं।
प्रश्न 84.
कार्बन का कौन सा समस्थानिक तत्व के सापेक्ष द्रव्यमान को व्यक्त करने में प्रयुक्त होता है?
उत्तर:
कार्बन-12(12C) समस्थानिक
प्रश्न 85.
तत्व के परमाणु द्रव्यमान अंशत: (Fractional) क्यों होते हैं?
उत्तर:
उनके समस्थानिकों की उपस्थिति के कारण।
प्रश्न 86.
मोल क्या है?
उत्तर:
किसी पदार्थ के मोल में उतने ही कण उपस्थित होते हैं जितनी कार्बन 12 समस्थानिक के 12g में परमाणुओं की संख्या होती है।
प्रश्न 87.
किसी तत्व के एक ग्राम परमाणु में कितने परमाणु होते हैं?
उत्तर:
6.023 x 1023 के तुल्य परमाणु।
प्रश्न 88.
परमाणु द्रव्यमान इकाई को समझाइए।
उत्तर:
कार्बन 12 के एक परमाणु का द्रव्यमान स्वेच्छा से 12 amu माना गया है। इसलिए- कार्बन 12 के एक परमाणु के द्रव्यमान के बारहवें भाग को परमाणु द्रव्यमान इकाई कहते हैं।
अतः 1 amu = \(\frac{1.9926 \times 10^{-23}}{12}\)
= 166 × 1024 g
1.9926 × 10-23, C-12 के एक परमाणु का वास्तविक द्रव्यमान।
प्रश्न 89.
औसत परमाणु द्रव्यमान से आप क्या समझते हैं?
उत्तर:
प्रकृति में तत्वों के समस्थानिक पाये जाते हैं। अतः तत्व के समस्थानिक परमाणु द्रव्यमानों के परिकलन में उनकी आपेक्षिक बाहुल्यता पर भी विचार किया जाता है। इस प्रकार परिकलित किया गया परमाणु द्रव्यमान औसत परमाणु द्रव्यमान कहलाता है।
प्रश्न 90.
आण्विक द्रव्यमान क्या है?
उत्तर:
किसी पदार्थ का आण्विक द्रव्यमान वह संख्या है जो यह प्रदर्शित करती है कि इस पदार्थ का एक अणु कार्बन 12 के एक परमाणु के 1/12 वें भाग से कितने गुना भारी है।
प्रश्न 91.
मोल संकल्पना क्या है?
उत्तर:
किसी पदार्थ का एक मोल उसकी वह मात्रा है जिसमें उतने ही कण उपस्थित रहते हैं जितनी C-12 समस्थानिक के ठीक 12g में परमाणुओं की संख्या होती है यह संख्या 6.023 x 1023 परमाणु / मोल होती है।
एक मोल में कर्णों की इस संख्या को आवोगाद्रो संख्या कहते हैं। इसे NA या N व्यक्त करते हैं।
प्रश्न 92.
मोलर द्रव्यमान क्या है?
उत्तर:
किसी पदार्थ के एक मोल में व्यक्त द्रव्यमान को मोलर द्रव्यमान कहते हैं। उदाहरणार्थ-
जल का मोलर द्रव्यमान = 18.02 g
प्रश्न 93.
हाइड्रोजन का आण्विक द्रव्यमान ज्ञात करो यदि उसकी परमाणुकता 2 हो?
उत्तर:
आण्विक द्रव्यमान परमाणु द्रव्यमान परमाणुकता = 1.008 x 2 = 2.016 u
∴ हाइड्रोजन का आण्विक द्रव्यमान 2.016 u होगा।
![]()
प्रश्न 94.
मैग्नीशियम के 2.5 ग्राम परमाणुओं का द्रव्यमान बताइये।
उत्तर:
मैग्नीशियम का ग्राम परमाणु 24 g
मैग्नीशियम का 2.5 ग्राम परमाणु 24 x 2.5 = 60 g
प्रश्न 95.
48u ओजोन में कितने ऑक्सीजन परमाणु उपस्थिति होते हैं?
उत्तर:
48u ओजोन (O3) में ऑक्सीजन के \(\frac { 48u }{ 16u }\) = 3 परमाणु होते हैं।
प्रश्न 96.
उन तीन तत्वों के नाम लिखिये जो कि मनुष्य के शरीर का 90% भाग बनाते हैं?
उत्तर:
कार्बन, हाइड्रोजन और ऑक्सीजन।
प्रश्न 97.
हाइड्रोजन गैस आसानी से आग पकड़ लेती है और ऑक्सीजन दहन में सहायक होती है। परन्तु जल आग बुझाने के लिये क्यों प्रयुक्त किया जाता है?
उत्तर:
चूँकि जल (H2O) एक यौगिक है, इस यौगिक के गुण हाइड्रोजन और ऑक्सीजन दोनों के गुणों से भिन्न होते हैं। अतः जल को आग बुझाने के लिये प्रयुक्त करते हैं।
प्रश्न 98.
आवागाद्रो संकल्पना क्या है?
उत्तर:
दाब व ताप की समान परिस्थितियों में दो गैसों के समान आयतनों में अणुओं की संख्या समान होती है।
प्रश्न 99.
बताइये कि निम्नलिखित नियमों का प्रतिपादन किसने किया-
(1) स्थिर अनुपात का नियम
(2) द्रव्यमान संरक्षण का नियम
(3) गुणित अनुपात का नियम
(4) व्युत्क्रम अनुपात का नियम
(5) गैसीय आयतन का नियम
उत्तर:
(1) प्राउस्ट, (2) लेवोशिए, (3) जॉन डाल्टन (4) रिक्टर (5) गैलुसाक।
प्रश्न 100.
गैलुसाक के आयतन के नियम का पालन कब नहीं होता?
उत्तर:
जब अभिकारकों अथवा उत्पादों में से कोई ठोस अथवा द्रव्य हो।
प्रश्न 101.
स्थिर अनुपात के नियम का पालन किन अवस्थाओं में नहीं होता है?
उत्तर:
वे यौगिक जिनमें समस्थानिक उपस्थित होते हैं जैसे H2O और D2O। इन यौगिकों में स्थिर अनुपात के नियम का पालन नहीं होता है।
प्रश्न 102.
परमाणु स्वतन्त्र अवस्था में नहीं रह सकता है, क्यों?
उत्तर:
अपना इलेक्ट्रॉनिक विन्यास पूर्ण करने के लिये परमाणु आपस में संयोग करके अणु बनाते इसलिये परमाणु स्वतन्त्र अवस्था में नहीं रह सकता है।
प्रश्न 103.
संख्या 3.82 में से 0.0016 को घटाइये तथा उत्तर सार्थक अंकों में दीजिए।
उत्तर:
| 3.82 |
| – 0.016 |
| 3.8184 उत्तर = 3.82 |
प्रश्न 104.
यदि किसी जल के नमूने का भार 10 g है तो उसमें जल के कितने मोल उपस्थित हैं?
उत्तर:
जल का अणुभार = 2 + 16 = 18
जल में उपस्थित मोल = \(\frac { भार }{ अणुभार }\) = \(\frac { 10 }{ 18 }\) = 0.55 मोल
प्रश्न 105.
0.2 मोल CO2 में कितने ग्राम CO2 उपस्थित हैं?
उत्तर:
1 मोल CO2 = 12 + 32 = 44 g
0.1 मोल CO2 = 0.1 x 44 = 4.4 g
प्रश्न 106.
नाइट्रोजन गैस का आण्विक द्रव्यमान ज्ञात कीजिए।
उत्तर:
नाइट्रोजन गैस का परमाणु द्रव्यमान 14 g/mol
अतः नाइट्रोजन गैस का द्रव्यमान 14 x 2
= 28 g/mol
प्रश्न 107.
S8 का आण्विक द्रव्यमान ज्ञात कीजिए?
उत्तर:
सल्फर का परमाण्विक द्रव्यमान = 32 g/mol
अतः S8 का आण्विक द्रव्यमान 32 × 8
= 256 g/mol
प्रश्न 108.
0.1 मोल CO में कितने ग्राम CO2 उपस्थित है?
उत्तर:
1 मोल CO2 = 12 + 2 × 16 = 44 g
0.1 मोल CO2 = 0.1 x 44 = 4.4 g
प्रश्न 109.
4 ग्राम ऑक्सीजन में परमाणुओं की संख्या ज्ञात कीजिए।
उत्तर:
परमाणुओं की संख्या

प्रश्न 110.
1 अणु कार्बन मोनो ऑक्साइड (CO) के द्रव्यमान की गणना करें।
उत्तर:
CO का मोलर द्रव्यमान 12 + 16 = 28 g
6.02 x 1023 अणुओं का द्रव्यमान = 28 g
1 अणु CO का द्रव्यमान = \(\frac{28}{5.02 \times 10^{23}}\)
= 4.65 × 10-23 g
लघु उत्तरीय प्रश्न
प्रश्न 1.
राष्ट्रीय अर्थव्यवस्था में, रसायन विज्ञान का महत्वपूर्ण योगदान किस प्रकार है?
उत्तर:
रसायन विज्ञान का राष्ट्रीय अर्थव्यवस्था में महत्त्वपूर्ण योगदान उर्वरकों, क्षारों, अम्लों, लवण, रंग, बहुलकों, दवाओं, साबुन, अपमार्जकों, धातुओं, मिश्र धातुओं तथा कार्बनिक, अकार्बनिक रसायनों सहित नवीन सामग्री के निर्माण में लगे रासायनिक उद्योग द्वारा है।
प्रश्न 2.
कैन्सर चिकित्सा तथा एड्स के उपचार हेतु प्रयोग में लायी जाने वाली औषधियाँ बताइए।
उत्तर:
- कैन्सर चिकित्सा में सिस प्लैटिन तथा टैक्सॉल औषधियां प्रयुक्त होती हैं।
- एड्स से ग्रस्त रोगियों के उपचार हेतु ऐजिडोथाइमिडिन (AZT) जीवन रक्षक औषधि प्रयुक्त की जाती है।
प्रश्न 3.
रासायनिक सिद्धान्तों के आधार पर किन-किन पदार्थों का संश्लेषण सम्भव हो सका?
उत्तर:
रासायनिक सिद्धान्तों के आधार पर चुम्बकीय, विद्युतीय और प्रकाशीय गुणधर्म युक्त पदार्थ संश्लेषित करना सम्भव हो सका है जिसके फलस्वरूप अतिचालक, सिरेमिक, सुचालक, बहुलक, प्रकाशीय फाइबर (तन्तु) जैसे पदार्थ संश्लेषित किये जा सकते हैं।
प्रश्न 4.
रसायन विज्ञान द्वारा पर्यावरणीय प्रदूषण की समस्याओं को कैसे नियन्त्रित किया गया?
उत्तर:
समताप मण्डल (stratosphere) में ओजोन अवक्षय (Ozone depletion) उत्पन्न करने वाले एवं पर्यावरण प्रदूषक क्लोरोफ्लोरो कार्बन (CFC) जैसे पदार्थों के विकल्प सफलतापूर्वक संश्लेषित किये गये हैं।
प्रश्न 5.
रसायन विदों की भावी पीढ़ियों के लिए कौन-कौन सी बौद्धिक चुनौतियाँ हैं?
उत्तर:
- पर्यावरण की अनेक समस्याएँ,
- ग्रीन हाउस गैसों (मेथेन, कार्बन डाइ ऑक्साइड),
- जैव रासायनिक प्रक्रियाओं की समझ,
- रसायनों का व्यापक स्तर पर उत्पादन,
- विभिन्न ऐन्जाइमों का उपयोग,
- नवीन उपयोगी पदार्थों का उत्पादन।
प्रश्न 6.
तत्व के सापेक्ष परमाणु द्रव्यमान को परिभाषित कीजिए।
उत्तर:
किसी तत्व का परमाणु द्रव्यमान वह संख्या है जो यह प्रदर्शित करती है कि तत्व का एक परमाणु कार्बन- 12 के परमाणु के बारहवें भाग द्रव्यमान अथवा हाइड्रोजन के 1.008 भाग द्रव्यमान से कितने गुना भारी है। किसी भी तत्व का परमाणु द्रव्यमान इसके परमाणु का औसत सापेक्ष द्रव्यमान होता है, जबकि उसकी तुलना कार्बन परमाणु (C12 समस्थानिक) का भार 12 मानकर की जाती है।
प्रश्न 7.
यौगिक के सूत्र से क्या तात्पर्य है?
उत्तर:
किसी यौगिक के अणु का इसमें उपस्थित विभिन्न तत्वों के प्रतीकों के रूप में संक्षिप्त प्रदर्शन यौगिक का सूत्र कहलाता है। इन्हें दो रूपों में वर्गीकृत किया जाता है।
- मूलानुपाती सूत्र – यौगिक का वह सूत्र जो यौगिक के एक अणु में उपस्थित भिन्न-भिन्न तत्वों के परमाणुओं का सरलतम अनुपात बताता है।
- आण्विक सूत्र – यौगिक का वह सूत्र जो उस यौगिक में उपस्थित भिन्न-भिन्न तत्वों के परमाणुओं का वास्तविक अनुपात प्रदर्शित करता है।
प्रश्न 8.
मूलानुपाती सूत्र व आण्विक सूत्र में सम्बन्ध बताएँ?
उत्तर:
आण्विक सूत्र =nx मूलानुपाती सूत्र
(यहाँ n = 1, 2, 3, 4 ……..)
मूलानुपाती व आण्विक सूत्रों में से आण्विक सूत्र यौगिक के वास्तविक सूत्र को व्यक्त करता है।
प्रश्न 9.
मोलरता एवं मोललता में अन्तर बताइए।
उत्तर:
| मोलरता | मोललता |
| 1. यह 1 लीटर विलयन में घुले हुए हुए विलेय के मोलों की संख्या है। | 1. यह 1 किग्रा. विलायक में घुले हुए विलेय के मोलों की संख्या है। |
| 2. यह ताप पर निर्भर करती है। | 2. यह ताप पर निभर्भर नहीं होती है। |
| 3. इसका मात्रक mol L-1 है। | 3. इसका मात्रक mol L-1 है। |
प्रश्न 10.
रूपान्तरण गुणक या विमीय विश्लेषण विधि से क्या तात्पर्य है?
उत्तर:
रूपान्तरण गुणक या विमीय विश्लेषण विधि – गणनाओं के लिये जो आँकड़े दिये जाते हैं, यह आवश्यक नहीं है कि वे सभी मात्रकों की एक ही पद्धति में हों। अत: कभी-कभी मात्रकों को एक पद्धति से दूसरी पद्धति में परिवर्तित करना पड़ता है। इस परिवर्तन के लिये जिस तकनीक का प्रयोग किया जाता है उसे विमीय विश्लेषण अथवा इकाई गुणक विधि या गुणक लेवल विधि या रूपान्तरण गुणक विधि कहते हैं।
प्रश्न 11.
एक व्यक्ति प्रति सेकण्ड दस लाख रुपये खर्च करता है। क्या वह अपने जीवन में 1 मोल खर्च कर सकता है।
उत्तर:
दस लाख रुपये खर्च करता है 1 सेकण्ड में,

अतः व्यक्ति अपने जीवनकाल में ये रुपये खर्च नहीं कर सकता।
आंकिक प्रश्न
प्रश्न 1.
निम्न को हल कीजिए :
(i) 2.3 x 105 + 2.9 x 104
(ii) 6.0 × 104 – 4.0 × 10-5
(iii) (5.0 × 106) × (2.0 × 106)
(iv) ( 3.2 x 10-2) ÷ (80×102)
हल:
(i) दोनों संख्याओं के चरघातांकों को समान करके जोड़ने योग
= (2.3 × 105) + (0.29 × 104)
= 2.59 × 104
(ii) दोनों संख्याओं के चरघातांकों को समान करके घटाने पर-
घटाव = (6.0 × 10-4) – (0.40 × 104)
= 5.60 × 10-4
(iii)
= (5.0 × 106) × (2.0 × 106)
= (5·0 × 2·0) × (106+6)
= 100 × 1012 = 1.0 × 1013
(iv) (3.2 x 10-2) ÷ (8.0 × 102)
= \(\frac{3.2 \times 10^{-2}}{8.0 \times 10^2}\)
= \(\frac{3 \cdot 2}{8} \times 10^{-2-(2)}\)
= 0.4 × 10-4 = 4 x 10-5
प्रश्न 2.
2.12 g ग्लूकोज तथा 2.925 g नमक को 30.2 g पानी में मिलाया गया है, विलयन का द्रव्यमान ज्ञात कीजिए।
हल:
ग्लूकोज का द्रव्यमान = 2.12 g
नमक का द्रव्यमान = 2.925 g
पानी का द्रव्यमान = 30.2 g
विलयन का कुल द्रव्यमान = 35.245 g
यहाँ सही उत्तर 35.2g है क्योंकि यहाँ प्रश्न में दशमलव के बाद सबसे कम संख्या एक है।
प्रश्न 3.
चाँदी धातु का द्रव्यमान 6.342 g तथा घनत्व 1.2g/cm³ है। इसके आयतन की गणना करें।
हल:
चाँदी धातु का द्रव्यमान = 6.342 g
चौदी धातु का घनत्व = 1.2g/cm³

चूँकि दी गई संख्याओं में निम्नतम सार्थक अंक 2 है अतः अन्तिम परिणाम में भी दो सार्थक अंक होने चाहिये अतः परिणाम में से अन्तिम दो अंक 8 व 5 को हटाने के लिये 2 में एक अंक का योग हो जायेगा अतः सही उत्तर 5.3cm है।
प्रश्न 4.
हाइड्रोजन के एक परमाणु का द्रव्यमान 1008u है। अतः हाइड्रोजन के 10 परमाणुओं का द्रव्यमान कितना होगा ?
हल:
H के एक परमाणु का द्रव्यमान = 10.08 u
H के 10 के परमाणुओं का द्रव्यमान = 1008 × 10 = 10.08 u
चूँकि 10 एक यथार्थ संख्या है अतः इसके सार्थक अंक अनन्त होंगे। अतः अन्तिम परिणाम में सार्थक अंक दूसरी संख्या के सार्थक अंक के समान होना चाहिये। अतः कुल द्रव्यमान 10.08 है।
प्रश्न 5.
1.3 मिनट को सेकेण्ड में परिवर्तित करें।
हल:

प्रश्न 6.
निम्नलिखित को अन्तर्राष्ट्रीय पद्धति (S.I.) में व्यक्त कीजिए।
(i) 90 मिलियन मील (यह सूर्य तथा पृथ्वी के बीच की दूरी है।
(ii) 90 मील प्रति घण्टा (राजधानी एक्सप्रेस की गति)
(iii) 5 फुट 6 इंच (भारतीय पुरुषों की औसत लम्बाई)
हल:
(i) 90 मीलियन मील दूरी की इकाई अन्तर्राष्ट्रीय पद्धति में मीटर होती है।
1 मील 1.60 कि.मी. = 160 x 103 मी.

(ii) 90 मील प्रति घन्टा
1 मील = 1.6 कि.मी. = 1.6 x 103 मीटर

(iii) 5 फुट 6 इंच 5×12 + 666 इंच
1 इंच = 2.54 × 10-2 मीटर
रूपान्तरण गुणांक = 2.54 x 10-2 ![]()
66 इंच = 66 इंच x रूपान्तरण गुणांक
= 66 x 2.54 × 10-2 मीटर
= 167.64 × 10-2 मीटर
= 1.68 मीटर
![]()
प्रश्न 7.
10 दिनों में कितने सेकण्ड (4) होते हैं।
हल:
हम जानते हैं.

प्रश्न 8.
10 लीटर जल के आयतन को मीटर³ (m³) में व्यक्त कीजिए।
हल:

प्रश्न 9.
ट्रेन की चाल मीटर/सेकेण्ड में बताइये जो कि 950 मील की दूरी 25 घण्टे में तय करती है। (दिया गया है कि 1 मील 1.60 कि. मी.)।
हल:

प्रश्न 10.
निम्नलिखित को हल करें तथा इसमें उपस्थित सार्थक अंकों को बताएँ।
(1) 3.412 × 11.5
(2) 80.674 + 6.2
(3) 6180.03546 + 406.27
हल:
(i) 3412 × 11.5 = 39.2380
चूँकि यहाँ पर न्यूनतम परिशुद्ध संख्या में तीन सार्थक अंक हैं, अतः परिणाम में कुल तीन सार्थक अंक होने चाहिये।
अतः सही उत्तर 39.2
(ii) \(\frac { 80.674 }{ 6.2 }\) = 13.0119
यहाँ भी उत्तर में दो सार्थक अंक होने चाहिये।
अत: सही उत्तर = 13
(iii) 6180.03546+ 406.27

यहाँ उत्तर में चार सार्थक अंक है क्योंकि गुणनफल में 618 एक परिशुद्ध अंक है तथा इसके सार्थक अंक तीन का प्रयोग उत्तर देने में नहीं किया जाता है।
21 . 91
406 . 27
428 . 18 उत्तर को दशमलव के दो स्थानों तक दें।
अतः सही उत्तर = 428.18
प्रश्न 11.
20.0 फुट³ एल्युमीनियम का भार ग्राम में ज्ञात करें यदि इसका घनत्व 2.70 g / cm³ है।
हल:

प्रश्न 12.
4.9 ग्राम सल्फ्यूरिक अम्ल द्वारा सोडियम क्लोराइड का कितना द्रव्यमान वियोजित होगा, बंदि इस अभिक्रिया में 6g सोडियम बाइसल्फेट (NaHSO) तथा 1.825g हाइड्रोजन क्लोराइड बनता हो।
हल:
अभिक्रिया का रासायनिक समीकरण निम्न है-
NaCl + H2SO4 → NaHSO4 + HCl
अभिकारकों का द्रव्यमान = NaCl का द्रव्यमान + H2SO4 का द्रव्यमान
= x + 4.9 g
उत्पादों का द्रव्यमान = NaHSO4 का द्रव्यमान + HCl का द्रव्यमान
= 6.0g + 1.825 g
= 7.825 g
द्रव्यमान संरक्षण के नियमानुसार,
अभिकारकों का द्रव्यमान = उत्पादों का द्रव्यमान
x + 4.9 g = 7.825 g
x = 7.825 – 4.9 = 2.925 g
अत: NaCl का द्रव्यमान = 2.925 g
प्रश्न 13.
10g कैल्सियम कार्बोनेट को गर्म करने पर मानक ताप व दाब पर 2.24L CO2 गैस व 5.6g CaO बना सिद्ध करें कि ये आँकड़े द्रव्य की अविनाशिता का नियम सिद्ध करते हैं।
हल:
अभिक्रिया का समीकरण
COCO3 → CaO + CO2↑
दिया गया है CaCO3 का द्रव्यमान = 10g
CaO का द्रव्यमान = 5.6g
∵ 22.4L CO2 का मानक ताप व दाब पर द्रव्यमान = 44 g
1L CO2 का मानक ताप व दाव पर द्रव्यमान = \(\frac { 44 }{ 22.4 }\)g
∴ 2.24 L CO2 का मानक ताप व दाब पर द्रव्यमान
= \(\frac {44×22.4 }{ 22.4 }\)g = 4.4g
उत्पादों का कुल द्रव्यमान = 5.6 + 4.4 = 10g
चूँकि इस अभिक्रिया में अभिकारकों का द्रव्यमान व उत्पादों का द्रव्यमान समान है, अत: उपर्युक्त आँकड़े द्रव्य की अविनाशिता का नियम सिद्ध करते हैं।
प्रश्न 14.
17g सिल्वर नाइट्रेट, सोडियम क्लोराइड से क्रिया करके 14.35g सिल्वर क्लोराइड तथा 8.5g सोडियम नाइट्रेट देता है। सोडियम क्लोराइड का द्रव्यमान क्या होगा?
उत्तर:

द्रव्यमान संरक्षण के नियमानुसार
अभिकारकों का द्रव्यमान = उत्पादों का द्रव्यमान

17g + x = 14.35g + 8.5g
17g + x = 22.85g
x = 22.85g – 17g = 5.85g
प्रश्न 15.
2.16g धात्विक कॉपर को नाइट्रिक अम्ल के साथ गर्म कर जलाने पर प्राप्त कॉपर ऑक्साइड का भार 2.7g पाया गया। एक अन्य प्रयोग में, 1.15g कॉपर ऑक्साइड अपचयित होकर 0.92g कॉपर प्राप्त होता है। दर्शाइये कि दिये गये आँकड़े ‘स्थिर अनुपात के नियम’ का पालन करते हैं।
हल:
प्रथम प्रयोग में,
धात्विक कॉपर का द्रव्यमान = 2.16g
कॉपर ऑक्साइड का द्रव्यमान = 2.7 g
ऑक्सीजन का द्रव्यमान = 2.7 – 2.16 = 0.54g
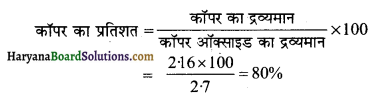
ऑक्सीजन का प्रतिशत = 100 – 80 = 20%
द्वितीय प्रयोग में,
धात्विक कॉपर का द्रव्यमान = 0.92g
कॉपर ऑक्साइड का द्रव्यमान = 1.15g
ऑक्सीजन का द्रव्यमान = 1.15 – 0.92 = 0.23g

ऑक्सीजन का प्रतिशत = 100 – 80 = 20%
दोनों प्रयोगों कॉपर तथा ऑक्सीजन दोनों के द्रव्यमानों का अनुपात एक जैसा है अतः यह स्थिर अनुपात के नियम को दर्शाते हैं।
प्रश्न 16.
सिद्ध कीजिए कि निम्नलिखित आँकड़े स्थिर अनुपात के नियम की पुष्टि करते हैं। कार्बन मोनो ऑक्साइड के दो विभिन्न नमूनों में कार्बन का द्रव्यमान निम्न प्रकार से है- (i) 1.26g कार्बन, 1.42g मोनो ऑक्साइड में, (ii) 1008g कार्बन, 1.136g मोनो ऑक्साइड में
हल:
प्रथम नमूने में
कार्बन मोनो ऑक्साइड का द्रव्यमान = 1.42g
कार्बन का द्रव्यमान = 1.26g
ऑक्सीजन का द्रव्यमान = 1.42 – 1.26 = 0.16g
कार्बन का प्रतिशत = \(\frac { 1.26 }{ 1.42 }\) x 100 = 88.73%
ऑक्सीजन का प्रतिशत = 100 – 88.73 = 11.27%
दूसरे नमूने में,
कार्बन मोनोऑक्साइड का द्रव्यमान = 136g
कार्बन का द्रव्यमान = 1.008g
ऑक्सीजन का द्रव्यमान = 0.128g
कार्बन की प्रतिशतता

ऑक्सीजन का प्रतिशत = 100 – 88.73 = 11.27%
चूँकि यहाँ पर दिये गये नमूने में कार्बन व ऑक्सीजन का प्रतिशत मात्राएँ समान हैं अतः ये आँकड़े स्थिर अनुपात के नियम का पालन करते हैं।
प्रश्न 17.
एक प्रयोग में तत्व ‘X’ के 15g तत्व ‘Y’ के 25g से संयोग करके एक यौगिक बनाते हैं। जबकि दूसरे प्रयोग में तत्व ‘X’ के 3g तत्व ‘Y’ के Sg से संयोग करके यौगिक बनाते हैं। कारण सहित बताइये कि इन आँकड़ों से रासायनिक संयोग के किस नियम का सत्यापन होता है।
हल:
पहले प्रयोग में,
X : Y
15 : 25
3 : 5
दूसरे प्रयोग में,
X : Y
3 : 5
यहाँ X तथा Y के द्रव्यमानों में अनुपात होने के कारण स्पष्ट है कि उपर्युक्त आँकड़े स्थिर अनुपात के नियम की पुष्टि करते हैं।
प्रश्न 18.
कॉपर सल्फेट क्रिस्टल में 25.45% कॉपर तथा 36.07% जल है। यदि स्थिर अनुपात का नियम सत्य हो तो 40g कॉपर सल्फेट का क्रिस्टल प्राप्त करने के लिये आवश्यक कॉपर के भार की गणना कीजिए।
हल:
दिये गये आँकड़ों के अनुसार,
कॉपर का प्रतिशत = 25.45%
जल का प्रतिशत = 36.07%
अत: सल्फेट प्रतिशत = 100 – (25.45 + 36.07)
= 100 – 61.52 = 38.48%
यदि स्थिर अनुपात का नियम सत्य है तो स्थिर संघटन का प्रतिशत कॉपर सल्फेट के दूसरे क्रिस्टल में भी वही होना चाहिये।
अतः
100g CuSO4 क्रिस्टल में Cu = 25.45g
40g CuSO4 क्रिस्टल में Cu = \(\frac { 25.45×40 }{ 100 }\)
= 10.18 g
प्रश्न 19.
कार्बन दो प्रकार के ऑक्साइड बनाता है जिनमें क्रमशः 42.8% व 27.27% कार्बन उपस्थित है। सिद्ध कीजिए कि ये प्रेक्षण गुणित अनुपात क नियम को सिद्ध करते हैं।
हल:
कार्बन के दोनों ऑक्साइड में कार्बन व ऑक्सीजन की निम्न प्रतिशत मात्राएँ हैं।
प्रथम ऑक्साइड
C = 42.8%
O = 57.2%
द्वितीय ऑक्साइड
27.27%
72.73
प्रथम ऑक्साइड में,
57.2g ऑक्सीजन से = 42.8g कार्बन संयोग करता है।
1g ऑक्सीजन से =\(\frac { 42.8 }{ 57.2 }\) = 0.748g
दूसरे ऑक्साइड में,
72.73g ऑक्सीजन = 27.27g कार्बन संयोग करता है।
1g ऑक्सीजन = \(\frac { 27.27 }{ 72.73 }\) = 0.375g
उपर्युक्त दोनों ऑक्साइड में कार्बन की विभिन्न मात्राओं में (0.748 : 0.375) एक सरल अनुपात 21 है अतः यह आँकड़े गुणित अनुपात नियम को सिद्ध करते हैं।
प्रश्न 20.
एक तत्व के दो सल्फाइडों में सल्फर का द्रव्यमान क्रमशः 53.33% और 36.36% है सिद्ध कीजिये कि ये आँकड़े गुणित अनुपात नियम की पुष्टि करते हैं।
हल:
प्रथम सल्फाइड में,
सल्फर की मात्रा = 53.33%
तत्व की मात्रा = 100 – 53.33 = 46.47%
अतः तत्व व सल्फर के प्रतिशतों का अनुपात
= 46.67:53.33
= 1 : 1 . 14
द्वितीय सल्फाइड में,
सल्फर की मात्रा = 26.36%
तत्व की मात्रा = 100 – 36.36 = 63.64%
= 1 : 0.57
तत्व और सल्फर के अनुपात = 63.64:36.36
चूँकि दोनों सल्फाइडों में तत्व की मात्रा निश्चित है अतः दोनों सल्फाइडों में सल्फर तत्व की निश्चित मात्रा में संयोग करने वाली मात्राओं में परस्पर अनुपात 0.571.14 या 2 है, जो एक सरल गुणित अनुपात है, अतः इन आँकड़ों से गुणित अनुपात का नियम सिद्ध होता है।
![]()
प्रश्न 21.
कार्बन हाइड्रोजन के साथ क्रिया करके तीन यौगिक A. B तथा C बनाता है। यौगिक A, B तथा C में हाइड्रोजन की प्रतिशत मात्र क्रमश: 25, 14.3 तथा 7.7 है ये आँकड़े किस नियम को सिद्ध करते हैं ?
हल:
यौगिक में
हाइड्रोजन की प्रतिशत मात्रा = 25.0%
कार्बन की प्रतिशत मात्रा 100 – 25 = 75%
अत: हाइड्रोजन का 25 भाग अभिक्रिया करता है 75 भाग कार्बन से, हाइड्रोजन का 1 भाग अभिक्रिया करेगा
= \(\frac { 75 }{ 25 }\) = 3 भाग कार्बन से।
यौगिक B में
हाइड्रोजन की प्रतिशत मात्रा = 14.3%
कार्बन की प्रतिशतता = 100 – 14.3
= 85.7%
अतः हाइड्रोजन के 14.3 भाग से अभिक्रिया करता है
= 85.7 भाग कार्बन,
हाइड्रोजन के 1 भाग से अभिक्रिया करेगा
= \(\frac { 85.7 }{ 14.3 }\) = 6 भाग कार्बन
यौगिक C में
हाइड्रोजन की प्रतिशत मात्रा = 7.7%
कार्बन की प्रतिशतता = 100.7.7 = 92.3%
7.7 भाग हाइड्रोजन अभिक्रिया करता है = 92.3 भाग कार्बन से
1 भाग हाइड्रोजन अभिक्रिया करेगा = \(\frac { 92.3 }{ 77 }\) = 120 भाग कार्बन से। चूँकि यौगिक A, B तथा C में हाइड्रोजन की समान मात्रा से
अभिक्रिया करने वाले कार्बन की मात्राओं का प्रतिशत निम्न प्रकार से है
3 : 6 : 12
1 : 2 : 4
जो कि एक सरल गुणित अनुपात है अतः यह आँकड़े गुणित अनुपात के नियम को सिद्ध करते हैं।
प्रश्न 22.
H2 एवं Cl2, सूर्य के प्रकाश में क्रिया करके HCI गैस बनाती है। 20ml हाइड्रोजन से HCl का कितना आयतन प्राप्त होता?
हल:

1 आयतन हाइड्रोजन से प्राप्त होता है = 2 आयतन HCl
20 ml हाइड्रोजन से प्राप्त होगी = 2 x 20 ml HCl
= 40ml HCl
प्रश्न 23.
एक धातु दो ऑक्साइड बनाती है। इन ऑक्साइडों के एक-एक g को अलग-अलग अपचयित करने पर क्रमशः 0-798g तथा 0.888g धातु प्राप्त हुई। ये परिणाम रासायनिक संयोग के किस नियम की पुष्टि करते हैं?
हल:
प्रथम ऑक्साइड में,
ऑक्साइड की मात्रा = 1.00 g
धातु की मात्रा = 0.798g
ऑक्सीजन की मात्रा = 1.00 – 0.798
= 0.202 g
0.202g ऑक्सीजन संयुक्त होती है = 0.798g धातु से
1g ऑक्सीजन संयुक्त होगी = \(\frac { 0.798 }{ 0.202 }\) = 3.95g धातु से
द्वितीय ऑक्साइड में,
ऑक्साइड की मात्रा = 100g
धातु की मात्रा = 0.888g
ऑक्सीजन की मात्रा = 1.00 – 0.888 = 0.112g
0.112g ऑक्सीजन संयुक्त होती है = 0.888g धातु से
1g ऑक्सीजन संयुक्त होगी = \(\frac { 0.888 }{ 0.202 }\) = 3.95 g धातु से
अत: 1g ऑक्सीजन से संयुक्त होने वाली धातु की मात्राएँ क्रमशः 3.95 और 7.92g हैं, जो कि 1 : 2 के सरल अनुपात में हैं, अतः दिये गये आँकड़े गुणित अनुपात के नियम की पुष्टि करते हैं।
प्रश्न 24.
यदि नाइट्रिक ऑक्साइड निम्नांकित समीकरण के अनुसार बनती है।
N2(g) + O2(g) → 2NO(g)
तो 30 L NO गैस बनाने के लिये नाइट्रोजन का कितना आयतन आवश्यक होगा?
हल:

2L NO प्राप्त करने के लिये आवश्यक होती है = 1L इट्रोजन
30L NO प्राप्त करने के लिये आवश्यक होती है।
15 L नाइट्रोजन
प्रश्न 25.
6.488 ग्राम सीसा 1.002 ग्राम ऑक्सीजन से क्रिया कराने पर लैड परऑक्साइड (Pb2O2) प्राप्त होता है। लैड परऑक्साइड को हम लैड नाइट्रेट को गर्म करके भी प्राप्त कर सकते हैं जिसमें 13.38% ऑक्सीजन है उपरोक्त सूचनाएं स्थिर संघटन नियम को सिद्ध करती हैं।
हल:
प्रथम ऑक्साइड में,
लैड परऑक्साइड का द्रव्यमान,
6.488g + 1.002 = 7.490g
7.49g लैंड परऑक्साइड में है = 1.002g O2
100g लैड परऑक्साइड में होगी = \(\frac { 1.002×100 }{ 7.49 }\)O2
= 13.38%
अत: ऑक्सीजन की प्रतिशतता = 13.38%
दूसरे प्रयोग में भी 13-38% ऑक्सीजन उपस्थित है। जो प्रथम प्रयोग में ऑक्सीजन की प्रतिशत मात्रा के समतुल्य है, अतः स्थिर अनुपात नियम की सत्यता सिद्ध होती है।
प्रश्न 26.
निम्नलिखित के मोलर द्रव्यमान की गणना कीजिए।
C2H5COOH, P4, S8, PCl5, SO2Cl2
हल:
(i) C2H5COOH का मोलर द्रव्यमान-
= 2 × 12 + 5 × 1 + 12 + 16 × 2 + 1
= 24 + 5 + 12 + 32 + 1
= 74 g/mol
(ii) P4 का मोलर द्रव्यमान-
= 31 × 4 = 124 g/mol
(iii) S8 का मोलर द्रव्यमान-
= 32 × 8 = 256g/mol
(iv) PCl5 का मोलर द्रव्यमान-
= 31 + 35.5 x 5
= 31 + 177.5 = 208.5 g/mol
(v) SO2 Cl2 का मोलर द्रव्यमान
= 32 + 16 × 2 + 2 × 35.5
= 32 + 32+ 71.0 = 135.0g/mol
प्रश्न 27.
नीचे दिये गए यौगिकों के सूत्र द्रव्यमान का परिकलन
कीजिए।
(i) MgO (ii) CaCl 2 (iii) CaCO3 (iv) AlCl3
हल:
(i) MgO का सूत्र द्रव्यमान
= 24 + 16 = 40g
(ii) CaCl2 का सूत्र द्रव्यमान
= 40+2 × 35.5
= 40 + 71 = 111g
(iii) CaCO3 का सूत्र द्रव्यमान
= 40 + 12 + 16 × 3
= 40 + 12 + 48 = 100g
(iv) AlCl3 का सूत्र द्रव्यमान
= 27 +3 × 35.5
= 27 + 106.5 = 133.5g
प्रश्न 28.
120g कार्बन में ग्राम परमाणु तथा परमाणुओं की संख्या ज्ञात कीजिए।
हल:

परमाणुओं की संख्या = ग्राम-परमाणुओं की संख्या x 6.02 × 1023
= 10 × 6.02 x 1023
= 6.02 x 1024 परमाणु
प्रश्न 29.
एक कार्बन परमाणु का द्रव्यमान ज्ञात कीजिए।
हल:
कार्बन का परमाणु द्रव्यमान = 12 u
1 मोल कार्बन परमाणुओं का द्रव्यमान = 12 g
अर्थात् 6.02 x 1023 परमाणुओं का द्रव्यमान = 12g
अतः एक C. परमाणु द्रव्यमान का = \(\frac{12}{6.02 \times 10^{23}}\)g
= 1.99 × 10-23g
प्रश्न 30.
5.75 g सोडियम में मोल संख्या ज्ञात कीजिये।
(सोडियम का परमाणु द्रव्यमान 23u)
हल:
1 मोल = परमाणु द्रव्यमान
23g सोडियम = 1 मोल सोडियम
5.75g सोडियम = \(\frac { 5.75 }{ 23 }\) मोल सोडियम
= 0.25 मोल सोडियम
प्रश्न 31.
2.3 g सोडियम में सोडियम परमाणुओं की संख्या कितनी होगी (सोडियम का परमाणु भार 23 )।
हल:
23g सोडियम में सोडियम परमाणु = 6.022 x 1023
2.3g सोडियम में सोडियम परमाणु
= \(\frac{6.022 \times 10^{23} \times 2.3}{23}\)
= 6.022 × 1022 Na परमाणु
प्रश्न 32.
0.585 ग्राम NaCl में Cl– आयनों की संख्या कितनी है।
(NaCl का सूत्र भार = 58.5)
हल:
58.5g NaCl में उपस्थित है
= 6.02 × 1023 NaCl अणु
0.585g NaCl में उपस्थित हैं
= \(\frac{6.02 \times 10^{23} \times 0.585}{58.5}\)NaCl अणु
= 6.02 × 1021 NaCl अणु
एक अणु NaCl में उपस्थित है Cl– आयन
6.02 x 1021 अणु NaCl में उपस्थित है
= 6.02 × 1021 Cl– आयन
प्रश्न 33.
नाइट्रोजन व हाइड्रोजन के संयोग से बनी अमोनिया का अणुसूत्र ज्ञात करो।
हल:
नाइट्रोजन + हाइड्रोजन = आयतन
1 आयतन + 3 आयतन = 2 आयतन
अमोनिया आवोगाद्रो नियम से 1n अणु + 3n अणु = 2n अणु यदि n = 1 रखने पर,

\(\frac { 1 }{ 2 }\) अणु नाइट्रोजन = 1 नाइट्रोजन परमाणु
\(\frac { 3 }{ 2 }\) अणु हाइड्रोजन = \(\frac { 3 }{ 2 }\) x 2 = 3 हाइड्रोजन परमाणु
अतः अमोनिया का अणुसूत्र NH3 होगा।
या (NH3) x n का द्रव्यमान = 17 n
परन्तु अमोनिया का आण्विक द्रव्यमान = 17
n = \(\frac { 17 }{ 17 }\) = 1
अतः अमोनिया का अणुसूत्र NH3 होगा।
प्रश्न 34.
3.01 × 1022 NH3 अणुओं का द्रव्यमान बताइए ?
हल:
NH3 का मोलर द्रव्यमान = 14 + 3 = 17g/mol
6.02 × 1023 NH3 अणुओं का द्रव्यमान = 17g/mol
3.01 × 1022 NH3 अणुओं का = \(\frac{17 \times 3.01 \times 10^{22}}{602 \times 10^{23}}\)
= 8.5 × 10-1
= 0.85g/mol
प्रश्न 35.
2.31 x 10-6 कॉपर में परमाणुओं की कितनी संख्या होगी? कॉपर का परमाणु द्रव्यमान 63.5a.m.u है।
हल:
63.5g कॉपर 6.02 x 1023 कॉपर परमाणु
2.31 × 10-6g कॉपर = \(\frac{602 \times 10^{23} \times 2.31 \times 10^{-6}}{63.5}\) कॉपर परमाणु
= 0.219 × 1017
= 2.19 × 1016 कॉपर परमाणु
प्रश्न 36.
द्रव मर्करी का घनत्व 13.6 ग्राम / सेमी. है। एक लीटर धातु में मर्करी के कितने मोल उपस्थित हैं ?
हल:
मर्करी का द्रव्यमान = घनत्व x आयतन
= 13.6 × 1000 = 13600g
मर्करी की मोल संख्या

मर्करी की मोल संख्या = 68 मोल
प्रश्न 37.
निम्नलिखित का द्रव्यमान ग्राम में ज्ञात कीजिए –
(i) 2 ग्राम परमाणु Ca
(ii) 3N परमाणु He
(iii) \(\frac { 1 }{ 2 }\) मोल N2
(iv) 3N अणु O2
ग्राम परमाणु परमाणु भार
हल:
(i) 2 ग्राम परमाणु Ca
द्रव्यमान = ग्राम परमाणु x परमाणु भार
= 2 x 20
= 40 ग्राम
(ii) 3N परमाणु He
He के N परमाणु = ग्राम – परमाणु द्रव्यमान
He के 3N परमाणु = 3 x 4 = 12 ग्राम
(iii) \(\frac { 1 }{ 2 }\) मोल Na2
द्रव्यमान = ग्राम अणु x अणु – भार
= \(\frac { 1 }{ 2 }\) x 28
= 14 ग्राम
(iv) 3N अणु O2
= O2 के N अणु = ग्राम – अणु द्रव्यमान = 32 ग्राम
O2 के 3N अणु = 3 × 32
= 96 ग्राम
प्रश्न 38.
4.9g H2SO4 में कितने g अणु होते हैं?
हल:
H2SO4 का आण्विक द्रव्यमान
= 2 × 1 + 32 + 16 × 4
= 2 + 32 + 64 = 98 g
98g H2SO4 में उपस्थित है = ग्राम मोल
4.9g H2SO4 में उपस्थित है = \(\frac { 1 }{ 98 }\) x 49 ग्राम मोल
= 0.05g ग्राम मोल
अर्थात् 0.05 ग्राम अणु
![]()
प्रश्न 39.
सोडियम कार्बोनेट डेकाहाइड्रेट (NaCO3.10H2O) एक महत्त्वपूर्ण औद्योगिक रसायन है। इसके सूत्र द्रव्यमान का परिकलन कीजिए।
हल:
Na2CO3. 10H2O का सूत्र द्रव्यमान
= [2 × 23 + 12 + 3 × 16 + 10 (2 × 1 + 16)]g
= [46 + 12 + 48 + 180] = 286g
प्रश्न 40.
निम्नलिखित के द्रव्यमान का परिकलन कीजिए.
(i) N के 1 मोल परमाणु
(ii) Al के 5 mol परमाणु
(iii) Na+ आयन के 5.0 मोल
(iv) NaOH के 10 mol
हल:
(i) N का परमाण्वीय द्रव्यमान = 14g
अतः N के मोल परमाणु का द्रव्यमान = 14g
(ii) Al के 5 mol परमाणु में द्रव्यमान
Al का परमाण्वीय द्रव्यमान = 27g
Al के 1 मोल परमाणु का द्रव्यमान = 27g
अत: Al के 5 मोल परमाणु = 27 x 5 = 135g
(iii) Na+ आयन के 5.0 mol का द्रव्यमान
Na+ आयन का परमाणु द्रव्यमान = 23g
Na+ आयन के 1 मोल का द्रव्यमान = 23g
अत: Na+ आयन के 5.0 मोल का द्रव्यमान = 23 x 5.0 = 115.0g
(iv) NaOH के 10 मोल का द्रव्यमान
NaOH का द्रव्यमान = 40g
NaOH के 1 मोल का द्रव्यमान = 40g
अत: NaOH के 10 मोल का द्रव्यमान
= 40 × 10g = 400g
प्रश्न 41.
निम्न को मोल में परिवर्तित करें।
(i) 12g SO2 गैस
(ii) 25g जल
(iii) 22g कार्बन डाई ऑक्साइड
हल:
(i) SO2 गैस का परमाणु भार = 32 + 32 = 64g
64g SO2 = 1 मोल SO2
12g SO2 = \(\frac { 12 }{ 64 }\) मोल SO2
= 0.1875 मोल SO2
(ii) 25g जल
जल (H2O) का अणु भार = 2 + 16 = 18g
18 ग्राम जल = 1 मोल जल
25 ग्राम जल = \(\frac { 25 }{ 44 }\) मोल जल
= 1.39 मोल जल
(iii) 22g कार्बन डाई ऑक्साइड
कार्बन डाई ऑक्साइड CO2 = 12 + 32 = 44g
44g CO2 = 1 मोल CO2
22g CO2 = \(\frac { 22 }{ 44 }\) मोल CO2
= \(\frac { 1 }{ 2 }\) = 0.5 मोल CO2
प्रश्न 42.
1.4g नाइट्रोजन गैस में उपस्थित कुल इलेक्ट्रॉनों की संख्या बताइए।
हल:
नाइट्रोजन गैस का मोलर द्रव्यमान
= 14 x 2 = 28g
28g नाइट्रोजन गैस में उपस्थित इलेक्ट्रॉन
= 14 मोल इलेक्ट्रॉन
1.4g नाइट्रोजन गैस में उपस्थित इलेक्ट्रॉन = \(\frac { 14×1.4 }{ 28 }\) मोल इलेक्ट्रॉन
= 0.7 मोल इलेक्ट्रॉन
= 0.7 × 6.02 × 1023 इलेक्ट्रॉन
= 4.214 1023 इलेक्ट्रॉन
प्रश्न 43.
3.42g सुक्रोज (C12H22O11) में उपस्थित प्रत्येक प्रकार के परमाणुओं की संख्या बताइये।
हल:
सुक्रोज (C12H22O11) का अणु भार
= 12 × 12 + 22 × 1 + 11 × 16
= 144 +22+ 176 = 342g
342g सुक्रोज में उपस्थित है = 6.02 x 1023 अणु
3.42g सुक्रोज में उपस्थित होंगे
= \(\frac{6.02 \times 3.42 \times 10^{23}}{342}\)अणु
= 6.02 × 1021 अणु
1 अणु सुक्रोज में है = 12 कार्बन परमाणु
6.02 x 1021 अणु सुक्रोज में उपस्थित होंगे
= 12 × 6.02 × 1021 कार्बन परमाणु
= 72.24 x 1021 कार्बन परमाणु
= 7.224 × 1022C परमाणु
1 अणु सुक्रोज में हैं = 22 हाइड्रोजन परमाणु
6.02 × 1021 अणु सुक्रोज में उपस्थित होंगे
= 22 × 6.02 × 1021
= 132.44 × 1021 हाइड्रोजन परमाणु
= 1.32 × 1023 H-परमाणु
1 अणु सुक्रोज में है = 11 ऑक्सीजन परमाणु
6.02 x 1021 अणु सुक्रोज में उपस्थित होंगे
= 11 × 6.02 × 1021 O-परमाणु
= 66.22 × 1021O-परमाणु
= 6.622 × 1022 O-परमाणु
प्रश्न 44.
1.21g ऐलुमिनियम ऑक्साइड (Al2O3) में उपस्थित एलुमिनियम आयन की संख्या बताइये।
हल:
Al2O3 का अणु भार
= 2 × 27 + 3 x 16 = 54 + 48
= 102 g/mol
102 g Al2O3 में उपस्थित है
= \(\frac{2 \times 1.21}{102}\) मोल एलुमिनियम आयन
= 0.024 मोल एलुमिनियम आयन
= 0.024 × 6.02 × 1023 एलुमिनियम आयन
= 0.144 × 1023 एलुमिनियम आयन
= 1.44 x 1022 एलुमिनियम आयन
प्रश्न 45.
कैल्सियम के कितने भार में परमाणुओं की संख्या 3.2g सल्फर में उपस्थित परमाणुओं की संख्या के बराबर होगी।
हल:
3.2g सल्फर में उपस्थित परमाणु
S का परमाणु भार = 32g
32g सल्फर में परमाणुओं की संख्या = 6.02 x 1023
3. 2g सल्फर में परमाणुओं की संख्या
= \(\frac{6.02 \times 3.2}{32}\) x 1023
= 6.02 × 1022
Ca के 6.02 x 1022 परमाणुओं का भार
Ca का परमाणु भार = 40g
6.02 × 1023 Ca-परमाणु का भार = 40g
6.02 × 10222 Ca-परमाणु का भार
= \(\frac{40 \times 6.02 \times 10^{22}}{602 \times 10^{23}}\)
= 4.0 g
प्रश्न 46.
SO2 के अणुओं की संख्या क्या होगी जिसमें 8.0g ऑक्सीजन उपस्थित हो।
हल:
SO2 का अणु भार = 32 + 2 × 16 = 64g
32 g ऑक्सीजन उपस्थित है = 64g SO2 में
8.0 g ऑक्सीजन उपस्थित होगी = \(\frac{64 \times 8 \cdot 0}{32}\)
= 16g SO2 में
64g SO2 में उपस्थित है
= 6.02 × 1023 अणु
16g SO2 में उपस्थित होगी
= \(\frac{6.02 \times 16}{64}\) x 1023 अणु
= 1.505 x 1023 अणु
प्रश्न 47.
200 mg H2S में से 1021 अणु हटा दिये गये हैं। बताइये कि H2S के कितने मोल शेष बचे।
हल:
H2S का अणु भार = 2 + 32 = 34g
34g H2S में अणुओं की संख्या = 6.02 × 1023
200 × 10-3g H2S में अणुओं की संख्या 6
= \(\frac{6.02 \times 10^{23} \times 200 \times 10^{-3}}{34}\)
= 35.41 × 1020
= 3.54 x 1021 अणु
इसमें से हटाये गये अणुओं की संख्या 1021
बचे अणुओं की संख्या = 3.54 x 1021 – 11.00 × 1021
= 2.54 x 1021 अणु
6.02 × 1023 H2S अणु उपस्थित है
= 1 मोल H2S में
2.54 × 1021 H2S अणु उपस्थित है।
= \(\frac{2.54 \times 10^{21}}{6.02 \times 10^{23}}\) मोल H2S में
= 0.42 × 10-2 मोल H2S
= 4.2 x 10-3 मोल H2S
प्रश्न 48.
1 मिली जल में उपस्थित अणुओं की संख्या क्या होगी ?
(यदि जल का घनत्व 1 ग्राम / मिली)
हल:
मिली जल का द्रव्यमान 1 x 1 = 1 ग्राम
1 मिली जल में मोलों की संख्या = \(\frac { 1 }{ 18 }\) मोल
अणुओं की संख्या = \(\frac { 1 }{ 18 }\)6.02 × 1023
= 3.34 x 1022 अणु
प्रश्न 49.
शरीर में पाये जाने वाले हार्मोन इन्सुलिन में 3.2% सल्फर पाया जाता है। इसका न्यूनतम अणुभार ज्ञात करो।
हल:
इन्सुलिन में न्यूनतम सल्फर परमाणु हो सकता है।
(सल्फर का परमाणु भार = 32g)
3.2% सल्फर से तात्पर्य है कि 100g इन्सुलिन में 3.2g सल्फर उपस्थित है।
3.2g ग्राम सल्फर उपस्थित है = 100 ग्राम इन्सुलिन में = 1000 ग्राम इन्सुलिन में
अतः इन्सुलिन का न्यूनतम अणु भार = 1000g
प्रश्न 50.
शरीर के रक्त में उपस्थित हीमोग्लोबिन का अणु भार 89600 है। इसमें 0.25% (भारानुसार) आयरन होता है। हीमोग्लोबिन के एक अणु में आयरन परमाणुओं की संख्या ज्ञात करो।
हल:
0.25% के अनुसार,
100 ग्राम हीमोग्लोबिन में Fe की मात्रा = 0.25g
89600 ग्राम में उपस्थित Fe की मात्रा
= \(\frac { 0.25 }{ 100 }\) × 89600 = 224 ग्राम Fe
1 मोल हीमोग्लोबिन में 224 ग्राम Fe उपस्थित है अर्थात् \(\frac { 224 }{ 56 }\) = 4 ग्राम-परमाणु Fe उपस्थित है।
अतः 1 अणु हीमोग्लोबिन में Fe के परमाणुओं की संख्या = 4 परमाणु Fe
प्रश्न 51.
किसी तत्व के 3 x 1023 परमाणुओं का भार 66 ग्राम है। तत्व का परमाणु भार ज्ञात करें।
हल:
3 x 1023 परमाणुओं का भार = 66 ग्राम
6.02 × 1023 परमाणुओं का भार = \(\frac{66 \times 6.02 \times 10^{23}}{3 \times 10^{23}}\)ग्राम
तत्व का परमाणु भार 132-44 ग्राम है।
प्रश्न 52.
किसी गैस का 1 ग्राम N. T.P. पर 1400 मिली आयतन घेरता है। गैस का अणु भार क्या है? N. T. P. पर, 1 मिली. गैस में कितने अणु हैं?
हल :
1400 मिली गैस का भार = 1 ग्राम
N.T.P. पर 22400 मिली गैस का भार = \(\frac { 22400 }{ 1400 }\) ग्राम = 16 ग्राम
गैस का अणु भार = 16 ग्राम
N.T.P. पर 22400 मिली. गैस में अणुओं की संख्या = 6.02 x 1023 अणु
अतः 1 मिली. गैस में अणुओं की संख्या
= \(\frac{6.02 \times 10^{23}}{22400}\)
= 2.688 ×1019 अणु
प्रश्न 53.
61g ऑक्सीजन के द्वारा N. T.P. पर ग्रहण करने वाला आयतन क्या होगा?
हल:
ऑक्सीजन (O2) गैस का भार = 16 x 2 = 32g
328 ऑक्सीजन का N. T. P. पर आयतन = 22.4 ली.
16g ऑक्सीजन का N. T. P. पर आयतन
= \(\frac { 22.4×16 }{ 32 }\)
= 11.2 ली.
प्रश्न 54.
110g कॉपर सल्फेट (CuSO4) से कितना कॉपर प्राप्त होता है ?
हल:
CuSO4 का अणु भार = 63.5 + 32 + 4 × 16
= 159.5 g
159.5 g CuSO4 में Cu का द्रव्यमान = 63.5 g
110g CuSO4 में Cu का द्रव्यमान
= \(\frac{63.5 \times 110}{159 \cdot 5}\)
= 43.79 g
प्रश्न 55.
कैल्सियम क्लोराइड के अशुद्ध नमूने का अध्ययन करने पर क्लोरीन का प्रतिशत 45.5 पाया गया। इस नमूने में शुद्ध कैल्सियम क्लोराइड का प्रतिशत कितना होगा।
हल:
शुद्ध कैल्सियम क्लोराइड (CaCl2) का अणु भार
= Ca का परमाणु भार + 2Cl
का परमाणु भार
=40 + 2 × 35.5
= 40 + 71 = 111g
शुद्ध CaCl2 में क्लोरीन की प्रतिशत मात्रा
= \(\frac{71 \times 100}{111}\)
= 63.96 %
यदि क्लोरीन का 63.96 भाग है तो CaCl2 है = 100 भाग
यदि क्लोरीन का 45.5 भाग है तो CaCl2 है
= \(\frac{100 \times 45.5}{63.96}\)
= 71.14%
अतः शुद्ध CaCl की प्रतिशतता = 71.14%
प्रश्न 56.
KClO3 में उपस्थित KCl व ऑक्सीजन तत्वों की % मात्राएँ ज्ञात कीजिए।
हल:
KClO3 का मोलर द्रव्यमान = 39 + 35.5 + 3 x 16 = 122.5
K की प्रतिशत मात्रा = \(\frac{39 \times 100}{122.5}\) = 31.83 %
Cl की प्रतिशत मात्रा = \(\frac{35 \cdot 5}{122 \cdot 5}\) x 100 = 28.97 %
O की प्रतिशत मात्रा = \(\frac { 48 }{ 122.5 }\) x 100 = 39.20 %
![]()
प्रश्न 57.
एक यौगिक में Na, S, H व ऑक्सीजन तत्व उपस्थित हैं। इन तत्वों की % मात्राएँ क्रमशः 14 28%, 9.92%, 96.20% व 69-60% हैं। यौगिक का अणुसूत्र ज्ञात कीजिए। यौगिक में उपस्थित सभी हाइड्रोजन परमाणु H2O के रूप में स्थित हैं। क्रिस्टलीय यौगिक का सूत्र ज्ञात कीजिए, यदि इसका मोलर द्रव्यमान 322g हो।
हल:
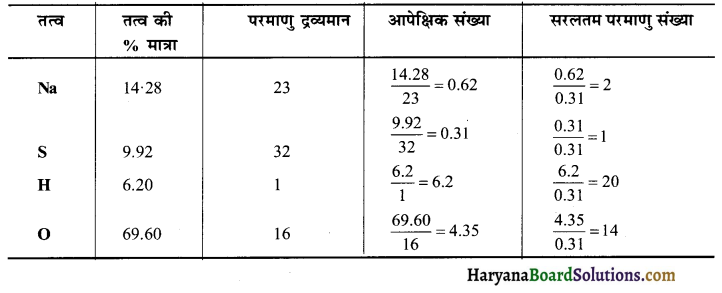
अतः यौगिक का मूलानुपाती सूत्र Na2SH20O14
मूलानुपाती सूत्र द्रव्यमान
= 23 × 2 + 32 + 20 + 14 x 16
= 46 + 32 + 20 + 224
= 322 g
यौगिक का मोलर द्रव्यमान = 322 g
मोलर द्रव्यमान = 322 g

यौगिक का अणु सूत्र Na2SH20O14, क्रिस्टलीय यौगिक का सूत्र Na2SO4.10H2O
प्रश्न 58.
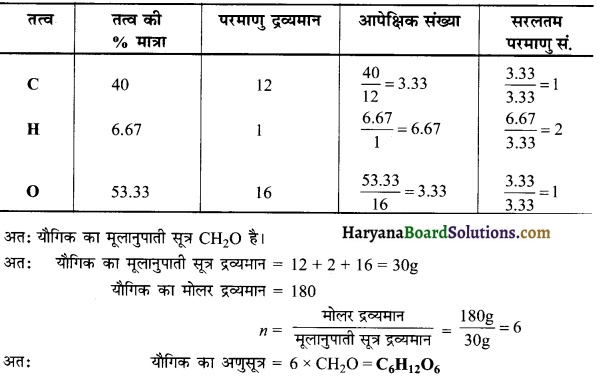
एक कार्बनिक यौगिक का रासायनिक विश्लेषण करने पर C, H और ऑक्सीजन तत्वों की उपस्थिति पायी गयी। कार्बन व H की % मात्राएँ क्रमश: 40% तथा 6.67% प्राप्त हुईं। यदि यौगिक का मोलर द्रव्यमान 180g हो तो यौगिक का अणुसूत्र ज्ञात कीजिए।
हल:
यौगिक का मूलानुपाती सूत्र निम्न प्रकार ज्ञात करते हैं-
प्रश्न 59.
धावन सोडे (Na2CO3. 10H2O) के शुद्ध नमूने में क्रिस्टलन जल की प्रतिशतता ज्ञात कीजिए ।
हल:
धावन सोडे (Na2CO3. 10H2O) का अणु भार
= 2 × Na का परमाणु भार + C का परमाणु भार + 3 x O का परमाणु भार + 10 x H2O का अणु भार
= 2 × 23 + 12 + 3 × 16 + 10 × 18
= 46+ 12 +48 + 180 = 286g
286g धावन सोडे के शुद्ध नमूने में जल = 180g
100g धावन सोडे के शुद्ध नमूने में जल = \(\frac { 180×100 }{ 286 }\)
= 62.94%
प्रश्न 60.
एक यौगिक का संघटन निम्न प्रकार से है.
C = 34·6%, H = 3 · 85% तथा O = 61.55% इस यौगिक का मूलानुपाती सूत्र ज्ञात कीजिए-
हल:
| तत्व | प्रतिशतता | परमाणु द्रव्यमान | आपेक्षिक संख्या | सरलतम परमाणु संख्या | सरलतम पूर्ण अनुपात |
| C | 34.6 | 12 | \(\frac { 34.6 }{ 12 }\) = 2.88 | \(\frac { 2.88 }{ 2.88 }\) = 1 | 1 |
| H | 3.85 | 1 | \(\frac { 3.85 }{ 1 }\) = 38.5 | \(\frac { 3.85 }{ 2.88 }\) = 1.33 | 2 |
| O | 61.55 | 16 | \(\frac { 61.55 }{ 16 }\) = 3.85 | \(\frac { 3.85 }{ 2.88 }\) = 1.33 | 2 |
यौगिक का मूलानुपाती सूत्र CH2O2.
प्रश्न 61.
रासायनिक विश्लेषण से ज्ञात हुआ कि किसी यौगिक में 10 ग्राम आयरन क्लोराइड में 3.438 ग्राम आयरन और 6.560 ग्राम क्लोरीन है। आयरन क्लोराइड का मूलानुपाती सूत्र निकालिये।
हल:
आयरन क्लोराइड में आयरन की प्रतिशतता = \(\frac{3.438 \times 100}{10}\) = 34.38%
आयरन क्लोराइड में क्लोरीन की प्रतिशतता = \(\frac{6.560 \times 100}{10}\) = 65.6%
| तत्व | प्रतिशतता | परमाणु द्रव्यमान | आपेक्षिक संख्या | सरलतम परमाणु संख्या | सरलतम पूर्ण अनुपात |
| Fe | 34.38 | 55.8 | \(\frac { 34.38 }{ 55.8 }\) = 0.616 | \(\frac { 0.616 }{ 0.616 }\) = 1 | 1 |
| Cl | 65.6 | 35.5 | \(\frac { 65.6 }{ 35.5 }\) = 1.848 | \(\frac { 1.848 }{ 0.616 }\) = 3 | 3 |
मूलानुपाती सूत्र – FeCl3
प्रश्न 62.
एक C, H एवं N युक्त यौगिक में तत्वों का भार सम्बन्धी अनुपात 9:1: 3.5 है। यदि यौगिक का वाष्प घनत्व 54 हो तो अणुसूत्र ज्ञात कीजिए।
हल:
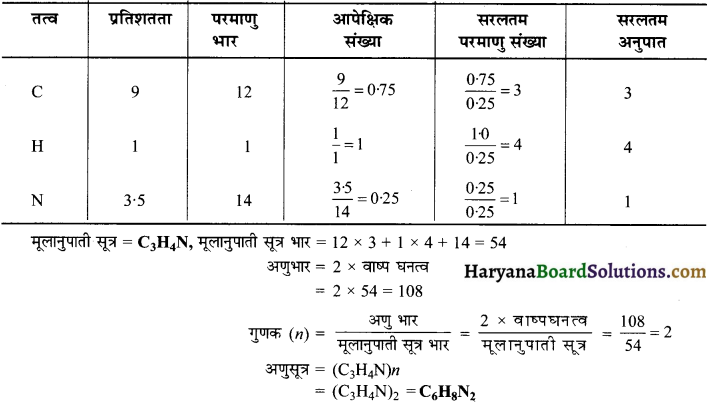
प्रश्न 63.
एक यौगिक का विश्लेषण करने पर प्रतिशत रचना निम्न प्रकार है।
C = 54.5%, H = 9.9%, O = 36.41%
यदि इस यौगिक का वाष्प घनत्व 44.1 हो तो अणुसूत्र निकालिए।
हल:
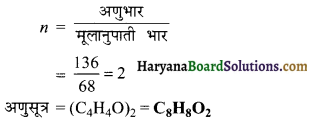
| तत्व | प्रतिशतता | परमाणु द्रव्यमान | आपेक्षिक संख्या | सरलतम परमाणु संख्या | सरलतम पूर्ण अनुपात |
| C | 54.5 | 12 | \(\frac {45.6 }{ 12 }\) = 4.5411 | \(\frac { 4.541 }{ 2.275 }\) = 2 | 2 |
| H | 9.9 | 1 | \(\frac { 99 }{ 1 }\) = 99 | \(\frac { 9.9 }{ 2.275 }\) = 4 | 4 |
| O | 36.41 | 16 | \(\frac { 36.41 }{ 16 }\) = 2.275 | \(\frac { 2.275 }{ 2.275 }\) = 1 | 1 |

प्रश्न 64.
5.325 ग्राम कार्बनिक यौगिक का अध्ययन करने पर पाया गया कि उसमें 3.758 ग्राम कार्बन, 0.316 ग्राम हाइड्रोजन तथा 1.251 ग्राम ऑक्सीजन है। इस यौगिक का मूलानुपाती सूत्र व अणुसूत्र ज्ञात करो यदि इसका वाष्प घनत्व 68 हो।
हल:
यौगिक का द्रव्यमान = 5.325
ग्राम कार्बन का द्रव्यमान = 3.758 ग्राम
हाइड्रोजन का द्रव्यमान = 0.316 ग्राम
ऑक्सीजन का द्रव्यमान = 1.251 ग्राम
कार्बन की प्रतिशतता = \(\frac { 3.758 }{ 5.325 }\) × 100 = 70.57%
हाइड्रोजन की प्रतिशतता = \(\frac { 0.316 }{ 5.325 }\) = 5.93%
ऑक्सीजन की प्रतिशतता = \(\frac { 1.251 }{ 5.325 }\) x 100 = 23.50%
| तत्व | प्रतिशतता | परमाणु द्रव्यमान | आपेक्षिक संख्या | सरलतम परमाणु संख्या | सरलतम पूर्ण अनुपात |
| C | 70.57 | 12 | 70.57/ 12 = 5.88 | \(\frac { 5.88 }{ 1.47 }\) = 4 | 4 |
| H | 5.93 | 1 | 5.93/1 = 5.93 | \(\frac { 5.93 }{ 1.47 }\) = 4 | 4 |
| O | 23.50 | 16 | 23.50/16 = 1.47 | \(\frac { 1.47 }{ 1.47 }\) = 1 | 1 |
यौगिक का मूलानुपाती सूत्र = CHO
मूलानुपाती सूत्र का अणुभार = (4 x 12) + (4 × 1) + 16 = 68
यौगिक का अणुभार = 2 x वाष्प घनत्व = 2 × 68 = 136
यौगिक का अणुसूत्र = (मूलानुपाती सूत्र)n
प्रश्न 65.
50g नाइट्रोजन और 8g हाइड्रोजन को मिला कर NH3(g) प्राप्त की गई है। सीमान्त अभिकर्मक कौन सा है? बनी हुई NH3 की मात्रा की गणना कीजिए।
हल:
अभिक्रिया की संतुलित समीकरण निम्न है-

समीकरण के अनुसार,
1.786 मोल N2 से क्रिया करने वाले H2 के मोलों की संख्या
= \(\frac { 3 }{ 1 }\) × 1.786 = 5.358 मोल
परन्तु H2 के उपस्थित मोल = 4
इसलिये सम्पूर्ण H2(g) अभिक्रिया में भाग लेगी अतः H2 सीमान्त अभिकर्मक है।
बनने वाली NH3
3 मोल H2 से बनी NH3 = 2 मोल
4 मोल H2 से बनी अमोनिया = \(\frac { 2 }{ 3 }\) × 4 मोल = 2.66 मोल
2.66 मोल = 2.66 × 17 = 45.22g
प्रश्न 66.
3.0g H2 व 30.0g O2 क्रिया करके जल बनाती है। इसमें सीमान्त अभिकर्मक क्या है? बनने वाले जल की मात्रा क्या होगी? एवं इसमें उस अभिकर्मक की मात्रा ज्ञात करें जो कि अनाभिकृत रह जाता है।
हल:
अभिक्रिया निम्न प्रकार होगी –
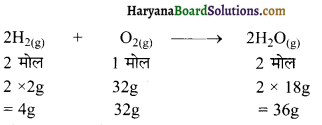
सीमान्त अभिकर्मक के लिये,
4g H2 क्रिया करती है = 32g O2 से
3g H2 क्रिया करेगी = \(\frac { 32×3 }{ 4 }\)
= 24g O2 से
परन्तु प्रश्न के अनुसार 30g O2 है अर्थात् O2 की मात्रा अधिक है।
यहाँ सीमान्त अभिकर्मक H2 है।
4g H2 से बनता है = 36g H2O
3g H2 से बनेगा = \(\frac { 36×3 }{ 4 }\)g H2O
= 27g H2O
चूँकि हम जानते हैं कि 3g H, क्रिया करती है 24g ऑक्सीजन से परन्तु प्रश्न के अनुसार 30g ऑक्सीजन है।
अत: O की शेष मात्रा 30 – 24 = 6g
प्रश्न 67.
1.0g Mg का एक बंद पात्र में दहन किया जाता है, जिसमें 0.5 g O2 उपस्थित है। सीमान्त अभिकर्मक क्या है ? तथा MgO अभिक्रिया में कितनी मात्रा में बनता है।
हल:
सन्तुलित अभिक्रिया निम्न प्रकार है.

सीमान्त अभिकर्मक का निर्धारण
48g Mg क्रिया करता है = 32 g O2 से
1g Mg क्रिया करता है = \(\frac { 32 }{ 48 }\) = 0.67g O2 से
परन्तु प्रश्नानुसार O2 की मात्रा = 0.5g
चूँकि उपलब्ध O2, आवश्यकता से कम है, अतः O2 एक सीमान्त अभिकर्मक है।
MgO की मात्रा का निर्धारण
32 g O2 मैग्नीशियम से क्रिया करके बनाती है = 80g MgO
∴ 0.5 g O2 मैग्नीशियम से क्रिया करके बनाती है।
= \(\frac { 80×0.5 }{ 32 }\)
= 1.25g MgO
प्रश्न 68.
एक लवण का अणुभार 40g mol-1 है। लवण की 4 ग्राम मात्रा 250 ग्राम जल में घोली गयी है, विलयन की मोललता बताएँ।
हल:
विलेय का अणुभार ‘MB‘ = 40g mol-1
विलेय का भार ‘WB‘ = 4 g
विलायक का भार ‘WA‘ = 250 g
मोललता (m) = \(\frac{\mathrm{W}_{\mathrm{B}} \times 1000}{\mathrm{M}_{\mathrm{B}} \times \mathrm{W}_{\mathrm{A}}}\)
= \(\frac{4 \times 1000}{40 \times 250}\)
= 0.4 मोल/ किग्रा.
प्रश्न 69.
यदि 10g ऑक्सेलिक अम्ल को 500ml विलयन (घनत्व = 1.1 g ml-1) में घोला जाए तो विलयन में ऑक्सलिक अम्ल का द्रव्यमान प्रतिशत क्या होगा?
हल:
विलेय का भार ‘WB‘ = 10 g
विलेय का घनत्व ‘d’ = 1.1 g/ml
विलयन का द्रव्यमान = आयतन x घनत्व = 500 x 1.1 = 550 g

प्रश्न 70.
सल्फ्यूरिक अम्ल के 49% (भार प्रतिशत) विलयन का घनत्व 1.109 ग्राम / मिली है विलयन की मोललता एवं मोलरता ज्ञात कीजिए।
हल:
49% (भार प्रतिशत) का अर्थ है कि 49 ग्राम विलेय 100 ग्राम विलयन में उपस्थित है।
विलेय का भार ‘WB‘ = 49g
विलायक का भार ‘WB‘ = 100 – 49 = 51 g
विलेय का अणुभार ‘MB‘ = 98g mol-1 (सल्फ्यूरिक अम्ल )
मोलरता
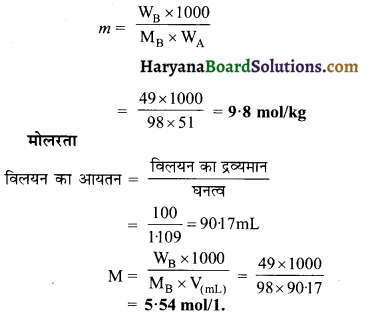
प्रश्न 71.
80 ग्राम जल तथा 90 ग्राम मेथिल ऐल्कोहॉल के मिश्रण में दोनों के मोल प्रभाज ज्ञात कीजिए।
हल:
जल का भार ‘WA‘ = 80g
जल का अणुभार ‘MA‘ = 18 g/mol
मैथिल ऐल्कोहॉल का भार ‘WB‘ = 90g
मेथिल ऐल्कोहॉल का अणुभार ‘MB‘ = 32g/mol
मेथिल ऐल्कोहॉल के मोल प्रभाज

प्रश्न 72.
सुक्रोज के विलयन का भार 214.2g है। इसमें 34.2g सुक्रोज घुला हुआ है। सुक्रोज की मोललता की गणना कीजिए।
हल:
सुक्रोज का भार ‘WB‘ = 34.2 g
जल का भार ‘WA‘ = विलयन का भार – विलेय का भार
= 214.2 – 34.2 = 180 g
सुक्रोज (C12H22O11) का मोलर द्रव्यमान
= 12 × 12 + 1 x 22 + 16 × 11
= 342g/mol
मोललता (‘m’) = \(\frac{\mathrm{W}_{\mathrm{B}} \times 1000}{\mathrm{M}_{\mathrm{B}} \times \mathrm{W}_{\mathrm{A}}}\)
= \(\frac{34.2 \times 1000}{342 \times 180}\)
= 0.55 m
प्रश्न 73.
5.85g सोडियम क्लोराइड को 500g जल में विलेय किया गया। प्राप्त विलयन की मोललता बताएँ।
हल:
विलेय का भार ‘WB‘ = 5.85g
विलेय का अणुभार ‘MB‘ = 2335.5
= 58.5g/mol
विलायक का भार ‘WA‘ = 500g
मोललता (m) = \(\frac{\mathrm{W}_{\mathrm{B}} \times 1000}{\mathrm{M}_{\mathrm{B}} \times \mathrm{W}_{\mathrm{A}}}\)
= \(\frac{5.85 \times 1000}{58.5 \times 500}\)
= 0.2 mol/kg
प्रश्न 74.
एथिलीन ग्लाइकॉल (C2H6O2) के मोल प्रभाज की गणना करो यदि विलयन में C2H6O2 का 20% द्रव्यमान उपस्थित हो।
हल:
20% C2H6O2 का मतलब है कि,
20g C2H6O2 100g विलयन में उपस्थित है।
अतः विलेय का भार WB = 20g
विलायक का भार WA = 100 – 20 = 80g
विलेय का मोलर द्रव्यमान MB
= 2 × 12 + 6 × 1 + 2 × 16 = 62g/mol
विलायक का मोलर द्रव्यमान

जल का मोल प्रभाज. = 1 – x(माइकल)
= 1 – 0.068 = 0.932
उत्तर-ग्लाइकॉल का मोल प्रभाज = 0.068
जल का मोल प्रभाज = 0.932
प्रश्न 75.
उस विलयन की मोलरता की गणना कीजिए। जिसमें 5g NaOH 450ml विलयन में घुला हुआ है।
हल:
विलेय का भार WB = 5g
विलेय का मोलर द्रव्यमान = MB = 40g/mol
विलयन का आयतन V = 450ml
मोलरता M = ?
M = \(\frac{W_B \times 1000}{40 \times 450}\)
= \(\frac{5 \times 1000}{40 \times 450}\)
= 0.278 mol/L
उत्तर. दिये गये विलयन की मोलरता 0.278 mol/ L है।
प्रश्न 76.
निम्नलिखित अभिक्रिया के लिए रासायनिक समीकरण लिखिए तथा इसे जाँच तथा भूल विधि द्वारा सन्तुलित कीजिए-
मैग्नीशियम नाइट्राइड + जल → मैग्नीशियम हाइड्रॉक्साइड + अमोनिया
हल:
अभिक्रिया के लिए रासायनिक समीकरण निम्नवत् है
Mg3N2 + H2O → Mg(OH)2 + NH3
समीकरण को निम्नलिखित पदों में सन्तुलित किया जा सकता है
(i) Mg परमाणुओं को सन्तुलित करना
Mg3N2 + H2O → 3Mg(OH)2 + NH3
(ii) N परमाणुओं को सन्तुलित करना
Mg3N2 + H2O → 3Mg(OH)2 + 2NH3
(iii) O परमाणुओं को सन्तुलित करना
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
जाँच करने पर ज्ञात होता है कि H परमाणु पहले से ही सन्तुलित है अतः पूर्णतया सन्तुलित समीकरण निम्नवत् है-
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3↑
प्रश्न 77.
100 किलो 90 प्रतिशत शुद्ध चूने के पत्थर (CaCO3) को गर्म करने पर प्राप्त CaO का द्रव्यमान ज्ञात करो ?
हल:
CaCO3 → CaO + CO2
CaCO3 का मोलर द्रव्यमान = 100g
90 प्रतिशत शुद्धता = 100kg CaCO3 में 90 kg शुद्ध CaCO3 उपस्थित है।
100kg CaCO3 में शुद्ध पदार्थ = 90kg
अभिक्रिया के अनुसार,

अतः समीकरण के अनुसार
100g CaCO3 से CaO बनता है = 56g
या 100kg CaCO3 से CaO बनेगा = 56kg
अत: 90kg CaCO3 से CaO बनेगा = \(\frac { 56 }{ 100 }\) x 90
= 50.4 kg