Haryana State Board HBSE 11th Class Chemistry Important Questions Chapter 9 हाइड्रोजन Important Questions and Answers.
Haryana Board 11th Class Chemistry Important Questions Chapter 9 हाइड्रोजन
बहुविकल्पीय प्रश्न:
1. हाइड्रोजन के लिए कौन-सा उपयुक्त है-
(1) एक अपचायक
(2) एक ऑक्सीकारक
(3) ऑक्सीकारक तथा अपचायक दोनों ही
(4) न तो ऑक्सीकारक न ही अपचायक ।
उत्तर:
(3) ऑक्सीकारक तथा अपचायक दोनों ही
2. निम्न में से कौन सी धातु तनु हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया करके हाइड्रोजन उत्पन्न नहीं करती-
(1) जिंक
(2) कॉपर
(3) लोहा
(4) मैग्नीशियम ।
उत्तर:
(2) कॉपर
3. हाइड्रोजन अपचयित नहीं करता-
(1) गरम क्यूप्रिक ऑक्साइड को
(2) गरम फैरिक ऑक्साइड को
(3) गरम स्टैनिक ऑक्साइड को
(4) गरम एल्यूमिनियम ऑक्साइड को ।
उत्तर:
(4) गरम एल्यूमिनियम ऑक्साइड को ।
4. हाइड्रोजन के नाभिकीय अपररूप है-
(1) ऑर्थो
(2) पैरा
(3) ऑर्थो व पैरा दोनों
(4) उपरोक्त में से कोई नहीं
उत्तर:
(3) ऑर्थो व पैरा दोनों
5. हाइड्रोजन अपने यौगिकों में ऑक्सीकरण संख्या को प्रदर्शित करता है-
(1) केवल – 1
(2) केवल जीरो
(3) + 1, 1 और जीरो
(4) केवल + 1
उत्तर:
(3) + 1, 1 और जीरो
6. निम्न में से कौन-सी अभिक्रिया करके हाइड्रोजन गैस को उत्पन्न नहीं करता-
(1) Fe तथा जलीय H2SO4
(2) Cu तथा जलीय HCl
(3) सोडियम तथा एथिल एल्कोहॉल
(4) आयरन तथा भाप ।
उत्तर:
(2) Cu तथा जलीय HCl
7. रॉकेट के लिये निम्न में से कौन प्रोपेलेण्ट के रूप में प्रयोग किया जा सकता है-
(1) द्रव ऑक्सीजन + द्रव ऑर्गन
(2) द्रव हाइड्रोजन + द्रव ऑक्सीजन
(3) द्रव नाइट्रोजन + द्रव ऑक्सीजन
(4) द्रव हाइड्रोजन + द्रव नाइट्रोजन ।
उत्तर:
(2) द्रव हाइड्रोजन + द्रव ऑक्सीजन
8. भारी जल तैयार कर सकते हैं-
(1) जल के प्रभाजी आसवन द्वारा
(2) \({ }_1^1 \mathrm{H}\) तथा \({ }_2^1 \mathrm{H}\) के रासायनिक विनिमय द्वारा
(3) क्षारीयकृत जल के विद्युत अपघटन द्वारा
(4) उपरोक्त सभी विधियों द्वारा ।
उत्तर:
(4) उपरोक्त सभी विधियों द्वारा ।
![]()
9. एक ड्यूटीरियम में पाये जाते हैं-
(1) एक न्यूट्रॉन तथा एक प्रोटॉन
(2) एक पॉजीट्रॉन तथा एक न्यूट्रॉन
(3) दो प्रोटॉन तथा एक न्यूट्रॉन
(4) एक प्रोटॉन तथा दो न्यूट्रॉन ।
उत्तर:
(1) एक न्यूट्रॉन तथा एक प्रोटॉन
10. भारी जल जम जाता है-
(1)-3.8°C पर
(2) 3.8°C पर
(3) 0°C पर
(4) 3.2°C पर ।
उत्तर:
(2) 3.8°C पर
11. हाइड्रोजन परमाणु का आयनीकरण करने पर प्राप्त होता है-
(1) हाइड्राइड आयन
(2) हाइड्रोनियम आयन
(3) प्रोटॉन
(4) हाइड्रॉक्सिल आयन ।
उत्तर:
(3) प्रोटॉन
12. सबसे हल्का तत्व है-
(1) हाइड्रोजन
(2) हीलियम
(3) निऑन
(4) ऑर्गन ।
उत्तर:
(1) हाइड्रोजन
13. ट्राइटियम में न्यूट्रॉनों की संख्या है-
(1) 1
(2) 2
(3) 3
(4) 4
उत्तर:
(2) 2
14. भारत में भारी जल का निर्माण होता है-
(1) दिल्ली में
(3) भिलाई में
(2) मुम्बई में
(4) नांगल में।
उत्तर:
(4) नांगल में।
15. ट्राइटियम प्राप्त किया जा सकता है-
(1) नाभिकीय अभिक्रिया द्वारा
(2) गर्म C पर वाष्प प्रवाह द्वारा
(3) Al पर NaOH की क्रिया द्वारा
(4) Zn पर H2SO4 की क्रिया द्वारा ।
उत्तर:
(1) नाभिकीय अभिक्रिया द्वारा
16. हीलियम प्राप्त करने के लिये हाइड्रोजन का संलयन किया जा सकता है-
(1) उच्च ताप तथा उच्च दाब पर
(2) उच्च ताप तथा निम्न दाब पर
(3) निम्न ताप तथा उच्च दाब पर
(4) निम्न ताप तथा निम्न दाब पर ।
उत्तर:
(1) उच्च ताप तथा उच्च दाब पर
17. किस पर तनु H2SO4 की क्रिया द्वारा हाइड्रोजन बनायी जा सकती है-
(1) जिंक
(2) हीलियम
(3) कॉपर
(4) मरकरी ।
उत्तर:
(1) जिंक
18. हाइड्रोजन प्राप्त नहीं होती है जब जिंक क्रिया करता है-
(1) ठण्डे जल से
(2) तनु H2SO4 से
(3) तनु HCl से
(4) गर्म NaOH (20%) से ।
उत्तर:
(1) ठण्डे जल से
19. हाइड्रोजन का रेडियो एक्टिव समस्थानिक होता है-
(1) 1H1
(2) 1H2
(3) 1H3
(4) इनमें से कोई नहीं ।
उत्तर:
(3) 1H3
20. प्लेटिनम द्वारा हाइड्रोजन का अधिशोषण कहलाता है-
(1) अपचयन
(2) रुकावट
(3) हाइड्रोजनीकरण
(4) विहाइड्रोजनीकरण ।
उत्तर:
(2) रुकावट
21. औद्योगिक हाइड्रोजन का निर्माण होता है-
(1) मार्श गैस से
(2) तेल गैस से
(3) प्रोड्यूसर गैस से
(4) कोयला गैस से ।
उत्तर:
(1) मार्श गैस से
22. जल का परीक्षण करते हैं-
(1) गन्ध से
(2) स्वाद से
(3) जलीय CuSO4 से
(4) निर्जलीय COCl3 से जो कि नीले रंग से गुलाबी रंग में बदल जाता है।
उत्तर:
(4) निर्जलीय COCl3 से जो कि नीले रंग से गुलाबी रंग में बदल जाता है।
![]()
23. H– (हाइड्राइड) आयन, OH– आयन से प्रबल क्षारीय है। निम्न में से कौन सी अभिक्रिया होती जब NaH को जल में घोला जायेगा-
(1) H–(aq) + H2O(l) → H3O+(aq)
(2) H–(aq) + H2O(l) → OH–(aq) + H2
(3) H–(aq) + H2O(l) → कोई अभिक्रिया नहीं
(4) उपरोक्त में से कोई नहीं ।
उत्तर:
(2) H–(aq) + H2O(l) → OH–(aq) + H2
24. निम्न में से कौन-सा हाइड्राइड अरससमीकरणमितीय प्रकृति का होता है-
(1) आयनिक हाइड्राइड
(2) आण्विक हाइड्राइड
(3) धात्विक हाइड्राइड
(4) उपरोक्त सभी।
उत्तर:
(3) धात्विक हाइड्राइड
25. जल की अस्थायी कठोरता, जो कि कैल्शियम बाइकार्बोनेट की वजह से होती है, को दूर किया जाता है। जब हम मिलाते हैं-
(1) CaCO3
(2) CaCl2
(3) Ca(OH)2
(4) HCl
उत्तर:
(2) CaCl2
26. कैलगॉन विधि में प्रयोग करते हैं-
(1) सोडियम पोली मैटा फॉस्फेट
(2) जलीय सोडियम एल्यूमिनियम सिलिकेट
(3) धनायन विनिमयक रेजिन
(4) ऋणायन विनिमयक रेजिन ।
उत्तर:
(1) सोडियम पोली मैटा फॉस्फेट
27. जल का क्रान्तिक ताप ऑक्सीजन से ज्यादा होता है क्योंकि जल के अणुओं में होता है-
(1) ऑक्सीजन से कम इलेक्ट्रॉन
(2) दो सह-संयोजक बन्ध
(3) V – आकार
(4) द्विध्रुव आघूर्ण ।
उत्तर:
(4) द्विध्रुव आघूर्ण ।
28. पॉली फॉस्फेट को जल के मृदुलीकरण में प्रयोग करते हैं क्योंकि वे –
(1) ऋणायन के साथ घुलनशील यौगिक बनाते हैं
(2) ऋणायन को अवक्षेपित करते हैं।
(3) धनायन के साथ घुलनशील यौगिक बनाते हैं
(4) धनायन को अवक्षेपित करते हैं।
उत्तर:
(3) धनायन के साथ घुलनशील यौगिक बनाते हैं
29. निम्न में से कौन-सा यौगिक जल की कठोरता ज्ञात करने में प्रयुक्त होता है-
(1) ऑक्सेलिक अम्ल
(2) EDTA
(3) सोडियम सिट्रेट
(4) सोडियम थायो सल्फेट ।
उत्तर:
(2) EDTA
30. भार की दृष्टि से हाइड्रोजन की H2O2 में प्रतिशत मात्रा है-
(1) 5.88
(2) 6.25
(3)25
(4) 50
उत्तर:
(1) 5.88
31. निम्न में से किस अभिक्रिया में H2O2 अपचायक का कार्य करता- है-
(1) PbO2 + H2O2 → PbO + H2O + O2
(2) Na2SO3 + H2O2 → Na2SO4 + H2O
(3) 2KI + H2O2 → 2KOH + I2
(4) KNO2 + H2O2 → KNO3 + H2O.
उत्तर:
(1) PbO2 + H2O2 → PbO + H2O + O2
32. H2SO4 से अम्लीय KMnO4 के विलयन में जब H2O2 मिलायी जाती है-
(1) केवल जल बनता है
(2) ऑक्सीकारक का कार्य करती है।
(3) अपचायक का कार्य करती है।
(4) H2SO4 को अपचयित करती है
उत्तर:
(3) अपचायक का कार्य करती है।
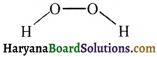
33. H2O2 की साम्य अणुक संरचना है-
(1) तलीय जैसी नीचे दी गयी है।
IMG
(2) रेखीय
(3) चतुष्फलकीय
(4) तलीय जैसी नीचे दी गयी है।
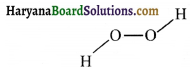
उत्तर:
(1) तलीय जैसी नीचे दी गयी है।
34. H2O2 एक काले पदार्थ X को सफेद पदार्थ में परिवर्तित कर देती है। X है-
(1) ZnS
(2) PbS
(3) CuS
(4) NiS
उत्तर:
(2) PbS
![]()
35. H2O2 का ऑक्सीजन परमाणु जो ऑक्सीकरण के लिये प्रयुक्त किया जाता है, जुड़ा रहता है-
(1) आयनिक बन्ध द्वारा
(2) सहसंयोजक बन्ध द्वारा
(3) हाइड्रोजन बन्ध द्वारा
(4) उप-सहसंयोजक बन्ध द्वारा ।
उत्तर:
(2) सहसंयोजक बन्ध द्वारा
36. दो समीकरणों का संज्ञान लीजिए ।
(x) H2O2 + 2HI → I2 ↑ + 2H2O
(y) H2O2 + O3 → 2O2 ↑ + H2O
H2O2 है।
(1) आयनिक बन्ध द्वारा
(2) सहसंयोजक बन्ध द्वारा
(3) हाइड्रोजन बन्ध द्वारा
(4) उप-सहसंयोजक बन्ध द्वारा ।
उत्तर:
(2) सहसंयोजक बन्ध द्वारा
37. ऑक्साइड जो तनु अम्ल से क्रिया करके H2O H2 देता है-
(1) PbO2
(2) MnO2
(2) Na2O2
(3) TiO2
उत्तर:
(2) MnO2
38. अभिक्रिया H2S + H2O2 → S + 2H2O दर्शाती है-
(1) H2O2 का अम्लीय गुण
(2) H2O2 का क्षारीय गुण
(3) H2O2 का ऑक्सीकारक गुण
(4) H2O2 का अपचायक गुण ।
उत्तर:
(3) H2O2 का ऑक्सीकारक गुण
39. H2O2 में ऑक्सीजन की ऑक्सीकरण संख्या है-
(1) -2
(2) -1
(3) +1
(4) +2.
उत्तर:
(2) -1
40. भारी जल में कैल्शियम कार्बाइड जब क्रिया करता है तो क्या बनता है-
(1) C2D2
(2) CaD2
(3) Ca2D2O
(4) CD2
उत्तर:
(1) C2D2
41. परमाणु रियेक्टर में भारी जल उपयोग में लाया जाता है-
(1) शीतलक के रूप में
(2) मन्दक के रूप में
(3) दोनों शीतलक तथा मन्दक के रूप में
(4) न उपरोक्त में से कोई नहीं
उत्तर:
(2) मन्दक के रूप में
42. भारी जल है-
(1) H2O18
(2) बार-बार आसवन से प्राप्त जल
(3) D2O
(4) 4°C ताप पर जल ।
उत्तर:
(3) D2O
43. D2O का अधिकता से प्रयोग किया जाता है-
(1) रसायन उद्योग में
(2) नाभिकीय रिएक्टर में
(3) दवाई बनाने में
(4) कीटाणुनाशको के निर्माण में ।
उत्तर:
(2) नाभिकीय रिएक्टर में
44. भारी जल तैयार किया जाता है-
(1) जल के प्रभाजी आसवन द्वारा
(2) \({ }_1^1 \mathrm{H}\) तथा \({ }_2^1 \mathrm{H}\) के रासायनिक विनिमय द्वारा
(3) क्षारीयकृत जल के विद्युत अपघटन द्वारा
(4) उपरोक्त सभी विधियों से ।
उत्तर:
(4) उपरोक्त सभी विधियों से ।
45. लीथियम- 6 पर न्यूट्रॉनों की बमबारी कराने पर हीलियम – 4 और (x) बनता है। (x) है-
(1) H
(2) D
(3) T
(4) Be.
उत्तर:
(3) T
46. भारी जल का अणुभार क्या है-
(1) 10
(2) 18
(3) 20
(4) 22
उत्तर:
(3) 20
47. जल का उच्चतम घनत्व का ताप 4°C है। भारी जल का उच्चतम घनत्व का ताप क्या है-
(1 ) 8.1°C
(2) 6.1°C
(3) 9.3°C
(4) 11.2°C
उत्तर:
(4) 11.2°C
48. भारी जल की खोज किसके द्वारा हुई –
(1) लुई और मैक्डोनाल्ड
(2) यूरे और वाशबर्न
(3) टेलर, आइरिंग और फ्रॉस्ट
(4) बर्ग और मैन्जल
उत्तर:
(2) यूरे और वाशबर्न
49. गलित कैल्सियम हाइड्राइड का विद्युत अपघटन करने पर क्या होता है-
(1) हाइड्रोजन कैथोड पर मुक्त होती है।
(2) हाइड्रोजन ऐनोड पर मुक्त होती है।
(3) हाइड्रोजन कैथोड व ऐनोड दोनों पर मुक्त होती हैं
(4) हाइड्रोजन मुक्त नहीं होती ।
उत्तर:
(2) हाइड्रोजन ऐनोड पर मुक्त होती है।
50. ट्राइटियम एक बीटा-उत्सर्जक है। इसकी अर्द्ध- आयु 12.4 वर्ष है। ट्राइटियम के विघटन से क्या बनता है-
(1) ड्यूटीरियम
(2) हीलियम-3
(3) हीलियम-4
(4) हाइड्रोजन
उत्तर:
(2) हीलियम-3
![]()
51. ड्यूटीरियम के खोजकर्ता कौन हैं ?
(1) बर्ग और मैन्जल
(2) मोस्ले
(3) लुई और मैक्डोनाल्ड
(4) यूरे
उत्तर:
(4) यूरे
52. निम्न में से कौन-सा पदार्थ जल में स्थायी कठोरता उत्पन्न करता है-
(1) NaCl
(2) NaHCO3
(3) K2SO4
(4) Mg(NO3)2
उत्तर:
(4) Mg(NO3)2
53. \(\mathrm{NaOCl}+\mathrm{H}_2 \mathrm{O}_2 \longrightarrow \mathrm{NaCl}+\mathrm{O}_2+\mathrm{H}_2 \mathrm{O}\)
इस अभिक्रिया में H2O2 अणु-
(1) इलेक्ट्रॉन लेता है
(2) इलेक्ट्रॉन देता है
(3) इलेक्ट्रॉन लेता भी है तथा देता भी है
(4) इलेक्ट्रॉन न लेता है और न देता है।
उत्तर:
(2) इलेक्ट्रॉन देता है
54. हाइड्रोजन परॉक्साइड का उपयोग पुराने तेल चित्रों का सफेद रंग काला पड़ जाने पर उसको पुनः सफेद करने में होता है। यह निम्न अभिक्रिया पर आधारित है-
(1) Ag2O + H2O2 → 2Ag + H2O + O2
(2) PbO2 + H2O2 → PbO + H2O + O2
(3) PbS + 4H2O2 → PbSO4 + 4H2O
(4) H2S + H2O2 → S + 2H2O
उत्तर:
(3) PbS + 4H2O2 → PbSO4 + 4H2O
55. निम्न में किस क्रिया में H2O2 ऑक्सीकरण के रूप में कार्य करता है ?
(1 ) I2 + H2O2 → 2HI + O2
(2) 2FeCl3 + H2O2 → 2FeCl2 + 2HC1 + O2
(3) PbO2 + H2O2 → PbO + H2O + O2
(4) Ag2O + H2O2 → 2Ag + H2O + O2
उत्तर:
(2) 2FeCl3 + H2O2 → 2FeCl2 + 2HC1 + O2
56. भारी पानी को पीने में प्रयुक्त नहीं करते हैं क्योंकि-
(1) यह विषैला होता है
(2) यह महँगा होता है
(3) इसकी शरीर क्रियात्मक क्रिया साधारण जल से भिन्न होती है
(4) इसके रासायनिक गुण साधारण जल से भिन्न होते हैं।
उत्तर:
(3) इसकी शरीर क्रियात्मक क्रिया साधारण जल से भिन्न होती है
57. सोडियम हाइपोक्लोराइट H2O2 से अभिक्रिया करके बनाता है-
(1 ) NaCl
(2) H2O
(3)O2
(4) उपरोक्त सभी।
उत्तर:
(4) उपरोक्त सभी।
58. जल का क्रान्तिक ताप O2 से अधिक है क्योंकि जल के अणु में-
(1) O2 की तुलना में कम इलेक्ट्रॉन हैं
(2) दो सहसंयोजक आबन्ध हैं
(3) आकृति V आकार की है
(4) द्विध्रुव आघूर्ण होता है ।
उत्तर:
(4) द्विध्रुव आघूर्ण होता है ।
59. साधारण हाइड्रोजन का परमाण्वीय हाइड्रोजन में परिवर्तन होता है-
(1) नाभिकीय अभिक्रिया
(2) एक ऊष्माशोषी अभिक्रिया
(3) एक ऊष्माक्षेपी अभिक्रिया
(4) एक विघटन अभिक्रिया ।
उत्तर:
(2) एक ऊष्माशोषी अभिक्रिया
60. HCl से H2 निम्न में किसकी क्रिया द्वारा उत्पन्न होती है-
(1) Cu
(2) Mg
(3) P
(4) Hg
उत्तर:
(2) Mg
61. वह ऑक्साइड जो तनु अम्ल से अभिक्रिया करके H2O2 देता है-
(1) PbO2
(2) Na2O2
(3) MnO2
(4) TiO2
उत्तर:
(2) Na2O2
62. \(\mathrm{H}_2 \mathrm{O}_2 \longrightarrow 2 \mathrm{H}^{+}+\mathrm{O}_2+2 e^{-}, \mathrm{E}^0=-0 \cdot 68 \mathrm{~V}\) उपरोक्त अभिक्रिया H2O2 के किस व्यवहार को निरूपित करती है-
(1) अपचायक
(3) अम्लीय
(2) ऑक्सीकारक
(4) उत्प्रेरक ।
उत्तर:
(1) अपचायक
![]()
63. क्रोमिक अम्ल के अम्लीय विलयन को H2O2 के साथ क्रिया कराने पर प्राप्त होता है-
(1) CrO2 + H2O + O2
(2) Cr2O3 + H2O + O2
(3) CrO5 + H2O
(4) H2Cr2O + H2O + O2
उत्तर:
(3) CrO5 + H2O
64. भारी जल को भारी कहा जाता है, क्योंकि –
(1) इसमें हाइड्रोजन का भारी समस्थानिक होता है
(2) यह ड्यूटीरियम का ऑक्साइड है
(3) इसके घनत्व साधारण जल से ज्यादा हैं।
(4) इसमें से भारी दुर्गन्ध आती है।
उत्तर:
(2) यह ड्यूटीरियम का ऑक्साइड है
65. कैलेगॉन का सूत्र है-
(1) Na4[Na2(PO4)6]
(2) Na2[Na4(PO3)6]
(3) Na4[Na2(PO3)6]
(4) Na2[Na4(PO4)6]
उत्तर:
(2) Na2[Na4(PO3)6]
66. निम्न में से कौन-सा यौगिक हाइड्रोजन द्वारा द्रव अवस्था से ठोस अवस्था में बदलता है-
(1) ग्लिसरॉल
(2) तेल
(3) ऐसिटिलीन
(4) इथाइलीन ।
उत्तर:
(2) तेल
67. सबसे अधिक क्रियाशील है-
(1) नवजात हाइड्रोजन
(2) साधारण हाइड्रोजन
(3) भारी हाइड्रोजन
(4) ऑर्थो हाइड्रोजन ।
उत्तर:
(1) नवजात हाइड्रोजन
अति लघु उत्तरीय प्रश्न:
प्रश्न 1.
हाइड्रोजन का नामकरण किस वैज्ञानिक ने किया ?
उत्तर:
हाइड्रोजन का नामकरण लेवोशिए ने किया।
प्रश्न 2.
हाइड्रोजन के एक अणु में कितने परमाणु होते हैं ?
उत्तर:
हाइड्रोजन के एक अणु में हाइड्रोजन के दो परमाणु होते हैं।
प्रश्न 3.
हाइड्रोजन को हवा में जलाने से कौन-सा पदार्थ प्राप्त होता है ?
उत्तर:
हाइड्रोजन को हवा में जलाने से जल (H2O) प्राप्त होता है।
प्रश्न 4. हाइड्रोजन गैस प्राप्त करने के दो मुख्य स्रोतों के नाम लिखिए।
उत्तर:
डाइहाइड्रोजन प्राप्त करने के दो मुख्य स्रोत जल तथा अम्ल हैं।
प्रश्न 5.
जल के विद्युत् अपघटन से ऋणोद पर एकत्र होने वाली गैस का नाम लिखिए।
उत्तर:
जल के विद्युत् अपघटन से ऋणोद पर डाइहाइड्रोजन गैस (H2) एकत्रित होती है।
प्रश्न 6.
वनस्पति तेलों का हाइड्रोजनीकरण किस उत्प्रेरक की उपस्थिति में होता है ?
उत्तर:
वनस्पति तेलों का हाइड्रोजनीकरण निकिल ( बारीक चूर्ण) उत्प्रेरक की उपस्थिति में होता है।
प्रश्न 7.
हाइड्रोजन के रेडियोऐक्टिव समस्थानिक का नाम बताइए।
उत्तर:
ट्राइटियम (1H3) रेडियोऐक्टिव है।
प्रश्न 8.
कक्ष-ताप पर डाइहाइड्रोजन अन्य पदार्थों से मन्द दर पर अभिक्रिया क्यों करती है ?
उत्तर:
डाइहाइड्रोजन की बंन्ध वियोजन ऊर्जा अत्यन्त उच्च (436 kJ mol-1) होती है जिस कारण यह अन्य पदार्थों से मन्द दर पर अभिक्रिया करती है।
प्रश्न 9.
हाइड्रोजन के कौन-से समस्थानिक का प्रयोग नाभिकीय रिऐक्टर में किया जाता है ?
उत्तर:
ड्यूटीरियम (D) का प्रयोग नाभिकीय रिएक्टर में किया ‘जाता है।
प्रश्न 10.
जब सोडियम हाइड्राइड विद्युत्-अपघटित होता है तो डाइहाइड्रोजन कौन से इलेक्ट्रोड पर मुक्त होती है ?
उत्तर:
डाइहाइड्रोजन ऐनोड पर मुक्त होती है; इसे निम्न प्रकार दर्शाया जा सकता है-

ऐनोड पर : 2H– – 2e– → H2(g)
प्रश्न 11.
हाइड्रोजन अणु उच्च ध्रुवी क्यों होता है ?
उत्तर:
अपने लघु आकार तथा उच्च विद्युत ऋणात्मकता के कारण हाइड्रोजन अणु उच्च ध्रुवी होता है।
प्रश्न 12.
शुद्ध H2 कैसे प्राप्त करते हैं ?
उत्तर:
अम्लीकृत जल के विद्युत् अपघटन से शुद्ध H2 तथा O2 प्राप्त करते हैं।
![]()
प्रश्न 13.
ब्रह्मांड में सबसे अधिक मात्रा में पाया जाने वाला तत्व कौन-सा है ?
उत्तर:
हाइड्रोजन।
प्रश्न 14.
हाइड्रोजन तत्व कक्ष ताप पर दूसरे तत्वों के साथ धीमी गति से क्रिया क्यों करता है।
उत्तर:
क्योंकि इसकी बन्ध एन्थैल्पी का मान बहुत अधिक (436kJ.mol) होता है।
प्रश्न 15.
हाइड्रोजन का स्थान आवर्त सारणी में अभी तक स्थायी क्यों नहीं है ?
उत्तर:
क्योंकि यह क्षार धातुओं तथा हैलोजन दोनों के साथ समानता प्रदर्शित करता है।
प्रश्न 16.
हाइड्रोजन का कौन सा समस्थानिक न्यूट्रॉन नहीं रखता ?
उत्तर:
प्रोटियम (1H1)
प्रश्न 17.
एक ऐसा उदाहरण दीजिए जिसमें हाइड्रोजन ऑक्सीकारक का कार्य करता है ?
उत्तर:
2Na + H2 → 2NaH
प्रश्न 18.
उस हाइड्रोजन का नाम लिखिए जिसमें नाभिक एक ही दिशा में चक्रण करता है।
उत्तर:
ऑर्थो हाइड्रोजन
प्रश्न 19.
उन धातुओं के नाम बताइए जो NaOH से क्रिया करके H2 गैस का उत्पादन करती है ?
उत्तर:
Al तथा Be वो धातुएँ हैं जो NaOH से क्रिया करके H1 गैस का उत्पादन करती हैं।
प्रश्न 20.
उन धातुओं के नाम बताइए जो 5% HNO3 से क्रिया करके हाइड्रोजन गैस बनाती हैं।
उत्तर:
Mg और Mn
प्रश्न 21.
H2S की तुलना में जल का क्वथनांक तथा गलनांक उच्च क्यों होता है?
उत्तर:
जल- अणु अन्तर- आण्विक हाइड्रोजन बन्धों द्वारा संगुणित रहते हैं जिससे इनका क्वथनांक तथा गलनांक उच्च हो जाता है, जबकि H2S में ऐसा नहीं होता ।
प्रश्न 22.
जल किस तत्व का ऑक्साइड है?
उत्तर:
जल हाइड्रोजन का ऑक्साइड है।
प्रश्न 23.
उस जल का नाम लिखिए, जो साबुन के साथ आसांनी से झाग उत्पन्न करता है।
उत्तर:
मृदु जल, साबुन के साथ आसानी से झाग उत्पन्न करता है ।
प्रश्न 24.
सोडियम जियोलाइट का नाम व रासायनिक सूत्र लिखिए ।
उत्तर:
सोडियम जियोलाइट / परम्यूटिट (Na2Z) सोडियम ऐलुमिनियम सिलिकेट को कहते हैं। इसका रासायनिक सूत्र Na2Al2Si2O 8 है।
प्रश्न 25.
जल की अस्थायी कठोरता किन लवणों के कारण होती है?
उत्तर:
जल की अस्थायी कठोरता कैल्सियम या मैग्नीशियम के बाइकार्बोनेट लवणों के कारण होती है।
प्रश्न 26.
जल की अस्थायी कठोरता दूर करने की किसी एक विधि का नाम लिखिए ।
उत्तर:
जल की अस्थायी कठोरता दूर करने के लिए क्लार्क विधि का उपयोग किया जाता है।
प्रश्न 27.
एक ऐसे पदार्थ का नाम लिखिए जो जल में घुलकर, उसे स्थायी कठोर बनाता है।
उत्तर:
मैग्नीशियम क्लोराइड जल में घुलकर उसे स्थायी कठोर बना देता है।
प्रश्न 28.
आसवन द्वारा जल की कौन-सी कठोरता दूर होती है ?
उत्तर:
आसवन द्वारा जल की स्थायी तथा अस्थायी दोनों प्रकार की कठोरता दूर हो जाती हैं।
प्रश्न 29.
जल कितने प्रकार का होता है?
उत्तर:
जल दो प्रकार होता हैं- मृदु जल तथा कठोर जल ।
प्रश्न 30. साधारण जल से भारी जल किस प्रकार उत्पन्न होता है?
उत्तर:
साधारण जल का बार-बार विद्युत अपघटन (repeated electrolysis) कराने पर भारी जल प्राप्त होता है।
प्रश्न 31.
किन-किन विधियों द्वारा जल- अणु निर्जलीय लवणों से जुड़कर हाइड्रेट बनाते हैं?
उत्तर:
उपसहसंयोजक बन्ध तथा हाइड्रोजन बन्ध द्वारा जुड़कर जल – अणु हाइड्रेट बनाते हैं।
प्रश्न 32.
कठोर जल की परिभाषा लिखिए।
उत्तर:
कठोर जल, वह जल है जो साबुन के साथ आसानी से झाग नहीं देता है अथवा अत्यधिक कठिनाई से झाग देता है।
![]()
प्रश्न 33.
वर्षा के जल में कौन-कौन सी अशुद्धियाँ होती हैं ?
उत्तर:
वर्षा का जल शुद्धतम प्राकृतिक जल है, किन्तु इसमें अमोनिया, कार्बन डाइऑक्साइड, नाइट्रोजन परऑक्साइड आदि गैसों के अतिरिक्त 0.005% ठोस अशुद्धियाँ भी मिली होती हैं।
प्रश्न 34.
किस गैस द्वारा जल शुद्ध किया जाता है?
उत्तर:
क्लोरीन गैस द्वारा जल शुद्ध किया जाता है।
प्रश्न 35.
जल की स्थायी कठोरता दूर करने के लिए दो विधियों के नाम लिखिए।
उत्तर:
जल की स्थायी कठोरता दूर करने की दो विधियाँ, आयन- विनिमय रेजिन विधि तथा जियोलाइट अथवा परम्यूटिट विधि हैं।
प्रश्न 36.
संश्लेषण विधि से जल का आयतनी संघटन ज्ञात करने के लिए किस उपकरण का प्रयोग किया जाता है ?
उत्तर:
संश्लेषण विधि से जल का आयतनी संघटन ज्ञात करने के लिए गैस आयतनमापी नली (eudiometer tube) नामक उपकरण का प्रयोग किया जाता है।
प्रश्न 37.
पेयजल को शुद्ध करने के लिए पोटैशियम परमैंगनेट (KMnO4) क्या कार्य करता है?
उत्तर:
पोटैशियम परमैंगनेट (KMnO4) जल के रोगाणुओं को नष्ट करता है तथा कार्बनिक अशुद्धियों को ऑक्सीकृत करता है।
प्रश्न 38.
गैस आयतनमापी नली में 15 घन सेमी ऑक्सीजन तथा 35 घन सेमी हाइड्रोजन लेकर मिश्रण में विद्युत् धारा प्रवाहित करने के बाद 5 घन सेमी गैस बाकी बच रही है। इस गैस का क्या नाम है ?
उत्तर:
गैस आयतनमापी नली में बची हुई उस गैस का नाम डाइहाइड्रोजन है।
प्रश्न 39.
एक कुएँ के जल में कैल्सियम बाइकार्बोनेट लवण विलेय है। यह किस प्रकार का कठोर जल होगा?
उत्तर:
कुएँ के जल में कैल्सियम बाइकार्बोनेट लवण विलेय है। यह अस्थायी कठोर जल होगा।
प्रश्न 40.
किसी कठोर जल में कैल्सियम बाइकार्बोनेट घुला है। इसे मृदु जल किस प्रकार बनाया जा सकता है?
उत्तर:
कैल्सियम बाइकार्बोनेट घुले अस्थायी कठोर जल को उबालने से कैल्सियम बाइकार्बोनेट लवण अविलेय कैल्सियम कार्बोनेट लवण में परिवर्तित हो जाता है और नीचे बैठ जाता है। इसको छानकर दूर कर लिया जाता है।
\(\mathrm{Ca}\left(\mathrm{HCO}_3\right)_2 \longrightarrow \mathrm{CaCO}_3 \downarrow+\mathrm{H}_2 \mathrm{O}+\mathrm{CO}_2 \uparrow\)
प्रश्न 41.
जल में कठोरता उत्पन्न करने वाले दो लवणों के नाम लिखिए ।
उत्तर:
जल में कैल्सियम व मैग्नीशियम के क्लोराइड व सल्फेट घुले रहने के कारण जल कठोरता (स्थायी) व्यक्त करता है।
प्रश्न 42.
कठोर जल में घुले हुए MgSO4 से धावन सोडा की क्या क्रिया होती है?
उत्तर:

प्रश्न 43.
क्या होता है जब – P4O10 ठण्डे जल में घोला जाता है? (केवल रासायनिक समीकरण दीजिए)
उत्तर:
ऑर्थो-फॉस्फोरिक अम्ल बनता है।
\(\mathrm{P}_4 \mathrm{O}_{10}+6 \mathrm{H}_2 \mathrm{O} \longrightarrow 4 \mathrm{H}_3 \mathrm{PO}_4\)
प्रश्न 44.
कठोर जल साबुन के साथ कम और देर में झाग क्यों देता है ?
उत्तर:
कठोर जल में कैल्सियम तथा मैग्नीशियम के लवण घुले होते हैं जिसके कारण कठोर जल साबुन के साथ झाग बनाने के स्थान पर कैल्सियम तथा मैग्नीशियम के स्टिऐरेट बनाता रहता है जो जल में अविलेय होते हैं।
प्रश्न 45.
सोडियम कार्बोनेट के द्वारा जल की स्थायी कठोरता क्यों दूर हो जाती है ?
उत्तर:
यदि स्थायी कठोर जल में सोडियम कार्बोनेट या धावन सोडा (Na2CO3) मिलाकर गर्म किया जाता है तो उसमें विलेय मैग्नीशियम तथा कैल्सियम के लवण अविलेय कार्बोनेटों में बदल जाते हैं जिनको छानकर अलग कर लिया जाता है।
प्रश्न 46.
“कठोर जल के एक नमूने की कठोरता 6° है ।” इस कथन का क्या तात्पर्य है?
उत्तर:
कठोर जल के एक नमूने में कठोरता 6° है। इसका अर्थ यह है कि उसकी कठोरता एक ppm ( part per million) है।

प्रश्न 47.
क्लार्क विधि से अस्थायी कठोरता दूर करने की रासायनिक समीकरण लिखिए।
उत्तर:
इस विधि में चूने का जल मिलाकर अस्थायी कठोरता दूर करते हैं।
\(\mathrm{Ca}\left(\mathrm{HCO}_3\right)_2+\mathrm{Ca}(\mathrm{OH})_2 \longrightarrow 2 \mathrm{CaCO}_3 \downarrow+2 \mathrm{H}_2 \mathrm{O}\)
कठोरता
![]()
प्रश्न 48.
हाइड्राइड अन्तराल क्या है ?
उत्तर:
वर्ग 3, 4 और 5 की संक्रमण धातुएँ धात्विक हाइड्राइड बनाती हैं। वर्ग 6 में क्रोमियम भी एक हाइड्राइड बनाता है। इसके पश्चात् इसमें एक अन्तराल बन जाता है क्योंकि 7, 8 तथा 9 से सम्बन्धित धातुएँ कोई हाइड्राइड नहीं बनाती हैं।
प्रश्न 49.
जल आयनिक एवं ध्रुवीय सहसंयोजक यौगिकों के लिये एक अच्छा विलायक क्यों है?
उत्तर:
आयनिक यौगिक जल में घुलकर आयन देते हैं जबकि ध्रुवीय सहसंयोजक यौगिक जल के साथ हाइड्रोजन बन्ध बनाते हैं। इसी कारण आयनिक एवं ध्रुवीय सहसंयोजक यौगिकों के लिये जल अच्छा विलायक है।
प्रश्न 50.
जल गैस क्या है?
उत्तर:
CO तथा H2 का मिश्रण जल गैस है।
प्रश्न 51.
H2O2 का सान्द्रण कम दाब पर क्यों किया जाता है?
उत्तर:
70°C तक गर्म करने पर H2O2 का सान्द्रण 45% तक हो जाता है, परन्तु इससे ऊपर उच्च ताप पर गर्म करने पर इसका अपघटन हो जाता है। अत: अपघटन को रोकने के लिए H2O2 का सान्द्रण कम दाब पर किया जाता है।
प्रश्न 52.
हाइड्रोजन परॉक्साइड जल की अपेक्षा उत्तम ऑक्सीकारक है। कारण सहित बताइए ।
उत्तर:
H2O2 में ऑक्सीजन की ऋण विद्युता जल की अपेक्षा अधिक होती है; अत: H2O2 जल की अपेक्षा उत्तम ऑक्सीकारक होता है । इसके अतिरिक्त H2O2 में O की ऑक्सीकरण संख्या -1 है, जबकि H2O में O की ऑक्सीकरण संख्या -2 है। H2O2 में O की उच्च ऑक्सीकरण संख्या उसके जल की अपेक्षा उत्तम ऑक्सीकारक होने का एक कारण है।
प्रश्न 53.
एक पदार्थ का नाम बताइए जो H2O2 को ऑक्सीकृत कर सकता है ?
उत्तर:
अम्लीकृत KMnO4, H2O2 को ऑक्सीकृत कर सकता है।
प्रश्न 54.
10 आयतन H2O2 विलयन की सामर्थ्य परिकलित कीजिए ।
हल : H2O2 के 10 आयतन विलयन का अर्थ है कि 1L H2O2 मानक ताप एवं दाब पर 10L ऑक्सीजन देगा-
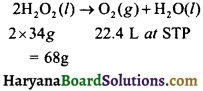
∴ 22.4L ऑक्सीजन बनती है = 68 g H2O2 से
∴ 10.L ऑक्सीजन बनती है = \(\frac { 68×10 }{ 22.4 }\)g H2O2 = 30.36 g H2O2
उत्तर:
’10 आयतन’ H2O2 विलयन की सामर्थ्य 30.36 gm/ L है।
प्रश्न 55.
हाइड्रोजन परॉक्साइड विलयन की आयतन में व्यक्त सान्द्रता का मोलरता तथा नॉर्मलता के साथ सम्बन्ध बताइये ।
उत्तर:
- आयतन सान्द्रता = 5.6 × नॉर्मलता
- आयतन सान्द्रता 11.2 × मोलरता
प्रश्न 56.
हाइड्रोजन परॉक्साइड विलयन की आयतन सान्द्रता एवं प्रतिशत सान्द्रता में सम्बन्ध बताइये ।
उत्तर:

प्रश्न 57.
H2O2 की आयतन सान्द्रता तथा इसकी सामर्थ्य (g / L-1) में, का आपस में सम्बन्ध बताइये ।
उत्तर:
आयतन सान्द्रता

प्रश्न 58.
जब H2O2 की क्रिया खून के साथ होती है तो एक गैस तेजी से निकलती है ? व्याख्या करें ?
उत्तर:
रक्त में उपस्थित एन्जाइम H2O2 के ऑक्सीकरण की दर बढ़ा देता है जिससे O2 गैस तेजी के साथ निकलती है।

प्रश्न 59.
’15 आयतन H2O2‘ से आप क्या समझते हैं ?
उत्तर:
15 आयतन H2O2 का अर्थ है कि H2O2 का 1 ml S.T.P. पर 15 ml O2 गैस देता है।
प्रश्न 60.
ऐसे दो यौगिकों के नाम लिखिये जो H2O2 के अपघटन की क्रिया को धीमा कर देते हैं।
उत्तर:
एसिटानिलाइड, ग्लिसरॉल।
प्रश्न 61.
’25 आयतन H2O2‘ के 10ml में कितनी H2O2 उपस्थित है?
उत्तर:
25 आयतन H2O2 के 10 ml में ऑक्सीजन की मात्रा = 10 × 25 = 250 ml at NTP
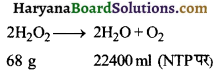
H2O2 की मात्रा जो 250 ml O2 को NTP पर मुक्त करती है
= \(\frac { 68 × 250 }{ 22400 }\) = 0.759 g
प्रश्न 62.
दिये गये H2O2 विलयन के 10ml में 0.91 g H2O2 उपस्थित है। इसकी सान्द्रता आयतन में व्यक्त करें ।
उत्तर:
68 g H2O2 NTP पर उत्पन्न करती है = 22400 ml O2
0.91 g H2O2 NTP पर उत्पन्न करती है।
= \(\frac { 22400×0.91 }{ 68 }\)
= 300 ml S.T.P. पर
अतः आयतन सान्द्रता = \(\frac { 300 }{ 100 }\) = ’30 आयतन H2O2‘
प्रश्न 63.
परहाइड्राल क्या है?
उत्तर:
परहाइड्राल H2O2 का व्यापारिक नाम है जो कि घाव, दाँत, कान आदि को साफ करने में प्रयुक्त होता है।
प्रश्न 64.
सूखे BaO2 को H2O2 को बनाने में प्रयुक्त नहीं करते हैं, क्यों ।
उत्तर:
सूखे BaO2 को प्रयोग में नहीं लाते क्योंकि अभिक्रिया के दौरान यह BaSO4 को बनाता है जो कि एक सुरक्षा कवच की तरह इसके ऊपर चढ़ जाता है तथा बचे हुये BaO2 की अभिक्रिया नहीं होने देता है।
प्रश्न 65.
वह कौन-सा यौगिक है जो तनु सल्फ्यूरिक अम्ल से क्रिया कराने पर हाइड्रोजन परॉक्साइड देता है ?
उत्तर:
BaO2
![]()
प्रश्न 66.
भारी जल का सूत्र लिखिए। इसके दो उपयोग दीजिए।
उत्तर:
भारी जल का रासायनिक सूत्र D2O है। भारी जल (D2O) का अणुभार = 2 × 2 + 16 = 20 होता है। इसका उपयोग परमाणु भट्टी में न्यूट्रॉनों की गति मन्द करने में तथा जैव-रासायनिक अभिक्रियाओं की क्रियाविधि ज्ञात करने में होता है।
प्रश्न 67.
भारी जल का रासायनिक सूत्र लिखिए। भारी जल का उपयोग परमाणु भट्टी में क्यों किया जाता है?
उत्तर:
भारी जल का रासायनिक सूत्र D2O है। इसका उपयोग परमाणु भट्टी में न्यूट्रॉनों की गति को मन्द करने के लिए होता है।
प्रश्न 68.
भारी जल (D2O) के एक अणु में कितने इलेक्ट्रॉन होते हैं?
उत्तर:
दस ।
प्रश्न 69.
नाभिकीय रिएक्टर में भारी जल की क्या उपयोगिता है?
उत्तर:
यह मन्दक के रूप में कार्य करता है। यहाँ यह न्यूट्रॉन की गति को कम करके नाभिकीय अभिक्रिया को सन्तुलित करता है।
प्रश्न 70.
क्या होता है जब भारी जल कैल्सियम कार्बाइड के साथ अभिक्रिया करता है।
उत्तर:

प्रश्न 71.
क्या होता है जब भारी जल क्लोरोफार्म के साथ क्षार की उपस्थिति में क्रिया करता है।
उत्तर:
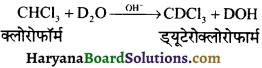
प्रश्न 72.
साधारण जल की अपेक्षा भारी जल में NaCl कम घुलनशील है, क्यों ?
उत्तर:
H2O की अपेक्षा D2O का परा वैद्युत स्थिरांक कम होता है यही कारण है कि NaCl भारी जल में कम विलेय है।
प्रश्न 73.
साधारण जल का विद्युत अपघटन भारी जल की अपेक्षा शीघ्र होता है, क्यों?
उत्तर:
साधारण जल में OH बन्ध की बन्धन ऊर्जा का मान D2O के OD बन्ध की बन्धन ऊर्जा के मान से कम होता है जिसके कारण साधारण जल का विद्युत अपघटन आसानी से होता हैं ।
प्रश्न 74.
यद्यपि D2O हर तरह से H2O जैसा है फिर भी यह विषैला है। क्यों ?
उत्तर:
D2O विषैला है क्योंकि एन्जाइम के द्वारा संचालित सभी अभिक्रियाएँ H+ की अपेक्षा D+ की उपस्थिति में धीमी गति से होती हैं।
प्रश्न 75.
D2O2 को कैसे बनाया जा सकता है ?
उत्तर:
जब पोटैशियम परसल्फेट की क्रिया भारी जल से होती है तो D2O2 बनता है।

प्रश्न 76.
हाइड्रोजन, क्षार धातुओं तथा हैलोजनों के साथ समानता रखती है, क्षार धातुओं के ऑक्साइड क्षारीय हैं, हैलोजनों के ऑक्साइड अम्लीय हैं जबकि हाइड्रोजन का ऑक्साइड उदासीन है। स्पष्ट करो।
उत्तर:
क्षार धातुओं के ऑक्साइड घुलने पर OH– आयन देते हैं तथा हैलोजनों के ऑक्साइड H+ देते हैं जबकि हाइड्रोजन के ऑक्साइड जल वियोजित होकर समान मात्रा में H+ तथा OH– आयन देते हैं ।
प्रश्न 77.
H2O2 का क्वथनांक आशा से अधिक होता है, क्यों ?
उत्तर:
H2O2 के अणु अन्तराअणुक हाइड्रोजन बन्ध द्वारा संगुणित रहते हैं। H2O2 में जल से अधिक संगुणन होता है। इसी कारण H2O2 का क्वथनांक आशा से अधिक होता है।
प्रश्न 78.
जब गलित कैल्सियम हाइड्राइड का विद्युत अपघटन किया जाता है तो हाइड्रोजन ऐनोड पर प्राप्त होती है, क्यों ?
उत्तर:
CaH2 में हाइड्रोजन H– के रूप में रहती है । वैद्युत अपघटन करने पर H– आयन ऑक्सीकृत होकर ऐनोड पर H2 को मुक्त करता है।
प्रश्न 79.
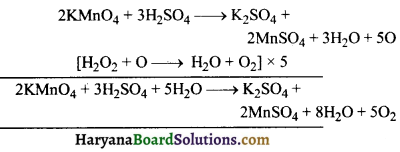
अम्लीय पोटैशियम परमैंगनेट और H2O2 की अभिक्रिया का सन्तुलित समीकरण लिखें ।
उत्तर:
प्रश्न 80.
D2O का गलनांक, साधारण जल से अधिक होता है, क्यों ?
उत्तर:
क्योंकि D2O में उपस्थित हाइड्रोजन बन्ध अधिक प्रबल होते हैं।
प्रश्न 81.
साधारण जल की अपेक्षा, भारी जल का घनत्व अधिक होता है, क्यों ?
उत्तर:
भारी जल का अधिक घनत्व इसके अधिक अणुभार के कारण है।
प्रश्न 82.
H2O2 अस्थायी द्रव क्यों होता है ?
उत्तर:
H2O2 को खुले में रखने पर या गर्म करने पर यह अपघटित हो जाता है।
\(2 \mathrm{H}_2 \mathrm{O}_2 \longrightarrow 2 \mathrm{H}_2 \mathrm{O}+\mathrm{O}_2\)
प्रश्न 83.
भारी जल के एक अणु में कितने इलेक्ट्रॉन होते हैं ?
उत्तर:
10 इलेक्ट्रॉन ।
प्रश्न 84.
अम्लों की भास्मिकता निकालने में भारी जल का प्रयोग किस प्रकार किया जाता है।
उत्तर:
आयनिक हाइड्रोजन या ऑक्सीजन से जुड़ी साधारण हाइड्रोजन का भारी हाइड्रोजन द्वारा विनिमय होता है।
उदाहरण:
CH3COOH की D2O से क्रिया कराने पर CH3COOD प्राप्त होता है न कि CD3COOD | इससे सिद्ध होता है कि CH3COOH में केवल एक आयनिक हाइड्रोजन है और यह मोनो बेसिक अम्ल है ।
![]()
प्रश्न 85.
H2O2 को जिस बोतल में रखते हैं उसकी आन्तरिक सतह मोम की होती है तथा बोतल रंगीन होती है, क्यों ?
उत्तर:
खुरदरी सतह H2O2 के विघटन में उत्प्रेरक का कार्य करती है। मोम की चिकनी सतह H2O2 के विघटन की दर कम कर देती है। रंगीन बोतल प्रकाश को रोकती है जिससे H2O2 का विघटन कम हो जाता है।
प्रश्न 86.
सूर्य में कौन-सा तत्व अधिक मात्रा में उपस्थित है ?
उत्तर:
हाइड्रोजन |
प्रश्न 87.
ज्वालामुखी एवं पेट्रोलियम कुँओं से निकलने वाली गैसों में मुख्य रूप से कौन-सी गैस है ?
उत्तर:
ज्वालामुखी एवं पेट्रोलियम कुँओं से अधिक मात्रा में हाइड्रोजन प्राप्त होती है।
प्रश्न 88.
धातुओं पर अम्लों की क्रिया द्वारा निकलने वाली गैस को हाइड्रोजन नाम किसने दिया ?
उत्तर:
लेवोशिये ने सर्वप्रथम इसे हाइड्रोजन नाम दिया।
प्रश्न 89.
ऐसे दो-दो उदाहरण दें जिनमें हाइड्रोजन का ऑक्सीकरण अंक +1 तथा 1 हो।
उत्तर:
(i) ऑक्सीकरण अंक + 1 वाले उदाहरण-
HCl तथा H2O
(ii) ऑक्सीकरण अंक – 1 वाले उदाहरण-
NaH, CaH2
प्रश्न 90.
वैज्ञानिक यूरे, ब्रिकवैड व मर्फी ने हाइड्रोजन के कौन से समस्थानिक की खोज की ?
उत्तर:
वैज्ञानिक यूरे, ब्रिकवैड व मर्फी ने ड्यूटीरियम की खोज की ।
प्रश्न 91.
वैज्ञानिक लोजिअर, ब्लीकनें व स्मिथ ने हाइड्रोजन के कौन-से समस्थानिक की खोज की ?
उत्तर:
ट्राइटियम की ।
प्रश्न 92.
गोल्ड हेबर विधि का समीकरण लिखें ?
उत्तर:
गोल्ड हेबर विधि में ट्राइटियम को लीथियम पर मन्द न्यूट्रॉनों के प्रहार से बनाते हैं।
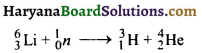
प्रश्न 93.
हाइड्रोजन को सर्वप्रथम किस वैज्ञानिक ने तैयार किया ?
उत्तर:
रॉबर्ट बॉयल ने सर्वप्रथम हाइड्रोजन को तैयार किया ।
प्रश्न 94.
किस वैज्ञानिक ने हाइड्रोजन को ज्वलनशील वायु कहा ?
उत्तर:
हैनरी कैवेन्डिश ने हाइड्रोजन को ज्वलनशील वायु कहा।
प्रश्न 95.
क्या ह्लेता है जब सोडियम की जल से क्रिया कराते हैं ?
उत्तर:
हाइड्रोजन गैस मुक्त होती है।
\(2 \mathrm{Na}+2 \mathrm{H}_2 \mathrm{O} \longrightarrow 2 \mathrm{NaOH}+\mathrm{H}_2 \uparrow\)
प्रश्न 96.
H2 गैस में कौन-कौन सी अशुद्धियाँ होती हैं ?
उत्तर:
H2 गैस में AsH3, PH3, H2S, SO2, CO2, NO2, नमी आदि की अशुद्धियाँ होती हैं।
प्रश्न 97.
AsH3 तथा PH3 की अशुद्धि को हाइड्रोजन से दूर करने के लिये इसे किस विलयन से गुजारते हैं ?
उत्तर:
AsH3 तथा PH2 की अशुद्धि को हाइड्रोजन से दूर करने के लिये इसे AgNO3 विलयन से गुजारते हैं।
प्रश्न 98.
सहसंयोजक हाइड्राइड के दो उदाहरण दें।
उत्तर:
B2H6, CH4
प्रश्न 99.
धात्विक हाइड्राइड के दो उदाहरण दें।
उत्तर:
ZrH, TaH
प्रश्न 100.
आयनिक हाइड्राइड के दो उदाहरण दें।
उत्तर:
CaH2, SrH2
प्रश्न 101.
जल में उपस्थित ऑक्सीजन तत्व पर संकरण क्या है ?
उत्तर:
sp3
प्रश्न 102.
जल अणु पुंज किसे कहते हैं ?
उत्तर:
जल में H2O-HOH प्रकार के अणु समूह या गुच्छे उपस्थित होते हैं, इन्हें जल अणु पुंज कहते हैं।
प्रश्न 103.
Na2CO3 का जलीय विलयन कैसा होता है ?
उत्तर:
Na2CO3 का जलीय विलयन क्षारीय होता है।
प्रश्न 104.
CuSO4 का जलीय विलयन कैसा होता है ?
उत्तर:
CuSO4 का जलीय विलयन अम्लीय होता है।
प्रश्न 105.
बॉयलर में किस रासायनिक पदार्थ की पपड़ी जमती है ?
उत्तर:
बॉयलर में CaSO4, MgSO4 लवण के कारण पपड़ी जमती है।
प्रश्न 106.
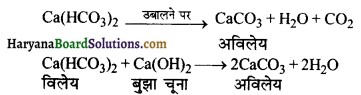
जल की अस्थायी कठोरता कैसे दूर होती है ?
उत्तर:
जल की अस्थायी कठोरता को उबालकर या जल में बुझा चूना डालकर दूर करते हैं।
प्रश्न 107.
किस धातु के स्टियरेट जल में अविलेय हैं ?
उत्तर:
मैग्नीशियम व कैल्सियम के स्टियरेट जल में अविलेय हैं।
प्रश्न 108.
किस धातु का स्टियरेट जल में विलेय है?
उत्तर:
सोडियम धातु का स्टियरेट जल में विलेय होता है।
प्रश्न 109.
हाइड्रोजन परॉक्साइड की खोज किसने की थी ?
उत्तर:
H2O2 की खोज बेनार्ड नामक फ्रेंच रसायनज्ञ ने की थी ।
प्रश्न 110.
H2O2 के भण्डारण में स्थायी कारक पदार्थ मिलाते हैं, इनके नाम बतायें ।
उत्तर:
फॉस्फोरिक अम्ल, ग्लिसरॉल, ऐसीटेनिलाइड आदि ।
प्रश्न 111.
H2O2 के क्वथनांक का सही मान ज्ञात नहीं है, क्यों ?
उत्तर:
H2O2 का क्वथनांक सही रूप से निर्धारित नहीं हो पाता है क्योंकि यह उस तापक्रम से पहले विघटित हो जाता है।
प्रश्न 112.
H2O2 की गैसीय अवस्था एवं क्रिस्टलीय अवस्था में बन्ध कोण कितना है ?
उत्तर:
H2O2 की गैसीय अवस्था में बन्ध कोण 111.5° व क्रिस्टलीय अवस्था में बन्ध कोण 90.2° होता है।
![]()
प्रश्न 113.
H2O2 को रंगीन बोतलों में रखते हैं, क्यों ?
उत्तर:
H2O2 का प्रकाश द्वारा विघटन रोकने के लिये इसे रंगीन बोतलों में रखते हैं।
प्रश्न 114.
धातु की सतह पर हाइड्रोजन का चिपकना क्या कहलाता है ?
उत्तर:
धातु की सतह पर हाइड्रोजन का चिपकना अधिशोषण कहलाता है।
प्रश्न 115.
क्या तनु HCl के साथ कॉपर की क्रिया करा कर हाइड्रोजन उत्पन्न कर सकते हैं ?
उत्तर:
नहीं।
प्रश्न 116.
जल गैस के घटक क्या हैं ?
उत्तर:
जल गैस के घटक CO, H2 हैं ।
प्रश्न 117.
क्या होता है जब निम्न पर जल गिराते हैं-
(i) CaC2
(ii) Mg3P2
उत्तर:
(i) CaC2 जल से क्रिया करके CH ≡ CH बनाता है।
(ii) Mg3P2 जल से क्रिया करके PH3 बनाता है।
प्रश्न 118.
परम्यूटिट का रासायनिक सूत्र लिखें ।
उत्तर:
परम्यूटिट का रासायनिक सूत्र Na2Al2Si2O8.xH2O होता है।
प्रश्न 119.
केलगॉन का रासायनिक सूत्र है ।
उत्तर:
Na2[Na4(PO3)6] को केलगॉन कहते हैं।
प्रश्न 120.
क्या समुद्री प्राणी आसुत जल में रह सकते हैं ?
उत्तर:
समुद्री प्राणी आसुत जल में नहीं रह सकते हैं।
प्रश्न 121.
H2O2 की क्षारकता कितनी होती है ?
उत्तर:
H2O2 की क्षारकता दो होती है।
प्रश्न 122.
ऐसीटैनिलाइड H2O2 के विघटन को रोकता है। इसकी प्रकृति कैसी होती है ?
उत्तर:
ऐसीटैनिलाइड संदमक का कार्य करता है।
प्रश्न 123.
जल की कठोरता की मात्रा की परिभाषा दें ।
उत्तर:
इसे भारानुसार जल के 10 लाख भाग में उपस्थित कैल्सियम कार्बोनेट या इसके तुल्यांक के भारानुसार भागों की संख्या के रूप में परिभाषित कर सकते हैं।
प्रश्न 124.
ऐसी अभिक्रियाओं का उदाहरण दो जिसमें हाइड्रोजन ऑक्सीकारक तथा अपचायक की तरह कार्य करता है ?
उत्तर:
अपचायक के रूप में,
\(\mathrm{CuO}_{(s)}+\mathrm{H}_{2(g)} \longrightarrow \mathrm{Cu}+\mathrm{H}_2 \mathrm{O}_{(\ell)}\)
ऑक्सीकारक के रूप में,
\(2 \mathrm{Na}_{(s)}+\mathrm{H}_{2(g)} \longrightarrow 2 \mathrm{Na}^{+} \mathrm{H}^{-}(s)\)
लघु उत्तरीय प्रश्न:
प्रश्न 1.
हाइड्रोजन की प्राप्ति पर विवेचना कीजिए।
उत्तर:
हाइड्रोजन ब्रह्माण्ड में अतिबाहुल्य तत्व (ब्रह्माण्ड के सम्पूर्ण द्रव्यमान का 70 प्रतिशत) है तथा यह सौर वायुमण्डल का प्रमुख तत्व है। बड़े ग्रहों-बृहस्पति (Jupiter) तथा शनि (Saturn) में अधिकांशत: हाइड्रोजन होती है, हालांकि अपनी हल्की प्रकृति के कारण यह पृथ्वी के वायुमण्डल में कम मात्रा (द्रव्यमानानुसार लगभग 0.15 प्रतिशत) में पाई जाती है। संयुक्त अवस्था में हाइड्रोजन तत्व भू-पर्पटी तथा महासागर में 15.4 प्रतिशत भाग का निर्माण करते हैं। संयुक्त अवस्था में जल के अतिरिक्त यह पादप तथा जन्तु-ऊतकों, कार्बोहाइड्रेट, प्रोटीन, हाइड्राइड, हाइड्रोकार्बन और कई अन्य यौगिकों में पायी जाती है।
![]()
प्रश्न 2.
क्या होता है, जबकि डाइहाइड्रोजन निम्न- लिखित के साथ अभिक्रिया करती है-
(i) फेरिक क्लोराइड,
(ii) सिल्वर क्लोराइड,
(iii) सल्फर।
उत्तर:
डाइहाइड्रोजन की फेरिक क्लोराइड, सिल्वर क्लोराइड तथा सल्फर के साथ अभिक्रियाएँ निम्नवत् हैं-
(i) फेरिक क्लोराइड से अभिक्रिया (Reaction with ferric chloride)-डाइहाइड्रोजन फेरिंक क्लोराइड के साथ क्रिया करके उसे फेरस क्लोराइड में अपचयित कर देती है।

(ii) सिल्वर क्लोराइड से अभिक्रिया (Reaction with silver chloride) – डाइहाइड्रोजन की सिल्वर क्लोराइड से अभिक्रिया होने पर सिल्वर तथा हाइड्रोजन क्लोराइड गैस प्राप्त होती है।
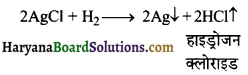
(iii) सल्फर से अभिक्रिया (Reaction with sulphur ) – हाइड्रोजन गैस को गर्म उबलते सल्फर में प्रवाहित करने से हाइड्रोजन सल्फाइड गैस बनती है।
\(\mathrm{H}_2+\mathrm{S} \longrightarrow \mathrm{H}_2 \mathrm{~S} \uparrow\) हाइड्रोजन सल्फाइड
प्रश्न 3.
उदाहरण देकर सिद्ध कीजिए कि डाइहाइड्रोजन एक प्रबल अपचायक है।
उत्तर:
डाइहाइड्रोजन को लेड, कॉपर आदि के गर्म ऑक्साइडों पर प्रवाहित करने से शुद्ध धातु प्राप्त होती है।
PbO + H2 → Pb + H2O
CuO + H2 → Cu + H2O
उपरोक्त अभिक्रियाएँ सिद्ध करती हैं कि H2 एक प्रबल अपचायक है।
प्रश्न 4.
क्या होता है, जबकि –
(i) जल में सोडियम का टुकड़ा डाला जाता है ?
(ii) डाइहाइड्रोजन और क्लोरीन की अभिक्रिया सूर्य के प्रकाश में होती है ?
(iii) जल के साथ हाइड्रोलिथ की अभिक्रिया होती है ?
उत्तर:
(i) जल में सोडियम का टुकड़ा डालने पर डाइहाइड्रोजन गैस बनती है।

(ii) सूर्य के प्रकाश में डाइहाइड्रोजन तथा क्लोरीन की अभिक्रिया से हाइड्रोजन क्लोराइड (HCl) गैस बनती है।

(iii) जल के साथ हाइड्रोलिथ की अभिक्रिया से डाइहाइड्रोजन गैस उत्पन्न होती है।
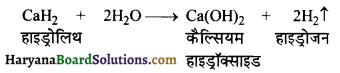
प्रश्न 5.
निम्न अभिक्रियाओं को पूर्ण करें-
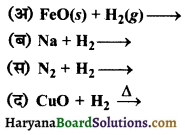
उत्तर:
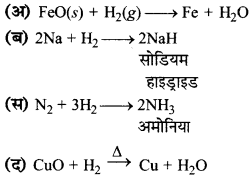
प्रश्न 6.
निम्न अभिक्रियाओं को पूर्ण करें-
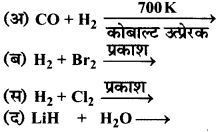
उत्तर:
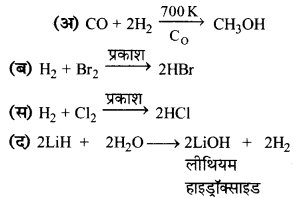
प्रश्न 7.
रिक्त स्थानों को भरिए ।
(अ) हाइड्रोजन ……………तथा……………दोनों प्रकार के गुण रखता है।
(ब) H+ आयन जल में…………… आयन की तरह रहते हैं तथा इन्हें……………… आयन कहते हैं।
(स) हाइड्रोजन………………. पर प्राप्त होती है जब NaH का विद्युत अपघटन किया जाता है।
(द) हाइड्रोनियम………………तथा………………… ऑक्सीकरण अवस्था प्रदर्शित करता है।
उत्तर:
(अ) विद्युत धनीय, विद्युत ऋणीय
(ब) H3O+, हाइड्रोनियम
(स) ऐनोड
(द) +1, -1
प्रश्न 8.
हाइड्रोजन अपने यौगिकों में तीन प्रकार के बन्ध बनाता है। इसे उदाहरण सहित समझाइए ।
उत्तर:
(i) आयनिक बन्ध (उदाहरण – NaH)
(ii) सहसंयोजक बन्ध ( उदाहरण HCl, NH3, H2O)
(iii) हाइड्रोजन बन्ध ( उदाहरण NH3, H2O, HF)
प्रश्न 9.
(i) हाइड्रोजन को गुब्बारों में नहीं भरा जाता । क्यों ?
(ii) H2 को सुखाने के लिये सान्द्र H2SO4 का प्रयोग नहीं करते, क्यों ?
(iii) क्या समुद्री जानवर आसुत जल में जीवित रह सकते हैं?
उत्तर:
(i) हाइड्रोजन अत्यन्त ज्वलनशील गैस है। हवा की अधिकता में इसमें तुरन्त आग लग जाती है। अत: इसे गुब्बारों में नहीं भरा जाता है।
(ii) जब सान्द्र H2SO4 हाइड्रोजन गैस के साथ मौजूद H2O के अणुओं को सोखता है तब अत्यधिक मात्रा में ऊर्जा उत्पन्न करता है। इस ऊर्जा की उपस्थिति में हाइड्रोजन में तुरन्त आग लग जाती है अत: Ha को सुखाने के लिये सान्द्र H2SO4 का प्रयोग नहीं करते हैं।
(iii) नहीं। क्योंकि आसुत जल में घुली हुयी O2 उपस्थित नहीं होती ।
प्रश्न 10.
अन्तराकाशी हाइड्राइडों के दो उदाहरण दीजिए।
उत्तर:
(i) CuH तथा
(ii) FeH.
प्रश्न 11.
क्या आप यह अपेक्षा करते हैं कि N, O तथा F के हाइड्राइडों के क्वथनांक उनके वर्ग के संगत सदस्यों के हाइड्राइडों से निम्न होते हैं? कारण बताइए।
उत्तर:
NH3, H2O तथा HF के आण्विक भारों के आधार पर इनके क्वथनांक संगत सदस्यों के हाइड्राइडों से कम होने चाहिए, परन्तु N, O, F की उच्च विद्युत् ऋणता के कारण हाइड्राइडों में हाइड्रोजन बन्ध बनाने की क्षमता उल्लेखनीय है। अत: NH3, H2O तथा HF के क्वथनांक उनके वर्ग के सदस्यों से उच्च होते हैं।
प्रश्न 12.
हाइड्रोजन किस प्रकार के तत्वों के साथ धात्विक हाइड्राइड बनाता है?
उत्तर:
d तथा f-ब्लॉक के तत्वों के साथ ।
प्रश्न 13.
वण समान हाइड्राइड तथा आण्विक हाइड्राइडों में अन्तर बताइए ?
उत्तर:
| लवण समान हाइड्राइड | आण्विक हाइड्राइड |
| (1) s-ब्लॉक के तत्व, बनाते हैं। | (1) p-ब्लॉक के तत्व बनाते हैं। |
| (2) आयनिक बन्ध बनाते हैं। | (2) सह-संयोजक बन्ध बनाते हैं। |
| (3) ये जल के साथ विस्फोटीय रूप से अभिक्रिया करते हैं। | (3) जल के साथ विस्फोटीय रूप से अभिक्रिया नहीं करते हैं तथा जल में विलेय नहीं होते हैं। |
| (4) हाइड्रोजन H– आयन में के रूप में होता है। | (4) हाइड्रोजन H– आयन के रूप नहीं होता है। |
| (5) उदाहरण: NaH, CaH2, KH आदि। | (5) उदाहरण: CH4, NH3, HF आदि । |
प्रश्न 14.
कठोर जल से हानियाँ और लाभ लिखिए ।
उत्तर:
कठोर जल से हानियाँ (Disadvantages from hard water) – कठोर जल में कैल्सियम तथा मैग्नीशियम के बाइकार्बोनेट, क्लोराइड तथा सल्फेट लवण घुले होते हैं जो साबुन से क्रिया करके अविलेय यौगिक बनाते हैं; जिसके कारण साबुन का अधिकतर भाग इस क्रिया में ही नष्ट हो जाता है और साबुन झाग नहीं देता है।
कठोर जल से लाभ (Advantages of hard water) – कठोर जल में उपस्थित कैल्सियम तथा मैग्नीशियम के कार्बोनेट, बाइकार्बोनेट तथा सल्फेट लवण हमारे स्वास्थ्य के लिए लाभदायक हैं तथा इन लवणों की उपस्थिति के कारण ही जल स्वादिष्ट होता है।
![]()
प्रश्न 15.
जल की कठोरता से क्या अभिप्राय है? क्या कठोर जल पीने के लिए उपयुक्त है ?
उत्तर:
जल का साबुन के साथ आसानी से झाग न देने अथवा अत्यधिक कठिनाई से झाग देने का गुण उसकी कठोरता कहलाता है अथवा जब जल साबुन के रगड़ने पर कम झाग अथवा देर से झाग उत्पन्न करता है तो जल के इस गुण को जल की कठोरता कहते हैं। कठोर जल की पीने के लिए उपयुक्तता निम्नवत् है-
- कठोर जल में घुले कैल्सियम के बाइकार्बोनेट, क्लोराइड तथा सल्फेट लवण हमारे स्वास्थ्य के लिए हितकर हैं। इनकी उपस्थिति से जल स्वादिष्ट हो जाता है, परन्तु पीने के जल में अधिक कठोरता नहीं होनी चाहिए।
- मृदु जल जब सीसे के नलों में बहता है तो कुछ धातु एवं उसके यौगिकों के घुलने से जल विषैला हो जाता है; अतः सीसे के नलों से बहाकर ले जाने के लिए जल कठोर होना चाहिए।
प्रश्न 16.
जल की कठोरता के क्या कारण हैं? कठोर जल को मृदु बनाने की किसी एक विधि का वर्णन कीजिए ।
उत्तर:
जल की कठोरता, जल में कैल्सियम तथा मैग्नीशियम के बाइकार्बोनेट, क्लोराइड तथा सल्फेट लवणों के कारण होती है। कठोर जल को मृदु बनाना (Softening of hard water) – स्थायी अथवा अस्थायी रूप से कठोर जल को शुद्ध करने के लिए आसवन विधि सर्वोत्तम मानी जाती है। इस विधि से जल में विलेय और निलम्बित दोनों प्रकार की अशुद्धियाँ दूर की जा सकती हैं।
इसके लिए अविरत क्रियाशील भभका प्रयोग किया जाता है। इसमें ताँबे के भभके को जल से भरकर गर्म करते हैं। उत्पन्न भाप को नल में से गुजारते हैं। इस नल से गुजरते समय, वाष्प जल को गर्म करती है तथा स्वयं ठण्डी होकर द्रव बन जाती है। यह जल ग्राही पात्र में एकत्रित कर लिया जाता है। इस प्रकार प्राप्त जल में कोई भी लवण नहीं होता है। यह शुद्ध जल ‘ आसुत जल’ कहलाता है।
प्रश्न 17.
जल की अस्थायी कठोरता उबालने से कैसे दूर हो जाती है ? रासायनिक समीकरण भी दीजिए।
उत्तर:
अस्थायी कठोर जल को उबालने पर उसमें घुले कैल्सियम तथा मैग्नीशियम के बाइकार्बोनेट लवण अविलेय कार्बोनेट लवणों में परिवर्तित हो जाते हैं, जो नीचे बैठ जाते हैं। इनको छानकर दूर कर लिया जाता है।
\(\mathrm{Ca}\left(\mathrm{HCO}_3\right)_2 \longrightarrow \mathrm{H}_2 \mathrm{O}+\mathrm{CO}_2 \uparrow+\mathrm{CaCO}_3 \downarrow\)
\(\mathrm{Mg}\left(\mathrm{HCO}_3\right)_2 \longrightarrow \mathrm{H}_2 \mathrm{O}+\mathrm{CO}_2 \uparrow+\mathrm{MgCO}_3 \downarrow\)
प्रश्न 18.
बुझा हुआ चूना मिलाकर जल को उबालने से वह मृदु क्यों हो जाता है ?
उत्तर:
अस्थायी कठोर जल में बुझा हुआ चूना मिलाकर जल को उबालने से उसमें विलेय बाइकार्बोनेट लवण, अविलेय कार्बोनेट लवणों में बदल जाते हैं जिन्हें छानकर अलग कर दिया जाता है।

प्रश्न 19.
कठोर जल में साबुन के रगड़े जाने पर झाग के देर से बनने का कारण स्पष्ट कीजिए । सम्बन्धित अभिक्रिया का समीकरण भी दीजिए।
उत्तर:
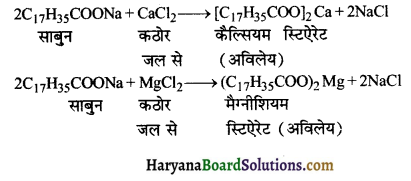
कठोर जल में कैल्सियम तथा मैग्नीशियम के क्लोराइड, सल्फेट, बाइकार्बोनेट्स इत्यादि साबुन (जो कि उच्च वसीय अम्लों के सोडियम लवण होते हैं) से क्रिया करके अविलेय कैल्सियम व मैग्नीशियम लवण बना लेते हैं जिससे कठोर जल झाग उत्पन्न नहीं करता है।
उदाहरण – सोडियम स्टिऐरेट एक उच्च वसीय अम्ल का लवण है अर्थात् साबुन है। यह कठोर जल में विद्यमान कैल्सियम व मैग्नीशियम लवणों से क्रिया करके अविलेय लवण बना लेता है जिससे साबुन झाग नहीं बनाता है।
प्रश्न 20.
जल की अस्थायी तथा स्थायी कठोरता से क्या तात्पर्य है ? ” कठोर जल में साबुन की काफी मात्रा व्यर्थ में चली जाती है।” समझाइए ।
उत्तर:
अस्थायी कठोरता (Temporary hard-ness) – जब जल में कैल्सियम तथा मैग्नीशियम के बाइकार्बोनेट लवण [Ca(HCO3)2 तथा Mg(HCO3)2] घुले होते हैं तो यह जल अस्थायी कठोर जल तथा इस प्रकार की कठोरता अस्थायी कठोरता कहलाती है। यह कठोरता जल को उबालने से सरलता से दूर हो जाती है।
स्थायी कठोरता (Permanent hardness) – जब जल में कैल्सियम तथा मैग्नीशियम के सल्फेट तथा क्लोराइड लवण घुले रहते हैं तो यह जल स्थायी कठोर जल तथा इस प्रकार की कठोरता स्थायी कठोरता कहलाती है। यह कठोरता उबालने से दूर नहीं होती ।
कठोर जल में अधिक साबुन खर्च होने का कारण (Reason of excess soap consumption in hard water) – कठोर जल में कैल्सियम, मैग्नीशियम के क्लोराइड, सल्फेट तथा बाइकार्बोनेट घुले होते हैं जिनसे क्रिया करके सोडियम स्टिऐरेट अर्थात् साबुन अविलेय लवण बनाता है जिससे साबुन झाग नहीं बनाता है। अतः कठोर जल में साबुन की क्रिया के कारण इसकी काफी मात्रा व्यर्थ में चली जाती है।
प्रश्न 21.
मृदु और कठोर जल में क्या अन्तर है?
उत्तर:
मृदु और कठोर जल में अन्तर
| मृदु जल | कठठेर जल |
| 1. यह साबुन के साथ आसानी से झाग देता है। | 1. यह साबुन के साथ कम झाग या देर में झाग उत्पन्न करता है। |
| 2. मृदु जल से कपड़े धोने में साबुन कम खर्च होता है। | 2. कठोर जल से कपड़े धोने में साबुन अधिक खर्च होता है। |
| 3. इसमें कैल्सियम व मैग्नीशियम के क्लोराइड, सल्फेट व बाइकार्बोनेट लवणों का अभाव होता है। | 3. इसमें कैल्सियम व मैग्नीशियम के क्लोराइड, सल्फेट तथा बाइकार्बोनेट लवण विलेय होते हैं। |
| 4. यह जल पीने के लिए उपयुक्त नहीं होता है; क्योंकि इसमें शरीर की वृद्धि के लिए कैल्सियम लवण नहीं घुले रहते हैं। | 4. यह जल कम मात्रा में पीने के लिए उपयोगी होता है। |
| 5. इसके प्रयोग से बॉयलर शीघ्र खराब नहीं होते हैं। | 5. इसके प्रयोग से बॉयलर शीघ्र खराब हो जाते हैं। |
प्रश्न 22.
जल की कठोरता दूर करने की जियोलाइट विधि में सोडियम जियोलाइट कुछ देर बाद अप्रभावी हो जाता है, क्यों ? इसे पुनः प्रभावी किस तरह बनाया जा सकता है ?
उत्तर:
अधिक समय तक उपयोग करने के पश्चात् जब सम्पूर्ण सोडियम परम्यूटिट, कैल्सियम अथवा मैग्नीशियम परम्यूटिट में बदल जाता है तो यह शक्तिहीन हो जाता है; अतः इसे शक्तिशाली करने के लिए नली में जल प्रवाह को रोककर, दूसरी नली द्वारा सोडियम क्लोराइड का विलयन प्रवाहित करते हैं। यह सोडियम क्लोराइड, कैल्सियम और मैग्नीशियम के जियोलाइट से क्रिया कर उन्हें पुनः सोडियम जियोलाइट में बदल देता है; अत: सोडियम परम्यूटिट पुनः जल को मृदु करने के योग्य हो जाता है।
\(\mathrm{CaZ}+2 \mathrm{NaCl} \longrightarrow \mathrm{CaCl}_2+\mathrm{Na}_2 \mathrm{Z}\)
प्रश्न 23.
परम्यूटिट क्या है? जल की कठोरता दूर करने में यह किस प्रकार सहायक हैं?
उत्तर:
परम्यूटिट सोडियम ऐलुमिनियम सिलिकेट नामक पदार्थ है। इसका सूत्र Na2Al2Si2O2 है। जल की कठोरता दूर करने के लिए इसे कठोर जल में प्रवाहित किया जाता है। जल में उपस्थित कैल्सियम तथा मैग्नीशियम लवण इसके साथ क्रिया करते हैं । सोडियम परमाणुओं के स्थान पर कैल्सियम या मैग्नीशियम परमाणु आ जाते हैं तथा कैल्सियम या मैग्नीशियम परम्यूटिट बन जाता है जिसे अलग कर लिया जाता है।
प्रश्न 24.
जल के स्वतः अपघटन से आप क्या समझते हैं?
उत्तर:
जब जल के दो अणु आपस में अभिक्रिया करते हैं तो अभिक्रिया के दौरान H+ आयन का आदान-प्रदान होता है। इस प्रकार जल का एक अणु अम्ल की भाँति जबकि दूसरा अणु क्षार की भाँति कार्य करता है। वह अणु जो H+ को ग्रहण करता है, H3O+ में परिवर्तित हो जाता
उत्तर:
सान्द्रता ग्राम/लीटर में. → 2.24 आयतन H2O2 का अर्थ है कि 1 लीटर H2O2 N. T. P. पर 2.24 लीटर O2 देता है।
2H2O2 → 2H2O + O2
2 × 34 1 mol
= 68g =22.4L
22.4 लीटर O2 प्राप्त होती है = 68 or H2O2 से
2.24 लीटर O2 प्राप्त होती है = \(\frac { 68×2.24 }{ 22.4 }\) = 6.8g/L
प्रतिशत सान्द्रता –

नॉर्मलता-
आयतन सान्द्रता 5.6 × नॉर्मलता
नॉर्मलता = \(\frac { 2.24 }{ 5.6 }\) = 0.4N
मोलरता- आयतन सान्द्रता = 11.2 × मोलरता
\(\frac { 2.24 }{ 5.6 }\) मोलरता
मोलरता = 0.2 M
प्रश्न 32.
’20 आयतन’ H2O2 की नॉर्मलता ज्ञात कीजिए ।
उत्तर:
20 आयतन H2O2 का अर्थ है कि यहाँ 1 लीटर H2O2 से 20 लीटर O2 N. T. P. पर प्राप्त होती है।
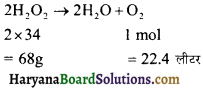
22.4 लीटर O2 हेतु N. T. P. पर आवश्यक
H2O2 = 68g
20 लीटर O2 हेतु N. T. P. पर आवश्यक
H2O2 = \(\frac { 68×20 }{ 22.4 }\) = 60.71 g/L

प्रश्न 33.
हाइड्रोजन परॉक्साइड की संरचना की विवेचना कीजिए ।
उत्तर:
हाइड्रोजन परॉक्साइड का अणुसूत्र H2O2 है। इसके लिए दो संरचना सूत्र प्रस्तुत किए गए हैं-
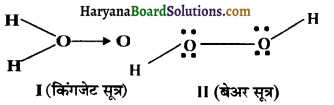
उत्तर:
किगंजेट द्वारा प्रस्तुत सूत्र की पुष्टि के प्रमाण-
(i) H2O2 जल और ऑक्सीजन में अपघटित होता है।
(ii) H2O2 की प्रकृति क्षीण अम्लीय है।
बेअर द्वारा प्रस्तुत सूत्र की पुष्टि के प्रमाण-
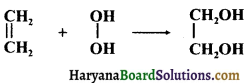
(i) H2O2 एथिलीन से क्रिया करके एथिलीन ग्लाइकॉल बनाता है जिससे यह विदित होता है कि H2O2 के अणु में दो -OH मूलक परस्पर ऑक्सीजन परमाणु द्वारा जुड़े हैं (HO- -OH)।
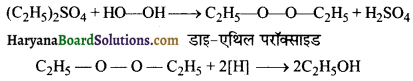
(ii) H2O2 डाइ – एथिल सल्फेट [ (C2H5)2 SO4] के साथ क्रिया करने पर डाइ – एथिल परॉक्साइड बनाता है जिसके अपचयन से एथिल ऐल्कोहॉल बनता है। इससे यह निष्कर्ष निकलता है कि H2O2 के एक अणु में O – O बन्ध उपस्थित है और एक-एक ऑक्सीजन परमाणु से केवल एक हाइड्रोजन जुड़ी है ।
(iii) यह क्लोरो सल्फोनिक अम्ल से अभिक्रिया करने पर डाइसल्फ्यूरिक अम्ल बनाता है जिसमें O – O बन्ध होता है। इससे सूत्र II की पुष्टि होती है।

(iv) द्विध्रुव आघूर्ण (dipole moment), अवरक्त अवशोषण स्पेक्ट्रा आदि भी सूत्र II की पुष्टि करते हैं। अब्राहम (Abraham, 1951) के अनुसार OH तथा O -O बन्ध के बीच का कोण 97° होता है। अब यह विश्वास किया जाता है कि H2O2 का जलीय विलयन दोनों सूत्रों का चलावयवी (tautomeric) साम्य है
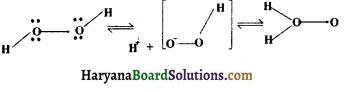
हाइड्रोजन परॉक्साइड की अम्लीय संरचना (Acidic structure of Hydrogen peroxide ) – ठोस हाइड्रोजन परॉक्साइड की संरचना एक खुली पुस्तक की तरह होती है, जिसमें पुस्तक के दोनों भागों के मध्य 90.2° का कोण होता है। दोनों ऑक्सीजन परमाणु पुस्तक के अक्ष पर तथा दोनों पृष्ठों पर एक-एक हाइड्रोजन परमाणु स्थित होता है।
O–O बन्ध दूरी = 145. 8pm, O-H बन्ध दूरी = 98.8pm,
O–O–H कोण = 101.9°
अतः इसका संरचना सूत्र निम्न है।
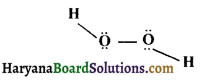
प्रश्न 34.
H2O2 अम्लीय तथा क्षारीय दोनों माध्यमों में प्रबल ऑक्सीकारक का कार्य करता है। विवेचना कीजिए ।
उत्तर:
अम्लीय माध्यम में ऑक्सीकारक गुण-
(i) \(2 \mathrm{FeSO}_4+\mathrm{H}_2 \mathrm{SO}_4+\mathrm{H}_2 \mathrm{O}_2 \longrightarrow \mathrm{Fe}_2\left(\mathrm{SO}_4\right)_3+2 \mathrm{H}_2 \mathrm{O}\)
(ii) \(2 \mathrm{KI}+\mathrm{H}_2 \mathrm{SO}_4+\mathrm{H}_2 \mathrm{O}_2 \longrightarrow \mathrm{K}_2 \mathrm{SO}_4+\mathrm{I}_2+2 \mathrm{H}_2 \mathrm{O}\)
(iii) \(\mathrm{PbS}+4 \mathrm{H}_2 \mathrm{O}_2 \longrightarrow \mathrm{PbSO}_4+4 \mathrm{H}_2 \mathrm{O}\)
क्षारीय माध्यम में ऑक्सीकारक गुण-
(i) \(\mathrm{Na}_2 \mathrm{SO}_3+\mathrm{H}_2 \mathrm{O}_2 \longrightarrow \mathrm{Na}_2 \mathrm{SO}_4+\mathrm{H}_2 \mathrm{O}\)
(ii) \(\mathrm{KNO}_2+\mathrm{H}_2 \mathrm{O}_2 \longrightarrow \mathrm{KNO}_3+\mathrm{H}_2 \mathrm{O}\)
(iii) \(\mathrm{Na}_3 \mathrm{AsO}_3+\mathrm{H}_2 \mathrm{O}_2 \longrightarrow \mathrm{Na}_3 \mathrm{AsO}_4+\mathrm{H}_2 \mathrm{O}\)
![]()
प्रश्न 35.
क्या होता है जब-
(i) BaO2 की क्रिया ठंडे तनु सल्फ्यूरिक अम्ल से कराते हैं।
(ii) BaO2 की क्रिया फॉस्फोरिक अम्ल से कराते हैं।
उत्तर:

प्रश्न 36.
निम्न को पूरा करें-
(i) PbS + H2O2
(ii) MnO4– + H2O
उत्तर:

प्रश्न 37.
’10 आयतन H2O2 विलयन का आयतन बताइये जो 200 ml के 2N KMnO4 के साथ अम्लीय माध्यम में अभिक्रिया करता है।
उत्तर:
’10 आयतन H2O2‘ की नॉर्मलता

हम जानते हैं कि,
N1V1(H2O2) = N2V2(KMnO4)
\(\frac { 10 }{ 5.6 }\) × V1 = 2 × 200
प्रश्न 38.
हाइड्रॉजीन तथा H2O2 का मिश्रण Cu(11) उत्प्रेरक की उपस्थिति में रोकेट प्रोपेलेन्ट की तरह कार्य करता है ? क्यों ?
उत्तर:
हाइड्रॉजीन तथा H2O2 के मध्य होने वाली अभिक्रिया अत्यधिक ऊष्माक्षेपी होती है तथा इसके साथ-साथ बनने वाले उत्पाद का आयतन बहुत अधिक बढ़ जाता है ।
अतः इसका मिश्रण रॉकेट के ईधन या प्रोपेलेन्ट की तरह प्रयुक्त होता है।
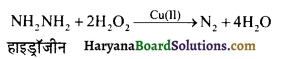
प्रश्न 39.
निम्न अभिक्रियाओं को लिखिए-
H2O2 के द्वारा अम्लीय एवं क्षारीय माध्यम में Fe2+ का Fe3+ आयनों में ऑक्सीकरण ।
उत्तर:
(i) अम्लीय माध्यम में,
\(2 \mathrm{Fe}^{2+}+\mathrm{H}_2 \mathrm{O}_2+2 \mathrm{H}^{+} \longrightarrow 2 \mathrm{Fe}^{3+}+2 \mathrm{H}_2 \mathrm{O}\)
(ii) क्षारीय माध्यम में,
\(2 \mathrm{Fe}^{2+}+4 \mathrm{OH}^{-}+\mathrm{H}_2 \mathrm{O}_2 \longrightarrow 2 \mathrm{Fe}(\mathrm{OH})_3\)
प्रश्न 40.
अभिक्रिया लिखें-
(i) H2O2 के द्वारा अम्लीय माध्यम में आयोडाइड आयन का आयोडीन में ऑक्सीकरण
(ii) H2O2 द्वारा अम्लीय डाईक्रोमेट आयन का ऑक्सीकरण ।
उत्तर:
(i) \(2 \mathrm{I}^{-}+\mathrm{H}_2 \mathrm{O}_2+2 \mathrm{H}^{+} \rightarrow \mathrm{I}_2+2 \mathrm{H}_2 \mathrm{O}\)
(ii) 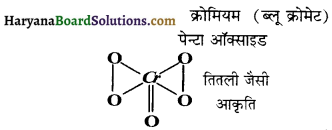
प्रश्न 41.
क्या होता है जब H2O2 अभिक्रिया करता है।
(i) क्षारीय पोटैशियम फेरी सायनाइड के साथ ।
(ii) सल्फ्यूरस अम्ल के साथ ।
(iii) सोडियम आर्सेनाइट के साथ ।
उत्तर:

प्रश्न 42.
H2O एवं D20 के गुणों को जानते हुए क्या आप मानते हैं कि D2O का उपयोग पेय-प्रयोजनों के रूप में किया जा सकता है ?
उत्तर:
नहीं, भारी जल पेय प्रयोजनों के रूप में उपयोगी नहीं होता है। इसके निम्न कारण हैं-
(i) भारी अणु होने के कारण D2O में आयतन H2O की तुलना में एक-तिहाई ही होता है।
(ii) D2O में बन्ध H2O की तुलना में अत्यन्त धीमी गति से टूटते हैं।
(iii) कम पराविद्युतांक के कारण इसमें आयनिक पदार्थ जल की तुलना में कम विलेय होते हैं। उपर्युक्त कारणों से भारी जल शरीर में होने वाली अपचयोपचयी अभिक्रियाओं को साधारण जल की तुलना में अति मन्द दर से करता है जिससे ये असन्तुलित हो जाती हैं। अतः यह स्वास्थ्य के लिए हानिकारक होता है। इसके अतिरिक्त इससे बीजों का अंकुरण रुक जाता है, इसमें रहने वाले टैडपोल तथा अन्य छोटे-छोटे जीव मर जाते हैं तथा यह पेड़-पौधों का विकास रोक देता है।
प्रश्न 43.
(i) भारी जल का अणुभार बताइए। भारी जल से ड्यूटीरियम बनाने के लिए एक रासायनिक अभिक्रिया का समीकरण दीजिए ।
(ii) सोडियम के साथ भारी जल की क्रिया का समीकरण लिखिए और अभिक्रिया के उत्पादों के नाम बताइए ।
(iii) भारी जल क्या है? यह कैसे प्राप्त होता है ?
उत्तर:
(i) भारी जल का अणुसूत्र D2O है जिसके आधार पर इसका अणुभार = 2 × 2 + 16 = 20 है। भारी जल से ड्यूटीरियम विद्युत अपघटन द्वारा प्राप्त कर सकते हैं जिसका रासायनिक समीकरण निम्नांकित प्रकार है-

(ii) सोडियम की भारी जल से अभिक्रिया का समीकरण निम्नांकित प्रकार से है-

(iii) ड्यूटीरियम ऑक्साइड (D2O) को भारी जल कहते हैं। इसका निर्माण साधारण जल की ड्यूटीरियम (D2) के साथ विनियम विधि द्वारा किया जा सकता है-
\(\mathrm{H}_2 \mathrm{O}+\mathrm{D}_2 \longrightarrow \mathrm{D}_2 \mathrm{O}+\mathrm{H}_2 \uparrow\)
प्रश्न 44.
(क) ड्यूटीरियम ऑक्साइड को भारी जल क्यों कहते हैं? केवल रासायनिक समीकरण देते हुए सल्फर डाइऑक्साइड से इसकी अभिक्रिया बताइए ।
(ख) भारी जल के उपयोग बताइए ।
(ग) भारी जल का न्यूट्रॉन विमन्दक तथा ट्रेसर के रूप में उपयोग समझाइए ।
उत्तर:
(क) भए पइड्रोजन में प्रोटॉन, 1 न्यूट्रॉन तथा 1 इलेक्ट्रॉन होता है, जबकि साधारण डाइहाइड्रोजन में 1 प्रोटॉन और 1 इलेक्ट्रॉन ही होता है। भारी हाइड्रोजन के नाभिक में एक अतिरिक्त न्यूट्रॉन के कारण यह भार में भारी होता है; अतः भारी हाइड्रोजन कहलाता है। भारी हाइड्रोजन से बने ड्यूटीरियम ऑक्साइड (D2O) का भार भी साधारण जल (H2O) से अधिक होता है; अत: इसे भारी जल कहते हैं।
D2O पर SO2 की अभिक्रिया से ड्यूटीरो सल्फ्यूरस अम्ल बनता है।
D2O+SO2 → D2SO3
(ख) भारी जल के प्रमुख उपयोग निम्नलिखित हैं-
(i) ड्यूटीरियम तथा इसके यौगिक बनाने में काम आता है। (ii) यह नाभिकीय अभिक्रियाओं में मन्दक (moderator) के रूप में प्रयुक्त होता है।
(iii) इसका उपयोग आरेख (tracer) के रूप में रासायनिक तथा जैव-अभिक्रियाओं की क्रियाविधि के अध्ययन में होता है।
(iv) आयनिक व अनायनिक हाइड्रोजन में विभेद करने में (In differentiating between ionic and non-ionic hydrogen)-आयनिक एवं अनायनिक हाइड्रोजन में विभेद करने में भारी जल का प्रयोग करते हैं। आयनिक हाइड्रोजन, अर्थात् वह हाइड्रोजन जोकि उच्च विद्युत् ऋणात्मकता वाले तत्वों से क्रिया कर यौगिक बनाती है, का विनिमय भारी जल के द्वारा आसानी से हो जाता है।
(ग) (i) न्यूट्रॉन विमन्दक के रूप में उपयोग (Uses as a neutron moderator) – नाभिकीय रिएक्टर में U235 पर मन्द गति के न्यूट्रॉनों की बमबारी करने के फलस्वरूप U235 का नाभिकीय विखण्डन हो जाता है और ऊर्जा उत्पन्न होती है। तीव्रगामी न्यूट्रॉनों की गति को मन्द करने के लिए उनको भारी जल से गुजारते हैं। इस प्रकार नाभिकीय रिएक्टरों में भारी जल का उपयोग न्यूट्रॉन विमन्दक के रूप में होता है।
(ii) ट्रेसर के रूप में उपयोग (Uses as a tracer) – D2O का उपयोग ट्रेसर के रूप में रासायनिक अभिक्रियाओं की क्रियाविधि ज्ञात करने में होता है। इससे ज्ञात होता है कि किस बन्ध का विदलन होता है और किस बन्ध का निर्माण होता है।
प्रश्न 45.
निम्न यौगिकों के नाम लिखें तथा उन अभिक्रियाओं को भी लिखें जिनके द्वारा ये बनाए जाते हैं।

प्रश्न 46.
बेरियम परॉक्साइड से H2O2 को बनाने के लिये सल्फ्यूरिक अम्ल के स्थान पर फॉस्फोरिक अम्ल को प्राथमिकता देते हैं, क्यों?
उत्तर:
क्योंकि बनने वाली H2O2 के अपघटन में H2SO4 उत्प्रेरक का कार्य करता है, इसलिये H2SO4 के स्थान पर फॉस्फोरिक अम्ल को प्राथमिकता देते हैं। साथ ही BaO2 पर BaSO4 की एक पर्त जम जाती है । जिससे BaO2 की क्रियाशीलता घट जाती है।
प्रश्न 47.
H2O2 की शीशी को खोलने से पहले ठण्डा करते हैं, क्यों ?
उत्तर:
H2O2 एक अस्थायी द्रव है, जो रखने पर या अधिक ताप पर अपघटित होकर जल व ऑक्सीजन को देता है। यदि खोलने से पहले शीशी को ठण्डा किया जाये तो द्रव का वाष्प दाब कम हो जाता है। यदि शीशी को ठण्डान किया जाये तो शीशी को खोलते ही विस्फोट हो सकता है।
प्रश्न 48.
H2O2 तथा O3 ओजोन में पाँच विभेद दें।
उत्तर:
| H2O2 (हाइड्रोजन परॉक्साइड) | O3 (ओजोन) |
| 1. यह एक गन्धहीन, रंगहीन व गाढ़ा द्रव होता है। | 1. मछली जैसी गन्ध की हल्के नीले रंग की गैस है। |
| 2. इसका मर्करी पर कोई भी प्रभाव नहीं पड़ता है। | 2. यह मर्करी की सतह को नष्ट कर देती है जिससे मर्करी काँच पर चिपक जाती है। |
| 3. इसका टेट्रामेथिल बेस पेपर पर कोई प्रभाव नहीं होता है। | 3. यह टेट्रामेथिल बेस पेपर को बैंगनी कर देती है। |
| 4. यह अम्लीय पोटैशियम परमैंगनेट विलयन को रंगहीन कर देता है। | 4. ओजोन अम्लीय पोटैशियम परमैंगनेट विलयन पर कोई प्रभाव नहीं डालती है। |
| 5. यह बेन्जीडीन पेपर पर कोई प्रभाव नहीं डालता है। | 5. यह बेन्जीडीन पेपर को भूरा कर देती है। |
प्रश्न 49.
कठोर जल को क्वथित्रों में प्रयोग करने से पहले मृदु बनाया जाता है, क्यों ?
उत्तर:
कठोर जल को जब क्वथित्रों में प्रयोग किया जाता है तो कठोर जल में उपस्थित लवण क्वथित्र के भीतर एक अघुलनशील परत बना लेते हैं, यह परत या पपड़ी ऊष्मा की कुचालक होती है इसलिये इसमें ईंधन का दुरुपयोग होता है तथा क्वथित्र का जीवन काल भी कम हो जाता है। इस कारण कठोर जल को क्वथित्रों में प्रयोग करने से पहले मृदु कर देते हैं।
प्रश्न 50.
क्या यह सत्य है कि हाइड्रोजन गैस धातु की तरह कार्य कर सकती है तथा यह किन परिस्थितियों में सम्भव है ?
उत्तर:
धातुएँ सदैव विद्युत धनात्मक तत्व होती हैं। जब किसी ऐसे यौगिक का विद्युत अपघटन होता है जिसमें धातुओं के साथ अधातुएँ भी उपस्थित हों तो धातुएँ सदैव कैथोड पर मुक्त होती हैं। इसी प्रकार हाइड्रोजन गैस यह व्यवहार तब प्रदर्शित करती है जब यह उच्च वैद्युत ऋणात्मक तत्व जैसे क्लोरीन के साथ संयोग कर यौगिक बनाये एवं यह यौगिक गलित अवस्था में विद्युत अपघट्य की तरह कार्य करे। ऐसी परिस्थिति में वैद्युत अपघटन होने पर हाइड्रोजन गैस सदैव कैथोड पर ही मुक्त होगी। यह व्यवहार धातुओं के समान ही है।
प्रश्न 51.
क्या होता है जब-
(1) O3 की H2O2 से क्रिया करायी जाती है।
(2) H2O2 की सिल्वर ऑक्साइड से अभिक्रिया होती है।
(3) फेरस सल्फेट के अम्लीय विलयन में H2O2 विलयन को मिलाया जाता है।
(4) H2O2 को KMnO4 के अम्लीय विलयन में मिलाते हैं।
(5) लेड सल्फाइड में H2O2 मिलाते हैं।
(6) क्षारीय पोटैशियम फेरीसायनाइड में H2O2 की क्रिया होती है।
(7) NaOH विलयन की उपस्थिति में क्रोमियम हाइड्रॉक्साइड की क्रिया H2O2 से होती है।
(8) H2O2 की क्रिया K2Cr2O7 और H2SO4 से होती है।
(9) H2O2 को KI विलयन में मिलाते हैं।
उत्तर:
(1) H2O2 ओजोन को ऑक्सीजन में अपचयित कर देता हैं।

(2) H2O2 सिल्वर ऑक्साइड Ag2O को Ag में अपचयित कर देता है।

(3) यह तनु अम्ल की उपस्थिति में फेरस सल्फेट को फेरिक सल्फेट में ऑक्सीकृत कर देता है।
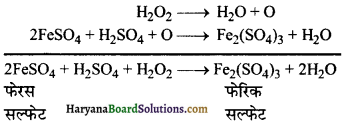
(4) अम्लीय माध्यम में हाइड्रोजन परॉक्साइड (H2O2) पोटैशियम परमैंगनेट (KMnO4) को मैंगनस सल्फेट (MnSO4) में अपंचयित कर देता है–
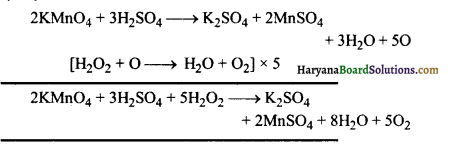
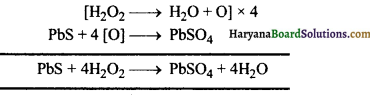
(5) हाइड्रोजन परॉक्साइड (H2O2) लेड सल्फाइड को लेड सल्फेट में ऑक्सीकृत कर देता है-
(6) क्षारीय माध्यम में K3[Fe(CN)6] को K4[Fe(CN)6] में अपचयित कर देता है।
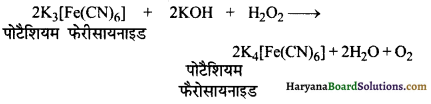
(7) NaOH के विलयन में निलम्बित क्रोमिक हाइड्रॉक्साइड में H2O2 डालने पर क्रोमियम लवणों का क्रोमेट में ऑक्सीकरण हो जाता है तथा विलयन का रंग पीला हो जाता है-

(8) यह अम्लीय पोटैशियम डाइक्रोमेट को नीले क्रोमिक परॉक्साइड या ब्लू परक्रोमेट (CrO5) में परिवर्तित कर देता है जो अम्ल से विघटित होकर ऑक्सीजन व क्रोमियम सल्फेट देता है-
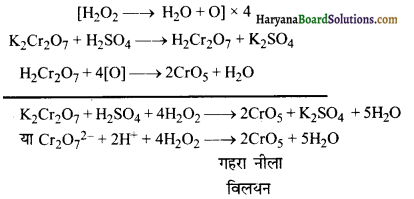
(9) यह अम्लीय पोटैशियम आयोडाइड विलयन से आयोडीन को मुक्त करता है-
\(\mathrm{H}_2 \mathrm{O}_2 \longrightarrow \mathrm{H}_2 \mathrm{O}+\mathrm{O}\)
\(2 \mathrm{KI}+\mathrm{H}_2 \mathrm{SO}_4+\mathrm{O} \longrightarrow \mathrm{K}_2 \mathrm{SO}_4+\mathrm{H}_2 \mathrm{O}+\mathrm{I}_2\)
\(2 \mathrm{KI}+\mathrm{H}_2 \mathrm{O}_2+\mathrm{H}_2 \mathrm{SO}_4 \longrightarrow \mathrm{K}_2 \mathrm{SO}_4+2 \mathrm{H}_2 \mathrm{O}+\mathrm{I}_2\)