Haryana State Board HBSE 12th Class Chemistry Solutions Chapter 3 वैद्युत रसायन Textbook Exercise Questions and Answers.
Haryana Board 12th Class Chemistry Solutions Chapter 3 वैद्युत रसायन
प्रश्न 3.1.
निम्नलिखित धातुओं को उस क्रम में व्यवस्थित कीजिए जिसमें वे एक-दूसरे को उनके लवणों के विलयनों में से प्रतिस्थापित करती हैं-
Al, Cu, Fe, Mg एवं Zn.
उत्तर:
दी गई धातुओं का एक-दूसरे को उनके लवणों के विलयनों में प्रतिस्थापित करने का क्रम निम्नलिखित है। यह इनकी क्रियाशीलता का घटता क्रम है-
Mg Al Zn Fe Cu
प्रश्न 3.2.
नीचे दिए गए मानक इलेक्ट्रॉड विभवों के आधार पर धातुओं को उनकी बढ़ती हुई अपचायक क्षमता के क्रम में व्यवस्थित कीजिए –
K+/K = – 2.93 V, Ag+/Ag = 0.80 V.
Hg2+/Hg = 0.79 V
Mg2+/Mg = – 2.37 V, Cr3+/Cr = – 0.74 V
उत्तर:
जब धातु का ऑक्सीकरण विभव उच्च होता है अर्थात् धातु आयन का अपचयन विभव निम्न (Low) होता है तो उस धातु की इलेक्ट्रॉन देने की प्रवृत्ति अधिक होती है तथा वह प्रबल अपचायक होता है। अतः दिए गए मानक इलेक्ट्रॉड विभव (अपचयन विभव) मानों के आधार पर इन धातुओं की अपचायक क्षमता का बढ़ता क्रम निम्न प्रकार होगा-
Ag < Hg < Cr < Mg < K
![]()
प्रश्न 3.3.
उस गैल्वैनी सेल को दर्शाइए जिसमें निम्नलिखित अभिक्रिया होती है—
Zn(s) + 2Ag+(aq) → Zn2+(aq) + 2Ag(s),
अब बताइए-
(i) कौन-सा इलेक्ट्रॉड ऋणात्मक आवेशित है?
(ii) सेल में विद्युत धारा के वाहक कौन से हैं?
(iii) प्रत्येक इलेक्ट्रॉड पर होने वाली अभिक्रिया क्या है?
उत्तर:
दी गयी अभिक्रिया के आधार पर गैल्वेनी सेल (विद्युत रासायनिक सेल) को निम्न प्रकार से दर्शाया जा सकता है-
![]()
(i) इस सेल में Zn | Zn+2 इलेक्ट्रॉड ऋणात्मक आवेशित है अतः यह ऐनोड होगा।
(ii) सेल में विद्युत धारा के वाहक इलेक्ट्रॉन हैं तथा धारा का प्रवाह. सिल्वर इलेक्ट्रॉड से जिंक इलेक्ट्रॉड की ओर होता है क्योंकि विद्युत धारा का प्रवाह, इलेक्ट्रॉन के प्रवाह की विपरीत दिशा में होता है।
(iii) कैथोड पर होने वाली अभिक्रिया निम्नलिखित है-
2Ag+ +2e– → 2Ag
तथा ऐनोड पर होने वाली अभिक्रिया निम्नलिखित है-
Zn → Zn2+ +2e–
प्रश्न 3.4.
निम्नलिखित अभिक्रियाओं वाले गैल्वेनी सेल का मानक सेल विभव परिकलित कीजिए-
(i) 2Cr(s) + 3Cd2+(aq) → 2Cr3+(aq) + 3Cds
(ii) Fe2+ (aq) + Ag+ (aq) → Fe3+(aq) + Ag(s)
उपरोक्त अभिक्रियाओं के लिए △rG एवं साम्य स्थिरांकों की भी गणना कीजिए ।
उत्तर:
सक्रियता श्रेणी से –

प्रश्न 3.5.
निम्नलिखित सेलों की 298 K पर नेस्ट समीकरण एवं emf लिखिए-
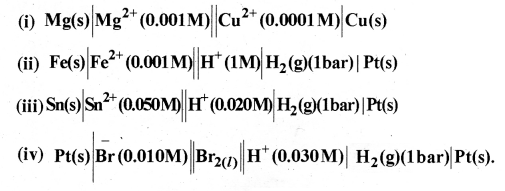
उत्तर:
सक्रियता श्रेणी से –



![]()
प्रश्न 3.6.
घड़ियों एवं अन्य युक्तियों में अत्यधिक उपयोग में आने वाली बटन सेलों में निम्नलिखित अभिक्रिया होती है-
उत्तर:
Zn(s) + Ag2O(s) + H2O(1) Zn2+(aq) + 2Ag(s) + 2OH–(aq)
सक्रियता श्रेणी से –

प्रश्न 3.7.
किसी वैद्युत अपघट्य के विलयन की चालकता एवं मोलर चालकता की परिभाषा दीजिये। सांद्रता के साथ इनके परिवर्तन की विवेचना कीजिए।
उत्तर:
चालकता (k) – प्रतिरोधकता ( या विशिष्ट प्रतिरोध) के व्युत्क्रम (विपरीत) को चालकता कहते हैं। चालकता को विशिष्ट चालकत्व भी कहते हैं। इसका प्रतीक K है तथा K = \(\frac { 1 }{ p }\)
अथवा किसी सान्द्रता पर विलयन की चालकता उसके इकाई आयतन का चालकत्व होता है जिसे इकाई दूरी पर स्थित इकाई अनुप्रस्थ काट क्षेत्रफल वाले दो इलेक्ट्रॉडों के मध्य रखा गया हो ।
मोलर चालकता (∧m) – किसी दी गई सांद्रता पर एक विलयन की मोलर चालकता उस विलयन के आयतन का चालकत्व है, जिसमें वैद्युत अपघट्य का एक मोल घुला हो तथा जो एक-दूसरे से इकाई दूरी पर स्थित, A अनुप्रस्थ काट क्षेत्रफल वाले दो इलेक्ट्रॉडों के मध्य रखा गया हो।
अथवा
मोलर चालकता किसी वैद्युत अपघट्य के विलयन के उस आयतन का चालकत्व है जिसे चालकता सेल के इकाई दूरी पर स्थित इलेक्ट्रॉडों के मध्य रखा गया है एवं जिनका अनुप्रस्थ काट क्षेत्रफल इतना है कि वह विलयन के उस आयतन (V) को रख सकें, जिसमें वैद्युत अपघट्य का एक मोल घुला हो । अतः एक मोल विद्युत अपघट्य को विलयन में घोलने पर प्राप्त आयनों की चालकता को मोलर चालकता कहते हैं।
वैद्युत अपघट्य की सांद्रता में परिवर्तन से चालकता तथा मोलर चालकता दोनों परिवर्तित होती हैं। प्रबल तथा दुर्बल दोनों प्रकार के वैद्युत अपघट्यों की सांद्रता कम करने पर चालकता हमेशा कम होती है क्योंकि तनुता बढ़ाने पर प्रति इकाई आयतन में विद्युतधारा ले जाने वाले आयनों की संख्या कम हो जाती है।
सान्द्रता कम होने पर मोलर चालकता बढ़ती है क्योंकि वह कुल आयतन (V) बढ़ जाता है जिसमें एक मोल वैद्युत अपघट्य उपस्थित हो। (∧m = kV) तथा आयतन में वृद्धि k में कमी की तुलना में अधिक होती है।
प्रश्न 3.8.
298 K पर 0.20M KCl विलयन की चालकता 0.0248 S cm-1 है। इसकी मोलर चालकता का परिकलन कीजिए ।
उत्तर:

प्रश्न 3.9
298 K पर एक चालकता सेल जिसमें 0.001 M KCl विलयन है, का प्रतिरोध 1500Ω है। यदि 0.001 M KCl विलयन की चालकता 298 K पर 0.146 × 10-3 S cm-1 हो तो सेल स्थिरांक क्या है ?
उत्तर:
सेल स्थिरांक (G*) = ![]() = \(\frac { K }{ G }\)
= \(\frac { K }{ G }\)
प्रतिरोध R = \(\frac { 1 }{ G }\)
अतः सेल स्थिरांक = चालकता × प्रतिरोध
चालकता (k) = 0.146 × 10-3S cm-1
प्रतिरोध R = 1500Ω
अतः सेल स्थिरांक = 0.146 × 10-3 × 1500
सेल स्थिरांक = 0.219 cm cm-1
प्रश्न 3.10
298K पर सोडियम क्लोराइड की विभिन्न सांद्रताओं पर चालकता का मापन किया गया जिसके आँकड़े निम्नलिखित हैं-
सांद्रता/M 0.001 0.010 0.020 0.050 0.100 102 × k/S m1 1.237 11.85 23.15 55.53106.74 सभी सांद्रताओं के लिए ∧m का परिकलन कीजिए एवं ∧m तथा C1/2 के मध्य एक आलेख खींचिए । ∧om का मान ज्ञात कीजिए ।
उत्तर:
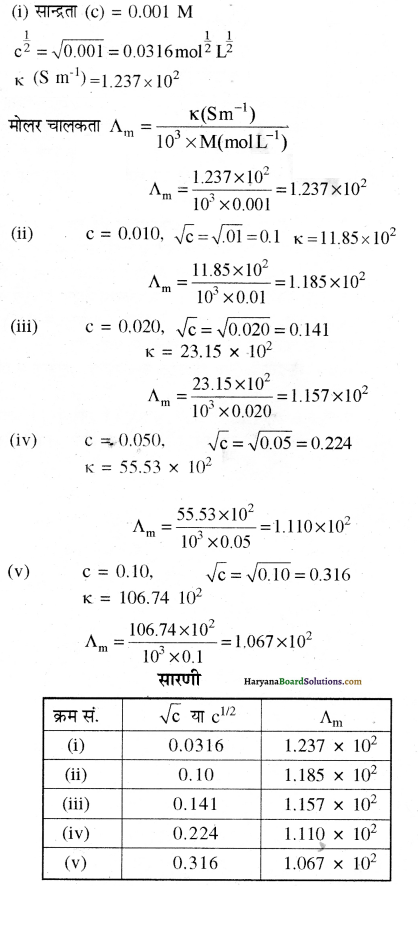
∧m C1/2 के मध्य आलेखित करने पर एक सीधी रेखा प्राप्त होती है जिसमें ∧m का मान C1/2 के साथ कम होता है।
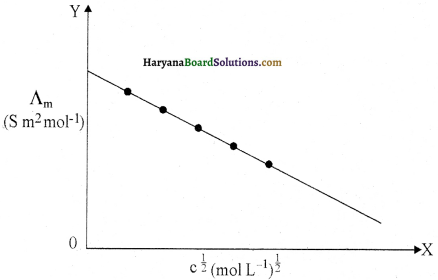
ग्राफ का शून्य सान्द्रता तक बहिर्वेशन करके ∧0m का मान ज्ञात किया जाता है जो कि लगभग 1.255 × 102 m2 mol-1 आता है।
अतः ∧0m = 1.255 × 102 m2 mol-1
प्रश्न 3.11
0.00241 M ऐसीटिक अम्ल की चालकता 7.896 × 10-5S cm-1 है। इसकी मोलर चालकता को परिकलित कीजिए। यदि ऐसीटिक अम्ल के लिए ∧0m का मान 390.5 S cm2 mol-1 हो तो इसका वियोजन स्थिरांक क्या है?
उत्तर:
मोलर चालकता (∧m) = 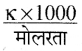
चालकता (k) = 7.896 × 10-5S cm-1,
मोलरता = 0.00241M
अतः ∧m = \(\frac{7.896 \times 10^{-5} \times 1000}{0.00241}\)
∧m = 32.76 S cm2 mol-1
वियोजन की मात्रा,
α = \(\frac{\Lambda_{\mathrm{m}}}{\Lambda_{\mathrm{m}}^{\circ}}\)
\(\Lambda_{\mathrm{m}}^0\) = 390.5 S cm2 mol-1
अतः α = \(\frac { 32.76 }{ 390.5 }\) = 8.4 × 10-2
वियोजन स्थिरांक (Ka) = \(\frac{c \alpha^2}{1-\alpha}\)
α = 8.4 × 10-2
अतः Ka = \(\frac{0.00241 \times\left(8.4 \times 10^{-2}\right)^2}{1-8.4 \times 10^{-2}}\)
Ka = \(\frac{0.00241 \times 70.56 \times 10^{-4}}{1-0.084}\)
Ka = \(\frac{0.1700 \times 10^{-4}}{0.916}\)
Ka = 0.1855 × 10-4
Ka = 1.85 × 10-5
प्रश्न 3.12.
निम्नलिखित के अपचयन के लिए कितने आवेश की आवश्यकता होगी ?
(i) 1 मोल Al3+ को Al में
(ii) 1 मोल Cu2+ को Cu में
(iii) 1 मोल \(\mathrm{MnO}_4^{-}\) को Mn2+ में ।
उत्तर:
(i) इलेक्ट्रॉड अभिक्रिया है – Al3+ + 3e– → Al
अतः 1 मोल Al3+ के अपचयन के लिए 3F आवेश की आवश्यकता होगी क्योंकि इस अभिक्रिया में 3 मोल इलेक्ट्रॉन प्रयुक्त हो रहे हैं तथा 3 फैराडे = 3 × 96500 कूलॉम (C) = 289500 C
(ii) अभिक्रिया – Cu2+ +2e → Cu
1 मोल Cu2+ के अपचयन के लिए 2F आवेश की आवश्यकता होगी तथा 2 फैराडे
= 2 × 96500 C = 193000 C
(iii) अभिक्रिया – MnO–4 → Mn2+
MnO–4 में Mn का ऑक्सीकरण अंक +7 है तथा यह Mn2+ बना रहा है अतः इसमें 5 इलेक्ट्रॉन प्रयुक्त हो रहे हैं। इसलिए 1 मोल MnO–4 के Mn2+ में अपचयन के लिए 5F आवेश की आवश्यकता होगी तथा
5F = 5 × 96500 C = 482500 C
![]()
प्रश्न 3.13.
निम्नलिखित को प्राप्त करने में कितने फैराडे विद्युत की आवश्यकता होगी ?
(i) गलित CaCl2 से 20.0g Ca
(ii) गलित Al2O3 से 40.0 g Al
उत्तर:
(i) गलित CaCl2 से Ca प्राप्त करने में कैथोड पर निम्न अभिक्रिया होगी-
Ca2+ + 2e– → Ca
Ca का 1 मोल = 40g (परमाणु द्रव्यमान)
अतः अभिक्रिया के अनुसार 40g Ca प्राप्त करने के लिए आवश्यक विद्युत की मात्रा : = 2 F
तो 20 g Ca प्राप्त करने के लिए 1 F विद्युत की आवश्यकता होगी।
(ii) गलित Al2O3 से Al प्राप्त करने के लिए कै थोड पर अभिक्रिया – Al3+ +3e– → Al
Al का परमाणु द्रव्यमान = 27 g = 1 मोल
अतः अभिक्रिया के अनुसार 27 g Al प्राप्त करने के लिए आवश्यक विद्युत = 3 F
तो 40 g Al के लिए = \(\frac{3 F \times 40}{27}\) = 4.44F विद्युत आवश्यक होगी।
प्रश्न 3.14.
निम्नलिखित को ऑक्सीकृत करने के लिए कितने कूलॉम विद्युत आवश्यक है ?
(i) 1 मोल H2O को O2 में ।
(ii) 1 मोल FeO को Fe2O3 में ।
उत्तर:
(i) H2O से 02 बनने की अभिक्रिया निम्नलिखित है-
2H2O → O2 + 4H+ + 4e–
यहाँ 2 मोल H2O से 4 मोल इलेक्ट्रॉन निकल रहे हैं अतः 1 मोल H2O से 2 मोल इलेक्ट्रान निकलेंगे इसलिए 1 मोल H2O के ऑक्सीकरण के लिए आवश्यक विद्युत की मात्रा = 2F = 2 × 96,500 कूलॉम
विद्युत की मात्रा = 1,93,000 कूलॉम
(ii) FeO से Fe2O3 का बनना निम्नलिखित अभिक्रिया के अनुसार होता है-
![]()
यहाँ Fe2+ से Fe3+ बन रहा है अतः 1 मोल FeO को Fe2O3 में आक्सीकृत करने के लिए आवश्यक विद्युत की मात्रा = 1F = 96,500 कूलॉम।
प्रश्न 3.15.
Ni(NO3)2 के एक विलयन का प्लैटिनम इलेक्ट्रॉडों के बीच 5 ऐम्पियर की धारा प्रवाहित करते हुए 20 मिनट विद्युत अपघटन किया गया। Ni की कितनी मात्रा कैथोड पर निक्षेपित होगी?
उत्तर:
प्रवाहित की गई विद्युत की मात्रा – Q = I t
I = 5 ऐम्पियर, t = समय सेकण्ड = 20 × 60s
Q = 5 × 20 × 60 = 6000C
कैथोड पर निम्नलिखित अभिक्रिया होगी-
Ni2+ + 2e– → Ni
Ni का परमाणु द्रव्यमान = 58.7 (1 मोल)
अभिक्रिया के अनुसार 2F या 2 × 96500C विद्युत प्रवाहित करने पर प्राप्त Ni की मात्रा = 58.7g
अतः 6000C विद्युत प्रवाहित करने पर प्राप्त Ni-
= \(\frac{58.7 \times 6000}{2 \times 96500}\) = 1.824 g
अतः Ni की कैथोड पर निक्षेपित मात्रा = 1.8248 g
प्रश्न 3.16.
ZnSO4, AgNO3 एवं CuSO4 विलयन वाले तीन वैद्युत अपघटनी सेलों A,B,C को श्रेणीबद्ध किया गया एवं 1.5 ऐम्पियर की विद्युतधारा, सेल B के कैथोड पर 1.45 g सिल्वर निपेक्षित होने तक लगातार प्रवाहित की गई। विद्युतधारा कितने समय तक प्रवाहित हुई? निपेक्षित कॉपर एवं जिंक का द्रव्यमान क्या होगा?
उत्तर:
सेल B के कैथोड पर सिल्वर के निक्षेपित होने में निम्नलिखित अभिक्रिया प्रयुक्त होती है-
Ag+ +e– → Ag
Ag का परमाणु द्रव्यमान = 108g (1 मोल)
108 g Ag के निक्षेपण के लिए आवश्यक विद्युत की मात्रा = 96500 C
अतः 1.45 g सिल्वर के निक्षेपण के लिए
= \(\frac{96500}{108}\) × 1.45
= 1295.6 C विद्युत आवश्यक होगी।
आवेश Q = I t, t = \(\frac { Q }{ I }\) = \(\frac{1295.6}{1.5}\) = 863.73 सेकंड
अतः मिनट में समय = \(\frac{863.73}{60}\) = 14.39 = 14.40 मिनट
अतः विद्युत धारा 14.40 मिनट तक प्रवाहित हुई।
Cu के निक्षेपण के लिए आवश्यक अभिक्रिया
Cu2+ + 2e– → Cu
Cu का परमाणु द्रव्यमान = 63.5g (1 मोल)
अतः 2 × 96500 C विद्युत से प्राप्त कॉपर 63.5 g
1295.6C विद्युत से प्राप्त कॉपर = \(\frac{63.5 \times 1295.6}{2 \times 96500}\) = 0.426 g
अतः निक्षेपित कॉपर का द्रव्यमान = 0.426 g
Zn के निक्षेपण के लिए आवश्यक अभिक्रिया-
Zn2+ +2e– → Zn
Zn का परमाणु द्रव्यमान = 65 g (1 मोल)
2 × 96500 C विद्युत से प्राप्त जिंक = 65g
अतः 1295.6 C विद्युत से प्राप्त जिंक
= \(\frac{65 \times 1295.6}{2 \times 96500}\) = 0.436 g
अतः निक्षेपित जिंक का द्रव्यमान = 0.436 g
प्रश्न 3.17.
सारणी 3.1 में दिए गए मानक इलेक्ट्रॉड विभवों की सहायता से अनुमान लगाइए कि क्या निम्नलिखित अभिकर्मकों के बीच अभिक्रिया संभव है?
(i) Fe3+ (aq) और I–(aq)
(ii) Ag+ (aq) और Cu(s)
(iii) Fe3+(aq) और Br– (aq)
(iv) Ag(s) और Fe3+(aq)
(v) Br2(aq) और Fe2+(aq)
उत्तर:
(i) Fe3+(aq) और I– (aq) के बीच अभिक्रिया संभव है
क्योंकि ![]() का मान
का मान ![]() मान से अधिक है तथा इसके लिए
मान से अधिक है तथा इसके लिए ![]() है। यह अभिक्रिया निम्न प्रकार होगी-
है। यह अभिक्रिया निम्न प्रकार होगी-
Fe3+ + I– (aq) → Fe2+ (aq) + \(\frac { 1 }{ 2 }\) I2
(ii) Ag+(aq) तथा Cu(s) के मध्य अभिक्रिया भी संभव है।
क्योंकि ![]() का मान
का मान ![]() मान से अधिक है तथा इसके लिए
मान से अधिक है तथा इसके लिए ![]() एवं यह अभिक्रिया निम्न प्रकार होगी-
एवं यह अभिक्रिया निम्न प्रकार होगी-
2Ag+ (aq) + Cu(s) → Cu2+ (aq) + 2Ag(s)
(iii) Fe3+ (aq) तथा Br– (aq) के बीच अभिक्रिया संभव नहीं है क्योंकि ![]() का मान
का मान ![]() मान से कम है तथा इसके लिए सैल
मान से कम है तथा इसके लिए सैल ![]() अतः Br– आयन Fe3+ आयनों का अपचयन नहीं कर सकते।
अतः Br– आयन Fe3+ आयनों का अपचयन नहीं कर सकते।
(iv) Ag(s) तथा Fe3+ (aq) के बीच भी अभिक्रिया संभव नहीं है क्योंकि ![]() का मान
का मान ![]() मान से कम है तथा इसके लिए
मान से कम है तथा इसके लिए ![]() अतः Ag, Fe+3 का अपचयन नहीं कर सकता ।
अतः Ag, Fe+3 का अपचयन नहीं कर सकता ।
(v) Br2(aq) तथा Fe2+ (aq) के बीच अभिक्रिया होगी क्योंकि ![]() का मान,
का मान, ![]() मान से अधिक है तथा इसके लिए
मान से अधिक है तथा इसके लिए ![]() अतः Fe2+, Br2 का अपचयन कर सकता है। यह अभिक्रिया निम्न प्रकार होगी-
अतः Fe2+, Br2 का अपचयन कर सकता है। यह अभिक्रिया निम्न प्रकार होगी-
Fe2+ (aq) + Br2 (aq) → Fe3+ (aq) + 2Br– (aq)
प्रश्न 3.18.
निम्नलिखित में से प्रत्येक के लिए वैद्युत अपघटन से प्राप्त उत्पाद बताइए-
(i) सिल्वर इलेक्ट्रॉडों के साथ AgNO3 का जलीय विलयन
(ii) प्लैटिनम इलेक्ट्रॉडों के साथ AgNO3 का जलीय विलयन
(iii) प्लैटिनम इलेक्ट्रॉडों के साथ H2SO4 का तनु विलयन
(iv) प्लैटिनम इलेक्ट्रॉडों के साथ CuCl2 का जलीय विलयन |
उत्तर:
(i) सिल्वर इलेक्ट्रॉडों के साथ AgNO3 के जलीय विलयन का वैद्युत अपघटन करने पर ऐनोड पर सिल्वर इलेक्ट्रॉड अभिक्रिया में भाग लेगा क्योंकि यह क्रियाशील इलेक्ट्रॉड है अतः
कैथोड पर – Ag+ से Ag बनेगा (अपचयन)
Ag+ (aq) + e– → Ag(s) तथा
ऐनोड पर – Ag का Ag+ में ऑक्सीकरण होगा
Ag(s)→ Ag (aq) + e ̄

(ii) प्लैटिनम इलेक्ट्रॉडों के साथ AgNO3 के जलीय विलयन का विद्युत अपघटन करने पर Pt अभिक्रिया में भाग नहीं लेगा क्योंकि यह अक्रिय इलेक्ट्रॉड है अतः कैथोड पर अभिक्रिया IMG होगी तथा ऐनोड पर अभिक्रिया
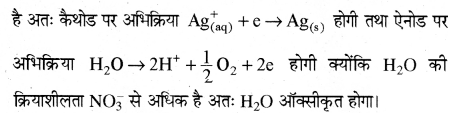
(iii) प्लैटिनम इलेक्ट्रॉडों के साथ H2SO4 के तनु विलयन का विद्युत अपघटन करने पर निम्नलिखित अभिक्रियाएँ होंगी क्योंकि SO- आयन H2O की तुलना में कम क्रियाशील है।
कैथोड पर 2H+ + 2e– → H2 (अपचयन)
एनोड पर_H2O → 2H+ + \(\frac { 1 }{ 2 }\)O2 + 2e– (ऑक्सीकरण)
(iv) प्लैटिनम इलेक्ट्रॉडों के साथ CuCl2 के जलीय विलयन का विद्युत अपघटन करने पर निम्नलिखित अभिक्रियाएँ होंगी-
कैथोड पर – Cu2+ + 2e– → Cu
Cu2+, H2O (H+) से अधिक क्रियाशील है।
ऐनोड पर – 2Cl– – 2e– → Cl2
Cl–,H2O(ŌH) से अधिक क्रियाशील है।
HBSE 12th Class Chemistry वैद्युत रसायन Intext Questions
प्रश्न 3.1.
निकाय Mg2+| Mg का मानक इलेक्ट्रॉड विभव आप किस प्रकार ज्ञात करेंगे?
उत्तर:
निकाय Mg2+| Mg का मानक इलेक्ट्रॉड विभव ज्ञात करने के लिए इसे मानक हाइड्रोजन इलेक्ट्रॉड (SHE) से जोड़कर सेल का विद्युत वाहक बल ज्ञात करते हैं। विद्युत वाहक बल ज्ञात करने के लिए वोल्टमीटर या पोटेन्शियोमीटर (विभवमापी) प्रयुक्त किया जाता है। मानक हाइड्रोजन इलेक्ट्रॉंड एक संदर्भ इलेक्ट्रॉड है जिसका इलेक्ट्रॉड विभव शून्य होता है। अतः सेल का विद्युत वाहक बल (emf) दूसरी अर्ध सेल (Mg2+| Mg) के मानक इलेक्ट्रॉड विभव (अपचयन विभव) के बराबर होगा। यहाँ Mg2+| Mg कैथोड के रूप में लिया जाता है।
प्रश्न 3.2.
क्या आप एक जिंक के पात्र में कॉपर सल्फेट का विलयन रख सकते हैं?
उत्तर:
जिंक के पात्र में कॉपर सल्फेट (CuSO4) का विलयन नहीं रखा जा सकता क्योंकि Zn, Cu से अधिक क्रियाशील धातु है अर्थात् Cu से Zn अधिक अपचायक है। अतः यह कॉपर सल्फेट के विलयन से क्रिया करके ZnSO4 बना देता है तथा Cu धातु अवक्षेपित हो जाती है।
\(\mathrm{Zn}_{(\mathrm{s})}+\mathrm{Cu}^{+2} \mathrm{SO}_{4(\mathrm{aq})}^{-2} \rightarrow \mathrm{Zn}^{+2} \mathrm{SO}_{4(\mathrm{aq})}^{-2}+\mathrm{Cu}_{(\mathrm{s})}\)
प्रश्न 3.3.
मानक इलेक्ट्रॉड विभव की तालिका का निरीक्षण कर तीन ऐसे पदार्थ बताइए जो अनुकूल परिस्थितियों में फेरस आयनों को ऑक्सीकृत कर सकते हैं।
उत्तर:
Fe+3/Fe+2 के लिए E° का मान 0.77 V है अतः वे पदार्थ जिनके लिए E° का मान इससे अधिक होता है वे Fe+2 को Fe+3 में ऑक्सीकृत कर सकते हैं। मानक इलेक्ट्रॉड विभव की तालिका के आधार पर ये पदार्थ हैं-
(i) \(\mathrm{Cr}_2 \mathrm{O}_7^{2-}\) (अम्लीय माध्यम में ),
(ii) जलीय Br2 या Cl2 तथा
(iii) जलीय Ag+
![]()
प्रश्न 3.4.
pH = 10 के विलयन के संपर्क वाले हाइड्रोजन इलेक्ट्रॉड के विभव का परिकलन कीजिए।
उत्तर:
विलयन का pH = 10 है अतः [H+] = 10-10 mol L-1 हाइड्रोजन इलेक्ट्रॉड के लिए-
नेर्न्स्ट समीकरण निम्न प्रकार होगा-
\(\mathrm{E}_{\mathrm{H}^{+} / \mathrm{H}}=\mathrm{E}_{\mathrm{H}^{+} / \mathrm{H}}^{\circ}-\frac{\mathrm{RT}}{\mathrm{nF}} \ln \frac{1}{\left[\mathrm{H}^{+}\right]}\)
अतः हाइड्रोजन इलेक्ट्रॉडड का विभव = – 0.59 V
प्रश्न 3.5.
एक सेल के emf का परिकलन कीजिए, जिसमे निम्नलिखित अभिक्रिया होती है। दिया गया है E°(सेल) =1.05 V
Ni(s) + 2Ag+(0.002M) → Ni2+(0.160M)+2Ag(s)
उत्तर:
किसी सेल का emf

प्रश्न 3.6.
एक सेल जिसमें निम्नलिखित अभिक्रिया होती है- 2Fe3+(aq) + 21–(aq) → 2Fe2+(aq) + I2(S) का 298 K ताप पर E° सेल = 0.236 V है। सेल अभिक्रिया की मानक गिब्ज ऊर्जा एवं साम्य स्थिरांक का परिकलन कीजिए।
उत्तर:
(a) मानक गिब्ज ऊर्जा △G° = -nFE° सेल
n = 2 (सम्पूर्ण अभिक्रिया के लिए)
F = 96500C, E° सेल = 0.236 V
मान रखने पर,
△G° = – 2 × 96500 × 0.236
△G° = – 45548 J mol-1
या △G° = – 45548 KJ mol-1
(b) साम्य स्थिरांक का परिकलन निम्नलिखित सूत्र से किया जाता है-
△G° = – 2.303RT log KC
log KC = – \(\frac{\Delta \mathrm{G}^{\circ}}{2.303 \mathrm{RT}}\)
△G° = – 45.548 J mol-1
R = 8.314J, T = 298 K
मान रखने पर,
log KC = – \(\frac{-45548}{2.303 \times 8.314 \times 298}\)
log KC = \(\frac { 45548 }{ 5705.848 }\)
log KC = 7.9826
KC = Antilog (7.9826)
KC = 9.6 × 107
प्रश्न 3.7.
किसी विलयन की चालकता तनुता के साथ क्यों घटती है?
उत्तर:
किसी विलयन की तनुता बढ़ाने पर प्रति इकाई आयतन में विद्युत धारा ले जाने वाले आयनों की संख्या कम हो जाती है अतः विलयन की चालकता घट जाती है।
प्रश्न 3.8.
जल की \(\Lambda_m^o\) ज्ञात करने का एक तरीका बताइए।
उत्तर:
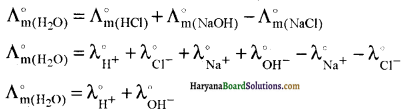
जल एक बहुत दुर्बल विद्युत अपघट्य माना जाता है अतः कोलराउश के नियम से जल के लिए \(\Lambda_m^o\) ज्ञात कर सकते हैं क्योंक HCl, NaOH तथा NaCl प्रबल विद्युत अपघट्य हैं जिनके लिए \(\Lambda_m^o\) के मान \(\Lambda_m\) तथा c1/2 के मध्य ग्राफ़ के बहिर्वेशन से प्राप्त कर सकते हैं। अतः \(\Lambda_m^o\) के मानों का प्रयोग कर निम्नलिखित समीकरण द्वारा जल के लिए \(\Lambda_m^o\) ज्ञात किया जा सकता है-
प्रश्न 3.9.
0.025 mol L-1 मेथेनॉइक अम्ल की मोलर चालकता 46.1 S cm2 mol-1 है। इसकी वियोजन की मात्रा एवं वियोजन स्थिरांक का पस्किलन कीजिए। दिया गया है-
λ ° (H+) = 349.6 S cm2 mol-1 एवं λ ° (HCOO–) = 546. S cm2 mol-1
उत्तर:
दिया गया है-सान्द्रता c = 0.025 molL-1, मोलर चालकता (\(\Lambda_{\mathrm{m}}\)) = 46.1 Scm2 mol-1 HCl के लिए सीमान्त मोलर चालकता
\(\Lambda_{\mathrm{HCl}}^{\circ}=\lambda_{\mathrm{H}^{+}}^{\circ}+\lambda_{\mathrm{Cl}^{-}}^0\)
\(\Lambda_{\mathrm{HCl}}^{\circ}\) = 349.6 + 54.6 = 404.2S cm2 mol-1
वियोजन की मात्रा (α) = \(\frac{\Lambda_{\mathrm{m}}}{\Lambda_{\mathrm{m}}^{\mathrm{o}}}\) = \(\) = 0.114
वियोजन स्थिरांक, K = \(\frac{c \alpha^2}{(1-\alpha)}\)
K = \(\frac{0.025 \times(0.114)^2}{(1-0.114)}\)
K = \(\frac{0.025 \times 0.012996}{0.886}\)
K = \(\frac{3.249 \times 10^{-4}}{0.886}\)
K = 3.667 × 10-4
= 3.67 × 10-4 mol L-1
अतः वियोजन स्थिरांक (K) = 3.67 × 10-4 mol L-1
प्रश्न 3.10.
यदि एक धात्विक तार में 0.5 ऐम्पियर की धारा 2 घंटों के लिए प्रवाहित होती है तो तार में से कितने इलेक्ट्रॉन प्रवाहित होंगे?
उत्तर:
आवेश (Q) = धारा × समय
Q = 0.5 × 2 × 60 × 60 = 3600 कूलम्ब
एक इलेक्ट्रॉन का आवेश = 1.6 × 10-19 कूलम्ब
अतः 3600 कूलम्ब में इलेक्ट्रॉनों की संख्या
= \(\frac{3600}{1.6 \times 10^{-19}}\) = 2.25 × 1022 इलेक्ट्रॉन
अतः धात्विक तार में से 2.5 × 1022 इलेक्ट्रॉन प्रवाहित होंगे।
![]()
प्रश्न 3.11.
उन धातुओं की एक सूची बनाइए जिनका वैद्युत अपघटनी निष्कर्षण होता है।
उत्तर:
ऐलुमिनियम (Al), सोडियम (Na) तथां मैग्नीशियम (Mg) ऐसी धातुएँ हैं जिनका वैद्युत अपघटनी निष्कर्षण होता है। ये अधिक क्रियाशील धातुएँ हैं क्योंकि इनके E° के मान अधिक ऋणात्मक होते हैं। अतः इनके लिए उपयुक्त रासायनिक अपचायक उपलब्ध नहीं है तथा ये स्वयं प्रबल अपचायक हैं।
प्रश्न 3.12.
निम्नलिखित अभिक्रिया में \(\mathrm{Cr}_2 \mathrm{O}_7^{2-}\) आयनों के एक मोल के अपचयन के लिए कूलॉम में विद्युत की कितनी मात्रा की आवश्यकता होगी?
\(\mathrm{Cr}_2 \mathrm{O}_7^{2-}+14 \mathrm{H}^{+}+6 \mathrm{e}^{-} \rightarrow 2 \mathrm{Cr}^{3+}+7 \mathrm{H}_2 \mathrm{O}\)
उत्तर:
दी गई अभिक्रिया में 1 मोल \(\mathrm{Cr}_2 \mathrm{O}_7^{2-}\) आयनों के अपचयन के लिए 6 मोल इलेक्ट्रॉन प्रयुक्त हो रहे हैं। 1 मोल इलेक्ट्रॉन प्रयुक्त होने के लिए आवश्यक विद्युत की मात्रा, 1 फैराडे ( 96500 कूलॉम) होती है। अतः 6 मोल इलेक्ट्रॉन प्रयुक्त होने पर आवश्यक विद्युत की मात्रा = 6 फैराडे = 96500 × 6 = 579000 कूलॉम = 5.79 × 105 कूलॉम।
प्रश्न 3.13.
चार्जिंग के दौरान प्रयुक्त पदार्थों का विशेष उल्लेख करते हुए लेड संचायक सेल की चार्जिंग क्रियाविधि का वर्णन रासायनिक अभिक्रियाओं की सहायता से कीजिए।
उत्तर:
एक संचायक सेल को उपयोग में लेने के बाद विपरीत दिशा में विद्युत धारा के प्रवाह से पुनः आवेशित कर पुनः उपयोग में लाया जा सकता है। लेड संचायक सेल में ऐनोड लैड का तथा कैथोड लैड डाइऑक्साइड (PbO2) से भरे हुए लैड ग्रिड का होता है। 38% सल्फ्यूरिक अम्ल (H2SO4) का विलयन वैद्युतअपघट्य के रूप में कार्य करता है। जब बैटरी उपयोग में आती है तो निम्नलिखित अभिक्रियाएँ सम्पन्न होती हैं-
ऐनोड – \(\mathrm{Pb}(\mathrm{s})+\mathrm{SO}_4^{2-}(\mathrm{aq}) \rightarrow \mathrm{PbSO}_4(\mathrm{~s})+2 \mathrm{e}^{-}\)
कैथोड – \(\begin{aligned}
\mathrm{PbO}_2(\mathrm{~s})+ & \mathrm{SO}_4{ }^{2-}(\mathrm{aq})+4 \mathrm{H}^{+}(\mathrm{aq})+2 \mathrm{e}^{-} \\
\rightarrow & \mathrm{PbSO}_4(\mathrm{~s})+2 \mathrm{H}_2 \mathrm{O}(\mathrm{l})
\end{aligned}\)
कैथोड एवं ऐनोड दोनों अभिक्रियाओं को मिलाकर नेट सेल अभिक्रिया निम्न प्रकार होती है-
Pb(s) + pbO2(s) + 2H2SO4(aq) → 2pbSO4(s) + 2H2O(l)
बैटरी को चार्ज (आवेशित) करने पर अभिक्रिया एकदम विपरीत हो जाती है तथा कैथोड एवं ऐनोड भी बदल जाते हैं।
कैथोड – PbO2, ऐनोड – PbSO4(s), Pb तथा चार्जिंग अभिक्रिया निम्न प्रकार होगी-
2PbSO4(s) + 2H2O → Pb(s) + PbO2(s) + 2H2SO4(aq)
प्रश्न 3.14.
हाइड्रोजन को छोड़कर ईंधन सेलों में प्रयुक्त किये जा सकने वाले दो अन्य पदार्थ सुझाइए।
उत्तर:
हाइड्रोजन के अलावा CO (कार्बन मोनो ऑक्साइड) तथा मेथेन (CH4) को भी ईंधन सेलों में प्रयुक्त किया जा सकता है।
प्रश्न 3.15.
समझाइए कि कैसे लोहे पर जंग लगने का कारण एक वैद्युत रासायनिक सेल बनना माना जाता है।
उत्तर:
लोहे पर जंग लगने को वैद्युत रासायनिक घटना माना जाता है क्योंकि इसमें निम्न प्रकार से वैद्युत रासायनिक सेल का निर्माण होता है जिसमें कैथोड तथा ऐनोड बनकर उन पर अपचयन एवं ऑक्सीकरण का प्रक्रम होता है। लोहे से बनी हुई किसी वस्तु के किसी निश्चित स्थान पर जब ऑक्सीकरण की प्रक्रिया होती है तो वह स्थान ऐनोड का कार्य करता है तथा इसे हम निम्नलिखित अभिक्रिया से दर्शा सकते हैं-
ऐनोड – 2Fe(s) → 2Fe2+ + 4e–
ऐनोड से प्राप्त इलेक्ट्रॉन, धातु के द्वारा प्रवाहित होकर इसके दूसरे स्थान पर पहुँच जाते हैं तथा वहाँ H+ की उपस्थिति में ऑक्सीजन क अपचयन करते हैं (माना जाता है कि H+ आयन CO2 के जल में घुलने से बने H2CO3 से प्राप्त होते हैं। वायुमंडल में उपस्थित अन्य अम्लीय ऑक्साइडों के जल में घुलने से भी H+ उपलब्ध हो सकते हैं)। यह स्थान कैथोड की तरह व्यवहार करता है तथा यहाँ पर होने वाली अभिक्रिया निम्नलिखित है-
O2(g) + 4H+(aq) + 4e– → 2H2O(l);
2Fe(s) + O2(g) + 4H+(aq) → 2Fe2+(aq) + 2H2O(l);
इसके पश्चात् वायुमंडलीय ऑक्सीजन के द्वारा फेरस आयन (Fe2+) और अधिक ऑक्सीकृत होकर फेरिक आयनों (Fe3+) में परिवर्तित हैं जो जलयोजित फेरिक ऑक्साइड (Fe2O3. × H2O ) बना लेते हैं तथा यही जंग का रासायनिक संघटन है तथा इसके साथ ही हाइड्रोजन आयन पुनः उत्पन्न हो जाते हैं।