Haryana State Board HBSE 12th Class Chemistry Important Questions Chapter 8 d- एवं f-ब्लॉक के तत्व Important Questions and Answers.
Haryana Board 12th Class Chemistry Important Questions Chapter 8 d- एवं f-ब्लॉक के तत्व
बहुविकल्पीय प्रश्न:
1. प्रथम संक्रमण श्रेणी का कौनसा तत्व उच्चतम ऑक्सीकरण अवस्था दर्शाता है?
(अ) Ni
(ब) Fe
(स) Mn
(द) Cr
उत्तर:
(स) Mn
2. निम्नलिखित में से कौनसे आयन का जलीय विलयन रंगीन नहीं होगा?
(अ) Mn2+
(ब) Fe2+
(स) Zn2+
(द) Cr2+
उत्तर:
(स) Zn2+
3. निम्नलिखित में से किस आयन का चुम्बकीय आघूर्ण अधिकतम होता है?
(अ) V3+
(ब) Fe3+
(स) Co3+
(द) Cr3+
उत्तर:
(ब) Fe3+
4. संक्रमण धातुओं का युग्म है-
(अ) Lu, Cu
(ब) Lu, Zn
(स) Cu, Zn
(द) Au, Cu
उत्तर:
(द) Au, Cu
5. निम्नलिखित में से कौनसा तत्व +8 ऑक्सीकरण अवस्था प्रदर्शित करता है?
(अ) Pt
(ब) Mn
(स) Os
(द) Cu
उत्तर:
(स) Os
![]()
6. किसी संक्रमण तत्व की उच्चतम ऑक्सीकरण अवस्था किसके बराबर हो सकती है?
(अ) ns इलेक्ट्रॉन
(ब) (n-1)d इलेक्ट्रॉन
(स) (n-1)d + ns इलेक्ट्रॉन
(द) (n+1) d इलेक्ट्रॉन
उत्तर:
(स) (n-1)d + ns इलेक्ट्रॉन
7. निम्नलिखित में से कौनसे आयन में अनुचुम्बकीय गुण सर्वाधिक होगा?
(अ) Cu2+
(ब) Mn2+
(स) Zn2+
(द) Ti+2
उत्तर:
(ब) Mn2+
8. d खण्ड के अन्य तत्वों की भाँति Zn परिवर्तनशील संयोजकता नहीं दर्शाता, क्योंकि-
(अ) यह नर्म धातु है।
(ब) इसमें d कक्षक पूर्ण भरा है।
(स) इसका गलनांक कम है।
(द) इसके बाह्यतम कक्षक में दो इलेक्ट्रॉन हैं।
उत्तर:
(ब) इसमें d कक्षक पूर्ण भरा है।
9. निम्नलिखित में से कौनसा तत्व केवल एक ही प्रकार की ऑक्सीकरण अवस्था दर्शाता है-
(अ) Mn
(ब) Zn
(स) Cr
(द) Ni
उत्तर:
(ब) Zn
10. संक्रमण धातुओ के लवण सामान्यतः रंगीन होते हैं, क्योंकि-
(अ) इनमें पूर्ण भरे d कक्षक होते हैं।
(ब) ये पराबेंगनी प्रकाश को अवशोष्तित करते हैं।
(स) इनमें d-d संक्रमण होता है।
(द) ये विद्युत चुम्बक्जीय विकिएगों से ऊर्जा का अवशोषण करते हैं।
उत्तर:
(स) इनमें d-d संक्रमण होता है।
11. कौनसे युग्म की धातुओं का आकार लगभग समान है?
(अ) Cd, Hg
(ब) Cu, Zn
(स) Sc, Ti
(द) Cr, Mo
उत्तर:
(अ) Cd, Hg
12. लैन्थेनॉयड श्रेणी के तत्वों की सामान्य ऑक्सीकरण अवस्था कौनसी है?
(अ) +1
(ब) +3
(स) +2
(द) +5
उत्तर:
(ब) +3
13. K2Cr2O7 के जलीय विलयन में SO2 गैस प्रवाहित करने पर Cr की ऑक्सीकरण अवस्था में क्या परिवर्तन होगा?
(अ) +3 से +1
(ब) +6 से +3
(स) +3 से +6
(द) +6 से +4
उत्तर:
(ब) +6 से +3
14. निम्नलिखित में से किस धातु का घनत्व अधिकतम होता है?
(अ) Pd
(ब) Hg
(स) Os
(द) Pt
उत्तर:
(स) Os
15. निम्नलिखित में से कौनसा ऑक्साइड उभयधर्मी है?
(अ) CoO
(ब) ZnO
(स) FeO
(द) CrO2
उत्तर:
(ब) ZnO
16. निम्नलिखित में से कौनसे आयन प्रतिचुंककीय हैं?
(अ) Cu2+
(ब) Ti3+, Co2+
(स) Ni2+, Mn2+
(द) Sc3+
उत्तर:
(द) Sc3+
17. निम्नलिखित में से आयनों के किस युग्म में निम्न (Lower) ऑक्सीकरण अवस्था अधिक स्थायी है?
(अ) Tl+2 , Tl3+
(ब) Cu+1, Cu2+
(स) Cr2+, Cr3+
(द) Mn+2, Mn+4
उत्तर:
(द) Mn+2, Mn+4
18. लैन्थेनॉयड संकुचन के कारण होने वाला प्रभाव है-
(अ) Zr तथा Nb की समान ऑक्सीकरण अवस्था
(ब) Zr तथा Hf का लगभग समान परमाणु आकार
(स) Zr तथा Y का लगभग समान परमाणु आकार
(द) Zr तथा Zn की समान ऑक्सीकरण अवस्था
उत्तर:
(ब) Zr तथा Hf का लगभग समान परमाणु आकार
19. La3+ (परमाणु क्रमांक = 57) की त्रिज्या 1.06 Å है तो Lu3+ (परमाणु क्रमांक =Lu) की त्रिज्या का मान (लगभग) होगा-
(अ) 1.40 Å
(ब) 1.06 Å
(स) 0.85 Å
(द) 1.60 Å
उत्तर:
(स) 0.85 Å
20. Ce+4 के स्थायित्व का कारण है-
(अ) 4f7 विन्यास
(ब) 4f0 विन्यास
(स) 4f14
(द) 4f76s2
उत्तर:
(ब) 4f0 विन्यास
21. f-ब्लॉक के तत्वों के लिए कौनसा कथन सत्य नहीं है?
(अ) ये आन्तरिक संक्रमण तत्व कहलाते हैं।
(ब) ये सभी तत्व रेडियोधर्मी होते हैं।
(स) इनमें इलेक्ट्रॉन सामान्यतः 4f तथा 5f में भरे जाते हैं।
(द) लैन्थेनॉयडों की तुलना में ऐक्टिनॉयडों में परिवर्तनशील ऑक्सीकरण अवस्थाएँ अधिक होती हैं।
उत्तर:
(ब) ये सभी तत्व रेडियोधर्मी होते हैं।
22. प्रथम संक्रमण श्रेणी में किस धातु का गलनांक उच्चतम होता है?
(अ) Mn
(ब) Cr
(स) Fe
(द) Cu
उत्तर:
(ब) Cr
23. \(\mathrm{Cr}_2 \mathrm{O}_7^{2-}\) क्षारीय माध्यम में बनाता है-
(अ) CrO3
(ब) \(\mathrm{CrO}_4^{2-}\)
(स) CrO2
(द) उपर्युक्त सभी
उत्तर:
(ब) \(\mathrm{CrO}_4^{2-}\)
24. अम्लीय पोटेशियम परमैंगनेट विलयन की ऑक्सेलेट आयन से क्रिया कराने पर प्राप्त उत्पाद है-
(अ) \(\mathrm{CO}_3^{2-}\)
(ब) CO2
(स) KHCO3
(द) उपर्युक्त सभी
उत्तर:
(ब) CO2
25. क्षारीय माध्यम में पोटैशियम परमैंगनेट कितने इलेक्ट्रॉन ग्रहण करता है?
(अ) 5
(ब) 4
(स) 3
(द) 2
उत्तर:
(स) 3
![]()
26. निम्नलिखित में से किस तत्व की तृतीय आयनन एन्थैल्पी सर्वाधिक होती है?
(अ) Mn
(ब) Cr
(स) Fe
(द) V
उत्तर:
(अ) Mn
27. निम्नलिखित में से अम्लीय ऑक्साइड कौनसा है?
(अ) MnO
(ब) Mn2O3
(स) MnO2
(द) Mn2O7
उत्तर:
(द) Mn2O7
28. K2Cr2O7 का तुल्यांकी भार क्या होगा यदि अणुभार = M हो?
(अ) M
(ब) M/3
(स) M/6
(द) M/2
उत्तर:
(स) M/6
29. लोहचुम्बकीय धातुओं का समूह है-
(अ) Cu, Ag, Au
(ब) Cr, Mo, W
(स) Fe, CO, Ni
(द) उपर्युक्त में से कोई नहीं
उत्तर:
(स) Fe, CO, Ni
30. रंगहीन आयनों का युग्म है-
(अ) Cu+, Zn2+
(ब) Cu2+, Zn2+
(स) V3+, Cr3+
(द) Mn3+, Fe3+
उत्तर:
(अ) Cu+, Zn2+
31. Cr, Mn, Fe तथा Co के लिए \(\mathrm{E}_{\mathrm{M}^{3+} / \mathrm{M}^{2+}}\) मान क्रमशः -0.41, + 1.57, 0.77 तथा +1.97V हैं। इनमें से किस धातु की ऑक्सीकरण अवस्था सुगमतापूर्वक +2 से +3 हो जायेगी?
(अ) Cr
(ब) Mn
(स) Fe
(द) Co
उत्तर:
(अ) Cr
32. निम्नलिखित बाह्यतम इलेक्ट्रॉनिक विन्यास वाले परमाणुओं में से सर्वाधिक ऑक्सीकरण संख्या किस परमाणु द्वारा प्रदर्शित होती है?
(अ) (n – 1) d8ns2
(ब) (n – 1) d5ns1
(स) (n – 1) d3ns2
(द) (n – 1) d5ns2
उत्तर:
(द) (n – 1) d5ns2
33. Ti3+ आयन का प्रभावी चुम्बकीय आघूर्ण है-
(अ) 1.73 BM
(ब) 270 BM
(स) 5.92 BM
(द) 2.83 BM
उत्तर:
(अ) 1.73 BM
34. Ti(22), V(23), Cr(24) तथा Mn(25) की द्वितीय आयनन एन्थैल्पी के घटते मानों का सही क्रम है-
(अ) Cr > MN > V > Ti
(ब) V > Mn > Cr > Ti
(स) Mn > Cr > Ti > V
(द) Ti > V > Cr > Mn
उत्तर:
(अ) Cr > MN > V > Ti
35. निम्नलिखित में से कौनसा यौगिक रंगीन नहीं है?
(अ) TiCl3
(ब) TiCl4
(स) K2Cr2O7
(द) KMnO4
उत्तर:
(ब) TiCl4
36. K2Cr2O7 का जलीय विलयन H2S के साथ अम्लीय परिस्थिति में क्रिया करके हरा उत्पाद (A) देता है। (A) है-
(अ) Cr2(SO4)3
(ब) CrSO4
(स) K2CrO4
(द) CrO3
उत्तर:
(अ) Cr2(SO4)3
अतिलघूत्तरात्मक प्रश्न:
प्रश्न 1.
Ni2+ का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
Ni2+ = 1s2 2s2 2p6 3s6 3p6 3d8 4s0
प्रश्न 2.
प्रथम संक्रमण श्रेणी के उन तत्वों के नाम बताइए जो केवल एक ही प्रकार की ऑक्सीकरण अवस्था दर्शाते हैं।
उत्तर:
Sc तथा Zn
प्रश्न 3.
MnO की प्रकृति बताइए।
उत्तर:
MnO क्षारीय प्रकृति का होता है।
प्रश्न 4.
संक्रमण हत्वों की 3d श्रेणी की सामान्य औक्सीकरण अवस्था कौनसी होती है?
उत्तर:
संकमण तत्चों की 3d क्रेणी की सामान्य औंकसीकरण अवस्थ +2 होती है।
प्रश्न 5.
निम्नलिखित में से किस औँक्साह्ड में सक्तंयोजी गुण अभिकतम होगा? Sc2O3, TiO2, Mn2O7 तथा V2O5
उत्तर:
Mn2O7
प्रश्न 6.
Cu+ तथा Cu+2 में कौनसी अवस्था अधिक स्थायी होती है?
उत्तर:
Cu2+ अवस्था अधिक स्थ्युी होती है।
प्रश्न 7.
d-ब्लॉक में वाध्यशील धातुएं कौनसी होती हैं तथा क्यों?
उत्तर:
d-क्लांक में Zn. Cd तथा Hg वाप्मशौल धातुएँ होती हैं क्योंकि इनके गलनांक तथा क्वथनांक कम क्षोते हैं।
प्रश्न 8.
CrO, Cr2O3, CrO2 तध CrO3 को अम्लीय गुण के बढ़ते क्रम में व्यवस्थित कीजिए।
उत्तर:
CrO < Cr2O3 < CrO2 < CrO3
प्रश्न 9.
Cu, Ag तथा Au में d10 विन्यास है फित्र भी ये संक्रमण तथव हैं। क्यों?
उत्तर:
Cu, Ag तथा Au के धनायनों में d10 विन्यास नरी रहत़ा है अतः ये संक्रमण तत्व है।
![]()
प्रश्न 10.
संक्रमण कत्वों में किसका गलनांक न्यूनतम होता है?
उत्तर:
संक्रमण तत्बों में मकंरी (Hg) का गलनांक न्यूनतम होत है।
प्रश्न 11.
संक्रमण हत्वों में अधिकत गलनांक वाला धातु कौनसा है?
उत्तर:
टंस्ट्टन (W)
प्रश्न 12.
CuSO4.5 H2O तथा ZnSO4 में से कौनसा यौगिक रेगहीन है?
उत्तर:
ZnSO4
प्रश्न 13.
संक्रमण धातुएं, मित्र धातु बनाती हैं, क्यों?
उत्तर:
संक्रमण तत्वों की त्रिज्या में समानता तथा इ्नके अभिलाषणिक गुणों के कारण ये मिक्ष धातु आसानी से बना लेती हैं।
प्रश्न 14.
मिश्र धातु, पीतल किन धातुओ से बनती है?
उत्तर:
कॉपर तथा जिक।
प्रश्न 15.
कोंपर की दो मिश्र धातुओं के नाम बताइए।
उत्तर:
काँस तथा पीतल।
प्रश्न 16.
Zn2+ प्रतिचुम्बकीय होता है जबकि Cu2+ अनुचुम्बकीय, क्यों?
उत्तर:
Zn+2(3d10) में एक भी अयुग्मित इलेक्ट्रॉन नहीं है जबकि Cu2+ (3d9) में एक अयुग्मित इलेक्ट्रॉन उपस्थित होता है अतः Zn2+ प्रतिचुम्बकीय होता है लेकिन Cu2+ अनुचुम्बकीय होता है।
प्रश्न 17.
MnVI के असमानुपातन का समीकरण लिखिए।
उत्तर:

प्रश्न 18.
\(\mathrm{CrO}_4^{2-}\) आयन की संरचना कैसी होती है?
उत्तर:
\(\mathrm{CrO}_4^{2-}\) की संरचना चतुष्फलकीय होती है।
प्रश्न 19.
K2Cr2O2 के नारंगी क्लियन में प्रबल क्षार (NaOH या KOH) मिलाने पर विलयन पीला हो जाता है। क्यों?
उत्तर:
K2Cr2O7 के नारंगी विलयन में प्रब्ल क्षार मिलाने पर क्रोमेट बन जाता है अतः विलयन पीला हो जाता है।
![]()
प्रश्न 20.
KI विलयन की क्रिया अम्लीय तथा क्षारीय KMnO4 से कराने पर बने उत्पाद्ध बताइए।
उत्तर:
KI विलयन की क्रिया अम्लीय KMnO4 के साथ कराने पर आयोडीन (I2) तथा क्षारीय KMnO4 से कराने पर पोटैशेशिय आयोडेट (KIO3) प्राप्त होता है।
प्रश्न 21.
बेयर अभिकर्मक का उपयोग बताइए।
उत्तर:
बेयर अभिकमंक (1% क्षारीय KMnO4) से असंतृप्तत का परीक्षण किया जाता है।
प्रश्न 22.
डाइक्रोमेट आयन की हाइड्रोजन परॉक्साइड से अभिक्रिया कराने पर बने उत्पादों को दर्शाने वाले समीकरण लिखिए।
उत्तर:
\(\mathrm{Cr}_2 \mathrm{O}_7^{2-}+4 \mathrm{H}_2 \mathrm{O}_2+2 \stackrel{+}{\mathrm{H}} \rightarrow 2 \mathrm{CrO}_5+5 \mathrm{H}_2 \mathrm{O}\)
प्रश्न 23.
लेन्थेनॉयडों को किस नाम से जाना जाता है?
उत्तर:
सैन्थेनॉयडों को दुर्लभ मृदा धातु के नाम से जाना जाता है।
प्रश्न 24.
लैन्थेनोंयड संकुचन किसे कहते हैं?
उत्तर:
La से Lu तक परमाणु क्रमांक बढने पर परमाणु कथा आयनिक त्रिज्याओ में कमी होती है, इसे लैन्थेनॉयड संकुचन कहते हैं।
प्रश्न 25.
Lu(OH)3 की तुलना में La(OH)3 अधिक क्षारीय होता है, क्यों?
उत्तर:
La से Lu तक हाइ्ड्रोंक्साइडों की धारीय प्रकृति कम होती है क्यांकि इनकी आयनिक त्रिज्या में कमी होती है अतः Lu(OH)3 की तुलना में La(OH)3 अधिक क्षारीय होता है।
प्रश्न 26.
ऐक्टनोंयडों द्वारा प्रदर्शित अधिकतम औक्सीकरण अवस्था बताइए।
उत्तर:
ऐक्टनॉयड अधिकतम +7 ऑक्सीकरण अवस्था प्रदार्शित करते हैं।
प्रश्न 27.
परायूरेनियम तत्व किन्हें कहते हैं?
उत्तर:
\(\begin{aligned}
& U \\
& 92
\end{aligned}\) के बाद के रैडियोसक्रिय तथा कूत्रिम तत्वों को परायूरोनियम तत्व कहते हैं।
प्रश्न 28.
d-ब्लॉक के तत्वों में किसका गलनांक न्यूनतम होता है?
उत्तर:
मर्करी (Hg)
प्रश्न 29.
शल्य चिकित्सा में उपयोग में आने वाले उपकरणों को KMnO4 द्वारा साफ किया जाता है, क्यों?
उत्तर:
KMnO4 के जर्मनाशी गुण के कारण इसे शल्य चिकित्सा में उपयोग में आने वाले उपकरणों को साफ करने में प्रयुक्त किया जाता है।
प्रश्न 30.
ऐक्टिनॉयड संकुचन, लैन्थेनॉयड संकुचन की तुलना में अधिक होता है, क्यों?
उत्तर:
5f इलेक्ट्रॉनों के दुर्बल परिरक्षण प्रभाव के कारण ऐक्टिनॉयड संकुचन, लैन्थेनॉयड संकुचन की अपेक्षा अधिक होता है।
प्रश्न 31.
सिक्का धातु कौनसे होते हैं?
उत्तर:
कॉपर, सिल्वर तथा गोल्ड।
लघूत्तरात्मक प्रश्न:
प्रश्न 1.
(a) CuI2 अस्थायी होता है। क्यों?
(b) मैंग्नीज, फ्लुओरीन के साथ उच्चतम +4 ऑक्सीकरण अवस्था (MnF4) दर्शाता है जबकि ऑक्सीजन के साथ + (Mn2O7) क्यों?
उत्तर:
(a) CuI2 में आयोडीन के बड़े आकार के कारण बन्ध दुर्बल होता है तथा Cu2+, I– को I2 में ऑक्सीकृत कर देता है अतः CuI2 अस्थायी होता है।
2Cu2+ + 4I– → Cu2I2(s) + I2
(b) मैंगनीज (Mn), फ्लुओरोन के साथ अच्वतम ऑक्सीकरण अवस्था + 4(MnF4) ही दर्शाता है जबकि ऑक्सीजन के साथ यह उच्चतम ऑक्सीकरण अवस्था + 7(Mn2O7) दर्शाता है, क्योंकि फ्लुओरीन की अपेक्षा ऑक्सीजन की उच्च ऑक्सीकरण अवस्थाओं को स्थायित्व प्रदान करने की क्षमता अधिक होती है जिसका कारण ऑक्सीजन की धातुओं के साथ बहबन्ध बनाने की क्षमता है।
![]()
प्रश्न 2.
(a) \(\stackrel{+}{\mathbf{C}} \mathbf{u} \overline{\mathbf{X}}\) अस्थायो होता है, क्या?
अथवा
जलीय विलयन में Cu+ की तुलना में Cu2+ अधिक स्थायी होता है, क्यों?
(b) Mn2O7 तथा \(\mathrm{MnO}_4^{-}\) की संरचना बताइए।
उत्तर:
(a) \(\mathrm{Cu}^{+} \mathrm{X}^{-}\) अस्थायी होता है क्योंक जलीय विलयन में Cu+ का असमानुपातन हो जाता है-
\(2 \mathrm{Cu}_{(\mathrm{aq})}^{+} \longrightarrow \mathrm{Cu}_{(\mathrm{aq})}^{2+}+\mathrm{Cu}_{(\mathrm{s})}\)
अतः जलीय विलयन में Cu+ की तुलना में Cu2+ अधिक स्थायी होता है क्योंकि Cu2+ की जलयोजन एन्थैल्पी का मान Cu+ की तुलना में बहुत अधिक ऋणात्मक होता है जो कि Cu+ से Cu2+ बनाने के लिए आवश्यक ऊर्जा (द्वितीय आयनन एन्थैल्पी) को आसानी से संतुलित कर देती है।
(b) Mn2O7 में प्रत्येक Mn परमाणु चतुष्फलकीय रूप से ऑक्सीजन परमाणुओं से घिरा होता है तथा इसमें एक Mn-O-Mn सेतुबन्ध भी पाया जाता है तथा \(\mathrm{MnO}_4\) की संरचना भी चतुष्फलकीय होती है।
प्रश्न 3.
चुम्बकीय गुण कितने प्रकार के होते हैं? पदार्थों में चुम्बकीय गुण उत्पन्न होने का कारण भी बताइए।
उत्तर:
पदार्थों में चुम्बकीय गुण मुख्यतः इलेक्ट्रॉनों के कारण ही होता है तथा इलेक्ट्रॉन स्वयं एक बहुत छोटे चुम्बक के समान कार्य करता है। किसी पदार्थ पर चुम्बकीय क्षेत्र लगाने पर कई प्रकार के चुम्बकीय व्यवहार प्रदर्शित होते हैं लेकिन इनमें से निम्नलिखित तीन गुण मुख्य होते हैं-
(i) प्रतिचुम्बकत्व
(ii) अनुचुम्बकत्व तथा
(iii) लोहचुम्बकत्व।
प्रतिचुम्बकीय पदार्थ वे होते हैं जो प्रयुक्त चुम्बकीय क्षेत्र द्वारा प्रतिकर्षित होते हैं लेकिन अनुचुम्बकीय पदार्थ चुम्बकीय क्षेत्र द्वारा आकर्षित होते हैं। वे पदार्थ जो चुम्बकीय क्षेत्र द्वारा प्रबलता से आकर्षित होते हैं, उन्हें लोहचुम्बकीय पदार्थ कहते हैं। वास्तव में लोहचुम्बकत्व, अनुचुम्बकत्व का ही अधिकतम रूप है।
पदार्थों में चुम्बकीय गुणों के उत्पन्न होने का मुख्य कारण इलेक्ट्रॉनों की दो प्रकार की गति है-
(i) कक्षीय गति (Orbital motion) तथा (ii) चक्रण गति (Spin motion)
अतः किसी पदार्थ का चुम्बकीय आघूर्ण (Magnetic moment) कक्षीय कोणीय संवेग (orbital angular momentum) तथा चक्रण कोणीय संवेग (spin angular momentum) के सम्मिलित प्रभाव के कारण होता है। संक्रमण तत्वों में (n – 1)d उपकोश के इलेक्ट्रॉन सतह पर ही स्थित होते हैं अतः ये बाहरी वातावरण से अधिक प्रभावित होते हैं।
इस कारण इलेक्ट्रॉनों की कक्षीय गति बहुत सीमित हो जाती है तथा कक्षीय कोणीय संवेग का योगदान अधिक प्रभावी नहीं रहता इसलिए यह महत्त्वपूर्ण नहीं है अतः चुम्बकीय आघूर्ण का मान केवल अयुग्मित इलेक्ट्रॉनों की संख्या के आधार पर ही ज्ञात किया जाता है। चुम्बकीय आघूर्ण ज्ञात करने के लिए निम्नलिखित सूत्र दिया गया है तथा इसे चक्रण मात्र (spin only) सूत्र कहते हैं-
चुम्बकीय आघूर्ण (µ)= \(\sqrt{n(n+2)}\), n = अयुग्मित इलेक्ट्रॉनों की संख्या
चुम्बकीय आघूर्ण का मात्रक बोर मैग्नेटॉन (BM) होता है।
1 BM = \(\frac { eh }{ 4πmc }\)
यहाँ e = इलेक्ट्रॉन का आवेश, h = प्लांक स्थिरांक, m = इलेक्ट्रॉन का द्रव्यमान तथा c = प्रकाश का वेग है।
अयुग्मित इलेक्ट्रॉनों की संख्या बढ़ने पर चुम्बकीय आघूर्ण का मान भी बढ़ता है। अतः प्रेक्षित (observed) चुम्बकीय आघूर्ण मानों से परमाणुओं, अणुओं या आयनों में उपस्थित अयुग्मित इलेक्ट्रॉनों की संख्या का संकेत प्राप्त हो जाता है। विभिन्न चुम्बकीय गुणों का विस्तृत विवरण अग्र प्रकार है-
(i) प्रतिचुम्बकत्व (Diamagnetism) – वे परमाणु, अणु या आयन जिनमें सभी इलेक्ट्रॉन युग्मित होते हैं, उनमें प्रतिचुम्बकत्व का गुण पाया जाता है। ये इलेक्ट्रॉन एक-दूसर के प्रभाव को नष्ट कर देते हैं, जिससे पदार्थ का कुल चुम्बकीय आघूर्ण शून्य हो जाता है। इन्हें प्रतिचुम्बकीय पदार्थ कहते हैं तथा इन पर चुम्बकीय क्षेत्र लगाने पर, कक्षीय आघूर्ण लगाए गए क्षेत्र की विपरीत दिशा में प्रेरित हो जाता है अतः ये पदार्थ चुम्बकीय क्षेत्र द्वारा प्रतिकर्षित होते हैं।

प्रतिचुम्बकत्व का गुण लगभग सभी पदार्थों द्वारा दर्शाया जाता है लेकिन अनुचुम्बकत्व की तुलना में इसका प्रभाव बहुत कम होता है, अतः अयुग्मित इलेक्ट्रॉन युक्त पदार्थों में इसका अनुभव नहीं होता इसलिए उनमें अनुचुम्बकत्व का गुण पाया जाता है। प्रतिचुम्बकत्व ताप पर निर्भर नहीं करता। उदाहरण- Sc3+, Ti+4 तथा Zn2+ इत्यादि।
(ii) अनुचुम्बकत्व (Paramagnetism) -वे परमाणु, अणु या आयन जिनमें अयुग्मित इलेक्ट्रॉन पाए जाते हैं, उनमें अनुचुम्बकत्व का गुण पाया जाता है तथा इन्हें अनुचुम्बकीय पदार्थ कहते हैं। इन पदार्थों को चुम्बकीय क्षेत्र में रखने पर ये चुम्बकीय क्षेत्र की ओर आकर्षित होते हैं लेकिन चुम्बकीय श्वेत्र हटा लेने पर इनका चुम्बकीय गुण नष्ट हो जाता है। अनुचुम्बकत्व, ताप के व्युक्क्रमानुपाती होता है, अर्थात् ताप बढ़ाने पर यह गुण कम हो जाता है। अयुग्मित इलेक्ट्रॉनों की संख्या बढ़ने पर पदार्थ का अनुचुम्बकीय गुण बढ़ता है। इन पदार्थों का चुम्बकीय आघूर्ण कभी शून्य नहीं होता। उदाहरण- Ti3+, Co2+, Cu2+ इत्यादि।

(iii) लोहचुम्बकत्व (Ferromagnetism) – यह उच्चतम कोटि का अनुच्बकत्व होता है। लोहचुम्बकीय पदार्थ चुम्बकीय क्षेत्र द्वारा प्रबलता से आकर्षित होते हैं तथा इनके छोटे-छोटे आण्विक चुम्बक एक ही दिशा में व्यवस्थित हो जाते हैं, जिससे इनका चुम्बकीय ग्रुण बढ़ जाता है। चुम्बकीय क्षेत्र हटा लेने पर भी ये स्थायी चुम्बक की तरह व्यवहार करते हैं। चोट मारने पर या ताप में परिवर्तन से इनके आण्विक चुम्बकों की व्यवस्था परिवर्तित हो जाती है, जिससे इनका चुम्बकीय गुण भी नष्ट हो जाता है या परिवर्तित हो जाता है।
Fe, Co तथा Ni लोहचुम्बकीय तत्वों के उदाहरण हैं। चुम्बकीय आघूर्णों के प्रायोगिक मान सामान्यतः विलयन में उपस्थित. जलयोजित आयनों अथवा ठोस अवस्था के लिए ज्ञात किए जाते हैं। प्रथम संक्रमण श्रेणी के आयनों के परिकलित तथा प्रेक्षित चुम्बकीय आघूर्णों के मान निम्नलिखित प्रकार होते हैं-
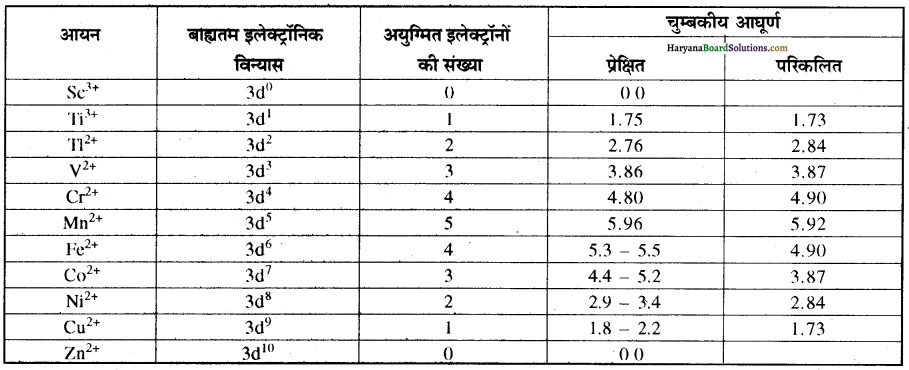
प्रश्न 4.
चुम्बकीय आघूर्ण ज्ञात करने के लिए आवश्यक सूत्र लिखिए तथा बताइए कि इसे ज्ञात करने के लिए चक्रण मात्र सूत्र ही क्यों प्रयुक्त किया जाता है?
उत्तर:
पदार्थों में चुम्बकीय गुण मुख्यतः इलेक्ट्रॉनों के कारण ही होता है तथा इलेक्ट्रॉन स्वयं एक बहुत छोटे चुम्बक के समान कार्य करता है। किसी पदार्थ पर चुम्बकीय क्षेत्र लगाने पर कई प्रकार के चुम्बकीय व्यवहार प्रदर्शित होते हैं लेकिन इनमें से निम्नलिखित तीन गुण मुख्य होते हैं-
(i) प्रतिचुम्बकत्व
(ii) अनुचुम्बकत्व तथा
(iii) लोहचुम्बकत्व।
प्रतिचुम्बकीय पदार्थ वे होते हैं जो प्रयुक्त चुम्बकीय क्षेत्र द्वारा प्रतिकर्षित होते हैं लेकिन अनुचुम्बकीय पदार्थ चुम्बकीय क्षेत्र द्वारा आकर्षित होते हैं। वे पदार्थ जो चुम्बकीय क्षेत्र द्वारा प्रबलता से आकर्षित होते हैं, उन्हें लोहचुम्बकीय पदार्थ कहते हैं। वास्तव में लोहचुम्बकत्व, अनुचुम्बकत्व का ही अधिकतम रूप है।
पदार्थों में चुम्बकीय गुणों के उत्पन्न होने का मुख्य कारण इलेक्ट्रॉनों की दो प्रकार की गति है-
(i) कक्षीय गति (Orbital motion) तथा (ii) चक्रण गति (Spin motion)
अतः किसी पदार्थ का चुम्बकीय आघूर्ण (Magnetic moment) कक्षीय कोणीय संवेग (orbital angular momentum) तथा चक्रण कोणीय संवेग (spin angular momentum) के सम्मिलित प्रभाव के कारण होता है। संक्रमण तत्वों में (n – 1)d उपकोश के इलेक्ट्रॉन सतह पर ही स्थित होते हैं अतः ये बाहरी वातावरण से अधिक प्रभावित होते हैं। इस कारण इलेक्ट्रॉनों की कक्षीय गति बहुत सीमित हो जाती है तथा कक्षीय कोणीय संवेग का योगदान अधिक प्रभावी नहीं रहता इसलिए यह महत्त्वपूर्ण नहीं है अतः चुम्बकीय आघूर्ण का मान केवल अयुग्मित इलेक्ट्रॉनों की संख्या के आधार पर ही ज्ञात किया जाता है। चुम्बकीय आघूर्ण ज्ञात करने के लिए निम्नलिखित सूत्र दिया गया है तथा इसे चक्रण मात्र (spin only) सूत्र कहते हैं-
चुम्बकीय आघूर्ण (µ)= \(\sqrt{n(n+2)}\), n = अयुग्मित इलेक्ट्रॉनों की संख्या
चुम्बकीय आघूर्ण का मात्रक बोर मैग्नेटॉन (BM) होता है।
1 BM = \(\frac { eh }{ 4πmc }\)
यहाँ e = इलेक्ट्रॉन का आवेश, h = प्लांक स्थिरांक, m = इलेक्ट्रॉन का द्रव्यमान तथा c = प्रकाश का वेग है।
अयुग्मित इलेक्ट्रॉनों की संख्या बढ़ने पर चुम्बकीय आघूर्ण का मान भी बढ़ता है। अतः प्रेक्षित (observed) चुम्बकीय आघूर्ण मानों से परमाणुओं, अणुओं या आयनों में उपस्थित अयुग्मित इलेक्ट्रॉनों की संख्या का संकेत प्राप्त हो जाता है। विभिन्न चुम्बकीय गुणों का विस्तृत विवरण अग्र प्रकार है-
(i) प्रतिचुम्बकत्व (Diamagnetism) – वे परमाणु, अणु या आयन जिनमें सभी इलेक्ट्रॉन युग्मित होते हैं, उनमें प्रतिचुम्बकत्व का गुण पाया जाता है। ये इलेक्ट्रॉन एक-दूसर के प्रभाव को नष्ट कर देते हैं, जिससे पदार्थ का कुल चुम्बकीय आघूर्ण शून्य हो जाता है। इन्हें प्रतिचुम्बकीय पदार्थ कहते हैं तथा इन पर चुम्बकीय क्षेत्र लगाने पर, कक्षीय आघूर्ण लगाए गए क्षेत्र की विपरीत दिशा में प्रेरित हो जाता है अतः ये पदार्थ चुम्बकीय क्षेत्र द्वारा प्रतिकर्षित होते हैं।

प्रतिचुम्बकत्व का गुण लगभग सभी पदार्थों द्वारा दर्शाया जाता है लेकिन अनुचुम्बकत्व की तुलना में इसका प्रभाव बहुत कम होता है, अतः अयुग्मित इलेक्ट्रॉन युक्त पदार्थों में इसका अनुभव नहीं होता इसलिए उनमें अनुचुम्बकत्व का गुण पाया जाता है। प्रतिचुम्बकत्व ताप पर निर्भर नहीं करता। उदाहरण- Sc3+, Ti+4 तथा Zn2+ इत्यादि।
(ii) अनुचुम्बकत्व (Paramagnetism) -वे परमाणु, अणु या आयन जिनमें अयुग्मित इलेक्ट्रॉन पाए जाते हैं, उनमें अनुचुम्बकत्व का गुण पाया जाता है तथा इन्हें अनुचुम्बकीय पदार्थ कहते हैं। इन पदार्थों को चुम्बकीय क्षेत्र में रखने पर ये चुम्बकीय क्षेत्र की ओर आकर्षित होते हैं लेकिन चुम्बकीय श्वेत्र हटा लेने पर इनका चुम्बकीय गुण नष्ट हो जाता है। अनुचुम्बकत्व, ताप के व्युक्क्रमानुपाती होता है, अर्थात् ताप बढ़ाने पर यह गुण कम हो जाता है। अयुग्मित इलेक्ट्रॉनों की संख्या बढ़ने पर पदार्थ का अनुचुम्बकीय गुण बढ़ता है। इन पदार्थों का चुम्बकीय आघूर्ण कभी शून्य नहीं होता। उदाहरण- Ti3+, Co2+, Cu2+ इत्यादि।

(iii) लोहचुम्बकत्व (Ferromagnetism) – यह उच्चतम कोटि का अनुच्बकत्व होता है। लोहचुम्बकीय पदार्थ चुम्बकीय क्षेत्र द्वारा प्रबलता से आकर्षित होते हैं तथा इनके छोटे-छोटे आण्विक चुम्बक एक ही दिशा में व्यवस्थित हो जाते हैं, जिससे इनका चुम्बकीय ग्रुण बढ़ जाता है। चुम्बकीय क्षेत्र हटा लेने पर भी ये स्थायी चुम्बक की तरह व्यवहार करते हैं। चोट मारने पर या ताप में परिवर्तन से इनके आण्विक चुम्बकों की व्यवस्था परिवर्तित हो जाती है, जिससे इनका चुम्बकीय गुण भी नष्ट हो जाता है या परिवर्तित हो जाता है।
Fe, Co तथा Ni लोहचुम्बकीय तत्वों के उदाहरण हैं। चुम्बकीय आघूर्णों के प्रायोगिक मान सामान्यतः विलयन में उपस्थित. जलयोजित आयनों अथवा ठोस अवस्था के लिए ज्ञात किए जाते हैं। प्रथम संक्रमण श्रेणी के आयनों के परिकलित तथा प्रेक्षित चुम्बकीय आघूर्णों के मान निम्नलिखित प्रकार होते हैं-
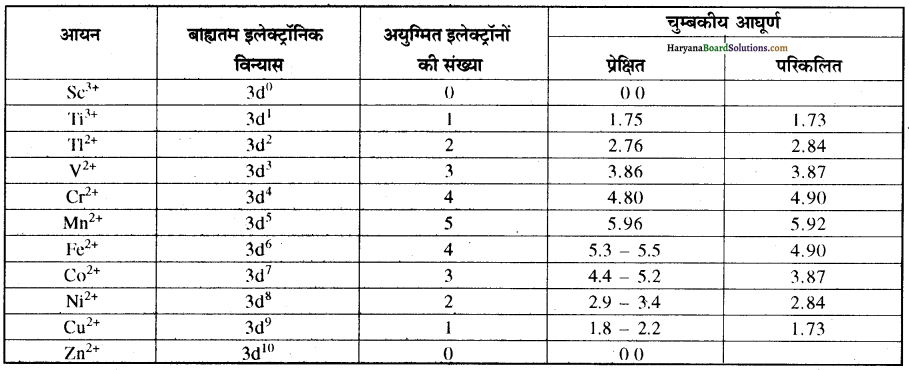
प्रश्न 5.
प्रतिचुम्बकत्व क्या होता है? समझाइए।
उत्तर:
प्रतिचुम्बकत्व (Diamagnetism) – वे परमाणु, अणु या आयन जिनमें सभी इलेक्ट्रॉन युग्मित होते हैं, उनमें प्रतिचुम्बकत्व का गुण पाया जाता है। ये इलेक्ट्रॉन एक-दूसर के प्रभाव को नष्ट कर देते हैं, जिससे पदार्थ का कुल चुम्बकीय आघूर्ण शून्य हो जाता है। इन्हें प्रतिचुम्बकीय पदार्थ कहते हैं तथा इन पर चुम्बकीय क्षेत्र लगाने पर, कक्षीय आघूर्ण लगाए गए क्षेत्र की विपरीत दिशा में प्रेरित हो जाता है अतः ये पदार्थ चुम्बकीय क्षेत्र द्वारा प्रतिकर्षित होते हैं।

प्रतिचुम्बकत्व का गुण लगभग सभी पदार्थों द्वारा दर्शाया जाता है लेकिन अनुचुम्बकत्व की तुलना में इसका प्रभाव बहुत कम होता है, अतः अयुग्मित इलेक्ट्रॉन युक्त पदार्थों में इसका अनुभव नहीं होता इसलिए उनमें अनुचुम्बकत्व का गुण पाया जाता है। प्रतिचुम्बकत्व ताप पर निर्भर नहीं करता। उदाहरण- Sc3+, Ti+4 तथा Zn2+ इत्यादि।
प्रश्न 6.
अनुचुम्बकत्च की व्याख्या कीजिए।
उत्तर:
अनुचुम्बकत्व (Paramagnetism) -वे परमाणु, अणु या आयन जिनमें अयुग्मित इलेक्ट्रॉन पाए जाते हैं, उनमें अनुचुम्बकत्व का गुण पाया जाता है तथा इन्हें अनुचुम्बकीय पदार्थ कहते हैं। इन पदार्थों को चुम्बकीय क्षेत्र में रखने पर ये चुम्बकीय क्षेत्र की ओर आकर्षित होते हैं लेकिन चुम्बकीय श्वेत्र हटा लेने पर इनका चुम्बकीय गुण नष्ट हो जाता है। अनुचुम्बकत्व, ताप के व्युक्क्रमानुपाती होता है, अर्थात् ताप बढ़ाने पर यह गुण कम हो जाता है। अयुग्मित इलेक्ट्रॉनों की संख्या बढ़ने पर पदार्थ का अनुचुम्बकीय गुण बढ़ता है। इन पदार्थों का चुम्बकीय आघूर्ण कभी शून्य नहीं होता। उदाहरण- Ti3+, Co2+, Cu2+ इत्यादि।

प्रश्न 7.
लोहचुम्बकत्व का गुण क्या होता है ? समझाइए।
उत्तर:
लोहचुम्बकत्व (Ferromagnetism) – यह उच्चतम कोटि का अनुच्बकत्व होता है। लोहचुम्बकीय पदार्थ चुम्बकीय क्षेत्र द्वारा प्रबलता से आकर्षित होते हैं तथा इनके छोटे-छोटे आण्विक चुम्बक एक ही दिशा में व्यवस्थित हो जाते हैं, जिससे इनका चुम्बकीय ग्रुण बढ़ जाता है। चुम्बकीय क्षेत्र हटा लेने पर भी ये स्थायी चुम्बक की तरह व्यवहार करते हैं।
चोट मारने पर या ताप में परिवर्तन से इनके आण्विक चुम्बकों की व्यवस्था परिवर्तित हो जाती है, जिससे इनका चुम्बकीय गुण भी नष्ट हो जाता है या परिवर्तित हो जाता है। Fe, Co तथा Ni लोहचुम्बकीय तत्वों के उदाहरण हैं। चुम्बकीय आघूर्णों के प्रायोगिक मान सामान्यतः विलयन में उपस्थित. जलयोजित आयनों अथवा ठोस अवस्था के लिए ज्ञात किए जाते हैं। प्रथम संक्रमण श्रेणी के आयनों के परिकलित तथा प्रेक्षित चुम्बकीय आघूर्णों के मान निम्नलिखित प्रकार होते हैं-
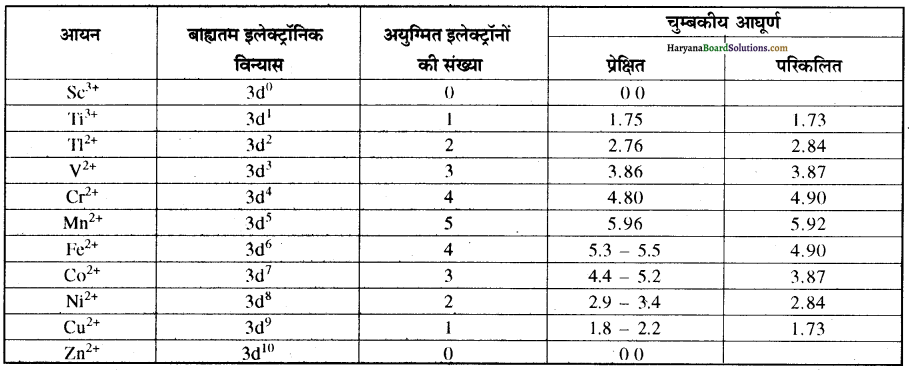
प्रश्न 8.
निर्जल CuSO4 श्वेत होता है लेकिन जलयोजित CuSO4 नील्ना होता है जबकि दोनों में ही Cu2+ आयन होते हैं। क्यों?
उत्तर:
निर्जल CuSO4 तथा CuSO4 . 5H2O (जलयोजित कपर सल्फेट) दोनों में ही Cu+2 है जिसमें एक अयुग्मित इलेक्ट्रांन (3d9) है लेकिन निजल CuSO4 में H2O (लिगन्ड) के बिना d-कक्षकों का विपाटन t2g तथा eg कक्षकों में विपाटन नहीं हो पाता अतः d-d संक्रमण नहीं होता है इसलिए यह रंगहीन होता है। जबकि जलयोजित CuSO4 में d-d संक्रमण हो जाता है, अतः यह नीला होता है।
प्रश्न 9.
(a) Mn का वह लवण कौनसा है जो KClO4 के समसंरचनात्मक होता है?
(b) मैंगनेट तथा परमेंगनेट आयनों की संरचना तथा चुम्बकीय गुण बताइए।
उत्तर:
(a) KMnO4 (पोटैशियम परमें गनेट) KClO4 (पोंटेशियम क्लोरेद) के समसंरचनात्मक होता है अर्थात् दोनों की संरचना समान होती है।
(b) मैंगनेट तथा परमैंगनेट आयन चतुष्फलकीय ह्रोते हैं जिनमें आवसीजन के p-कथक तथा Mn के d कथकों के मध्य अंत्यापन, से π-बन्ध बनता है तथा इनमें Mn पर sp3 संकरण होता है। इनकी संरचना निम्न प्रकार होती है-
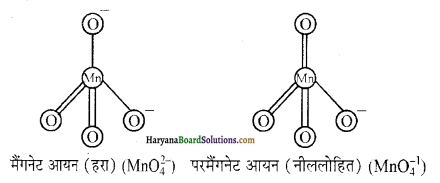
परमैंगनेट आयन प्रतिचुम्बकीय होता है जिसे 513 K पर गर्म करने पर यह मैंगनेट आयन में परिवर्तित हो जाता है जो कि अनुचुंबकीय होता है क्योंकि इसमें एक अयुग्मित इलेक्ट्रॉंन होता है।
प्रश्न 10.
परमैंगनेट आयन \(\left(\mathrm{MnO}_4^{-}\right)\) हाइड्रोजन आयनों की भिन्न-भिन्न सान्द्रताओं प्रर भिन्न-भिन्न अपचयन उत्पाद् देता है, इनके समीकरण लिखिए।
उत्तर:
परमैंगनेट आयन की अपचयन अभिक्रिया से बने उत्पाद हाइ्ड्रोजन आयन की संद्रता पर निभर करते हैं। H+ की विभिन्न सान्द्रताओं पर होने वाली अभिक्रियाएँ निम्न प्रकार हैं-
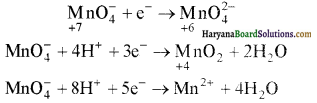
[H+] = 1 पर परमैंगनेट आयन द्वारा जल का आंक्सीकरण होना चाहिए लेकिन यह अभिक्रिया बहुत धीमी गति से होती है लोकिन इसमें Mn2+ आयन उत्त्रेसक के रूप में प्रयुक्त करने पर या ताप बन्ढ़ने पर अभिक्रिया का वेग बढ़ जाता है।
![]()
प्रश्न 11.
क्रोमिल क्नोराइड परीक्षणा को समझाइए।
उत्तर:
(vi) क्रोमिल क्लोराइड परीक्षण-यह क्लोराइड आयन का निश्चयात्मक परीक्षण है। जब किसी क्लोराइड लवण को प्रबल अम्लीय माध्यम (सान्द्र H2SO4) में K2Cr2O7 के साथ गर्म किया जाता है तो क्रोमिल क्लोराइड (CrO2Cl2) की नारंगी धूम बनती है।
K2Cr2O7 + 6H2SO4 + 4KCl → 2CrO2Cl2 + 6KHSO4 + 3H2O
प्रश्न 12.
एथीलीन की बेयर अभिकर्मक से क्रिया को समझाइए।
उत्तर:
एथिलीन की क्रिया 1% क्षारीय KMnO4 (बेयर अभिकर्मक) से करवाने पर एथिलीन ग्लाइकॉल बनता है जिसके कारण विलयन गुलाबी से रंगहीन हो जाता है। इस अभिक्रिया की सहायता से असंतृप्तता C = C या (C ≡ C) का परीक्षण किया जाता है तथा इसे बेयर परीक्षण कहते हैं।
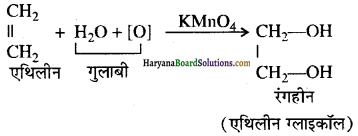
प्रश्न 13.
(i) Ce+4 प्रबल ऑक्सीकारक होता है, क्यों?
(ii) Eu2+ प्रबल अपचायक होता है, क्यों?
उत्तर:
(i) Ce+4 में उंत्कृष्ट गैस विन्यास होते हुए भी यह प्रचल ऑक्स्रीकारक होता है क्योंक Ce+4/Ce+3 के लिए मानक इलेबट्रॉड विभव का मान उच्च होता है अतः यह आसानी से इलेक्ट्रॉन ग्रहृण करके Ce+3 (सामान्य ऑक्सीकरण अवस्था) बना लेता है। अतः यह जल को भौ ऑंक्सीकृत कर द्तेता है।
(ii) Eu2+ प्रबल अपचायक होता है क्योंक यह इलेक्ट्रॉन त्यागकर लैन्थेनॉयडों की सामान्य औक्सीकरण अवस्था +3 में परिवर्तित हो ज्ञात है।
प्रश्न 14.
लैन्थेनॉयडों के रंग तथा चुम्बकीय गुणों को समझाइए।
उत्तर:
रंग तथा चुम्बकीय गुण (Colour and Magnetic Property)一लैन्थेनॉयडों में कुछ त्रिसंयोजी आयन ठोस अवस्था तथा विलयन में रंगीन होते हैं। इन आयनों का रंग f इलेक्ट्रॉनों की उपस्थिति के कारण होता है। La3+ तथा Lu3+ आयन रंगहीन हैं परन्तु शेष लैन्थेनॉयड आयन रंगीन होते हैं। लेकिन f स्तर पर (f-f संक्रमण) ही उत्तेजना के कारण अवशोषण बैंड संकीर्ण (narrow) होते हैं। कुछ आयनों का रंग समान होता है। जैसे- Pr3+ व Tm+3 हरे रंग के तथा Nd3+ व Er3+ गुलाबी होते हैं। 4f0 (La3+ तथा Ce4+) एवं 4f14(Yb2+ तथा Lu3+) विन्यास के अतिरिक्त अन्य सभी विन्यासयुक्त लैन्थेनॉयड आयन अनुचुंबकीय होते हैं तथा नियोडिमियम का अनुचुंबकीय गुण अधिकतम होता है।
प्रश्न 15.
लैन्थेनॉयडों के अपचायक गुण का कारण तथा क्रम बताइए।
उत्तर:
अपचायक गुण (Reducing Property) – अर्धअभिक्रिया \(\operatorname{Ln}_{(a q)}^{3+}+3 \mathrm{e}^{-} \rightarrow \operatorname{Ln}_{(s)}\) के लिए E0 के मान लगभग – 2.2 से – 2.4 V तक होते हैं। E0 के इन उच्च ऋणात्मक मानों से ज्ञात होता है कि लैन्थेनॉयड प्रबल अपचायक होते हैं तथा आसानी से Ln3+ बना देते हैं। La से Lu तक E0 के मान कम ऋणात्मक होते जाते हैं अतः इनका अपचायक गुण कम होता जाता है। अपचायक गुण के कारण ही ये धातुएँ विद्युत धनी होती हैं।
प्रश्न 16.
ऐक्टिनॉयडों के परमाणु तथा आयनिक आकार को समझाइए।
उत्तर:
ऐक्टिनॉयडों में परमाणु तथा आयनिक आकार की सामान्य प्रवृत्ति लैन्थेनॉयडों के समान ही होती है। श्रेणी में बाएँ से दाएँ जाने पर परमाणु आकार तथा आयनिक आकार (M+3) में क्रमिक कमी होती है, इसे ऐक्टिनॉयड संकुचन कहते हैं। आकार में यह कमी एक तत्व से दूसरे तत्व में उत्तरोत्तर बढ़ती है, जिसका कारण 5f इलेक्ट्रॉनों का दुर्बल परिरक्षण प्रभाव है।
बोर्ड परीक्षा के दुष्टिकोण से सम्भावित महत्त्वपूर्ण प्रश्न:
प्रश्न 1.
निम्नलिखित रासायनिक अभिक्रिया समीकरणों को पूर्ण कीजिए-
(i) \(\mathrm{MnO}_4^{-}(\mathrm{aq})+\mathrm{C}_2 \mathrm{O}_4^{2-}(\mathrm{aq})+\mathrm{H}^{+}(\mathrm{aq}) \rightarrow\)
(ii) \(\mathrm{Cr}_2 \mathrm{O}_7^{2-}(\mathrm{aq})+\mathrm{Fe}^{2+}(\mathrm{aq})+\mathrm{H}^{+}(\mathrm{aq}) \rightarrow\)
उत्तर:
(i) \(2 \mathrm{MnO}_4^{-}(\mathrm{aq})+5 \mathrm{C}_2 \mathrm{O}_4^{2-}(\mathrm{aq})+16 \mathrm{H}^{+}(\mathrm{aq}) \rightarrow 2 \mathrm{Mn}^{2+}(\mathrm{aq})+8 \mathrm{H}_2 \mathrm{O}(\mathrm{l})+10 \mathrm{CO}_2(\mathrm{~g})\)
(ii) \(\mathrm{Cr}_2 \mathrm{O}_7^{2-}(\mathrm{aq})+14 \mathrm{H}^{+}(\mathrm{aq})+6 \mathrm{Fe}^{2+}(\mathrm{aq}) \rightarrow 2 \mathrm{Cr}^{3+}(\mathrm{aq})+6 \mathrm{Fe}^{3+}(\mathrm{aq})+7 \mathrm{H}_2 \mathrm{O}(l)\)
प्रश्न 2.
आप निम्नलिखित के क्या कारण समझते हैं-
(i) बहुत से संक्रमण तत्व और उनके यौगिक अच्छे उत्प्रेरकों का कार्य करते हैं।
(ii) संक्रमण तत्वों की तीसरी (5d) श्रेणी के तत्चों की धात्विक त्रिज्याएँ लगभग वही होती हैं जो दूसरी श्रेणी के तत्सम्बन्धी तत्वों की होती हैं।
(iii) ऐक्टिनॉयडों में उपचयन अवस्थाओं (ऑक्सीकरण अवस्थाओं) का परास लैन्थेनॉयडों की अपेक्षा अधिक होता है।
उत्तर:
(i) संक्रमण तत्य और उनके यौगिक अच्छे उत्त्रेरक होते हैं क्योंकि इनमें परिवर्तनशील औंक्सीकरण अवस्था, अयुग्मित इ्लेक्ट्रॉन एवं रिक्त $d$ कक्षक पाए जाते हैं अतः ये आसानी से मध्यवर्तो यौगिक बना लेते हैं।
(ii) संक्रमण तात्वों की तीसरी श्रेणी (5d) के तत्वों की धात्थिक त्रिज्याएँ लगभग वही होती हैं जो दूसरी श्रेणी के संग्त तत्वों की होती है क्योंकि इल्लेक्ट्रॉन, 5d से पहले 4f कक्षकों में भर जाते हैं जिनके कारण परमाणु आकार में होने वाली वृद्धि का प्रभाव 4f के 14 तत्वों के नाभिकीय आवेश द्वारा संतुलित हो जाता है।
(iii) ऐक्टिनायडों में उपचयन अवस्थाओं का परास लैन्थेनोंयडों की अपेक्षा अधिक होता है क्यांकि इनमें 5f, 6d तथा 7s उपकोशों की ऊर्जा लमभग समान होती है। अतः इनके इलेकर्रोन बन्ध बनाने में भाग लेते हैं।
प्रश्न 3.
(a) निम्नलिखित रासायनिक समीकरणों को पूर्ण कीजिए-
(i) \(\mathrm{Cr}_2 \mathrm{O}_7^{2-}(\mathrm{aq})+\mathrm{H}_2 \mathrm{~S}(\mathrm{~g})+\mathrm{H}^{+}(\mathrm{aq}) \rightarrow\)
(ii) \(\mathrm{Cu}^{2+}(\mathrm{aq})+\mathbf{I}^{-}(\mathrm{aq}) \rightarrow\)
(b) निम्नलिखित को कारण लिखकर स्पष्ट कीजिए-
(i) ऑक्सोत्रुणायनों की ऑक्सीकरण क्षमता \(\mathrm{VO}_2^{+}<\mathrm{Cr}_2 \mathrm{O}_7^{2-}<\mathrm{MnO}_4^{-}\) के क्रम में होती है।
(ii) मैंगनीज (Z = 25) की तृतीय आयनन एन्थैल्पी अनअपेक्षित: उच्च्च होती है।
(iii) Cr2+ अपेक्षाकृत Fe2+ के अधिक प्रबल अपचायक है।
अथवा
(a) निम्नलिखित रासायनिक समीकरणों को पूर्ण कीजिए-
(i) \(\mathrm{MnO}_4^{-}(\mathrm{aq})+\mathrm{S}_2 \mathrm{O}_3^{2-}(\mathrm{aq})+\mathrm{H}_2 \mathrm{O}(l) \rightarrow\)
(ii) \(\mathrm{Cr}_2 \mathrm{O}_7^{2-}(\mathrm{aq})+\mathrm{Fe}^{2+}(\mathrm{aq})+\mathrm{H}^{+}(\mathrm{aq}) \rightarrow\)
(b) निम्नलिखित अवलोकनों की व्याख्या कीजिए-
(i) La3+ (Z = 57) और Lu3+ (Z = 71) विलयनों में कोई रंग नहीं दर्शांते।
(ii) प्रथम श्रेणी के संक्रमण तत्वों के द्विसंयोजन धनायनों में मैंगनीज सर्वाधिक अनुचुम्बकत्व प्रदर्शित करता है।
(iii) जलीय विलयनों में Cu+ आयन का अस्तित्व नहीं जाना जाता।
उत्तर:
(a) (i) \(\mathrm{Cr}_2 \mathrm{O}_7^{2-}(\mathrm{aq})+\mathrm{H}_2 \mathrm{~S}(\mathrm{~g})+8 \mathrm{H}^{+}(\mathrm{aq}) \rightarrow 2 \mathrm{Cr}^{+3}(\mathrm{aq})+7 \mathrm{H}_2 \mathrm{O}(\mathrm{l})+3 \mathrm{~S}(\mathrm{~s})\)
(ii) \(2 \mathrm{Cu}^{2+}(\mathrm{aq})+2 \mathrm{I}^{-}(\mathrm{aq}) \rightarrow \mathrm{Cu}_2^{+2}(\mathrm{aq})+\mathrm{I}_2\)
(b) (i) ऑक्सोत्रशणायनों की ऑँक्सीकरण क्षमता \(\mathrm{VO}_2^{+}<\mathrm{Cr}_2 \mathrm{O}_7^{2-}<\mathrm{MnO}_4^{-}\) के क्रम में होने का कारण धातु की ऑक्सीकरण अवस्था बट़ना है। इनमें V, Cr तथा Mn की आंक्सीकरण अवस्थाएँ क्रमशः + 5, + 6 तथा +7 है जिससे इलेक्ट्रॉंनों को आकर्षित करने की प्रवृत्ति बढ़ती है तथा इनके अपचयन के बाद प्राप्त उत्पादों का स्थायित्व बढ़ता है।
(ii) मैंगनीज की तृतीय आयनन एन्थैल्पी अनअपेक्षितः उच्च होती है क्योंकि दो इलेक्ट्रॉन निकलने के पश्चात् स्थायी अर्धपूरित (3d5) विन्यास प्राप्त हो जाता है जिसमें से तीसरा इलेक्ट्रॉन निकालने के लिए अत्यधिक ऊर्जा की आवश्यकता होती है।
(iii) पाड्यानिहित प्रश्न 8.7 का उत्तर देखें।
अथवा
(a) (i) \(8 \mathrm{MnO}_4^{-}(\mathrm{aq})+2 \mathrm{~S}_2 \mathrm{O}_3^{2-}(\mathrm{aq})+\mathrm{H}_2 \mathrm{O}(l) \rightarrow 8 \mathrm{MnO}_2(\mathrm{~s})+6 \mathrm{SO}_4^{2-}(\mathrm{aq})+2 \mathrm{OH}^{-}(\mathrm{aq})\)
(ii) \(\mathrm{Cr}_2 \mathrm{O}_7^{2-}(\mathrm{aq})+14 \mathrm{H}^{+}(\mathrm{aq})+6 \mathrm{Fe}^{2+}(\mathrm{aq}) \rightarrow 2 \mathrm{Cr}^{+3}(\mathrm{aq})+6 \mathrm{Fe}^{3+}(\mathrm{aq})+7 \mathrm{H}_2 \mathrm{O}(l)\)
(b) (i) La3+ तथा Lu3+ विलयनों में कोई रंग नहीं दर्शाते क्योंकि इन आयनों का इलेक्ट्रॉनिक विन्यास क्रमशः 4f0 तथा 4f14 है जिनमें कोई अयुग्मित इलेक्ट्रॉन नहीं है अतः इनमें इलेक्ट्रॉनों का संक्रमण (f–f संक्रमण) नहीं हो सकता।
(ii) प्रथम श्रेणी के संक्रमण तत्वों के द्विसंयोजक धनायनों में मैंगनीज (Mn2+) सर्वीधिक अनुचुम्बकत्व दर्शाता है क्योंकि इसमें सर्वाधिक अयुग्मित इलेक्ट्रॉन (5) पाए जाते हैं।
(iii) Fe2+ की तुलना में Cr2+ एक प्रबल अपचायक पदार्थ है, क्योंकि Cr2+ से Cr3+ बनने में d4 का d3 में परिवर्तन होता है किन्तु Fe2+ से Fe3+ बनने में d6 का d5 में परिवर्तन होता है तथा जल जैसे माध्यम में d5 की तुलना में d3 अधिक स्थायी है। इसका कारण \(\mathrm{t}_{2 \mathrm{~g}}{ }^3\) विन्यास का अधिक स्थायी होना है तथा इनके E0 मानों से भी यह स्पष्ट हो जाता है।
प्रश्न 4.
निम्नलिखित को कारण सहित स्पष्ट कीजिए-
(i) Cr2+ एक अपचायक है जबकि समान d-ऑर्बिटल विन्यास (d4) के साथ Mn3+ एक उपचायक (ऑक्सीकारक) होता है।
(ii) संक्रमण धातुओं की किसी श्रेणी में, जो तत्व सर्वाधिक संख्या में उपचयन अवस्थाएँ (ऑक्सीकरण अवस्थाएँ) प्रदर्शित करने वाला है, वह श्रेणी के मध्य में पाया जाता है।
उत्तर:
(i) Cr2+ एक अपचायक है; क्योंकि इसका विन्यास d4 से d3 में परिवर्तित होता है जिसमें अर्ध-पूरित t2g स्तर (\(\left(t_{2 g}^3\right)\)) होता है। दूसरी ओर Mn3+ से Mn2+ में परिवर्तन से अर्धपूरित (d5) स्थायी विन्यास प्राप्त होता है जो इसे अतिरिक्त स्थायित्व प्रदान करता है जिसके कारण यह ऑक्सीकारक होता है।
(ii) संक्रमण धातुओं की किसी श्रेणी में मध्य में पाए जाने वाला तत्व सर्वाधिक संख्या में उपचयन अवस्थाएँ दर्शाता है क्योंक इसमें अयुग्मित इलेक्ट्रॉनों की संख्या अधिक होती है अतः इसमें साझेदारी या त्यागने के लिए अधिक इलेक्ट्रॉन उपलब्ध हैं तथा साझेदारी के लिए d कक्षक भी अधिक संख्या में पाए जाते हैं।
प्रश्न 5.
तत्वों की 3d श्रेणी में Cr3+, Mn2+, Fe3+ और बाद में M2+ आयनों के विपरीत 4d और 5d श्रेणियों के धातु सामान्यतः ऐसे स्थायी धनायनी स्पीशीज नहीं बनाते।
उत्तर:
4d तथा 5d श्रेणियों के धातु 3d श्रेणी के तत्वों के समान निम्न ऑक्सीकरण अवस्था नहीं दर्शाते क्योंकि इनमें उच्च ऑक्सीकरण अवस्थाएँ अधिक स्थायी होती हैं जबकि 3d श्रेणी के तत्वों के उच्च ऑक्सीकरण अवस्था के यौगिक अपचयित हो जाते हैं।
प्रश्न 6.
निम्नलिखित रासायनिक अभिक्रिया समीकरणों को पूर्ण कीजिए-
(i) \(\mathrm{Cr}_2 \mathrm{O}_7^{2-}+\mathrm{I}^{-}+\mathrm{H}^{+} \rightarrow\)
(ii) \(\mathrm{MnO}_4^{-}+\mathrm{NO}_2^{-}+\mathrm{H}^{+} \rightarrow\)
उत्तर-
(i) \(\mathrm{Cr}_2 \mathrm{O}_7^{2-}+6 \mathrm{I}^{-}+14 \mathrm{H}^{+} \rightarrow 2 \mathrm{Cr}^{3+}+7 \mathrm{H}_2 \mathrm{O}+3 \mathrm{I}_2\)
(ii) \(2 \mathrm{MnO}_4^{-}+5 \mathrm{NO}_2^{-}+6 \mathrm{H}^{+} \rightarrow 2 \mathrm{Mn}^{2+}+5 \mathrm{NO}_3^{-}+3 \mathrm{H}_2 \mathrm{O}\)
प्रश्न 7.
निम्नलिखित को आप कारण सहित कैसे स्पष्ट करेंगे-
(i) लैन्थेनॉयडों में Ln(III) यौगिक प्रमुख होते हैं। परन्तु कभी-कभी विलयनों अथवा ठोस यौगिकों में, +2 और +4 आयन भी पाए जाते हैं।
(ii) \(\mathbf{E}_{\mathbf{M}^{2+} / \mathbf{M}}^{\circ}\) का मान कॉपर के लिए धनात्मक (0.34 V) है। संक्रमण तत्वों के प्रथम श्रेणी में ऐसा व्यवहार दिखाने वाली कॉपर अकेली धातु है।
उत्तर:
(i) लैन्थेनॉयडों की मुख्य ऑक्सीकरण अवस्था +3(Ln3+) होती है। इसके अतिरिक्त ठोस अवस्था में या विलयन में कुछ यौगिकों में + 2 तथा + 4 अवस्था भी पाई जाती है। इसका कारण इनमें उपस्थित रिक्त (f0), अर्धपूरित (f7) तथा पूर्ण पूरित (f14) f-कक्षकों का अधिक स्थायित्व है।
(ii) कॉपर के लिए \(\mathbf{E}_{\mathbf{M}^{2+} / \mathbf{M}}^{\circ}\) का मान धनात्मक होता है क्योंकि कॉपर की क्रियाशीलता कम होती है तथा Cu2+ बनने के लिए 3d10 पूर्णपूरित स्थायी विन्यास में से इलेक्ट्रॉन निकलता है जिसके लिए बहुत अधिक ऊर्जा की आवश्यकता होती है।
![]()
प्रश्न 8.
(i) लैन्थेनॉयड संकुचन किसे कहते हैं?
(ii) क्रोमाइट अयस्क से पोटैशियम डाइक्रोमेट प्राप्त करने की रासायनिक समीकरणों को लिखिए।
उत्तर:
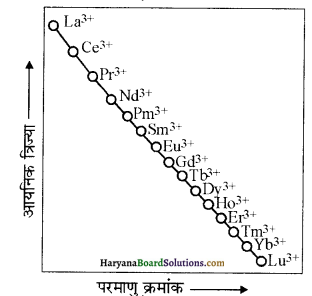
(i) लैन्थेनॉयड संकुचन (Lanthanoid Contraction)लैन्थेनॉयडों में परमाणु क्रमांक बढ़ने पर La से Lu (लैन्थेनम से ल्यूटीशियम) तक परमाणु तथा आयनिक त्रिज्याओं में समग्र (over all) कमी होती है, इसे लैन्थेनॉयड संकुचन कहते हैं।
परमाणु त्रिज्याओं के मानों में यह कमी नियमित नहीं होती है जैसा कि M+3 आयनो में नियमित रूप से कमी होती है। यह संकुचन भी सामान्य संक्रमण श्रेणियों के समान ही है तथा इसका कारण भी समान है अर्थात् एक ही उपकोश में एक इलेक्ट्रॉन का दूसरे इलेक्ट्रॉन द्वारा परिरक्षण प्रभाव अपूर्ण होता है। फिर भी श्रेणी में नाभिकीय आवेश बढ़ने पर एक d-इलेक्ट्रॉन पर दूसरे d-इलेक्ट्रॉन के परिशक्षण प्रभाव की तुलना में, एक 4f इलेक्ट्रॉन का दूसरे 4f इलेक्ट्रॉन पर परिरक्षण प्रभाव कम होता है तथा f-कक्षकों की आकृति भी इसके लिए अनुकूल नहीं है।
अतः श्रेणी में बढ़ते हुए नाभिकीय आवेश के कारण परमाणु क्रमांक बढ़ने के साथ परमाणु आकार में एक नियमित कमी पायी जाती है, लेकिन Eu की परमाणु त्रिज्या अधिक होती है।
(ii) पोटैशियम डाइक्रोमेट (Potassium dichromate) (K2Cr2O7)
बनाने की विधि- K2Cr2O7 को क्रोमाइट अयस्क (FeCr2O4) से बनाया जाता है।
क्रोमाइट अयस्क से K2Cr2O7 बनाने में निम्नलिखित पद प्रयुक्त होते हैं-(i) पहले क्रोमाइट अयस्क को वायु की उपस्थिति में सोडियम कार्बोनेट के साथ संगलित किया जाता है, तो क्रोमेट प्राप्त होता है।
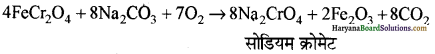
प्रश्न 9.
Ni2+ आयन का चुम्बकीय आघूर्ण ज्ञात कीजिए।
उत्तर:
Ni2+ का इलेक्ट्रॉनिक विन्यास = 3d8
![]()
अतः अयुग्मित इलेक्ट्रोंनों की संख्या, n = 2
चुम्बकीय आघूर्ण
(µ) = \(\sqrt{n(n+2)}\) BM
µ = \(\sqrt{2(2+2)}\) =
√8 = 2.82 BM
प्रश्न 10.
कारण दीजिए-
(अ) संक्रमण तत्वों की 3d श्रेणी में Mn अधिकतम ऑक्सीकरण अवस्था दर्शाता है।
(ब) Cr2+ तथा Mn3+ दोनों का d4 विन्यास है, परन्तु Cr2+ अपचायक और MnCr3+ ऑक्सीकारक है।
उत्तर:
(अ) संक्रमण तत्वों की 3d श्रेणी में Mn सबसे अधिक संख्या में ऑक्सीकरण अवस्थाएँ (+2 से +7) दर्शाता है क्योंकि इसमें सर्वाधिक अयुग्मित इलेक्ट्रॉन पाए जाते हैं।
(ब) Cr2+ एक अपचायक है; क्योंकि इसका विन्यास d4 से d3 में परिवर्तित होता है जिसमें अर्ध-पूरित t2g स्तर (\(t_{2 \mathrm{~g}}^3\)) होता है। दूसरी और Mn3+ से Mn2+ में परिवर्तन से अर्धपूरित (d5) स्थायी विन्यास प्राप्त होता है जो इसे अतिरिक्त स्थायित्व प्रदान करता है जिसके कारण यह ऑक्सीकारक होता है।
प्रश्न 11.
Zn, Cd एवं Hg को संक्रमण तत्व नहीं माना जाता है। कारण दीजिए।
उत्तर:
Zn, Cd एवं Hg की मूल अवस्थाओं तथा सामान्य ऑक्सीकरण अवस्थाओं में d-कक्षक पूर्ण भरे होते हैं अतः इन्हें संक्रमण तत्व नहीं माना जाता है। संक्रमण तत्वों में मूल अवस्था अथवा सामान्य ऑक्सीकरण अवस्था में d-कक्षक अपूर्ण होते हैं।
प्रश्न 12.
क्रोमेट आयन की आकृति केसी होती है? इसकी संरचना बनाइए।
उत्तर:
क्रोमेट आयन \(\left(\mathrm{CrO}_4^{2-}\right)\) कौ अकृति चतुण्फलकीय होती है।
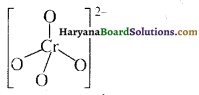
प्रश्न 13.
Ti4+ आयन संगहीन होता है। कारण बताइए।
उत्तर:
Ti4+ आयन का बहातम इलेक्ट्रानिक विन्यास 3d0 है जिसमें कोई अयुग्मित इ्लेक्टान नहीं है अत्ता इसमें इलेक्टौन का उत्तेजन सम्भग नहीं है। इसकिए Ti4+ आयन रेगहीन होता है।
प्रश्न 14.
निम्नलिखित के कारण दीजिए-
(1) (a) Mn3+ एक अच्छा अंबसीकास्क है।
(b) संक्रमण तत्वो की प्रथम श्रेणी में \(\mathbf{E}_{\mathbf{M}^{2+}, \mathbf{M}}^{\circ}\) के मान नियमित नहीं हैं।
(c) यद्वापि फ्लुओरीन की विद्युतक्रणता औंक्सीजन से अधिक होती है फिर भी Mn का उच्चतम फ्लुओराइड MnF4 है जबकि इसका उच्चतम ऑक्साइड Mn2O7 है।
(ii) निम्नलिखित समीकरणों को पूर्ण कीजिए-
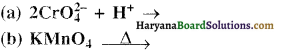
उत्तर:
(i) (a) Mn3+/Mn2+ के लिए E° का मन उच्च धनात्मक है अन्तः Mn3+ आसानी से Mn2+ सें अपचयित हो सकता है तथा Mn2+ में अर्धपरित (3d5) स्थायी विन्बास है इसलिए वह Mn+3 से अंक र्थ्यायी है। इसी कारण Mn3+ एक अच्छ कौनसीकारक है।
(b) प्रथम संक्रमण श्रेणी की धातुओं के लिए E0(Mn2+/M) के मान नियमित नहीं हैं। E0 मान आयनन एन्थैल्पी में अनियमित परिवर्तन (△iH1+△iH2) तथा ऊर्ध्वपातन एन्थैल्पी पर निर्भर करता है। V तथा Mn के लिए आयनन एन्थैल्पी तथा ऊर्ध्वपातन एन्थैल्पी अपेक्षाकृत कम होती है, अतः E0 के मान अनियमित हो जाते हैं।
(c) अन्य मकत्वपूर्ण प्रश्न (लमूतरत्मक) संख्या lb का उतर देखें।
(ii) 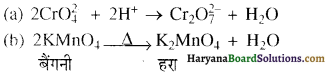
प्रश्न 15.
(i) निम्नलिखित को कैसे बनाएंगे? केवल समीकरण बीजिए।
(a) MnO2 से K2MnO4
(b) Na2CrO4 से Na2Cr2O7
(ii) +3 ऑक्सीकरण अवस्था में ऑक्सीकृत होने के सन्दर्ध गें Mn2+, Fe+2 की तुलना में अधिक स्थायी होता है, क्यों ?
(iii) ऐकिटनॉयडों में ऑवसीकरण अवस्थाओं की परास अधिक होती है, क्यों?
उत्तर:
(i) (a) 2MnO2 + 4KOH + O2 → 2K2MNO4 + 2H2O
(b) 2Na2CrO4 + \(2 \stackrel{+}{\mathrm{H}}\) → Na2Cr2O7 + \(2 \mathrm{Na}^{+}\)
(ii) जिंक में 3d कक्षकों के इलेक्ट्रॉन धात्विक बन्ध बनाने में प्रयुक्त नहीं होते हैं क्योंकि इसका इलेक्ट्रॉनिक विन्यास 3d104s2 होता है जबकि 3d श्रेणी के अन्य सभी धातुओं के d कक्षक अपूर्ण भरे होने के कारण ये इलेक्ट्रॉन धात्विक बनाने में प्रयुक्त होते हैं। अतः Zn में धात्विक बन्ध दुर्बल होता है इसलिए इसकी कणन एन्थैल्पी (परमाणुकरण की एन्थैल्पी) सबसे कम होती है।
(iii) ऐक्टिनायडों में उपचयन अवस्थाओं का परास लैन्थेनोंयडों की अपेक्षा अधिक होता है क्यांकि इनमें 5f, 6d तथा 7s उपकोशों की ऊर्जा लमभग समान होती है। अतः इनके इलेकर्रोन बन्ध बनाने में भाग लेते हैं।
प्रश्न 16.
कोई धातु अपनी उच्चतम ऑक्सीकरण अवस्था केवल ऑक्साइड अथवा फ्लुओराइड में ही क्यों प्रदर्शित करती है?
उत्तर:
ऑक्सीजन तथा फ्लुओरोन की उच्च विद्युत्तरणता तथा इनके छोटे आकार के कारण ये धातुओं को उचतम ऑक्सीकरण अवस्था तक ऑक्सीकृत कर देते हैं अतः कोई धातु अपनी उच्चतम ऑक्सीकरण अवस्था केवल ऑक्साइड अथवा फ्लुओराइड में ही प्रद्रार्शित करती है।
प्रश्न 17.
(अ) सिल्वर परमाणु की मूल अवस्था में पूर्ण भरित d-कक्षक (4 d10) हैं, फिर भी यह एक संक्रमण तत्व है। कैसे?
(ब) ऐक्टिनॉयड आकुंचन समझाइए।
उत्तर:
(अ) सिल्वर परमाणु की मूल अवस्था में पूर्ण भरित d कक्षक (4 d10) होते हुए भी यह एक संक्रमण तत्व है क्योंकि इसकी ऑक्सीकरण अवस्था (Ag2+) में d-कक्षक अपूर्ण हो जाते हैं।
(ब) ऐक्टिनॉयड श्रेणी में बाएं से दाएं जाने पर परमाणु आकार तथा आयनिक आकार (M+3) में धीरे-धीरे क्रमिक कमी होती है, इसे ऐक्टिनॉयंयड आकुंचन कहते हैं।
![]()
प्रश्न 18.
(अ) लैन्थेनॉयड आकुंचन किसे कहते हैं?
(ब) अंतराकाशी यौगिक किसे कहते हैं? एक उदाहरण दीजिए।
(स) M2+ (जलीय) आयन (Z = 29) के लिए ‘प्रचक्रण मात्र’ चुम्बकीय आघूर्ण की गणना कीजिए।
उत्तर:
(अ) लैन्थेनॉयडों में La से Lu (लैन्थेनम से ल्यूटीशियम ) तक परमाणु क्रमांक बढ़ने पर परमाणु तथा आयनिक त्रिज्याओं में कमी होती है, इसे लैन्थेनॉयड आकुंचन (संकुचन ) कहते हैं।
(ब) संक्रमण धातुओं के क्रिस्टल में परमाणुओं के निबिड़ संकुलित होने के बाद भी उनके मध्य छोटे-छोटे रिक्त स्थान बच जाते हैं, जिन्हें अन्तराकाश कहते हैं। इन रिक्त स्थानों में छोटे अधातु परमाणु जैसे H. B, C तथा N आदि आ जाते हैं तो इस प्रकार बने यौगिकों को अन्तराकाशी यौगिक कहते हैं। उदाहरण- Fe3H
(स) परमाणु क्रमांक (Z) = 29 के M2+ आयन (Cu2+) का इलेक्ट्रॉनिक विन्यास निम्न है-
Cu2+ = [Ar] 3d9
![]()
यहाँ अयुग्मित इलेक्ट्रॉनों की संख्या n = 1, अतः प्रचक्रण मात्र चुम्बकीय आघूर्ण
(µ) = \(\sqrt{n(n+2)}\) BM
µ = \(\sqrt{1(1+2)}\) BM
µ = √3 BM
µ = 1.732 BM
प्रश्न 19.
संक्रमण तत्त्व परिवर्तनशील उपचयन अवस्थाएँ क्यों दिखलाते हैं? d-ब्लॉक की उपचयन अवस्थाएँ p-ब्लॉक के तत्त्वों की उपचयन अवस्थाओं से कैसे भिन्न होती हैं?
उत्तर:
संक्रमण तत्त्व परिवर्तनशील उपचयन (ऑक्सीकरण) अवस्थाएँ प्रदर्शित करते हैं क्योंकि इनके (n – 1) d तथा ns कक्षकों की ऊर्जा में अन्तर बहुत कम होता है तथा इनके d-कक्षकों में अयुग्मित इलेक्ट्रॉन भी पाए जाते हैं। अतः इनमें ns इलेक्ट्रॉनों के साथ (n – 1)d इलेक्ट्रॉन भी बन्ध बनाने में प्रयुक्त होते हैं।
d-ब्लॉक की उपचयन अवस्थाओं में एक का अन्तर होता है। जैसे Mn,+ 2,+ 3,+ 4,+ 5,+ 6 तथा +7 अवस्था दर्शाता है जबकि p-ब्लॉक के तत्त्वों में उपचयन अवस्थाओं में सदैव दो का अन्तर होता है। जैसें- Sn,+2 तथा + 4 अवस्था दर्शाता है।
प्रश्न 20.
(i) Mn3+/Mn2+ युग्म के लिए E0 का मान धनात्मक (+1.5 V) है जबकि Cr3+/Cr2+ के लिए यह ऋणात्मक (- 0.4 V) है। क्यों?
(ii) संक्रमण धातुएँ यौगिक बनाती हैं। क्यों?
(iii) निम्नलिखित समीकरण को पूर्ण कीजिए-
\(2 \mathrm{MnO}_4^{-}+16 \mathrm{H}^{+}+5 \mathrm{C}_2 \mathrm{O}_4^{2-} \rightarrow\)
उत्तर:
(i) Mn3+/Mn2+ युग्म के लिए E0 का मान धनात्मक है जबकि Cr3+/Cr2+ के लिए यह ऋणात्मक है क्योंकि Mn3+ से Mn2+ में परिवर्तन से अर्धपूरित (d5) स्थायी विन्यास प्राप्त होता है जबकि Cr+3 से Cr+2 में परिवर्तन से अधिक स्थायी अर्धपूरित t2g स्तर (\(\left(\mathrm{t}_{2 \mathrm{~g}}^3\right)\)) कम स्थायी \(\left(\mathrm{t}_{2 \mathrm{~g}}^2\right)\) विन्यास में परिवर्तित होता है।
(ii) संक्रमण धातुओं के यौगिक सामान्यतः रंगीन होते हैं क्योंकि इनमें अयुग्मित इलेक्ट्रॉन होते हैं जिससे दृश्य प्रकाश द्वारा d-d संक्रमण (t2g से eg) आसानी से हो जाता है। लिगन्ड (जल इत्यादि) की उपस्थिति में d कक्षक दो भागों में विभाजित हो जाते हैं- t2g तथा eg । इसी कारण इनका रंग जलीय विलयन या जलयोजित अवस्था में ही प्रेक्षित होता है।
(iii) \(2 \mathrm{MnO}_4^{-}(\mathrm{aq})+16 \mathrm{H}^{+}(\mathrm{aq})+5 \mathrm{C}_2 \mathrm{O}_4^{2-}(\mathrm{aq}) \rightarrow 2 \mathrm{Mn}^{2+}(\mathrm{aq})+8 \mathrm{H}_2 \mathrm{O}(l)+10 \mathrm{CO}_2(\mathrm{~g})\)