Haryana State Board HBSE 12th Class Chemistry Important Questions Chapter 4 रासायनिक बलगतिकी Important Questions and Answers.
Haryana Board 12th Class Chemistry Important Questions Chapter 4 रासायनिक बलगतिकी
बहुविकल्पीय प्रश्न:
1. अभिक्रिया
![]()
की अभिक्रिया की कोटि तथा अणुसंख्यता क्रमशः है-
(अ) 1, 3
(ब) 1, 2
(स) 2, 1
(द) 2, 2
उत्तर:
(ब) 1, 2
2. प्रथम कोटि अभिक्रिया की अर्धायु 100 सेकण्ड है तो इसका वेग स्थिरांक होगा-
(अ) 6.93 × 10-3s
(ब) 6.93 × 10-2s
(स) 0.693 s
(द) 6.93 s
उत्तर:
(अ) 6.93 × 10-3s
3. अभिक्रिया x + y → उत्पाद के लिए अभिक्रिया का वेग = k[x]a [y]b है तो अभिक्रिया की कोटि होगी-
(अ) b
(ब) a
(स) a + b
(द) उपर्युक्त में से कोई नहीं ।
उत्तर:
(स) a + b
4. x तथा y के मध्य अभिक्रिया का वेग 100 गुना हो जाता है जब x की सांद्रता 10 गुना बढ़ा देते हैं तो X ‘संदर्भ में अभिक्रिया की कोटि होगी-
(अ) 10
(ब) 2
(स) 4
(द) 1
उत्तर:
(ब) 2
![]()
5. प्रथम कोटि अभिक्रिया के वेग स्थिरांक की इकाई है-
(अ) सेकंड2
(ब) मोल लीटर-1 सेकंड-1
(स) सेकंड-1
(द) उपर्युक्त में से कोई नहीं ।
उत्तर:
(स) सेकंड-1
6. अभिक्रिया के वेग की इकाई है-
(अ) मोल लीटर-1
(ब) मोल सेकंड-1
(स) मोल लीटर-1 सेकंड-1
(द) मोल लीटर-1 सेकंड
उत्तर:
(स) मोल लीटर-1 सेकंड-1
7. उत्प्रेरक की उपस्थिति में किसी अभिक्रिया की सक्रियण ऊर्जा-
(अ) बढ़ जाती है।
(ब) कम हो जाती है।
(स) स्थिर रहती है।
(द) उपर्युक्त में से कोई नहीं ।
उत्तर:
(ब) कम हो जाती है।
8. किसी अभिक्रिया का वेग स्थिरांक निम्नलिखित में से किस पर निर्भर करता है?
(अ) सांद्रता
(ब) अभिक्रिया का ताप
(स) दाब
(द) माध्यम की प्रकृति
उत्तर:
(ब) अभिक्रिया का ताप
9. प्रथम कोटि की अभिक्रिया की अर्धायु निर्भर करती है-
(अ) क्रियाकारकों की सांद्रता पर
(ब) उत्पादों की सांद्रता पर
(स) वेग स्थिरांक पर
(द) उत्प्रेरक पर
उत्तर:
(स) वेग स्थिरांक पर
10. शून्य कोटि अभिक्रिया का उदाहरण है-
(अ) H2 + I2 → 2HI
![]()
(स) एस्टर का क्षारीय जल अपघटन
(द) \(\mathrm{C}_2 \mathrm{H}_{4(\mathrm{~g})}+\mathrm{H}_{2(\mathrm{~g})} \rightarrow \mathrm{C}_2 \mathrm{H}_{6(\mathrm{~g})}\)
उत्तर:
![]()
11. किसी अभिक्रिया का वेग, अभिकारकों की सांद्रता पर निर्भर नहीं करता तो उस अभिक्रिया की कोटि क्या होगी ?
(अ) 1
(ब) शून्य
(स) 2
(द) 3
उत्तर:
(ब) शून्य
12. किसी शून्य कोटि अभिक्रिया के लिए निम्नलिखित में से कौनसा कथन सत्य है ?
(अ) वेग = k
![]()
(स) k का मात्रक = सेकण्ड-1
(द) उपर्युक्त सभी।
उत्तर:
(अ) वेग = k
13. अभिक्रिया A + B = 2C के लिए A के लुप्त होने का वेग 10-2 मोल लीटर-1 सेकंड-1 है तो C के बनने का वेग क्या होगा-
(अ) 1.5 × 10-2 मोल लीटर10-1 सेकंड10-1
(ब) 0.5 × 10-2 मोल-1 लीटर सेकंड
(स) 1 × 10-2 मोल लीटर सेकंड
(द) 2.0 × 10-2 मोल लीटर सेकंड ।
उत्तर:
(द) 2.0 × 10-2 मोल लीटर सेकंड ।
14. \({ }_6 \mathrm{C}^{14}\) की अर्धायु 5760 वर्ष है। \({ }_6 \mathrm{C}^{14}\) का 100 mg का नमूना कितने वर्ष के बाद 25 mg रह जाएगा ?
(अ) 1440 वर्ष
(ब) 23040 वर्ष
(स) 11520 वर्ष
(द) उपर्युक्त में से कोई नहीं।
उत्तर:
(स) 11520 वर्ष
15. किसी रासायनिक अभिक्रिया के लिए देहली ऊर्जा होती है-
(अ) सक्रियण ऊर्जा – अभिकारकों की सामान्य ऊर्जा
(ब) सक्रियण ऊर्जा + अभिकारकों की सामान्य ऊर्जा
(स) सक्रियण ऊर्जा के बराबर
(द) अभिकारकों की सामान्य ऊर्जा के बराबर.
उत्तर:
(ब) सक्रियण ऊर्जा + अभिकारकों की सामान्य ऊर्जा
16. अभिकारक अणुओं को उत्पाद में परिवर्तित होने के लिए आवश्यक न्यूनतम ऊर्जा होती है-
(अ) गतिज ऊर्जा
(ब) स्थितिज ऊर्जा
(स) सक्रियण ऊर्जा
(द) गतिज ऊर्जा + स्थितिज ऊर्जा
उत्तर:
(स) सक्रियण ऊर्जा
17. अभिक्रिया 2A + B → 3C + D के लिए, निम्नलिखित में से कौनसा व्यंजक, अभिक्रिया के वेग को नहीं दर्शाता ?
(अ) \(-\frac{\mathrm{d}(\mathrm{A})}{2 \mathrm{dt}}\)
(ब) \(-\frac{\mathrm{d}(\mathrm{B})}{\mathrm{dt}}\)
(स) \(-\frac{\mathrm{d}(\mathrm{C})}{\mathrm{dt}}\)
(द) \(+\frac{\mathrm{d}(\mathrm{D})}{\mathrm{dt}}\)
उत्तर:
(स) \(-\frac{\mathrm{d}(\mathrm{C})}{\mathrm{dt}}\)
18. किसी अभिक्रिया की सक्रियण ऊर्जा को प्रभावित करने वाला कारक
(अ) ताप
(स) सांद्रता
(ब) टक्कर आवृत्ति
(द) ताप
उत्तर:
(द) ताप
19. किसी अभिक्रिया के वेग स्थिरांक की ताप पर निर्भरता को निम्नलिखित में से किस समीकरण से दिया जाता है?
(अ) In k = In A – \(\frac{\mathrm{E}_{\mathrm{a}}}{\mathrm{RT}}\)
(ब) In A = In k – \(\frac{\mathrm{E}_{\mathrm{a}}}{\mathrm{RT}}\)
(स) In k = A\(\frac{\mathrm{E}_{\mathrm{a}}}{\mathrm{RT}}\)
(द) In A = RT In Ea – In k
उत्तर:
(अ) In k = In A – \(\frac{\mathrm{E}_{\mathrm{a}}}{\mathrm{RT}}\)
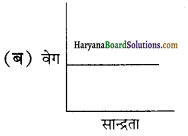
20. शून्य कोटि अभिक्रिया का आलेख है-
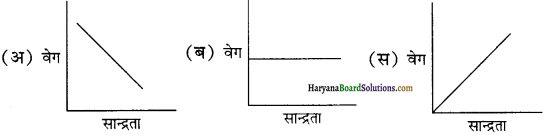
(द) उपर्युक्त में से कोई नहीं
उत्तर:
21. किसी अभिक्रिया में अभिकारक की प्रारम्भिक सान्द्रता दुगुनी करने पर उस अभिक्रिया की अर्धआयु भी पहले की तुलना में दुगुनी हो जाती है तो इस अभिक्रिया की कोटि होगी-
(अ) 3
(ब) 2
(स) शून्य
(द) 1
उत्तर:
(स) शून्य
22.  यह ग्राफ किस कोटि की अभिक्रिया को दर्शाता है?
यह ग्राफ किस कोटि की अभिक्रिया को दर्शाता है?
(अ) प्रथम
(ब) शून्य
(स) द्वितीय
(द) तृतीय
उत्तर:
(अ) प्रथम
![]()
23. रेडियोएक्टिव विघुटन की अभिक्रिया की कोटि कितनी होती है?
(अ) शून्य
(ब) 1
(स) 2
(द) 3
उत्तर:
(ब) 1
24. शून्य कोटि अभिक्रिया के पूर्ण होने में लगा समय है-
(अ) [R]o/k
(ब) 2k/[R]o
(स) [R]ok
(द) उपर्युक्त में से कोई नहीं
उत्तर:
(अ) [R]o/k
25. अभिक्रिया A + 2B → उत्पाद के लिए अवकलन दर समीकरण है-
(अ) \(-\frac{1}{2} \frac{\mathrm{d}[\mathrm{A}]}{\mathrm{dt}}=\frac{-\mathrm{d}[\mathrm{B}]}{\mathrm{dt}}=\mathrm{k}[\mathrm{A}][\mathrm{B}]^2\)
(ब) \(\frac{1}{2} \frac{\mathrm{d}[\mathrm{A}]}{\mathrm{dt}}=\frac{\mathrm{d}[\mathrm{B}]}{\mathrm{dt}}=\mathrm{k}[\mathrm{A}][\mathrm{B}]^2\)
(स) \(\frac{-\mathrm{d}[\mathrm{A}]}{\mathrm{dt}}=\frac{-1}{2} \frac{\mathrm{d}[\mathrm{B}]}{\mathrm{dt}}=\mathrm{k}[\mathrm{A}][\mathrm{B}]^2\)
(द) \(\frac{\mathrm{d}[\mathrm{A}]}{\mathrm{dt}}=\frac{1}{2} \frac{\mathrm{d}[\mathrm{B}]}{\mathrm{dt}}=\mathrm{k}[\mathrm{A}][\mathrm{B}]^2\)
उत्तर:
(स) \(\frac{-\mathrm{d}[\mathrm{A}]}{\mathrm{dt}}=\frac{-1}{2} \frac{\mathrm{d}[\mathrm{B}]}{\mathrm{dt}}=\mathrm{k}[\mathrm{A}][\mathrm{B}]^2\)
26. अभिकर्मक की प्रारम्भिक सान्द्रता को दोगुना करने पर इसकी t1/2 आधी हो जाती है। इस अभिक्रिया की कोटि होगी-
(अ) प्रथम कोटि
(ब) शून्य कोटि
(स) द्वितीय कोटि
(द) तृतीय कोटि
उत्तर:
(स) द्वितीय कोटि
27. यदि a तथा t1/2 क्रमशः अभिक्रियकों की प्रारम्भिक सान्द्रता तथा शून्य कोटि की अभिक्रिया की अर्द्ध आयु हो तो निम्नलिखित में से सही सम्बन्ध है?
(अ) t1/2 ∝ \(\frac { 1 }{ a }\)
(ब) t1/2 ∝ a
(स) t1/2 ∝ \(\frac{1}{a^2}\)
(द) t1/2 ∝ a2
उत्तर:
(ब) t1/2 ∝ a
28. प्रथम कोटि की अभिक्रिया के (t2/3) ज्ञात कीजिए। दिया है k = 5.48 × 10-14 सेकण्ड |
(अ) 2.00 × 1013 सेकण्ड
(ब) 2.00 × 1013 सेकण्ड
(स) 200 × 1020 सेकण्ड
(द) 0.200 × 1010 सेकण्ड
उत्तर:
(अ) 2.00 × 1013 सेकण्ड
29. 2A + B → उत्पाद (P) अभिक्रिया गति नियम दिया है। \(\frac { dp }{ dt }\) = k[A][B] जब [B] >> [A], तो इस परिस्थिति में अभिक्रिया की कोटि होगी-
(अ) 0
(ब) 1
(स) 2
(द) 1.5
उत्तर:
(ब) 1
अतिलघूत्तरात्मक प्रश्न:
प्रश्न 1.
शर्करा के क्रिस्टल की तुलना में शर्करा का पाउडर जल में जल्दी घुल जाता है। क्यों?
उत्तर:
पाठडर अवस्था में शर्करा का पृष्ठ क्षेत्रफल क्रिस्टल की तुलना में अधिक होता है अतः यह जल में जल्दी घुल जाता है।
प्रश्न 2.
N2O5 के विघटन की अभिक्रिया की कोटि बताइए।
उत्तर:
N2O5 का विघटन प्रथम कोटि की अभिक्रिया है।
प्रश्न 3.
किसी अभिक्रिया का औसत वेग तथा तात्क्षणिक वेग कब समान होता है?
उत्तर:
जब समय अन्तराल △t बहुत ही कम (शून्य के नजदीक) हो तब अभिक्रिया का औसत वेग तथा तात्क्षणिक वेग समान होगा।
प्रश्न 4.
किसी अभिक्रिया के लिए वेग स्थिरांक तथा अभिक्रिया वेग की इकाई समान है तो इस अभिक्रिया की कोटि कितनी होगी?
उत्तर:
यह शून्य कोटि की अभिक्रिया है क्योकि इसके लिए-
वेग = k
प्रश्न 5.
किस प्रकार की अभिक्रिया के वेग स्थिरांक की इकाई सान्द्रता पर निर्भर नहीं करती?
उत्तर:
प्रथम कोटि की अभिक्रिया के लिए वेग स्थिरांक (k) की इकाई sec-1 होती है अतः यह सान्द्रता पर निर्भर नहीं करती।
प्रश्न 6.
अभिक्रिया के वेग स्थिरांक को प्रभावित करने वाले कारक बताइए।
उत्तर:
किसी अभिक्रिया का वेग स्थिरांक अभिकारकों की प्रकृति तथा ताप पर निर्भर करता है।
प्रश्न 7.
शून्य कोटि अभिक्रिया में अभिकारकों की सान्द्रता को तीन गुना करने पर इसके वेग पर क्या प्रभाव होगा?
उत्तर:
अभिक्रिया का वेग अपरिवर्तित रहेगा क्योंकि शून्य कोटि अभिक्रिया का वेग सान्द्रता पर निर्भर नहीं करता है।
प्रश्न 8.
अभिक्रिया 2NO +O2 की आप्विकता तथा कोटि कितनी है?
उत्तर:
इस अभिक्रिया की कोटि तथा आण्विकता दोनों ही 3 हैं।
प्रश्न 9.
अभिक्रिया की कोटि तथा आण्विकता में एक अन्तर बताइए।
उत्तर:
अभिक्रिया की आण्विकता हमेशा पूर्णांक होती है जबकि कोटि का पूर्णांक होना आवश्यक नहीं है।
प्रश्न 10.
कोई द्विअणुक अभिक्रिया किस स्थिति में प्रथम कोटि की होगी?
उत्तर:
द्विअणुक अभिक्रिया में किसी एक अभिकारक को आधिक्य में लेने पर अभिक्रिया प्रथम कोटि की होगी क्योंकि अभिक्रिया का वेग इस अभिकारक की सान्द्रता पर निर्भर नहीं करेगा।
प्रश्न 11.
अवकल वेग समीकरण क्या होता है?
उत्तर:
किसी अभिक्रिया के लिए सांद्रता पर आधारित समीकरण को अवकल वेग समीकरण कहते हैं।
प्रश्न 12.
किसी अभिक्रिया का वेग निधाँक पद कौनसा होता है?
उत्तर:
जटिल अभिक्रियाओं में सबसे धीमा पद वेग निर्धारक पद होता है क्योंकि इससे अभिक्रिया का वेग निर्धारित किया जाता है।
प्रश्न 13.
किसी रेडियोएक्टिव विघटन अभिक्रिया की कोटि कितनी होती है?
उत्तर:
रेडियोएक्टिव विघटन अभिक्रिया हमेशा प्रथम कोटि की होती हैं।
प्रश्न 14.
प्रथम कोष्टि अभिक्रिया के वेग स्थिरांक का मात्रक बताइए।
उत्तर:
समय-1 (सेकण्ड-1 या मिनट-1)
प्रश्न 15.
शून्य कोटि अभिक्रिया के वेग स्थिरांक का सूत्र बताइए।
उत्तर:
शून्य कोटि अभिक्रिया के लिए वेग स्थिरांक
\(\mathrm{k}=\frac{[\mathrm{R}]_0-[\mathrm{R}]}{\mathrm{t}}\)
प्रश्न 16.
गैसीय अभिक्रिया A → B + C के लिए वेग नियतांक का सूत्र बताइए।
उत्तर:
\(k=\frac{2.303}{t} \log \frac{P_i}{\left(2 P_i-P_t\right)}\)
प्रश्न 17.
शून्य कोटि अभिक्रिया की अर्धयु ज्ञात करने का सूत्र बताइए।
उत्तर:
\(\mathbf{t}_{\frac{1}{2}}=\frac{[\mathrm{R}]_0}{2 \mathrm{k}}\)
प्रश्न 18.
यदि किसी अभिक्रिया में अभिकारक के सभी अणुओं के मध्य प्रभावी टक्कर हो जाए तो क्या होगा?
उत्तर:
अभिक्रिया तीक्र वेग से होगी तथा लगभग पूर्ण हो जाएगी।
![]()
प्रश्न 19.
देहली ऊर्जा किसे कहते हैं?
उत्तर:
किसी अभिकारक की वह न्यूनतम आवश्यक ऊर्जा जो उसे उत्पाद् में परिवर्तित होने के लिए आवश्यक होती है, उसे देहली ऊर्जा कहते हैं।
देहली ऊर्जां = सामान्य अणु की ऊर्जा + सक्रियण ऊर्जा
प्रश्न 20.
किसी अभिक्रिया में टक्कर करने वाले अणुओं की पर्याप्त संख्या की ऊर्जा, देहली ऊर्जा से अधिक है फिर भी अभिक्रिया का वेग कम है, क्यों?
उत्तर:
अणुओं का अभिविन्यास सही नही होने के कारण अभिक्रिया का वेग कम है।
प्रश्न 21.
दो भिन्न-भिन्न अभिक्रियाएँ समान ताप पर करवाई जाती हैं तथा दोनों के लिए सक्रियण ऊर्जा भी समान है, तो क्या इन अभिक्रियाओं के वेग भी समान होंगे?
उत्तर:
इन अभिक्रियाओं के वेग समान नहीं हो सकते क्योंकि वेग नियतांक, पूर्व चरघातांकी गुणक (A) पर भी निर्भर करता है, जो कि भिन्नभिन्न अभिक्रियाओं के लिए भिन्न-भिन्न होता है।
प्रश्न 22.
प्रभावी टक्कर क्या होती है?
उत्तर:
वे टक्कर जिनके परिणामस्वरूप उत्पाद का निर्माण होता है, उन्हें प्रभावी टक्कर कहते है।
प्रश्न 23.
किसी अभिक्रिया के लिए t1/2 ∝ [R]0 है, तो इस अभिक्रिया की कोटि कितनी होगी?
उत्तर:
शून्य।
लघूत्तरात्मक प्रश्न:
प्रश्न 1.
अभिक्रिया की कौटि तथा अणुसंख्यता (आणिवकता) में विभेद् कीजिए।
उत्तर:
किसी अभिक्रिया की कोटि तथा अणुसंख्यता में निम्नलिखित विभेद है-
- अभिक्रिया की कोटि प्रायोगिक राशि है जबकि आण्विक्ता एक सैद्धान्तिक राशि है।
- कोटि, शून्य या भिन्नात्मक भी हो सकती है जबकि आण्विकता हमेशा पूर्णांक होती है।
- कोटि से अभिक्रिया की क्रियाविधि ज्ञात होती है, आण्विकता से नहीं।
- अभिक्रिया की कोटि प्राथमिक तथा जटिल दोनों प्रकार की अभिक्रियाओं के लिए लाग होती है लेकिन अभिक्रिया की आण्विकता केवल प्राथमिक अभिक्रियाओ के लिए ही लागू होती है। जटिल अभिक्रियाओं की आण्विकता का कोई अर्थ नहीं होता। जटिल अभिक्रियाओं में कोटि सबसे धीमे पद से दी जाती है तथा सामान्यतः सबसे मंद पद की आण्विकता तथा कोटि समान होती है।
- कोटि ताप, दाब या अभिक्रिया की परिस्थिति पर निभर करती है लेकिन आण्विकता नहीं।
- कोटि सान्द्रता से सम्बन्धित होती है जबकि आण्विकता अणुओं की संख्या से सम्बन्धित है।
प्रश्न 2.
तीन अभिक्रियाएँ जिनकी कोटि 1,2 तथा 3 हैं इनके लिए वेग स्थिरांकों का मान समान है तो सान्द्रता का मान 1M, से कम तथा 1M से अधिक होने पर इन अभिक्रियाओं के वेगों का क्रम क्या होगा?
उत्तर:
माना R → उत्पाद्
प्रथम कोटि के लिए, वेग (v1)=k[R]
द्वितीय कोटि के लिए, वेग (v2)=k[R]2
तृतीय कोटि के लिए, वेग (v3)=k[R]3
अतः [R] = 1 होने पर v1 = v2 = v3
जब [R] = 1 तो v1 > v2 > v3
तथा [R] > 1 होने पर v1 < v2 < v3
प्रश्न 3.
किसी अभिक्रिया के वेग स्थिरांक तथा अभिक्रिया वेग में तीन अन्तर बताइए।
उत्तर:
वेग स्थिरांक तथा अभिक्रिया वेग में निम्नलिखित अन्तर होते है-
- वेग स्थिरांक वह वेग है जब सभी अभिकारकों की सान्द्रता इकाई हो लेकिन इकाई समय में किसी अभिकारक या उत्पाद् की सान्द्रता में होने वाला परिवर्तन अभिक्रिया वेग होता है।
- वेग स्थिरांक अभिकारकों की सान्द्रता पर निर्भर नहीं करता जबकि अभिक्रिया का वेग सान्द्रता के समानुपाती होता है।
- वेग स्थिरांक का मात्रक अभिक्रिया की क्रोटि पर निर्भर करता है जबकि वेग का मात्रक mol L-1 s-1 है। अर्थात् यह निश्चित होता है।
प्रश्न 4.
अभिक्रिया – ![]() में पात्र का आयतन प्रारम्भिक आयतन का \(\frac { 1 }{ 3 }\) करने पर अभिक्रिया वेग पर क्या प्रभाव होगा तथा आयतन में इस परिवर्तन से अभिक्रिया की कोटि में क्या परिवर्तन होगा?
में पात्र का आयतन प्रारम्भिक आयतन का \(\frac { 1 }{ 3 }\) करने पर अभिक्रिया वेग पर क्या प्रभाव होगा तथा आयतन में इस परिवर्तन से अभिक्रिया की कोटि में क्या परिवर्तन होगा?
उत्तर:
समीकरण के अनुसार,
अभिक्रिया का प्रारम्भिक वेग (v)= k [A]2 [B]
जब्न पात्र का आयतन प्रारम्भिक आयतन का \(\frac { 1 }{ 3 }\) कर द्यि जाता है तो A तथा B दोनों की सान्द्रता 3 गुना हो जाएगी। अतः इस स्थिति में अभिक्रिया का वेग
v1 = k [3A]2[3B]
v1 = 27k [A]2[B]
अतः अभिक्रिया का वेग प्रारम्भिक वेग की तुलना में 27 गुना हो जाएगा लेकिन अभिक्रिया की कोटि पर कोई प्रभाव नहीं होगा क्योंकि कोटि सान्द्रता या आयतन पर निभर नहीं करती।
प्रश्न 5.
प्रथम कोटि अभिक्रिया की अर्धायु का सूत्र ज्ञात कीजिए तथा सिद्ध कीजिए कि प्रथम कोटि अभिक्रिया की अर्धायु अभिकारक की प्रारंभिक सांद्रता पर निर्भर नहीं करती।
उत्तर:
प्रथम कोटि की अभिक्रिया के लिए वेग स्थिरांक

अतः किसी प्रथम कोटि की अभिक्रिया के लिए अध्धायु का मान निश्चित होता है। अर्थात् यह अभिकारक की प्रारंभिक सांद्रता पर निर्भर नहीं करती।
प्रश्न 6.
प्रथम कोटि की गैसीय अभिक्रिया A(g) → B(g) + C(g) के लिए वेग नियतांक के सूत्र \(k=\frac{2.303}{t} \log \frac{P_i}{\left(2 P_i-P t\right)}\) की व्युत्पत्ति कीजिए।
उत्तर:
अभिक्रिया का अर्ध आयु काल:
प्रथम कोटि की अभिक्रिया के लिए वेग स्थिरांक-

अतः किसी प्रथम कोटि की अभिक्रिया के लिए अर्धायु का मान निश्चित होता है, अर्थात् यह अभिकारक की प्रारंभिक सान्द्रता पर निर्भर नहीं करता।
इसे निम्नलिखित ग्राफ द्वारा दर्शाया जा सकता है-

अत: n वीं कोटि की अभिक्रिया के लिए अर्धायु (t1/2) का सूत्र निम्न प्रकार होगा-
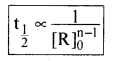
[R]0 = अभिकारक की प्रारम्भिक सान्द्रता
तथा किसी अभिक्रिया के लिए n अर्धायु के बाद बचा पदार्थ = \(\frac{[\mathrm{R}]_0}{2^n}\)
प्रथम कोटि अभिक्रियाओं के उदाहरण-
(i) एथीन का हाइड्रोजनीकरण-
C2H4 (g) + H2 (g) → C2H4 (g)
वेग = k (C2H4) (इसमें H2 आधिक्य में होता है।)
(ii) नाभिकीय विखण्डन (प्राकृतिक या कृत्रिम) की सभी अभिक्रियाएँ प्रथम कोटि की होती हैं जैसे
![]()
(iii) नाइट्स्सक्साइड का अपघटन-
2N2O → 2N2 + O2
वेग = k[N2O]
अभिक्रिया की क्रियाविधि
- N2O → N2 + O (धीमा पद)
- N2O → N2 + O2 (तेज पद)
(iv) गैसीय अभिक्रिया का अध्ययन विभिन्न समय पर अभिकारकों तथा उत्पादों के आंशिक दाब ज्ञात करके किया जाता है।
अभिक्रिया A(g) → B(g) + C(g)
उदाहरण-एजो आइसोप्रोपेन का विघटन
C6H14N2 → N2 + C6H14
अभिक्रिया के लिए वेग = k[A]
अतः यह प्रथम कोटि की अभिक्रिया है।
माना कि गैस A का प्रारंभिक दाब Pi तथा ‘t’ समय पर अभिक्रिया मिश्रण का कुल दाब Pt है तो इस अभिक्रिया हेतु समाकलित वेग समीकरण निम्न प्रकार ज्ञात कर सकते हैं-
कुल दाब Pt = PA + PB + PC
PA, PB तथा PC क्रमशः A, B तथा C के आंशिक दाब हैं।
माना t समय पर A के दाब में x atm की कमी होती है तो B तथा C प्रत्येक के दाब में x atm की वृद्धि होगी।

यहाँ Pi = t = 0 समय पर A का प्रारंभिक दाब
Pt = (Pi – x) + x + x
Pt = Pi + x
x = Pt – Pi
t समय पर, PA = Pi – x
= Pi – (Pt – Pi)
या PA = 2Pi – Pt
k = \(\frac { 2.303 }{ t }\)log\(\frac{[\mathrm{R}]_0}{[\mathrm{R}]}\)
[R]0 = Pi, [R] pt
अतः k = \(\frac { 2.303 }{ t }\)log\(\frac{p_i}{p_A}\)
k = \(\frac { 2.303 }{ t }\)log\(\frac{p_i}{\left(2 p_i-p_t\right)}\)
प्रश्न 7.
उस अभिक्रिया की कोटि क्या होगी जिसके 50% पूर्ण होने में 2 घण्टे तथा 75% पूर्ण होने में 4 घण्टे लगते हैं?
उत्तर:
इस अभिक्रिया के 50% पूर्ण होने में 2 घण्टे लग रहे हैं अर्थात् इस अभिक्रिया की अर्धायु 2 घण्टे है। इसमें 4 घण्टे (दो अर्धायु) के बाद 75% अभिक्रिया पूर्ण हो जाती है अर्थात् 25% अभिकारक बच जाता है, जिसका तात्पर्य यह है कि इस अभिक्रिया की अध्धायु प्रारम्भिक सान्द्रता पर निभर नर्ही करती। अतः यह एक प्रथम कोटि की अभिक्रिया है।
प्रश्न 8.
(a) किसी जटिल अभिक्रिया के धीमे पद् की अणुसंख्यता ही सम्पूर्ण अभिक्रिया की अणुसंख्यता होती है। समझाइए।
(b) उच्य कोटि की अभिक्रियाएँ सामान्यत: नहीं होती, क्यों?
उत्तर:
(a) जटिल अभिक्रियाओं की क्रियाविधि में सबसे धीमे पद को वेग निर्धारक पद माना जाता है। चूँक किसी अभिक्रिया के लिए अणुसंख्यता का मान सामान्यतया 3 से अधिक नहीं होता अतः धीमे पद में उपस्थित अणुओं से ही अभिक्रिया की अणुसंख्यता ज्ञात करते हैं, चाहे पूर्ण सन्तुलित समीकरण में अणुओ की संख्या अधिक हो।
(b) अभिक्रिया होते समय उन अणुओ के मध्य टक्कर होती है जो निश्चित दिशा में अभिविन्यासित होते हैं तथा जटिल अभिक्रियाओं में धीमे पद में जितने अणुओ की सान्द्रता में परिवर्तन होता है, वही अभिक्रिया की कोटि होती है। टककर में सामान्यतः तीन से अधिक अणु भाग नहीं लेते अतः उच्च कोटि की अभिक्रियाएँ सामान्यतः नहीं होती।
प्रश्न 9.
अभिक्रिया – 2N2O → 2N2 + O2 का प्रायोगिक वेग समीकरण निम्नलिखित है-वेग =k[N2O], इस अभिक्रिया की क्रियाविधि बताइए।
उत्तर:
वेग समीकरण में N2O की सान्द्रता की घात एक है अतः वेग निर्धारक पद (धीमा पद) में N2O का एक अणु उपस्थित होना चाहिए इसलिए इस अभिक्रिया की क्रियाविधि निम्नलिखित है-
N2O → N2 + O (धीमा पद)
N2O + O → N2 + O2 (तेज पद)
![]()
प्रश्न 10.
अभिक्रिया 2NO + Br2 → 2NOBr की क्रियाविधि निम्नलिखित है –
![]()
तो इस अभिक्रिया का वेग समीकरण लिखिए।
उत्तर:
अभिक्रिया की क्रियाविधि के आधार पर धीमे पद से अभिक्रिया के वेग को ज्ञात किया जाता है अतः
वेग = k[NOBr2][NO] ….(1)
चूँकि NOBr2 अभिकारक नहीं है बल्कि माध्यमिक यौगिक है तथा प्रथम पद उत्क्रमणीय है अतः
साम्य स्थिरांक Kc = \(\frac{\left[\mathrm{NOBr}_2\right]}{[\mathrm{NO}]\left[\mathrm{Br}_2\right]}\) …(2)
या [NOBr2] = Kc [NO][Br2]
यह मान समीकरण (i) में रखने पर
वेग = k Kc [NO][Br2][NO]
वेग = k1 [NO]2[Br2]
यहाँ k1 = k . Kc
अतः अभिक्रिया का वेग समीकरण निम्न प्रकार होगा-
वेग = k1 [NO]2[Br2]
बोर्ड परीक्षा के दूष्टिकोण से सम्भावित महत्त्वपर्ण प्रश्न:
प्रश्न 1.
(a) निम्नलिखित पदों को स्पष्ट कीजिए-
- अभिक्रिया की दर
- अभिक्रिया की सक्रियण ऊर्जा
(b) फॉस्फोन, PH3, का अपघटन निम्नलिखित समीकरण के अनुसार होता है-
4PH3(g) → P4(g) + 6H2(g)
यह पाया जाता है कि अभिक्रिया निम्नलिखित दर समीकरण के अनुसार होती है-
दर = k [PH3].
120°C पर PH3 की अर्ध-आयु 37.9 s है।
(i) PH3 के 3/4 भाग के अपघटित होने के लिए कितना समय लगेगा?
(ii) 1 मिनट के पश्चात् PH3 के मूल प्रतिदर्श का कौनसा प्रभाज शेष रह जाएगा?
अथवा
(a) निम्न पदों को स्पष्ट कीजिए-
- एक अभिक्रिया की कोटि
- एक अभिक्रिया की आण्विकता
(b) तापमान 300 K से बढ़कर 320 K हो जाने पर एक अभिक्रिया की दर चार गुनी हो जाती है। अभिक्रिया की सक्रियण ऊर्जा का परिकलन कीजिए, यह मानते हुए तापमान बदलने के साथ इसका मान परिवर्तित नहीं होता है। (R = 8.314 JK-1 mol-1)
उत्तर:
(a) (i) अभिक्रिया की दर-काई समय में कसी अभिकारक या उत्पाद की सान्द्रता में जितना परिंवर्तन होता है, उसे अभिक्रिया की दर कहते हैं।
(ii) अभिक्रिया की सक्रियण ऊर्जा-किसी अभिकारक को उत्पाद में परिवर्तित होने के लिए आवश्यक न्यूनतम ऊर्जा जो अभिकारक द्वारा ग्रहण करना आवश्यक है, उसे अभिक्रिया की सक्रियण ऊर्जा कहते हैं।
(b) (i) अभिक्रिया 4PH3(g) → P4(g)(g) + 6H2(g) की दर = k[PH3] दी गई है अतः यह एक प्रथम कोटि की अभिक्रिया है। इसके लिए
t1/2 = \(\frac { 0.693 }{ k }\)
k = 0.693/t1/2
t1/2 = 37.9 s
अतः k = \(\frac { 0.693 }{ 37.9 }\) = 0.01828
k = 1.82 × 10-2 s-1
समाकलित वेग समीकरण
k = \(\frac { 2.303 }{ t }\)log\(\frac{[\mathrm{R}]_0}{[\mathrm{R}]}\)
t समय पर PH3 का 3/4 भाग अपघटित हो रहा है।
अतः t = \(\frac { 2.303 }{ k }\)log\(\frac{[R]_0}{\frac{3}{4}[R]_0}\)
t = \(\frac{2.303}{1.82 \times 10^{-2}}\)log\(\frac { 4 }{ 3 }\)
t = 126.5 (log 4 – log 3)
t = 126.5 (0.6021 – 0.4771)
t = 126.5 × 0.125
t = 15.8 sec.
(ii) k = \(\frac { 2.303 }{ 37.9 }\)log\(\frac{[\mathrm{R}]_0}{[\mathrm{R}]}\)
t = 1 मिनट = 60 सेकण्ड
1.82 × 10-2 = \(\frac { 2.303 }{ 60 }\)log\(\frac{1}{[R]}\)
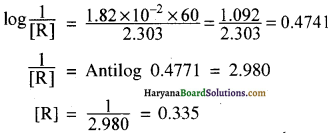
अतः 1 मिनट (60 sec) के बाद पदार्थ का बचा अंश = 0.335 अर्थात् 33.5%
अथवा
(a) (i) अभिक्रिया की कोटि:
रासायनिक अभिक्रिया के दौरान अभिकारकों की सान्द्रता में परिवर्तन होता है, अतः किसी अभिक्रिया के प्रायोगिक वेग समीकरण (वेग नियम व्यंजक) में अभिकारकों की सान्द्रता के घातांकों का योग उस अभिक्रिया की कोटि कहलाता है।
अथवा
किसी अभिक्रिया में अभिकारक अणुओं की संख्या, जिनकी सान्द्रता में परिवर्तन होता है, उसे अभिक्रिया की कोटि कहते हैं।
अभिक्रिया aA + bB → उत्पाद के लिए
वेग = k [A]x[B]y
अतः अभिक्रिया की कोटि (n) = x + y
इस अभिक्रिया में अभिकारक A के प्रति अभिक्रिया की कोटि x है एवं अभिकारक B के प्रति अभिक्रिया की कोटि y है। अभिक्रिया की कोटि शून्य, एक, दो, तीन अथवा भिन्नात्मक भी हो सकती है। किसी अभिक्रिया की कोटि शून्य होने का अर्थ है कि उस अभिक्रिया का वेग अभिकारकों की सान्द्रता के शून्य घात के समानुपाती होता है अर्थात् अभिक्रिया का वेग, अभिकारकों की सान्द्रता पर निर्भर नहीं करता।
किसी रासायनिक अभिक्रिया के संतुलित समीकरण द्वारा अभिक्रिया की पूर्ण जानकारी प्राप्त नहीं होती। कुछ अभिक्रियाएँ एक पद में तथा कुछ अभिक्रियाएँ एक से अधिक पदों में सम्पन्न होती हैं। लेकिन एक पद में होने वाली अभिक्रियाएँ बहुत कम होती हैं। वे अभिक्रियाएँ जो एक पद में होती हैं, उन्हें प्राथमिक अभिक्रियाएँ (Elementary reactions) तथा एक से अधिक पदों में होने वाली अभिक्रियाओं को जटिल अभिक्रियाएँ (Complex reactions) कहते हैं। इन अभिक्रियाओं में कुछ पद धीमे तथा कुछ पद तेज होते हैं, लेकिन धीमा पद अभिक्रिया का गति निर्धारक पद होता है जिससे अभिक्रिया का वेग लिखा जाता है।
जटिल अभिक्रियाएँ तीन प्रकार की होती हैं-
- क्रमागत अभिक्रियाएँ
- विपरीत अभिक्रियाएँ तथा
- पाश्र्व अभिक्रियाएँ।
एथेन का CO2 तथा H2O में ऑक्सीकरण क्रमागत अभिक्रिया तथा फीनॉल का नाइट्रीकरण पार्श्व अभिक्रिया का उदाहरण है।
(ii) अभिक्रिया की आण्विकता:
प्राथमिक अभिक्रिया में भाग लेने वाली स्पीशीज (परमाणु, अणु या आयन ) की संख्या जो कि एक साथ टक्कर करके रासायनिक अभिक्रिया सम्पन्न करती हैं, उसे अभिक्रिया की आण्विकता कहते हैं।
उदाहरण – NH4NO2 → N2 + 2H2O (एक अणुक अभिक्रिया)

तीन से अधिक अणुओं की उचित विन्यास के साथ एक साथ टक्कर होकर अभिक्रिया होने की सम्भावना बहुत ही कम होती है अतः अणुसंख्यता सामान्यतः तीन से अधिक नहीं होती है।
सरल अभिक्रियाओं की आण्विकता, संतुलित रासायनिक समीकरण में उपस्थित अभिकारक अणुओं की संख्या के बराबर होती है। उदाहरण-
H2 + I2 → 2HI (द्विअणुक अभिक्रिया)
जटिल अभिक्रियाएँ जिनमें तीन से अधिक अभिकारक अणु उपस्थित होते हैं, सामान्यतया एक से अधिक पदों में सम्पन्न होती हैं। जैसे-
KCIO3 + 6 FeSO4 + 3H2SO4 → KCI + 3Fe2 (SO4)3 + 3H2O
यह अभिक्रिया द्वितीय कोटि की है। इन जटिल अभिक्रियाओं की कोटि क्रियाविधि से ज्ञात होती है जिसमें धीमा पद गति निर्धारक पद होता है। अतः इनके लिए सम्पूर्ण अभिक्रिया की अणुसंख्यता का कोई महत्त्व नहीं होता है, केवल गति निर्धारक पद की अणुसंख्यता देखी जाती है।

प्रश्न 2.
अभिक्रिया कोटि को परिभाषित कीजिए।
उत्तर:
अभिक्रिया की कोटि:
रासायनिक अभिक्रिया के दौरान अभिकारकों की सान्द्रता में परिवर्तन होता है, अतः किसी अभिक्रिया के प्रायोगिक वेग समीकरण (वेग नियम व्यंजक) में अभिकारकों की सान्द्रता के घातांकों का योग उस अभिक्रिया की कोटि कहलाता है।
अथवा
किसी अभिक्रिया में अभिकारक अणुओं की संख्या, जिनकी सान्द्रता में परिवर्तन होता है, उसे अभिक्रिया की कोटि कहते हैं।
अभिक्रिया aA + bB → उत्पाद के लिए
वेग = k [A]x[B]y
अतः अभिक्रिया की कोटि (n) = x + y
इस अभिक्रिया में अभिकारक A के प्रति अभिक्रिया की कोटि x है एवं अभिकारक B के प्रति अभिक्रिया की कोटि y है। अभिक्रिया की कोटि शून्य, एक, दो, तीन अथवा भिन्नात्मक भी हो सकती है। किसी अभिक्रिया की कोटि शून्य होने का अर्थ है कि उस अभिक्रिया का वेग अभिकारकों की सान्द्रता के शून्य घात के समानुपाती होता है अर्थात् अभिक्रिया का वेग, अभिकारकों की सान्द्रता पर निर्भर नहीं करता।
किसी रासायनिक अभिक्रिया के संतुलित समीकरण द्वारा अभिक्रिया की पूर्ण जानकारी प्राप्त नहीं होती। कुछ अभिक्रियाएँ एक पद में तथा कुछ अभिक्रियाएँ एक से अधिक पदों में सम्पन्न होती हैं। लेकिन एक पद में होने वाली अभिक्रियाएँ बहुत कम होती हैं। वे अभिक्रियाएँ जो एक पद में होती हैं, उन्हें प्राथमिक अभिक्रियाएँ (Elementary reactions) तथा एक से अधिक पदों में होने वाली अभिक्रियाओं को जटिल अभिक्रियाएँ (Complex reactions) कहते हैं। इन अभिक्रियाओं में कुछ पद धीमे तथा कुछ पद तेज होते हैं, लेकिन धीमा पद अभिक्रिया का गति निर्धारक पद होता है जिससे अभिक्रिया का वेग लिखा जाता है।
जटिल अभिक्रियाएँ तीन प्रकार की होती हैं-
- क्रमागत अभिक्रियाएँ
- विपरीत अभिक्रियाएँ तथा
- पाश्र्व अभिक्रियाएँ।
एथेन का CO2 तथा H2O में ऑक्सीकरण क्रमागत अभिक्रिया तथा फीनॉल का नाइट्रीकरण पार्श्व अभिक्रिया का उदाहरण है।
प्रश्न 3.
आप एक अभिक्रिया के दर नियम (वेग व्यंजक) और दर स्थिरांक (वेंग स्थिरांक) से क्या समझते हैं? दर स्थिरांक के निम्नलिखित मात्रकों से अभिक्रिया की कोटि की पहचान कीजिए-
(i) L-1 mol s-1
(ii) L mol-1 s-1
उत्तर:
किसी अभिक्रिया के वेग को अभिकारकों की सांद्रता के पदों में व्यक्त करना ही वेग नियम कहलाता है। अतः वेग नियम वह व्यंजक होता है जिसमें किसी अभिक्रिया के वेग को अभिकारकों की मोलर सांद्रता के पद पर कोई घातांक लगाकर व्यक्त किया जाता है। यह किसी संतुलित रासायनिक समीकरण में अभिकर्मकों के स्टॉइकियोमीट्री गुणांक के समान या भिन्न होता है।
वेग नियम को वेग समीकरण या वेग व्यजंक भी कहते हैं।
उदाहरण : अभिक्रिया-
a A + bB → cC + dD के लिए
अभिक्रिया का वेग ∝[A]x [B]y
x तथा y, a व b के समान भी हो सकते हैं अथवा भिन्न भी हो सकते हैं तथा x व y का मान प्रयोग द्वारा ज्ञात किया जाता है, अतः इसे प्रायोगिक वेग समीकरण कहते हैं।
या वेग = k[A]x [B]y
\(\frac{-\mathrm{d}[\mathrm{R}]}{\mathrm{dt}}\) = k[A]x [B]y
इसे अवकल वेग समीकरण कहते हैं।
यहाँ k = समानुपाती स्थिरांक जिसे वेग स्थिरांक या वेग नियतांक भी कहते हैं। अतः वेग नियम अभिक्रिया के वेग तथा अभिकारकों की सान्द्रता में सम्बन्ध दर्शाता है।
(i) शून्य कोटि
(ii) द्वितीय कोटि।
![]()
प्रश्न 4.
दिए गए ताप पर 2.4 × 10-3 s-1 के दर स्थिरांक के साथ HCO2H का ऊष्मीय विघटन एक प्रथम कोटि की अभिक्रिया होता है। परिकलन कीजिए HCO2H की एक आरम्भिक मात्रा को इसके तीन-चौथाई तक विघटन में कितना समय लगेगा?
उत्तर:
k = \(\frac { 2.303 }{ t }\)log\(\frac{[\mathrm{R}]_0}{[\mathrm{R}]}\)
t = \(\frac { 2.303 }{ k }\)log\(\frac{[\mathrm{R}]_0}{[\mathrm{R}]}\)
t समय पर प्रारम्भिक मात्रा का तीन-चौथाई विघटन हो रहा है, अतः \(\frac { 1 }{ 4 }\) भाग बचेगा
t = \(\frac{2.303}{2.4 \times 10^{-3}}\)log\(\frac{[\mathrm{R}]_0}{\frac{1}{4}[\mathrm{R}]_0}\)
t = 0.9595 × 103 (log 4)
t = 0.9595 × 103 × 0.6021
t = 577.7 sec.
प्रश्न 5.
एक अभिक्रिया एक अभिकारक के सन्दर्भ में द्वितीय कोटि की है। यदि इस अभिकारक की सान्द्रता (i) दुगुनी कर दी जाए (ii) आधी कर दी जाए, तो दर (वेग) कैसे प्रभावित होती है?
उत्तर:
वेग = k [R]2
(i) अभिकारक की सान्द्रता दुगुनी करने पर,
वेग = k [2R]2
वेग = 4k [R]2
अतः दर पहले की तुलना में 4 गुना हो जाएगी।
(ii) अभिकारक की सान्द्रता आधी करने पर,
वेग = \(\mathrm{k}\left[\frac{\mathrm{R}}{2}\right]^2\)
वेग = \(\frac{\mathrm{k}}{4}[\mathrm{R}]^2\)
अतः दर पहले की एक-चौथाई रह जाएगी।
प्रश्न 6.
(अ) रासायनिक अभिक्रिया में 10°C ताप वृद्धि से वेग स्थिरांक में लगभग दुगुनी वृद्धि हो जाती है। नामांकित वितरण वक्र से समझाइए।
(ब) ताप 350 K से 400 K परिवर्तित करने पर प्रथम कोटि अभिक्रिया का वेग स्थिरांक चार गुना बढ़ जाता है। सक्रियण ऊर्जा की गणना यह मानकर कीजिए कि यह ताप के साथ परिवर्तित नहीं होती है।
(R=8.314 जूल केल्विन-1 मोल-1, log 4=0.6021)
अथवा
(अ) उत्प्रेरक की उपस्थिति में अभिक्रिया का वेग अधिक हो जाता है। इस कथन को अभिक्रिया निर्देशांक व ऊर्जा में वक्र बनाकर समझाइए।
(ब) एक अभिक्रिया के लिए क्रियाकारकों की प्रारम्भिक सान्द्रता 0.4 M तथा वेग स्थिरांक 2.5 × 10-4 मोल लीटर-1 से.-1 हैं। अभिक्रिया का अर्द्ध-आयुकाल ज्ञात कीजिए।
उत्तर:
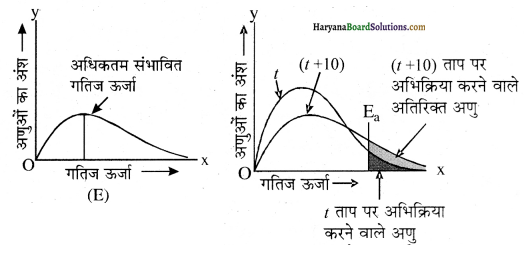
(अ) किसी पदार्थ का ताप बढ़ाने पर Ea से अधिक ऊर्जायुक्त संघट्ट करने वाले अणुओं की संख्या में वृद्धि होती है। चित्र से स्पष्ट है कि वक्र मेंt +10 तापमान पर सक्रियण ऊर्जा या इससे अधिक ऊर्जायुक्त अणुओं को दर्शाने वाला क्षेत्रफल लगभग दो गुना हो जाता है अतः अभिक्रिया वेग भी दो गुना हो जाता है।
आर्रेनिसस समीकरण में कारक \(\mathrm{e}^{-\mathrm{E}_a / \mathrm{RT}}, \mathrm{E}_{\mathrm{a}}\) से अधिक गतिज ऊर्जा वाले अणुओं की भिन्न के संगत होता है।
(ब) log\(\frac{k_2}{k_1}\) = \(\frac{\mathrm{E}_{\mathrm{a}}}{2.303 \mathrm{R}}\left[\frac{\mathrm{T}_2-\mathrm{T}_1}{\mathrm{~T}_1 \mathrm{~T}_2}\right]\)
प्रश्नानुसार,
\(\frac{\mathrm{k}_2}{\mathrm{k}_1}\) = 4, T1 = 350K, T2 = 400 K, R = 8.314 जूल केल्विन-1 मोल-1
मान रखने पर,
log 4 = \(\frac{\mathrm{E}_{\mathrm{a}}}{2.303 \times 8.314}\left[\frac{400-350}{350 \times 400}\right]\)
0.6021 = \(\frac{\mathrm{E}_{\mathrm{a}}}{19.1471}\left[\frac{50}{140000}\right]\)
Ea = \(\frac{0.6021 \times 19.1471 \times 140000}{50}\)
Ea = 32279.71 J mol-1
अथवा
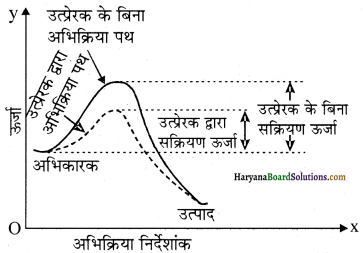
उत्तर:
(अ) उत्प्रेरक अभिक्रिया को वैकल्पिक पथ प्रदान करता है जिससे सक्रियण ऊर्जा कम हो जाती है अतः यह ऊर्जा अवरोध में कमी करके अभिक्रिया को सम्पन्न करता है जिससे अभिक्रिया का वेग बढ़ जाता है। इसे निम्नलिखित वक्र से समझाया जा सकता है-
(ब) यह शून्य कोटि अभिक्रिया है क्योंकि इसमें प्रारम्भिक सान्द्रता दी गई है। अतः इसके लिए

प्रश्न 7.
एथिल ऐसीटेट के जल अपघटन का उदाहरण लेकर छद्म प्रथम कोटि की अभिक्रिया को समझाइए।
उत्तर:
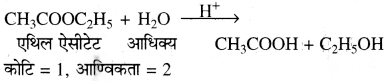
छद्म प्रथम कोटि की अभिक्रिया-वह अभिक्रिया जिसकी कोटि एक हो तथा आण्विकता एक से अधिक हो उसे छद्म प्रथम कोटि अभिक्रिया कहते हैं। इस प्रकार की अभिक्रिया में दो अभिकारकों में से एक अभिकारक आधिक्य में होता है जिसकी सान्द्रता में परिवर्तन बहुत कम होता है अतः इसको नगण्य मानते हैं।
उदाहरण: एस्टर का अम्लीय माध्यम में जल अपघटन
प्रश्न 8.
शून्य कोटि एवं प्रथम कोटि की अभिक्रियाओं के लिए वेग स्थिरांक की इकाइयाँ लिखिए।
उत्तर:
शून्य कोटि अभिक्रिया के लिए वेग स्थिरांक की इकाई = mol L-1S-1
प्रथम कोटि अभिक्रिया के लिए वेग स्थिरांक की इकाई =S-1
प्रश्न 9.
अभिक्रिया की अर्धायु किसे कहते हैं? प्रथम कोटि अभिक्रिया के वेग समीकरण से अर्धायु ज्ञात करने का सूत्र व्युत्पन्न कीजिए।
उत्तर:
अभिक्रिया की अर्धायु-किसी अभिक्रिया में जितने समय में अभिकारक की प्रारम्भिक सान्द्रता आधी रह जाती है, उसे अभिक्रिया की अर्धायु कहते हैं।
प्रथम कोटि अभिक्रिया का अवकल वेग समीकरण-
k = \(\frac { 2.303 }{ t }\)log\(\frac{[\mathrm{R}]_0}{[\mathrm{R}]}\)
[R]0 = प्रारम्भिक सान्द्रता, [R] = t समय पर सान्द्रता,
t = समय तथा k = वेग नियतांक
अर्धायु t1/2 पर, [R] = \(\frac{[\mathrm{R}]_0}{2}\)
ये मान उपर्युक्त समीकरण में रखने पर,
k = \(\frac{2.303}{\mathrm{t}^{\frac{1}{2}}} \log \frac{\frac{[\mathrm{R}]_0}{[\mathrm{R}]_0}}{2}\)
या t1/2 = \(\frac { 2.303 }{ k }\)log2
= \(\frac { 2.303 }{ k }\)log2
= \(\frac { 2.303 }{ k }\) × 0.3010
t1/2 = \(\frac { 0.693 }{ k }\)
प्रश्न 10.
(a) अभिक्रिया A + B → P के लिए वेग नियम v = \(\mathbf{k}[\mathbf{A}]^{\frac{1}{2}}[\mathrm{~B}]^2\) से दिया जाता है। इस अभिक्रिया की कोटि क्या होगी ?
(b) एक प्रथम कोटि अभिक्रिया का वेग नियतांक k = 5.5 × 10-14s-1 से दिया जाता है । इस अभिक्रिया की अर्धआयु कीजिए ।
उत्तर:
(a) अभिक्रिया की कोटि = \(\frac { 1 }{ 2 }\)+2 = 2\(\frac { 1 }{ 2 }\) या 2.5
(b) प्रथम कोटि अभिक्रिया के लिए-
अर्धआयु (t\(\frac { 1 }{ 2 }\)) = \(\frac { 0.693 }{ k }\)
t\(\frac { 1 }{ 2 }\) = \(\frac{0.693}{5.5 \times 10^{-14}}\)
t\(\frac { 1 }{ 2 }\) = 1.26 × 1013s
प्रश्न 11.
स्थिर आयतन पर SO2Cl2 के प्रथम कोटि के तापीय विघटन के दौरान निम्नलिखित आँकड़े प्राप्त हुए-
SO2Cl2(g) → SO2(g) + Cl2(g)
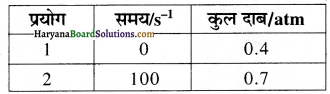
वेग नियतांक परिकलित कीजिए।
( दिया गया है – log 4 = 0.6021)
उत्तर:
अभिक्रिया SO2Cl2(g) → SO2(g) + Cl2(g)
अभिक्रिया Ag → B(g) + C(g) के समतुल्य है
अतः इसके लिए-
k = \(\frac { 2.303 }{ t }\)log\(\frac{P_i}{\left(2 P_i-P_t\right)}\)
यहाँ Pi = 0.4 atm, Pt = 0.7 atm तथा t = 100 s
k = \(\frac { 2.303 }{ 100 }\)log\(\frac{0.4}{(2 \times 0.4-0.7)}\)
= \(\frac { 2.303 }{ 100 }\)log\(\frac { 0.4 }{ 0.1 }\)
= \(\frac { 2.303 }{ 100 }\)log4
= \(\frac { 2.303 }{ 100 }\) × 0.6021
k = 0.01386 = 1.38 × 10-2 s-1
प्रश्न 12.
एक रासायनिक अभिक्रिया, R → P के लिए, समय (t) के प्रति सान्द्रता (R) में परिवर्तन को निम्नलिखित ग्राफ में दर्शाया गया है –
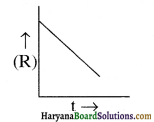
(i) इस अभिक्रिया की कोटि बताइए ।
(ii) ग्राफ की प्रवणता ( ढलान ) क्या होगी ?
उत्तर:
(i) यह एक शून्य कोटि अभिक्रिया है ।
(ii) इस ग्राफ का ढाल = – k = –\(-\left[\frac{[\mathrm{R}]_0-[\mathrm{R}]}{\mathrm{t}}\right]\)
यदि [R]0 = a तथा [R] = a – x तो k = \(-\frac{x}{t}\)
प्रश्न 13.
निम्नलिखित अभिक्रियाओं की कोटि बताइए-
(अ) कृत्रिम नाभिकीय क्षय
(ब) उच्च दाब पर गैसीय अमोनिया का तप्त Pt सतह पर वियोजन
(स) एथीन का हाइड्रोजनन
(द) N2O5 का अपघटन ।
उत्तर:
(अ) कृत्रिम नाभिकीय क्षय प्रथम कोटि अभिक्रिया होती है।
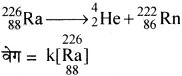
(ब) उच्च दाब पर गैसीय अमोनिया का तप्त Pt सतह पर वियोजन शून्य कोटि अभिक्रिया होती है।
![]()
वेग = k [NH3]
(स) एथीन का हाइड्रोजनन (हाइड्रोजनीकरण) एक प्रथम कोटि अभिक्रिया है।
C2H4(g) + H2(g) → C2H6(g)
वेग = K [C2H4]
(द) N2O5 का अपघटन एक प्रथम कोटि अभिक्रिया है।
2N2O5 → 4NO2 + O2
वेग = k[N2O5]
प्रश्न 14.
किसी अभिक्रिया की अर्धायु क्या है? प्रथम कोटि अभिक्रिया के लिए वेग समीकरण से यह पुष्टि कीजिए कि इस अभिक्रिया की अर्धायु अभिक्रियकों की प्रारम्भिक सान्द्रताओं पर निर्भर नहीं होती।
उत्तर:
किसी अभिक्रिया में अभिकारक की प्रारम्भिक सान्द्रता का आधा जितने समय में उत्पाद में बदल जाता है उसे अभिक्रिया की अर्धायु कहते हैं।
प्रथम कोटि की अभिक्रिया के लिए वेग समीकरण
k = \(\frac { 2.303 }{ t }\)log\(\frac{[\mathrm{R}]_0}{[\mathrm{R}]}\);
\(\mathrm{t}_{\frac{1}{2}}\) पर [R] = \(\frac{[\mathrm{R}]_0}{2}\)
R का यह मान रखने पर,
k = \(\frac{2.303}{\mathrm{t}_{\frac{1}{2}}} \frac{[\mathrm{R}]_0}{\frac{[\mathrm{R}]_0}{2}}\)
या \(\mathrm{t}_{\frac{1}{2}}\) = \(\frac { 2.303 }{ t }\)log 2
= \(\frac { 2.303 }{ t }\) × 0.3010 (log 2 = 0.3010)
या \(\mathrm{t}_{\frac{1}{2}}\) = \(\frac { 0.693 }{ k }\)
अतः किसी प्रथम कोटि की अभिक्रिया के लिए अर्धायु निश्चित होती है, अर्थात् यह अभिकारक की प्रारम्भिक सान्द्रता पर निर्भर नहीं होती।
![]()
प्रश्न 15.
किसी अभिक्रिया के लिए वेग स्थिरांक की इकाई सेकण्ड-1 है। अभिक्रिया की कोटि क्या होगी ?
उत्तर:
यह एक प्रथम कोटि अभिक्रिया है।
प्रश्न 16.
अभिक्रिया 2A + B → उत्पाद हेतु अवकलन वेग समीकरण लिखिए।
उत्तर:
अभिक्रिया 2A + B → उत्पाद के लिए अवकलन वेग समीकरण निम्न प्रकार होगा-
\(-\frac{\mathrm{d}[\mathrm{R}]}{\mathrm{dt}}\) = K[A]2[B]
प्रश्न 17.
प्रथम कोटि अभिक्रिया की अर्धायु काल 10 sec
उत्तर:
प्रथम कोटि अभिक्रिया की अर्धायु काल
\(\mathrm{t}_{\frac{1}{2}}\) = \(\frac { 0.693 }{ k }\) यहाँ k = वेग स्थिरांक
\(\mathrm{t}_{\frac{1}{2}}\) = 10 sec.
अतः वेग स्थिरांक k = \(\frac{0.693}{t_{1 / 2}}\)
k = \(\frac { 0.693 }{ 10 sec. }\) = 0.0693 sec-1
प्रश्न 18.
जलीय विलयन में मेथिल ऐसीटेट के जल- अपघटन से निम्नलिखित परिणाम प्राप्त हुए-

(i) जल की सान्द्रता स्थिर रखते हुए प्रदर्शित कीजिए कि यह छद्म (स्यूडो) प्रथम कोटि की अभिक्रिया है।
(ii) समयांतराल 30 से 60 सेकण्ड के बीच अभिक्रिया की औसत दर का परिकलन कीजिए।
अथवा
(a) एक अभिक्रिया A + B → P के लिए दर दिया गया है। दर = k [A]2 [B]
- यदि A की सान्द्रता दुगुनी कर दी जाए, तो अभिक्रिया की दर कैसे प्रभावित होती है ?
- यदि B बड़ी मात्रा में उपस्थित हो, तो अभिक्रिया की सम्पूर्ण कोटि क्या है?
(b) एक अभिक्रिया 50% पूर्ण होने में 23.1 मिनट लेती है और अभिक्रिया प्रथम कोटि की है। इस अभिक्रिया को 75% पूर्ण होने में कितना समय लगेगा, उसका परिकलन कीजिए। ( दिया गया है – log 2 = 0.301, log 3 = 0.4771, log 4 = 0.6021)
उत्तर:
(i) जल की सान्द्रता स्थिर है अतः यह छद्म प्रथम कोटि की अभिक्रिया है। प्रथम कोटि अभिक्रिया के लिए वेग स्थिरांक है-
k = \(\frac { 2.303 }{ t }\)log\(\frac{[\mathrm{R}]_0}{[\mathrm{R}]}\)
उपर्युक्त आँकड़ों से सूत्र द्वारा k का मान 30 S तथा 60 S पर ज्ञात करते हैं तो समान आता है जो कि 2.310 × 10-2 s-1 है। इससे यह प्रदर्शित होता है कि यह एक छद्म प्रथम कोटि अभिक्रिया है।
(ii) अभिक्रिया की औसत दर (rav) = \(-\frac{\Delta[\mathrm{R}]}{\Delta \mathrm{t}}\)=\(\frac{\mathrm{C}_2-\mathrm{C}_1}{\Delta \mathrm{t}}\)
= \(-\frac{0.15-0.30}{60-30}\) = \(-\frac{(-0.15)}{30}\)
= 0.005
= 5 × 10-3 mol L-1
अथवा
(a) अभिक्रिया की दर = k [A]2 [B]
(i) जब A की सान्द्रता दुगुनी की जाती है तो उपरोक्त समीकरण के अनुसार
दर = k [24]2 [B]
दर = 4k [A]2 [B]
अतः अभिक्रिया की दर 4 गुना हो जाती है।
(ii) जब B बड़ी मात्रा में उपस्थित हो तो अभिक्रिया की दर इस पर निर्भर नहीं करेगी इसलिए अभिक्रिया की सम्पूर्ण कोटि 2 + 0 = 2 होगी।
(b) प्रथम कोटि अभिक्रिया के 50% पूर्ण होने में लगा समय अर्थात्
अर्धायु
\(\mathrm{t}_{\frac{1}{2}}\) = \(\frac { 0.693 }{ k }\)
या k = \(\frac{0.693}{t_{\frac{1}{2}}}\) \(\frac{0.693}{23.1 \mathrm{~min}}\)
= 0.03 = 3 × 10-2 min-1
अतः अभिक्रिया के 75% पूर्ण {[R] = 0.25} होने में लगा समय-
k = \(\frac { 2.303 }{ t }\)log\(\frac{\left[\mathrm{R}_0\right]}{[\mathrm{R}]}\)
t = \(\frac{2.303}{3 \times 10^{-2}}\)log\(\frac{1}{0.25}\) = \(\frac{2.303}{0.03}\)log 4
t = \(\frac { 2.303 }{ 0.03 }\)(0.6021) = 46.2 मिनट