Haryana State Board HBSE 12th Class Chemistry Important Questions Chapter 3 वैद्युत रसायन Important Questions and Answers.
Haryana Board 12th Class Chemistry Important Questions Chapter 3 वैद्युत रसायन
बहुविकल्पीय प्रश्न :
1. गैल्वेनिक सेल के लिए कौनसा कथन सत्य नहीं है?
(अ) ऐनोड ऋणावेशित होता है।
(ब) कैथोड धनावेशित होता है।
(स) ऐनोड पर अपचयन होता है।
(द) कैथोड पर अपचयन होता है।
उत्तर:
(स) ऐनोड पर अपचयन होता है।
2. इलेक्ट्रॉड अभिक्रिया, \(\mathbf{M}_{(\mathrm{aq})}^{\mathrm{n}+}+\mathrm{ne}^{-} \rightarrow \mathbf{M}_{(\mathrm{s})}\) के लिये नेन्ंस्ट अभिक्रिया है-
(अ) E = E° + \(\frac { RT }{ nF }\) ln \(\frac{1}{\left[\mathrm{M}^{\mathrm{n}+}\right]}\)
(ब) E = E° + \(\frac { RT }{ nF }\) ln \(\left[\mathrm{M}^{\mathrm{n}+}\right]\)
(स) E = E° + RT ln \(\left[\mathrm{M}^{\mathrm{n}+}\right]\)
(द) \(\frac{E}{E^{\circ}}\) = \(\frac { RT }{ nF }\) ln \(\left[\mathrm{M}^{\mathrm{n}+}\right]\)
उत्तर:
(ब) E = E° + \(\frac { RT }{ nF }\) ln \(\left[\mathrm{M}^{\mathrm{n}+}\right]\)
3. विशिष्ट चालकत्व की इकाई है-
(अ) S cm2 mol-1
(ब) Scm2
(स) S m-1
(द) cm-1
उत्तर:
(स) S m-1
4. लैड संचायक सेल को आवेशित करने पर-
(अ) PbO2 घुलता है।
(ब) लैड इलेक्ट्रोड पर PbSO4 जमता है।
(स) H2SO4 पुनः बनता है
(द) H2SO4 की मात्रा कम होती है।
उत्तर:
(स) H2SO4 पुनः बनता है
5. चार पृथक् पृथक् परखनलियों में भिन्न-भिन्न लवणों के रंगहीन विलयन उपस्थित हैं। इनमें कॉपर की छड़ डुबोने पर कौनसे विलयन का रंग नीला हो जाएगा-
(अ) Pb(NO3)2
(ब) AgNO3
(स) Zn(NO3)2
(द) Cd (NO3)2
उत्तर:
(ब) AgNO3
6. \(\mathrm{Zn}_{(\mathrm{s})}\left|\mathrm{Zn}_{(\mathrm{aq})}^{+2} \| \mathrm{Cu}_{(\mathrm{aq})}^{2+}\right| \mathrm{Cu}\) में दो खड़ी समानान्तर रेखाएँ (||) किसको दर्शाती हैं?
(अ) कैथोड
(ब) ऐनोड
(स) लवण सेतु
(द) विद्युत अपघट्य
उत्तर:
(स) लवण सेतु
![]()
7. कॉपर को अम्लीय CuSO4 तथा क्षारीय Cu(CN)2 से निक्षेपित किया जा सकता है। यदि समान विद्युत धारा समान समय के लिए इनके विलयन में प्रवाहित की जाए तो निम्नलिखित में से कौनसा कथन सत्य है?
(अ) क्षारीय कॉपर सायनाइड (Cu(CN)2) से निक्षेपित कॉपर की मात्रा अम्लीय CuSO4 की तुलना में दुगुनी होगी।
(ब) क्षारीय कॉपर सायनाइड से निक्षेपित कॉपर की मात्रा अम्लीय CuSO4 की तुलना में आधी होगी।
(स) दोनों विलयनों से कॉपर की समान मात्रा निक्षेपित होगी।
(द) उपरोक्त सभी कथन गलत हैं।
उत्तर:
(स) दोनों विलयनों से कॉपर की समान मात्रा निक्षेपित होगी।
8. निम्नलिखित में से किसके जलीय विलयन में विद्युत धारा प्रवाहित करने पर उसका विघटन होगा?
(अ) ग्लूकोस
(ब) यूरिया
(स) शर्करा
(द) सिल्वर नाइट्रेट
उत्तर:
(द) सिल्वर नाइट्रेट
9. गलित NaCl के वैद्युत अपघटन से प्राप्त उत्पाद हैं-
(अ) NaOH, H2 तथा Cl2
(ब) Na तथा Cl2
(स) Na, NaOH तथा Cl2
(द) उपरोक्त सभी
उत्तर:
(ब) Na तथा Cl2
10. Zn2+ | Zn (E° = – 0.76 V) तथा Cu2+ | Cu(E° = +0.34) से बने एक गैल्वेनिक सेल का EMF है-
(अ) 0.42 V
(ब) 1.10 V
(स) – 0.10 V
(द) – 0.42 V
उत्तर:
(ब) 1.10 V
11. मानक हाइड्रोजन इलेक्ट्रॉड का इलेक्ट्रॉड विभव होता है-
(अ) 1.0 V
(ब) 0.0 v
(स) 1.10 V
(द) 0.20 V
उत्तर:
(ब) 0.0 v
12. धात्विक चालक में आवेश के वाहक होते हैं-
(अ) इलेक्ट्रॉन
(ब) आयन
(स) प्रोटोन
(द) लवण
उत्तर:
(अ) इलेक्ट्रॉन
13. Cu2+ आयन पर आवेश (कूलाम में ) है-
(अ) 96500
(ब) 57900
(स) 1.6 × 10-19
(द) 3.2 × 10-19
उत्तर:
(द) 3.2 × 10-19
14. लोहे पर जंग लगने से रोकने का सर्वोत्तम उपाय है-
(अ) लवणयुक्त जल में रखकर
(ब) कैथोडिक रक्षण
(स) टिन की परत चढ़ाकर
(द) साधारण जल में रखकर
उत्तर:
(ब) कैथोडिक रक्षण
15. \(\mathrm{MnO}_4^{-}\) के 1 मोल का MnO2 में अपचयन करने के लिए आवश्यक आवेश है-
(अ) 1F
(ब) 3F
(स) 5F
(द) 7F
उत्तर:
(ब) 3F
16. Na2SO4 के तनु जलीय विलयन का वैद्युत अपघटन करने पर ऐनोड तथा कैथोड पर प्राप्त उत्पाद क्या होंगे? यदि Pt इलेक्ट्रॉड प्रयुक्त किया गया है-
(अ) O2, Na
(ब) H2. NaOH
(स) O2. H2
(द) \(\mathrm{S}_2 \mathrm{O}_8^{-2}, \mathrm{H}_2\)
उत्तर:
(स) O2. H2
17. निम्नलिखित में से किस अवस्था में विलयन की मोलर चालकता बढ़ती है?
(अ) सान्द्रता बढ़ाने पर
(ब) ताप कम करने पर
(स) तनुता बढ़ाने पर
(द) उपरोक्त में से कोई नहीं।
उत्तर:
(स) तनुता बढ़ाने पर
18. डेनियल सेल में प्रयुक्त उपापचयी अभिक्रिया है-
(अ) \(\mathrm{Zn}_{(\mathrm{s})}+\mathrm{Cu}_{(\mathrm{s})} \rightarrow \mathrm{Zn}_{(\mathrm{aq})}^{2+}+\mathrm{Cu}_{(\mathrm{aq})}^{2+}\)
(ब) \(\mathrm{Zn}_{(\mathrm{s})} \rightarrow \mathrm{Zn}_{(\mathrm{aq})}^{2+}+2 \mathrm{e}^{-}\)
(स) \(\mathrm{Zn}_{(\mathrm{s})}+\mathrm{Cu}_{(\mathrm{aq})}^{2+} \rightarrow \mathrm{Zn}_{(\mathrm{aq})}^{2+}+\mathrm{Cu}_{(\mathrm{s})}\)
(द) \(\mathrm{Cu}_{(\mathrm{s})}+\mathrm{Zn}_{(\mathrm{aq})}^{2+} \rightarrow \mathrm{Cu}_{(\mathrm{aq})}^{2+}+\mathrm{Zn}_{(\mathrm{s})}\)
उत्तर:
(स) \(\mathrm{Zn}_{(\mathrm{s})}+\mathrm{Cu}_{(\mathrm{aq})}^{2+} \rightarrow \mathrm{Zn}_{(\mathrm{aq})}^{2+}+\mathrm{Cu}_{(\mathrm{s})}\)
19. प्रतिरोध का व्युत्क्रम होता है-
(अ) प्रतिरोधकता
(ब) चालकत्व
(स) सेल नियतांक
(द) चालकता
उत्तर:
(ब) चालकत्व
20. निम्नलिखित में से किसकी चालकता सर्वाधिक होती है?
(अ) सोडियम
(ब) सिल्वर
(स) गोल्ड
(द) कॉपर
उत्तर:
(ब) सिल्वर
21. इलेक्ट्रॉनिक चालकत्व निम्नलिखित में से किस पर निर्भर करता है-
(अ) धातु की प्रकृति एवं संरचना
(ब) ताप
(स) प्रति परमाणु संयोजी इलेक्ट्रॉनों की संख्या
(द) उपरोक्त सभी
उत्तर:
(द) उपरोक्त सभी
22. किसी विलयन की चालकता का सूत्र है-
(अ) k = \(\frac { G }{ R }\)
(ब) k = \(\frac { l }{ A }\)
![]()
(द) उपरोक्त में से कोई नहीं
उत्तर:
![]()
23. लैड संचायक सेल में ऐनोड पर होने वाली अभिक्रिया है-
(अ) PbO2(s) → PbSO4(s)
(ब) PbSO4(s) → PbO2(s)
(स) \(\mathrm{Pb}_{(\mathrm{s})}+\mathrm{SO}_{4(\mathrm{aq})}^{2-} \rightarrow \mathrm{PbSO}_{4(\mathrm{~s})}+2 \mathrm{e}^{-}\)
(द) Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(aq) + 2H2O(l)
उत्तर:
(स) \(\mathrm{Pb}_{(\mathrm{s})}+\mathrm{SO}_{4(\mathrm{aq})}^{2-} \rightarrow \mathrm{PbSO}_{4(\mathrm{~s})}+2 \mathrm{e}^{-}\)
![]()
24. H2 व O2 से बने ईंधन सेल में कैथोड पर होने वाली अभिक्रिया है-
(अ) \(2 \mathrm{H}_{2(\mathrm{~g})}+4 \mathrm{OH}_{(\mathrm{aq})}^{-} \rightarrow 4 \mathrm{H}_2 \mathrm{O}_{(l)}+4 \mathrm{e}^{-}\)
(ब) \(2 \mathrm{H}_{2(\mathrm{~g})}+\mathrm{O}_{2(\mathrm{~g})} \rightarrow 2 \mathrm{H}_2 \mathrm{O}_{(l)}\)
(स) \(\mathrm{O}_{2(\mathrm{~g})}+2 \mathrm{H}_2 \mathrm{O}_{(l)}+4 \mathrm{e}^{-} \rightarrow 4 \mathrm{OH}_{(\mathrm{aq})}^{-}\)
(द) \(4 \mathrm{OH}_{(\mathrm{aq})}^{-} \rightarrow \mathrm{O}_{2(\mathrm{~g})}+2 \mathrm{H}_2 \mathrm{O}_{(l)}+4 \mathrm{e}^{-}\)
उत्तर:
(स) \(\mathrm{O}_{2(\mathrm{~g})}+2 \mathrm{H}_2 \mathrm{O}_{(l)}+4 \mathrm{e}^{-} \rightarrow 4 \mathrm{OH}_{(\mathrm{aq})}^{-}\)
25. सेल स्थिरांक किस पदार्थ के जलीय विलयन की चालकता मापकर ज्ञात करते हैं?
(अ) NaCl
(ब) CaCl2
(स) KCl
(द) MgCl2
उत्तर:
(स) KCl
26. किसी सेल अभिक्रिया की साम्यावस्था पर सेल का विद्युत वाहक बल (EMF) होता है-
(अ) धनात्मक
(ब) शून्य
(स) ऋणात्मक
(द) उपर्युक्त में से कोई नहीं
उत्तर:
(ब) शून्य
27. किसी स्वतः प्रवर्तित अभिक्रिया के लिए साम्य स्थिरांक E°सेल तथा △G क्रमशः होंगे-
(अ) <1, +ve, -ve
(ब) >1, +ve, -ve
(स) = 1, +ve, +ve
(द) = 1, – ve, -ve
उत्तर:
(ब) >1, +ve, -ve
28. लवण सेतु में KNO का संतृप्त विलयन प्रयुक्त किया जाता है क्योंकि-
(अ) KNO3 की जल में विलेयता उच्च है।
(ब) K+ तथा \(\mathrm{NO}_3^{-}\) की गति लगभग समान होती है।
(स) K+ की गति \(\mathrm{NO}_3^{-}\) से अधिक होती है।
(द) K+ की गति \(\mathrm{NO}_3^{-}\) से कम होती है।
उत्तर:
(ब) K+ तथा \(\mathrm{NO}_3^{-}\) की गति लगभग समान होती है।
29. यदि सेल अभिक्रिया स्वतः परिवर्तित है, तो-
(अ) E° = -ve
(ब) E° = + ve
(स) emf = + ve
(द) (△G + E°) = + ve
उत्तर:
(स) emf = + ve
30. Zn – Cu सेल के लिए E° = 1.10 V है। यदि \(\mathrm{Cu}^{2+}{ }_{(\mathrm{aq})} / \mathrm{Cu}_{(\mathrm{s})}\) युग्म का अपचयन विभव 0.34 V हो तो \(\mathrm{Zn}^{2+}(\mathrm{aq}) / \mathrm{nn}_{(\mathrm{s})}\) युग्म का अपचयन विभाग होगा-
(अ) – 0.76 V
(ब) 0.76 V
(स) 7.6 V
(द) 0.38 V
उत्तर:
(अ) – 0.76 V
31. 25°C पर, Zn + Cu2+ → Cu + Zn2+ का मानक विद्युत वाहक बल 1.10 है तो इस सेल में 0.1 M Cu2+ तथा 0.1 M Zn2+ विलयन का प्रयोग करने पर सेल के विद्युत वाहक बल का मान क्या होगा?
(अ) 1.10 V
(ब) + 0.110 V
(स) – 1.10 V
(द) – 0.11 V
उत्तर:
(अ) 1.10 V
32. तीन धात्विक धनायनों X, Y, Z के मानक अपचयन विभव मान क्रमश: 0.52 – 3.03 तथा – 1.18 V है | संगत धातुओं की अपचायक क्षमता का क्रम है-
(अ) Y > Z > X
(ब) X > Y > Z
(स) Z> Y> X
(द) Z > x > Y
उत्तर:
(अ) Y > Z > X
33. अभिक्रिया IMG गैलवेनिक सेल में होती है। इसका सही निरूपण है-
(अ) Ag/AgCl(s)/KCl(aq)//AgNO3(aq)/Ag
(ब) Pt, H2(g)/HCl(aq)//AgNO3(qa)/Ag
(स) Pt, H2(g)/HCl(aq)//AgCl(aq)/ Ag(s)
(द) Pt, H2(g)/KCl(aq)//AgCl(s)/Ag
उत्तर:
(स) Pt, H2(g)/HCl(aq)//AgCl(aq)/ Ag(s)
अतिलघूत्तरात्मक प्रश्न:
प्रश्न 1.
जब CuSO4 के जलीय विलयन में जिंक धातु की छड़ को डुबोते हैं तो विलयन का नीला रंग गायब हो जाता है, क्यों?
उत्तर:
Zn+2 का मानक अपचयन विभव, Cu+2 के मानक अपचयन विभव से कम होने के कारण Zn Cu+2 को इलेक्ट्रॉन देकर उसे अपचयित कर देता है। अतः विलयन का नीला रंग गायब हो जाता है क्योंकि विलयन का नीला रंग Cu+2 आयनों के कारण होता है।
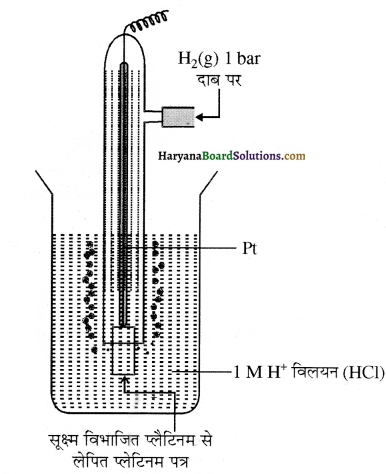
प्रश्न 2. मानक हाइड्रोजन इलेक्ट्रॉड (SHE) में प्लैटिनम का कार्य बताइए।
उत्तर:
SHE में प्लैटिनम, उत्प्रेरक तथा धात्विक सम्पर्क हेतु अक्रिय धातु का कार्य करता है।
प्रश्न 3.
साम्यावस्था स्थिरांक Kc. E°(सेल) से सम्बन्धित होता है, न कि Eसेल से क्यों?
उत्तर:
Kc का सम्बन्ध E°(सेल) से होता है क्योंकि साम्य पर Eसेल का मान शून्य होता है।
प्रश्न 4.
निम्नलिखित अभिक्रिया होगी या नहीं-
ZnSO4(aq) + 2Ag(s) → Ag2SO4(aq) + Zn(s)
उत्तर:
यह अभिक्रिया नहीं होगी क्योंकि Ag की ऑक्सीकृत होने की प्रवृत्ति Zn की ऑक्सीकृत होने की प्रवृत्ति से कम होती है।
प्रश्न 5.
Zn+2 की सान्द्रता बढ़ाने पर Zn इलेक्ट्रॉड के इलेक्ट्रॉड विभव के मान पर क्या प्रभाव होगा?
उत्तर:
Zn+2 की सान्द्रता बढ़ाने पर Zn इलेक्ट्रॉड का इलेक्ट्रॉड विभव बढ़ता है।
प्रश्न 6.
विलयन की pH तथा हाइड्रोजन इलेक्ट्रॉड विभव में सम्बन्ध बताइए।
उत्तर:
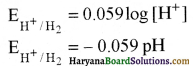
प्रश्न 7.
कॉपर सल्फेट (CuSO4) के जलीय विलयन को आयरन के पात्र में रखा जा सकता है या नहीं?
उत्तर:
CuSO4 के जलीय विलयन को आयरन के पात्र में नहीं रख सकते क्योंकि इसकी क्रियाशीलता Cu से अधिक है।
![]() अतः Fe, Cu+2 को Cu में अपचयित कर देता है जिसमें निम्नलिखित अभिक्रिया होती है-
अतः Fe, Cu+2 को Cu में अपचयित कर देता है जिसमें निम्नलिखित अभिक्रिया होती है-
\(\mathrm{Cu}_{(\mathrm{aq})}^{2+}+\mathrm{Fe}_{(\mathrm{s})} \rightarrow \mathrm{Fe}_{(\mathrm{aq})}^{+2}+\mathrm{Cu}_{(\mathrm{s})}\)
प्रश्न 8.
तनु H2SO4 से H2 को विस्थापित नहीं करने वाली धातुएँ बताइए।
उत्तर:
Cu, Ag. Au, Pt
प्रश्न 9.
Na, Al तथा Zn की क्रियाशीलता का अवरोही क्रम लिखिए।
उत्तर:
Na > Al > Zn
प्रश्न 10.
गैल्वेनी सेल में लवण सेतु में प्रयुक्त एक लवण का नाम बताइए।
उत्तर:
पोटेशियम क्लोराइड (KCl)
![]()
प्रश्न 11.
निम्नलिखित सेल अभिक्रिया का सेल आरेख लिखिए-
\(2 \mathrm{Fe}_{(\mathrm{s})}+3 \mathrm{Cd}_{(\mathrm{aq})}^{2+} \rightarrow 2 \mathrm{Fe}_{(\mathrm{aq})}^{+3}+3 \mathrm{Cd}_{(\mathrm{s})}\)
उत्तर:
उपर्युक्त सेल अभिक्रिया का सेल आरेख निम्न प्रकार होगा- एनोड-
एनोड \({ }^{-} \mathrm{Fe}_{(\mathrm{s})}\left|\mathrm{Fe}_{(\mathrm{aq})}^{+3} \| \mathrm{Cd}_{(\mathrm{aq})}^{2+}\right| \mathrm{Cd}_{(\mathrm{s})}{ }^{+}\) कैथोड
प्रश्न 12.
डेनियल सेल में धारा तथा इलेक्ट्रॉनों के प्रवाह की दिशा बताइए |
उत्तर:
डेनियल सेल में धारा का प्रवाह Cu से Zn इलेक्ट्रॉड की तरफ तथा इलेक्ट्रॉनों का प्रवाह Zn से Cu इलेक्ट्रॉड की तरफ होता है अर्थात् धारा तथा इलेक्ट्रॉनों का प्रभाव एक-दूसरे से विपरीत दिशा में होता है।
प्रश्न 13.
E°सेल का ऋणात्मक मान क्या दर्शाता है?
उत्तर:
E°सेल के ऋणात्मक होने का अर्थ है, △G = +ve तथा इस स्थिति में सेल में कार्य नहीं होगा।
प्रश्न 14.
सेल अभिक्रिया \(\mathrm{Cu}_{(\mathrm{s})}+2 \mathrm{Ag}_{(\mathrm{aq})}^{+} \rightarrow \mathrm{Cu}_{(\mathrm{aq})}^{2+}+2 \mathrm{Ag}_{(\mathrm{s})}\) के लिए EMF का मान बताइए जब \(\mathrm{E}_{\mathrm{Cu}^{+2 / \mathrm{Cu}}}^{\mathrm{o}}=0.34 \mathrm{~V}\) तथा \(\mathrm{E}_{\mathrm{Ag}^{+} / \mathrm{Ag}}^{\mathrm{o}}=0.80 \mathrm{~V}\)
उत्तर:
E°सेल = ER – EL
= 0.80 – (0.34)
E°सेल = 0.46 V
प्रश्न 15.
प्लैटिनम इलेक्ट्रॉड प्रयुक्त करके CuSO4 के विलयन का विद्युत अपघटन करने पर प्राप्त उत्पाद बताइए ।
उत्तर:
CuSO4 के विलयन का विद्युत अपघटन करने पर कैथोड पर कॉपर तथा एनोड पर ऑक्सीजन प्राप्त होती है।
प्रश्न 16.
Al3+ से एक मोल AI प्राप्त करने के लिए कितने कूलॉम आवेश चाहिए?
उत्तर:
Al3+ + 3e– →Al
अभिक्रिया के अनुसार 1 मोल Al प्राप्त करने के लिए 3F= 3 × 96500 = 289500 कूलॉम आवेश आवश्यक होगा।
प्रश्न 17.
NaCl के जलीय विलयन में विद्युत प्रवाहित करने पर विलयन की pH में क्या परिवर्तन होगा?
उत्तर:
NaCl के जलीय विलयन में विद्युत प्रवाहित करने पर विलयन की pH बढ़ जाती है (pH > 7) क्योंकि इसमें प्रबल क्षार (NaOH) बनता है।
प्रश्न 18.
विशिष्ट चालकत्व (K) तथा सेल स्थिरांक में सम्बन्ध बताइए |
उत्तर:
K = \(\frac { 1 }{ R }\) × \(\frac { 1 }{ A }\) (\(\frac { 1 }{ A }\) = सेल स्थिरांक)
प्रश्न 19.
मोलर चालकता ज्ञात करने का सूत्र लिखिए।
उत्तर:
मोलर चालकता, \(\Lambda_{\mathrm{m}}=\frac{K \times 1000}{\mathrm{M}}\) (M = मोलरता)
प्रश्न 20.
मोलर चालकता तथा तुल्यांकी चालकता में क्या सम्बन्ध होता है?
उत्तर:
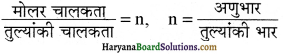
प्रश्न 21.
अधिविभव किसे कहते हैं?
उत्तर:
कुछ वैद्युत रासायनिक प्रक्रम सम्भव होते हैं लेकिन उनकी गति इतनी कम होती है कि वे निम्न विभव पर आसानी से नहीं होते। इस स्थिति में प्रक्रम को करवाने के लिए अतिरिक्त विभव लगाना पड़ता है, उसे अधिविभव कहते हैं।
प्रश्न 22.
गलित PhBr2 का विद्युत अपघटन करने पर प्राप्त उत्पाद क्या होंगे? यदि अक्रिय इलेक्ट्रॉड लिया गया है।
उत्तर:
गलित PhBr2 का विद्युत अपघटन करने पर कैथोड पर Pb तथा एनोड पर Br2 प्राप्त होती है।
प्रश्न 23.
डिबाई हकल-आंनसेगर समीकरण क्या होता है?
उत्तर:
\(\Lambda_m=\Lambda_m^{\circ}-A \sqrt{C}\)
\(\Lambda_{\mathrm{m}}\) मोलर चालकता, \(\Lambda_{\mathrm{m}}^{\circ}\) = सीमान्त मोलर चालकता, A = स्थिरांक तथा C = सान्द्रता
प्रश्न 24.
विद्युत रासायनिक तुल्यांक (Z) किसे कहते हैं?
उत्तर:
किसी विद्युत अपघट्य के विलयन में एक ऐम्पियर की धारा एक सेकण्ड (एक कूलॉम आवेश ) तक प्रवाहित करने पर इलेक्ट्रॉड पर निक्षेपित पदार्थ की मात्रा को उसका विद्युत रासायनिक तुल्यांक कहते हैं।
प्रश्न 25.
वैद्युत अपघटन से Na, Mg तथा Al कैसे प्राप्त की जाती है?
उत्तर:
सोडियम तथा मैग्नीशियम को उनके गलित क्लोराइडों के वैद्युत अपघटन द्वारा तथा ऐलुमिनियम को क्रायोलाइट (Na3AlF6) की उपस्थिति में ऐलुमिनियम ऑक्साइड के वैद्युत अपघटन से प्राप्त करते हैं।
प्रश्न 26.
Al के लवणों के विद्युत अपघटन से Al धातु प्राप्त नहीं होती, क्यों?
उत्तर:
Al के लवणों के विद्युत अपघटन से Al धातु प्राप्त नहीं होती क्योंकि यह जल से क्रिया करके Al2O3 बना लेता है।
प्रश्न 27.
सीसा संचायक सेल को लगातार प्रयोग में लेने पर उसमें उपस्थित H2SO4 पर क्या प्रभाव होता है?
उत्तर:
सीसा संचायक सेल को लगातार प्रयोग में लेने पर उसमें उपस्थित H2SO4, का घनत्व कम हो जाता है क्योंकि अभिक्रिया होने पर सल्फेट (\(\mathrm{SO}_4^{2-}\)) आयन, Pb+2 से क्रिया करके PbSO4 बना देते हैं।
प्रश्न 28.
शुष्क सेल में जिंक क्लोराइड (ZnC12) का क्या कार्य है ?
उत्तर:
ZnCl2 से प्राप्त Zn2+, अभिक्रिया में उत्पन्न NH3 से क्रिया करके [Zn(NH3)4] 22+ संकुल आयन बना लेता है जिससे दाब उत्पन्न नहीं होता है तथा सील के टूटने की सम्भावना नहीं रहती ।
प्रश्न 29.
मर्क्यूरी सेल में सम्पूर्ण कार्य अवधि में विभव स्थिर रहता है, क्यों?
उत्तर:
मयूरी सेल की सम्पूर्ण सेल अभिक्रिया में कोई ऐसा आयन नहीं है, जिसकी सान्द्रता विलयन में होने के कारण बदलती हो ।
प्रश्न 30.
शुष्क सेल को काफी समय तक प्रयोग में नहीं लेने पर वह नष्ट हो जाता है, क्यों?
उत्तर:
शुष्क सेल को काफी समय तक प्रयोग में नहीं लेने पर इसमें उपस्थित अमोनियम क्लोराइड, उसके जिंक से बने पात्र को संक्षारित करके उसे नष्ट कर देता है।
प्रश्न 31.
लवणीय जल में जंग जल्दी लगती है, क्यों?
उत्तर:
लवण (NaCl), H2O के आयनन को बढ़ा देता है जिससे H+ की सान्द्रता बढ़ जाती है जो कि जंग लगने में सहायक है।
प्रश्न 32.
(i) 100 मिली विलयन में एक मोल NaCl तथा (ii) 250 मिली विलयन में एक मोल NaCl में से किसकी मोलर चालकता अधिक होगी तथा क्यों?
उत्तर:
विलयन (ii) की मोलर चालकता अधिक होगी क्योंकि \(\Lambda_{\mathrm{m}}=\kappa \times \mathrm{V}\) अर्थात् आयतन बढ़ने पर मोलर चालकता बढ़ती है।
लघुत्तरात्मक प्रश्न:
प्रश्न 1.
कॉपर की HCl तथा HNO3 से अभिक्रिया कराने पर क्या होता है?
उत्तर:
कॉपर की HCl से कोई अभिक्रिया नहीं होती क्योंकि H+ आयन, Cu को ऑक्सीकृत नहीं कर सकता अर्थात् Cu, H+ को इलेक्ट्रॉन नहीं दे सकता क्योंकि कॉपर, हाइड्रोजन से कम क्रियाशील होता है। लेकिन Cu की HNO3 से क्रिया करवाने पर यह H+ से क्रिया न करके \(\mathrm{NO}_3^{-}\) आयनों द्वारा ऑक्सीकृत होता है।
प्रश्न 2.
गैल्वेनिक सेल में लवण सेतु की बनावट तथा कार्य बताइए ।
उत्तर:
गैल्वैनी सेल एक वैद्युत रासायनिक सेल है। इसमें स्वतः उपापचयी अभिक्रिया की गिब्ज ऊर्जा, विद्युत ऊर्जा (वैद्युत कार्य ) में परिवर्तित होती है, जिससे मोटर, पंखा, गीजर, हीटर इत्यादि चलाए जाते हैं।
डेनियल सेल, गैल्वैनी सेल का एक उदाहरण है जिसमें Zn का ऐनोड तथा Cu का कैथोड लिया जाता है। इस सेल के दोनों इलेक्ट्रॉंडों को अर्ध सेल कहते हैं तथा इन पर होने वाली अभिक्रियाओं को अर्ध सेल अभिक्रिया कहते हैं। दोनों इलेक्ट्रॉडों को लवण सेतु से जोड़ा जाता है। डेनियल सेल में होने वाली अभिक्रिया निम्नलिखित है-
\(\mathrm{Zn}_{(\mathrm{s})}+\mathrm{Cu}_{(\mathrm{aq})}^{2+} \rightarrow \mathrm{Zn}_{(\mathrm{aq})}^{2+}+\mathrm{Cu}_{(\mathrm{s})}\)
यह अभिक्रिया निम्नलिखित दो अभिक्रियाओं का योग है-
(i) कैथोड पर Cu2+ + 2e– → Cu(s) (अपचयन अर्ध अभिक्रिया)
(ii) ऐनोड पर Zu(s) → Zn2+ + 2e– (ऑक्सीकरण अर्ध अभिक्रिया )
Z के ऑक्सीकरण से प्राप्त इलेक्ट्रॉन धातु के तार की सहायता से Cu की छड़ पर चले जाते हैं तथा CuSO4 विलयन से Cu2+ आयन, कॉपर की छड़ की ओर गमन करते हैं। ऐनोड (Zn छड़ ) पर इलेक्ट्रॉन निकलने के कारण इसे ऋण ध्रुव (-ve) कहते हैं तथा कैथोड (Cu छड़) पर Cu2+ आयन एकत्रित होने के कारण इसे धन ध्रुव (+ve) कहते हैं। बाहरी परिपथ में इलेक्ट्रॉन -ve इलेक्ट्रॉड से +ve इलेक्ट्रॉड की ओर जाते हैं। उपर्युक्त अभिक्रियाएँ डेनियल सेल के दो अलग-अलग भागों में होती हैं। अपचयन अर्ध अभिक्रिया कॉपर इलेक्ट्रॉड पर जबकि ऑक्सीकरण अर्ध अभिक्रिया ज़िंक इलेक्ट्रॉड पर होती है। डेन्यल सेल के ये भाग, अर्ध सेल या रेडॉक्स युग्म कहलाते हैं। कॉपर इलेक्ट्रॉड को अपचयन अर्ध सेल एवं ज़िंक इलेक्ट्रॉड को ऑक्सीकरण अर्ध सेल कहते हैं।
प्रश्न 3.
सान्द्रता सेल की व्याख्या कीजिए ।
उत्तर:
वह सेल जिसमें दो समान इलेक्ट्रॉड अपने आयनों की भिन्न-भिन्न सान्द्रता के विलयनों में डूबे होते हैं। इस कारण इन इलेक्ट्रॉडों के विभव भी भिन्न-भिन्न होते हैं। अतः सेल में विभवान्तर उत्पन्न होता है। इसके लिए 298 K पर सेल विभव

प्रश्न 4.
किसी एक इलेक्ट्रॉड का इलेक्ट्रॉड विभव ज्ञात करना सम्भव नहीं है। क्यों?
उत्तर:
किसी एक इलेक्ट्रॉड का इलेक्ट्रॉड विभव इसलिए ज्ञात नहीं किया जा सकता क्योंकि विद्युत वाहक बल (EMF) उसी स्थिति में माप सकते हैं जब परिपथ पूर्ण हो तथा एक इलेक्ट्रॉड से परिपथ पूर्ण नहीं होता ।
प्रश्न 5.
Fe2+ → Fe3+ (E° = – 0.77V)
तथा Cu → Cu2+ (E° = – 0.34V)
इन मानों के आधार पर ज्ञात कीजिए कि Cu+ आयन, Fe2+ आयन से अपचयित हो सकता है या नहीं।
उत्तर:
दिए गए मान ऑक्सीकरण विभव के हैं, अतः अपचयन विभव के मान Fe+3 → Fe2+ के लिए 0.77 V तथा Cu+2 → Cu के लिए 0.34 V होंगे। चूँकि Fe+3 का अपचयन विभव Cu2+ के अपचयन विभव से अधिक है। अतः Cu2+ आयन, Fe2+ आयन से अपचयित नहीं हो सकता।
प्रश्न 6.
अपचयन विभव तथा ऑक्सीकरण विभव क्या होते हैं?
उत्तर:
उपापचयी अभिक्रिया में अपचयन अर्ध- अभिक्रिया के विभव को अपचयन विभव तथा ऑक्सीकरण अर्ध-अभिक्रिया के विभव को ऑक्सीकरण विभव कहते हैं। किसी अर्ध-अभिक्रिया के लिए ऑक्सीकरण विभव तथा अपचयन विभव के मान समान होते हैं लेकिन उनके चिह्न विपरीत होते हैं।
![]()
प्रश्न 7.
सेल \(\mathrm{Zn}_{(\mathrm{s})}\left|\mathbf{Z n}_{(\mathrm{aq})}^{2+} \| \mathrm{Cu}_{(\mathrm{aq})}^{+2}\right| \mathrm{Cu}_{(\mathrm{s})}\) के लिए सेल विभव का मान धनात्मक है। इससे क्या निष्कर्ष प्राप्त होता है?
उत्तर:
यह गैल्वेनिक सेल है तथा इसके लिए नेंस्ट समीकरण निम्न प्रकार लिखा जाता है-
\(\mathrm{E}_{\text {सेल }}=\mathrm{E}_{\text {सेल }}^0-\frac{0.059}{2} \log \frac{\left[\mathrm{Zn}^{2+}\right]}{\left[\mathrm{Cu}^{2+}\right]}\)
इस समीकरण से सिद्ध होता है कि Cu2+ की सान्द्रता अधिक होने पर ही Eसेल का मान धनात्मक होना सम्भव है। इस स्थिति में Zn ऑक्सीकृत होकर Zn2+ देता है तथा Cu2+ आयन का अपचयन होकर Cu प्राप्त होता है।
प्रश्न 8.
एक मोल इलेक्ट्रॉनों के आवेश की गणना कीजिए ।
उत्तर:
एक इलेक्ट्रॉन पर आवेश 1.6021 × 10-19C (कूलॉम)
1 मोल इलेक्ट्रॉन = आवोगाद्रो संख्या (NA) = 6.022 × 1023
अतः एक मोल इलेक्ट्रॉनों का आवेश
= एक इलेक्ट्रॉन का आवेश × NA
= 1.6021 × 10-19 C × 6.022 × 1023 mol-1
= 96478 C mol-1 ≈ 96500 C mol-1 = 1 फैराडे (IF)
प्रश्न 9.
किसी विद्युत अपघट्य के विलयन के वैद्युत अपघटन से प्राप्त उत्पाद किन कारकों पर निर्भर करते हैं?
उत्तर:
वैद्युत अपघटन के उत्पाद: किसी पदार्थ (विद्युत अपघट्य) के वैद्युत अपघटन से प्राप्त उत्पाद (i) पदार्थ की अवस्था, (ii) प्रयुक्त किए गए इलेक्ट्रॉडों की प्रकृति तथा (iii) ओंक्सीकारक व अपचायक स्पीशीज एवं उनके मानक इलेक्ट्रोंड विभव पर निभर करते हैं। सक्रिय धातुओं के इलेक्ट्रॉडड लेने पर वे अभिक्रिया में भाग लेते हैं लेकिन अक्रिय धातुओं जैसे प्लैटिम इत्यादि के इलेक्ट्रॉड बनाने पर ये अभिक्रिया में भाग नहीं लेते तथा केवल इलेक्ट्रॉनों के स्रोत का कार्य करते हैं।
गलित NaCl के वैद्युत अपघटन से कैथोड पर Na तथा ऐनोड पर Cl2 प्राप्त होती है क्योंकि द्रव अवस्था में केवल एक ही प्रकार के धनायन Na+ तथा ऋणायन (Cl– हैं, जिनका क्रमशः अपचयन तथा ऑंक्सीकरण होता है-
कैथोड पर- Na+ + e– → Na
ऐनोड पर- Cl– → \(\frac { 1 }{ 2 }\)Cl2 + e–
जब विद्युत अपघट्य का जलीय विलयन लिया जाता है तो विलयन में एक से अधिक प्रकार के धनायन तथा ऋणायन होते हैं क्योंकि कुछ मात्रा में H2O के आयनन से H+ तथा \(\overline{\mathrm{O}} \mathrm{H}\) आयन भी प्राप्त होते हैं। इस स्थिति में किसी इलेक्ट्रोंड पर कौनसा आयन विसर्जित होगा, इसे चयनात्मक विसर्ज्जन सिद्धान्त (Preferential Discharge Theory) के आधार पर समझाया जाता है। इस सिद्धान्त के अनुसार, जब विलयन में एक ही प्रकार (धनायन या ऋणायन) के एक से अधिक आयन होते हैं तो इलेक्ट्रॉंड पर वह आयन पहले विसर्जित (Discharge) होगा, जिसका विसर्जन विभव (Discharge Potential) कम हो अर्थात् जिसके विसर्जन हेतु कम ऊर्जा की आवश्यकता हो।
प्रश्न 10.
सोडियम क्लोराइड के जलीय विलयन के वैद्युत अपघटन से प्राप्त उत्पादों को इलेक्ट्रॉड विभव मानों के आधार पर समझाइए |
उत्तर:
वैद्युत अपघटन के उत्पाद: किसी पदार्थ (विद्युत अपघट्य) के वैद्युत अपघटन से प्राप्त उत्पाद (i) पदार्थ की अवस्था, (ii) प्रयुक्त किए गए इलेक्ट्रॉडों की प्रकृति तथा (iii) ओंक्सीकारक व अपचायक स्पीशीज एवं उनके मानक इलेक्ट्रोंड विभव पर निभर करते हैं। सक्रिय धातुओं के इलेक्ट्रॉडड लेने पर वे अभिक्रिया में भाग लेते हैं लेकिन अक्रिय धातुओं जैसे प्लैटिम इत्यादि के इलेक्ट्रॉड बनाने पर ये अभिक्रिया में भाग नहीं लेते तथा केवल इलेक्ट्रॉनों के स्रोत का कार्य करते हैं।
गलित NaCl के वैद्युत अपघटन से कैथोड पर Na तथा ऐनोड पर Cl2 प्राप्त होती है क्योंकि द्रव अवस्था में केवल एक ही प्रकार के धनायन Na+ तथा ऋणायन (Cl– हैं, जिनका क्रमशः अपचयन तथा ऑंक्सीकरण होता है-
कैथोड पर- Na+ + e– → Na
ऐनोड पर- Cl– → \(\frac { 1 }{ 2 }\)Cl2 + e–
जब विद्युत अपघट्य का जलीय विलयन लिया जाता है तो विलयन में एक से अधिक प्रकार के धनायन तथा ऋणायन होते हैं क्योंकि कुछ मात्रा में H2O के आयनन से H+ तथा \(\overline{\mathrm{O}} \mathrm{H}\) आयन भी प्राप्त होते हैं। इस स्थिति में किसी इलेक्ट्रोंड पर कौनसा आयन विसर्जित होगा, इसे चयनात्मक विसर्ज्जन सिद्धान्त (Preferential Discharge Theory) के आधार पर समझाया जाता है। इस सिद्धान्त के अनुसार, जब विलयन में एक ही प्रकार (धनायन या ऋणायन) के एक से अधिक आयन होते हैं तो इलेक्ट्रॉंड पर वह आयन पहले विसर्जित (Discharge) होगा, जिसका विसर्जन विभव (Discharge Potential) कम हो अर्थात् जिसके विसर्जन हेतु कम ऊर्जा की आवश्यकता हो।
किसी आयन का विसर्जन विभव निम्न कारको पर निर्भर करता है-
(i) विद्युत रासायनिक श्रेणी में आयन का स्थान,
(ii) आयन की सान्द्रता तथा
(iii) इलेक्ट्रॉंड की प्रकृति।
इस आधार पर विभिन आयनों के विसर्जित होने का क्रम निम्न प्रकार होता है-
धनायन – Li+ < K+ <Na+ < Ca2+ < Mg2+ < Al3+ < Zn2+ < Fe2+ < Co2+ < Ni2+ < Sn2+ < H+ < Cu2+ < Hg2+ < Ag2+ < Au3+
ॠणायन – \(\mathrm{SO}_4^{2-}<\mathrm{NO}_3^{-}<\mathrm{OH}^{-}<\mathrm{Cl}^{-}<\mathrm{Br}^{-}<\mathrm{I}^{-}\)
(i) सोडियम क्लोराइड के जलीय विलयन का वैद्युत अपघटन-सोडियम क्लोराइड के जलीय विलयन के वैद्युत अपघटन से NaOH, Cl2 गैस तथा H2 गैस बनती है। इसमें Na+ एवं Cl– के साथ H+ एवं OH– आयन तथा विलायक के अणु (H2O) भी होते है। कैथोड पर निम्नलिखित दो अभिक्रियाएँ हो सकती है-
Na+(aq) + e– → Na(s); E°सेल = – 2.71 V …(1)
H+(aq) + e– → \(\frac { 1 }{ 2 }\)H2(g); E°सेल = 0.00 V …(2)
लेकिन कैथोड पर वह अभिक्रिया होती है जिसके लिए E° का मान अधिक हो, अतः कैथोड पर अभिक्रिया (2) होगी। \(\mathrm{H}_{(\mathrm{aq})}^{+}\), H2O के वियोजन से प्राप्त होता है, अतः कैथोड पर होने वाली अभिक्रिया को निम्न प्रकार लिखा जाता है-
\(\mathrm{H}_2 \mathrm{O}_{(l)}+\mathrm{e}^{-} \rightarrow \frac{1}{2} \mathrm{H}_{2(\mathrm{~g})}+\overline{\mathrm{O}} \mathrm{H}_{(a q)}\)ऐनोड पर होने वाली संभावित अभिक्रियाएँ निम्नलिखित हैं-
Cl–(aq) → \(\frac { 1 }{ 2 }\) Cl2(g) + e–; E°सेल = 1.36 V …(1)
2H2O(l) → O2(g) + 4H+(aq)+4e–; E°सेल = 1.23 V …(2)
ऐनोड़ पर कम E° मान वाली अभिक्रिया पहले होती है अतः ऐनोड पर अभिक्रिया (2) होनी चाहिए लेकिन ऑक्सीजन के अधिविभव (Over Potential) के कारण अभिक्रिया (1) ही सम्पन्न होती है। अतः सम्पूर्ण अभिक्रिया को निम्न प्रकार से लिखा जाता है-
NaCl(aq) + H2O(l) →Na+ (aq) + OH–(aq)+\(\frac { 1 }{ 2 }\)H2 (g)+\(\frac { 1 }{ 2 }\)Cl2(g)
नोट-इस विद्युत अपघटन में अक्रिय इलेक्ट्रोंड (Pt) प्रयुक्त किया जाता है लेकिन मर्करी का इलेक्ट्रॉंड प्रयुक्त करने पर कैथोड पर H+ का विसर्जन, Na+ की तुलना में मुश्किल से होता है। अतः कैथोड पर H2 के स्थान पर Na प्राप्त होता है तथा सोडियम अमलगम (Na/Hg) बन जाता है।
(ii) H2SO4 का वैद्युत अपघटन (Pt इलेक्ट्रॉड) – H2SO4 के वैद्युत अपघटन उत्पाद सान्द्रता पर निर्भर करते हैं अतः इसमें इलेक्ट्रॉड विभव के स्थान पर नेर्न्स्ट.समीकरण से प्राप्त इलेक्ट्रॉड विभव काम में लेते हैं।
(i) तनु H2SO4 के वैद्युत अपघटन पर निम्नलिखित अभिक्रिया होती है-
2H2O(l)→O2(g) + 4H+(aq) + 4e–; E°सेल = +1.23 V
(ii) सांद्र H2SO4 लेने पर निम्नलिखित अभिक्रिया होगी-
\(2 \mathrm{SO}_4^{2-}(\mathrm{aq}) \rightarrow \mathrm{S}_2 \mathrm{O}_8^{2-}(\mathrm{aq})+2 \mathrm{e}^{-} ; \mathrm{E}_{\text {(सेल) }}^{\circ}=+1.96 \mathrm{~V}\)
(iii) K2SO4 के जलीय विलयन का वैद्युत अपघटन (Pt इलेक्ट्रॉड) –
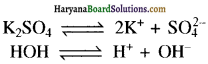
K+ की तुलना में H+ अधिक क्रियाशील है अतः कैथोड पर निम्नलिखित अभिक्रिया होगी-
2H+ + 2e– → H2(g)
तथा \(\mathrm{SO}_4^{2-}\) की तुलना में OH– अधिक क्रियाशील है अतः ऐनोड पर निम्नलिखित अभिक्रिया होगी-
2OH– → [O] + H2O + 2e–
या 4OH– → O2 + 2H2O + 4e–
प्रश्न 11.
गलित NaCl का वैद्युत अपघटन किस प्रकार होता
उत्तर:
गलित NaCl में केवल Na+ तथा Cl– आयन होते हैं अतः कैथोड पर Na+ अपचयित होकर Na बनाते हैं तथा ऐनोड पर Cl– ऑक्सीकृत होकर Cl2 बनाते हैं।
कैथोड पर – 2Na+ + 2e– → 2Na(s)
ऐनोड पर – 2Cl– – 2e– → Cl2(g)
प्रश्न 12.
तनु तथा सान्द्र H2SO4 के वैद्युत अपघटन में होने वाली अभिक्रियाएँ लिखिए ।
उत्तर:
तनु H2SO4 के वैद्युत अपघटन पर निम्नलिखित अभिक्रिया होती है-
2H2O(/) → O2(g) + 4H+ (aq) + 4e–, \(E_{\text {(सेल) }}^{\circ}\) = +1.23V तथा सांद्र H2SO4 लेने पर निम्नलिखित अभिक्रिया होगी-
\(2 \mathrm{SO}_4^{2-}(\mathrm{aq}) \rightarrow \mathrm{S}_2 \mathrm{O}_8^{2-}(\mathrm{aq})+2 \mathrm{e}^{-}, \mathrm{E}_{\text {(बेल) }}^{\circ}=+1.96 \mathrm{~V}\)
प्रश्न 13.
अनन्त तनुता पर किसी दुर्बल वैद्युत अपघट्य की मोलर चालकता को किस प्रकार ज्ञात किया जाता है?
उत्तर:
दुर्बल वैद्युत अपघट्यों की मोलर चालकता पर सान्द्रता या तनुता का प्रभाव-दुर्बल वैद्युत अपघट्यों में प्रारम्भ में सान्द्रता अधिक होने पर वियोजन कम होता है लेकिन इनकी तनुता बढ़ाने पर, वियोजन की मात्रा बढ़ जाती है जिससे एक मोल वैद्युत अपघट्य युक्त विलयन में आयनों की संख्या में वृद्धि होती है, जिससे मोलर चालकता (\(\Lambda_m\)) का मान बढ़ जाता है। अतः निम्न सान्द्रता के समीप तनुता बढ़ाने पर \(\Lambda_m\) का मान तेजी से बढ़ता है। (ग्राफ) उदाहरण-ऐसीटिक अम्ल (CH3COOH) |
प्रश्न 14.
किसी अल्प विलेय लवण की विलेयता को चालकता मापन द्वारा किस प्रकार ज्ञात किया जाता है?
उत्तर:
अल्प विलेय लवणों जैसे BaSO की जल में विलेयता, बहुत ही कम होती है अतः इसके विलयन में आयनों की सान्द्रता बहुत ही कम होगी। इसलिए इसके विलयन को अनन्त तनु मान सकते हैं तथा इसके संतृप्त विलयन की सान्द्रता ही इसकी विलेयता होगी। इस विलयन की मोलर चालकता तथा विशिष्ट चालकत्व ज्ञात करके विलेयता की गणना निम्नलिखित सूत्र द्वारा की जा सकती है-
S = \(\frac{\kappa \times 1000}{\Lambda_{\mathrm{m}}^{\circ}}\)
प्रश्न 15.
विद्युत अपघटनी चालन तथा धात्विक चालन में अन्तर बताइए ।
उत्तर:
- विद्युत अपघटनी चालन आयनों द्वारा होता है जबकि धात्विक चालन इलेक्ट्रॉनों द्वारा होता है।
- विद्युत अपघटन चालन में विद्युत प्रवाहित करने पर आयन क्रिया में भाग लेते हैं अर्थात् वैद्युत अपघटन होता है जबकि धात्विक चालकों पर कोई प्रभाव नहीं होता।
- विद्युत अपघटन चालकों का ताप बढ़ाने पर चालकता बढ़ती है जबकि ताप बढ़ाने पर धात्विक चालकों की चालकता कम हो जाती है।
प्रश्न 16.
निम्नलिखित युग्मों में से किसमें अधिक विद्युत धारा प्रवाहित होगी तथा क्यों ?
(a) 25°C पर KCl विलयन तथा 50°C पर KCl विलयन
(b) 0.2M CH3COOH क्लियन तथा 2M CH3COOH विलयन
(c) 25°C पर NH4OH विलयन तथा 75°C पर NH4OH विलयन
(d) 25°C पर AI का तार तथा 50°C पर Al का तार ।
उत्तर:
(a) 50°C पर KCl विलयन, क्योंकि ताप बढ़ाने पर आयनों की गति बढ़ती है।
(b) 0.2M CH3COOH विलयन, क्योंकि तनु विलयन में दुर्बल वैद्युत अपघट्य का आयनन अधिक होता है।
(c) 75°C पर NH4OH विलयन, क्योंकि ताप बढ़ाने पर दुर्बल वैद्युत अपघट्य का आयनन अधिक होता है।
(d) 25°C पर Al का तार क्योंकि ताप बढ़ाने पर धातुओं की चालकता कम होती है।
आंकिक प्रश्न:
प्रश्न 1.
कॉपर सल्फेट के जलीय विलयन के विद्युत अपघटन में 3 घण्टे में 1.5 ग्राम कॉपर प्राप्त करने के लिए कितनी विद्युत धारा प्रवाहित करनी होगी ? [Cu का परमाणु भार = 63.5]
उत्तर:
![]()
कॉपर का तुल्यांकी भार = \(\frac { 63.5 }{ 2 }\) = 31.75
क्योंकि Cu2+ से Cu बनता है जिसके लिए 2 इलेक्ट्रॉन आवश्यक है।
अतः \(Z=\frac{31.75}{96500}=3.29 \times 10^{-4}\)
फैराडे के प्रथम नियम से
W = ZIt
I = \(\frac { W }{ Zt }\)
W = 1.5 ग्राम, Z = 3.29 × 10-4, t = 3 × 60 × 60 सेकण्ड
अतः I = \(\frac{1.5}{3 \times 60 \times 60 \times 3.29 \times 10^{-4}}\)
I = 0.422 ऐम्पियर
प्रश्न 2.
गलित NaCl में 50 एम्पियर की धारा 2 घण्टे तक प्रवाहित करने पर
(a) ऐनोड पर कितने ग्राम क्लोरीन गैस प्राप्त होगी?
(b) प्राप्त क्लोरीन गैस का मानक ताप तथा दाब (NTP) पर आयतन कितना होगा?
उत्तर:
गलित NaCl में विद्युत प्रवाहित करने पर ऐनोड पर निम्नलिखित अभिक्रिया होगी-
(a) 2C– → Cl2 + 2e
Cl2 का अणुभार = 35.5 × 2 = 71 ग्राम
आवेश Q = It
1 = 50 ऐम्पियर तथा t = 2 × 60 × 60 सेकण्ड = 7200 सेकण्ड
अतः Q = 50 × 7200 = 360000 C समीकरण के अनुसार,
2 × 96500 कूलॉम, Cl2 = 71 ग्राम Cl2 (1 मोल )
360000 कूलॉम Cl2 = \(\frac{360000}{2 \times 96500}\) × 71 = 132.4 ग्राम क्लोरीन
(b) 2 × 96500 कूलॉम Cl2 = 1 मोल Cl2
अतः 36,000 कूलॉम Cl2 = \(\frac{3,60,000}{2 \times 96500}\) = 1.8652 मोल क्लोरीन
NTP पर एक मोल Cl2 = 22.4 लीटर
अत: 1.8652 मोल Cl2 = 22.4 × 1.8652 = 41.78 लीटर क्लोरीन
![]()
प्रश्न 3.
कॉपर धातु की सतह जिसका क्षेत्रफल 60 cm2 है पर 0.004 मिलीमीटर मोटी Ag की परत के लेपन के लिए AgNO3 के विलयन में 5.0 ऐम्पियर की धारा कितने सेकण्ड तक प्रवाहित करनी आवश्यक होगी?
(सिल्वर का घनत्व 10.5 ग्राम सेमी तथा Ag का परमाणु भार = 108)
उत्तर:
कॉपर पर लेपित Ag की मात्रा (W)
= आयतन × घनत्व
= सतह का क्षेत्रफल × सतह की मोटाई × घनत्व
= 60 × 0.004 × 10.5
W = 2.52 ग्राम
फैराडे के प्रथम नियम से
W = Zlt
![]()
अभिक्रिया \(\mathrm{Ag}_{(\mathrm{aq})}^{+}+\mathrm{e}^{-} \rightarrow \mathrm{Ag}_{(\mathrm{s})}\) में एक इलेक्ट्रॉन प्रयुक्त हो रहा
है अतः Ag का तुल्यांकी भार
= \(\frac { 108 }{ 1 }\) = 108
अतः Z = \(\frac { 108 }{ 96500 }\)
समय t = \(\frac { W }{ ZI }\) = \(\frac{2.52 \times 96500}{108 \times 5}\)
t = 450.3 सेकण्ड
प्रश्न 4.
श्रेणीक्रम में जुड़े हुए दो विद्युत अपघटनी सेलों में क्रमशः अम्लीकृत जल तथा CuSO4 के विलयन में विद्युत धारा प्रवाहित करने पर 200 ml H2 (NTP पर ) तथा 0.60 ग्राम Cu प्राप्त हुए, तो Cu का तुल्यांकी भार कितना होगा?
उत्तर:
H2 का अणुभार = 2 तथा तुल्यांकी भार = 1
NTP पर 22.4 लीटर (22400 ml) H2 ग्राम
अतः 200ml H2 = \(\frac{2 \times 200}{22400}\) = 0.01785 ग्राम
प्राप्त Cu का भार = 0.60 ग्राम
फैराडे के द्वितीय नियम से-

प्रश्न 5.
AlCl3 के विलयन में 0.1 फैराडे विद्युत धारा प्रवाहित करने पर कैथोड पर कितने ग्राम AI धातु प्राप्त होगी ? (Al का परमाणु भार = 27)
उत्तर:
कैथोड पर होने वाली अभिक्रिया निम्नलिखित है-
\(\mathrm{Al}_{(\mathrm{aq})}^{3+}+3 \mathrm{e} \rightarrow \mathrm{Al}_{(\mathrm{s})}\)
फैराडे के प्रथम नियम से-
W = ZQ
Z = \(\frac { M }{ nF }\)
अतः W = \(\frac{M}{n F} Q\)
Al के लिए M = 27, n = 3, F = 96500 कूलॉम
Q = 0.1. फैराडे = 9650 कूलॉम
W = \(\frac{27 \times 9650}{3 \times 96500}\) = 0.9 ग्राम
प्रश्न 6.
किसी आयन से परमाणु बनने पर होने वाले अपचयन में 6 × 1020 इलेक्ट्रॉन प्रयुक्त होते हैं तो आयन के तुल्यांक ज्ञात कीजिए।
उत्तर:
\(\mathrm{X}^{\mathrm{n}+}+\mathrm{ne}^{-} \rightarrow \mathrm{X}\)
n = 6 × 1023 = 0.001 मोल
क्योंकि 6 × 1023 = 1 मोल
चूँकि एक तुल्यांक आयन 1 मोल इलेक्ट्रॉन ग्रहण करता है। अतः 0.001 मोल इलेक्ट्रॉन ग्रहण करने वाले आयन के तुल्यांक = 0.001
प्रश्न 7.
गलित AlCl3, CuSO4 के जलीय विलयन तथा गलित NaCl से भरे विभिन्न विद्युत अपघटनी सेलों में 3 फैराडे विद्युत धारा प्रवाहित करने पर कैथोड पर प्राप्त Al, Cu तथा Na की मात्राओं का अनुपात क्या होगा ?
उत्तर:
(i) \(\mathrm{Al}_{(\mathrm{aq})}^{3+}+3 \mathrm{e}^{-} \rightarrow \mathrm{Al}_{(\mathrm{s})}\) (कैथोडिक अभिक्रिया)
3 × 96500 कूलॉम विद्युत = 3
तुल्यांक Al = 1 मोल Al
(ii) \(\mathrm{Cu}_{(\mathrm{aq})}^{2+}+2 \mathrm{e} \rightarrow \mathrm{Cu}_{(\mathrm{s})}\)
3 × 96500 कूलॉम विद्युत = 3
तुल्यांक Cu = 1.5 मोल Cu
(iii) \(\mathrm{Na}^{+}+\mathrm{e}^{-} \rightarrow \mathrm{Na}_{(\mathrm{s})}\)
3 × 96500 कूलॉम विद्युत = 3
तुल्यांक Na = 3 मोल Na
अतः Al, Cu तथा Na की मात्राओं का अनुपात
= 1 : 1.5 : 3
=2 : 3 : 6
प्रश्न 8.
Mg2+ आयन के विलयन से 1 ग्राम Mg प्राप्त करने के लिए आवश्यक विद्युत की कीमत 5.00 रुपए है तो Al3+ से 10 ग्राम Al प्राप्त करने के लिए आवश्यक विद्युत की कीमत ज्ञात कीजिए। (AI का परमाणु भार = 27 तथा Mg का परमाणु भार = 24 ) हल – फैराडे के प्रथम नियम से-
Al के लिए- W = ZQ
Z = \(\frac { E }{ F }\) = \(\frac { M }{ nF }\)
अतः W = \(\frac{M}{n F} Q\)
W = 10 ग्राम तथा n 3 क्योंकि Al3+ से Al बनता है।
अतः Q = \(\frac { WnF }{ M }\) = \(\frac{10 \times 3 \times 96500}{27}\) = 107222 कूलाम
इसी प्रकार Mg के लिए, Q = \(\frac { WnF }{ M }\)
(W= 1 ग्राम तथा n = 2 क्योंकि Mg2+ से Mg बनता है।)
= \(\frac{1 \times 2 \times 96500}{24}\) = 8041 कूलाम
प्रश्नानुसार, 8041 कूलाम विद्युत = 5.00 रुपए तो
107222 कूलाम विद्युत = \(\frac { 5 }{ 8041 }\) × 107222 = 66.67 रुपए
प्रश्न 9.
HCl से अम्लीकृत किए गए जल में 1 ऐम्पियर की धारा 3000 सेकण्ड तक प्रवाहित करने पर कैथोड पर मुक्त H2 की मात्रा ज्ञात कीजिए।
उत्तर:
विद्युत धारा की मात्रा Q = It
I = 1 ऐम्पियर, t = 3000 सेकण्ड
Q = 1 × 3000 = 3000 कूलॉम
कैथोड पर निम्नलिखित अभिक्रिया होगी-
\(\mathrm{H}_{(\mathrm{aq})}^{+}+\mathrm{e}^{-} \rightarrow \frac{1}{2} \mathrm{H}_2\)
अतः इस अभिक्रिया के अनुसार \(\frac { 1 }{ 2 }\) मोल H2 (1g H2) प्राप्त होने के लिए आवश्यक विद्युत की मात्रा = 96500 कूलॉम = (1 मोल इलेक्ट्रॉन)
चूँकि 96,500 कूलॉम से प्राप्त
H2 = 1 ग्राम
अतः 3000 कूलॉम से प्राप्त
H2 = \(\frac { 1 }{ 96500 }\) × 3000 = 0.0310 ग्राम
प्रश्न 10.
H+ आयन के विलयन के विद्युत अपघटन से 6 मोल H2 गैस प्राप्त करने के लिए आवश्यक विद्युत की मात्रा कूलॉम में ज्ञात कीजिए।
उत्तर:
\(2 \mathrm{H}^{+}+2 \mathrm{e}^{-} \rightarrow \mathrm{H}_2\)
समीकरण के अनुसार 1 मोल H2 प्राप्त करने के लिए आवश्यक विद्युत की मात्रा = 2 फैराडे
अतः 6 मोल H2 प्राप्त करने के लिए आवश्यक विद्युत की मात्रा = 2 × 6 = 12 फैराडे
12F = 12 × 96500 कूलॉम
=1158000 कूलॉम
=11.58 × 105 कूलॉम
बोर्ड परीक्षा के दूष्टिकोण से सम्भावित महत्त्वपूर्ण प्रश्न:
प्रश्न 1.
सीमान्त मोलर चालकता क्या होती है ?
उत्तर:
किसी विलयन की अनन्त तनुता (लगभग शून्य सान्द्रता ) पर मोलर चालकता को सीमान्त मोलर चालकता कहते हैं। इसे \(\Lambda_{\mathrm{m}}^{\mathrm{o}}\) से दर्शाते हैं।
प्रश्न 2.
सेल स्थिरांक, सेल में विलयन का प्रतिरोध और विलयन की चालकता के बीच जो सम्बन्ध होता है, उसे स्पष्ट कीजिए। किस प्रकार विलयन की चालकता उसकी मोलर चालकता से सम्बन्धित होती है?
उत्तर:
(i) G = \(\frac { 1 }{ R }\) = \(\frac { A }{ pl }\) = k\(\frac { A }{ l }\)
यहाँ G = चालकत्व, k= चालकता (विशिष्ट चालकत्व)
\(\frac { l }{ A }\) = सेल स्थिरांक
R = विलयन का प्रतिरोध, p = प्रतिरोधकता
(ii) मोलर चालकता \(\Lambda_{\mathrm{m}}\) = \(\frac { k × 1000 }{ M }\)
K = चालकता, M = मोलरता
प्रश्न 3.
कुछ धातुओं के मानक इलेक्ट्रॉड विभव (E°) दिए गए हैं-
K+/K = – 2.93 V, Ag+/Ag = 0.80 V, Cu2+/Cu = 0.34 V, Mg2+/Mg = – 2.37 V, Cr2+ / Cr = – 0.74 V, Fe2+/ Fe = – 0.44 V.
इन धातुओं को उनके बढ़ते अपचायी सामर्थ्य के क्रम में पुनः व्यवस्थित कीजिए।
अथवा
एक विद्युत रासायनिक सेल की दो अर्ध-अभिक्रियाएँ नीचे दी गई हैं-
\(\mathrm{MnO}_4^{-}(\mathrm{aq})+8 \mathrm{H}^{+}(\mathrm{aq})+5 \mathrm{e}^{-} \rightarrow \mathrm{Mn}^{2+}(\mathrm{aq})+4 \mathrm{H}_2 \mathrm{O}(l), \mathrm{E}^{\circ}=+1.51 \mathrm{~V}\)
\(\mathrm{Sn}^{2+}(\mathrm{aq}) \rightarrow \mathrm{Sn}^{4+}(\mathrm{aq})+2 \mathrm{e}^{-}, \mathrm{E}^{\circ}=+0.15 \mathrm{~V}\)
इन दो अर्ध- अभिक्रियाओं के आधार पर रेडॉक्स (अपचयोपचय) अभिक्रिया का समीकरण लिखिए और मानक इलेक्ट्रॉड विभवों से सेल विभव परिकलित कीजिए और प्रागुक्ति कीजिए कि अभिक्रिया अभिकारक अनुकूली होगी अथवा उत्पाद अनुकूल होगी।
उत्तर:
मानक इलेक्ट्रॉड विभव के आधार पर इन धातुओं की बढ़ती अपचायी सामर्थ्य का क्रम निम्नलिखित है-
Ag < Cu < Fe < Cr < Mg < K [मानक इलेक्ट्रॉड विभव (अपचयन विभव) का घटता क्रम ]
अथवा
मानक इलेक्ट्रॉड विभव के आधार पर अभिक्रिया का संतुलित समीकरण निम्न प्रकार होगा-

अधिक क्रियाशील धातु (Mn) का एनोड होगा अतः
\(\mathrm{E}_{\mathrm{R}}^{\circ}=1.51 \mathrm{~V} \mathrm{E}_{\mathrm{L}}^{\circ}=-0.15 \mathrm{~V}\) (क्योंकि ऑक्सीकरण विभव दिया गया है अतः इसका विपरीत अपचयन विभव होगा)
E°सेल = 1.51 – (- 0.15 V)
E°सेल = 1.66 V
E°सेल का मान धनात्मक है अतः उपरोक्त अभिक्रिया सम्पन्न होगी, अर्थात् अभिक्रिया उत्पाद अनुकूली है।
प्रश्न 4.
(a) सीसा संचायक बैटरी किस प्रकार की बैटरी है? सीसा संचायक बैटरी के काम करने पर जो एनोड और कैथोड पर अभिक्रियाएँ होती हैं और कुल मिलाकर जो सेल अभिक्रिया होती है, उन्हें लिखिए।
(b) 0.10 M K2Cr2O7 (aq), 0.20 M Cr3+ (aq) और 1.0 × 10-4 M H+ (aq) वाले अर्ध-सेल का विभव परिकलित कीजिए । अर्ध- सेल अभिक्रिया इस प्रकार दी जाती है-
\(\begin{array}{r}\mathrm{Cr}_2 \mathrm{O}_7^{2-}(\mathrm{aq})+14 \mathrm{H}^{+}(\mathrm{aq})+6 \mathrm{e}^{-} \rightarrow \\2 \mathrm{Cr}^{3+}(\mathrm{aq})+7 \mathrm{H}_2 \mathrm{O}(l)\end{array}\)
इसके लिए मानक इलेक्ट्रॉड विभव दिया गया है, E° = 1.33V.
उत्तर:
(a) सीसा संचायक बैटरी (सेल) एक द्वितीयक सेल है। सीसा संचायक बैटरी के काम करने पर होने वाली अभिक्रियाएँ निम्नलिखित हैं-

प्रश्न 5.
एक विद्युत अपघट्य के 1.5 M विलयन की मोलर चालकता 138.9 S mol-1 पाई जाती है। इस विलयन की चालकता परिकलित कीजिए ।
उत्तर:

प्रश्न 6.
1 cm व्यास और 50 cm लम्बाई वाले 0.05 M NaOH विलयन के कॉलम का विद्युतीय प्रतिरोध 5.55 × 103 ohm है। इसकी प्रतिरोधकता, चालकता और मोलर चालकता का परिकलन कीजिए।
उत्तर:
r = 1/2 = 0.5 cm
अनुप्रस्थ काट का क्षेत्रफल
A = πr2 = 3.14 × 0.52 cm2 = 0.785cm2 = 0.785 × 10-4m2
l = 50 cm 0.5 m
प्रतिरोध R = \(\frac { pl }{ A }\)
या p = \(\frac { RA }{ l }\) = \(\frac{5.55 \times 10^3 \Omega \times 0.785 \mathrm{~cm}^2}{50 \mathrm{~cm}}\)
प्रतिरोधकता (p) = 87.135 Ω cm
चालकता \(\kappa=\frac{1}{\rho}=\left(\frac{1}{87.135}\right) \mathrm{S} \mathrm{cm}^{-1}\)
\(\mathcal{K}\) = 0.011476 s cm-1
\(\mathcal{K}\) = 0.01148 s cm-1
मोलर चालकता,
\(\Lambda_{\mathrm{m}}=\frac{\kappa \times 1000}{\mathrm{c}} \mathrm{cm}^3 \mathrm{~L}^{-1}\)
c = 0.05 mol L-1
\(\Lambda_{\mathrm{m}}=\frac{0.01148 \mathrm{~S} \mathrm{~cm}^{-1} \times 1000 \mathrm{~cm}^3 \mathrm{~L}^{-1}}{0.05 \mathrm{~mol} \mathrm{~L}^{-1}}\)
\(\Lambda_{\mathrm{m}}=229.6 \mathrm{~S} \mathrm{~cm}{ }^2 \mathrm{~mol}^{-1}\)
जब cm के स्थान पर m के पदों में गणना करें तो-
p = \(\frac { RA }{ l }\) = \(\frac{5.55 \times 10^3 \Omega \times 0.785 \times 10^{-4} \mathrm{~m}^2}{0.5 \mathrm{~m}}\)
= 87.135 × 10-2 Ω m
\(\mathcal{K}\) = \(\frac { l }{ p}\) = \(\frac { 100 }{ 87.135 }\)Ω cm
= 1.148 S m-1
तथा \(\Lambda_{\mathrm{m}}\) = \(\frac{\mathrm{K}}{\mathrm{c}}\) = \(\frac{1.148 \mathrm{~S} \mathrm{~m}^{-1}}{50 \mathrm{~mol} \mathrm{~m}^{-3}}\)
= 229.6 × 10-4 S m2 mol-1
![]()
प्रश्न 7.
AgNO3 के विलयन को 2.0 ऐम्पियर की धारा से 30 मिनट तक वैद्युत अपघटित किया गया। कैथोड पर निक्षेपित चाँदी का द्रव्यमान क्या होगा?
(Ag का मोलर द्रव्यमान 108 ग्राम मोल-1, F = 96500 कूलाम मोल-1)
उत्तर:
समय (t) = 30 मिनट = 30 × 60 = 1800 sec.
I = 2 ऐम्पियर
आवेश = धारा × समय
Q = It = 2 × 1800 कूलाम
= 3600 amp sec. = 3600 कूलाम
\(\mathrm{Ag}_{(\mathrm{aq})}^{+}+\mathrm{e}^{-} \rightarrow \mathrm{Ag}_{(\mathrm{s})}\) के अनुसार, एक मोल (108 g) Ag को निक्षेपित करने के लिए IF या 96500 कूलाम आवेश की आवश्यकता होती है।
अतः 3600 कूलाम आवेश द्वारा निक्षेपित Ag का द्रव्यमान
= \(\frac{108 \times 3600}{96500}\) = 4.029 = 4.03 ग्राम
प्रश्न 8.
KCl, HCl एवं CH3COOK के लिए \(\stackrel{\circ}{\Lambda}_m\) के मान क्रमशः 149.8 S Cm2 mol-1, 425.9 S cm2 mol-1 एवं 114.4 S Cm2 mol-1 हैं | CH3COOH के लिए \(\stackrel{\circ}{\Lambda}_m\) का मान ज्ञात कीजिए।
उत्तर:
\(\stackrel{\circ}{\Lambda}_m\) (CH3COOH) = \(\stackrel{\circ}{\Lambda}_m\) (CH3COOK) + \(\stackrel{\circ}{\Lambda}_m\) (HCl) – \(\stackrel{\circ}{\Lambda}_m\) (KCl)
= 114.4 + 425.9 – 149,8
= 540.3 – 149.8
= 390.5 S cm2 mol-1
प्रश्न 9.
विद्युत चालन के आधार पर अचालक एवं अर्धचालक को समझाइए |
उत्तर:
अचालक या विद्युतरोधी – वे ठोस जिनकी चालकता बहुत कम (10-20 से 10-10 ohm-1 m-1 ) होती है, उन्हें अचालक कहते हैं। इनमें स्वतंत्र आयन या स्वतंत्र इलेक्ट्रॉन नहीं होते अतः ये विद्युत का चालन नहीं करते हैं। इनमें संयोजी बैंड पूर्ण भरा होता है तथा संयोजी बैण्ड एवं चालन बैंड के मध्य ऊर्जा अन्तराल अधिक होता है। उदाहरण- यूरिया तथा शर्करा ।
अर्धचालक – वे ठोस जिनकी चालकता, चालक तथा अचालक के मध्य (10-6 से 104 ohm-1 m-1 ) होती है, उन्हें अर्धचालक कहते हैं। अर्धचालकों में संयोजी बैंड तथा चालक बैंड के मध्य ऊर्जा अन्तराल बहुत कम होता है अतः ये अल्प चालकता दर्शाते हैं। उदाहरण- सिलिकन एवं जर्मेनियम ।
प्रश्न 10.
साम्य अवस्था पर डेन्यल सेल के लिए नेन्ंस्ट समीकरण लिखिए एवं E°(सेल) तथा साम्य स्थिरांक (Kc) में सम्बन्ध व्युत्पन्न कीजिए।
उत्तर:
डेनियल सेल में प्रयुक्त अभिक्रिया-

अतः T = 298 K पर R तथा F का मान रखने पर, उपर्युक्त समीकरण को निम्न प्रकार लिखा जा सकता है-
E°सेल = \(\frac { 0.059V }{ 2 }\)log KC
डेन्यल सेल के लिए E°सेल =1.1 V
1.1 V = \(\frac { 0.059V }{ 2 }\)log Kc
log Kc = \(\frac{(1.1 \mathrm{~V} \times 2)}{0.059 \mathrm{~V}}\) = 37.288
Kc = Antilog 37.288 = 1.941 × 1037
Kc = 2 × 1037 (297 K परं)
अतः सामान्य रूप में,
E°सेल = \(\frac{2.303 \mathrm{RT}}{\mathrm{nF}}\)log Kc या E°सेल = \(\frac{0.059 \mathrm{~V}}{\mathrm{nF}}\) log Kc
यह समीकरण सेल के मानक विभव (E°सेल) तथा साम्य स्थिरांक (Kc) के मध्य सम्बन्ध है।
प्रश्न 11.
(अ) डेनियल सेल का नामांकित चित्र बनाइए ।
(ब) इलेक्ट्रॉडों पर होने वाली ऑक्सीकरण एवं अपचयन की अर्ध अभिक्रियाएँ लिखिए।
उत्तर:
(अ) डेनियल सेल को निम्न प्रकार प्रदर्शित किया जाता हैं-
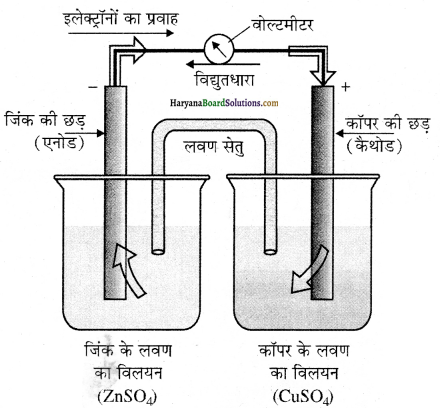
डेनियल सेल जिसमें जिंक एवं कॉपर इलेक्ट्रॉड अपने लवणों के विलयनों में उपस्थित हैं।
(ब) डेन्यल सेल में इलेक्ट्रॉडों पर होने वाली अर्ध अभिक्रियाएँ निम्नलिखित हैं-
कैथोड पर-
(i) \(\mathrm{Cu}_{(\mathrm{aq})}^{2+}+2 \mathrm{e}^{-} \rightarrow \mathrm{Cu}(\mathrm{s})\) (अपचयन अर्ध अभिक्रिया)
ऐनोड पर –
(ii) \(\mathrm{Zn}(\mathrm{s}) \rightarrow \mathrm{Zn}_{(\mathrm{aq})}^{2+}+2 \mathrm{e}^{-}\) (ऑक्सीकरण अर्ध अभिक्रिया) तथा सम्पूर्ण अभिक्रिया निम्नलिखित है-
\(\mathrm{Zn}_{(\mathrm{s})}+\mathrm{Cu}_{(\mathrm{aq})}^{2+} \rightarrow \mathrm{Zn}_{(\mathrm{aq})}^{2+}+\mathrm{Cu}_{(\mathrm{s})}\)
प्रश्न 12.
डेनियल सेल का मानक इलेक्ट्रॉड विभव E° = + 1.1V है तो अभिक्रिया \(\mathbf{Z n}_{(\mathrm{s})}+\mathbf{C u}_{(\mathrm{aq})}^{2+} \rightarrow \mathbf{Z n}_{(\mathrm{aq})}^{2+}+\mathbf{C u}_{(\mathrm{s})}\) के लिए △G° का परिकलन कीजिए। (F = 96500C mol-1)
उत्तर:
उपरोक्त अभिक्रिया के लिए n = 2
△G° = – nFE°सेल
= – 2 × 96500 × 1.1
= – 212,300
= – 212,300 जूल मोल-1
= 212.30 किलो जूल मोल-1
प्रश्न 13.
(i) 298 K पर निम्नलिखित सेल के विद्युत वाहक बल का परिकलन कीजिए-
Mg(s) | Mg2+ (0.1M) || Cu2+(0.01M) | Cu(s)
दिया गया है-
E°सेल = + 2.71V तथा 1F = 96500 C mol-1
(ii) अपोलो अंतरिक्ष प्रोग्राम के लिए विद्युत शक्ति उपलब्ध कराने के लिए प्रयुक्त सेल के प्रकार का नाम लिखिए।
उत्तर:

प्रश्न 14.
(अ) क्या हम CuSO4 के विलयन को लोहे के पात्र में भण्डारण कर सकते हैं? समझाइए ।
(ब) कॉलराउश का नियम लिखिए एवं एक अनुप्रयोग बताइए ।
उत्तर:
(अ) CuSO4 के विलयन का लोहे के पात्र में भण्डारण नहीं किया जा सकता क्योंकि लोहा, कॉपर से अधिक क्रियाशील होता है। अर्थात् आयरन (लोहा) कॉपर की तुलना में प्रबल अपचायक है। अतः यह CuSO4 के विलयन से कॉपर को अवक्षेपित कर देता है।
\(\mathrm{CuSO}_{4(\mathrm{aq})}+\mathrm{Fe}_{(\mathrm{s})} \rightarrow \mathrm{FeSO}_{4(\mathrm{aq})}+\mathrm{Cu}_{(\mathrm{s})}\)
(ब) कोलराडश के अनुसार वैद्युत अपघट्यों के वे युग्म जिनमें धनायन या ऋणायन समान हों, उनकी अनन्त तनुता पर मोलर चालकताओं (A) का अन्तर निश्चित होता है।
\(\Lambda_{\mathrm{m}(\mathrm{KCl})}^{\circ}-\Lambda_{\mathrm{m}(\mathrm{NaCl})}^{\circ}=\Lambda_{\mathrm{m}(\mathrm{KBr})}^{\circ}-\Lambda_{\mathrm{m}(\mathrm{NaBr})}^{\circ}\)
अतः अनन्त तनुता पर किसी विद्युत अपघट्य का प्रत्येक आयन मोलर चालकता (\(\Lambda_{\mathrm{m}}\)) में एक निश्चित योगदान देता है तथा यह दूसरे आयन पर निर्भर नहीं करता। इस आधार पर कोलराडश ने आयनों के स्वतंत्र अभिगमन का नियम दिया जिसे कोलराडश का नियम कहते हैं। इसके अनुसार किसी वैद्युत अपघट्य की सीमान्त मोलर चालकता, उसके धनायन तथा ऋणायन की सीमान्त मोलर चालकता का योग होती है।
उदाहरण – KCl के लिए
\(\Lambda_{\mathrm{m}}^{\circ} \mathrm{KCl}=\lambda_{\mathrm{K}^{+}}^{\circ}+\lambda_{\mathrm{Cl}^{-}}^{\circ}\) \(\lambda_{\mathrm{K}^{+}}^{\circ}\)
\(\lambda_{\mathrm{K}^{+}}^{\circ}\) व \(\lambda_{\mathrm{Cl}^{-}}^{\circ}\) क्रमश: K+ तथा Cl– की सीमान्त मोलर चालकता है। कोलराडश के नियम से किसी दुर्बल विद्युत अपघट्य की सीमान्त मोलर चालकता (अनन्त तनुता पर मोलर चालकता) ज्ञात की जा सकती है।
उदाहरण – CH3COOH (HAc) के लिए
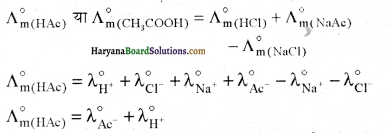
प्रश्न 15.
(अ) लोहे के जंग लगने की सम्पूर्ण रासायनिक अभिक्रिया लिखिए।
(ब) डेन्यल सेल की सम्पूर्ण अभिक्रिया दीजिए एवं इस सेल के लिए नेर्नूस्ट समीकरण का गणितीय रूप लिखिए।
उत्तर:
(अ) लोहे के जंग लगने की सम्पूर्ण रासायनिक अभिक्रिया निम्नलिखित है-
\(2 \mathrm{Fe}_{(\mathrm{s})}+\mathrm{O}_{2(\mathrm{~g})}+4 \stackrel{+}{\mathrm{H}}_{(\mathrm{aq})} \rightarrow 2 \mathrm{Fe}_{(\mathrm{aq})}^{2+}+2 \mathrm{H}_2 \mathrm{O}_{(/)}\)
इसके पश्चात् वायुमण्डलीय ऑक्सीजन के द्वारा Fe2+ आयन पुनः ऑक्सीकृत होकर Fe3+ बनाते हैं। ये आयन जलयोजित फेरिक ऑक्साइड (Fe2O3. x H2O) बना लेते हैं। यही जंग का रासायनिक संघटन है।
(ब) डेनियल सेल की सम्पूर्ण रासायनिक अभिक्रिया निम्नलिखित है-
\(\mathrm{Zn}_{(\mathrm{s})}+\mathrm{Cu}_{(\mathrm{aq})}^{2+} \rightarrow \mathrm{Zn}_{(\mathrm{aq})}^{2+}+\mathrm{Cu}_{(\mathrm{s})}\)
इसके लिए नेर्नूस्ट समीकरण इस प्रकार लिखा जा सकता है-
E(सेल) = E°सेल – \(\frac{\mathrm{RT}}{2 \mathrm{~F}} \ln \frac{\left[\mathrm{Zn}^{2+}\right]}{\left[\mathrm{Cu}^{2+}\right]}\)
E°सेल = मानक सेल विभव
समीकरण में प्राकृतिक लघुगणक को 10 के आधार में बदलने तथा R, F एवं T के मान रखने पर
E(सेल) = E°सेल – \(\frac{0.059}{2} \log \frac{\left[\mathrm{Zn}^{2+}\right]}{\left[\mathrm{Cu}^{2+}\right]}\)
प्रश्न 16.
प्रतिरोधकता का SI मात्रक लिखिये ।
उत्तर:
प्रतिरोधकता का SI मात्रक ओम मीटर (Ωm) होता है।
प्रश्न 17.
Mg2+ व Cl– आयनों की सीमान्त मोलर चालकता क्रमश: 106.0 s.cm2.mol-1 तथा 76.3 s.cm2.mol-1 है। MgCl2 की सीमान्त मोलर चालकता ज्ञात कीजिए।
उत्तर:
MgCl2 की सीमान्त मोलर चालकता
\(\Lambda_{\mathrm{m}}^0\left(\mathrm{MgCl}_2\right)=\lambda^{\circ}\left(\mathrm{Mg}^{2+}\right)+2 \lambda^{\circ}\left(\mathrm{Cl}^{-}\right)\)
= 106.0 s.cm–.mol-1 + 2( 76.3 s. cm2.mol-1) = 258.6 s.cm2.mol-1
प्रश्न 18.
(अ) फैराडे के विद्युत अपघटन के द्वितीय नियम को लिखिए।
(ब) मानक हाइड्रोजन इलेक्ट्रॉड का नामांकित चित्र बनाइए ।
उत्तर:
(अ) फैराडे के विद्युत अपघटन का द्वितीय नियम – विभिन्न वैद्युत अपघट्यों के विलयनों में विद्युत की समान मात्रा समान समय तक प्रवाहित करने पर इलेक्ट्रॉडों पर प्राप्त विभिन्न पदार्थों की मात्राएँ उनके रासायनिक तुल्यांकी भारों के समानुपाती होती हैं।
प्रश्न 19.
जब 1.5 A की विद्युत धारा AgNO3 के विलयन में से प्रवाहित की जाती है तो कैथोड पर सिल्वर का 1.5 g जमा होने में जो समय लगता है, उसका परिकलन कीजिए ।
(Ag का मोलर द्रव्यमान = 108 g mol-1, 1 F = 96500 C mol-1)
उत्तर:
1 मोल (108g) Ag के निक्षेपित होने के लिए आवश्यक आवेश = 96500 कूलाम
अतः 1.5 g Ag के निक्षेपित होने के लिए प्रयुक्त आवेश
= \(\frac { 96500 }{ 108 }\) × 1.5 = 1340.3 कूलाम
आवेश Q = I × t
अतः समय (t) = \(\frac { Q }{ I }\) = \(\frac { 1340.3 }{ 1.5 }\) = 893.5 सेकण्ड
इसलिए 1.5 g सिल्वर के जमा होने में लगा समय = 893.5 सेकण्ड
प्रश्न 20.
निम्नलिखित अभिक्रिया के लिए E°सेल और △rG° को 25°C पर परिकलित कीजिए-
A2+ + B+ → A3+ + B
दिया गया है – Kc = 1010, 1 F = 96500 C mol-1
उत्तर:
