Haryana State Board HBSE 12th Class Chemistry Important Questions Chapter 2 विलयन Important Questions and Answers.
Haryana Board 12th Class Chemistry Important Questions Chapter 2 विलयन
बहुविकल्पीय प्रश्न:
1. 250 ग्राम जल में 2 g NaOH घुला हुआ है तो विलयन की सान्द्रता होगी –
(अ) 0.2 M
(ब) 0.2 N
(स) 0.2 m
(द) 4 ग्राम लीटर-1
उत्तर:
(स) 0.2 m
2. निम्न में से किस मात्रक में विलयन की सान्द्रता ताप पर निर्भर नहीं करती है?
(अ) मोलरता
(ब) नार्मलता
(स) फार्मलता
(द) मोललता
उत्तर:
(द) मोललता
3. निम्नलिखित में से किस विलयन का परासरण दाब न्यूनतम होगा?
(अ) 0.1M BaCl2
(ब) 0.1M यूरिया
(स) 0.1M HCl
(द) 0.2M ग्लूकोस
उत्तर:
(ब) 0.1M यूरिया
4. वाट हॉफ गुणक के लिए कौनसा सूत्र सही नहीं है?

5. निम्नलिखित में से किसके लिए वान्ट हॉफ गुणक का मान K4[Fe (CN)6] के लिए वान्ट हॉफ गुणक के बराबर होगा ?
(अ) NaCl
(ब) Na2SO4
(स) Al2(SO4)3
(द) Al(NO3)3
उत्तर:
(स) Al2(SO4)3
![]()
6. प्रकृति में कुल कितने प्रकार के विलयन संभव हैं?
(अ) 6
(ब) 10
(स) 12
(द) 9
उत्तर:
(द) 9
7. शुद्ध जल की मोलरता कितनी होती है?
(अ) 5.5
(ब) 55.5
(स) 18.0
(द) 10.0
उत्तर:
(ब) 55.5
8. प्रतिलोम परासरण (Reverse osmosis) के लिए प्रयुक्त अर्धपारगम्य झिल्ली किससे बनी होती है?
(अ) सेलोफेन
(ब) सूअर का ब्लेडर
(स) सेलूलोस ऐसीटेट
(द) पार्चमेन्ट
उत्तर:
(स) सेलूलोस ऐसीटेट
9. रुधिर कोशिका में स्थित द्रव का परासरण दाब निम्नलिखित में से किसके समान होता है?
(अ) 1% (w/V) NaCl विलयन
(ब) 0.9% (w/V) NaCl विलयन
(स) 1% (w/V) Na2SO4 विलयन
(द) उपर्युक्त में से कोई नहीं
उत्तर:
(ब) 0.9% (w/V) NaCl विलयन
10. विलायक के प्रति किलोग्राम में उपस्थित विलेय के मोलों की संख्या कहलाती है-
(अ) मोलरता
(ब) मोलरता
(स) मोललता
(द) मोल भिन्न
उत्तर:
(स) मोललता
11. परासरण की क्रिया को रोकने हेतु प्रयुक्त दाब कहलाता है-
(अ) वाष्प दाब
(ब) आंशिक दाब
(स) परासरण दाब
(द) वायुमण्डलीय दाब
उत्तर:
(स) परासरण दाब
12. समान परासरण दाब वाले विलयन कहलाते हैं-
(अ) अतिपरासरी विलयन
(ब) अल्पपरासरी विलयन
(स) समपरासरी विलयन
(द) सामान्य परासरी विलयन
उत्तर:
(स) समपरासरी विलयन
13. दो द्रवों का विलयन जो संघटन में परिवर्तन के बिना एक निश्चित ताप पर आसवित होता है, कहलाता है-
(अ) संतृप्त विलयन
(ब) आदर्श विलयन
(स) स्थिर क्वाथी मिश्रण
(द) असंतृप्त विलयन
उत्तर:
(स) स्थिर क्वाथी मिश्रण
14. एक वायुमण्डलीय दाब पर निम्नलिखित में से किसका क्वथनांक उच्चतम होगा-
(अ) 0.1M ग्लूकोस
(ब) 0.1 M यूरिया
(स) 0.1M बेरियम क्लोराइड
(द) 0.1M NaCl
उत्तर:
(स) 0.1M बेरियम क्लोराइड
15. निम्नलिखित में से कौनसा गुण अणुसंख्य गुण नहीं है ?
(अ) क्वथनांक उन्नयन
(स) हिमांक अवनमन
(ब) वाष्प दाब अवनमन
(द) हिमांक
उत्तर:
(द) हिमांक
16. बेन्जीन और टॉलूईन का मिश्रण है-
(अ) धनात्मक विचलन युक्त विलयन
(ब) ऋणात्मक विचलन युक्त विलयन
(स) आदर्श विलयन
(द) अनादर्श विलयन
उत्तर:
(स) आदर्श विलयन
![]()
17. निम्नलिखित में से कौनसा युग्म आदर्श विलयन नहीं बनाता?
(अ) C2H5Br, C2H5I
(ब) C2H5I, C2H5OH
(स) C6H5Cl, C6H5Br
(द) C6H6, C6H5CH3
उत्तर:
(ब) C2H5I, C2H5OH
18. H2SO4 का एक मोलर विलयन किसके समान होगा?
(अ) नॉर्मल विलयन
(ब) N/2 विलयन
(स) 2N विलयन
(द) 4N विलयन
उत्तर:
(स) 2N विलयन
19. निम्नलिखित में से किस मिश्रण में मुख्य रूप से द्विध्रुव – द्विध्रुव आकर्षण पाया जाता है?
(अ) KCl तथा H2O
(ब) C6H6 तथा CCl4
(स) C6H6 तथा C2H5OH

उत्तर:
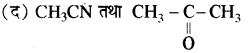
20. आदर्श विलयन के लिए निम्नलिखित में से कौनसी शर्त सही है?

21. सोडा वाटर होता है-
(अ) CO2 गैस में जल का विलयन
(ब) CO2 गैस का जल में विलयन
(स) CO2 तथा O2 का विलयन
(द) CO2 तथा N2 का विलयन
उत्तर:
(ब) CO2 गैस का जल में विलयन
22. निम्नलिखित में से कौनसा अणुसंख्य गुण है?
(अ) पृष्ठ तनाव
(ब) श्यानता
(स) परासरण दाब
(द) चालकता
उत्तर:
(स) परासरण दाब
23. 0.1 M KCl, 0.1 M CaSO4 तथा 0.1M K2CO3 के जलीय विलयनों के हिमांक अवनमन का अनुपात होगा-
(अ) 1 : 1 : 3
(ब) 2 : 2 : 5
(स) 1 : 1 : 1.5
(द) 1 : 1 : 1
उत्तर:
(स) 1 : 1 : 1.5
24. जब विलयन में वैद्युत अपघट्य वियोजित होता है तो इसके वान्ट हॉफ गुणक का मान होगा-
(अ) > 1
(ब) < 1
(स) 1
(द) शून्य
उत्तर:
(अ) > 1
25. यूरिया के एक जलीय विलयन के क्वथनांक में उन्नयन 0.52° है। [Kb = 0.52°C मोल’ किग्रा.] तो इस विलयन में यूरिया का मोल प्रभाज है-
(अ) 0.982
(स) 0.943
(ब) 0.567
(द) 0.018
उत्तर:
(द) 0.018
26. अर्द्धपारगम्य झिल्ली अनुमति करती है-
(अ) एक विलयन को गुजरने देना
(ब) विलेय को गुजरने देना
(स) विलायक को गुजरने देना
(द) विलेय एवं विलायक दोनों को गुजरने देना
उत्तर:
(स) विलायक को गुजरने देना
27. 5 ग्राम NaOH के 450 मिली. विलयन की मोलरता होगी-
(अ) 0.189 मोल dm-3
(ब) 0.278 मोल dm-3
(स) 0.556 मोल dm-3
(द) 0.027 मोल dm-3
उत्तर:
(ब) 0.278 मोल dm-3
28. किसी जलीय विलयन का हिमांक- 0.186°C है, इसी विलयन के क्वथनांक में उन्नयन का मान है ( Kf = 1.86°C mol-1 kg) (Kb = 0.512°C mol-1 kg)
(अ) 0.186°C
(ब) 0.0512°C
(स) 1.86°C
(द) 5.12°C
उत्तर:
(ब) 0.0512°C
![]()
29. निम्नलिखित में से द्रवों का कौन-सा युग्म राउल्ट के नियम से धनात्मक विचलन प्रदर्शित करता है?
(अ) जल-हाइड्रोजन अम्ल
(ब) बेन्जीन – मेथेनॉल
(स) जल- नाइट्रिक अम्ल
(द) ऐसीटोन – क्लोरोफॉर्म
उत्तर:
(ब) बेन्जीन – मेथेनॉल
30. समान तापमान पर 5% ग्लूकोस ( अणु भार 180 ) का विलयन एवं 10% अज्ञात पदार्थ का विलयन समपरासरी है, तो अज्ञात पदार्थ का अणुभार है-
(अ) 90
(ब) 180
(स) 360
(द) 45
उत्तर:
(स) 360
31. कौनसा सान्द्रता अभिव्यक्ति का माध्यम ताप से स्वतंत्र है?
(अ) मोलरता
(ब) नार्मलता
(स) फॉर्मलता
(द) मोललता
उत्तर:
(द) मोललता
अतिलघूत्तरात्मक प्रश्न :
प्रश्न 1.
0.2 मोलल विलयन का क्या अर्थ है ?
उत्तर:
0.2 मोलल विलयन का अर्थ है कि 0.2 मोल विलेय 1000g (1 kg) विलायक में घुला हुआ है।
प्रश्न 2.
जलीय विलयन के लिए मोललता तथा किसी पदार्थ (विलेय) मोल अंश में क्या सम्बन्ध होगा?
उत्तर:
विलेय का मोल अंश = \(\frac { m }{ m + 55.5 }\)
m = मोललता, 1000 ग्राम जल के मोल = \(\frac { 1000 }{ 18 }\) = 55.5
प्रश्न 3.
विलयन का ताप बढ़ाने पर मोलरता पर क्या प्रभाव होगा ?
उत्तर:
विलयन का ताप बढ़ाने पर मोलरता कम हो जाती है क्योंकि विलयन का आयतन बढ़ जाता है।
प्रश्न 4.
H2O2 की आयतन सान्द्रता से क्या तात्पर्य है?
उत्तर:
एक आयतनं H2O2 विलयन के वियोजन से NTP पर प्राप्त ऑक्सीजन का आयतन, इसकी आयतन सान्द्रता कहलाती है।
प्रश्न 5.
मोलरता की तुलना में मोललता को अधिक महत्त्व दिया जाता है, क्यों?
उत्तर:
मोलरता की तुलना में मोललता को अधिक महत्त्व दिया जाता है क्योंकि मोललता ताप पर निर्भर नहीं करती।
प्रश्न 6.
एक मोलल तथा एक मोलर जलीय विलयन में से किसकी सान्द्रता अधिक होती है?
उत्तर:
एक मोलर विलयन।
प्रश्न 7.
ताप बढ़ाने पर गैसों की द्रवों में विलेयता पर क्या प्रभाव
उत्तर:
ताप बढ़ाने पर गैसों की द्रवों में विलेयता कम हो जाती है।
प्रश्न 8.
हेनरी के नियम की परिभाषा लिखिए।
उत्तर:
किसी विलयन में गैस का मोल अंश, उस विलयन के ऊपर उपस्थित गैस के आंशिक दाब के समानुपाती होता है, अर्थात् किसी गैस का वाष्प अवस्था में आंशिक दाब, उस विलयन में गैस के मोल अंश के समानुपाती होता है। इसे हेनरी का नियम कहते हैं।
प्रश्न 9.
किस प्रकार के द्रवों में आदर्श विलयन बनाने की प्रवृत्ति होती है?
उत्तर:
बहुत अधिक तनु विलयन, लगभग समान संरचना तथा ध्रुवता वाले द्रवों में आदर्श विलयन बनाने की प्रवृत्ति होती है।
प्रश्न 10.
स्थिरक्वाथी मिश्रण में उपस्थित अवयवों को प्रभाजी आसवन द्वारा पृथक् नहीं किया जा सकता। क्यों?
उत्तर:
स्थिर क्वाथी मिश्रण में उपस्थित अवयव निश्चित अनुपात में होते हैं जो निश्चिंत ताप पर एक साथ उबलते हैं, अतः इन्हें प्रभाजी आसवन द्वारा पृथक् नहीं किया जा सकता।
प्रश्न 11.
समान ताप पर नाइट्रोजन की जल में विलेयता, हाइड्रोजन की तुलना में कम होती है तो किस गैस का हेनरी स्थिरांक अधिक है?
उत्तर:
नाइट्रोजन का हेनरी स्थिरांक अधिक है क्योंकि किसी गैस की
![]()
प्रश्न 12.
गैसों की द्रवों में विलेयता पर दाब का क्या प्रभाव
उत्तर:
दाब बढ़ाने पर गैसों की द्रवों में विलेयता बढ़ती है।
प्रश्न 13.
अमोनिया की बोतल को खोलने से पहले ठण्डा किया जाता है। क्यों?
उत्तर:
अमोनिया की बोतल को ठण्डा करने से उसका वाष्प दाब कम हो जाता है जिससे द्रव अमोनिया तेजी से बाहर नहीं निकलती ।
प्रश्न 14.
विलयन में विलेय की वियोजन की मात्रा तथा वान्ट हॉफ गुणक में क्या सम्बन्ध होता है ?
उत्तर:
∝ = \(\frac{i-1}{n-1}\)
∝ = वियोजन की मात्रा, n = वियोजन से प्राप्त कणों की संख्या तथा i = वान्टहॉफ गुणक ।
प्रश्न 15.
जल में थोड़ा-सा ग्लुकोस मिलाने पर इसके वाष्पदाब पर क्या प्रभाव होगा?
उत्तर:
ग्लुकोस मिलाने से जल का वाष्पदाब कम हो जाएगा क्योंकि ग्लुकोस अवाष्पशील पदार्थ है।
प्रश्न 16.
किसी विलयन के क्वथनांक उन्नयन (△Tb) तथा विलेय के मोलर द्रव्यमान में सम्बन्ध बताइए।
उत्तर:
△Tb, विलेय के मोलर द्रव्यमान के व्युत्क्रमानुपाती होता है।
![]()
प्रश्न 17.
प्रतिलोम परासरण कब होता है?
उत्तर:
जब विलयन पर परासरण दाब से अधिक दाब लगाते हैं तो प्रतिलोम परासरण होता है।
प्रश्न 18.
शर्करा तथा KCl के सममोलर विलयन समपरासरी होंगे या नहीं, तथा क्यों?
उत्तर:
शर्करा तथा KCl के सममोलर विलयन समपरासरी नहीं होते क्योंकि KCl वियोजित होकर दो आयन देता है जबकि शर्करा का वियोजन नहीं होता।
प्रश्न 19.
जल के लिए मोलल अवनमन (Kf) स्थिरांक 1.86 K Kg mol-1 होता है, इसका क्या तात्पर्य है?
उत्तर:
जल के लिए Kf = 1.86 का अर्थ है कि जब 1 मोल अवाष्पशील विलेय को 1 Kg विलायक में घोला जाता है तो जल के हिमांक में 1.86 K की कमी हो जाती है।
प्रश्न 20.
अण्डे के बाहरी खोल को हटाकर जब उसे लवण (NaCl) के संतृप्त विलयन में रखा जाता है, तो क्या होगा ?
उत्तर:
अण्डे में बाह्यपरासरण होगा जिसके कारण वह सिकुड़ जाता है।
प्रश्न 21.
मोललता तथा क्वथनांक उन्नयन में सम्बन्ध बताइए |
उत्तर:
क्वथनांक उन्नुयन तथा मोललता एक-दूसरे के समानुपाती होते हैं।
प्रश्न 22.
एक प्रतिहिम (Anti Freezing Agent) पदार्थ का उदाहरण दीजिए ।
उत्तर:
एथिलीन ग्लाइकॉल प्रतिहिम का कार्य करता है।
प्रश्न 23.
आइसोप्रोपिल ऐल्कोहॉल को त्वचा पर रगड़ने से शीतलन का अनुभव होता है, क्यों?
उत्तर:
आइसोप्रोपिल ऐल्कोहॉल वाष्पशील होता है अतः यह त्वचा से गुप्त ऊष्मा का अवशोषण करके वाष्प में परिवर्तित हो जाता है, जिसके कारण शीतलन का अनुभव होता है।
प्रश्न 24.
गले में सूजन होने पर साधारण नमक के पानी से गरारे करने की सलाह दी जाती है । क्यों?
उत्तर:
नमक का पानी अतिपरासरी (हाइपरटोनिक ) होता है, जिसके कारण यह गल में खिंचाव उत्पन्न करने वाले कारक को बाहर निकाल देता है।
प्रश्न 25.
जलीय जीवजन्तु गरम जल की अपेक्षा ठण्डे जल में अधिक आसानी से रहते हैं, क्यों ?
उत्तर:
ताप बढ़ाने पर गैसों की जल में विलेयता कम होती है अतः गरम जल में ऑक्सीजन की मात्रा कम होती है इसलिए जलीय जीवजन्तु गरम जल की अपेक्षा ठण्डे जल में अधिक आसानी से रहते हैं ।
लघूत्तरात्मक प्रश्न :
प्रश्न 1.
राउल्ट के नियम से धनात्मक विचलन की व्याख्या उदाहरण सहित कीजिए ।
उत्तर:
दो द्रव A तथा B के मिश्रण में धनात्मक विचलन होने पर A-B आकर्षण A-A तथा B-B के मध्य आकर्षण की तुलना में दुर्बल होता है। अर्थात् इस स्थिति में विलेय-विलायक अणुओं के मध्य अंतराआण्विक आकर्षण बल विलेय-विलेय और विलायक – विलायक अणुओं की तुलना में दुर्बल होते हैं। अतः इस प्रकार के विलयनों में से A अथवा B के अणु शुद्ध अवयव की तुलना में अधिक आसानी से निकल सकते हैं, जिसके कारण वाष्प दाब में वृद्धि होती है।
उदाहरण-एथेनॉल तथा ऐसीटोन का मिश्रण। शुद्ध एथेनॉल में अणुओं के हाइड्रोजन बंध होते हैं। इसमें ऐसीटोन मिलाने पर इसके अणु एथेनॉल के अणुओं के बीच में आ जाते हैं, जिसके कारण इनके बीच पहले से उपस्थित हाइड्रोजन बंध टूट जाते हैं। इससे अंतराआण्विक आकर्षण बल दुर्बल हो जाने के कारण यह मिश्रण राउल्ट के नियम से धनात्मक विचलन दर्शाता है।
प्रश्न 2.
राउल्ट के नियम से ऋणात्मक विचलन को उदाहरण सहित समझाइए |
उत्तर:
दो द्रव A तथा B के मिश्रण में ऋणात्मक विचलन की स्थिति में A-A तथा B-B के मध्य आर्कषण बल A-B की तुलना में दुर्बल होता है। इसके कारण वाष्पदाब कम हो जाता है। उदाहरण- फीनॉल तथा ऐनिलीन का मिश्रण। इस स्थिति में फीनॉलिक प्रोटॉन एवं ऐनिलीन के नाइट्रोजन परमाणु के एकाकी इलेक्ट्रॉन युग्म के मध्य अंतराआण्विक हाइड्रोजन बंध समान अणुओं के मध्य हाइड्रोजन बंध की तुलना में प्रबल होता है। इसी प्रकार से क्लोरोफॉर्म तथा ऐसीटोन का मिश्रण भी उल्ट के नियम से ऋणात्मक विचलन दर्शाता है। इसका कारण यह है कि क्लोरोफॉर्म, ऐसीटोन के साथ हाइड्रोजन बंध बना लेता है।
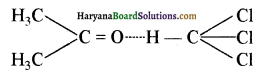
प्रश्न 3.
एक शीतल पेय पदार्थ जो कि कार्बोनेटीकृत है, की house बोतल को खोलने पर गैस के बुलबुले तेजी से बाहर निकलते हैं। क्यों?
उत्तर:
कार्बोनेटीकृत पेय की बोतल में उच्च दाब पर कार्बन डाइऑक्साइड (CO2) गैस भरी होती है। जब बोतल का ढक्कन खोला जाता है, तो यह गैस उच्च दाब से निम्न दाब की ओर तेजी से बाहर निकलती है। अतः गैस के बुलबुले बाहर की तरफ निकलते हुए दिखाई देते हैं।
प्रश्न 4.
NaOH की जल में विलेयता पर ताप का क्या प्रभाव होगा?
उत्तर:
NaOH का जल में विलयन बनना एक ऊष्माक्षेपी प्रक्रम है अतः ले-शातैलिए के नियमानुसार ऊष्माक्षेपी प्रक्रम हेतु ताप बढ़ाने पर साम्यावस्था पश्च दिशा में जाती है अर्थात् NaOH की विलेयता कम हो जाएगी।
प्रश्न 5.
ऐनॉक्सिया क्या है?
उत्तर:
ऐनॉक्सिया एक प्रकार की बीमारी है जो सामान्यतः अधिक ऊँचाई पर रहने वाले लोगों में पाई जाती है। इसमें व्यक्तियों के रक्त एव ऊतकों में ऑक्सीजन की सान्द्रता कम हो जाती है अतः वे कमजोर हो जाते हैं तथा उनकी सोचने की क्षमता में भी कमी आ जाती है।
प्रश्न 6.
एथिल ऐल्कोहॉल तथा साइक्लोहेक्सेन का मिश्रण, राउल्ट के नियम से धनात्मक विचलन दर्शाता है, क्यों?
उत्तर:
साइक्लोहेक्सेन के अणुओं के मध्य वान्डरवाल बल तथा एथिल ऐल्कोहॉल (एथेनॉल) के अणुओं के मध्य हाइड्रोजन बन्ध पाया जाता है लेकिन जब एथेनॉल तथा साइक्लोहेक्सेन को मिलाया जाता है तो एथेनॉल के अणुओं के मध्य उपस्थित हाइड्रोजन बन्ध टूट जाते हैं अर्थात् A-B आकर्षण, A-A तथा B-B आकर्षण से कम है अतः अणु दूर-दूर जाते हैं इसलिए यह धनात्मक विचलन का उदाहरण है।
प्रश्न 7.
राउल्ट के नियम की सीमाएँ बताइए ।
उत्तर:
- यह नियम केवल तनु विलयनों पर ही लागू होता है।
- विद्युत अपघट्यों के विलयनों पर यह नियम नहीं लगता है।
- जब विलयन में पदार्थ का संगुणन या वियोजन होता है तो भी राउल्ट का नियम नहीं लगता।
प्रश्न 8.
नमक के सान्द्र विलयन में ताजा अंगूर डालने पर वे सिकुड़ जाते हैं जबकि इन्हें पुन: जल में डालने पर ये फूल जाते हैं। क्यों?
उत्तर:
परासरण के कारण विलायक निम्न सान्द्रता युक्त विलयन से उच्च सान्द्रता वाले विलयन की ओर गमन करता है। यहाँ अंगूर की कोशिका झिल्ली, अर्धपारगम्य झिल्ली की तरह व्यवहार करती है अतः अंगूर को नमक के सान्द्र विलयन में रखने पर जल अंगूर से बाहर आ जाता है, जिसके कारण वे सिकुड़ जाते हैं तथा इन्हें पुनः जल में डालने पर जल अंगूर में प्रवेश कर जाता है अतः वे फूलकर पुनः ताजा हो जाते हैं।
![]()
प्रश्न 9.
हिमांक अवनमन विधि से अणुभार ज्ञात करने के लिए साधारण थर्मामीटर के स्थान पर विशिष्ट थर्मामीटर (बैकमान थर्मामीटर) का प्रयोग किया जाता है। क्यों?
उत्तर:
विलायक में विलेय मिलाने पर होने वाला हिमांक अवनमन बहुत कम मात्रा में होता है जिसका मापन साधारण थर्मामीटर द्वारा नहीं होता क्योंकि इसमें न्यूनतम माप 0.01°C से अधिक होती है जबकि बैकमान ने इस कार्य के लिए एक विशिष्ट थर्मामीटर बनाया जो बहुत संवेदी (Sensi- tive) होता है जिसमें न्यूनतम माप 0.01°C होती है जिससे कम मात्रा में होने वाले हिमांक अवनमन का भी मापन हो जाता है अतः हिमांक अवनमन विधि में साधारण थर्मामीटर के स्थान पर यह विशिष्ट थर्मामीटर (बैकमान थर्मामीटर) प्रयुक्त किया जाता है।
प्रश्न 10.
किसी पदार्थ के गलनांक तथा क्वथनांक से उसमें उपस्थित अशुद्धियों के बारे में जानकारी प्राप्त हो जाती है। इस कंथन की व्याख्या कीजिए ।
उत्तर:
शुद्ध अवस्था में प्रत्येक पदार्थ का गलनांक तथा क्वथनांक निश्चित होता है। जब इसमें अवाष्पशील अशुद्धि मिली होती है तो क्वथनांक में वृद्धि तथा गलनांक में कमी हो जाती है, अशुद्धि की मात्रा बढ़ने पर ये मान भी उसी अनुपात में परिवर्तित हो जाते हैं, अतः गलनांक तथा क्वथनांक के मान से किसी पदार्थ में उपस्थित अशुद्धियों की जानकारी प्राप्त हो जाती है ।
प्रश्न 11.
प्याज को सामान्य ताप पर काटने के बजाय फ्रिज में ठण्डा करने के बाद काटने से आँसू कम आते हैं। क्यों?
उत्तर:
प्याज को जब ठण्डा करते हैं तो उसमें उपस्थित वाष्पशील द्रव जिनके कारण आँसू आते हैं, का वाष्पदाब कम हो जाता है, अतः उनका वाष्पन कम होता है। अतः ठण्डे प्याज को काटने पर आँसू कम आते हैं।
प्रश्न 12.
क्वथनांक उन्नयन से किसी वाष्पशील पदार्थ का मोलर द्रव्यमान ज्ञात नहीं किया जा सकता। क्यों?
उत्तर:
क्वथनांक उन्नयन इत्यादि विधियाँ (अणुसंख्यक गुण) केवल अवाष्पशील पदार्थों के लिए ही उपयुक्त होती हैं क्योंकि विलयन में वाष्पशील पदार्थ मिलाकर गर्म किया जाता है तो वाष्पशील पदार्थ, वाष्प बनकर बाहर निकल जाता है, जिससे इसके कारण क्वथनांक में उन्नयन ही नहीं होगा अतः इस विधि से वाष्पशील पदार्थ का मोलर द्रव्यमान ज्ञात नहीं- कर सकते।
प्रश्न 13.
सर्दी के मौसम में गाड़ी के रेडिएटर में जल के साथ एथिलीन ग्लाइकॉल मिलाया जाता है। क्यों?
उत्तर:
सर्दी के मौसम में केवल जल को गाड़ी का इंजन ठण्डा करने में प्रयुक्त नहीं किया जा सकता क्योंकि जल 0°C (273K) पर ही जम जाता है जबकि 35% (V/V) एथिलीन ग्लाइकॉल के जलीय विलयन का हिमांक – 17.6°C होता है, अतः यह निम्न ताप पर भी नहीं जमता इसलिए इसे शीतलक (Coolant) के रूप में प्रयुक्त किया जाता है। यहाँ एथिलीन ग्लाइकॉल हिमरोधी (Anti Freezing Agent ) का कार्य करता है। अतः एथिलीन ग्लाइकॉल को सर्दी के मौसम में गाड़ी के रेडिएटर में जल के साथ मिलाया जाता है।
प्रश्न 14.
सड़कों पर जमी बर्फ को हटाने के लिए NaCl के स्थान पर CaCl2 लेना अधिक उपयुक्त है। क्यों?
उत्तर:
NaCl तथा CaCh2 दोनों ही प्रतिहिम कारक का कार्य करते हैं क्योंकि इनको मिलाने से जल का हिमांक कम हो जाता है लेकिन हिमांक अवनमन एक कण संख्यक गुण है जो कणों की संख्या पर निर्भर करता है। CaCl2 के आयनन से तीन आयन (Ca+2 तथा 2Cl–) प्राप्त होते हैं जबकि NaCl के आयनन से केवल दो आयन ही प्राप्त होंगे, अतः CaCl2 मिलाने पर बर्फ अधिक तेजी से पिघलती है क्योंकि हिमांक में अधिक कमी हो जाने के कारण बर्फ के जमने की प्रवृत्ति कम हो जाती है।
प्रश्न 15.
प्रेशर कुकर में भोजन जल्दी पकता है लेकिन पहाड़ों पर भोजन धीरे पकता है । इसकी व्याख्या कीजिए ।
उत्तर:
प्रत्येक द्रव का क्वथनांक निश्चित होता है तथा दाब बढ़ाने पर क्वथनांक में वृद्धि होती है। प्रेशर कुकर में दाब अधिक होने के कारण, जल का क्वथनांक बढ़ जाता है अतः यह अधिक ताप पर उबलता है जिसके कारण भोजन को अधिक ऊष्मा प्राप्त होती है इसलिए वह जल्दी पक जाता है जबकि पहाड़ों पर वायुमण्डलीय दाब कम होता है जिसके कारण क्वथनांक भी कम हो जाता है अतः पानी उबल तो जल्दी जाता है लेकिन भोजन को कम ऊष्मा प्राप्त होती है, जिससे वह धीरे पकता है ।
प्रश्न 16.
किसी विलायक के लिए मोलल उन्नयन स्थिरांक का मान निश्चित होता है। क्यों?
उत्तर:
मोलल उन्नयन स्थिरांक को निम्नलिखित सूत्र से ज्ञात किया जाता है-
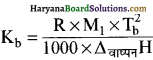
इस सूत्र में उपस्थित सभी मान, R ( विलयन स्थिरांक या गैस स्थिरांक), M1 ( विलायक का मोलर द्रव्यमान ), Tb ( विलायक का क्वथनांक) तथा △Hवाष्पन( वाष्पन एन्थैल्पी) किसी विलायक के लिए निश्चित होते हैं अतः मोलल उन्नयन स्थिरांक (Kb) का मान भी निश्चित होगा ।
प्रश्न 17.
केवल दूध से आइसक्रीम बनाने की तुलना में शर्करायुक्त दूध से आइसक्रीम बनाने में अधिक समय लगता है। क्यों?
उत्तर:
दूध में शर्करा (चीनी) मिलाने पर दूध का हिमांक कम हो जाता है (हिमांक अवनमन) अर्थात् दूध पहले की तुलना में कम ताप पर जमेगा अतः इससे आइसक्रीम बनाने में अधिक समय लगता है।
प्रश्न 18.
दो ग्राम शर्करा को 100 ग्राम जल में घोलने पर विलयन X तथा 2 ग्राम यूरिया को 100 ग्राम जल में घोलने पर विलयन Y प्राप्त होता है तो किस विलयन में क्वथनांक उन्नयन अधिक होगा तथा क्यों ?
उत्तर:
विलयन Y में क्वथनांक उन्नयन अधिक होगा क्योंकि यूरिया का अणुभार शर्करा के अणुभार से कम होता है अतः विलयन Y की मोललता, विलयन X की मोललता से अधिक होगी तथा क्वथनांक उन्नयन मोललता के समानुपाती होता है।
प्रश्न 19
(i) प्रतिहिम (Antifreezing agent) क्या होता है ?
(ii) विहिमीकारक (de-icing agent) किसे कहते हैं? समझाइए |
उत्तर:
- वह पदार्थ जिसे जल में मिलाने पर उसके हिमांक को कम कर देता है, उसे प्रतिहिम कहते हैं। उदाहरण – एथिलीन ग्लाइकॉल।
- वह पदार्थ जो जल के हिमांक को कम करता है तथा जिसे बर्फ पर डालने से बर्फ जल्दी पिघलती है, उसे विहिमीकारक कहते हैं, जैसे- – NaCl, CaCl2 इत्यादि ।
बोर्ड परीक्षा के दृष्टिकोण से सम्भावित महत्त्वपूर्ण प्रश्न :
प्रश्न 1.
राउल्ट के नियम से धनात्मक तथा ऋणात्मक विचलन दर्शाने वाले विलयनों के उदाहरण लिखिए।
उत्तर:
धनात्मक विचलन- एथेनॉल तथा ऐसीटोन से बना विलयन ऋणात्मक विचलन- नाइट्रिक अम्ल तथा जल से बना विलयन
प्रश्न 2.
‘परासरण’ और ‘परासरणी दाब’ पदों को परिभाषित कीजिए । अन्य अणुसंख्य गुणधर्मों की तुलना में परासरण दाब के उपयोग का विलयनों में विलेय पदार्थों के मोलर द्रव्यमान ज्ञात करने के लिए क्या लाभ होता है ?
उत्तर:
परासरण – प्रकृति तथा घर पर कई सामान्य घटनाएँ होती हैं जैसे वातावरण में जल की कमी से लचीली हुई गाजर को जल में रखने पर ताजा होना, मटर के सूखे दानों को जल में रखने पर उनकी फूलना, मुरझाए हुए फूलों को ताजे जल में रखने पर पुनः ताजा होना, कच्चे आम के टुकड़ों को नमक के जलीय विलयन में रखने पर उनका सिकुड़ना तथा लाल रुधिर कणिकाओं को लवण जल में रखने पर सिकुड़ना इत्यादि। ये सभी परासरण के उदाहरण हैं तथा इनमें सभी पदार्थ झिल्लियों युक्त हैं जिसे अर्धपारगम्य झिल्ली कहते हैं।
![]()
प्रश्न 3.
NaCl (मोलर द्रव्यमान = 58.5 g mol-1) की कितनी मात्रा 65 g जल में घोली जाए जिससे हिमांक में 7.5°C की गिरावट आ जाए ? जल के लिए हिमांक अवनमन स्थिरांक Kf, 1.86 K Kg mol-1 है। यह मानकर चलिए कि NaCl के लिए वाट हॉफ गुणक 1.87 है।
उत्तर:
हिमांक अवनमन

प्रश्न 4.
निम्नलिखित का कथन लिखिए-
(i) विलयनों के सन्दर्भ में सामान्य रूप में राउल्ट का नियम ।
(ii) मिश्रण में एक गैस के आंशिक दाब के सम्बन्ध में हेनरी का नियम ।
उत्तर:
- वाष्पशील द्रवों के विलयन में किसी अवयव का आंशिक दाब, विलयन में उसके मोल अंश के समानुपाती होता है।
- किसी विलयन में गैस का मोल अंश उस विलयन के ऊपर उपस्थित गैस के आंशिक दाब के समानुपाती होता है, अर्थात् किसी गैस का वाष्प अवस्था में आंशिक दाब (P) उस विलयन में गैस के मोल अंश (x) के समानुपाती होता है।
प्रश्न 5.
जल के 35.0 mL में जीन के एक खण्ड की 8.95 mg मात्रा घुलाकर विलयन बनाया गया, जिसका 25°C पर परासरण दाब 0.335.torr. है । यह मानते हुए कि जीन खण्ड विद्युत अपघट्य है, इसका आणव (मोलर) द्रव्यमान ज्ञात कीजिए ।
उत्तर:
परासरण दाब

अतः जीन खण्ड का मोलर द्रव्यमान = 14.218 kg.
प्रश्न 6.
निम्नलिखित पदों को परिभाषित कीजिए-
(a) (i) मोल प्रभाज (Mole fraction)
(ii) आदर्श विलयन
(b) एक अज्ञात आण्विक पदार्थ की 15.0 g मात्रा को जल 450g में घुलाया जाता है। प्राप्त विलयन – 0.34°C पर हिमीभूत होता है । पदार्थ का मोलर द्रव्यमान क्या है ? ( जल के लिए Kf = 1.86 K Kg mol-1)
अथवा
(a) निम्नलिखित को स्पष्ट कीजिए-
- एक द्रव में किसी गैस के घुलने के सम्बन्ध में हेनरी का नियम ।
- एक विलायक के लिए क्वथनांक उन्नयन स्थिरांक ।
(b) जल के 500 g में कुछ ग्लिसरॉल को घुलाकर ग्लिसरॉल (C3H8O3) का एक विलयन बनाया जाता है। इस विलयन का क्वथनांक 100.42°C है। इस विलयन को बनाने में ग्लिसरॉल की कितनी मात्रा घुलाई गई थी ? (जल के लिए Kb = 0.512K Kg mol-1)
उत्तर:
(a) (i) मोलरता – एक लीटर विलयन में घुले हुए विलेय के मोलों की संख्या को विलयन की मोलरता (M) कहते हैं।

यदि w ग्राम विलेय, V मिली विलयन में घुला हो तो
मोलरता (M) = \(\frac{\mathrm{W} \times 1000}{\mathrm{M} . \mathrm{W} \cdot \times \mathrm{V}}\)
M.W. = विलेय का अणुभार
उदाहरण- NaOH के 0.25 molL-1(0.25 M) विलयन का अर्थ है कि 0.25 मोल NaOH एक लीटर विलयन में घुला हुआ है।
(ii) आदर्श विलयन :
वह विलयन जो ताप तथा सान्द्रता के सभी मानों पर राउल्ट के नियम का पालन करता है, उसे आदर्श विलयन कहते हैं। एक पूर्ण रूप से आदर्श विलयन होना बहुत मुश्किल है लेकिन कुछ विलयन व्यवहार में लगभग आदर्श होते हैं। आदर्श विलयन के लिए आवश्यक शर्तें-
(i) विलयन बनने पर एन्थैल्पी परिवर्तन शून्य होता है अर्थात् इसके अवयवों को मिश्रित करने पर ऊष्मा का उत्सर्जन या अवशोषण नहीं होता, अर्थात् △Hमिश्रण = 0।
(ii) आयतन में परिवर्तन शून्य होता है अर्थात् विलयन का आयतन दोनों अवयवों के आयतन के योग के बराबर होता है, अर्थात् △Vमिश्रण = 0।
(iii) राउल्ट के नियम के अनुसार,
\(\mathrm{P}_{\text {कुल }}=\mathrm{p}_{\mathrm{o}} \mathrm{A}+\mathrm{p}_{\mathrm{B}}\)
\(\mathrm{p}_{\text {कुल }}=\mathrm{p}_{\mathrm{A}} \mathrm{X}_{\mathrm{A}}+\stackrel{\circ}{\mathrm{p}} \mathrm{B}_{\mathrm{B}} \mathrm{X}_{\mathrm{B}}\)
माना मिश्रण दो अवयव (द्रव) A तथा B से बना है जिनमें अन्तराआण्विक आकर्षण A-A तथा B-B प्रकार के हैं लेकिन द्विअंगी विलयन (मिश्रण) में A-A तथा B-B आकर्षण के साथ-साथ A-B प्रकार का आकर्षण भी होगा जो कि A-A तथा B-B के बीच अंतराआण्विक आकर्षण बल के ही समान होगा।
इसलिए △H=0 तथा △V=0, इसी कारण यह आदर्श विलयन बनाता है। अत: A-B आकर्षण = A-A आकर्षण तथा B-B आकर्षण।
आदर्श विलयनों के उदाहरण-
(i) n-हेक्सेन + n-हेप्टेन (n-C6H14 + n-C7H16)
(ii) बेन्जीन + टॉलूईन (C6H6 + C6H5 – CH3)
(iii) ब्रोमोएथेन + क्लोरोएथेन (C2H5Br + C2H5Cl)
(iv) कार्बन टेट्राक्लोरइड + सिलिकन टेट्रक्लोरइड (CCl4 + SiCl4)
(v) मेथिल ऐल्कोहॉल + एथिल एल्कोहॉल (CH3OH + C2H5OH)
(vi) क्लोरोबेन्जीन + ब्रोमोबेन्जीन (C6H5Cl + C6H5Br)
(b) हिमांक अवनमन
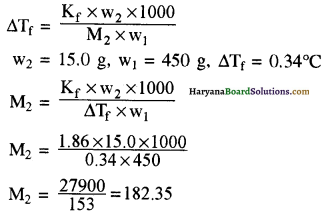
अतः पदार्थ का मोलर द्रव्यमान = 182.3
अथवा
(a)
- गैसों की द्रवों में विलेयता: भिन्न-भिन्न गैसों की जल या अन्य विलायकों में विलेयता भिन्न-भिन्न होती है। कुछ गैसें जल में अधिक्त मात्रा में घुल जाती हैं जब्वक्रि ऑक्सीजन जल में बहुत कम मात्रा में घुलती है तथा इसी घुली हुई ऑक्सीजन के कारण जलीय जीवन जीवित रहता है। गैसों की द्रव में विलेयता को अवशोषण गुणांक द्वारा समझा सकते हैं। निश्चित ताप तथा वायुमण्डलीय दाब पर किसी विलायक के निश्चित आयतन में घुली हुई गैस के मानक ताप व दाब (NTP) पर आयतन को उस गैस का अवशोषण गुणांक (Absorption Coefficient) कहते हैं।
- किसी विलायक का क्वथनांक उन्नयन स्थिरांक उस विलायक के क्वथनांक में वह वृद्धि है जो उसके 1 Kg में एक मोल अवाष्पशील विलेय मिलाने पर होती है।
(b) क्वथनांक उन्नयन

अतः ग्लिसरॉल की मात्रा = 37.7 ग्राम।
प्रश्न 7.
प्रतिलोम परासरण किसे कहते हैं? इसका एक उपयोग दीजिए।
उत्तर:
प्रतिलोम परासरण – विलयन पर परासरण दाब से अधिक बाहरी दाब लगाने पर शुद्ध विलायक, अर्धपारगम्य झिल्ली द्वारा विलयन से बाहर निकलता है अर्थात् परासरण की दिशा बदल जाती है, इसे प्रतिलोम परासरण कहते हैं। प्रतिलोम परासरण का उपयोग समुद्री जल के विलवणीकरण (Desalination) में किया जाता है।
प्रश्न 8.
यदि 10% (w/w) जलीय H2SO4 का घनत्व 1.84 ग्राम सेमी 3 है तो H2SO4 विलयन की मोललता की गणना कीजिए | (H2SO4 का मोलर द्रव्यमान = 98 ग्राम मोल-1 )
उत्तर:
मोललता

प्रश्न 9.
निम्नलिखित विलयनों को वान्ट हॉफ गुणक के बढ़ते क्रम में व्यवस्थित कीजिए-
0.1 M CaCl2, 0.1M KCl, 0.1 M Al2 (SO4)3, 0.1 M C12H22O11.
उत्तर:
उपर्युक्त विलयनों के वान्ट हॉफ गुणक का बढ़ता क्रम निम्नलिखित है-
C12H22O11 < KCl < CaCl2 < Al2(SO4)3
प्रश्न 10.
5g NaOH को 500 ml जल में घोला गया। विलयन की मोलरता ज्ञात कीजिए ।
उत्तर:
NaOH के मोल = 5g/40g mol-1 = 0.125 mol
विलयन का लीटर में आयतन = \(\frac{500 \mathrm{ml}}{1000 \mathrm{ml} \mathrm{L}^{-1}}\)
मोलरता = विलेय के मोल / विलयन का लीटर में आयतन
= \(\frac{0.125 \times 1000 \mathrm{ml} \mathrm{L}^{-1}}{500 \mathrm{ml}}\)
= o.25 M
प्रश्न 11.
एक प्रोटीन के 0.2 L जलीय विलयन में 1.26 g प्रोटीन है। 300 K पर इस विलयन का परासरण दाब 2.57 × 10-3 bar पाया गया। प्रोटीन के मोलर द्रव्यमान का परिकलन कीजिए। (R = 0.083 L bar mol-1 K-1)
उत्तर:
मोलर द्रव्यमान (M2) = \(\frac{W_2 \mathrm{RT}}{\Pi \mathrm{V}}\)
W2 = 1.26 g, R = 0.083 L bar mol-1 K-1
T = 300K, Π = 2.57 × 10-3 bar, V = 0.2 L
M2 = \(\frac{1.26 \mathrm{~g} \times 0.083 \mathrm{LbarK}^{-1} \mathrm{~mol}^{-1} \times 300 \mathrm{~K}}{2.57 \times 10^{-3} \mathrm{bar} \times 0.2 \mathrm{~L}}\)
M2 = 61038 g mol-1
अतः प्रोटीन का मोलर द्रव्यमान = 61038 g mol-1
![]()
प्रश्न 12.
(i) स्थिर क्वाथी मिश्रण को परिभाषित कीजिए ।
(ii) वाष्पशील घटकयुक्त विलयन के लिए राउल्ट के नियम की व्याख्या कीजिए तथा किस प्रकार राउल्ट का नियम, हेनरी के नियम की एक विशेष स्थिति है ?
उत्तर:
- दो या अधिक घटकों का वह मिश्रण जिसका संघटन द्रव तथा वाष्प अवस्था में होता है तथा जिसका क्वथनांक निश्चित होता है, उसे स्थिर क्वाथी मिश्रण कहते हैं।
- 2.4.1. द्रव-द्रव विलयना का वाष्प दाब – एक बंद पात्र में दो वाष्पशील द्रवों का विलयन लेते हैं तो इन द्रवों का वाष्पीकरण होगा तथा कुछ समय के बाद वाष्य अवस्था तथा द्रव अवस्था के मध्य साम्य स्थापित हो जाता है।
- माना दोनों द्रवों के आंशिक वाष्प दाब क्रमशः p1 p2 हैं तथा कुल दाब pकुल है, तो राउल्ट के नियम के अनुसार, वाष्पशील द्रवों के विलयन में किसी अवयव (द्रव) का आंशिक दाब, विलयन में उसके मोल अंश के समानुपाती होता है।
अतः प्रथम द्रव के लिए-
p1 ∝ x1
या \(\mathrm{p}_1=\mathrm{p}_1^0 \mathrm{x}_1\)
यहाँ \(\mathrm{p}_1^0\) = शुद्ध अवस्था में प्रथम घटक का समान ताप पर वाष्प दाब है। इसी प्रकार द्वितीय द्रव के लिए-
\(\mathrm{p}_2=\mathrm{p}_2^0 \mathrm{x}_2\)
यहाँ \(\mathrm{p}_2^0\) द्वितीय शुद्ध द्रव का वाष्प दाब है।डाल्टन के आंशिक दाब के नियम के अनुसार, पात्र में विलयन का कुल दाब \(\mathrm{p}_{\text {कुल }}\), विलयन के सभी अवयवों के आंशिक दाब के योग के बराबर होता है। अतः
\(\mathrm{p}_{\text {कुल }}\) = p1 + p2
p1 व p2 का मान रखने पर,

इस समीकरण से निम्नलिखित निष्कर्ष प्राप्त होते हैं-
(1) किसी विलयन के कुल वाष्प दाब को उसके किसी अवयव के मोल-अंश से संबंधित कर सकते हैं।
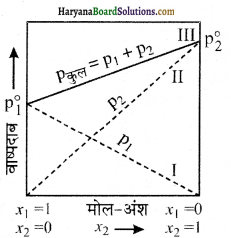
(2) किसी विलयन का कुल वाष्प दाब द्वितीय अवयव के मोल-अंश के साथ रेखीय रूप से बदलता है।
(3) शुद्ध अवयवों के वाष्प दाब पर निर्भर रहते हुए विलयन का कुल वाष्प दाब प्रथम अवयव के मोल-अंश के बढ़ने से कम या अधिक होता है।किसी विलयन के लिए p1 या p2 का x1 तथा x2 के मध्य आलेखित करने पर सीधी रेखा प्राप्त होती है। जब x1 व x2 का मान 1 होता है तो ये रेखाएँ (I व II) क्रमशः बिंदु \(\mathrm{p}_1^0\) व \(\mathrm{p}_2^0\) से होकर गुज़रती हैं। इसी प्रकार pकुल का x2 के साथ आलेख (लाइन III) भी रेखीय होता है। pकुल का न्यूनतम मान \(\mathrm{p}_1^0\) तथा इसका अधिकतम मान \(\mathrm{p}_2^0\) होगा। यहाँ प्रथम घटक द्वितीय घटक की तुलना में कम वाष्पशील है अर्थात् \(\mathrm{p}_1^0<\mathrm{p}_2^0\) |वाष्प अवस्था में संघटन – विलयन के साथ साम्य अवस्था में स्थित वाष्प प्रावस्था के संघटन का निर्धारण अवयवों के आंशिक दाब से किया जा सकता है। यदि y1 एवं y2 क्रमशः प्रथम एवं द्वितीय अवयव के वाष्पीय अवस्था में मोल-अंश हैं तो डाल्टन के आंशिक दाब के नियम के अनुसार

राउल्ट का नियम : हेनरी के नियम की एक विशेष स्थिति राउल्ट के नियम से
\(\mathrm{p}_{\mathrm{i}}=\mathrm{x}_{\mathrm{i}} \mathrm{p}_{\mathrm{i}}^0\)
अर्थात् किसी विलयन में उसके वाष्पशील अवयव का वाष्पदाब उसके मोल अंश के समानुपाती होता है। किसी द्रव में गैस के विलयन में गैसीय अवयव गैस के रूप में-ही रहता है जिसकी विलेयता हेनरी के नियम के अनुसार होती है।अतः p = KH.xअतः राउल्ट के नियम तथा हेनरी के नियम की तुलना करने पर यह निष्कर्ष निकलता है कि वाष्पशील घटक (गैस) का आंशिक दाब विलयन में उसके मोल-अंश के समानुपाती होता है, केवल समानुपातिक स्थिरांक KH एवं \(\mathrm{p}_{\mathrm{i}}^0\) में भिन्नता है। अतः राउल्ट का नियम, हेनरी के नियम की एक विशेष स्थिति है जिसमें KH तथा \(\mathrm{p}_{\mathrm{i}}^0\) के मान के बराबर हो जाते हैं।
प्रश्न 13.
(i) समपरासरी विलयन किसे कहते हैं?
(ii) आदर्श विलयन को परिभाषित कीजिए तथा इसका एक लक्षण बताइए।
(iii) मोलल उन्नयन स्थिरांक की परिभाषा दीजिए।
उत्तर:
- दिए गए ताप पर दो विलयन, जिनका परासरण दाब समान होता है, उन्हें ‘समपरासरी’ विलयन कहते हैं। इन विलयनों की मोलर सान्द्रता समान होती है।
- वह विलयन जो ताप तथा सान्द्रता के सभी मानों पर राउल्ट के नियम का पालन करता है, उसे आदर्श विलयन कहते हैं। आदर्श विलयन बनने पर एन्थैल्पी परिवर्तन शून्य होता है।
- 1000 g विलायक में एक मोल अवाष्पशील विलेय घुला होने पर क्वथनांक में जितनी वृद्धि होती है, उसे मोलल उन्नयन स्थिरांक कहते हैं।
प्रश्न 14.
(अ) (i) जल वाष्प दाब का क्या होगा यदि एक चम्मच चीनी उसमें डाल दी जाए?
(ii) वृहदअणुओं के मोलर द्रव्यमान ज्ञात करने के लिए कौन-सा अणुसंख्य गुणधर्म उपयुक्त है ?
(ब) क्या क्वथनांक का उन्नयन समान होगा यदि 0.1 मोल सोडियम क्लोराइड या 0.1 मोल चीनी को 1 लीटर जल में विलेय किया जाए? समझाइए ।
(स) क्या हम स्थिर क्वाथी मिश्रण के यौगिकों को प्रभाजी आसवन द्वारा पृथक् कर सकते हैं? समझाइए ।
उत्तर:
(अ)
- जल में एक चम्मच चीनी डालने पर उसका वाष्प दाब कम हो जाता है क्योंकि वाष्प दाब अवनमन कणों की संख्या पर निर्भर करता है तथा जल में चीनी डालने पर कणों की संख्या बढ़ जाती है।
- बृहदअणुओं के मोलर द्रव्यमान ज्ञात करने के लिए परासरण दाव विधि अधिक उपयुक्त है क्योंकि ये उच्च ताप पर स्थायी नहीं होते हैं तथा परासरण दाब कमरे के ताप पर ही ज्ञात किया जाता है एवं परासरण दाब का परिमाण भी अधिक होता है।
(च) 0.1 मील सोडियम क्लोराइड या 0.1 मोल चीनी को 1 लीटर जल में विलेय करने पर क्वथनांक का उन्नयन समान नहीं होगा क्योंकि चीनी का आयनन नहीं होता जबकि सोडियम क्लोराइड (NaCl) का आयनन होकर दुगुनी संख्या में आयन प्राप्त होंगे।
(स) स्थिर क्वाथी मिश्रण के यौगिकों को प्रभाजी आसवन द्वारा पृथक् नहीं किया जा सकता क्योंकि इस मिश्रण का व्वथनांक निश्चित होता है जिस पर मिश्रण में उपस्थित सभी यौगिक निश्चित अनुपात में एक साथ आसवित होते हैं। अतः इस मिश्रण के यौगिकों को स्थिर क्वाथी आसवन विधि द्वारा पृथक् किया जाता है।
प्रश्न 15.
विलयन की मोललता ज्ञात करने का सूत्र लिखिये ।
उत्तर:
विलयन की मोललता को निम्नलिखित सूत्र से ज्ञात किया जाता है-
![]()
प्रश्न 16.
400 K तापक्रम पर किसी विलयन का परासरण दाब 0.0821 वायुमण्डल है तो विलयन की सान्द्रता मोल / लीटर में ज्ञात कीजिए। [R 0.0821 L atm K-1 mol-1]
उत्तर:
परासरण दाब Π = CRT
Π = 0.0821 वायुमण्डल,
R = 0.0821 L atm K-1 mol-1
T = 400K
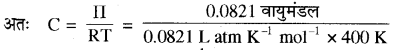
C = 0.0025 mol L-1
प्रश्न 17.
(i) क्या कारण है कि जलीय जीव ठण्डे जल में अधिक अच्छा महसूस करते हैं अपेक्षाकृत गर्म जल में?
(ii) क्या होता है जब हम रक्त सेल को नमकीन जल के विलयन (अतिपरासरणदाबी विलयन) में रखते हैं? कारण बताइए।
उत्तर:
- जलीय जीव गर्म जल की अपेक्ष ठण्डे जल में अधिक अच्छा महसूस करते हैं क्योंकि ताप बढ़ने पर गैसों की जल में विलेयता कम होती है जिसके कारण जल में ऑक्सीजन की मात्रा कम हो जाती है।
- जब रक्त सेल को नमकीन जल के विलयन (अतिपरासरण- दात्री विलयन) में रखा जाता है तो परासरण के कारण रक्त सेल संकुचित हो जाती हैं अर्थात् जल रक्त सेल से बाहर आ जाता है।
प्रश्न 18.
20°C पर जल का वाष्प दाब 17.5 mm Hg है। ग्लूकोस (मोलर द्रव्यमान = 180 gmol-1) का 15 g जल के घुला हो, तो 20°C पर जल का वाष्प दाब परिकलित कीजिए ।
उत्तर:
\(\frac{\mathrm{P}_1^0-\mathrm{P}_1}{\mathrm{P}_1^0}\) = \(\frac{\mathbf{W}_2 \times \mathbf{M}_1}{\mathbf{M}_2 \times \mathbf{W}_1}\)
\(\mathrm{P}_1^0\) = शुद्ध जल का वाष्प दाब = 17.5 mm Hg
P1 = विलयन का वाष्प दाब = ?
W1 = 150 g, W2 = 15 g, M1 = 18 g mol-1
M2 = 180g mol-1
अतः = \(\frac{17.5 \mathrm{~mm} \mathrm{Hg}-\mathrm{P}_1}{17.5 \mathrm{~mm} \mathrm{Hg}}\) = \(\frac{15 \mathrm{~g} \times 18 \mathrm{~g} \mathrm{~mol}^{-1}}{180 \mathrm{~g} \mathrm{~mol}^{-1} \times 150 \mathrm{~g}}\)
\(\frac{17.5-\mathrm{P}_1}{17.5}\) = \(\frac { 270 }{ 27000 }\)
\(\frac{17.5-P_1}{17.5}\) = 0.01
17.5 – P1 = 17.5 × 0.01
17.5 – P1 = 0.175
P1 = 17.5 – 0.175
P1 = 17.325mm Hg
अतः 20°C पर ग्लूकोसयुक्त जल का वाष्प दाब (P1) = 17.325 mm Hg.