Haryana State Board HBSE 11th Class Chemistry Solutions Chapter 12 कार्बनिक रसायन : कुछ आधारभूत सिद्धांत तथा तकनीकें Textbook Exercise Questions and Answers.
Haryana Board 11th Class Chemistry Solutions Chapter 12 कार्बनिक रसायन : कुछ आधारभूत सिद्धांत तथा तकनीकें
प्रश्न 1.
निम्नलिखित यौगिकों में प्रत्येक कार्बन की संकरण अवस्था बताइये-
(i) CH2 = C = O
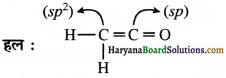
(ii) CH3CH=CH2
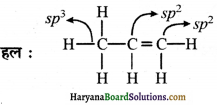
(iii) (CH3)2CO
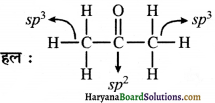
(iv) CH2 = CHCN
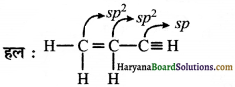
(v) C6H6
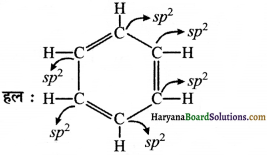
निष्कर्ष-
(1) यदि कार्बन परमाणु चार एकल बन्ध से जुड़ा है तो संकरण sp3 होगा।
(2) यदि कार्बन परमाणु पर दो एकल एक द्विबन्ध है, तो संकरण sp2 होगा।
(3) यदि कार्बन परमाणु पर एक एकल बन्ध तथा एक त्रिबन्ध है तो संकरण sp होगा।
(4) यदि कार्बन परमाणु पर दो द्विबन्ध उपस्थित हैं तो संकरण sp होगा।
प्रश्न 2.
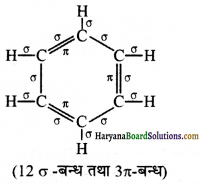
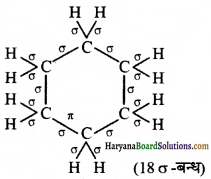
निम्नलिखित अणुओं में σ तथा π-आबन्ध दर्शाइए C6H6, C6H12, CH2Cl2,
CH2=C=CH2,CH3NO2,HCONHCH3
उत्तर:
(i) C6H6
(ii) C6H12
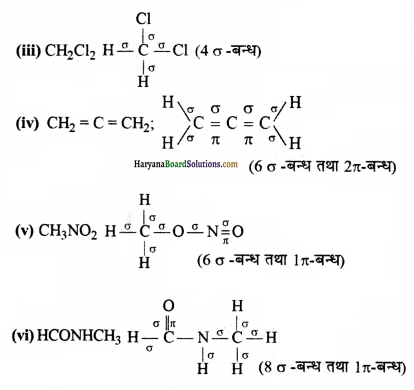
![]()
प्रश्न 3.
निम्नलिखित यौगिकों के आबन्ध-रेखा-सूत्र लिखिएआइसोप्रोपिल ऐे पेहॉल, 2, 3-डाइमेथिल ब्यूटेनल, हेप्टेन-4-ओन
उत्तर:
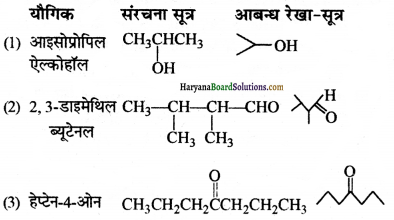
प्रश्न 4.
निम्नलिखित यौगिकों के IUPAC नाम लिखिए-
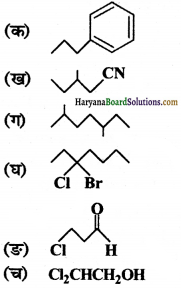
उत्तर:
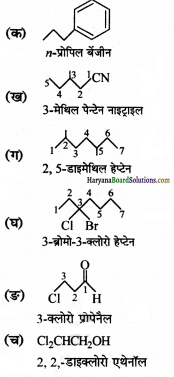
प्रश्न 5.
निम्नलिखित यौगिकों में से कौन-सा नाम IUPAC पद्धति के अनुसार सही है ?
(क) 2, 2-डाइमेथिलपेण्टेन अथवा 2-डाइमेथिलपेण्टेन
(ख) 2,4,7-ट्राइमेथिलऑक्टेन अथवा 2,5,7-ट्राइमेथिल ऑक्टेन
(ग) 2-क्लोरो-4-मेथिलपेण्टेन अथवा 4-क्लोरो-2-मेथिलपेण्टेन
(घ) ब्यूट-3-आइन-1-ऑल अथवा ब्यूट-4-ऑल-1-आइन
उत्तर:
(क) 2,2 -डाइमेथिलपेन्टेन सही है :
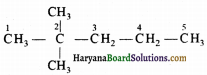
(ख) 2,4,7-ट्राइमेथिलऑक्टेन सही है :
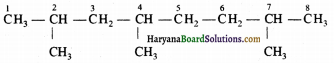
(ग) 2-क्लोरो-4-मेथिलपेण्टेन सही है :
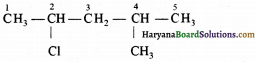
(घ) ब्यूट-3-आइन-1-ऑल सही है :
![]()
प्रश्न 6.
निम्नलिखित दो सजातीय श्रेणियों में से प्रत्येक के प्रथम पाँच सजातों के संरचना-सूत्र लिखिए-
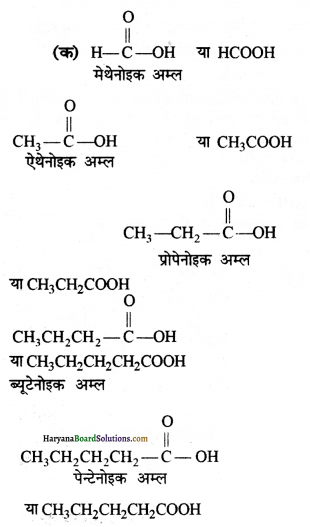
(क) H – COOH
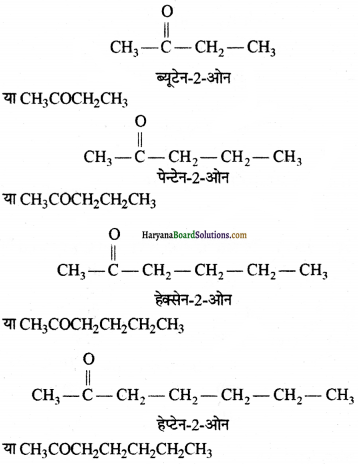
(ख) CH3COCH3
(ग) H – CH = CH2
उत्तर:
(ख) CH3COCH3
प्रोपेन-2-ओन
(ग) H – CH = CH2
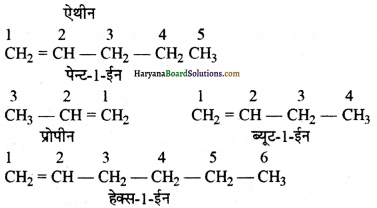
प्रश्न 7.
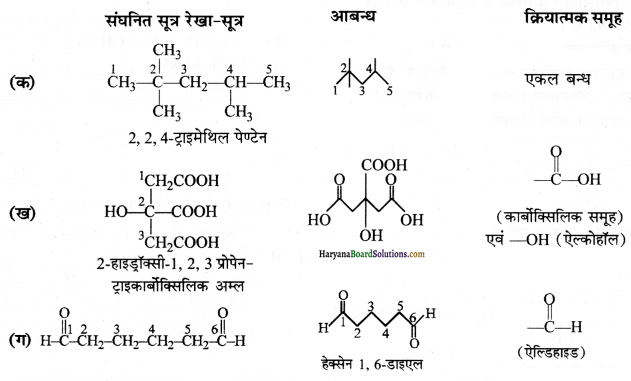
निम्नलिखित के संघनित और आबन्ध रेखा-सूत्र लिखिए तथा यदि कोई क्रियात्मक समूह हो तो उसे पहचानिए-
(क) 2, 2, 4-ट्राइमेथिल पेण्टेन
(ख) 2-हाइड्रॉक्सी-1, 2,3 -प्रोपेनट्राइकार्बोक्सिलिक अम्ल
(ग) हेक्सेनडाइएल
उत्तर:
प्रश्न 8.
निम्नलिखित यौगिकों में क्रियात्मक समूह पहचानिए-
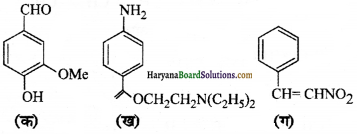
उत्तर:
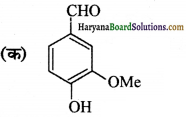
क्रियात्मक समूह-इस यौगिक में ऐल्कोहॉल, ईथर, ऐल्डिहाइड समूह उपस्थित है।
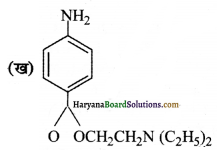
क्रियात्मक समूह-इस यौगिक में ऐमीनो, एस्टर, तृतीय-ऐमीन समूह उपस्थित हैं।
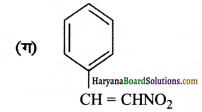
क्रियात्मक समूह-इस यौगिक में नाइट्रो एवं द्विबन्ध समूह उपस्थित हैं।
प्रश्न 9.
निम्नलिखित में से कौन अधिक स्थायी है तथा क्यों ?
O2NCH2CH2O– और CH3CH2O–
उत्तर:
दिये गये दोनों आयनों में से O2NCH2CH2O– अधिक स्थायी हैं क्योंकि यहाँ पर -I प्रभाव वाला -NO2 समूह जुड़ा हुआ है, जो ऋणायन पर ऋण आवेश को घटा देता है जिससे आयन का स्थायित्व बढ़ जाता है। जबकि दूसरे आयन CH3CH2O– में एक +I प्रभाव वाला CH3 समूह जुड़ा हुआ है, जो ऋणायन पर ऋण आवेश की मात्रा को बढ़ा देता है जिससे वह अस्थायी हो जाता है।
प्रश्न 10.
π-निकाय से आबन्धित होने पर ऐल्किल समूह इलेक्ट्रॉन दाता की तरह व्यवहार प्रदर्शित क्यों करते हैं ? समझाइए।
उत्तर:
ऐल्किल समूह sp3 संकरित होता है तथा जब यह π-निकाय से आबन्धित होता है तो इसमें sp2 संकरण हो जाता है। हम जानते हैं कि जैसे-जैसे s-गुण या s की प्रतिशतता बढ़ती है वैसे-वैसे विद्युत ऋणात्मकता बढ़ जाती है अतः π-निकाय से आबन्धित होने पर यह इलेक्ट्रॉन दाता की तरह व्यवहार करने लगता है।
प्रश्न 11.
निम्नलिखित यौगिकों की अनुनाद संरचना लिखिए तथा इलेक्ट्रॉनों का विस्थापन मुड़े तीरों की सहायता से दर्शाइए-
(क) C6H5OH
(ख) C6H5NO2
(ग) CH3CH = CHCHO
(घ) C6H5-CHO
(ङ) C6H5-CH2+
(च) CH3CH = CHC+H2
उत्तर:
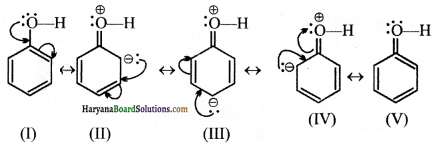
(क) C6H5OH की अनुनाद संरचना
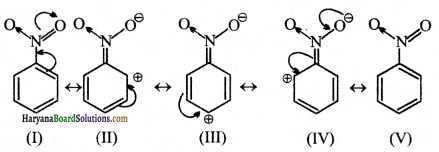
(ख) C6H5NO2 की अनुनाद संरचना
(ग) CH3CH=CHCHO की अनुनाद संरचना
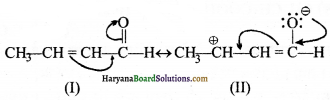
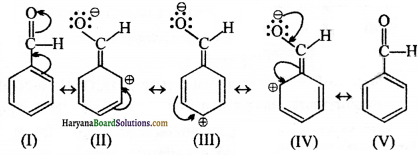
(घ) C6H5CHO की अनुनाद संरचना
(ङ) \(\mathrm{C}_6 \mathrm{H}_5 \mathrm{CH}_2^{+}\) की अनुनाद संरचना
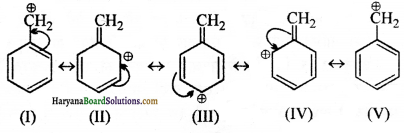
(च) CH2CH = \(\mathrm{CHCH}_2^{+}\) की अनुनाद संरचना

![]()
प्रश्न 12.
इलेक्ट्रॉन स्नेही तथा नाभिक स्नेही क्या है ? उदाहरण सहित समझाइए ?
उत्तर:
इलेक्ट्रॉन स्नेही अभिकर्मक (Electro philic reagent) – ऐसे अभिकर्मकों के एक परमाणु पर इलेक्ट्रॉन की कमी रहती है। इलेक्ट्रॉन की कमी वाले परमाणु की उपस्थिति की वजह से यह ऐसे स्रोतों के साथ अभिक्रिया करते हैं, जहाँ इलेक्ट्रॉन की अधिकता रहती है। इस कारण इन्हें इलेक्ट्रॉन स्नेही (Electrophiles) कहा जाता है।
(A) इलेक्ट्रॉनिक स्नेही अभिकभेक के प्रकार –
- धनात्मक इलेक्ट्रॉन स्नेही (E+) – इनमें इलेक्ट्रॉनों की कमी होती है एवं इनके ऊपर धनात्मक आवेश होता है। जैसे-कार्बोनियम आयन, क्लोरोनियम आदि। इनके बाह्मतम कोश में 6 इलेक्ट्रॉन पाये जाते हैं एवं इनमें दो इलेक्ट्रॉनों की कमी होती है।

- उदासीन इलेक्ट्रॉन स्ने ही (E) – इनके ऊपर कोई भी आवेश नहीं होता है परन्तु इनमें इलेक्ट्रॉनों की कमी होती है। जैसे- BF3, AlCl3, SO3, FeCl3 आदि। इलेक्ट्रॉन स्नेही सदैव अभिकारक के इलेक्ट्रॉन समूह वाले केन्द्र पर आक्रमण करते हैं।
प्रश्न 13.
निम्नलिखित समीकरणों में रेखांकित अभिकर्मकों को नाभिकस्नेही तथा इलेक्ट्रॉनस्नेही में वर्गीकृत कीजिए-
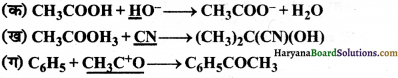
उत्तर:
(क) OH– नाभिकस्नेही है क्योंकि इस पर ऋण आवेश है तथा हाइड्रोजन से संयोग कर H2O बनाता है।

(ख) CN– नाभिकस्नेही है क्योंकि इस पर ऋण आवेश है तथा यह कार्बन से संयोग करता है जिस पर धनावेश उत्पन्न होता है।
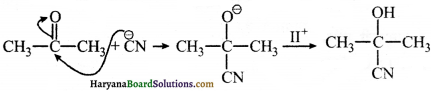
(ग) CH3CO+ इलेक्ट्रॉनस्नेही हैं क्योंकि इस पर धनावेश है।
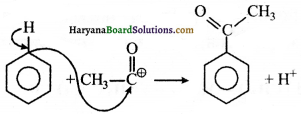
प्रश्न 14.
निम्नलिखित अभिक्रियाओं को वर्गीकृत कीजिए-
(क) CH3CH2Br + HS– → CH3CH2SH + Br–
(ख) (CH3)2C = CH2 + HCl → (CH3)2ClC – CH3
(ग) CH3CH2Br + HO– → CH2 = CH2 + H2O + Br–
(घ) (CH3)3C – CH2OH + HBr → (CH3)2CBrCH2CH3 + H2O
उत्तर:
(क) नाभिकस्नेही प्रतिस्थापन अभिक्रिया।
(ख) इलेक्ट्रॉनस्नेही संकलन अभिक्रिया।
(ग) द्विआण्विक निराकरण अभिक्रिया
(घ) नाभिकस्नेही प्रतिस्थापन अभिक्रिया (पुर्नव्यवस्थापन सहित)
प्रश्न 15.
निम्नलिखित युग्मों में सदस्य-संरचनाओं के मध्य कैसा सम्बन्ध है? क्या ये संरचनाएँ संरचनात्मक या ज्यामितीय समावयवी अथवा अनुनाद संरचनाएँ हैं ?
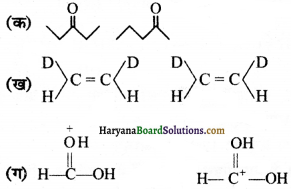
उत्तर:
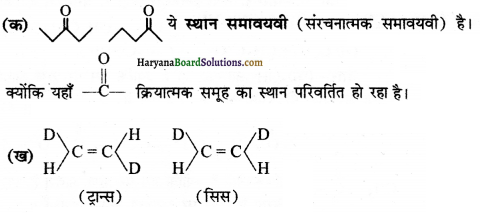
ये ज्यामितीय समावयवी हैं। इसमें एक सिस समावयवी तथा एक ट्रान्स समावयवी है।
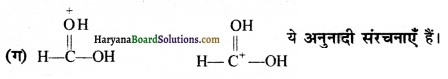
प्रश्न 16.
निम्नलिखित आबन्ध विदलनों के लिए इलेक्ट्रॉन विस्थापन को मुड़े तारों द्वारा दर्शाएँ तथा प्रत्येक विदलन को समांश अथवा विषमांश में वर्गीकृत कीजिए। साथ ही निर्मित सक्रिय मध्यवर्ती उत्पादों में मुक्त-मूलक, कार्बधनायन तथा कार्बत्रणायन पहचानिए-
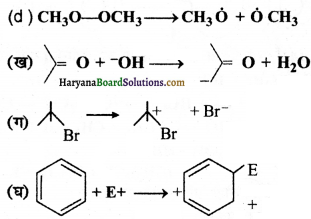
उत्तर:
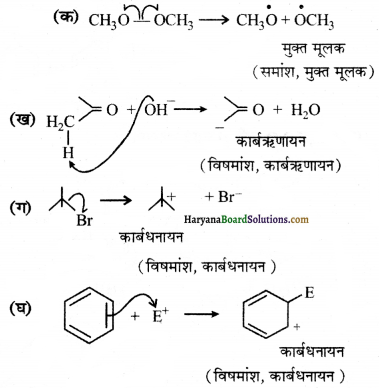
प्रश्न 17.
प्रेरणिक तथा इलेक्ट्रोमेरिक प्रभावों की व्याख्या कीजिए। निम्नलिखित कार्बोक्सिलिक अम्लों की अम्लता का सही क्रम कौन-सा इलेक्ट्रॉन-विस्थापन वर्णित करता है ?
(क) Cl3CCOOH>Cl2CHCOOH>ClCH2COOH
(ख) CH3CH2COOH>(CH3)2CHCOOH>(CH3)3C.COOH
उत्तर:
जब सह-संयोजन बन्ध दो भिन्न विद्युत ऋणात्मकता वाले परमाणुओं के मध्य होता है तो साझे का इलेक्ट्रॉन युग्म दोनों परमाणुओं के मध्य न रहकर यह अधिक विद्युत ऋणी परमाणु की तरफ विस्थापित हो जाता है। इसी विस्थापन के फलस्वरूप अधिक विद्युत ऋणी परमाणु के ऊपर आंशिक ऋणावेश एवं कम विद्युत ऋणी परमाणु पर आंशिक धनावेश उत्पन्न हो जाता है।
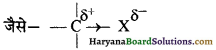
कार्बन श्रंखला में यह आवेश निम्न प्रकार उत्पन्न होता है-
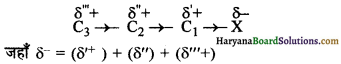
इस प्रभाव को I द्वारा प्रदर्शित करते है। यह दो प्रकार का होता है-
(A) प्रकार (Types) यह दो प्रकार का होता है।
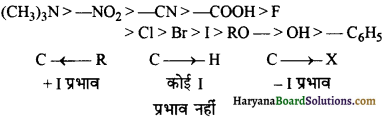
(i) + I प्रभाव (+ I Effect) – जब कार्बन के साथ कोई इलेक्ट्रॉन प्रतिकर्षित करने वाला समूह जुड़ा रहता है तो साझे के इलेक्ट्रॉन युग्म कार्बन की तरफ विस्थापित हो जाते हैं। इसी प्रभाव को +I या धनात्मक प्रेरणिक प्रभाव कहते हैं। ऐल्किल समूह के द्वारा + I प्रभाव प्रदर्शित किया जाता है।
विभिन्न ऐल्किल समूहों द्वारा उत्पन्न प्रभाव की तीव्रता का क्रम निम्नलिखित है-
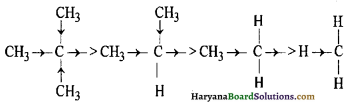
(ii) -I प्रभाव (-I Effect) – जब कार्बन के साथ इलेक्ट्रॉन आकर्षित करने वाला समूह जुड़ा रहता है तो साझे का इलेक्ट्रॉन युग्म कार्बन परमाणु से दूर विस्थापित हो जाता है। इसी प्रभाव को – I प्रभाव या ऋणात्मक प्रेरणिक प्रभाव कहते हैं। ऋणात्मक प्रेरणिक प्रभाव उत्पन्न करने वाले कुछ समूहों के उदाहरण एवं उनकी तीव्रता का क्रम इस प्रकार है-
(B) प्रेरणिक प्रभाव की विशेषताएँ – प्रेरणिक प्रभाव बन्धों में ध्रुवता करता है। इसकी निम्न विशेषताएँ हैं-
(i) C-H बन्ध में कार्बन एवं हाइड्रोजन की विद्युत ऋणात्मकता का मान लगभग समान होता है। अत: C-H बन्ध के मध्य प्रेरणिक प्रभाव नहीं होता है।
(ii) प्रेरणिक प्रभाव सदैव कार्बन परमाणु एवं एक विद्युत ऋणी परमाणु या समूह के मध्य केवल एक इलेक्ट्रॉन युग्म के साझे से उत्पन्न होता है।
(iii) कार्बन श्रृंखला की लम्बाई बढ़ने के साथ-साथ इलेक्ट्रॉन विस्थापन घटता जाता है अर्थात् C-X बंध से दूरी बढ़ने के साथ कार्बन परमाणुओं पर आने वाला आवेश घटता जाता है तथा तीसरे कार्बन के बाद यह प्रभाव नगण्य हो जाता है।
![]()
यह प्रभाव तीर ![]() के द्वारा प्रदर्शित किया जाता है जो कि अधिक विद्युत ऋणी की ओर रहता है।
के द्वारा प्रदर्शित किया जाता है जो कि अधिक विद्युत ऋणी की ओर रहता है।
(C) प्रेरणिक प्रभाव के अनुप्रयोग (Uses of Inductive Effect) – प्रेरणिक प्रभाव के मुख्य अनुप्रयोग निम्नलिखित हैं-
- यह कार्बनिक यौगिकों के सहसंयोजक बंधों के मध्य ध्रुवता की व्याख्या करता है।
- अभिक्रिया मध्यवर्तियों जैसे-कार्बोनियम आयन, कार्बेनायन इत्यादि की स्थायित्व की भी व्यख्या करता है।
- यह अम्लों एवं क्षारों की प्रबलता भी स्पष्ट करता है।
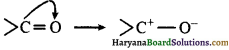
इलेक्ट्रोमेरिक पभाव: ऐसे यौगिक जिनमें द्विबंध या त्रिक बंध (double bond or triple bond) होता है, के π इलेक्ट्रॉन आक्रमणकारी अभिकर्मक (attacking reagent) की उपस्थिति में अधिक विद्युत ऋणी तत्त्व पर स्थानान्तरित हो जाते हैं तथा यौगिक में पूर्ण धन एवं ऋण आवेश उत्पन्न हो जाता है। इस प्रभाव को इलेक्ट्रोमेरिक (Electromeric effect) प्रभाव कहते हैं।
उदाहरण – जब CN– कार्बोनिल समूह (> C = O) के कार्बन पर आक्रमण करता है तो π बंध का इए न्ट्रॉन युग्म ऑक्सीजन परमाणु पर पूर्णतया स्थानान्तरित हो जाता है।
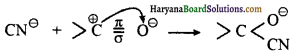
अतः द्विबंध या त्रिक बंध में उपस्थित साझे के इलेक्ट्रॉन युग्मों का आक्रमणकारी अभिकर्मक की उपस्थिति में अधिक विद्युत ऋणी तत्त्व पर स्थानान्तरित हो जाने की क्रिया को इलेक्ट्रोमेरिक प्रभाव (Electromeric Effect) कहते हैं। यह प्रभाव आक्रमणकारी अभिकर्मक की उपस्थिति तक ही रहता है, अतः यह प्रभाव अस्थायी होता है।
इलेक्ट्रोमेरिक प्रभाव दो प्रकार का होता है।
(i) +E प्रभाव
(ii) – E प्रभाव
(i) धनात्मक इलेक्ट्रोमेरिक प्रभाव (+ E प्रभाव) – इस प्रभाव में बहुआबंध के π – इलेक्ट्रॉनों का स्थानांतरण उस परमाणु पर होता है, जिससे आक्रमणकारी अभिकर्मक बंधित होता है। उदाहरणार्थ-
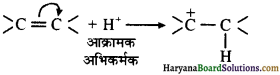
(ii) ऋणात्मक इलेक्ट्रोमेरिक प्रभाव (- E प्रभाव)—इस प्रभाव में बहुआबंध के π – इलेक्ट्रॉनों का स्थानांतरण उस परमाणु पर होता है, जिससे आक्रमणकारी अभिकर्मक बंधित नहीं होता है। उदाहरणार्थ-
इलेक्ट्रोमेरिक प्रभाव के आधार पर द्विबंध या त्रिकबंध युक्त यौगिकों के विभिन्न योग अभिक्रियाओं की व्याख्या की जा सकती है।
उदाहरण-ऐथीन(CH2 = CH2) की क्रिया HBr से निम्न प्रकार होती है।

जब प्रेरणिक तथा इलेक्ट्रोमेरिक प्रभाव एक-दूसरे की विपरीत दिशाओं में कार्य करते हैं, तब इलेक्ट्रोमेरिक प्रभाव प्रबल होता है।
(क) हैलेजेन परमाणुओं की संख्या घटने पर समग्र – I प्रभाव घटता है तथा अम्लीय सामर्थ्य घटती है।
Cl3CCOOH>Cl2CHCOOH>ClCH2COOH
(ख) ऐल्किल समूहों की संख्या बढ़ने पर +I प्रभाव बढ़ता है तथा अम्लीय सामर्थ्य घटती है।
CH3CH2COOH>(CH3)2CHCOOH>(CH3)3C.COOH
यह इलेक्ट्रॉन दाता प्रेरणिक प्रभाव (+1) दर्शाता है।
![]()
प्रश्न 18.
प्रत्येक का एक उदाहरण देते हुए निम्नलिखित प्रक्रमों के सिद्धान्तों का संक्षिप्त विवरण दीजिए-
(क) क्रिस्टलन,
(ख) आसवन,
(ग) क्रोमेटोग्राफी।
उत्तर:
(क) क्रिस्टलन:
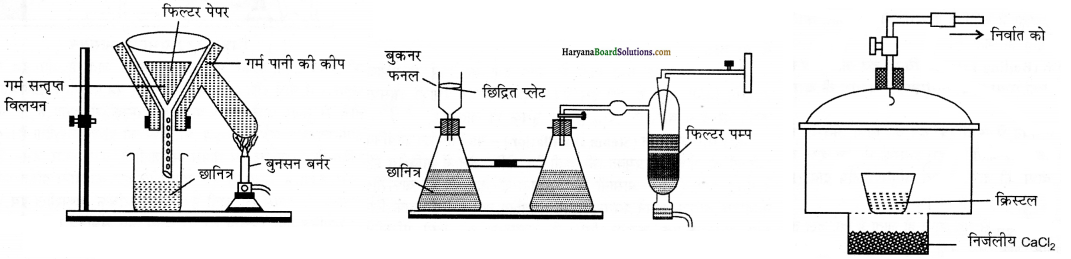
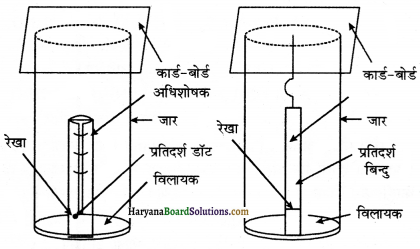
ठोस कार्बनिक पदार्थों के शोधन के लिये इस विधि को प्रयोग में लाया जाता है। यह विधि कार्बनिक यौगिक तथा अशुद्धि की किसी एक उपयुक्त विलायक में इनकी विलेयताओं में निहित अंतर पर आधारित होती है। अशुद्ध यौगिक को किसी एक ऐसे विलायक में घोलते हैं जिसमें यौगिक सामान्य ताप पर अल्प-विलेय परन्तु उच्च ताप पर अधक विलेय होता है। यौगिक को घोलने के पश्चात् उसे सान्द्रित करते हैं तथा इतना सान्द्रित करते हैं कि विलयन संतृप्त हो जाये। अब विलयन को ठण्डा करने पर शुद्ध पदार्थ क्रिस्टलित हो जाता है, जिसे मातृ द्रव से पृथक् कर लेते हैं।
बचे हुये मातृ द्रव में अशुद्धियों तथा यौगिक की अल्प मात्रा रह जाती है। यदि यौगिक किसी एक विलायक में अत्यधिक विलेय तथा अन्य में अल्प विलेय होता है तब की उचित मात्रा में इन विलायकों को मिश्रित करके किया जाता है। सक्रियित काष्ठ कोयले की सहायता से बने हुये विलयन में से रंगीन अशुद्धियों को दूर किया जाता है। इस प्रकार बार-बार क्रिस्टलन करके यौगिक को शुद्ध किया जाता है।
उदाहरणार्थ-कार्बनिक पदार्थ। जैसे- कार्बन टेट्राक्लोराइड (CCl4), बेन्जीन (C6H6), ऐल्कोहॉल, ऐसीटोन, क्लोरोफॉर्म (CHCl3) आदि। क्रिस्टलन में प्रयुक्त होने वाले उपकरणों को निम्न चित्रों दिखाया गया है।
(ख) आसवन:
द्रव कार्बनिक यौगिकों का शोधन प्रायः आसवन विधियों द्वारा किया जाता है। “किसी द्रव को गर्म करके वाष्प में परिवर्तन करने तथा वाष्प को ठण्डा करके फिर से द्रव में बदलने की क्रिया को आसवन कहते हैं। आसवन में वाष्पन तथा संघनन दोनों प्रक्रियाएँ होती हैं।”
आसवन = वाष्पन + संघनन
ऐसे कार्बनिक पदार्थ, जो सामान्य ताप पर द्रव अवस्था में होते हैं या जिनके क्वथनांक बहुत कम या बहुत अधिक नहीं होते हैं, का शोधन एवं पृथक्करण आसवन विधि द्वारा किया जाता है। केवल उन्हीं पदार्थों को उनके मिश्रण से अलग किया जाता है, जो परस्पर विलेय होते हैं। इसकी निम्न विधियाँ होती है।
- साधारण आसवन
- प्रभाजी आसवन
- भाप आसवन
- निर्वात आसवन या कम दाब पर आसवन
(1) साधारण आसवन (Simple Distillation)-इस विधि की सहायता से ऐसे दो द्रवों का लिश्रण जिनके हो, को पृथक् कर सकते हैं। भिन्न ववधनांक। बाले द्रव भिन्न ताष पर वाष्पित होते हैं। वाष्पों को ठण्डा करने से प्राप्त द्रवों को अलग-अलगं एकत्र कर लेते हैं। क्लोरोफार्म (क्वथनांक 334K) और ऐनिलीन (क्वथनांक 457K) का साधारण आसवन विधि द्वारा आसानी से पृथक् कर सकते हैं।
विधि-द्रव-मिश्रण को चित्रानुसार एक गोल पेंदे के फ्लास्क में लेकर बर्नर की सहायता से धीरे-धीरे गरम करते हैं। उबालने प्र कम क्वथनांक वाले द्रव की वाष्प पहले बनती है। वाष्प को संघनित्र की सहायता से संघनित करके प्राप्त द्रव को ग्राही में एकत्र कर लेते हैं। उच्च क्वथनांक वाले घटक के वाष्प बाद में बनते हैं। इनमें संघनन से प्राप्त द्रव को दूसरे ग्राही में एकत्र कर लेते हैं।
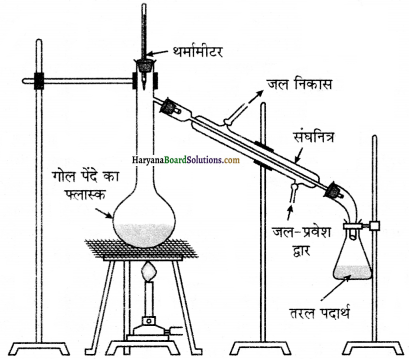
(2) प्रभाजी आसवन (Fractional Distillation) – यह द्रवों के क्वथनांकों की भिन्नता पर आधारित है, यदि दो या दो से अधिक द्रवों के क्वथनांक काफी समीप होते हैं तथा उन्हें शुद्ध रूप में प्राप्त करना होता है और वे स्थिर क्वाथी मिश्रण भी नहीं होते तो उन्हें प्रभाजी आसवन द्वारा पृथक् करते हैं। इस विधि की यह विशेषता है कि इसके द्वारा ऐसे यौगिकों को भी पृथक् किया जा सकता है जिनके क्वथनांकों में 10°C से उच्च या 50°C से कम का अन्तर होता है।
इस विधि द्वारा ऐसीटोन (50°C) तथा मेथिल ऐल्कोहॉल (65°C) या बेन्जीन व टॉलूईन आदि के मिश्रण को पृथक् किया जा सकता है।
विधि (Method) – सर्वप्रथम एक गोल पेंदी वाले फ्लास्क में प्रभाजक स्तम्भ लगा देते हैं तथा इसका दूसरा सिरा संघनित्र से जोड़ देते हैं (जब मिश्रण में उपस्थित द्रवों के क्वथनांकों में अधिक अन्तर न हो या आसवन केवल एक ही बार कराना चाहते हैं तो हम यहाँ पर प्रभाजक स्तम्भ का प्रयोग करते हैं)। संघनित्र का दूसरा सिरा ग्राही में लगा दिया जाता है जिसका बल्ब स्तम्भ में पारर्व नली के पास होता है। फ्लास्क में प्रेथिल ऐल्कोहलल एवं ऐसीटोन या उन द्रवों को जिन्हें अलग करना होता है, भर लेते हैं तथा मिश्रण को गर्म करते हैं। गर्म करने पर कणष खनती है नी र की ओर उठती है।
इन गर्म वाष्प के मार्ग में प्रभाजक स्तम्भ रुकावट डालते हैं। इस रुकावट के कारण कम वाष्पशील द्रव अर्थात् यहाँ पर लिये गये द्रवों में से मेथिल एल्कोहॉल
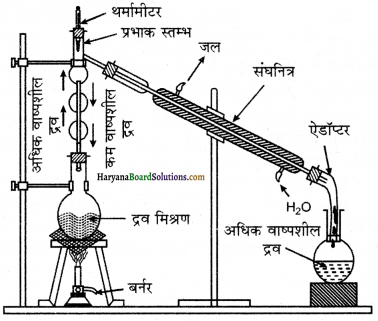
की वाष्प ठण्डी होकर पुनः द्रव में बदल जाती है और द्रव धीरे-धीरे फ्लास्क में नीचे लौट आता है। जैसे-जैसे यह द्रव नीचे खिसकता है और नीचे से ऊपर आने वाली वाष्प के सम्पर्क में आता है तो यह उसमें उपस्थित कम वाष्पशील द्रव की वाष्प को द्रवित कर देता है। यह वाष्प द्रवित होकर फ्लास्क में वापस आ जाती है। इस प्रकार जैसे-जैसे वाष्प ऊपर उठती है, उसमें से कम वाष्पशील द्रव की वाष्प द्रवित होकर पुनः फ्लास्क में वापस आ जाती है। केवल अधिक वाष्पशील द्रव की वाष्प ही संघनित्र तक पहुँचती है। यह वाष्प अब संघनित्र द्वारा द्रवित हो जाती है और उसे ग्राही में एकत्र कर लेते हैं।
अन्त में केवल कम वाष्पशील द्रव आसवन फ्लास्क में रह जाता है और अधिक वाष्पशील द्रव ग्राही में आ जाता है। आसवन फ्लास्क तथा ग्राही से प्राप्त द्रवों का फिर से प्रभाजी आसवन किया जाता है तथा इस प्रकार दो तीन बार प्रभाजी आसवन कराने पर दोनों वाष्पशील द्रव पूर्णतया पृथक् हो जाते हैं।
(3) भाप आसवन (Steam Distillation) – यह विधि उन कार्बनिक यौगिकों के शोधन में प्रयुक्त की जाती है। जोकि जल में अविलेय होते हैं परन्तु भाप के द्वारा आसानी से वाष्पीकृत हो जाते हैं। जो वाष्पशील कार्बनिक यौगिक अपने क्वथनांक पर अपघटित नहीं होते हैं, उनके लिये भाप आसवन एक कारगर विधि है। उदाहरण को लिये ऐनिलीन, नाइट्रोबेंजीन, ऑर्थों नाइट्रोफिनॉल, क्लोरोबेंजीन आदि को इस विधि द्वारा ही शुद्ध किया जाता है क्योंक ये सभी यौगिक भाप की उपस्थिति में शीघ्र ही वाष्पीकृत हो जाते हैं।
क्वथनांक (Boiling Point)-किसी द्रव का क्वथनांक वह ताप है जिस पर उसका वाष्प दाब, वायुमण्डलीय दाब के बराबर हो जाता है।
भापीय आसवन में कार्बनिक द्रव को वाष्प अवस्था में बदलने के लिये भाप प्रवाहित की जाती है। इस अवस्था में जल वाष्प की दाब (P1) तथा द्रवों के वाष्प की दाब P2 एवं वायुमण्डलीय दाब (P) है तो,
P = P1 + P2
उपरोक्त लिखे सूत्र से यह स्पष्ट हो जाता है कि जल तथा कार्बनिक द्रव के क्वथनांक शुद्ध जल तथा शुद्ध कार्बनिक द्रवों के मिश्रणों का क्वथनांकों से कम होता है। अतः भाप आसवन में कार्बनिक द्रव अपने क्वथनांक से कम ताप पर बिना अपघटित हुये ही आसवित अर्थात् वाष्प में परिवर्तित हो जाती है।
भाप आसवन की विधि के लिये चित्र 12.13 के अनुसार उपकरण का संयोजन किया जाता है जिस पदार्थ का आसवन करना होता है। उस फ्लास्क को धीरे-धीरे लगभग 80°C से 90°C तक गर्म किया जाता है। अब इस फ्लास्क को भाप पात्र से जोड़ देते हैं जिससे भाप तेजी से प्रवाहित होती है। भाप वाष्पशील यौगिक को अपने साथ उड़ाकर संघनित्र में पहुँचा देती है। यहाँ संघनित्र दोनों की वाष्प को ठण्डा कर देता है तथा दोनों अर्थात् जल एवं कार्बनिक यौगिक द्रव में परिवर्तित हो जाते हैं। जिसे ग्राही में एकत्र कर लेते हैं।
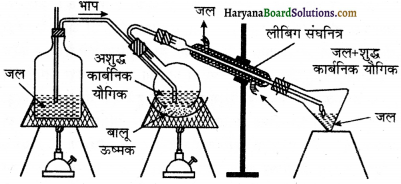
चूँकि वाष्पशील यौगिक जल में अविलेय है तो यहाँ दोनों की अलग-अलग पर्त सी बन जाती है। अर्थात् यदि यौगिक ठोस है तो उसे जल से छानकर पृथक् कर लेते हैं, यदि वे निलम्बित अवस्था में है तो द्रव को एक पृथक्कारी फलन में ले लेते हैं और पृथक् कर देते हैं। कुछ समय पश्चात् द्रव व जल की दो पर्त बन जाती है, यदि जल उपस्थित रहता है तो उन्हें पुनः पृथक्कारी फलन से पृथक् कर देते हैं और शुद्ध यौगिक प्राप्त कर लेते हैं।
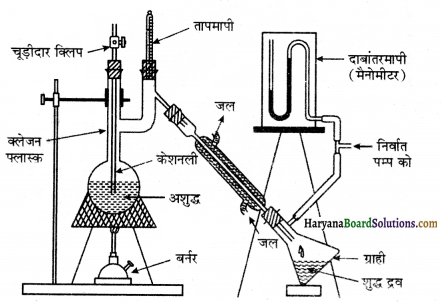
(4) निर्वात आसवन या कम दाब पर आसवन (Vacuum Distilation or Distillation at Low Pressure)-इस विधि का प्रयोग उन द्रवों पर किया जाता है, जो अपने क्वथनांक से पूर्व ताप पर अपघटित होते हैं, किसी द्रव का क्वथनांक वह ताप होता है जिस पर उसका दाब वायुमण्डल के दाब के बराबर हो जाता है। यदि किसी प्रकार द्रव का दाब कम कर दिया जाये तो उसका क्वथनांक भी कम हो जाता है। यदि ऐसे द्रव का आसवन कराना हो क्वथनांक से पूर्व ताप पर अपघटित होता है तो उस पर दाब कम करके उसको इस तरह उबालते हैं कि ये अपघटित नहीं होता है।
चित्र 12.14 में दिखाये गये उपकरण की भाँति सभी अवयवों को व्यवस्थित कर लेते हैं। ग्राही को जो कि एक फ्लास्क है, निर्वात पम्प से जोड़ देते हैं। इस निर्वात पम्प की सहायता से दाब को कम किया जाता है। ग्राही व पम्प के मध्य एक मैनोमीटर लगाया जाता है। अब एक फ्लास्क में अशुद्ध कार्बनिक द्रव लिया जाता है तथा उसको कम दाब पर उबालते हैं। कम दाब होने के कारण द्रव अपने सामान्य क्वथनांक से नीचे की उबलने लगता है तथा उबलने पर वाष्प बनती है, इस वाष्प को संघनित्र में प्रवाहित करके द्रव में परिवर्तित कर लिया जाता है और शुद्ध द्रव को कम दाब पर ग्राही में एकत्र कर लेते हैं।
(ग) क्रोमेटोग्राफी:
यह एक महत्त्वपूर्ण तकनीक है, जिसका उपयोग यौगिकों के शोधन करने में होता है। इसका उपयोग सर्वप्रथम पादपों में पाये जाने वाले रंगीन पदार्थों को पृथक् करने में किया गया था। यह ‘क्रोमेटोग्राफी’ राब्द ग्रीक शब्द ‘क्रोमा’ से बना है जिसका अर्थ ‘रंग’ है। इसमें दो प्रावस्था पायी जाती है। एक स्थिर प्रावस्था तथा दूसरी गतिशील प्रावस्था। यौगिकों के मिश्रण को स्थिर प्रावस्था पर अधिशोषित कर दिया जाता है।
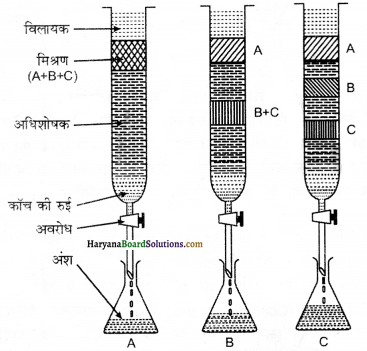
स्थिर प्रावस्था ठोस या द्रव हो सकती है। अंब स्थिर प्रावस्था में से उपयुक्त विलायक, गैस या विलायकों के मिश्रण को धीरे-धीरे प्रवाहित किया जाता है। इस प्रकार मिश्रण के अवयव क्रमश : एक दूसरे से पृथक् हो जाते हैं। यहाँ गति करने वाली प्रावस्था को ‘गतिशील प्रावस्था’ कहा जाता है। इसे निसालक (eluennt) भी कहते हैं। विभिन्न सिद्धान्तों के आधार पर क्रोमेटोग्राफी को विभिन्न वर्गों में बाँटा जाता है। इनमें से दो निन्न प्रकार हैं-
(1) अधिशोषण वर्ण लेखन या अधिशोषण क्रोमेटोग्राफी (Adsorption Chromatography)-इस प्रकार की क्रोमेटोग्राफी में एक विशिष्ट प्रकार के अधिशोषक पर विभिन्न यौगिक भिन्न अंशो में अधिशोषित होते हैं। यहाँ पर प्रयोग होने वाले अधिशोषक ऐलुमिना तथा सिलिका जेल है। स्थिर प्रावस्था अर्थात् अधिशोषक पर गतिशील प्रावस्था प्रवाहित करने के उपरान्त मिश्रण के अवयव स्थिर प्रावस्था पर अलग-अलग दूरी तय करते हैं। इस प्रकार की क्रोमेटोग्राफी दो प्रकार की होती हैं।
(a) कॉलम क्रोमेटोग्राफी या कॉलम-वर्णलेखन या स्तम्भ वर्ण लेखन (Column Chromatography)-इस प्रकार की क्रोमेटोग्राफी में काँच की एक लम्बी नली में स्थिर प्रावस्था या अधिशोषक भरा जाता है। यहाँ प्रयुक्त होने वाला अधिशोषक प्राय: सिलिका जेल या ऐलुमिना होता है, नली के निचले सिरे पर रोधनी लगी रहती है। यौगिक के मिश्रण को उपयुक्त विलायक की न्यूनतम मात्रा में घोलकर कॉलम के ऊपरी
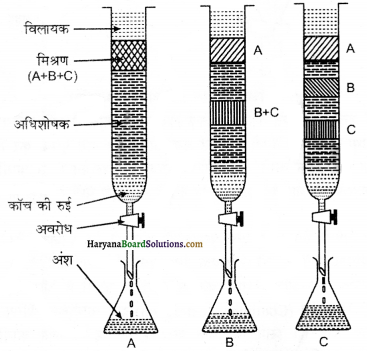
भाग में अधिशोषित कर देते हैं। तत्पश्चात् एक उपर्युक्त विक्षालक या गतिशील प्रावस्था या इलुएन्ट जो कि द्रव या द्रवों का मिश्रण होता है, को कॉलम में धीमी गति से नीचे की ओर बहने दिया जाता है। विभिन्न यौगिकों के अधिशोषण की मात्रा के आधार पर उसका आंशिक या पूर्ण पृथक्करण हो जाता है। अधिक अधिशोषित यौगिक कॉलम में विभिन्न दूरी तक अधिशोषित होकर नीचे आ जाते हैं। अब लम्बी काँच की नली में लगे रोधन को हटाकर हम विभिन्न यौगिकों को प्राप्त कर लेते हैं। चूंकि यहाँ काँच की लम्बी नली को कॉलम की तरह प्रयोग करते हैं अतः इसको कॉलम स्तम्भ क्रोमेटोग्राफी कहते हैं।
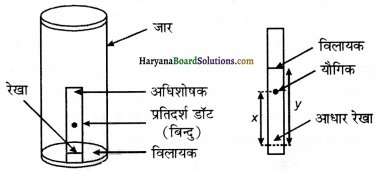
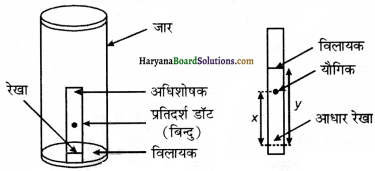
(b) पतली पर्त वर्ण लेखन (Thin Layer Chromatography)-यह एक अधिशोषण क्रोमेटोग्राफी का प्रकार है। यहाँ अधिशोषक या स्थिर प्रावस्था की पतली पर्त का मिश्रण के अवयवों का पृथक्करण होता है। इस प्रकार की वर्ण लेखन में काँच की उपयुक्त आमाप की प्लेट पर अधिशोषक की पतली लगभग 0.2mm की पर्त फैला दी जाती है। यहाँ उपयोग होने वाले अधिशोषक सिलिका जेल या ऐलुमिना होते हैं। इस काँच पर छोटा-सा बिन्दु प्लेट के एक सिरे से लगभग 2 सेमी ऊपर लगाते हैं। प्लेट को अब कुछ ऊँचाई तक विलायक से भरे हुये एक बंद जार में खड़ा कर देते हैं, जैसा कि चित्र में दिखाया गया है।
गतिशील प्रावस्था या निक्षालक जैसे-जैसे प्लेट पर आगे बढ़ता है, वैसे-वैसे मिश्रण के अवयव भी निक्षालक या विलायक या गतिशील प्रावस्था के साथ-साथ प्लेट पर आगे बढ़ते हैं, परन्तु अधिशोषण की तीव्रता के आधार पर ऊपर बढ़ने की उनकी गति भिन्न अधिशोषण को धारण गुणक (retention factor) अर्थात् Rf मान द्वारा प्रदर्शित किया जाता है।

रंगीन यौगिकों के बिन्दुओं को, जो प्लेट पर विभिन्न अधिशोषक क्षमता के आधार पर प्राप्त हुये हैं, बिना कठिनाई के देखा जा सकता है, परन्तु रंगहीन एवं प्रतिदीप्त होने वाले यौगिकों के बिन्दुओं को प्लेट पर पराबैंगनी प्रकाश के नीचे रखकर देखते हैं। इसके अलावा जार में कुछ आयोडीन के क्रिस्टल रखकर भी रंगहीन बिन्दुओं को देखा जा सकता है।
जो यौगिक आयोडीन अवशोषित करते हैं। उनके बिन्दु भूर रंग के दिखाई देते हैं। कभी-कभी उपर्युक्त अभिकर्मक के विलयन को जिसे दर्शनीय अभिकर्मक (visualizing reagent) कहा जाता है, भी प्लेट पर छिड़क कर बिन्दुओं को देखा जा सकता है।
उदाहरण के लिए ऐमीनों अम्ल को देखने के लिए बिन्दुओं की प्लेट पर निनहाइड्रिन विलयन छिड़कते हैं जिससे ऐमीनो अम्ल के यौगिक रंगीन दिखाई देने लगते हैं।
(2) वितरण क्रोमेटोग्राफी (Partition Chromatography)- इस प्रकार की क्रोमेटोग्राफी स्थिर तथा गतिशील प्रावस्थाओं के मध्य मिश्रण के अवयवों के सतत विभेदी वितरण पर आधारित है। इसका मुख्य उदाहरण पेपर क्रोमेटोग्राफी है। इसमें एक विशिष्ट प्रकार के क्रोमेटोग्राफी कागज का प्रयोग किया जाता है। इस कागज के छिद्रों में जल के अणु पारित रहते हैं, जोकि स्थिर प्रावस्था का कार्य करते हैं।
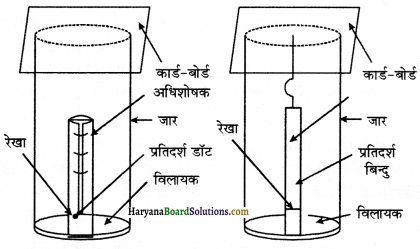
(a) पेपर क्रोमेटोग्राफी या कागज वर्णलेखन (Paper Chromatography) – यह वितरण क्रोमेटोग्राफी का एक प्रकार है। यहाँ एक विशिष्ट प्रकार के कागज का प्रयोग करते हैं। जिसमें जल के अणु पारित रहते हैं तथा स्थिर प्रावस्था का कार्य करते हैं। इस पेपर को क्रोमेटोग्राफी पेपर कहा जाता है।
क्रोमेटोग्राफी पेपर की सर्वप्रथम एक पट्टी काट ली जाती है जो लगभग 4 सेमी. चौड़ी तथा 25 सेमी. लम्बी होती है। इस पट्टी के आधार पर मिश्रण का बिन्दु लगाकर उसे जार में लटका देते हैं। जार में उपयुक्त ऊँचाई तक एक विलायक भरा होता है अर्थात् जार में गतिशील प्रावस्था भरी होती है। कोशिका क्रिया के कारण पेपर की पट्टी पर विलायक ऊपर की ओर चढ़ता है तथा बिन्दु पर प्रवाहित होता है। विभिन्न यौगिकों का दो प्रावस्थाओं में अधिशोषण वितरण भिन्न-भिन्न होने के कारण वे अलग-अलग दूरी तक आगे की ओर चढ़ते हैं। इस प्रकार प्राप्त क्रोमेटोग्राफी पट्टी को क्रोमेटोग्राम कहा जाता है।
प्रश्न 19.
ऐसे दो यौगिक, जिनकी विलेयताएँ विलायक S में भिन्न हैं, को पृथक् करने की विधि की व्याख्या कीजिए।
उत्तर:
ऐसे यौगिकों को क्रिस्टल विधि से पृथक् करते हैं। इसमें सर्वप्रथम अशुद्ध यौगिक को किसी एक ऐसे विलायक में घोलते हैं, जिसमें यौगिक सामान्य ताप पर कम विलेय तथा उच्च ताप पर अधिक विलेय हो। इसके पश्चात् विलयन को सान्द्रित करते हैं जिससे वह संतृप्त हो जाता है। ठंडा करने पर विलयन में से अल्प विलेय घटक पहले क्रिस्टलीय होता है तथा विलयन को पुन: गरम करके ठंडा करने पर अधिक विलेय घटक क्रिस्टलीकृत हो जाता है। विलयन में उपस्थित रंगीन अशुद्धियों को दूर करने के लिए सक्रियित काष्ठ कोयले की सहायता ली जाती है। विलयन का बार-बार क्रिस्टलन करने पर शुद्ध यौगिक प्राप्त होता है।
प्रश्न 20.
आसवन, निम्न दाब पर आसवन तथा भाप आसवन में क्या अन्तर है ? विवेचना कीजिए।
उत्तर:
आसवन:
क्वथनांक में अधिक अन्तर वाले द्रवों को पृथक् करने के लिए इसका प्रयोग करते हैं।
निम्न दाब पर:
इसका प्रयोग उन यौगिकों पर होता है जो अपने साधारण क्वथनांक पर या उससे नीचे अपघटित हो जाते हैं।
भाप आसवन:
इसका प्रयोग उन यौगिकों पर होता है, जो भाप में वाष्प-शील होते हैं। परन्तु जल में अमिश्रणीय होते हैं।
प्रश्न 21.
लैसग्ने-परीक्षण का रसायन सिद्धान्त समझाइए।
उत्तर:
किसी कार्बनिक यौगिक में उपस्थित नाइट्रोजन, सल्फरर, हैलोजेन तथा फॉस्फोरस की पहचान ‘लैसग्ने-परीक्षण’ (Lassaigne’s Test) द्वारा दी जाती है। यौगिक को सोड्डियम धातु के साथ संगलित करने पर ये वत्व सहसंयोजी सूप से आयनिक रूप में परिवर्तित हो जाते है। इनमें निम्नलिखित अभिक्रियाएँ होती हैं-

C, N, S तथा X कार्बनिक यौगिक में उपस्थित तत्व हैं। सोडियम संगलन से प्राप्त अवशेष को आसुत जल के साथ उबालने पर सोडियम सायनाइड, सल्फाइड तथा हैलाइ्ड जल में घुल जाते हैं। इस निष्कर्ष को ‘सोडियम संगलन निष्कर्ष’ (Sodium Fusion Extract) कहते है।
प्रश्न 22.
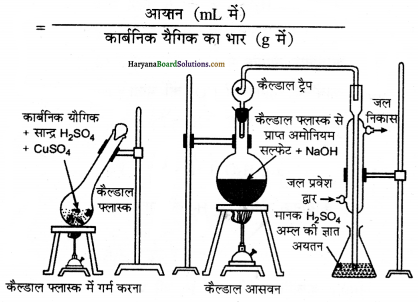
किसी कार्बनिक यौगिक में नाइट्रोजन के आकलन की (i) इ्यूमा विधि तथा (ii) कैल्डॉल विधि के सिद्धान्त की रूप-रेखा प्रस्तुत कीजिए।
उत्तर:
(i) ड्यूमा विधि
(ii) कैल्डॉल विधि
(i) ड्यूमा विधि (Duma’s Method)-जब किसी नाइट्रोजन युक्त कार्बनिक यौगिक को CuO के साथ गर्म करने पर नाइट्रोजन मुक्त होती
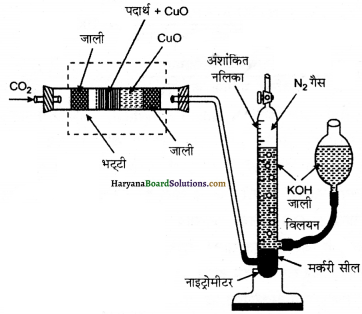
है। कार्बन तथा हाइड्रोजन क्रमशः कार्बन डाइऑक्साइड एवं जल में परिवर्तित हो जाते हैं।
![]()
अल्प मात्रा में बने नाइट्रोजन ऑक्साइडों को गरम कॉपर तार पर प्रवाहित कर नाइट्रोजन में अपचयित कर दिया जाता है। इस प्रकार प्राप्त गैसीय मिश्रण को हाइड्रॉक्साइड पोटैशियम के जलीय विलयन पर एकत्र कर लिया जाता है। कार्बन डाइऑक्साइड पोटैशियम हाइड्रॉक्साइड द्वारा अवशोषित हो जाती है तथा बची हुयी N2 गैस को जल के ऊपर एकत्र कर लेते हैं। अब N2 का आयतन वायुमण्डल के दाब तथा ताप पर नोट कर लेते हैं तथा इसे NTP पर परिवर्तित कर लेते हैं।
मान लिया, m g कार्बनिक याँगिक से N.T.P. पर x मिली नाइट्रोजन प्राप्त होती है।
∵ N.T.P. पर 22,400 मिली नाइट्रोजन (N2) की मात्रा = 28 g (N2 का g अणुभार)
∴ N.T.P. पर x मिली नाइट्रोजन (N2) की मात्रा = \(\frac { 28x }{ 22,400 }\) g
∵ m g कार्बनिक यौगिक में नाइट्रोजन (N2) की मात्रा = \(\frac { 28x }{ 22,400 }\) g
∴ 100 g कार्बनिक यौगिक में नाइट्रोजन (N2) की मात्रा = \(\frac{28 x \times 100}{22,400 \times m} \mathrm{~g}\)

(ii) (ii) कैल्डाल विधि (Kjeldahl’s Method) – जब किसी नाइट्रोजन युक्त कार्बनिक यौगिक को K2SO4 की उपस्थित में सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म करते हैं तो उसमें उपस्थित नाइट्रोजन पूर्ण रूप से अमोनियम सल्फेट में परिवर्तित हो जाता है। इस अमोनियम सल्फेट को जब सान्द्र NaOH विलयन के साथ गर्म करते हैं तो अमोनियम गैस निकलती है जिसको ज्ञात सान्द्रण वाले H2SO4 के निश्चित आयतन में अवशोषित कर लेते हैं। इस अम्ल का मानक NaOH के साथ अनुमापन करके गणना द्वारा अवशोषित हुई अमोनिया की मात्रा ज्ञात कर ली जाती है। फिर अन्त में नाइट्रोजन के आयतन की गणना कर लेते हैं।
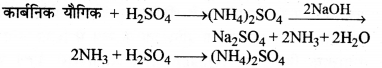
माना कि,
कार्बनिक यौगिक का भार = m
प्रयुक्त अम्ल का आयतन = vmL
प्रयुक्त अम्ल की नॉर्मलता = N
V mL N नॉर्मलता का अम्ल = V mL N नॉर्मलता की अमोनिया 1000 mL N नॉर्मलता वाली अमोनिया में 17 g अमोनिया या 14 g नाइट्रोजन होती है।
V mL N NH3 में नाइट्रोजन की मात्रा = \(\frac { 14 }{ 1000 }\) × V × N = 0.014 NV g
इसलिए m ग्राम कार्बनिक यौगिक में नाइट्रोजन की मात्रा = 0.014 NV g
100 ग्राम कार्बनिक यौगिक में नाइट्रोजन की मात्रा
= \(\frac{0.014 \times \mathrm{N} \times \mathrm{V} \times 100}{m}\) = \(\frac{1.4 \mathrm{NV}}{m}\) g
अत :
कार्बनिक यौगिक में नाइट्रोजन की प्रतिशत मात्रा (%)
1.4 × प्राप्त NH3 की नॉर्मलता × प्राप्त NH3 का
प्रश्न 23.
किसी बौगिक में हैलोजेन, सल्फर तथा फॉस्फोरस के आंकलन के सिद्धान्त की विवेचना कीजिए।
उत्तर:
(i) सल्फर एवं नाइट्रोजन का संयुक्त परीक्षण (Combined Test for Sulphur and Nitrogen)-परखनली में सोडियम निष्कर्ष लेकर उसे HCl की सहायता से अम्लीय कर लेने के बाद, उसमें फेरिक क्लोराइड विलयन मिलाते हैं, विलयन का रंग रक्त के समान लाल हो जाता है।

(ii) फॉस्फोरस का परीक्षण (Detection of Phosphorous)ऑक्सीकारक के साथ गरम करने पर यौगिक में उपस्थित फॉस्फोरस, फॉस्फेट में परिवर्तित हो जाता है। विलयन को नाइट्रिक अम्ल के साथ उबालकर अमोनियम मॉलिब्डेट मिलाने पर पीला अवक्षेप बनता है, जो फॉस्फोरस की उपस्थित को निश्चित करता है।

![]()
प्रश्न 24.
पेपर क्रोमेटोग्राफी के सिद्धान्त को समझाइए।
उत्तर:
(iii) यह एक महत्त्वपूर्ण तकनीक है, जिसका उपयोग यौगिकों के शोधन करने में होता है। इसका उपयोग सर्वप्रथम पादपों में पाये जाने वाले रंगीन पदार्थों को पृथक् करने में किया गया था। यह ‘क्रोमेटोग्राफी’ राब्द ग्रीक शब्द ‘क्रोमा’ से बना है जिसका अर्थ ‘रंग’ है। इसमें दो प्रावस्था पायी जाती है। एक स्थिर प्रावस्था तथा दूसरी गतिशील प्रावस्था। यौगिकों के मिश्रण को स्थिर प्रावस्था पर अधिशोषित कर दिया जाता है।
स्थिर प्रावस्था ठोस या द्रव हो सकती है। अंब स्थिर प्रावस्था में से उपयुक्त विलायक, गैस या विलायकों के मिश्रण को धीरे-धीरे प्रवाहित किया जाता है। इस प्रकार मिश्रण के अवयव क्रमश : एक दूसरे से पृथक् हो जाते हैं। यहाँ गति करने वाली प्रावस्था को ‘गतिशील प्रावस्था’ कहा जाता है। इसे निसालक (eluennt) भी कहते हैं। विभिन्न सिद्धान्तों के आधार पर क्रोमेटोग्राफी को विभिन्न वर्गों में बाँटा जाता है। इनमें से दो निन्न प्रकार हैं-
(1) अधिशोषण वर्ण लेखन या अधिशोषण क्रोमेटोग्राफी (Adsorption Chromatography)-इस प्रकार की क्रोमेटोग्राफी में एक विशिष्ट प्रकार के अधिशोषक पर विभिन्न यौगिक भिन्न अंशो में अधिशोषित होते हैं। यहाँ पर प्रयोग होने वाले अधिशोषक ऐलुमिना तथा सिलिका जेल है। स्थिर प्रावस्था अर्थात् अधिशोषक पर गतिशील प्रावस्था प्रवाहित करने के उपरान्त मिश्रण के अवयव स्थिर प्रावस्था पर अलग-अलग दूरी तय करते हैं। इस प्रकार की क्रोमेटोग्राफी दो प्रकार की होती हैं।
(a) कॉलम क्रोमेटोग्राफी या कॉलम-वर्णलेखन या स्तम्भ वर्ण लेखन (Column Chromatography)-इस प्रकार की क्रोमेटोग्राफी में काँच की एक लम्बी नली में स्थिर प्रावस्था या अधिशोषक भरा जाता है। यहाँ प्रयुक्त होने वाला अधिशोषक प्राय: सिलिका जेल या ऐलुमिना होता है, नली के निचले सिरे पर रोधनी लगी रहती है। यौगिक के मिश्रण को उपयुक्त विलायक की न्यूनतम मात्रा में घोलकर कॉलम के ऊपरी
भाग में अधिशोषित कर देते हैं। तत्पश्चात् एक उपर्युक्त विक्षालक या गतिशील प्रावस्था या इलुएन्ट जो कि द्रव या द्रवों का मिश्रण होता है, को कॉलम में धीमी गति से नीचे की ओर बहने दिया जाता है। विभिन्न यौगिकों के अधिशोषण की मात्रा के आधार पर उसका आंशिक या पूर्ण पृथक्करण हो जाता है। अधिक अधिशोषित यौगिक कॉलम में विभिन्न दूरी तक अधिशोषित होकर नीचे आ जाते हैं। अब लम्बी काँच की नली में लगे रोधन को हटाकर हम विभिन्न यौगिकों को प्राप्त कर लेते हैं। चूंकि यहाँ काँच की लम्बी नली को कॉलम की तरह प्रयोग करते हैं अतः इसको कॉलम स्तम्भ क्रोमेटोग्राफी कहते हैं।
(b) पतली पर्त वर्ण लेखन (Thin Layer Chromatography)-यह एक अधिशोषण क्रोमेटोग्राफी का प्रकार है। यहाँ अधिशोषक या स्थिर प्रावस्था की पतली पर्त का मिश्रण के अवयवों का पृथक्करण होता है। इस प्रकार की वर्ण लेखन में काँच की उपयुक्त आमाप की प्लेट पर अधिशोषक की पतली लगभग 0.2mm की पर्त फैला दी जाती है। यहाँ उपयोग होने वाले अधिशोषक सिलिका जेल या ऐलुमिना होते हैं। इस काँच पर छोटा-सा बिन्दु प्लेट के एक सिरे से लगभग 2 सेमी ऊपर लगाते हैं। प्लेट को अब कुछ ऊँचाई तक विलायक से भरे हुये एक बंद जार में खड़ा कर देते हैं, जैसा कि चित्र में दिखाया गया है।
गतिशील प्रावस्था या निक्षालक जैसे-जैसे प्लेट पर आगे बढ़ता है, वैसे-वैसे मिश्रण के अवयव भी निक्षालक या विलायक या गतिशील प्रावस्था के साथ-साथ प्लेट पर आगे बढ़ते हैं, परन्तु अधिशोषण की तीव्रता के आधार पर ऊपर बढ़ने की उनकी गति भिन्न अधिशोषण को धारण गुणक (retention factor) अर्थात् Rf मान द्वारा प्रदर्शित किया जाता है।

रंगीन यौगिकों के बिन्दुओं को, जो प्लेट पर विभिन्न अधिशोषक क्षमता के आधार पर प्राप्त हुये हैं, बिना कठिनाई के देखा जा सकता है, परन्तु रंगहीन एवं प्रतिदीप्त होने वाले यौगिकों के बिन्दुओं को प्लेट पर पराबैंगनी प्रकाश के नीचे रखकर देखते हैं। इसके अलावा जार में कुछ आयोडीन के क्रिस्टल रखकर भी रंगहीन बिन्दुओं को देखा जा सकता है। जो यौगिक आयोडीन अवशोषित करते हैं। उनके बिन्दु भूर रंग के दिखाई देते हैं। कभी-कभी उपर्युक्त अभिकर्मक के विलयन को जिसे दर्शनीय अभिकर्मक (visualizing reagent) कहा जाता है, भी प्लेट पर छिड़क कर बिन्दुओं को देखा जा सकता है।
उदाहरण के लिए ऐमीनों अम्ल को देखने के लिए बिन्दुओं की प्लेट पर निनहाइड्रिन विलयन छिड़कते हैं जिससे ऐमीनो अम्ल के यौगिक रंगीन दिखाई देने लगते हैं।
(2) वितरण क्रोमेटोग्राफी (Partition Chromatography)- इस प्रकार की क्रोमेटोग्राफी स्थिर तथा गतिशील प्रावस्थाओं के मध्य मिश्रण के अवयवों के सतत विभेदी वितरण पर आधारित है। इसका मुख्य उदाहरण पेपर क्रोमेटोग्राफी है। इसमें एक विशिष्ट प्रकार के क्रोमेटोग्राफी कागज का प्रयोग किया जाता है। इस कागज के छिद्रों में जल के अणु पारित रहते हैं, जोकि स्थिर प्रावस्था का कार्य करते हैं।
(a) पेपर क्रोमेटोग्राफी या कागज वर्णलेखन (Paper Chromatography) – यह वितरण क्रोमेटोग्राफी का एक प्रकार है। यहाँ एक विशिष्ट प्रकार के कागज का प्रयोग करते हैं। जिसमें जल के अणु पारित रहते हैं तथा स्थिर प्रावस्था का कार्य करते हैं। इस पेपर को क्रोमेटोग्राफी पेपर कहा जाता है।
क्रोमेटोग्राफी पेपर की सर्वप्रथम एक पट्टी काट ली जाती है जो लगभग 4 सेमी. चौड़ी तथा 25 सेमी. लम्बी होती है। इस पट्टी के आधार पर मिश्रण का बिन्दु लगाकर उसे जार में लटका देते हैं। जार में उपयुक्त ऊँचाई तक एक विलायक भरा होता है अर्थात् जार में गतिशील प्रावस्था भरी होती है। कोशिका क्रिया के कारण पेपर की पट्टी पर विलायक ऊपर की ओर चढ़ता है तथा बिन्दु पर प्रवाहित होता है। विभिन्न यौगिकों का दो प्रावस्थाओं में अधिशोषण वितरण भिन्न-भिन्न होने के कारण वे अलग-अलग दूरी तक आगे की ओर चढ़ते हैं। इस प्रकार प्राप्त क्रोमेटोग्राफी पट्टी को क्रोमेटोग्राम कहा जाता है।
प्रश्न 25.
‘सोडियम संगलन निष्करर्ष’ में हैलोजेन के परीक्षण के लिए सिल्वर नाइट्रेट मिलाने से पूर्व नाइट्रिक अम्ल ब्यों मिलाया जाता है।
उत्तर:
सोडियम संगलन निफ्कर्ष में हैलोजेन के परीक्षण के लिये सिल्वर नाइट्रेट मिलाने से पूर्व नाइट्रिक अम्ल मिलाया जाता है क्योंकि यदि यौगिक में हैलोजेन के अलावा नाइट्रोजन अथवा सल्फर उपस्थित होते है तो ये नाइट्रिक अम्ल से क्रिया करके सायनाइड तथा सल्फाइड में विघटित हो जाते हैं तथा हैलोजेन के सिल्वर नाइट्रेट परीक्षण में बाधा उत्पन्न नहीं करते हैं।
NaCN + HNO3 → NaNO3 + HCN↑
Na2S + 2NaNO3 + H2S ↑
यदि नाइट्रिक अम्ल न डाले तो NaCN तथा Na2S, AgNO3 से क्रिया करके अवक्षेप देते हैं तथा हैलोजन के परीक्षण में बाधा उत्पन्न करेंगे।

प्रश्न 26.
नाइट्रोजन, सल्फर तथा फॉस्फोरस के परीक्षण के लिए सोडियम के साथ कार्बनिक यौगिक का संगलन क्यों किया जाता है ?
उत्तर:
नाइट्रोजन, सल्फर तथा फॉस्फोरस के परीक्षण के लिए सोडियम के साथ कार्बनिक यौगिक का संगलन किया जाता है क्योंकि सोडियम के साथ ये तत्व अपने सोडियम लवण में जैसे- NaCN, Na2S, Na3PO4 में परिवर्तित हो जाते हैं। ये यौगिक आयनिक होते हैं एवं अत्यधिक क्रियाशील भी होते हैं जिसके कारण इन्हें उपर्युक्त अभिकर्मक
प्रश्न 27.
कैल्सियम सल्फेट तथा कपूर के मिश्रण के अवयवों को पृथक् करने के लिए एक उपयुक्त तकनीक बताइए।
उत्तर:
इसके लिए ऊर्ध्वपातन तकनीक उपयुक्त है क्योंक कपूर का ऊर्ध्वपातन हो सकता जबकि कैल्सियम सल्फेट का नहीं।
प्रश्न 28.
भाप आसवन करने पर एक कार्बनिक द्रव अपने क्वथनांक से निम्न ताप पर वाष्पीकृत क्यों हो जाता है?
उत्तर:
भाप आसवन वास्तव में निम्न दाब पर आसवन होता है। आसवन फ्लास्क में रखे जल वाष्प तथा कार्बनिक द्रव दोनों के वाष्प दाबों का योग वायुमण्डलीय दाब के बराबर होना चाहिए। इसका तात्पर्य यह है कि दोनों अपने सामान्य क्वथनांक से कम ताप पर ही वाष्पीकृत हो जाएँगे।
प्रश्न 29.
क्या CCl4 सिल्वर नाइट्रेट के साथ गर्म करने पर AgCl का श्वेत अवक्षेप देगा ? अपने उत्तर को कारण सहित समझाइए।
उत्तर:
नहीं; क्योंकि CCl4 अध्रुवी यौगिक है तथा जलीय विलयन में Cl– आयन नहीं देता है, जबकि सिल्वर नाइट्रेट आयनिक प्रवृत्ति का यौगिक है। इसलिए ये परस्पर अभिक्रिया नहीं करेंगे तथा सिल्वर क्लोराइड का श्वेत अवक्षेप प्राप्त नहीं होगा।
प्रश्न 30.
किसी कार्बनिक यौगिक में कार्बन का आकलन करते समय उत्पन्न कार्बन डाइऑक्साइड को अवशोषित करने के लिए पोटैशियम हाइड्रॉक्साइड विलयन का उपयोग क्यों किया जाता है?
उत्तर:
ऐसा इसलिए किया जाता है; क्योंकि पोटैशियम हाइड्रॉक्साइड प्रबल क्षार है तथा CO2 का पूर्णतया अवशोषण कर सकता है। इस प्रकार कार्बन डाइऑक्साइड का अवशोषण करके पोटैशियम हाइड्रॉक्साइड विलेय पोटैशियम कार्बोनेट बना लेता है जिसका आकलन किया जा सकता है।
2KOH + CO2 → K2CO3 + H2O
प्रश्न 31.
सल्फर के लेड ऐसीटेट द्वारा परीक्षण में ‘सोडियम संगलन निष्कर्ष’ को ऐसीटिक अम्ल द्वारा उदासीन किया जाता है, न कि सल्फ्यूरिक अम्ल द्वारा। क्यों ?
उत्तर:
सोडियम संगलन निष्कर्ष को ऐसीटिक अम्ल द्वारा अम्लीकृत कर लेड ऐसीटेट मिलाने पर यदि लेड सल्फाइड का काला अवक्षेप बनता है तो सल्फर की उपस्थिति की पुष्टि होती है।
![]()
परन्तु ऐसीटिक अम्ल के स्थान पर सल्फ्यूरिक अम्ल का प्रयोग किया जाए तो लेड ऐसीटेट सल्फ्यूरिक अम्ल से क्रिया करके लेड सल्फेट का सफेद अवक्षेप देगा जो सल्फर के परीक्षण में बाधा उत्पन्न कर देता है।
![]()
प्रश्न 32.
एक कार्बनिक यौगिक में 69% कार्बन, 4.8% हाइड्रोजन तथा शेष ऑक्सीजन है। इस यौगिक के 0.20g के पूर्ण दहन के फलस्वरूप उत्पन्न कार्बन डाइऑक्साइड तथा जल की मात्राओं की गणना कीजिए।
उत्तर:
उत्पन्न कार्बन डाइऑक्साइड की मात्रा की गणना-
यौगिक का द्रव्यमान = 0.20g
कार्बन का प्रतिशत = 69%
कार्बन का प्रतिशत

उ्पन्न जल की मात्रा की गणना –
यौगिक का द्रव्यमान = 0.20g
हाइड्रोजन का प्रतिशत = 4.8%
हाइड्रोजन का प्रतिशत

प्रश्न 33.
0.50g कार्बनिक यौगिक को कैल्डाल विधि के अनुसार उपचारित करने पर प्राप्त अमोनिया को 0.5 M H2SO4 के 50 mL में अवशोषित किया गया। अवशिष्ट अम्ल के उदासीनीकरण के लिए 0.5 M NaOH के 50 mL की आवश्यकता हुई। यौगिक में नाइट्रोजन प्रतिशतता की गणना कीजिए।
हल : अवशिष्ट अम्ल के आयतन की गणना –
NaOH विलयन का आवश्यक आयतन = 50 mL
NaOH विलयन की मोलरता = 0.5 M
H2SO4 विलयन की मोलरता = 0.5 M
अवशिष्ट अम्ल के आयतन की गणना के लिए मोलरता समीकरण का प्रयोग करना होगा।

प्रयुक्त अम्ल के आयतन की गणना-
मिलाए गए अम्ल का आयतन = 50 mL
अवशिष्ट अम्ल का आयतन = 25 mL
प्रयुक्त अम्ल का आयतन = (50 – 25) = 25 mL
नाइट्रोजन की प्रतिशतता की गणना-
यौगिक की मात्रा = 0.50 g
प्रयुक्त अम्ल का आयतन = 25 mL
प्रयुक्त अम्ल की मोलरता = 0.5 M
नाइट्रोजन की प्रतिशतता

प्रश्न 34.
केरियस आकलन में 0.3780 g कार्बनिक क्लोरो यौगिक से 0.5740 g सिल्वर क्लोराइड प्राप्त हुआ। यौगिक में क्लोरीन की प्रतिशतता की गणना कीजिए।
हल : यौगिक का द्रव्यमान = 0.3780 g
सिल्वर क्लोराइड का द्रव्यमान = 0.5740 g
क्लोरीन की प्रतिशतता

= \(\frac { 35.5 }{ 143.5 }\) × \(\frac { 0.5740 }{ 0.3780 }\) × 100
= \(\frac { 2037.7 }{ 54.243 }\) = 37.57%
प्रश्न 35.
केरियस विधि द्वारा सल्फर के आकलन में 0.468 g सल्फर युक्त कार्बनिक यौगिक से 0.668 g बेरियम सल्फेट प्राप्त हुआ। दिए गए कार्बन यौगिक में सल्फर की प्रतिशतता की गणना कीजिए।
उत्तर:
बेरियम सल्फेट की मात्रा = 0.668 g
सल्फर की प्रतिशतता

= \(\frac { 32 }{ 233 }\) × \(\frac { 0.668 }{ 0.468 }\) × 100 = \(\frac { 2137.6 }{ 109.044 }\) = 19.60%
प्रश्न 36.
CH2 = CH-CH2-CH2-C ≡CH, कार्बनिक यौगिक में C2 – C3 आबन्ध किन संकरित कक्षकों के युग्म से निर्मित होता है ?
(क) sp – sp2
(ख) sp – sp3
(ग) sp2 – sp3
(घ) sp3 – sp3
उत्तर:
(ग) sp2 – sp3
प्रश्न 37.
किसी कार्बनिक यौगिक में लैसेग्ने-परीक्षण द्वारा नाइट्रोजन की जाँच में प्रश्शियन ब्लू रंग निम्नलिखित में से किसके कारण प्राप्त होता है ?
(क) Na4[Fe(CN)6]
(ख) Fe4[Fe(CN)6]3
(ग) Fe2[Fe(CN)6]
(घ) Fe3[Fe(CN)6]4
उत्तर:
(ख) Fe4[Fe(CN)6]3
प्रश्न 38.
निम्नलिखित कार्बधनायनों में से कौन-सा सबसे अधिक स्थायी है ?
(क) \(\left(\mathrm{CH}_3\right)_3 \stackrel{+}{\mathrm{C}} \cdot \mathrm{CH}_2\)
(ख) \(\left(\mathrm{CH}_3\right)_3 \stackrel{+}{\mathrm{C}}\)
(ग) \(\mathrm{CH}_3 \mathrm{CH}_2 \stackrel{+}{\mathrm{C}} \mathrm{H}_2\)
(घ) \(\mathrm{CH}_3 \stackrel{+}{\mathrm{C}} \mathrm{HCH}_2 \mathrm{CH}_3\)
उत्तर:
(ख) \(\left(\mathrm{CH}_3\right)_3 \stackrel{+}{\mathrm{C}}\)
प्रश्न 39.
कार्बनिक यौगिकों के पृथक्करण और शोधन की सर्वोत्तम तथा आधुनिकतम तकनीक कौन-सी है ?
(क) क्रिस्टलन
(ख) आसवन
(ग) ऊर्ध्वपातन
(घ) क्रोमेटोग्राफी
उत्तर:
(घ) क्रोमेटोग्राफी
प्रश्न 40.
CH3CH2I + KOH(aq) → CH3CH2OH+KI अभिक्रिया को नीचे दिए गए प्रकार में वर्गीकृत कीजिए-
(क) इलेक्ट्रॉनस्नेही प्रतिस्थापन
(ख) नाभिकस्नेही प्रतिस्थापन
(ग) विलोपन
(घ) संकलन
उत्तर:
(ख) नाभिकस्नेही प्रतिस्थापन