Haryana State Board HBSE 12th Class Chemistry Important Questions Chapter 9 उपसहसंयोजन यौगिक Important Questions and Answers.
Haryana Board 12th Class Chemistry Important Questions Chapter 9 उपसहसंयोजन यौगिक
बहुविकल्पीय प्रश्न
1. क्लोरोफिल में उपस्थित धातु आयन है-
(अ) Fe3+
(ब) Co2+
(स) Mg 2+
(द) Zn 2+
उत्तर:
(स) Mg 2+
2. संकुल [Co(en)2(NH3)2] Br3 में Co की समन्वयी संख्या (CN) है-
(अ) 3
(ब) 4
(स) 7
(द) 6
उत्तर:
(द) 6
3. संकुल [Pt(NH3)3Cl2Br]Cl2 के जलीय विलयन में उपस्थित हैलाइड आयनों की संख्या कितनी होगी?
(अ) 4
(ब) 3
(स) 1
(द) 2
उत्तर:
(स) 1
4. लिगेन्ड सामान्यतः होते हैं-
(अ) लुईस अम्ल
(ब) लुईस क्षार
(स) ऋणायन
(द) उदासीन अणु
(स) ऋणायन
उत्तर:
(ब) लुईस क्षार
5. K4[Fe(CN)6] में Fe की प्राथमिक संयोजकता कितनी है ?
(अ) -4
(ब) +2
(स) +6
(द) +4
उत्तर:
(ब) +2
6. संकुल [Co(NH3) )5Br] SO4 तथा [Co (NH3)5SO4]Br में आपस में कौनसी समावयवता है?
(अ) बंधनी
(ब) ज्यामितीय
(स) आयनन
(द) उपसहसंयोजन
उत्तर:
(स) आयनन
![]()
7. संकुल में कौनसा लिगेन्ड होने पर बंधनी समावयवता होगी ?
(अ) NH3
(ब) en
(स) NC\(\overline{\mathbf{S}}\)
(द) H2O
उत्तर:
(स) NC\(\overline{\mathbf{S}}\)
8. निम्नलिखित में से कौनसा कीलेट लिगेन्ड है?
(अ) \(\overline{\mathrm{C}}\)N
(ब) C2O4-2
(स) NH3
(द) NO–2
उत्तर:
(ब) C2O4-2
9. निम्नलिखित में से किस संकुल आयन में अनुचुंबकीय गुण अधिकतम होगा?
(अ) [Cr(H2O)6]3+
(ब) [Fe(CN)6]4-
(स) [Fe(H2O)6]2+
(द) [Zn(H2O)6]2+
उत्तर:
(स) [Fe(H2O)6]2+
10. निम्नलिखित में से कौनसा द्विक लवण (double salt) नहीं है?
(अ) KCl.MgC2.6H2O
(ब) FeSO4.(NH4)2SO4.6H2O
(स) K4[Fe (CN)6]
(द) उपर्युक्त सभी
उत्तर:
(स) K4[Fe (CN)6]
11. संकुल (Co(H2O)6] [CrCl3] तथा [Cr(H2O)6] [CoCl6] दर्शाते हैं-
(अ) बन्धनी समावयवता
(ब) उपसहसंयोजन समावयवेता
(स) आयनन समावयवता
(द) विलायकयोजन समावयवता
उत्तर:
(ब) उपसहसंयोजन समावयवेता
12. निम्नलिखित से कौनसा संकुल ज्यामितीय समावयवता नहीं दर्शाता ?
(अ) [MX2L2]
(ब) [MX2AB]
(स) [ML4]
(द) [MABXY]
उत्तर:
(स) [ML4]
13. [Fe (CN)6)]4- में अयुग्मित इलेक्ट्रॉनों की संख्या कितनी है?
(अ) 3
(ब) 4
(स) शून्य
(द) 2
उत्तर:
(स) शून्य
14. निम्नलिखित में से कौनसा धातु आयन, NH3 के साथ रंगीन विलयन देता है?
(अ) Cu2+
(ब) Zn2+
(स) Mg2+
(द) Ag+
उत्तर:
(अ) Cu2+
15. निम्नलिखित में से किसके जलीय विलयन में स्वतंत्र Fe3+ आयन उपस्थित होगा?
(अ) K3Fe (CN)6
(ब) Fe2 (SO4)3
(स) K4Fe(CN)6
(द) (NH4)2SO4 . FeSO4.6H2O
उत्तर:
(ब) Fe2 (SO4)3
16. संकुल (Cr(H2O)6]Cl3 तथा (Cr(H2O)5Cl]Cl2. H2O
(अ) बन्धनी समावयवी
(ब) आयनन समावयवी
(स) हाइड्रेट समावयवी
(द) उपसहसंयोजन समावयवी
उत्तर:
(स) हाइड्रेट समावयवी
17. [Fe(CO)5] का IUPAC नाम है-
(अ) आयरन पेन्टा कार्बोनिल
(ब) पेन्टा कार्बोनिल आयरन (O)
(स) आयरन पेन्टा कार्बनमोनोऑक्साइड
(द) उपर्युक्त सभी
उत्तर:
(ब) पेन्टा कार्बोनिल आयरन (O)
![]()
18. निम्नलिखित में से कौनसा द्विदन्तुर लिगेन्ड है?
(अ) अमोनिया
(ब) जल
(स) एथिलीनडाइऐमीन
(द) पिरीडीन
उत्तर:
(स) एथिलीनडाइऐमीन
19. संकुल Na2[Ni ( EDTA)) में Ni की समन्वयी संख्या (CN) कितनी है?
(अ) 1
(ब) 2
(स) 4
(द) 6
उत्तर:
(द) 6
20. निम्नलिखित में से कौनसा बाह्य कक्षक संकुल है?
(अ) [Co(NH3)6]3+
(ब) [CoF6]3-
(स) [Co(CN)6]3-
(द) [Fe(CN)6]3-
उत्तर:
(ब) [CoF6]3-
21. [Fe(CN)6]4- में Fe पर कौनसा संकरण होता है?
(अ) dsp³
(ब) sp³d²
(स) d²sp³
(द) sp³d³
उत्तर:
(स) d²sp³
22. निम्नलिखित में से कौनसा संकुल आयन प्रकाशिक समावयवता दर्शाता है?
(अ) [ZnCl4]2-
(ब) [Co(CN)6)3-
(स) [Cu(NH3)4]2+
(द) [Cr(C2O4)3]3-
उत्तर:
(द) [Cr(C2O4)3]3-
23. संकुल यौगिक [Cr(H2O)6]Cl3 के लिए चुम्बकीय आघूर्ण का मान 3.83 BM है तो इस संकुल में Cr परमाणु में 3d इलेक्ट्रॉनों का वितरण होगा-
(अ) \(3 \mathrm{~d}_{\mathrm{xy}}^1, 3 \mathrm{~d}_{\mathrm{yz}}^1, 3 \mathrm{~d}_{\mathrm{xz}}^1\)
(ब) \(3 \mathrm{~d}_{\mathrm{xy}}^1, 3 \mathrm{~d}_{\mathrm{x}^2-\mathrm{y}^2}^1, 3 \mathrm{~d}_{\mathrm{z}}^1\)
(स) \(3 \mathrm{~d}_{\mathrm{xy}}^{\mathrm{l}}, 3 \mathrm{~d}_{\mathrm{yz}}^1, 3 \mathrm{~d}_{\mathrm{z}^2}^1\)
(द) \(3 \mathrm{~d}_{\mathrm{x}^2-\mathrm{y}^2}^1, 3 \mathrm{~d}_{\mathrm{z}^2}^1, 3 \mathrm{~d}_{\mathrm{xy}}^1\)
उत्तर:
(अ) \(3 \mathrm{~d}_{\mathrm{xy}}^1, 3 \mathrm{~d}_{\mathrm{yz}}^1, 3 \mathrm{~d}_{\mathrm{xz}}^1\)
24. निम्नलिखित में से प्रतिचुम्बकीय संकुल आयन कौनसा है ?
(अ) [CoCl4]2-
(ब) (CoF6]2-
(स) [Ni (CN)4]2-
(द) [NiCl4]2-
उत्तर:
(स) [Ni (CN)4]2-
25. निम्नलिखित में से किस संकुल आयन की ज्यामिति वर्गाकार समतलीय है?
(अ) [NiCl4]2-
(ब) [FeCl4]2-
(स) [PtCl4]2-
(द) [CoCl4]2-
उत्तर:
(स) [PtCl4]2-
26. किसी संक्रमण धातु के संकुल का विन्यास (t2g)4 (eg)² है। धातु आयन से जुड़े लिगेण्ड की प्रकृति है-
(अ) प्रबल क्षेत्र
(ब) दुर्बल क्षेत्र
(स) उदासीन
(द) धनात्मक क्षेत्र
उत्तर:
(ब) दुर्बल क्षेत्र
27. [Co(NH3)4(NO2)2]Cl प्रदर्शित करता है-
(अ) बन्धन, आयनन समावयवता तथा प्रकाशिक समावयवता
(ब) बन्धन, आयनन तथा ज्यामितीय समावयवता
(स) आयनन ज्यामितीय तथा प्रकाशिक समावयवता
(द) बन्धन, ज्यामितीय तथा प्रकाशिक समावयवता
उत्तर:
(ब) बन्धन, आयनन तथा ज्यामितीय समावयवता
28. चतुष्फलकीय ज्यामिति निम्नलिखित में से किसकी है?
(अ) [Ni(NH3)6]2+
(ब) Ni (CO)4
(स) [Ni (CN)4]2-
(द) [Pt(CN)4]2-
उत्तर:
(ब) Ni (CO)4
![]()
29. निम्नलिखित में से कौन अनुचुम्बकीय लक्षण प्रदर्शित नहीं करता है?
(परमाणु क्रमांक Ti = 22; Fe = 26; Cr = 24; Cu = 29 )
(अ) [Ti(H2O)6]3+
(ब) [Fe(CN)6]3+
(स) [Cr(NH3)6]3+
(द) [Co(NH3)6]3+
उत्तर:
(द) [Co(NH3)6]3+
30. निम्नलिखित में से कौनसा संकुल दृश्य प्रकाश अवशोषण के लिए प्रत्याशित (Expected) नहीं है?
(अ) [Cr(NH3)6]2+
(ब) [Fe (H2O)6]2+
(स) [Ni(CN)4]2-
(द) [Ni(H2O)6]2+
उत्तर:
(स) [Ni(CN)4]2-
अतिलघूत्तरात्मक प्रश्न
प्रश्न 1.
\(\overline{\mathrm{N}}\)H2 लिगेन्ड का IUPAC नाम बताइए।
उत्तर:
\(\overline{\mathrm{N}}\)H2 का नाम ऐमीडो है।
प्रश्न 2.
[NiCl4]2- में Ni का प्रभावी परमाणु क्रमांक कितना है?
उत्तर:
[NiCl4]2- में Ni का प्रभावी परमाणु क्रमांक 26 + 8 = 34 है।
प्रश्न 3.
कार्नेलाइट का सूत्र लिखिए।
उत्तर:
कार्नेलाइट का सूत्र KCl . MgCl2 . 6H2O होता है।
प्रश्न 4.
[Cr(EDTA)]-1 में Cr की समन्वयी संख्या कितनी है?
उत्तर:
इस संकुल आयन में Cr की समन्वयी संख्या 6 है।
प्रश्न 5.
निम्नलिखित संकुलों के जलीय विलयन की चालकता का आरोही क्रम बताइए।
(i) K4[Fe(CN)
(ii) [Pt(NH3)4] [PtCl4]
(iii) [Ni (CO)4]
उत्तर:
(iii) < (ii) < (i) क्योंकि (iii) के विलयन में कोई आयन नहीं है लेकिन (ii) व (i) के जलीय विलयन में क्रमशः 2 तथा 5 आयन होंगे।
प्रश्न 6.
(i) [Pt(NH3)4Cl2]Br2 तथा
(ii) [Pt(NH3)4Br2]Cl2 में किस प्रकार विभेद किया जा सकता है?
उत्तर:
दोनों संकुलों के जलीय विलयन में AgNO3 का विलयन डालने पर (i) में AgBr का पीला अवक्षेप बनेगा जबकि (ii) में AgCl का श्वेत अवक्षेप प्राप्त होगा।
प्रश्न 7.
संकुल (Fe (C5H5)2] का IUPAC नाम बताइए।
उत्तर:
बिस (साइक्लोपेन्टा डाइइनिल) आयरन (II)
प्रश्न 8.
किस प्रकार के वर्गाकार समतलीय संकुल ज्यामितीय समावयवता दर्शाते हैं?
उत्तर:
[MX2L2], [ML2X4], [M(AB)2] प्रकार के वर्गाकार समतलीय संकुल ज्यामितीय समावयवता दर्शाते हैं।
प्रश्न 9.
[M ABXY] प्रकार के संकुल के कितने ज्यामितीय समावयवी सम्भव हैं?
उत्तर:
तीन (दो समपक्ष तथा एक विपक्ष)।
प्रश्न 10.
[Fe(CO)5] में Fe पर dsp³ कौनसा संकरण होता है तथा इसका चुम्बकीय गुण भी बताइए।
उत्तर:
[Fe(CO)5] में Fe पर dsp³ संकरण होता है तथा यह प्रतिचुम्बकीय होता है।
प्रश्न 11.
[Pt (NH3)4Cl2]2+ के समपक्ष तथा विपक्ष समावयवी बनाइए।
उत्तर:
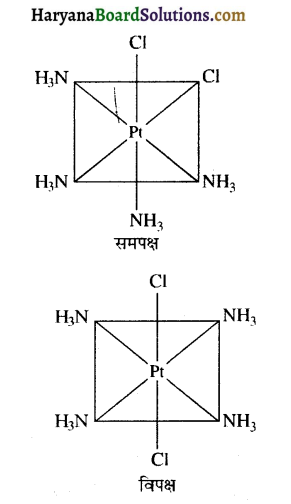
प्रश्न 12.
समपक्ष [PtCl2(en)2] के प्रकाशिक समावयवी बनाइए।
उत्तर:
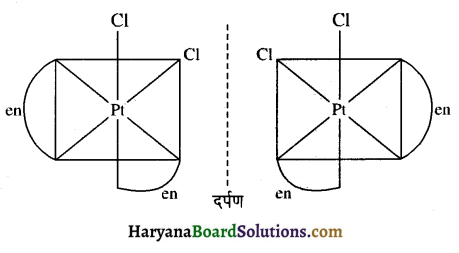
प्रश्न 13.
Pt(NH3)2Cl2 के ज्यामितीय समावयवी बनाइए।
उत्तर:
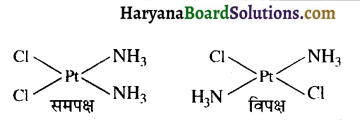
प्रश्न 14.
[Co(en)3]3+ के ध्रुवण समावयवियों की संरचना बनाइए।
उत्तर:
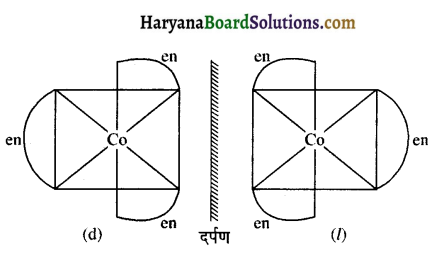
प्रश्न 15.
जल की कठोरता के निर्धारण के लिए आवश्यक लिगेन्ड का नाम बताइए।
उत्तर:
जल की कठोरता का निर्धारण EDTA ( एथिलीनडाई एमीनटेट्रासीटेट) द्वारा किया जाता है।
प्रश्न 16.
[Cu (NH3)4]2+ संकुल आयन की अपेक्षा [Cu(CN)4]2- संकुल आयन अधिक स्थायी होता है, क्यों?
उत्तर:
NH3 की अपेक्षा \(\overline{\mathrm{C}}\)N अधिक प्रबल लिगेन्ड होता है अतः [Cu(NH3)4]2+ संकुल की अपेक्षा [Cu (CN)4]2- संकुल अधिक स्थायी होता है।
प्रश्न 17.
युग्मन ऊर्जा क्या होती है?
उत्तर:
किसी कक्षक में दो इलेक्ट्रॉनों के युग्मन के लिए आवश्यक ऊर्जा को युग्मन ऊर्जा कहते हैं।
प्रश्न 18.
I–, S2-, H2O, NC\(\overline{\mathrm{S}}\) तथा CO में से प्रबल क्षेत्र लिगन्ड कौनसे हैं ?
उत्तर:
NC\(\overline{\mathrm{S}}\) तथा CO प्रबल क्षेत्र लिगेन्ड हैं।
लघूत्तरात्मक प्रश्न
प्रश्न 1.
(a) विशेष नाम युक्त उदासीन लिगेन्डों के उदाहरण बताइए।
(b) धनात्मक लिगेन्डों का नाम किस प्रकार दिया जाता है ? समझाइए।
उत्तर:
(a) विशेष नाम युक्त उदासीन लिगेन्ड निम्नलिखित हैं-
H2O = एक्वा
CS = थायोकार्बोनिल
NH3 = एम्मीन
NO = नाइट्रोसिल
CO = कार्बोनिल
NS थायोनाइट्रोसिल
(b) धनात्मक लिगेन्डों के नाम के अन्त में अनुलग्न इयम (ium) प्रयुक्त किया जाता है।
उदाहरण- \(\stackrel{+}{N}\)O नाइट्रोसिलियम, NH2 – \(\stackrel{+}{N}\)H, हाइड्रेजिनियम तथा \(\stackrel{+}{N}\)O2 नाइट्रोनियम।
प्रश्न 2.
संकुल यौगिकों में उपस्थित केन्द्रीय धातु परमाणु का ऑक्सीकरण अंक तथा संकुल आयन पर आवेश किस प्रकार ज्ञात किया जाता है?
उत्तर:
(i) संकुल में केन्द्रीय धातु परमाणु पर उपस्थित आवेश को उसका ऑक्सीकरण अंक कहते हैं जब वह लिगन्डों से नहीं जुड़ा हो।
(ii) किसी संकुल स्पीशीज पर उपस्थित आवेश उसके केन्द्रीय धातु परमाणु या आयन तथा उससे जुड़े हुए लिगन्डों के आवेश के योग के बराबर होता है तथा यह प्रति आयनों द्वारा उदासीन होता है।
(iii) किसी उदासीन संकुल में केन्द्रीय धातु परमाणु तथा उससे जुड़े लिगन्डों के आवेश का योग शून्य होता है। कभी-कभी धातु तथा लिगन्ड दोनों ही उदासीन होते हैं, जैसे-[Ni(CO)4]
(iv) उदाहरण –
(a) संकुल K4[Fe(CN)6] में Fe का ऑक्सीकरण अंक ज्ञात करना-
यहाँ K तथा CN पर आवेश ज्ञात है जो कि क्रमशः + 1 तथा – 1 है। अतः
K4[Fe(CN)6]
+ 4 + x – 1 ( 6 ) = 0
+ 4 + x – 6 = 0
x = + 2
अतः इसमें Fe का ऑक्सीकरण अंक, + 2 है।
(b) [Co(NH3)5Cl] Cl2 में Co का ऑक्सीकरण अंक भी इसी प्रकार ज्ञात किया जाता है।
यहाँ NH3 उदासीन है तथा Cl पर आवेश – 1 है अतः
[Co(NH3)5Cl] Cl2
x + 0 – 1 – 2 = 0
x = + 3
![]()
प्रश्न 3.
निम्नलिखित प्रकार के संकुलों के उदाहरण तथा IUPAC नाम बताइए –
(i) उदासीन संकुल
(ii) ऋणायनिक संकुल
(iii) धनायनिक संकुल
उत्तर:
(i) Fe(CO)5 पेन्टाकार्बोनिल आयरन (O)
(ii) [Co(NO3)6]3- हेक्सानाइट्रेटोकोबाल्टेट (IH) आयन
(iii) [Pt(NH3)4Cl2]2+ टेट्राऐम्मीनडाइक्लोरिडोप्लेटिनम (IV) आयन
प्रश्न 4.
Pt (IV), NH3, Cl– तथा Na+ आपस में मिलकर सात प्रकार के संकुल यौगिक बनाते हैं। इनमें से एक संकुल यौगिक निम्नलिखित है-
[Pt(NH3)6]Cl4
(i) अन्य छः संकुल यौगिकों के सूत्र लिखिए।
(ii) इन संकुल यौगिकों के IUPAC नाम लिखिए।
(iii) इनमें से किस संकुल जलीय विलयन की चालकता सर्वाधिक होगी?
(iv) इनमें से कौनसा संकुल अनआयनिक है?
(v) इन संकुलों में Pt का ऑक्सीकरण अंक व उपसहसयोजन संख्या भी बताइए।
उत्तर:
(i) (a) [Pt (NH3)5Cl]Cl3
(b) [Pt (NH3)4Cl2]Cl2
(c) [Pt(NH3)3Cl3]Cl
(d) [Pt(NH3)2Cl4]
(e) Na[Pt(NH3)Cl5]
(f) Na2[PtCl6]
(ii) (a) पेन्टाऐम्मीन प्लेटिनम (IV) क्लोराइड
(b) टेट्राऐम्मीन डाइक्लोरिडो प्लेटिनम (IV) क्लोराइड
(c) ट्राइऐम्मीन ट्राइक्लोरिडो प्लेटिनम (IV) क्लोराइड
(d) डाइऐम्मीन टेट्राक्लोरिडो प्लेटिनम (IV)
(e) सोडियम ऐम्मीन पेन्टाक्लोरिडो प्लेटिनेट (IV)
(f) सोडियम हेक्साक्लोरिडो प्लेटिनेट (IV)
(iii) संकुल [Pt(NH3)6]Cl4 की चालकता सर्वाधिक होगी क्योंकि यह विलयन में अधिकतम (पाँच आयन) देता है।
(iv) [Pt(NH3)2Cl4] अनआयनिक है।
(v) इन सभी संकुलों में Pt का ऑक्सीकरण अंक + 4 तथा उपसहसंयोजन संख्या 6 है।
प्रश्न 5.
समावयवता को परिभाषित कीजिए तथा इसके प्रकार बताइए।
उत्तर:
समावयवता (Isomerism) – ऐसे दो या दो से अधिक यौगिक जिनके रासायनिक सूत्र (अणु सूत्र ) समान होते हैं परन्तु उनमें परमाणुओं की व्यवस्था भिन्न होती है, उन्हें एक-दूसरे के समावयवी कहते हैं तथा इस गुण को समावयवता कहते हैं। परमाणुओं की भिन्न व्यवस्थाओं के कारण इनके एक या अधिक भौतिक या रासायनिक गुणों में भिन्नता होती है। उपसहसंयोजन यौगिकों में दो प्रमुख प्रकार की समावयवताएँ होती हैं जिनको पुनः कई भागों में वर्गीकृत किया जाता है-
(a) त्रिविम समावयवता-
- ज्यामितीय समावयवता
- ध्रुवण समावयवता
(b) संरचनात्मक समावयवता-
- बंधनी समावयवता
- उपसहसंयोजन समावयवता या समन्वयी समावयवता
- आयनन समावयवता
- विलायकयोजन समावयवता या हाइड्रेट समावयवता
- लिगन्ड समावयवता
- बहुलकीकरण समावयवता
- उपसहसंयोजन स्थिति समावयवता
प्रश्न 6.
आयनन समावयवता की व्याख्या उदाहरण सहित कीजिए।
उत्तर:
आयनन समावयवता – जब किसी संकुल में उपस्थित प्रतिआयन स्वयं एक संभावित लिगेन्ड हो तथा यह किसी लिगेन्ड को प्रतिस्थापित करके दूसरा संकुल बनाता है तो प्राप्त संकुल को आयनन समावयवी तथा इस गुण को आयनन समावयवता कहते हैं।
उदाहरण-
(i) [Co (NH3)5 SO4] Br तथा
(ii) [Co(NH3)5Br]SO4।
(i) के आयनन से Br– प्राप्त होता है जबकि
(ii) के आयनन से SO2-4 प्राप्त होगा।
प्रश्न 7.
उपसहसंयोजन समावयवता क्या होती है? समझाइए।
उत्तर:
उपसहसंयोजन समावयवता – जब किसी संकुल में उपस्थित भिन्न-भिन्न धातुओं की धनायनिक एवं ऋणायनिक उपसहसंयोजन सत्ता के मध्य लिगेन्डों का अंतरपरिवर्तन (Interchange) होता है तो यह समावयवता उत्पन्न होती है। संकुल [Co (NH3)6] [Cr(CN)6] जिसमें NH3, CO3+ से बंधित हैं तथा CN–, Cr3+ से जबकि इसके उपसहसंयोजन समावयवी [Cr(NH3)6] [Co(CN6)] में, NH3, Cr3+ से तथा CN–, Co3+ से बंधित है।
प्रश्न 8.
प्रकाशिक या ध्रुवण समावयवता किसे कहते हैं? संक्षिप्त व्याख्या कीजिए।
उत्तर:
यह समावयवता असममित अणुओं या संकुलों में पाई जाती है जिनमें सममिति नहीं होती। ये संकुल ध्रुवित प्रकाश के तल को घुमा देते हैं, अतः इन्हें प्रकाशिक या ध्रुवण समावयवी कहते हैं। ध्रुवण समावयवी एक-दूसरे के दर्पण प्रतिबिम्ब होते हैं तथा इन्हें एक-दूसरे पर अध्यारोपित नहीं किया जा सकता। इन्हें प्रतिबिम्ब रूप या एनैन्टिओमर (enantiomers) भी कहते हैं।
अणु या आयन जो एक-दूसरे पर अध्यारोपित नहीं किए जा सकते, उन्हें काइरल (chiral) कहते हैं । काइरल अणु दो प्रकाशिक समावयवियों के रूप में पाया जाता है दक्षिण-ध्रुवण घूर्णक (d) तथा वाम ध्रुवण घूर्णक (l)। ये ध्रुव प्रकाश को अलग-अलग दिशा में घुमाते हैं (d दाईं तरफ तथा / बाईं तरफ)। प्रकाशिक समावयवता सामान्यतः द्विदंतुर लिगेन्ड युक्त. अष्टफलकीय संकुलों में पाई जाती है, जिनका सामान्य सूत्र
- [M(AA)2X2]
- M (AA )3]
- [M (AA ) X2 Y2] तथा
- [MX2Y2Z2] होता है।
लेकिन जिन संकुलों में ज्यामितीय समावयवता होती है, उनका समपक्ष रूप ही प्रकाशिक समावयवता दर्शाता है क्योंकि विपक्ष रूप तो सममित होता है।
उदाहरण-
(i) [PtCl2(en)2]2+ या [Rh (en)2Cl2]+ या [Co(en)2 Cl2]+
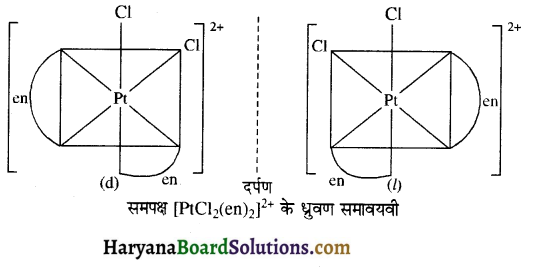
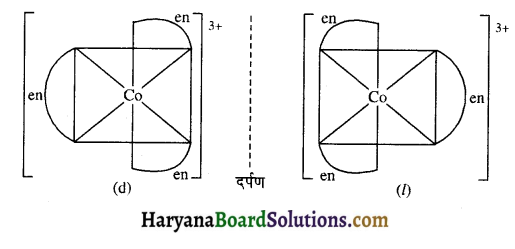
(ii) [Co(en)3]3+ या [Cr(OX)3]5- [OX = ऑक्सेलेट (C2O2-4)]
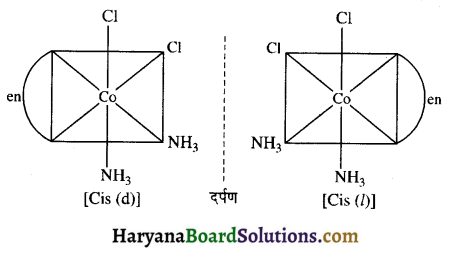
(iii) [Co(en)(NH3)2Cl2]+
(iv) [Pt(NH3)2(Py)2Cl2]2+
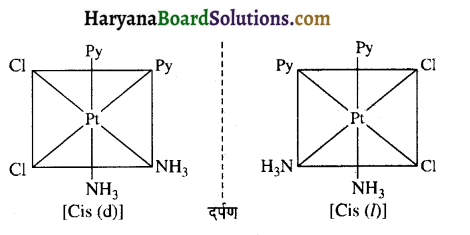
उपसहसंयोजन संख्या 4 वाले संकुलों में वर्गाकार समतलीय ज्यामिति होने पर प्रकाशिक समावयवता नहीं होती क्योंकि इन संकुलों में सममिति तल पाया जाता है लेकिन असममित द्विदंतुर लिगेन्ड युक्त चतुष्फलकीय संकुलों में प्रकाशिक समावयवता होती है।
उदाहरण – बिस (ग्लाइसिनेटो) निकल (II)
[Ni(NH2-CH2-COO–)2] (gly = O-N) या [Ni (Gly)2]
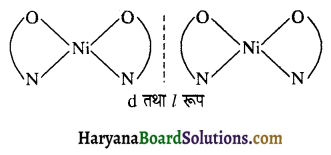
इसी प्रकार बस (बेन्जॉयल ऐसीटोनेटो) बेरिलियम (II) भी प्रकाशिक समावयवता दर्शाता है।
[Be(C6H5COCHCOCH3)2]
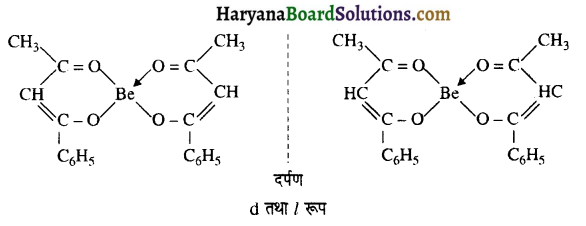
प्रश्न 9.
[Co(NH3)6]3+ की ज्यामिति तथा चुम्बकीय गुण की व्याख्या VBT की सहायता से कीजिए।
उत्तर:
[Co(NH3)6]3+ संकुल आयन-संकुल आयन [Co(NH3)6]3+ में, कोबाल्ट आयन +3 ऑक्सीकरण अवस्था में है तथा Co3+ का इलेक्ट्रॉनिक विन्यास 36 है। अतः इसमें संकरण निम्न प्रकार होता है-
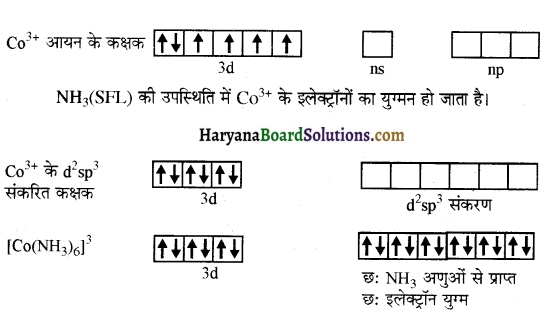
छः अमोनिया अणुओं से प्रत्येक का एक इलेक्ट्रॉन युग्म छः d²sp³ संकरित कक्षकों में स्थान ग्रहण करता है। इस प्रकार संकुल की ज्यामिति अष्टफलकीय है तथा अयुग्मित इलेक्ट्रॉनों की अनुपस्थिति के कारण यह संकुल आयन प्रतिचुंबकीय होता है। यह एक आन्तरिक कक्षक संकुल या निम्न चक्रण संकुल है।
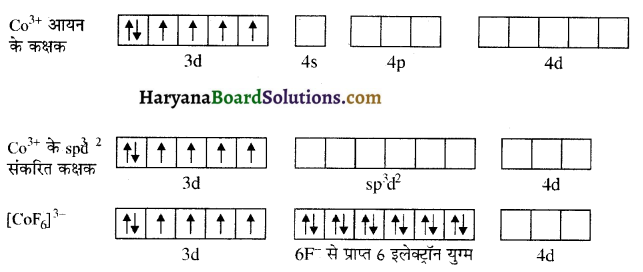
प्रश्न 10.
[CoFo6]3- के अनुचुम्बकीय गुण की व्याख्या कीजिए।
उत्तर:
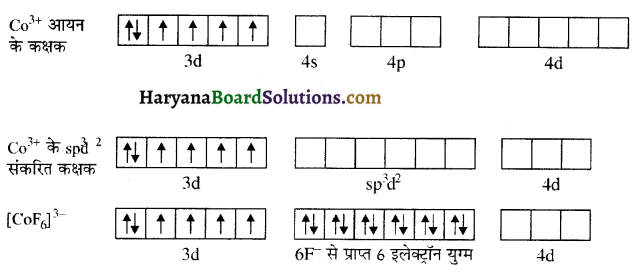
[CoFo6]3- संकुल आयन-इस संकुल में भी कोबाल्ट की ऑक्सीकरण अवस्था +3 है लेकिन F–(WFL) की उपस्थिति में धातु आयन के इलेक्ट्रॉनों का युग्मन नहीं होता अतः इसमें sp³d² संकरण होता है तथा अयुग्मित इलेक्ट्रॉनों की उपस्थिति के कारण यह अनुचुम्बकीय होता है तथा इसे बाह्य कक्षक संकुल या उच्च चक्रण संकुल कहते हैं। इसकी ज्यामिति भी अष्टफलकीय होती है। इस संकुल में संकरण को निम्न प्रकार दर्शाया जा सकता है-
प्रश्न 11.
[Fe(CO)5] की ज्यामिति तथा प्रतिचुम्बकीय गुण की व्याख्या VBT की सहायता से कीजिए।
उत्तर:
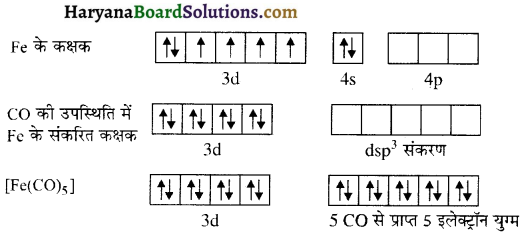
त्रिकोणीय द्विपिरेमिडी संकुल-उदाहरण [Fe(CO)5] इस संकुल में Fe परमाणु अवस्था में है, जिसका इलेक्ट्रॉंनिक विन्यास 3d64s² होता है। CO(SFL) की उपस्थिति में Fe के 3d तथा 4s कक्षकों के सभी इलेक्ट्रॉन 3d में युग्मित हो जाते हैं तथा एक d कक्षक रिक्त होकर dsp³ संकरण होता है। इसमें सभी इलेक्ट्रॉन युग्मित होने के कारण यह संकुल प्रतिचुम्बकीय होता है तथा इसकी ज्यामिति त्रिकोणीय द्विपिरैमिडी होती है।
प्रश्न 12.
[Cu(NH3)4]2+ की वर्गाकार समतलीय ज्यामिति को समझाइए।
उत्तर:
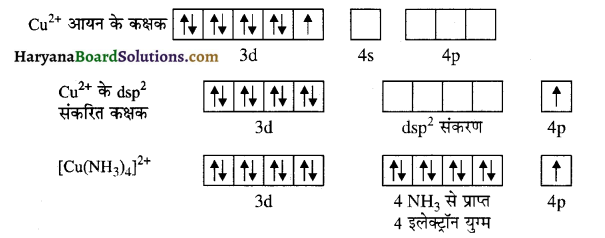
[Cu(NH3)4]2+ – इस संकुल में भी dsp² संकरण होता है क्योंकि X-किरण विवर्तन से ज्ञात हुआ है कि इसमें लिगेन्ड समतलीय अवस्था में पाए जाते हैं। इसमें एक अयुग्मित इलेक्ट्रॉन पाए जाने के कारण यह अनुचुम्बकीय होता है तथा इसकी ज्यामिति भी वर्गाकार समतलीय होती है। इसमें संकरण को निम्न प्रकार दर्शाया जाता है-
बोर्ड परीक्षा के दृष्टिकोण से सम्भावित महत्त्वपूर्ण प्रश्न
प्रश्न 1.
निम्नलिखित के कारण स्पष्ट कीजिए-
(i) निकल के अल्प स्पिन (Low spin) के अष्टफलकीय कॉम्पलेक्स (संकुल) ज्ञात नहीं हैं।
(ii) केवल संक्रमण तत्वों के लिए ही π-कॉम्पलेक्स जाने जाते हैं।
(iii) बहुत-सी धातुओं के लिए CO लिगेण्ड NH3 की अपेक्षा अधिक प्रबल है।
अथवा
निम्नलिखित संकुलों (कॉम्पलेक्सों) की तुलना, उनकी इकाइयों की आकृतियों, चुम्बकीय व्यवहार और इकाइयों में उपस्थित संकर ऑर्बिटलों के सन्दर्भ में कीजिए-
(i) [Ni(CN)4]2-
(ii) [NiCl4]2-
(iii) [CoF6]3- [परमाणु क्रमांक : Ni = 28; Co = 27]
उत्तर:
(i) निकल (Ni) सामान्यतः +2 अवस्था में संकुल बनाता है जिसका इलेक्ट्रॉनिक विन्यास 3d84s0 होता है जिसमें प्रबल क्षेत्र लिगेन्ड की उपस्थिति में भी इलेक्ट्रॉनों के युग्मन से दो d कक्षक रिक्त नहीं हो सकते अतः इलेक्ट्रॉनों का युग्मन नहीं होता एवं इसमें sp³d² संकरण होता है अतः यह उच्च चक्रण संकुल ही बनाता है अर्थात् निम्न चक्रण संकुल नहीं बनते।
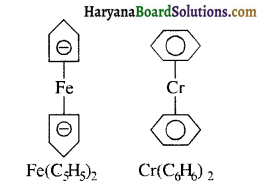
(ii) केवल संक्रमण तत्व ही π कॉम्पलेक्स बनाते हैं क्योंकि इस प्रकार के संकुल बनाने के लिए आवश्यक लिगेन्ड (जैसे बेन्जीन, साइक्लोपेन्टा डाइइनिल ऋणायन) संक्रमण तत्वों के रिक्त कक्षकों के साथ π बन्ध बना लेते हैं। π संकुलों के उदाहरण निम्नलिखित हैं-
फेरोसीन Fe (η5 – C5H5)2
तथा डाइबेन्जीन क्रोमियम Cr (η56 -C6H6)2
(यहाँ η6 का अर्थ है C6H6 के 6C क्रोमियम से जुड़े हैं।)
(iii) स्पेक्ट्रमी रासायनिक श्रेणी से ज्ञात होता है कि CO लिगेन्ड, NH3 की अपेक्षा अधिक प्रबल है क्योंकि CO की इलेक्ट्रॉन देने की प्रवृत्ति, NH3 की अपेक्षा अधिक होती है। क्योंकि कार्बन की विद्युतॠणता का मान नाइट्रोजन से कम होता है।
अथवा
उत्तर:
| सकुल | संकरण | आकृति (ज्यामिति) | चुम्बकीय गुण |
| (i) [Ni(CN)4]2- | dsp² | वर्गाकार समतलीय | प्रतिचुम्बकीय |
| (ii) [NiCl4]2- | sp³ | चतुष्फलकीय | अनुचुम्बकीय |
| (iii) [CoF6]3- | sp³d² | अष्टफलकीय | अनुचुम्बकीय |
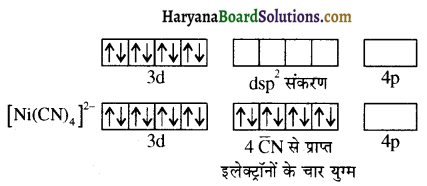
(i) [Ni(CN)4]2- – [Pt(CN)4]2- – वर्ग समतलीय आयन [Ni(CN)4]2- में Ni पर dsp² संकरण होता है। इसमें Ni की ऑक्सीकरण अवस्था +2 है अतः इसका इलेक्ट्रॉनिक विन्यास 3d8 है। इसमें संकरण निम्न प्रकार होता है-
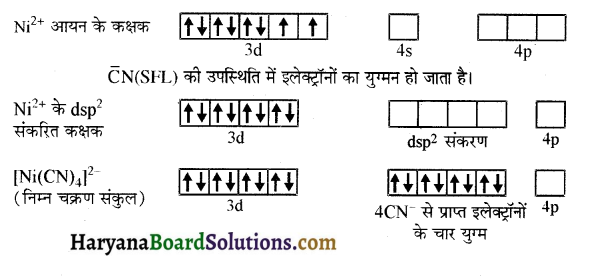
प्रत्येक संकरित कक्षक एक सायनाइड आयन से एक इलेक्ट्रॉन युग्म ग्रहण करता है। अयुग्मित इलेक्ट्रॉनों की अनुपस्थिति के कारण यह संकुल प्रतिचुंबकीय होते हैं।
(ii) [NiCl4]2--[NiCl4]2- आयन में Ni पर sp³ संकरण होता है तथा इसकी ज्यामिति चतुष्फलकीय होती है। यहाँ एक s तथा तीन p कक्षकों के संकरण से चार समान sp³ संकर कक्षक बनते हैं। इस संकुल में निकल +2 ऑक्सीकरण अवस्था में है अतः इसका इलेक्ट्रॉनिक विन्यास 3d8 है। इसमें संकरण निम्न प्रकार होता है-
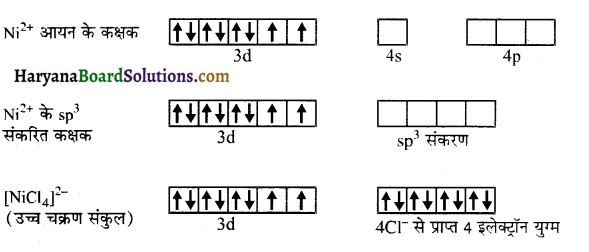
संकरण के पश्चात् भी 3d कक्षकों में दो अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं जिनके कारण यह संकुल आयन अनुचुम्बकीय होता है।
![]()
(iii) [CoF6]3- [परमाणु क्रमांक : Ni = 28; Co = 27] संकुल आयन-इस संकुल में भी कोबाल्ट की ऑक्सीकरण अवस्था +3 है लेकिन F–(WFL) की उपस्थिति में धातु आयन के इलेक्ट्रॉनों का युग्मन नहीं होता अतः इसमें sp³d² संकरण होता है तथा अयुग्मित इलेक्ट्रॉनों की उपस्थिति के कारण यह अनुचुम्बकीय होता है तथा इसे बाह्य कक्षक संकुल या उच्च चक्रण संकुल कहते हैं। इसकी ज्यामिति भी अष्टफलकीय होती है। इस संकुल में संकरण को निम्न प्रकार दर्शाया जा सकता है-
प्रश्न 2.
उपयुक्त कारण देते हुए निम्नलिखित की व्याख्या कीजिए-
(i) निकल न्यून-चक्रण अष्टफलकीय संकुल नहीं बनाता है।
(ii) π-कॉम्प्लेक्स केवल संक्रमण तत्वों के ही ज्ञात हैं।
उत्तर:
(i) निकल (Ni) सामान्यतः +2 अवस्था में संकुल बनाता है जिसका इलेक्ट्रॉनिक विन्यास 3d84s0 होता है जिसमें प्रबल क्षेत्र लिगेन्ड की उपस्थिति में भी इलेक्ट्रॉनों के युग्मन से दो d कक्षक रिक्त नहीं हो सकते अतः इलेक्ट्रॉनों का युग्मन नहीं होता एवं इसमें sp³d² संकरण होता है अतः यह उच्च चक्रण संकुल ही बनाता है अर्थात् निम्न चक्रण संकुल नहीं बनते।
(ii) केवल संक्रमण तत्व ही π कॉम्पलेक्स बनाते हैं क्योंकि इस प्रकार के संकुल बनाने के लिए आवश्यक लिगेन्ड (जैसे बेन्जीन, साइक्लोपेन्टा डाइइनिल ऋणायन) संक्रमण तत्वों के रिक्त कक्षकों के साथ π बन्ध बना लेते हैं। π संकुलों के उदाहरण निम्नलिखित हैं-
फेरोसीन Fe (η5 – C5H5)2
तथा डाइबेन्जीन क्रोमियम Cr (η56 -C6H6)2
(यहाँ η6 का अर्थ है C6H6 के 6C क्रोमियम से जुड़े हैं।)

प्रश्न 3.
उपयुक्त उदाहरण देते हुए निम्नलिखित प्रत्येक पद की व्याख्या कीजिए-
(i) उभयदन्ती लिगेन्ड ( Ambidentate ligand)
(ii) लिगण्ड की दंतिता (Denticity)
(iii) अष्टफलकीय संकुलों में क्रिस्टल क्षेत्र विपाटन।
उत्तर:
(i) उभयदन्ती या उभयदंतुर लिगन्ड वह लिगेन्ड होता है जो दो भिन्न-भिन्न परमाणुओं द्वारा धातु से जुड़ सकता है लेकिन एक समय में केवल एक दाता परमाणु ही बन्ध बनाता है।
उदाहरण – \(\overline{\mathrm{C}}\)N व \(\overline{\mathrm{N}}\)C
(ii) किसी संकुल में उपस्थित लिगेन्ड के उन परमाणओं की संख्या जो धातु के साथ बन्ध बनाते हैं, उसे लिगेन्ड की दंतिता या दन्तुरता कहते हैं।
(iii) अष्टफलकीय संकुलों में क्रिस्टल क्षेत्र विपाटन- एक अष्टफलकीय संकुल में धातु परमाणु छः लिगेन्डों द्वारा घिरा होता है। इसमें धातु के d कक्षकों के इलेक्ट्रॉनों तथा लिगेन्डों के इलेक्ट्रॉनों के मध्य प्रतिकर्षण होता है। जब धातु ad कक्षक लिगेन्ड की ओर सीधे निर्दिष्ट (directed) होते हैं तो प्रतिकर्षण अधिक होता है। dx² – y² तथा dz² कक्षक, लिगेन्ड की दिशा वाले अक्षों पर होते हैं, अतः इन पर प्रतिकर्षण अधिक होता है जिससे इनकी ऊर्जा में वृद्धि हो जाती है जबकि dxy, dyz और dxz कक्षक, अक्षों के बीच में स्थित होते हैं, अतः इनकी ऊर्जा गोलीय क्रिस्टल क्षेत्र की औसत ऊर्जा की तुलना में कम हो जाती है।
इस प्रकार अष्टफलकीय संकुल लगन्ड इलेक्ट्रॉन धातु इलेक्ट्रॉन प्रतिकर्षण के कारण d कक्षकों की समभ्रंशता समाप्त हो जाती है तथा ये तीन निम्न ऊर्जा वाले, t2g कक्षकों तथा दो उच्च ऊर्जा वाले, eg कक्षकों में विभाजित हो जाते हैं। इस प्रकार समान eg ऊर्जा वाले कक्षकों का, लिगेन्डों की निश्चित ज्यामिति में उपस्थिति से दो भागों में विपाटन क्रिस्टल क्षेत्र विपाटन कहलाता है तथा इस ऊर्जा अंतर को ∆0 [ यहाँ O = अष्टफलकीय (octahedral)] से दर्शाते हैं । eg कक्षकों की ऊर्जा में (3/5) ∆0 के बराबर वृद्धि होती है तथा t2g कक्षकों की ऊर्जा में (2/5) ∆0 के बराबर कमी होती है। प्रबल क्षेत्र लिगेन्ड की उपस्थिति में ∆0 का मान अधिक होता है जबकि दुर्बल क्षेत्र लिगेन्ड की उपस्थिति में यह मान कम होता है।
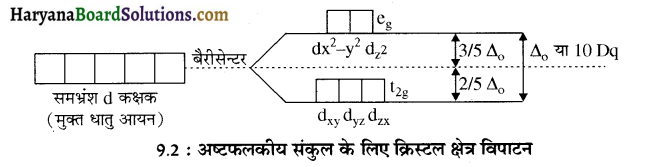
∆ को प्रभावित करने वाले कारक – क्रिस्टल क्षेत्र विपाटन (∆) निम्नलिखित कारकों पर निर्भर करता है-
- धातु की प्रकृति
- धातु आयन पर आवेश
- लिगेन्ड की प्रकृति
- संकुल की ज्यामिति
- d- इलेक्ट्रॉनों की संख्या
ये कारक संकुल आयन के रंग को भी प्रभावित करते हैं। धातु आयन पर आवेश बढ़ने से तथा प्रबल क्षेत्र लिगेन्डों की उपस्थिति में विपाटन अधिक होता है।
प्रश्न 4.
निम्नलिखित उपसहसंयोजन अवस्थाओं ( एन्टीटियों) के नाम और उनके त्रिविम- समावयवियों की संरचनाएँ दीजिए-
(i) [ Co(en)2Cl2]+ (en = एथेन – 1, 2 – डाइऐमीन )
(ii) [Cr(C2O4)3]3-
(iii) [Co(NH3)3Cl3]
(परमाणु क्रमांक Cr = 24, Co = 27)
उत्तर:
(i) [Co(en)2 Cl2]+ का नाम बिस (एथेन – 1,2- डाइऐमीन) डाइक्लोरिडोकोबाल्ट (III) आयन है।
(ii) [Cr(C2O4)3]3- ट्राइऑक्सेलेटो क्रोमेट (III) आयन
(iii) ट्राइऐम्मीनट्राइक्लोरिडो कोबाल्ट (III)
प्रश्न 5.
अणुसूत्र Co (NH3)5SO4 Br वाले दो संकुलों को बोतल A व B में अलग-अलग भरा गया है। इनमें से एक संकुल BaCl2 के साथ श्वेत अवक्षेप जबकि दूसरा सिल्वर नाइट्रेट के साथ हल्का पीला अवक्षेप देता है तो बोतल A व B में उपस्थित संकुलों के सूत्र लिखिए तथा अलग-अलग अभिक्रिया प्रदर्शित करने का कारण समझाइये।
उत्तर:
अणु सूत्र Co ( NH3)5 SO4 Br वाले दो संकुलों में से बोतल A में [Co ( NH3 )5 Br] SO4 तथा बोतल B में [Co(NH3)5SO4]Br संकुल का विलयन है।
संकुल A के आयनन से SO2-2 आयन प्राप्त होगा जो BaCl2 के साथ क्रिया करके BaSO4 का श्वेत अवक्षेप देता है जबकि संकुल B आयनन से प्राप्त Br आयन AgNO3के साथ AgBr का हल्का पीला अवक्षेप देता है। अतः संकुल A तथा B एक-दूसरे के आयनन समावयवी हैं।
प्रश्न 6.
क्रिस्टल क्षेत्र विपाटन सिद्धान्त के आधार पर चतुष्फलकीय उपसहसंयोजन यौगिकों के बनने में d-कक्षकों के विपाटन को समझाते हुए बताइये कि ये संकुल हमेशा उच्च चक्रण वाले ही क्यों बनते हैं?
उत्तर:
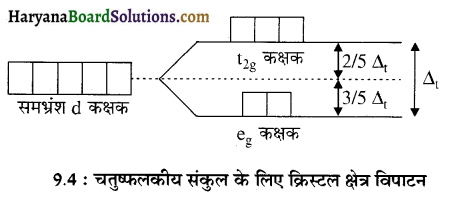
चतुष्फलकीय संकुलों में क्रिस्टल क्षेत्र विपाटन- चतुष्फलकीय संकुलों में d कक्षकों का विपाटन अष्टफलकीय संकुलों से विपरीत तथा कम होता है। अर्थात् eg कक्षकों की ऊर्जा t2g कक्षकों से कम होती है। समान धातु, समान लिगन्डों तथा धातु तथा लिगेन्ड के बीच की दूरी समान होने पर ∆t = 4 / 9 ∆0, ∆t = चतुष्फलकीय कक्षकों की क्रिस्टल क्षेत्र विपाटन ऊर्जा, अतः कक्षकों की विपाटन ऊर्जा इतनी कम होती है कि इलेक्ट्रॉनों का युग्मन कक्षकों में नहीं होता अतः चतुष्फलकीय संकुल सामान्यतः उच्च चक्रण युक्त ही होते हैं।
प्रश्न 7.
निम्नलिखित संकुल यौगिकों के आई.यू.पी.ए.सी. नाम लिखिए-
(अ) [CoCl2 (en)2 ]Cl
(ब) K3[Fe (CN)6]
उत्तर:
(अ) डाइक्लोरिडोबिस (एथेन-1, 2- डाइऐमीन) कोबाल्ट (III) क्लोराइड
(ब) पोटैशियम हेक्सासायनोफेरेट (III)
प्रश्न 8.
[NiCl4]2- आयन अनुचुम्बकीय है जबकि [Ni(CN)4]2- आयन प्रतिचुम्बकीय है। संयोजकता बंध सिद्धान्त की सहायता से समझाइए।
उत्तर:
वर्ग समतलीय आयन [Ni (CN)4]2- में Ni पर dsp² संकरण पाया जाता है। इसमें Ni की ऑक्सीकरण अवस्था + 2 है अतः इसका इलेक्ट्रॉनिक विन्यास 3d8 है। इसमें संकरण निम्न प्रकार होता है-
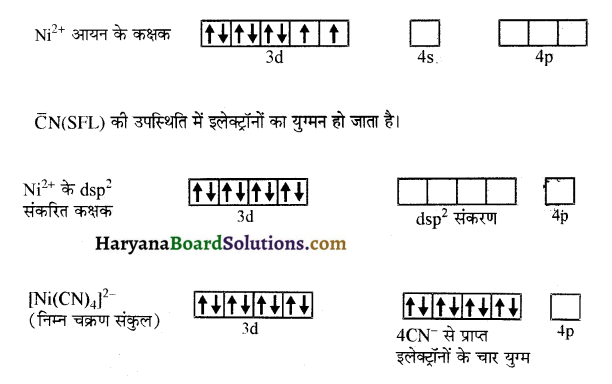
प्रत्येक संकरित कक्षक एक सायनाइड आयन से एक इलेक्ट्रॉन युग्म प्राप्त करता है। अयुग्मित इलेक्ट्रॉन अनुपस्थित होने के कारण यह संकुल प्रतिचुंबकीय है।
[NiCl4]2-आयन में Ni पर sp³ संकरण पाया जाता है तथा इसकी ज्यामिति चतुष्फलकीय होती है।
इसमें एक s तथा तीन कक्षकों के संकरण से चार समान sp³ संकर कक्षक बनते हैं। यहाँ निकल + 2 ऑक्सीकरण अवस्था में है तथा इस आयन का इलेक्ट्रॉनिक विन्यास 3d8 है अतः इसमें संकरण निम्न प्रकार होता है-
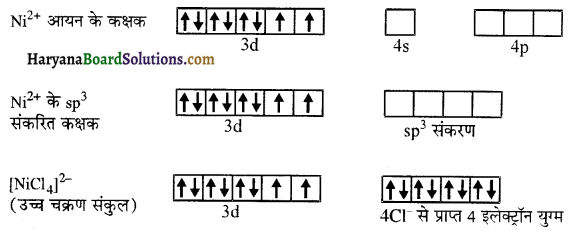
संकरण के पश्चात् भी 3d कक्षकों में दो अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं जिनके कारण यह संकुल आयन अनुचुंबकीय होता है।
प्रश्न 9.
उभयदंती लिगन्ड का एक उदाहरण लेकर बताइए कि यह क्यों उभयदन्ती लिगेन्ड कहलाता है?
उत्तर:
वह लिगेन्ड जो दो भिन्न परमाणुओं द्वारा धातु आयन के साथ जुड़ सकता है, उसे उभयदंती लिगेन्ड कहते हैं। उदाहरण – NO2, यह नाइट्रोजन (NO2) अथवा ऑक्सीजन (\(\overline{\mathrm{O}}\)NO) द्वारा धातु आयन से जुड़ सकता है।
प्रश्न 10.
संकुल यौगिक K3[ Fe(C2O4)3] में केन्द्रीय धातु परमाणु की ऑक्सीकरण संख्या तथा उपसहसंयोजन संख्या बताइए।
उत्तर:
संकुल यौगिक K3[Fe (C2O4)3] में केन्द्रीय धातु परमाणु (Fe) की ऑक्सीकरण संख्या + 3 तथा उपसहसंयोजन संख्या 6 है।
ऑक्सीकरण संख्या की गणना निम्न प्रकार की जाती है-
K3[Fe (C2O4)3]
+ 3 + x – 2 ( 3 ) = 0
+ 3 + x – 6 = 0
x = + 3
Fe से तीन द्विदंतुर लिगेन्ड (C2O42-) जुड़े हैं अतः इसकी उपसहसंयोजन संख्या 6 है।
प्रश्न 11.
समपक्ष [CoCl2 (en)2 ] तथा फलकीय [Co(NH3)3(NO2)3] समावयवियों की संरचना दीजिए।
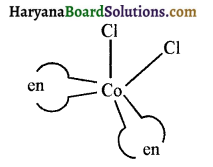
उत्तर:
(i) समपक्ष [CoCl2 (en)2] की संरचना
(ii) फलकीय [Co(NH3)3(NO2)3] की संरचना
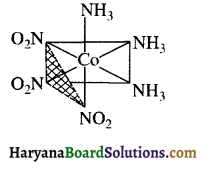
प्रश्न 12.
संकुल [NiCL]2- के लिए निम्नलिखित प्रश्नों के उत्तर दीजिए-
(i) IUPAC नाम
(ii) संकरण का प्रकार
(iii) संकुल की ज्यामिति।
उत्तर:
(i) टेट्राक्लोरिडोनिकलेट (II) आयन
(ii) sp³ संकरण
(iii) चतुष्फलकीय ज्यामिति।
प्रश्न 13.
संकुल [Cr (NH3)4 Cl2]Cl का IUPAC नाम लिखिए तथा इसमें किस प्रकार की समावयवता पाई जाती है?
उत्तर:
संकुल [Cr(NH3)4 Cl2] Cl का IUPAC नाम- टेट्राएम्मीन डाइक्लोरिडो क्रोमियम (III ) क्लोराइड है तथा इसमें ज्यामितीय समावयवता पाई जाती है, अर्थात् इसके दो रूप होते हैं – समपक्ष एवं विपक्ष।
प्रश्न 14.
(अ) धातुओं के शुद्धिकरण के क्षेत्र में उपसहसंयोजन यौगिकों का अनुप्रयोग एक उदाहरण के साथ समझाइए
(ब) उपसहसंयोजन यौगिक [Ag (NH3)2] [Ag(CN)2] का IUPAC नाम लिखिए।
उत्तर:
(अ) धातुओं का शुद्धिकरण उनके संकुल बनाकर तथा उसे पुनः अपघटित करके किया जाता है। उदाहरण- अशुद्ध निकल को पहले [Ni(CO)4] में परिवर्तित किया जाता है तथा फिर इसे अपघटित करके शुद्ध निकल प्राप्त कर लिया जाता है।
(ब) [Ag (NH3)2] [Ag (CN)2] का IUPAC नाम डाइएम्मीनसिल्वर (I) डाइसायनो अर्जेन्टेट (I) है।
प्रश्न 15.
द्विक लवण तथा संकुल में अन्तर समझाते हुए प्रत्येक का एक-एक उदाहरण दीजिए।
उत्तर:
द्विक लवण तथा संकुल दोनों ही दो या दो से अधिक स्थायी यौगिकों के रससमीकरणमितीय अनुपात में मिलाने से बनते हैं। फिर भी दोनों में निम्नलिखित अन्तर पाए जाते हैं-
(i) द्विक लवण, जल में पूर्ण रूप से साधारण आयनों में वियोजित हो जाते हैं जबकि संकुल, जल में वियोजित होकर संकुल आयन तथा प्रति आयन देते हैं।
(ii) द्विक लवण का विलयन सभी आयनों का परीक्षण देता है जबकि संकुल का विलयन संकुल आयन तथा प्रतिआयन का ही परीक्षण देता है।
(iii) द्विक लवण में आयनिक बन्ध पाया जाता है जबकि संकुल में उपसहसंयोजी बन्ध भी पाया जाता है। मोहर लवण (FeSO4 . (NH4)2SO4 . 6H2O) ( फेरस अमोनियम सल्फेट) द्विक लवण का उदाहरण है जबकि पोटैशियम फेरो सायनाइड K4[Fe(CN)6] संकुल का उदाहरण है।
प्रश्न 16.
[Cr (H2O) Br2]Cl के आयनन समावयवी का सूत्र लिखिए।
उत्तर:
[Cr(H2O)4 Br2] Cl का आयनन समावयवी [Cr(H2O)4BrCl] Br होता है।
प्रश्न 17.
मर्क्युरी टेट्राथायोसायनेटो – कोबाल्टेट (III) उपसहसंयोजक यौगिक का सूत्र लिखिए।
उत्तर:
Hg [Co(SCN)4]
प्रश्न 18.
संयोजकता बंध सिद्धान्त के आधार पर समझाइए कि [Ni(CN)4]2- एक निम्न प्रचक्रण संकुल आयन है।
उत्तर:
वर्ग समतलीय आयन [Ni(CN)4]2- में Ni पर dsp² संकरण पाया जाता है। इसमें Ni की ऑक्सीकरण अवस्था +2 है। अतः इसका इलेक्ट्रॉनिक विन्यास 3d8 है। इसमें संकरण निम्न प्रकार होगा-
Ni2+ आयन के कक्षक
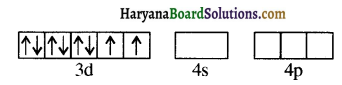
\(\overline{\mathrm{C}}\)N (प्रबल क्षेत्र लिगन्ड) की उपस्थिति में इलेक्ट्रॉनों का युग्मन हो जाता है।
Ni2+ के dsp² संकरित कक्षक
प्रत्येक संकरित कक्षक एक \(\overline{\mathrm{C}}\)N से एक इलेक्ट्रॉन युग्म प्राप्त करता है। अयुग्मित इलेक्ट्रॉनों की अनुपस्थिति के कारण यह एक निम्न प्रचक्रण संकुल आयन है।
![]()
प्रश्न 19.
[Co(NH3)5ONO]Cl2 किस प्रकार की समावयवता प्रदर्शित करता है?
(ii) क्रिस्टल क्षेत्र सिद्धान्त के आधार पर यदि ∆0 < P है, तो d+ आयन का इलेक्ट्रॉनिक विन्यास लिखिए।
(iii) [Fe(CN)′′]’ में संकरण अवस्था और इसका आकार लिखिए।
(Fe का परमाणु क्रमांक = 26)
उत्तर:
(i) [Co(NH3)5ONO]Cl2 बन्धनी तथा आयनन समावयवता दर्शाता है क्योंकि इसमें ONO में दाता परमाणु O है जबकि NO2 में दाता परमाणु N है। इसके साथ ही ŌNO व \(\overline{\mathrm{C}}\)l के विनिमय से आयनन समावयवता होती है।
(ii) जब ∆0 < P, तो क्रिस्टल क्षेत्र सिद्धान्त के अनुसार + आयन का इलेक्ट्रॉनिक विन्यास t2g³eg1 होगा।
(iii) [Fe(CN)6]3- में d²sp³ संकरण होता है क्योंकि इसमें \(\overline{\mathrm{C}}\)l प्रबल श्क्षेत्र लिगेन्ड है जिसकी उपस्थिति में Fe+3 आयन में इलेक्ट्रॉनों का युग्मन हो जाता है और इस आयन का आकार अष्टफलकीय है।
प्रश्न 20.
(i) निम्नलिखित कॉम्प्लेक्स का आई.यू.पी.ए.सी. नाम लिखिए-
[Pt(NH3)(H2O)Cl2]
(ii) निम्नलिखित कॉम्प्लेक्स का सूत्र लिखिए- ट्रिस (एथेन – 1, 2 – डाइऐमीन) क्रोमियम (III ) क्लोराइड
उत्तर:
(i) इस कॉम्प्लेक्स (संकुल) का आई. यू. पी. ए. सी. नाम ऐम्मीन एक्वा डाइक्लोरिडो प्लेटिनम (II) है।
(ii) इस कॉम्प्लेक्स का सूत्र [Cr(en)3]Cl3 है।