Haryana State Board HBSE 11th Class Chemistry Solutions Chapter 9 हाइड्रोजन Textbook Exercise Questions and Answers.
Haryana Board 11th Class Chemistry Solutions Chapter 9 हाइड्रोजन
प्रश्न 1.
हाइड्रोजन के इलेक्ट्रॉनिक विन्यास के आधार पर आवर्त सारणी में इसकी स्थिति को युक्तिसंगत ठहराइए।
उत्तर:
हाइड्रोजन का इलेक्ट्रॉनिक विन्यास 1s1 होता है। आवर्त सारणी में इसकी स्थिति अनिश्चित है क्योंक यह क्षार धातुओं तथा हैलोजन दोनों के साथ समानताएँ प्रदर्शित करती है।
क्षार धातु से समानता – हाइड्रोजन तथा क्षार धातुओं दोनों के बाह्यतम कोश में एक s इलेक्ट्रॉन होता है।
H – 1s1
Li – 1s2, 2s1
Na – 1s2, 2s2 2p6, 3s1
K – 1s2, 2s2 2p6, 3s23p6, 4s1
हैलोजन से समानता – अक्रिय गैस की स्थायी संरचना प्राप्त करने के लिए हाइड्रोजन तथा हैलोजन दोनों को ही एक-एक इलेक्ट्रॉन की आवश्यकता होती है।
H – 1s1
F – 1s2, 2s2, 2p5
Cl – 1s2, 2s22p6, 3s23p5
निष्कर्ष – इलेक्ट्रॉंनिक विन्यास के आधार पर हम सिद्ध कर सकते हैं कि यह ‘हाइड्रोजन’ क्षार धातुओं तथा हैलोजन दोनों के साथ समानता प्रदर्शित करती है अतः इसे क्षार धातुओं के साथ ‘IA’ ग्रुप में रखना तर्क संगत नहीं है।
प्रश्न 2. हाइड्रोजन के समस्थानिकों के नाम लिखिए तथा बताइए कि इन समस्थानिकों का द्रव्यमान अनुपात क्या है ?
उत्तर:
हाइड्रोजन के तीन समस्थानिक होते हैं।
(i) प्रोटियम (1H1)
(ii) ड्यूटीरियम (1H2)
(iii) ट्राइटियम (1H3)
इन समस्थानिकों का द्रव्यमान अनुपात निम्नवत् है।
प्रश्न 3.
सामान्य परिस्थितियों में हाइड्रोजन एकल परमाण्विक की अपेक्षा द्विपरमाण्विक रूप में क्यों पाया जाता है ?
उत्तर:
एकल परमाण्विक रूप में हाइड्रोजन परमाणु के K-कोश में केवल 1 इलेक्ट्रॉन होता है क्योंकि इसका इलेक्ट्रॉनिक विन्यास (1s1) होता है। जबकि द्विपरमाण्विक रूप में इसका K-कोश पूर्ण रूप से भर जाता है, इसका तात्पर्य H2 के रूप में यह उत्कृष्ट गैस (हीलियम) का विन्यास प्राप्त कर लेती है इसलिए द्विपरमाण्विक रूप स्थायी होता है जबकि एकल परमाण्विक रूप अस्थायी होता है।
![]()
प्रश्न 4.
‘कोल गैसीकरण’ से प्राप्त हाइड्रोजन का उत्पादन कैसे बढ़ाया जा सकता है ?
उत्तर:
कोल से ‘संश्लेषण गैस’ या ‘सिन्नैस’ का उत्पादन करने की प्रक्रिया को ‘कोलगैसीकरण’ (coalgasification) कहते हैं-
![]()
सिन्गैस में उपस्थित कार्बन मोनोक्साइड को आयरन क्रोमेट उत्प्रेरक की उपस्थिति में भाप से अभिकृत कराने पर हाइड्रोजन का उत्पादन बढ़ाया जा सकता है।
![]()
यह भाप-अंगार गैस सृति अभिक्रिया कहलाती है।
प्रश्न 5.
विद्युत-अपघटन विधि द्वारा हाइड्रोजन वृहद् स्तर पर किस प्रकार बनाई जा सकती है ? इस प्रक्रम में विद्युत-अपघट्य की क्या भूमिका है ?
उत्तर:
विद्युत-अपघटन विधि द्वारा हाइड्रोजन का निर्माण (Formation of Dihydrogen by electrolytic process)-सर्वप्रथम शुद्ध जल में अम्ल तथा क्षारक की कुछ बूँदें मिलाकर इसे विद्युत का सुचालक बना लेते हैं।
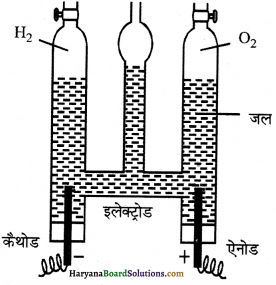
अब इसका विद्युत-अपघटन ( वोल्टामीटर में) करते हैं। जल के विद्युत-अपघटन से ऋणोद (कैथोड) पर हाइड्रोजन और धनोद (ऐनोड) पर ऑक्सीजन (सह-उत्पाद के रूप में) एकत्रित होती है। ऐनोड तथा कैथोड को एक ऐस्बेस्टस डायफ्राम की सहायता से पृथक्कृत कर दिया जाता है जो मुक्त होने वाली हाइड्रोजन तथा ऑक्सीजन को मिश्रित नहीं होने देता।
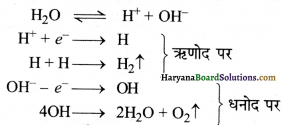
इस प्रकार प्राप्त डाई-हाइड्रोजन पर्याप्त रूप से शुद्ध होती है। विद्युत-अपघट्य की भूमिका (Role of electrolyte) – शुद्ध जल विद्युत-अपघट्य नहीं होता और न ही विद्युत का चालक होता है। शुद्ध जल में अम्ल या क्षार की कुछ मात्रा मिलाकर इसे विद्युत-अपघट्य बनाया जाता है।
प्रश्न 6.
निम्नलिखित समीकरणों को पूरा कीजिए-

उत्तर:

प्रश्न 7.
डाइहाइड्रोजन की अभिक्रियाशंलता के पदों में H – H बन्ध की उच्च एन्थैल्पी के परिणामों की विवेचना कीजिए ?
उत्तर:
डाइहाइड्रोजन की अभिक्रियाशीलता के पदों में H – H बन्ध की उच्च एन्थैल्पी के परिणामों की विवेचना निम्न प्रकार की जा सकती है। H – H बन्ध की बन्ध एन्थैल्पी काफी उच्च होती है जो किसी भी तत्व के दो परमाणुओं के एकल बन्ध के लिए अधिकतम है। इस उच्च बन्ध एन्थैल्पी का कारण हाइड्रोजन का लघु परमाण्वीय आकार तथा लघु बन्ध लम्बाई है। इस कारण से हाइड्रोजन का इसके परमाणुओं में वियोजन केवल 2000K के ऊपर लगभग 0.081% ही होता है जो 5000K पर बढ़कर 95.5% तक हो जाता है। अत: उच्च H – H बन्ध एन्थैल्पी के कारण कक्ष ताप पर H2 अपेक्षाकृत निष्क्रिय हैं। यह केवल विशिष्ट परिस्थितियों में ही रासायनिक संयोग करता है।
प्रश्न 8.
हाइड्रोजन के (i) इलेक्ट्रॉन न्यून (ii) इलेक्ट्रॉन परिशुद्ध तथा (iii) इलेक्ट्रॉन समृद्ध यौगिकों से आप क्या समझते हैं ? उदाहरण द्वारा समझाइये।
उत्तर:
(i) इलेक्ट्रॉन न्यून यौगिक-ये सह-संयोजक हाइड्राइड का प्रकार है। इस प्रकार के हाइड्राइड में, लुइस संरचना लिखने के लिए इलेक्ट्रॉनों की संख्या अपर्याप्त होती है। ये आवर्त सारणी के 13 वें वर्ग के सभी तत्वों द्वारा बनाये जाते हैं। ये लुइस अम्ल की भाँति कार्य करते है। ये इलेक्ट्रॉन ग्राही होते हैं।
उदाहरण- BH3, AlH3 आदि। ये अधिकतर बहुलक के रूप में पाये जाते हैं। जैसे B2H6, B4 H10, (AlH3)n आदि।
(ii) इलेक्ट्रॉन परिशुद्ध यौगिक-इस प्रकार के हाइड्राइड में परम्परागत लुइस संरचना के लिए आवश्यक इलेक्ट्रॉन की संख्या होती है। आवर्त सारणी के 14 वें वर्ग के सभी तत्व इस प्रकार के यौगिक बनाते हैं। इनकी ज्यामिती चतुष्फलकीय होती है।
उदाहरण- CH4, SiH4, GeH4 आदि ।
(iii) इलेक्ट्रॉन समृद्ध यौगिक-इस प्रकार के हाइड्राइड में इलेक्ट्रॉन आधिक्य एकाकी इलेक्ट्रॉन युग्म के रूप में उपस्थित रहते हैं। आवर्त सारणी में 15 वें से 17 वें वर्ग तक के सभी तत्व इस प्रकार के यौगिक बनाते हैं।
उदाहरण-
NH3, PH3, AsH3 एक एकाकी इलेक्ट्रान युग्म होता हैं।
H2O, H2S, H2Se दो एकाकी इलेक्ट्रान युग्म होते हैं।
HF, HCl, HBr, HI तीन एकाकी इलेक्ट्रान युग्म होते हैं।
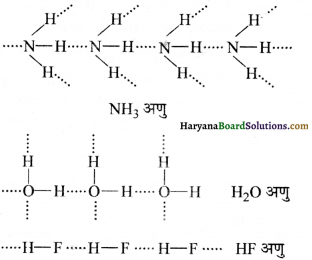
ये लुइस क्षार की भाँति कार्य करते हैं। ये इलेक्ट्रॉन दाता होते हैं। उच्च विद्युत ऋणात्मकता वाले परमाणु जैसे- N,O तथा F के हाइड्राइड पर एकाकी इलेक्ट्रॉन युग्म होने के कारण अणुओं में हाइड्रोजन बंध बनता है जिसके कारण अणुओं में संगुणन होता है।
प्रश्न 9.
संरचना एवं रासायनिक अभिक्रियाओं के आधार पर बताइए कि इलेक्ट्रॉन न्यून हाइड्राइड के कौन-कौन से अभिलक्षण होते हैं ?
उत्तर:
(i) वे आण्विक-हाइड्राइड जिनमें केन्द्रीय परमाणु पर अष्टक नहीं होता है, इलेक्ट्रॉन न्यून हाइड्राइड कहलाते हैं। वर्ग 13 के तत्वों के हाइड्राइड; जैसे – B2H6, (AlH3)n आदि, इलेक्ट्रॉन न्यून अणु होते हैं तथा इसलिए किसी दाता अणु; जैसे- NH3, PF3, CO आदि से इलेक्ट्रॉन युग्म ग्रहण करने की प्रवृत्ति रखते हैं तथा योगात्मक यौगिक बनाते हैं। इन योगात्मक यौगिकों के निर्माण में इलेक्ट्रॉन न्यून हाइड्राइड लुइस अम्लों की भाँति तथा दाता अणु लुइस क्षारकों की भाँति व्यवहार करते हैं।

(ii) बोरोंन के हाइड्राइड पाना के साथ क्रिया करक हाइड्राजन मुक्त करते हैं।
B2H6 + 6H2O → B(OH)3 + 6H2
(iii) क्योंकि इनमें सामान्यतः सहसंयोजक बन्ध बनाने के लिए पर्याप्त मात्रा में इलेक्ट्रॉन नहीं होते हैं अतः ये संगुणन करते हैं और बहुलक के रूप में पाये जाते हैं। जैसे- B2H6, B4H10, (AlH3)n आदि।
(iv) इलेक्ट्रॉन न्यून होने के कारण इसकी क्रियाशीलता अधिक होती है क्योंकि ये अपनी इलेक्ट्रॉन न्यूनता को दूर करने के लिए जल्द से जल्द अन्य यौगिक के साथ अभिक्रिया कर लेते हैं।
उदाहरण –

प्रश्न 10.
क्या आप आशा करते हैं कि (CnH2n + 2) कार्बनिक हाइड्राइड लुइस अम्ल या क्षार की भाँति कार्य करेंगे ? अपने उत्तर को युक्ति संगत ठहराइए।
उत्तर:
CnH2n + 2 कार्बनिक हाइड्राइड इलेक्ट्रॉन परिशुद्ध प्रकार के हाइड्राइड होते हैं अर्थात् इनमें इलेक्ट्रॉन की संख्या उतनी ही होती है जितनी कि इन्हें सह-संयोजक बन्ध बनाने के लिए चाहिए होती है। अतः ये न तो इलेक्ट्रॉन को ग्रहण करते हैं और न ही उन्हें त्यागते हैं। अर्थात ये न तो लुइस अम्ल की तरह न ही लुइस क्षार की भाँति कार्य करते हैं।
प्रश्न 11.
अरससमीकरणमितीय हाइड्राइड से आप क्या समझते हैं ? क्या आप क्षारीय धातुओं से ऐसे यौगिकों की आशा करते हैं ? अपने उत्तर को न्याय संगत ठहराइए।
उत्तर:
अरससमीकरणमितीय हाइड्राइड-संक्रमण तथा अन्त: संक्रमण धातुएँ हाइड्रोजन को अपने जालक के अन्तराकोश में अवशोषित करके इस प्रकार के हाइड्राइड बनाती है। इनमें धातु और हाइड्रोजन का अनुपात समानुपात न होकर भिन्नात्मक होता है। इनका भिन्नात्मक अनुपात ताप तथा दाब के साथ बदलता रहता है।
क्षार धातुएँ प्रबल अपचायक होती हैं। ये अपने इलेक्ट्रॉन को हाइड्रोजन परमाणु को देकर H– आयन बनाती हैं। क्षार धातुओं के हाइड्राइड आयनिक होते हैं। क्योंकि ये क्षार धातुओं से इलेक्ट्रॉन ग्रहण करके उस आयन के साथ आयनिक बन्ध बनाते हैं। अर्थात् क्षार धातुएँ अरससमीकरणमितीय हाइड्राइड नहीं बनातीं। ये आयनिक हाइड्राइड अर्थात् रससमीकरणमितीय यौगिक बनाती हैं।
![]()
प्रश्न 12.
हाइड्रोजन भण्डारण के लिए धात्विक हाइड्राइड किस प्रकार उपयोगी हैं ? समझाइए।
उत्तर:
हाइड्रोजन के उच्च ज्वलनशील होने के कारण इसका भण्डारण करना एक कठिनाई का विषय है। इस कठिनाई का एक हल यह है कि हाइड्रोजन का भण्डारण इसके मैग्नीशियम, मैग्नीशियम-निकिल तथा आयरन-टाइटेनियम मिश्र-धातु के साथ बने यौगिक के टैंक (tank) के रूप में किया जाए। ये धातु मिश्र-धातु छिद्रों की भाँति हाइड्रोजन की वृहद् मात्रा को अवशोषित कर लेती हैं तथा धात्विक हाइड्राइड बनाती हैं।
धात्विक हाइड्राइड तन्त्र को जलाना अथवा इसका विस्फोट होना सम्भव नहीं होता; अतः इसे हाइड्रोजन भण्डारण की सुरक्षित युक्ति माना जा सकता है। चूँकि हाइड्रोजन इन धातुओं से रासायनिक रूप से जुड़ी रहती है तथा यह धातु में तब तक भण्डारित रहती है जब तक कि इसे अतिरिक्त ऊर्जा न दी जाए। अतः हाइड्रोजन भण्डारण के लिए धात्विक हाइड्राइड अत्यन्त उपयोगी होते हैं।
प्रश्न 13.
कर्तन और वेल्डिंग में परमाणवीय हाइड्रोजन अथवा ऑक्सी-हाइड्रोजन टॉर्च किस प्रकार कार्य करती है ? समझाइए।
उत्तर:
परमाण्विक हाइड्रोजन या ऑक्सी-हाइड्रोजन टॉर्च का उपयोग कर्तन तथा वेल्डिंग में होता है। परमाण्विक हाइड्रोजन, परमाणु (जो विद्युत आर्क की सहायता से डाइहाइड्रोजन के वियोजन से बनते हैं) का पुनर्संयोग वेल्डिंग की जानी वाली धातुओं की सतह पर लगभग 4000K तक ताप उत्पन्न कर देता है।
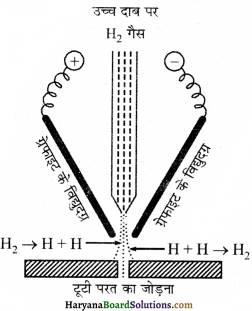
ऑक्सी-हाइड्रोजन टॉर्च की ज्वाला अत्यन्त उच्च ताप (3000K से भी अधिक) उत्पन्न करती है जो वेल्डिंग कार्य में प्रयोग किया जाता है। उपरोक्त कार्य में होने वाली अभिक्रिया निम्न है।
![]()
उपरोक्त अभिक्रिया से बनने वाली परमाण्विक हाइड्रोजन का जीवन 0.3 sec होता है। अतः यह तुरन्त आण्विक हाइड्रोजन में परिवर्तित हो जाती है और साथ-साथ अत्यधिक मात्रा में ऊर्जा उत्पन्न करती है जो वेल्डिंग तथा कर्तन में प्रयोग होती है।
प्रश्न 14.
NH3, H2O तथा HF में से किसका हाइड्रोजन बन्ध का परिमाण उच्चतम अपेक्षित है और क्यों ?
उत्तर:
उच्च इलेक्ट्रॉन ऋणात्मकता होने के कारण N, O तथा F हाइड्रोजन बन्ध बनाते हैं। HF अणु में हाइड्रोजन बन्ध का परिमाण उच्चतम अपेक्षित है; क्योंकि फ्लुओरीन आवर्त सारणी का सर्वाधिक विद्युत ऋणी तत्व (4.0) है परिणामस्वरूप H-F बन्ध प्रबल ध्रुवीय होने के कारण प्रबल अन्तर-आण्विक हाइड्रोजन बन्ध प्रदर्शित करता है।
प्रश्न 15.
लवणीय हाइड्राइड जल के साथ प्रबल अभिक्रिया करके आग उत्पन्न करती है क्या इसमें CO2 (जो एक सुपरिचित अगिनशामक है) का उपयोग हम कर सकते हैं ? समझाइए।
उत्तर:
लवणीय हाइड्राइड जैसे- NaH, CaH2 आदि जल के साथ प्रबल अभिक्रिया करके हाइड्रॉक्साइड तथा हाइड्रोजन उत्पन्न करते हैं। यह हाइड्रोजन आग पकड़ लेती है तथा अभिक्रिया अत्यधिक ऊष्माक्षेपी होती है।
NaH(s) + H2O(l) → NaOH(aq) + H2(g) + ऊष्मा
CaH2(s) + 2H2O(l) → Ca(OH)2(aq) + 2H2(g) + ऊष्मा
इस अभिक्रिया में उत्पन्न आग के लिए हम CO2 को अग्निशामक की तरह प्रयोग नहीं कर सकते हैं। क्योंकि इसमें बने हाइड्रॉक्साइड से CO2 क्रिया करके कार्बोनेट बना लेती है।
2NaOH(aq) + CO2(g) → Na2CO3(aq) + H2O(aq)
इसके साथ-साथ CO2 धातु हाइड्राइड से अभिक्रिया करके अपचयित हो जाती है।
NaH + CO2 → HCOONa
अत: अभिक्रिया में उत्पन्न आग को रेत से बुझाया जा सकता है।
प्रश्न 16.
निम्नलिखित को व्यवस्थित कीजिए-
(i) CaH2, BeH2 तथा TiH2 को उनकी बढ़ती हुई विद्युत्चालकता के क्रम में।
(ii) LiH, NaH तथा CsH को आयनिक गुण के बढ़ते हुए क्रम में।
(iii) H-H, D-D तथा F-F को उनके बन्ध-वियोजन एन्थैल्पी के बढ़ते हुए क्रम में।
(iv) NaH, MgH2 तथा H2O को बढ़ते हुए अपचायक गुण के क्रम में।
उत्तर:
(i) BeH2 <TiH2 < CaH2 : विद्युत् चालकता का बढ़ता क्रम।
(ii) LiH < NaH < CsH : आयनिक गुण का बढ़ता क्रम।
(iii) F-F (iv) H2O < MgH2 < NaH: अपचायक गुण का बढ़ता क्रम।
प्रश्न 17.
H2O तथा H2O2 की संरचनाओं की तुलना कीजिए।
उत्तर:
जल-अणु की संरचना:
गैस-प्रावस्था में जल एक बंकित (bent) अणु है तथा आबन्ध कोण एवं O-H आबन्ध दूरी के मान क्रमशः 104.5° तथा 95.7 pm हैं, जैसा चित्र (क) में प्रदर्शित किया गया है अत्यधिक ध्रुवित अणु चित्र- (ख) में तथा चित्र-(ग) में जल के अणु में ऑर्बिटल अतिव्यापन दर्शाया गया है।
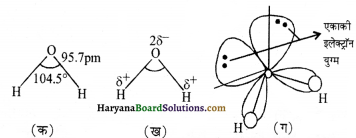
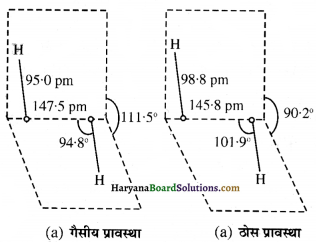
हाइड्रोजन परॉवसाइड अणु की संरचना:
हाइड्रोजन परॉक्साइड की संरचना असमतलीय (खुली पुस्तक के समान ) होती है। गैसीय प्रावस्था तथा ठोस प्रावस्था में इसकी आण्विक संरचना को निम्न चित्र में दर्शाया गया है।
प्रश्न 18.
जल के स्वतः प्रोटोनीकरण से आप क्या समझते हैं ? इसका क्या महत्त्व है ?
उत्तर:
जल का स्वतः प्रोटोनीकरण (Auto-protolysis of water)-एक जल-अणु किसी दूसरे जल-अणु से प्रोटॉन ग्रहण करके H3O+ तथा OH+ बनाता है। यह प्रक्रिया जल का स्वतः प्रोटोनीकरण कहलाती है।
H2O(l) + H2O(l) → H3O+(aq) + OH–(aq)
प्रोटॉनीकरण का महत्त्व यह है कि जल अम्ल तथा क्षारक दोनों की भाँति कार्य कर सकता है अर्थात् इसकी प्रवृत्ति उभयधर्मी होती है। उपर्युक्त अभिक्रिया को एक साम्य स्थिरांक, ‘आयनिक गुणनफल’ (Kw) द्वारा निर्धारित किया जाता है। इसका मान निम्नवत् दर्शाया जा सकता है-
Kw = [H3O+] [OH–]
298K पर Kw = 1.0 × 10-14 mol2 L-2
अतः जल के स्वतः प्रोटोनीकरण का अम्ल-क्षारक रसायन में अत्यधिक महत्त्व होता है।
प्रश्न 19.
F2 के साथ जल की अभिक्रिया में ऑक्सीकरण तथा अपचयन के पदों पर विचार कीजिए एवं बताइए कि कौन-सी स्पीशीज ऑक्सीकृत/अपचयित होती है ?
उत्तर:
फ्लुओरीन की जल के साथ अभिक्रिया निम्नवत् है
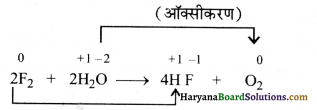
ऑक्सीकरण संख्या में कमी (अपचयन)
अतः स्पष्ट है कि-
F2 ऑक्सीकारक है तथा H2O अपचायक है।
H2O का ऑक्सीकरण O2 में होता है।
F2 का अपचयन HF में होता है।
![]()
प्रश्न 20.
निम्नलिखित अभिक्रियाओं को पूर्ण कीजिए-
(i) PbS(s) + 4H2O2(aq) →
(ii) 2MnO4–(aq) + 3H2O2(aq) →
(iii) CaO(s) + H2O(g) →
(iv) AlCl3(g) + 3H2O(l) →
(v) Ca3N2(s) + 6H2O(l) →
उपर्युक्त को (क) जल-अपघटन, (ख) अपचयोपचय (redox) तथा (ग) जलयोजन अभिक्रियाओं में वर्गीकृत कीजिए।
उत्तर:
(i) PbS(s) + 4H2O2(aq) → PbSO4(s) + 4H2O(aq) (अपचयोपचय अभिक्रिया)
(ii) 2MnO4–(aq) + 3H2O2(aq) → 2MnO2(aq) + 3O2(aq) + 2H2O(l) + 2OH–(aq) (अपचयोपचय अभिक्रिया)
(iii) CaO(s) + H2O(g) → Ca(OH)2(s) ( जलयोजन अभिक्रिया)
(iv) AlCl3(g) + 3H2O(l) → Al(OH)3(s) + 3HCl(l) (जल अपघटन अभिक्रिया)
(v) Ca3N2(s) + 6H2O(l) → 3Ca(OH)2(aq) + 2NH3(g) ( जल-अपघटन अभिक्रिया)
प्रश्न 21.
बर्फ के साधारण रूप की संरचना का उल्लेख कीजिए।
उत्तर:
बर्फ की संरचना
(Structure of Ice)
बर्फ एक अतिव्यवस्थित, त्रिविम, हाइड्रोजन आबन्धित संरचना है जिसे निम्नांकित चित्र में दर्शाया गया है।
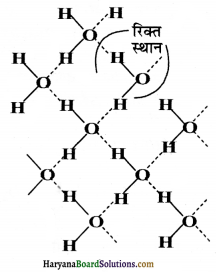
X-किरणों द्वारा परीक्षण से पता चला है कि बर्फ क्रिस्टल में ऑक्सीजन परमाणु चार अन्य हाइड्रोजन परमाणुओं से 276 pm दूरी पर चतुष्फलकीय रूप से घिरा रहता है। हाइड्रोजन आबन्ध बर्फ में वृहद् छिद्र (एक प्रकार की खुली संरचना) बनाते हैं। ये छिद्र उपयुक्त आकार के कुछ दूसरे अणुओं को अन्तराकोश में ग्रहण कर सकते हैं।
उपर्युक्त चित्र में दर्शाई गयी बर्फ की संरचना से स्पष्ट है कि प्रत्येक ऑक्सीजन परमाणु चार हाइड्रोजन परमाणुओं से घिरा हुआ है जिनमें दो प्रबल सहसंयोजी आबन्ध (ठोस रेखा द्वारा प्रदर्शित) से तथा दो दुर्बल हाइड्रोजन आबन्धों (बिन्दुदार रेखा से प्रदशित) से जुड़े हुए हैं। चूँकि हाइड्रोजन बन्ध (177 pm) सहसंयोजी आबन्धों (95.7 pm) से लम्बे हैं; अतः जल-अणु क्रिस्टल जालक में निविड़-संकुलित (closely packed) नहीं होते। यही कारण है कि जल के घनत्व से बर्फ का घनत्व कम होता है तथा यह (बर्फ) जल की सतह पर तैरती है।
प्रश्न 22.
जल की अस्थायी एवं स्थायी कठोरता के क्या कारण हैं ? वर्णन कीजिए।
उत्तर:
अस्थायी कठोरता (Temporary hardness) अस्थायी कठोरता जल में कैल्सियम तथा मैग्नीशियम के हाइड्रोजन कार्बोनेट की उपस्थिति के कारण होती है। इसे उबालकर दूर किया जा सकता है।
स्थायी कठोरता (Permanent hardness)-स्थायी कठोरता जल में विलेयशील कैल्सियम तथा मैग्नीशियम के क्लोराइड तथा सल्फेट के रूप में घुले रहने के कारण होती है। यह उबालने से दूर नहीं की जा सकती है।
प्रश्न 23.
संश्लेषित आयन विनिमयक विधि द्वारा कठोर जल के मृदुकरण के सिद्धान्त एवं विधि की विवेचना कीजिए।
उत्तर:
संश्लेषित आयन विनिमयक विधि-यह दो प्रकार की होती है-
1. अकार्बनिक आयन विनिमयक विधि
2. कार्बनिक आयन विनिमयक विधि
1. अकार्बनिक आयन विनिमयक विधि-इसे जियोलाइट या परम्यूटिट विधि भी कहते हैं। यह कठोर जल को मृदु जल में परिवर्तित करती है। इसमें सोडियम जियोलाइट प्रयुक्त होता है जोकि सोडियम ऐल्युमिनियम सिलिकेट होता है जिसका सूत्र Na2Al2Si2O8 या NaAlSiO4. 3H2O होता है। सरलता के लिए इसे Na2Z लिख सकते हैं।
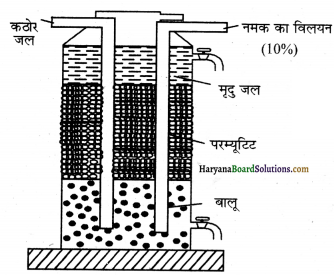
परम्यूटिट विधि में हम दोनों प्रकार की कठोरता दूर कर सकते ? क्योंकि सोडियम जियोलाइट में उपस्थित सोडियम लवणों का यह गुण है कि ये अन्य आयनों द्वारा विस्थापित हो जाते हैं। कठोर जल को जियोलाइट की परत के ऊपर से प्रवाहित करने पर जल में उपस्थित कैल्सियम तथा मैग्नीशियम आयन इसमें उपस्थित सोडियम आयनों द्वारा विस्थापित हो जाते हैं और यहं मैग्नीशियम या कैल्सियम जियोलाइट में परिवर्तित हो जाता है।

अब प्राप्त जल में कैल्सियम तथा मैग्नीशियम के आयन नहीं होते हैं और वह मृदु जल बन जाता है।
परम्यूटिट का पुन: निर्माण-जब Na2Z पूर्णत: CaZ व MgZ में परिवर्तित हो जाता है तो इसके पुनः निर्माण के लिए इसमें कठोर जल के प्रवेश को रोककर इसके स्थान पर 10% NaCl विलयन प्रवाहित करते हैं तब Ca2+ तथा Mg2+ आयन Na+ आयनों द्वारा प्रतिस्थापित हो जाते हैं जिससे परम्यूटिट का पुनः निर्माण हो जाता है और उसे हम पुनः प्रयोग कर सकते हैं।

2. काबनिके आयन विनिमयक विध या संश्लाषित रीजन विधि-यह अत्यधिक आधुनिक विधि है। परम्यूटिट केवल Ca2+ तथा Mg2+ आयनों को जल से हटाता है जबकि कार्बनिक रेजिन जल में उपस्थित सभी आयनों को (H+ तथा OH– को छोड़कर) हटाता है। इस प्रकार इस विधि से प्राप्त जल पूर्णतः आयनों रहित होता है। इस विधि में दो प्रकार के रेजिन प्रयोग में आते हैं।
(i) ऋणायन विनिमयक रेजिन
(ii) धनायन विनिमयक रेजिन
(i) ऋणायन विनिमयक रेजिन-इनमें हाइड्रोकार्बन समूह के साथ क्षारीय समूह -OH अथवा -NH2 जुड़े रहते हैं जिन्हें -OH रेजिन के रूप में प्रदर्शित किया जाता है। ये जल में उपस्थित ऋणायन जैसे-Cl–, HCO3–, SO42- आदि का विनिमय OH– के साथ करता है। इस प्रकार जल में उपस्थित सभी ऋणायन कठोर जल से मुक्त हो जाते हैं।
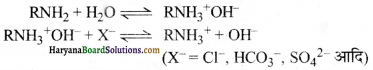
जब ऋणायन विनिमयक रेजिन में से सभी OH– आयन ऋणायनों के द्वारा प्रतिस्थापित हो जाते है तब इस टैंक में NaOH का छिड़काव करते हैं जो कि -OH रेजिन को पुननिर्मित कर देता है।
RNH3+X– + NaOH → RNH3+OH– + NaX
(ii) धनायन विनिमयक रेजिन – ये हाइड्रोजन समूह ही है जिनके साथ अम्लीय समूह जैसे- COOH या -SO3H समूह जुड़े रहते हैं। इन्हें H– रेजन भी कहते हैं। जब जल में उपस्थित सभी ऋणायनों का प्रतिस्थापन हो जाता है तब उस जल को धनायन विनिमयक रेजिन के टैंक में प्रवाहित करते हैं। जहाँ जल में उपस्थित सभी धनायन H+ आयनों के साथ प्रतिस्थापित हो जाते हैं। ये H+ आयन OH– के साथ जल का निर्माण करते हैं। इनका पुनर्जनन NaCl/HCl विलयन से होता है।
2 RNa + M2+ → R2M + 2Na+(M = Ca,Mg)
R2M + 2Na+ → 2RNa + M2+ (पुनर्जनन)
या 2RH + M2+ → MR2 + 2H+ (M2+ → Ca2+, Mg2+)
MR2 + 2H+ → 2RH + M2+
अतः इस विधि द्वारा सभी धनायनों तथा ऋणायनों का प्रतिस्थापन क्रमशः H+ तथा OH– द्वारा हो जाता है एवं हमें शुद्ध विखनिजित (demineralized) तथा विआयनित (deionised) जल प्राप्त होता है।
प्रश्न 24.
जल के उभयधर्मी स्वभाव को दर्शाने वाले रासायनिक समीकरण लिखिए।
उत्तर:
जल की उभयधर्मी प्रकृति (Amphoteric nature of water)—जल अम्ल तथा क्षारक दोनों रूपों में व्यवहार करता है। अतः यह उभयधर्मी है। ब्रॉन्स्टेड अवधारणा के सन्दर्भ में जल NH3 के साथ अम्ल के रूप में तथा H2S के साथ क्षारक के रूप में कार्य करता है-
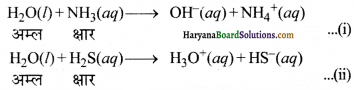
जल अपने से प्रबल अम्लों के साथ क्षारक की भाँति व्यवहार करता है; जैसे-उपर्युक्त अभिक्रिया (ii) में दर्शाया गया है। इसमें जल-अणु H2S से एक प्रोटॉन ग्रहण करके H3O+आयन बनाता है। अभिक्रिया (i) में जल-अणु एक प्रोटॉन का त्याग करता है। NH3 अणु इस प्रोटॉन को ग्रहण करके NH4+ आयन बनाता है। यहाँ जल एक अम्ल की भाँति कार्य करता है।
प्रश्न 25.
हाइड्रोजन परॉक्साइड के ऑक्सीकारक एवं अपचायक रूप को अभिक्रियाओं द्वारा समझाइए।
उत्तर:
हाइड्रोजन परॉक्साइड के अपघटन के दौरान ऑक्सीकरण-अवस्था परिवर्तन निम्नवत् दर्शाया जा सकता हैऑक्सीकरण-संख्या में वृद्धि = ऑक्सीकरण

चूँकि H2O2 में उपस्थित ऑक्सीजन परमाणुओं की ऑक्सीकरण संख्या में वृद्धि तथा कमी दोनों होती हैं; इसलिए यह अपचायक तथा ऑक्सीकारक दोनों की भाँति कार्य कर सकता है। इसे निम्नलिखित अभिक्रियाओं द्वारा समझा जा सकता है-
(i) अम्लीय माध्यम में H2O2 ऑक्सीकारक के रूप में-
2Fe2+(aq) + 2H+(aq) + H2O2(aq) → 2Fe3+(aq) + 2H2O(l)
PbS(s) + 4H2O2(aq) → PbSO4(s) + 4H2O(l)
(ii) अम्लीय माध्यम में H2O2 अपचायक के रूप में-
2MnO4–(aq) + 6H+(aq) + 5H2O2 → 2Mn2+(aq) + 8H2O(l) + 5O2(g)
HOCl + H2O2 → H3O+ + Cl– + O2(g)
(iii) क्षारीय माध्यम में H2O2 ऑक्सीकारक के रूप में-
2Fe2+ + H2O2 → 2Fe3+ + 2OH–
Mn2+ + H2O2 → Mn4+ + 2OH–
(iv) क्षारीय माध्यम में H2O2 अपचायक के रूप में-
I2 + H2O2 + 2OH– → 2I– + 2H2O + O2 ↑
2MnO4– + 3H2O2 → 2MnO2 + 3O2 ↑+ 2H2O + 2OH–
![]()
प्रश्न 26.
विखनिजित जल से क्या अभिप्राय है ? यह कैसे प्राप्त किया जा सकता है ?
उत्तर:
वह जल जो सभी विलेयशील खनिज अशुद्धियों से पूर्णतया मुक्त हो, विखनिजित जल (demineralized water) कहलाता है। दूसरे शब्दों में धनायनों (Ca2+, Mg2+ आदि) तथा ऋणायनों (Cl–, SO42-, HCO3– आदि) से पूर्णतया विमुक्त जल विखजनित जल कहलाता है। विखनिजित जल को आयन-विनिमयक रेजिन विधि से प्राप्त किया जाता है। इस विधि के अन्तर्गत आयन-विनिमयक रेजिनों द्वारा जल में उपस्थित सभी धनायनों तथा ऋणायनों को हटा दिया जाता है।
इसके लिए सर्वप्रथम कठोर जल को H+ रेजिन के टैंक से प्रवाहित करते हैं। जहाँ Na+, Ca2+, Mg2+ आदि सभी धनायन H+ आयनों से प्रतिस्थापित हो जाते हैं उसके बाद इस जल को -OH– रेजिन के टैंक से प्रवाहित करते हैं जहाँ सभी ऋणायन जैसे- Cl–, SO42-, HCO3–, आदि OH– से प्रतिस्थापित हो जाते हैं। इस प्रकार सभी ऋणायन तथा धनायन OH– तथा H+ द्वारा प्रतिस्थापित होते हैं और हमें विखनिजित जल प्राप्त होता है।
प्रश्न 27.
क्या विखनिजित या आसुत जल पेय-प्रयोजनों में उपयोगी है यदि नहीं तो इसे उपयोगी कैसे बनाया जा सकता है ?
उत्तर:
नही, विखनिजित या आसुत जल पेय-प्रयोजनों में उपयोगी नहीं है क्योंकि यह स्वादहीन होता है। यदि कुछ आयन जैसे- Na+, K+, Mg+, Li+ आदि जो हमारे शरीर के लिए उपयोगी होते हैं, को इन विखनिजित जल में डाल दें तो यह पेय-प्रयोजनों में प्रयुक्त हो सकता है। ऐसा करने के लिए हम इसमें लवण जैसे- NaCl, KCl आदि मिला देते हैं ।
प्रश्न 28.
जीवमण्डल एवं जैव-प्रणालियों में जल की उपयोगिता को समझाइए।
उत्तर:
जीवमण्डल एवं जैव-प्रणालियों में जल की उपयोगिता सभी सजीवों का एक वृहद् भाग जल द्वारा निर्मित है। मानव शरीर में लगभग 65 प्रतिशत एवं कुछ पौधों में लगभग 95 प्रतिशत जल होता है। जीवों को जीवित रखने के लिए जल एक महत्वपूर्ण यौगिक है। संघनित प्राबस्था (द्रव तथा टोस अवस्था) में जल के आयामान्य गुणों का कारण तथा अन्य तत्वों के हाइड्राइड H2S तथा H2Se की नुलना में जल का उच्व हिमांक, उच्च क्वधनांक, उच्च वाण्यन कप्मा उच्च संलयन ऊष्मा का कारण इसमें हाहड्रोजन-बन्ध का उपस्थित होनो है अन्य द्रवों की जुलना में जल की विशिष्ट कप्मा, तापीय नालकता. पृष्ठ-तनाव, द्विध्रुव आघर्ण तथा पराविद्युतांक के मान उच्च होते है।
इन्तीं गुणों के कारण जीवमण्डल में जल की महत्वमूण भृमिका है। शरीर तथा जलवायु के सामान्य ताप को बनाए रख्बने के लिए उत्तरदायी है। वनस्पतियों एवं प्राणियों के उपापचय (metabolism) में अणुओं के अभिगमन के लिए जल एक उत्तम विलायक का कार्य करता है। अल ध्रुवीय अणुओं के साथ हाइड्रोजन बन्ध बनाता है जिससे सहसंयोजक यौगिक; जैसे-ऐल्कोहॉल तथा काबॉहाइट्ट्रेट यौगिक जल में चिलेय होते हैं। अतः जैव-प्रणालियों के लिए भी यह आवश्यक होता दै।
प्रश्न 29.
जाल का कौन-सा गुण इसे विलायक के क्रष में उपयोगी बनाता है ? बह किस प्रकार के घौगिक-
(i) घोल सकता है। और
(ii) जल-अपघटन कर सकता हैं ?
उत्तर:
जल के गुण
जल के निम्नलिखित गुण हसे विलायक के रुप में ज्यतिमहत्वपयर्ण बनाते हैं-
(i) इसकी वाष्पन एन्धैल्पी तथा कप्मा-धारिता उच्च होती है।
(ii) यंह ताप की एक दीर्घ परास (0°C से 100°C तक ) के अन्तमंत द्रव-अवस्था में होता है।
(iii) यह ध्रुवी प्रकृति का होता है तथा इसका पराचित्रितांक उक्च (78-39) होता है।
(iv) अन्य यौगिकौं के साथ हाइड्रोजन बन्ध बना सकता है।
जल विलायक के मूप में:
(i) यह हाइड्रोजन बन्ध के कारण श्रुवी पदाधों तथा कछ कर्वंनिक यौगिकों को घोल सकता है। यह आयनिक पदार्थों तथा उन याँगिकों को घोल सकता है जो इसके साथ H-बन्ध बनाते हैं।
(ii) इसमें उपस्थित ऑक्सीजन की अनेक तस्चों से अत्यधिक वन्थूता के कारण यह सहसंयोजी यौगिकों को जल-अपधटित कर देता है। गह ऑक्साइडों, हैलाइडों, फॉस्फाइडों, नाहट्राइड्टों आदि को जल-अप्टित कर देता है।
प्रश्न 30.
H2O एवं D2O के गुणों को जानते हुए क्या आय मानते हैं कि D2O का उपयोग पेय-प्रयोजनों के रूप में किया जा सकता है ?
उत्तर:
D2O का उपयोग हम पेय-प्रयोजनों में नहीं कर सकते हैं। इसके निम्न कारण हैं-
(i) D2O की बन्ध ऊर्जा H2O की अपेक्षा अधिक होती है।
(ii) भारी अणु होने के कारण D2O का आयनन H2O की तुलना में एक तिहाई ही होता है।
(iii) कम पराविद्युतांक के कारण इसमें आयनिक पदार्थ जल की तुलना में कम विलेय होता है।
भारी जल शंरीर में होने वाली अपचयोपचयी अभिक्रियाओं को साधारण जल की तुलना में अति मन्द गति से करता है। जिससे ये असन्तुलित हो जाती है अतः यह जीवन के लिए हानिकारक होता है। यह पेड़-पौधों का विकास रोक देता है, बीजों का अंकुरण रोकता है, जल में रहने वाले जीवों को मार देता है।
प्रश्न 31.
जल-अपघटन तथा जलयोजन पदों में क्या अन्तर है ?
उत्तर:
| जल-अपघटन | जलयोजन |
| 1. जल अपघटन अभिक्रिया में एक पदार्थ उदासीन, अम्लीय अथवा क्षारीय माध्यमों में जल से अभिक्रिया करता है।
उदाहरण- AlCl3 + 3H2O → Al(OH)3 + 3HCl |
1. किसी रासायनिक पदार्थ का वह गुण जिसमें वह क्रिस्टलन जल के अणु ग्रहण करके जलयोजित हो जाता है, जल योजन कहलाता है।
उदाहरण – निर्जलीय CuSO4 का रंग सफेद होता है तथा H2O के पाँच अणु ग्रहण करके यह CuSO4.5H2O बनाता है जो नीले रंग का होता है। |
| 2. अभिक्रिया के दौरान pH परिवर्तित होता है। | 2. pH परिवर्तित नहीं होता है। |
| 3. सह-संयोजी यौगिक प्रदर्शित करते हैं। | 3. आयनिक यौगिक प्रदर्शित करते हैं। |
प्रश्न 32.
लवणीय हाइड्राइड किस प्रकार कार्बनिक यौगिकों से अति सूक्ष्म जल की मात्रा को हटा सकते हैं ?
उत्तर:
लवणीय हाइड्राइडों में H2O के लिए अत्यधिक बन्धुता होती है। लवणीय हाइड्राइड; जैसे- NaH, H– आयनों को मुक्त करता है जो प्रबल ब्रॉ्स्टेड क्षारकों की भाँति कार्य करते हैं (H2O एक दुर्बल ब्रॉन्स्टेड अम्ल होता है) । NaH जल से संयुक्त होकर हाइड्रोजन गैस मुक्त करता है। लवणीय हाइड्राइडों का यह गुण कार्बनिक यौगिकों से अति सूक्ष्म जल की मात्रा को हटाने में प्रयुक्त होता है।
प्रश्न 33.
परमाणु क्रमांक 15,19,23 तथा 44 वाले तत्व यदि डाइहाइड्रोजन से अभिक्रिया कर हाइड्राइड बनाते हैं तो उनकी प्रकृति से आप क्या आशा करेंगे ? जल के प्रति इनके व्यवहार की तुलना कीजिए।
उत्तर:
परमाणु क्रमांक 15 वाला तत्व फॉस्फोरस (P) है। इसका हाइड्राइड (PH3) सहसंयोजी होता है।
परमाणु क्रमांक 19 वाला तत्व पोटैशियम (K) है। इसका हाइड्राइड (KH) आयनिक होता है।
परमाणु, क्रमांक 23 वाला तत्व वैनेडियम (V) है इसका हाइड्राइड अन्तराकाशी या धात्विक होगा।
परमाणु क्रमांक 44 वाला तत्व रूथेनियम (Ru) है। इसका हाइड्राइड अन्तराकाशी या धात्विक होगा।
जल के प्रति व्यवहार:
(i) परमाणु क्रमांक 15 वाला तत्व (P) सहसंयोजी हाइड्राइड (PH3) बनाता है जो जल में अल्प-विलेय होता है।
(ii) परमाणु क्रमांक 19 वाला तत्व (K) आयनिक हाइड्राइड (KH) बनाता है जो जल के साथ विस्फोटक रूप से अभिक्रिया करके डाइहाइड्रोजन गैस देता है।
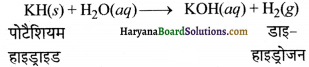
(iii) परमाणु क्रमांक 23 तथा 44 वाले तत्व V तथा Ru अन्तराकाशी या धात्विक हाइड्राइड बनाते हैं जो जल को संगुणित कर लेते हैं।
प्रश्न 34.
जब ऐलुमिनियम (III) क्लोराइड एवं पोटैशियम क्लोराइड को अलग-अलग (i) सामान्य जल, (ii) अम्लीय जल एवं (iii) क्षारीय जल से अभिकृत कराया जाएगा तो आप किन-किन विभिन्न उत्पादों की आशा करेंगे ? जहाँ आवश्यक हो, वहाँ रासायनिक समीकरण दीजिए।
उत्तर:
(i) सामान्य जल में-सामान्य जल में ऐलुमिनियम (III) क्लोराइड निम्नवत् जल-अपघटित होगा-
AlCl2 + 3H2O → Al(OH)3 + 3HCl
KCl जल में विलेय होगा तथा इसके आयन जलयोजित हो जायेंगे।
KCl(s) + H2O (आधिक्य) → K+(aq) + Cl–(aq)
(ii) अम्लीय जल में-अम्लीय जल में ऐलुमिनियम (III) क्लोराइड जल-अपघटित हो जाएगा, परन्तु समआयन प्रभाव के कारण जल-अपघटन धीमी दर से होगा तथा यह HCl से अभिक्रिया करके AlCl3 बना लेगा जो Al3+ तथा Cl– के रूप में उपस्थित होंगे।
![]()
पोटैशियम क्लोराइड पर अम्लीय जल का कोई प्रभाव नहीं होगा।
(iii) क्षारीय जल में-क्षारीय जल में AlCl3 तीव्रता से जल-अपघटित होकर विलेय टेट्राहाइड्रॉक्सो-ऐलुमिनेट बनाता है।
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
Al(OH)3 + OH– → [Al(OH4]–
पोटैशियम क्लोराइड पर क्षारीय जल का कोई प्रभाव नहीं होगा।
प्रश्न 35.
H2O2 विरंजन कारक के रूप में कैसे व्यवहार करता है ? लिखिए।
उत्तर:
हाइड्रोजन परॉक्साइड (H2O2) निम्नलिखित अभिक्रिया के आधार पर विरंजन कारक के रूप में व्यवहार करता है-
H2O2 → H2O + [O] नवजात ऑक्सीजन
रंगीन पदार्थ + [O] → रंगहीन पदार्थ ( विरंजित)
दैनिक जीवन में इसका उपयोग बालो, ऊन, सिल्क, हाथा-दात आदि के विरंजन में किया जाता है।
प्रश्न 36.
निम्नलिखित पदों से आप क्या समझते हैं ?
(i) हाइड्रोजन अर्थव्यवस्था,
(ii) हाइड्रोजनीकरण,
(iii) सिन्नैस,
(iv) भाप अंगार गैस सृति अभिक्रिया तथा
(v) ईंघन सेल।
उत्तर:
(i) हाइड्रोजन अर्थव्यवस्था:
हम सभी जानते हैं कि कोयला तथा पेट्रोलियम सर्वाधिंक प्रयुक्त होने वाले ईंधन हैं, परन्तु ये संसाधन अत्यन्त तीव्र दर से समाप्त होते जा रहे हैं तथा आगामी भविष्य में उद्योग तथा परिवहन इससे बहुत अधिक प्रभावित हो सकते है। इसके अंतिरिक्त ये संसाधन मानव-स्वास्थ्य के प्रति भी अत्यन्त हानिकारक हैं: क्यौंकि ये वायु प्रदूषण के प्रमुख्य कारक हैं।
इनके दहन के फलस्वरूप उत्पन्न अनेक विपाक्त गैसे-कार्वन मोनोक्साइड, नाइट्रोजन तथा सल्फर के ऑक्साइड वायुमण्डल में मिल जाते हैं। इन समस्याओं से निपटने के लिए वैकल्पिक हैधनों की ख्रोज सदैव होती रही है। इस सन्दर्भ में भावी विकल्प ‘हाड़्रोजन अर्थव्यवस्था’ है। हाइड्रोजन अर्थव्यवस्था का मूल सिद्धान्त ऊर्जा का द्रव हाइड्रोजन अथवा गैसीय हाइड्रोजन के रूप में अभिगमन तथा भण्डारण है।
हाइड्रोजन अर्थव्यवस्था का मुख्य ध्येय तथा लाभ-ऊर्जा का संचरण विद्युत्-ऊर्जा के रूप में न होकर हाइड्रोजन के रूप में होना है। हमारे देश में पहली बार अक्श्बर, 2005 में आरम्भ परियोजना में डाइहाइड्रोजन स्बचालित वाहनों के हैधन के रूप में प्रयुक्त किया गया। प्रारम्भ में चौपढिया बाहन के लिए 5 प्रतिशत हाइहाइड्रोजन मिश्रित CNG का प्रयोग किया गया।
बाद में डाहहाइड्रोजन की प्रतिशतता धरि-धीरे अनुकूलतम स्तर तक बढ़ाई जाएगी। आजकल डाहाइड्रोजन का उपयोग ईद्रन सेलों में विद्युत्-उत्पादन के लिए किया जाता है। ऐसी आशा की जाती है कि आर्थिक रूप से व्यवत्तार्य तथा दाइहाइड्रोजन के सुरक्षित स्रोत का पता आने वाले वष्षों में लग सकेगा तथा उसका उपयोग ऊर्जा के रूप में हो सकेगा।
(ii) हाइड्रोजनीकरण:
असंतृप्त कार्वनिक यौगिक हाइड्रोजन से सीधे संयोग करके संतृप्त यौगिक बनाते हैं, यह अभिक्रिया हाइड्रोजनीकरण कहलाती है। यह अभिक्रिया उत्र्रेरक की उपस्थिति में होती है तथा इन अभिक्रियाओं से अनेक महत्त्वपूर्ण औद्योगिक हाइड्रोजनीकृत उत्पाद प्राप्त होते हैं। वनस्पति तेलों का हाइड्रोजनीकरण (Hydrogenation of Vegetable Oils)- 473K पर निकिल उत्त्रेरक की उपस्थिति में वनस्पति तेलों; जैसे – मूँगफली के तेल, बिनौले के तेल में हाइड्रोजन गैस प्रवाहित करने पर तेल ठोस वसाओं, जिन्हें वनस्पति घी कहा जाता है, में
परिवर्तित हो जाते हैं। वास्तव में तेल ![]() बन्ध की उपस्थिति के कारण असंतृप्त होते हैं। हाइड्रोजनीकरण पर ये बन्ध
बन्ध की उपस्थिति के कारण असंतृप्त होते हैं। हाइड्रोजनीकरण पर ये बन्ध ![]() बन्ध में परिवर्तित हो जाते हैं जिसके परिणामस्वरूप असंतृप्त तेल संतृप्त वसा में परिवर्तित हो जाते हैं।
बन्ध में परिवर्तित हो जाते हैं जिसके परिणामस्वरूप असंतृप्त तेल संतृप्त वसा में परिवर्तित हो जाते हैं।
![]()
ओलिफिन का हाइड्रोफॉर्मिलीकरण (Hydrofor-mylation of Olefins) – ओलिफिन का हाइड्रोफॉर्मिलीकरण कराने पर ऐल्डिहाइड प्राप्त होता है, जो ऐल्कोहॉल में अपचयित हो जाता है।
RCH = CH2 + CO + H2 → RCH2CH2CHO
RCH2CH2CHO + H2 → RCH2CH2CH2OH
उपर्युक्त के अतिरिक्त कोयले का हाइड्रोजनीकरण करने पर द्रव हाइड्रोकार्बनों का मिश्रण प्राप्त होता है जिसे आसुत करने पर कृत्रिम पेट्रोल प्राप्त होता है।
(iii) सिन्गैस:
हाइड्रोकार्बन अथवा कोक की उच्च ताप पर एवं उत्प्रेरक की उपस्थिति में भाप से अभिक्रिया कराने पर डाइहाइड्रोजन प्राप्त होती है।
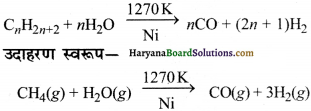
CO एवं H2 के मिश्रण को वाटर गैस कहते हैं। CO एवं H2 का यह मिश्रण मेथेनॉल तथा अन्य कई हाइड्रोकार्बनों के संश्लेषण में काम आता है। अतः इसे ‘संश्लेषण गैस’ या ‘सिन्ञैस’ (syngas) भी कहते हैं। आजकल सिन्गैस वाहितमल (sewage waste), अखबार, लकड़ी का बुरादा, लकड़ी की छीलन आदि से प्राप्त की जाती है। कोल से सिन्गैस का उत्पादन करने की प्रक्रिया को ‘कोलगैसीकरण’ (coalgasification) कहते हैं-
![]()
(iv) भाप-अंगार गैस सृति अभिक्रिया:
सिन्गैस में उपस्थित कार्बन मोनोक्साइड की आयरन क्रोमेट उत्प्रेरक की उपस्थिति में भाप से क्रिया कराने पर हाइड्रोजन का उत्पादन बढ़ाया जा सकता है-
![]()
यह ‘भाप-अंगार गैस सृति अभिक्रिया’ (water gas shift reaction) कहलाती है। वर्तमान में लगभग 77 प्रतिशत डाइहाइड्रोजन का औद्योगिक उत्पादन शैल रसायनों (petro-chemicals), 18 प्रतिशत कोल, 4 प्रतिशत जलीय विलयनों के विद्युत्-अपघटन तथा 1 प्रतिशत उत्पादन अन्य स्रोतों से होता है।
(v) ईंधन सेल:
वह युक्ति जो ईंधन की रासायनिक ऊर्ग को विद्युत् ऊर्जा में परिवर्तित करती है, ईंधन सेल कहलाती है। कल डाइहाइड्रोजन का प्रयोग ईंधन सेलों में विद्युत्-उत्पादन के लिए किया जाता है। ये प्राथमिक सेलों की तरह ही होते हैं। इसमें ईंधन का दहन होता है तथा उसमें से उत्पन्न रासायनिक ऊर्जा को विद्युत् ऊर्जा में परिवर्तित किया जाता है। इन सेलों को इस प्रकार बनाया जाता है कि इनमें ईंधन लगातार भरा जा सके जिससे कि विद्युत् धारा निरन्तर प्राप्त होती रहे।
इस सेल में ईंधन के रूप में H2, CO, CH4, C3H8, C2H5OH आदि को प्रयुक्त करते हैं। सर्वप्रथम बैकोन ने एक सेल बनाया जिसमें उन्होंने ईंधन के रूप में H2-O2 लिया था। इसे बैकोन सैल भी कहते हैं।
इस सेल में कार्बन के सरन्ध्र (Porous) इलेक्ट्रोड होते हैं जो Pt, Ag या CuO आदि के द्वारा संसेचित(impregnated) होते हैं।
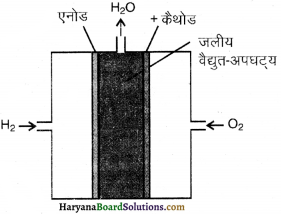
यहाँ विद्युत्- अपघट्य इलेक्ट्रोडों के मध्य भरा होता है। विद्युत् -अपघट्य KOH या NaOH का विलयन होता है। H2 तथा O2 गैसों के सरन्ध्र इलेक्ट्रोडों में से विद्युत्-अपघट्य विलयन में भेजा जाता है।
अभिक्रियाएँ, इलेक्ट्रोडों पर निम्न प्रकार होती हैं-
ऐनोड : 2H2(g) + 4OH–(aq) → 4H2O(l) + 4e–
कैथोड : O2(g) + 2H2O(l) + 4e– → 4OH–(aq)
सम्पूर्ण अभिक्रिया-
2H2(g) + O2(g) → 2H2O(l)
नोट – चूँकि अभिक्रिया के दौरान ईंधन खर्च होता रहता है अतः इसे बार-बार भरते रहना चाहिए।
ईंधन सेल की विशेषताएँ-
- ईंधन की लगातार पूर्ति करने पर लगातार विद्युत् धारा प्राप्त होती है इसलिए सेल की आयु लम्बी होती है।
- ये सेल प्रदूषण रहित होते हैं।
- इनकी दक्षता उच्च लगभग 75-80% होती है।
नोट – इस ईंधन सेल का प्रयोग सर्वप्रथम अन्तरिक्ष कार्यक्रम में अपोलो यान को विद्युत् ऊर्जा प्रदान करने के लिए किया गया था। यहाँ H2 तथा O2 परस्पर द्रव H2O बनाते हैं। इस जल वाष्प को संघनित कर उसका प्रयोग अन्तरिक्ष यात्रियों के पेयजल के रूप में किया जाता है।