Haryana State Board HBSE 10th Class Science Solutions Chapter 2 अम्ल, क्षारक एवं लवण Textbook Exercise Questions and Answers.
Haryana Board 10th Class Science Solutions Chapter 2 अम्ल, क्षारक एवं लवण
HBSE 10th Class Science अम्ल, क्षारक एवं लवण Textbook Questions and Answers
प्रश्न 1.
कोई विलयन लाल लिटमस को नीला कर देता है, इसका pH सम्भवतः क्या होगा ?
(a) 1
(b) 4
(c) 5
(d)10.
उत्तर-
(d) 10.
प्रश्न 2.
कोई विलयन अण्डे के पिसे हुए कवच से अभिक्रिया कर एक गैस उत्पन्न कर जो चूने के पानी को दूधिया कर देती है। इस विलय क्या होगा ?
(a) NaCl
(b) HCl
(c) LiCl
(d) KCl.
उत्तर-
(b) HCl.
प्रश्न 3.
NaOH का 10 mL विलयन HCI के 8 mL विलयन से पूर्णतः उदासीन हो जाता है। यदि हम NaOH के उसी विलयन का 20 mL लें तो इसे उदासीन करने के लिए HCI के उसी विलयन की कितनी मात्रा की आवश्यकता होगी ?
(a) 4 mL
(b) 8 mL
(c) 12 mL
(d) 16 mL.
उत्तर-
(d) 16 mL.
![]()
प्रश्न 4.
अपच का उपचार करने के लिए निम्न में से किस औषधि का उपयोग होता है ?
(a) एण्टीबायोटिक (प्रतिजैविक)
(b) ऐनालजेसिक (पीड़ाहारी)
(c) ऐन्टैसिड
(d) एण्टीसेप्टिक (प्रतिरोधी)।
उत्तर-
(c) ऐन्टैसिड। 2015
प्रश्न 5.
निम्न अभिक्रिया के लिए पहले शब्द समीकरण लिखिए तथा उसके बाद सन्तुलित समीकरण लिखिए –
(a) तनु सल्फ्यूरिक अम्ल दानेदार जिंक के साथ अभिक्रिया करता है।
(b) तनु हाइड्रोक्लोरिक अम्ल मैग्नीशियम पट्टी के साथ अभिक्रिया करता है।
(c) तनु सल्फ्यूरिक अम्ल ऐलुमिनियम चूर्ण के साथ अभिक्रिया करता है।
(d) तनु हाइड्रोक्लोरिक अम्ल लौह के रेतन के साथ अभिक्रिया करता है।
उत्तर –
(a) जिंक + सल्फ्यूरिक अम्ल → जिंक सल्फेट + हाइड्रोजन गैस
Zn (s) + H2SO4 (aq) →ZnSO4+H2↑
(b) मैग्नीशियम + तनु हाइड्रोक्लोरिक अम्ल → मैग्नीशियम क्लोराइड + हाइड्रोजन गैस
Mg (s) + 2HCl (aq) → MgCl2(aq) + H2↑
(c) ऐलुमिनियम + तनु सल्फ्यूरिक अम्ल → ऐलुमिनियम सल्फेट + हाइड्रोजन गैस
2AI (s) +3H2SO4 (aq) →Al2(SO4)3(aq) +3H2 ↑
(d) आयरन + तनु हाइड्रोक्लोरिक अम्ल → आयरन क्लोराइड + हाइड्रोजन गैस
Fe (s) + 2HCl (aq) → FeCl2(aq) + H2 ↑
प्रश्न 6.
ऐल्कोहॉल एवं ग्लुकोज जैसे यौगिकों में भी हाइड्रोजन होती है लेकिन इनका वर्गीकरण अम्ल की तरह नहीं होता है। एक क्रियाकलाप द्वारा इसे सिद्ध कीजिए।
उत्तर-
ऐल्कोहॉल एवं ग्लूकोज जैसे यौगिकों में हाइड्रोजन होती है पर वे विलयन में आयनीकृत नहीं होते और H+ आयन उत्पन्न नहीं करते। यह निम्नलिखित क्रियाकलाप से प्रदर्शित होता है –
क्रियाकलाप
- एक कॉर्क में दो कीलें लगाकर कॉर्क को 100 mL के एक बीकर में रख देते हैं।
- दोनों कीलों को 6 वोल्ट की एक बैटरी से जोड़ देते हैं जो एक बल्ब तथा स्विच से भी सम्बद्ध हैं। यह समायोजन निम्न चित्र में दर्शाया गया है।
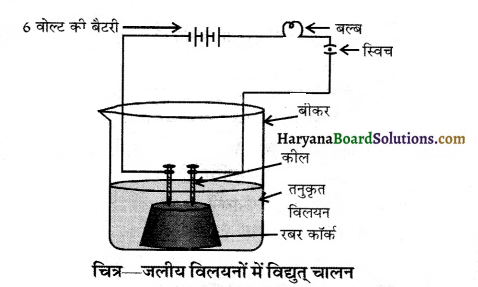
अब हम ऐल्कोहॉल तथा ग्लूकोज के विलयनों को बारी-बारी से बीकर में डालते हैं तथा विद्युत प्रवाह हेतु स्विच चालू करते हैं।
प्रेक्षण व परिणाम (Observation and Result) हम यह पाते हैं कि बल्ब नहीं जलता अत: ग्लूकोज तथा ऐल्कोहॉल विलयनों में विद्युत चालन नहीं होता परन्तु अम्लों में विद्युत चालन सम्भव है। अत: ग्लूकोज एवं ऐल्कोहॉल को अम्लों में वर्गीकृत नहीं किया जा सकता।
प्रश्न 7.
आसवित जल विद्युत का चालक क्यों नहीं होता, जबकि वर्षा का जल होता है ?
उत्तर-
आसवित जल हाइड्रोजन आयन (H+) उत्पन्न नहीं करता है तथा यह उदासीन होता है। वर्षा जल अम्लीय होता है तथा हाइड्रोजन आयन (H+) उत्पन्न करता है। इस कारण से वर्षा जल विद्युत का चालन करता है।
![]()
प्रश्न 8.
जल की अनुपस्थिति में अम्ल का व्यवहार अम्लीय क्यों नहीं होता है ?
उत्तर-
जल की अनुपस्थिति में अम्लों से हाइड्रोजन आयनों (H+) का विलगन नहीं हो सकता है चूँकि हाइड्रोजन आयन ही अम्लों के अम्लीय व्यवहार के लिए उत्तरदायी हैं। अतः इसकी अनुपस्थिति में अम्ल, अम्लीय व्यवहार प्रदर्शित नहीं कर सकते।
प्रश्न 9.
पाँच विलयनों A, B, C, D व E की जब सार्वत्रिक सूचक से जाँच की जाती है तो pH के मान क्रमशः 4,1, 11, 7 एवं 9 प्राप्त होते हैं। कौन-सा विलयन
(a) उदासीन है?
(b) प्रबल क्षारीय है?
(c) प्रबल अम्लीय है?
(d) दुर्बल अम्लीय है?
(e) दुर्बल क्षारीय है?
pH के मानों को हाइड्रोजन आयन की सान्द्रता के आरोही क्रम में व्यवस्थित कीजिए।
उत्तर –
(a) उदासीन – pH 7 वाला विलयन D
(b) प्रबल क्षारीय – pH 11 वाला विलयन C
(c) प्रबल अम्लीय – pH 1 वाला विलयन B
(d) दुर्बल अम्लीय – pH 4 वाला विलयन A
(e) दुर्बल क्षारीय – pH 9 वाला विलयन E :
हाइड्रोजन आयन सान्द्रता के बढ़ते क्रम में pH मान इस प्रकार व्यवस्थित होंगे
11<9<7<4<1
अर्थात् विलयन C < विलयन E < विलयन D < विलयन A< विलयन B
प्रश्न 10.
परखनली ‘A’ एवं ‘B’ में समान लम्बाई की मैग्नीशियम की पट्टी लीजिए। परखनली ‘A’ में हाइड्रोक्लोरिक अम्ल (HCI) तथा परखनली ‘B’ में ऐसीटिक अम्ल (CH3COOH) डालिए। दोनों अम्लों की मात्रा तथा सान्द्रता समान है। किस परखनली में अधिक तेजी से बुदबुदाहट होगी तथा क्यों?
उत्तर-
HCl युक्त परखनली A में सनसनाहट अधिक तेज होगी क्योंकि HCl ऐसीटिक अम्ल की तुलना में अधिक प्रबल अम्ल है, अर्थात् HCl अम्ल में हाइड्रोजन आयन सान्द्रता अधिक होती है।
प्रश्न 11.
ताजे दूध के pH का मान 6 होता है। दही बन जाने पर इसके pH के मान में क्या परिवर्तन होगा? अपना उत्तर समझाइए।
उत्तर-
दूध के दही में परिवर्तित होने पर pH का मान 6 से कम हो जाएगा क्योंकि दूध की तुलना में दही अधिक अम्लीय होता है।
![]()
प्रश्न 12.
एक ग्वाला ताजे दूध में थोड़ा बेकिंग सोडा मिलाता है।
(a) ताजे दूध के pH के मान को 6 से बदलकर थोड़ा क्षारीय क्यों बना देता है?
(b) इस दूध को दही बनने में अधिक समय क्यों लगता है?
उत्तर-
(a) दूध बेचने वाला ताजे दूध के pH को 6 से थोड़ा क्षारीय तक स्थानान्तरित कर देता है क्योंकि ऐसा करने से दूध अधिक समय तक खराब नहीं होगा।
(b) यह दूध दही बनने में अत्यधिक समय लेता है क्योंकि दूध को क्षारीय से अम्लीय होने में अधिक समय लगेगा जबकि यदि दूध का pH 6 ही होता तो यह अपेक्षाकृत कम समय में ही दही में परिवर्तित हो जाता।
प्रश्न 13.
प्लास्टर ऑफ पेरिस को आर्द्र-रोधी बर्तन में क्यों रखा जाना चाहिए? इसकी व्याख्या कीजिए।
उत्तर-
प्लास्टर ऑफ पेरिस नमी (जल) के सम्पर्क में आने पर लेई जैसा पदार्थ बन जाता है तथा शीघ्रता से कठोर क्रिस्टलीय ठोस (जिप्सम) में परिवर्तित हो जाता है अतः प्लास्टर ऑफ पेरिस को आर्द्र-रोधी बर्तन में रखा जाना चाहिए।
प्रश्न 14.
उदासीनीकरण अभिक्रिया क्या है? दो उदाहरण दीजिए।”
उत्तर-
अम्ल एवं क्षार के मध्य अभिक्रिया होने पर लवण व जल प्राप्त होता है, इसे उदासीनीकरण अभिक्रिया कहते हैं।
क्षार + अम्ल → लवण + जल उदाहरण
2KOH (aq) + H2SO4 (aq) →K2SO4 (aq) +2H2O(l)
NaOH (aq) + HCl (aq) →NaCl (aq) +H2O(l)
प्रश्न 15.
धोने का सोडा एवं बेकिंग सोडा के दो-दो प्रमुख उपयोग बताइए।
उत्तर-
धोने के सोडे के उपयोग-
1. जल की स्थायी कठोरता दूर करने में,
2. काँच, कागज व साबुन के निर्माण में। .
खाने के सोडे के उपयोग-1, प्रतिअम्ल (antacid) औषधि के घटक के रूप में, 2. भोज्य तथा पेय पदार्थों में योगात्मक के रूप में।
HBSE 10th Class Science अम्ल, क्षारक एवं लवण InText Questions and Answers
(पाठ्य-पुस्तक पृ. सं. 20)
प्रश्न 1.
आपको तीन परखनलियाँ दी गयी हैं। इनमें से एक में आसवित जल एवं शेष दो में से एक में अम्लीय विलयन तथा दूसरे में क्षारीय विलयन है। यदि आपको केवल लाल लिटमस पत्र दिया जाता है तो आप प्रत्येक परखनली में पदार्थ की पहचान कैसे करेंगे?
उत्तर-
जिस परखनली में क्षारीय विलयन है वह लाल रंग के लिटमस पत्र को नीले रंग में परिवर्तित कर देता है। अब इस नीले लिटमस पत्र को बची हुई दोनों परखनलियों में डालते हैं। यदि नीला लिटमस पत्र पुनः लाल हो रहा है तो उस परखनली में अम्ल है तथा जिस परखनली में नीले लिटमस का रंग परिवर्तित नहीं हो रहा है वह आसवित जल है।
(पाठ्य-पुस्तक पृ. सं. 24) .
प्रश्न 1.
पीतल एवं ताँबे के बर्तनों में दही एवं खट्टे पदार्थ क्यों नहीं रखने चाहिए?
उत्तर-
दही एवं खट्टे पदार्थ अम्लीय होते हैं जोकि पीतल एवं ताँबे के बर्तनों के साथ अम्ल अभिक्रिया करके लवण बनाते हैं, जो विषैले होते हैं। इस कारण दही तथा अन्य खट्टे पदार्थों को पीतल तथा ताँबे के बर्तनों में नहीं रखना चाहिए।
![]()
प्रश्न 2.
धातु के साथ अम्ल की अभिक्रिया होने पर सामान्यतः कौन- गैस निकलती है ? एक उदाहरण के द्वारा समझाइए। : गैस की उपस्थिति की जाँच आप कैसे करेंगे?
उत्तर-
जब एक अम्ल किसी धातु के साथ अभिक्रिया करता है तो सामान्यतः हाइड्रोजन गैस विमुक्त होती है। उदाहरण के लिए, जिंक पर सल्फ्यूरिक अम्ल की अभिक्रिया से जिंक सल्फेट तथा हाइड्रोजन गैस उत्पन्न होती है।
Zn (s) + H2SO4 (aq) →ZnSO4 + H2T.
हाइड्रोजन गैस की उपस्थिति की जाँच के लिए गैस के समीप एक जलती हुई मोमबत्ती ले जाने पर यदि गैस धमाके की आवाज के साथ जलती है तो यह हाइड्रोजन गैस है।
प्रश्न 3.
कोई धातु यौगिक ‘A’ तनु हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया करता है तो बुदबुदाहट उत्पन्न होती है। इससे उत्पन्न गैस एक जलती हुई मोमबत्ती को बुझा देती है। यदि उत्पन्न यौगिकों में एक कैल्सियम क्लोराइड है तो इस अभिक्रिया के लिए एक सन्तुलित रासायनिक समीकरण लिखिए।
उत्तर-
धातु यौगिक ‘A’ कैल्सियम कार्बोनेट होगा। उत्पन्न गैस कार्बन डाइऑक्साइड है।

(पाठ्य-पुस्तक पृ. सं. 27)
प्रश्न 1.
HCl, HNO3, आदि जलीय विलयन में अम्लीय अभिलक्षण क्यों प्रदर्शित करते हैं, जबकि ऐल्कोहॉल तथा ग्लूकोज जैसे यौगिकों के विलयनों में अम्लीयता के अभिलक्षण नहीं प्रदर्शित होते हैं ?
उत्तर-
HCl, HNO3, आदि जलीय विलयनों में अम्लीय गुण प्रदर्शित करते हैं क्योंकि ये विलयन में केवल हाइड्रोजन आयन (H+) उत्पन्न करते हैं। अम्लीय गुण के लिए हाइड्रोजन आयन ही कारण हैं। ऐल्कोहॉल तथा ग्लूकोज जलीय विलयनों में हाइड्रोजन आयन उत्पन्न नहीं करते, अतः इनके विलयन अम्लीय गुण प्रदर्शित नहीं करते।
![]()
प्रश्न 2.
अम्ल का जलीय विलयन क्यों विद्युत का चालन करता है ?
उत्तर-
अम्ल के जलीय विलयन में हाइड्रोजन आयन (H+) उत्पन्न होते हैं जो कि विद्युत धारा के प्रवाह के लिए उत्तरदायी होते हैं।
प्रश्न 3.
शुष्क हाइड्रोक्लोरिक गैस शुष्क लिटमस पत्र के रंग को क्यों नहीं बदलती है ? –
उत्तर-
शुष्क HCl गैस H+ आयन उत्पन्न नहीं करती, क्योंकि HCl अणु से H+ आयनों का निष्कासन जल की अनुपस्थिति में नहीं हो पाता है। इस कारण से H+ आयनों की अनुपस्थिति अर्थात् अम्लीय गुण की अनुपस्थिति के कारण शुष्क लिटमस पत्र का रंग परिवर्तित नहीं होता है।
प्रश्न 4.
अम्ल को तनुकृत करते समय यह क्यों अनुशंसित करते हैं कि अम्ल को जल में मिलाना चाहिए, न कि जल को अम्ल में ?.
उत्तर-
अम्ल को तनुकृत करने के दौरान इसमें जल कभी भी नहीं मिलाना चाहिए क्योंकि अम्ल को जल में मिलाने पर उत्पन्न ऊष्मा बहुत अधिक होती है जिसके कारण मिश्रण पात्र से बाहर भी आ सकता है तथा समीप खड़े व्यक्ति को हानि पहुँच सकती है।
प्रश्न 5.
अम्ल के विलयन को तनुकृत करते समय हाइड्रोनियम आयन (H3O+) की सान्द्रता कैसे प्रभावित हो जाती है ?
उत्तर-
अम्ल को तनुकृत करने पर उसमें उपस्थित अनआयनित जल की मात्रा तो बढ़ती है परंतु H3O+ की मात्रा वही रहती है, परिणामस्वरूप H3O+ की सान्द्रता लगातार घटती जाती है।
प्रश्न 6.
जब सोडियम हाइड्रॉक्साइड विलयन में अधिक क्षारक मिलाते हैं तो हाइड्रॉक्साइड आयन (OH–) की सान्द्रता कैसे प्रभावित होती है ?
उत्तर-
हाइड्रॉक्साइड आयनों (OH–) की सान्द्रता बढ़ जाती है।
![]()
(पाठ्य-पुस्तक पृ. सं.31)
प्रश्न 1.
आपके पास दो विलयन ‘A’ तथा ‘B’ हैं। विलयन A के pH का मान 6 है एवं विलयन B के pH का मान 8 है। किस विलयन में हाइड्रोजन आयन की सान्द्रता अधिक है ? इनमें से कौन अम्लीय है तथा कौन क्षारकीय?
उत्तर-
विलयनं ‘A’ में हाइड्रोजन आयन की सान्द्रता अधिक है।
विलयन ‘A’ (pH = 6) अम्लीय है। विलयन ‘B’ (pH = 8) क्षारीय है।
प्रश्न 2.
H+ (aq) आयन की सान्द्रता का विलयन की प्रकृति पर क्या प्रभाव पड़ता है?
उत्तर-
H+ (aq) आयनों की सान्द्रता जितनी अधिक होती है, अम्ल उतना ही प्रबल होता है।
प्रश्न 3.
क्या क्षारकीय विलयन में H+ (aq) आयन होते हैं? यदि हाँ, तो यह क्षारकीय क्यों होते हैं ?
उत्तर-
हाँ, क्षारकीय विलयनों में भी H+ (aq) आयन होते हैं फिर भी ये क्षारकीय होते हैं क्योंकि इनमें हाइड्रॉक्साइड आयनों (OH ) की सान्द्रता H+ (aq) आयनों से बहुत अधिक होती है।
प्रश्न 4.
कोई किसान खेत की मृदा की किस परिस्थिति में बिना बुझा हुआ चूना (कैल्सियम ऑक्साइड) बुझा हुआ चूना (कैल्सियम हाइड्रॉक्साइड) या चॉक (कैल्सियम कार्बोनेट) का उपयोग करेगा?
उत्तर-
किसान अपने खेत की मिट्टी को बिना बुझा हुआ चूना (कैल्सियम ऑक्साइड) या बुझे हुए चूने (कैल्सियम हाइड्रॉक्साइड) या चॉक (कैल्सियम कार्बोनेट) के साथ तब उपचारित करेगा जब मिट्टी में अम्लों की मात्रा आवश्यक मात्रा से अधिक होगी।
![]()
(पाठ्य-पुस्तक पृ. सं. 36)
प्रश्न 1.
CaOCl2 यौगिक का प्रचलित नाम क्या है ?
उत्तर-
ब्लीचिंग पॉउडर।
प्रश्न 2.
उस पदार्थ का नाम बताइए जो क्लोरीन से क्रिया करके विरंजक चूर्ण बनाता है।
उत्तर-
शुष्क बुझा हुआ चूना।
प्रश्न 3.
कठोर जल को मृदु करने के लिए किस सोडियम यौगिक का उपयोग किया जाता है ?
उत्तर-
धावन सोडा (सोडियम कार्बोनेट डेकाहाइड्रेट) NaCO3.10H2O.
प्रश्न 4.
सोडियम हाइड्रोजन कार्बोनेट के विलयन को गर्म करने पर क्या होगा ? इस अभिक्रिया के लिए समीकरण लिखिए।
उत्तर-
सोडियम हाइड्रोजन कार्बोनेट के विलयन को गर्म करने पर कार्बन डाइऑक्साइड गैस प्राप्त होती है।
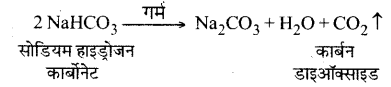
प्रश्न 5.
प्लास्टर ऑफ पेरिस की जल के साथ अभिक्रिया के लिए समीकरण लिखिए।
उत्तर-
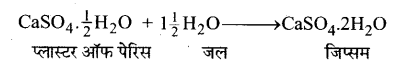
HBSE 10th Class Scienceअम्ल, क्षारक एवं लवण InText Activity Questions and Answers
क्रियाकलाप 2.1. (पा. पु. पृ. सं. 20)
प्रश्न 1.
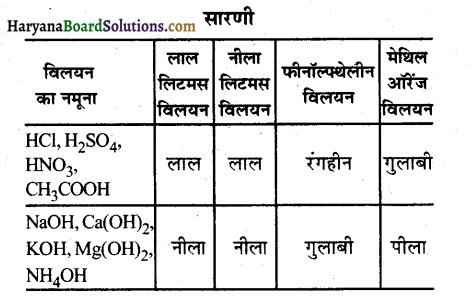
प्रयोगशाला में हाइड्रोक्लोरिक अम्ल (HCl), सल्फ्यूरिक अम्ल (H2SO4), नाइट्रिक अम्ल (HNO3), ऐसीटिक अम्ल (CH3COOH), सोडियम हाइड्रॉक्साइड (NaOH), कैल्सियम हाइड्रॉक्साइड [Ca(OH)2], पोटैशियम हाइड्रोक्साइड [Mg(OH)2], एवं अमोनियम हाइड्रॉक्साइड (NH4OH) के नमूने एकत्र करके उनकी अम्लीय व क्षारीय स्थिति की पहचान कैसे करेंगे?
उत्तर-
अम्लीय व क्षारीय स्थिति की पहचान-
अतः कुछ पदार्थ ऐसे होते हैं जिनकी गंध अम्लीय या क्षारकीय माध्यम में बदल जाती है, इन्हें गंधीय सूचक कहते
क्रियाकलाप 2.2 (पा. पु. पृ. सं. 20)
प्रश्न 1.
इनमें से दो टुकड़े लीजिए एवं उनकी गंध की जाँच कीजिए।
उत्तर-
कपड़े के टुकड़ों से प्याज की गंध नहीं आ रही
प्रश्न 2. दोनों टुकड़ों को जल से धोकर उनकी गंध की पुनः जाँच कीजिए।
उत्तर-
(i) कपड़े के टुकड़े + तनु HCI का घोल → प्याज की गंध मौजूद है तथा इसका लाल रंग हल्का लाल हो गया।
(ii) कपड़े के टुकड़े + तनु NaOH का घोल → प्याज की गंध खत्म हो जाती है तथा इसका लाल रंग बदलकर हरा हो गया।
![]()
प्रश्न 3.
कपड़े के दोनों टुकड़ों को धोकर इसमें से एक में तनु वैनिला एवं दूसरे में लौंग का तेल की कुछ बूंदें डालकर इनकी गंधों की जाँच करने पर क्या ज्ञात होता है?
उत्तर-
गंध की जाँच (i) तनु वैनिला + तनु NaOH → कोई गंध नहीं है। तनु वैनिला + तनु HCl → वैनिला की गंध मौजूद है।
(ii) लौंग का तेल + HCl → गंध में कोई परिवर्तन नहीं हुआ।
लौंग का तेल + NaOH → गंध में कोई परिवर्तन नहीं हुआ।
क्रियाकलाप 2.3 (पा. पु. पृ. सं. 21)
प्रश्न 1.
दानेदार जिंक के टुकड़ों की सतह पर आप क्या देखते हैं?
उत्तर-
दानेदार जिंक के टुकड़ों की सतह से हाइड्रोजन गैस के बुलबुले निकलते हुए दिखाई देते हैं।
प्रश्न 2.
साबुन के विलयन में बुलबुले क्यों बनते हैं?
उत्तर-
साबुन के विलयन में हाइड्रोजन गैस के प्रवाहित होने के कारण ही बुलबुले बनते हैं।
प्रश्न 3.
जलती हुई मोमबत्ती को गैस वाले बुलबुले के पास ले जाने पर आप क्या प्रेक्षण करते हैं?
उत्तर-
जलती हुई मोमबत्ती को गैस वाले बुलबुले के पास ले जाने पर यह फट-फट (Pop-sound) की ध्वनि के साथ जलने लगती है।
प्रश्न 4.
कुछ अन्य अम्ल, जैसे- HCI, HNO3, एवं CH3COOH के साथ यदि Zn की क्रिया करायें तो क्या होगा?
उत्तर-
HCl, HNO3, व CH3COOH के साथ भी Zn क्रिया करके H2 गैस उत्पन्न करती है।
क्रियाकलाप 2.4 (पा. पु. पृ. सं. 22)
प्रश्न 1.
क्या जिंक NaOH के घोल से अभिक्रिया करती है?
उत्तर-
हाँ, दानेदार जिंक में 2mL, NaOH मिलाकर गर्म करने पर क्रियाकलाप 2.3 की तरह H2 गैस उत्सर्जित होती है।
प्रश्न 2.
जिंक तथा NaOH के बीच होने वाली अभिक्रिया लिखिए।
उत्तर-

क्रियाकलाप 2. 5 (पा.पु. पृ.सं. 22)
प्रश्न 1.
चित्र के अनुसार प्रत्येक स्थिति में उत्पादित गैस को चूने के पानी (कैल्सियम हाइड्रॉक्साइड का विलयन) से प्रवाहित कीजिए एवं अपने निरीक्षणों को अभिलिखित कीजिए। .
उत्तर-
चूने का पानी दूधिया हो जाता है। उपर्युक्त क्रियाकलाप में होने वाली अभिक्रियाओं को इस प्रकार लिखा जा सकता है
परखनली ‘A’-NaCO3 (s) + 2HCl (aq) → 2NaCl (aq) + H2O (l) + H2O (l) + CO2 (g)
परखनली ‘B’-NaHCO3 (s) + HCl (aq) → NaCl (aq) + H2O (l) + CO2 (g) उत्पादित कार्बन डाइऑक्साइड गैस को चूने के पानी में प्रवाहित करने पर,
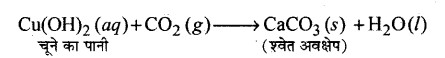
अत्यधिक मात्रा में कार्बन डाइ ऑक्साइड प्रवाहित करने पर निम्न अभिक्रिया होती है
CaCO3 (s)+ H2O(l) + CO2(g) → Ca(HCO3)2(aq) (जल में विलेयशील)|
![]()
प्रश्न 2.
Na2CO3 व NaHCO3, में तनु HCl मिलाने पर क्या होता है?
उत्तर-
Na2CO3, व NaHCO3, में तनु HCI मिलाने पर CO2, गैस मुक्त होती है।
प्रश्न 3.
CaCO3 के विविध रूप कौन से हैं?
उत्तर-
CaCO3, के चूना पत्थर (Limestone), खड़िया (Chalk) एवं संगमरमर (marble) आदि विविध रूप हैं।
क्रियाकलाप 2.6 (पा. पु. पृ. सं. 23)
प्रश्न 1.
क्या अभिक्रिया मिश्रण के रंग में कोई परिवर्तन आया?
उत्तर-
अम्ल में फिनॉल्पथेलीन मिलाने पर कोई रंग नहीं आया जबकि क्षार में फिनॉल्पथेलीन मिलाने पर गुलाबी – रंग आता है।
प्रश्न 2.
अम्ल मिलाने पर क्षार में मिले फिनॉल्पथेलीन का रंग क्यों बदल गया?
उत्तर-
क्षार में अम्ल मिलाने पर क्षार का प्रभाव खत्म हो गया। यही कारण है कि फिनॉल्पथेलीन का रंग बदल गया।
प्रश्न 3.
उपरोक्त मिश्रण में दोबारा NaOH की बूंद मिलाने पर क्या फिनॉल्फ्थेलीन का रंग पुनः गुलाबी हो गया?
उत्तर-
हाँ, क्योंकि अब विलयन पुनः क्षारीय हो गया।
प्रश्न 4.
आपके विचार में ऐसा क्यों होता है?
उत्तर-
ऐसा इसलिये होता है क्योंकि अम्ल द्वारा क्षार का प्रभाव व क्षार द्वारा अम्ल का प्रभाव समाप्त हो जाता है।
क्रियाकलाप 2.7 (पा. पु. पृ. सं. 23)
प्रश्न 1.
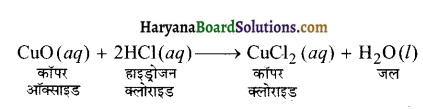
कॉपर ऑक्साइड का अभिक्रिया के दौरान क्या होता है?
उत्तर-
कॉपर ऑक्साइड का नीला रंग समाप्त होने लगेगा व विलयन का रंग नील-हरित होने लगेगा। ऐसा कॉपर (II) क्लोराइड के बनने के कारण होता है।
प्रश्न 2.
अभिक्रिया का सन्तुलित समीकरण लिखें।
उत्तर-
क्रियाकलाप 2. 8 (पा. पु. पृ. सं. 24)
प्रश्न 1.
आपने क्या प्रेक्षण किया ?
उत्तर-
बीकर में अम्ल का विलयन लेने पर विद्युत का चालन होता है और बल्ब जलने लगता है।
प्रश्न 2.
ग्लूकोज व ऐल्कोहॉल के विलयन को लेने पर क्या विद्युत का चालन होता है?
उत्तर-
नहीं, ग्लूकोज एवं ऐल्कोहॉल का विलयन विद्युत का चालन नहीं करता है।
![]()
प्रश्न 3.
अम्ल में विद्युत का चालन किस कारण से होता है?
उत्तर-
अम्ल में विद्युत का चालन धनायन H+ की उपस्थिति के कारण होता है।
प्रश्न 4.
बल्ब क्या प्रत्येक स्थिति में जलता है।
उत्तर-
बल्ब प्रत्येक स्थिति में नहीं जलता है।
क्रियाकलाप 2.9 (पा. पु. पृ. सं. 25)
प्रश्न 1.
NaCI व सान्द्र H2SO4 के मध्य क्रिया कराने पर क्या कोई गैस बाहर निकलती है?
उत्तर-
हाँ।
प्रश्न 2.
उत्सर्जित गैस को सूखे व नम नीले लिटमस पत्र से जाँचने पर क्या ज्ञात होता है?
उत्तर-
उत्सर्जित गैस नम नीले लिटमस पत्र को लाल कर देती है परन्तु सूखे नीले लिटमस पत्र पर कोई प्रभाव नहीं डालती है।
प्रश्न 3.
कौन अम्लीय गुण प्रदर्शित करता है?
(i) शुष्क HCl गैस या
(ii) HCl विलयन।
उत्तर-
HCl विलयन।
प्रश्न 4.
HCl विलयन अम्लीय गुण प्रदर्शित क्यों । करता है?
उत्तर-
क्योंकि विलयन में H+ आयन मुक्त हो जाते हैं इस कारण HCl विलयन अम्लीय गुण प्रदर्शित करता है।
क्रियाकलाप 2.10 (पा. पु. पृ. सं. 26)
प्रश्न 1.
जल व सल्फ्यूरिक अम्ल के मध्य क्रिया करने पर क्या तापमान में कोई परिवर्तन आता है?
उत्तर-
हाँ, जल व H2SO4 के मध्य क्रिया कराने पर तापमान बढ़ने लगता है।
प्रश्न 2.
अभिक्रिया ऊष्माशोषी है या ऊष्माक्षेपी?
उत्तर-
अभिक्रिया ऊष्माक्षेपी होती है।
क्रियाकलाप 2.11 (पा. पु. पृ. सं. 28)
प्रश्न-
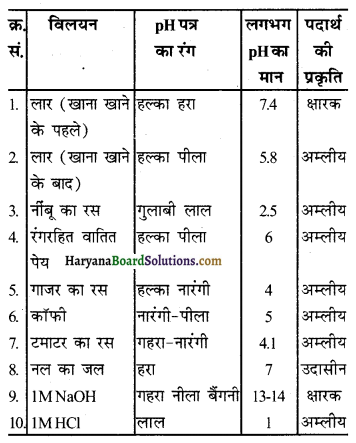
सारणी 2.2 में विलयन की pH की जाँच कीजिए। अपने प्रेक्षणों को सारणी में लिखिए।
उत्तर –
क्रियाकलाप 2.12 (पा. पु. पृ. सं. 29).
प्रश्न 1.
अपने क्षेत्र में पौधों के उपयुक्त विकास के लिए आदर्श मिट्टी के pH के सम्बन्ध में आपने क्या उत्कर्ष निकाला?
उत्तर-
आदर्श मिट्टी के लिए आदर्श pH परास 7 से 7.6
क्रियाकलाप 2.13 (पा. पु. पृ. सं. 31)
प्रश्न 1.
नीचे दिए गए लवण के सूत्र लिखिए. पौटेशियम सल्फेट, सोडियम सल्फेट, कैल्सियम सल्फेट, मैग्नीशियम सल्फेट, कॉपर सल्फेट, सोडियम क्लोराइड, सोडियम नाइट्रेट, सोडियम कार्बोनेट एवं अमोनियम क्लोराइड।
उत्तर –
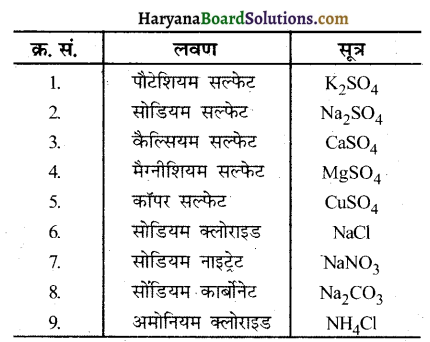
प्रश्न 2.
उन अम्ल एवं क्षारक की पहचान कीजिए जिससे उपर्युक्त (क्रियाकलाप-2.13 के प्रश्न 1) लवण प्राप्त किए जा सकते हैं।
उत्तर –
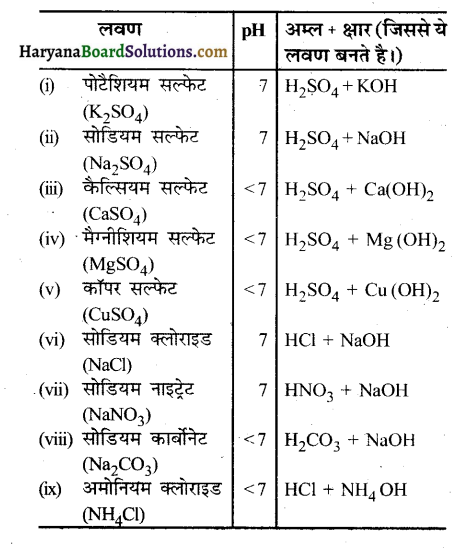
![]()
प्रश्न 3.
समान धन या ऋण मूलक वाले लवणों को एक ही परिवार का कहा जाता है। जैसे-NaCl एवं Na2SO4 , सोडियम लवण के परिवार का है। इसी प्रकार NaCl एवं KCI क्लोराइड लवण के परिवार के हैं। इस क्रियाकलाप में दिए गए लवणों में आप कितने परिवारों की पहचान कर सकते हैं?
उत्तर-

क्रियाकलाप 2.14 (पा. पु. पृ. सं. 32)
प्रश्न 1.
कौन से लवण अम्लीय, क्षारकीय एवं उदासीन हैं।
उत्तर-
अम्लीय लवण : ऐलुमिनियम क्लोराइड, जिंक सल्फेट, कॉपर सल्फेट।
क्षारकीय लवण : सोडियम ऐसीटेट, सोडियम कार्बोनेट, सोडियम हाइड्रोजन कार्बोनेट।
उदासीन लवण : सोडियम क्लोराइड, पोटैशियम नाइट्रेट।
प्रश्न 2.
अपने प्रेक्षणों को सारणी 2.4 में लिखिए।
उत्तर-
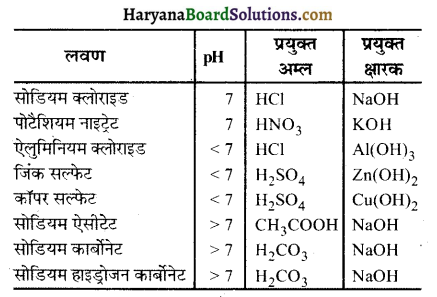
क्रियाकलाप 2.15 (पा. पु. पृ. सं. 35)
प्रश्न 1.
गर्म करने के बाद कॉपर सल्फेट का रंग क्या है?
उत्तर-
गर्म करने के बाद कॉपर सल्फेट का नीला रंग सफेद रंग में परिवर्तित हो जाता है।
प्रश्न 2.
क्वथन नली में क्या जल की बूंदें नजर आती हैं? ये कहाँ से आती हैं?
उत्तर-
क्वथन नली में जल की बूंदें नजर आती हैं। ये कॉपर सल्फेट के क्रिस्टल में उपस्थित जल को गर्म किये जाने पर वाष्प निकलने के कारण प्राप्त होती हैं अर्थात् ये कॉपर सल्फेट के क्रिस्टल में से आती हैं।
![]()
प्रश्न 3.
गर्म करने के बाद प्राप्त कॉपर सल्फेट के नमूने में दोबारा जल की 2-3 बूंदें डालने पर क्या प्राप्त होता है ? क्या नीला रंग वापस आता है?
उत्तर-
कॉपर सल्फेट के नमूने में दोबारा जल की बूंदें डालने पर नीला रंग वापस आ जाता है क्योंकि CuSO4 दोबारा जल से क्रिया करके नीले रंग का CuSO4, 5 H2O बना लेता है।