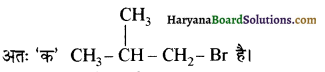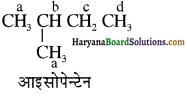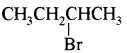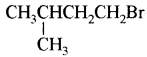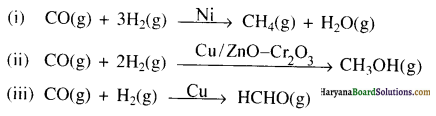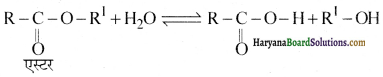HBSE 12th Class Chemistry Solutions Chapter 13 ऐमीन
Haryana State Board HBSE 12th Class Chemistry Solutions Chapter 13 ऐमीन Textbook Exercise Questions and Answers.
प्रश्न 13.1.
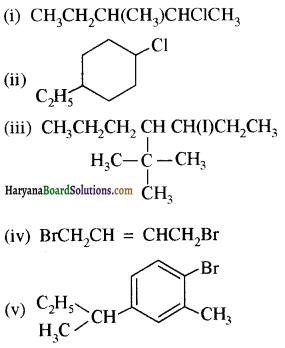
निम्नलिखित यौगिकों को प्राथमिक, द्वितीयक एवं तृतीयक ऐमीनों में वर्गीकृत कीजिए तथा इनके आईयूपीएसी नाम लिखिए-
(i) (CH3),CHNH2
(ii) CH3(CH2)2NH2
(iii) CH3NHCH(CH3)2
(iv) (CH3)3CNH2
(v) C6H5NHCH3
(vi) (CH3CH2)2NCH3
(vii) 
उत्तर:
(i) प्रोपेन 2-ऐमीन (1°)
(ii) प्रोपेन- 1- ऐमीन (1°)
(iii) N मेथिल प्रोपेन-2-ऐमीन (2°)
(iv) 2- मेथिल प्रोपेन 2- ऐमीन (1°)
(v) N-मेथिलबेन्जीनेमीन या N – मेथिलऐनिलीन (2°)
(vi) N. एथिल – N मेथिलएथेनेमीन (3°)
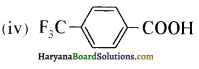
(vii) 3 ब्रोमोऐनिलीन या 3 – ब्रोमोबेन्जीनेमीन (1°)
प्रश्न 13.2.
निम्नलिखित युगलों के यौगिकों में विभेद के लिए एक रासायनिक परीक्षण दीजिए-
(i) मेथिलऐमीन एवं डाइमेथिलऐमीन
(ii) द्वितीयक एवं तृतीयक ऐमीन
(iii) ऐथिलऐमीन एवं ऐनिलीन
(iv) ऐनिलीन एवं बेन्जिलऐमीन
(v) ऐनिलीन एवं N मेथिलऐनिलीन ।
उत्तर:
(i) मेथिलऐमीन CH3-NH2 (1°) हिन्सबर्ग अभिकर्मक (C6H5 SO2Cl) से क्रिया करता है तथा बना उत्पाद क्षार में विलेय होता है। जबकि डाइमेथिलऐमीन CH3-NH-CH3(2°) की हिन्सबर्ग अभिकर्मक (बेन्जीन सल्फोनिल क्लोराइड) से क्रिया द्वारा बना उत्पाद धार में अविलेय होता है।
(ii) द्वितीयक ऐमीन (R2NH) हिन्सवर्ग अभिकर्मक से क्रिया करते हैं तथा बना उत्पाद धार में अविलेय होता है जबकि तृतीयक ऐमीन हिन्सबर्ग अभिकर्मक से क्रिया नहीं करते।
(iii) ऐथिलऐमीन बेन्जीन डाइएजोनियम क्लोराइड से क्रिया करके ऐजो रंजक (Azo dye) नहीं बनाता जबकि ऐनिलीन, बेन्जीन डाइएजोनियम क्लोराइड से क्रिया करके एजोरंजक (पीला) बनाती है।
(iv) ऐनिलीन, बेन्जीन डाइएजोनियम क्लोराइड (C6H5N2Cl) से क्रिया करके एजोरंजक बनाती है लेकिन बेन्जिलऐमीन ऐसा नहीं करती।
(v) ऐनिलीन (1°), CHCl3 तथा क्षार के साथ कार्बिलऐमीन परीक्षण देता है जबकि N मेथिल ऐनिलीन (2°) कार्बिल ऐमीन परीक्षण नहीं देती।
![]()
प्रश्न 13.3.
निम्नलिखित के कारण बताइए-
(i) ऐनिलीन का pKb मेथिलऐमीन की तुलना में अधिक होता
(ii) ऐथिलऐमीन जल में विलेय है जबकि ऐनिलीन नहीं।
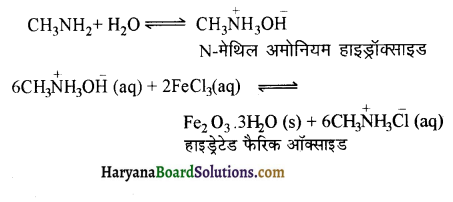
(iii) मेथिलऐमीन फेरिक क्लोराइड के साथ जल में अभिक्रिया करने पर जलयोजित फेरिक ऑक्साइड का अवक्षेप देता है।
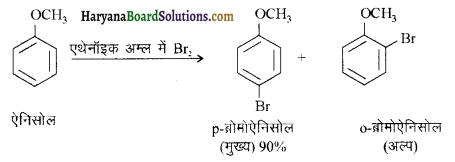
(iv) यद्यपि ऐमीनों समूह इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाओं में आर्थों एवं पैरा निर्देशक होता है फिर भी ऐनिलीन नाइट्रोकरण द्वारा यथेष्ट मात्रा में मेटानाइट्रोऐनीलीन देती है।
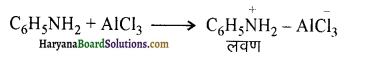
(v) ऐनिलीन फ्रिडेल क्राफ्ट्स अभिक्रिया प्रदर्शित नहीं करती।
(vi) ऐरोमैटिक ऐमीनों के डाइऐजोनियम लवण ऐलीफैटिक ऐमीनों से प्राप्त लवण से अधिक स्थायी होते हैं।
(vii) प्राथमिक ऐमीन के संश्लेषण में गैब्रिएल थैलिमाइड संश्लेषण को प्राथमिकता दी जाती है।
उत्तर:
(i) मेथिल ऐमीन (CH3-NH2) में मैथिल समूह के +I प्रभाव (इलेक्ट्रॉन प्रतिकर्षी प्रभाव ) के कारण नाइट्रोजन परमाणु पर इलेक्ट्रॉन घनत्व बढ़ जाता है अतः इसकी इलेक्ट्रॉन देने की प्रवृत्ति अधिक होती है।
इसलिए इसका क्षारीय गुण अधिक होता है जबकि ऐनिलीन 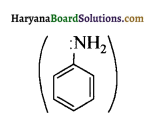 में नाइट्रोजन का एकाकी इलेक्ट्रॉन युग्म बेन्जीन वलय के साथ अनुनाद (+M प्रभाव) करता है जिससे इसके नाइट्रोजन पर इलेक्ट्रॉन घनत्व कम हो जाता है अतः इसकी इलेक्ट्रॉन देने की प्रवृत्ति कम हो जाती है इसलिए इसका क्षारीय गुण कम होता है। इसी कारण ऐनिलीन का pKb मेथिलऐमीन की तुलना में अधिक होता है क्योंकि क्षारीय गुण ∝ \(\frac{1}{\mathrm{pK}_{\mathrm{b}}} \propto \mathrm{K}_{\mathrm{b}}\) (क्षार वियोजन स्थिरांक)
में नाइट्रोजन का एकाकी इलेक्ट्रॉन युग्म बेन्जीन वलय के साथ अनुनाद (+M प्रभाव) करता है जिससे इसके नाइट्रोजन पर इलेक्ट्रॉन घनत्व कम हो जाता है अतः इसकी इलेक्ट्रॉन देने की प्रवृत्ति कम हो जाती है इसलिए इसका क्षारीय गुण कम होता है। इसी कारण ऐनिलीन का pKb मेथिलऐमीन की तुलना में अधिक होता है क्योंकि क्षारीय गुण ∝ \(\frac{1}{\mathrm{pK}_{\mathrm{b}}} \propto \mathrm{K}_{\mathrm{b}}\) (क्षार वियोजन स्थिरांक)
(ii) ऐथिलऐमीन (C2H5NH2) जल के साथ हाइड्रोजन बन्ध बनाती है जबकि ऐनिलीन के C.H, समूह (अध्रुवीय) के बड़े आकार के कारण इसमें जल के साथ हाइड्रोजन बन्ध बनाने की प्रवृत्ति नहीं होती अतः ऐथिलऐमीन जल में विलेय है जबकि ऐनिलीन नहीं।
(iii) मैथिलऐमीन जलीय विलयन में OH आयन देता है जो FeCl3 (जलीय) के साथ क्रिया करके पहले हाइड्रॉक्साइड तथा वह फिर जलयोजित ऑक्साइड का अवक्षेप देता है। अभिक्रियाएँ निम्न प्रकार होती हैं-
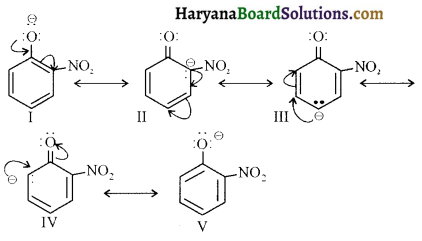
(iv) ऐमीनों समूह इलेक्ट्रॉनरागी प्रतिस्थापन के लिए ऑर्थो तथा पैरा निर्देशी होता है लेकिन ऐनिलीन के नाइट्रीकरण में यथेष्ट मात्रा में मेटानाइट्रोऐनिलीन बनती है क्योंकि प्रबल अम्लीय माध्यम में ऐनिलीन प्रोटॉन ग्रहण करके ऐनिलीनियम आयन बनाती है जो कि मेटा निर्देशक है (-I प्रभाव के कारण)।
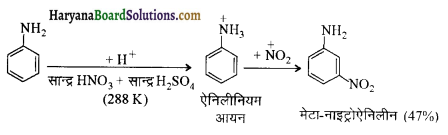
इस अभिक्रिया में पैरा 51% तथा आर्थो उत्पाद (2%) भी बनते हैं।
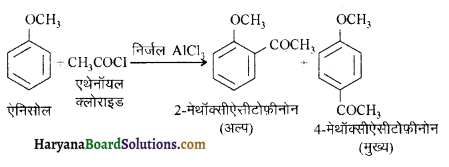
(v) ऐनिलीन फ्रिडेल क्राफ्ट्स अभिक्रिया प्रदर्शित नहीं करती क्योंकि इस अभिक्रिया में प्रयुक्त उत्प्रेरक AlCl3 (ऐलुमिनियम क्लोराइड) लुइस अम्ल है अतः यह ऐनिलीन (लुईस क्षार) के साथ लवण बना लेता है। लवण बनने के कारण ऐनिलीन का नाइट्रोजन, धन आवेश प्राप्त कर लेता है जो कि प्रबल विसक्रियणकारी समूह है अतः इसकी क्रियाशीलता कम हो जाती है।
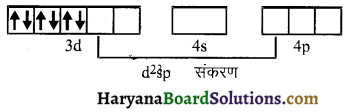
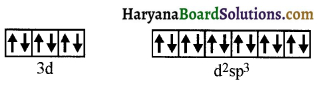
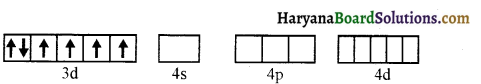
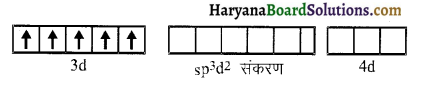
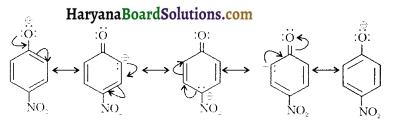
(vi) ऐरोमैटिक ऐमीनों के डाइएजोनियम लवण, ऐलीफैटिक ऐमीनों से प्राप्त लवण से अधिक स्थायी होते हैं क्योंकि इनमें अनुनाद के कारण स्थायित्व आ जाता है। C6H5N2+ की अनुनादी संरचनाएँ निम्न प्रकार होती हैं-
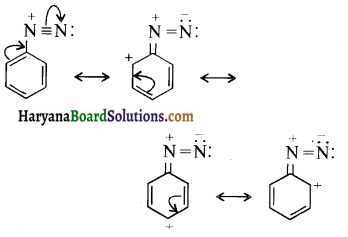
ऐरीन डाइएजोनियम लवण विलयन में निम्न ताप पर (273-278K) कुछ समय के लिए ही स्थायी होते हैं।
(vii) गैब्रिएल थैलिमाइड संश्लेषण में R X से R-NH2 बनता है जिसमें शुद्ध प्राथमिक ऐमीन बनती है तथा अन्य कोई सहउत्पाद प्राप्त नहीं होते क्योंकि अभिक्रिया से प्राप्त थैलिक अम्ल पुनः प्रयुक्त हो जाता है जबकि अन्य अभिक्रियाओं में उत्पादों का मिश्रण बनता है। अतः प्राथमिक ऐमीन के संश्लेषण में गैब्रिएल थैलिमाइड अभिक्रिया को प्राथमिकता दी जाती है।
![]()
प्रश्न 13.4.
निम्नलिखित को क्रम में लिखिए-
(i) pK, मान के घटते क्रम में-
C2H5NH2, C6H5NHCH3, (C2H5)2NH एवं C6H5NH2
(ii) क्षारकीय प्राबल्य के घटते क्रम में-
C6H5NH2, C6H5N(CH3)2, (C2H5)2NH एवं CH3NH2
(iii) क्षारकीय प्राबल्य के बढ़ते क्रम में-
(क) ऐनिलीन, पैरा-नाइट्रोऐनिलीन एवं पैरा-टॉलूडीन
(ख) C6H5NH2, C6H5NHCH3, C6H5CH2NH2
(iv) गैस अवस्था में घटते हुए क्षारकीय प्राबल्य के क्रम में-
C2H5NH2, (C2H5)2NH, (C2H5)3N एवं NH3
(v) क्वथनांक के बढ़ते क्रम में-
C2H5OH, (CH3)2NH, C2H5NH2
(vi) जल में विलेयता के बढ़ते क्रम में-
C6H5NH2, (C2H5)2NH, C2H5NH2
उत्तर:
(i) C6H5NH2 > (C6H5NHCH3 > C2H5NH2 > (C2H5)2NH (pKb मान का घटता क्रम अर्थात् क्षारीय प्रबलता का बढ़ता क्रम)
(ii) (C2H5)2NH > CH3-NH2 > C6H5N (CH3)2 > CH, NH (क्षारीय प्रबलता (प्राबल्य) का घटता क्रम )
(iii) (क) p-नाइट्रोऐनिलीन < ऐनिलीन < p-टॉलूडीन (क्षारीय प्रबाल्य का बढ़ता क्रम )
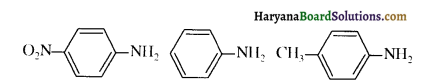
(ख) C6H5NH2 < C6H5NHCH3 < C6H5CH2NH2
(iv) (C2H5)3N > (C2H5)2NH > C2H5NH2 > NH3
(गैसीय अवस्था में शारकीय प्राबल्य का घटता क्रम )
(v) (CH3)2NH < C2H5NH<sub2 < C2H5OH ( क्वथनांक का बढ़ता क्रम )
(vi) C6H5NH2 < (C2H5)2NH < C2H5NH2 (जल में विलेयता का बढ़ता क्रम)
प्रश्न 13.5.
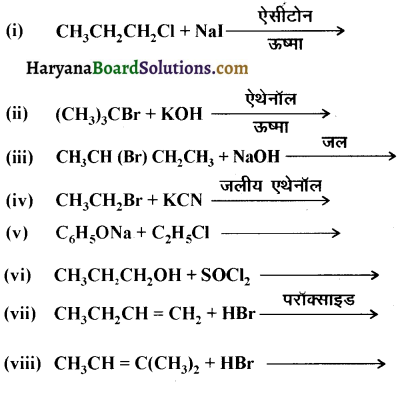
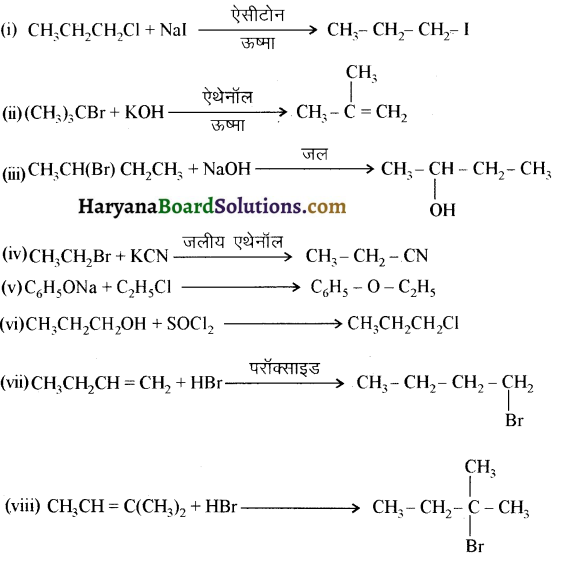
इन्हें आप कैसे परिवर्तित करेंगे-
(i) एथेनॉइक अम्ल को मेथेनेमीन में
(ii) हैक्सेननाइट्राइल को 1- ऐमीनापेन्टेन में
(iii) मेथेनॉल को एथेनॉइक अम्ल में
(iv) एथेनेमीन को मेथेनेमीन में
(v) एथेनॉइक अम्ल को प्रोपेनॉइक अम्ल में
(vi) मेथेनेमीन को एथेनेमीन में
(vii) नाइट्रोमेथेन को डाइमेथिलऐमीन में
(viii) प्रोपेनॉइक अम्ल को एथेनॉइक अम्ल में ?
उत्तर:
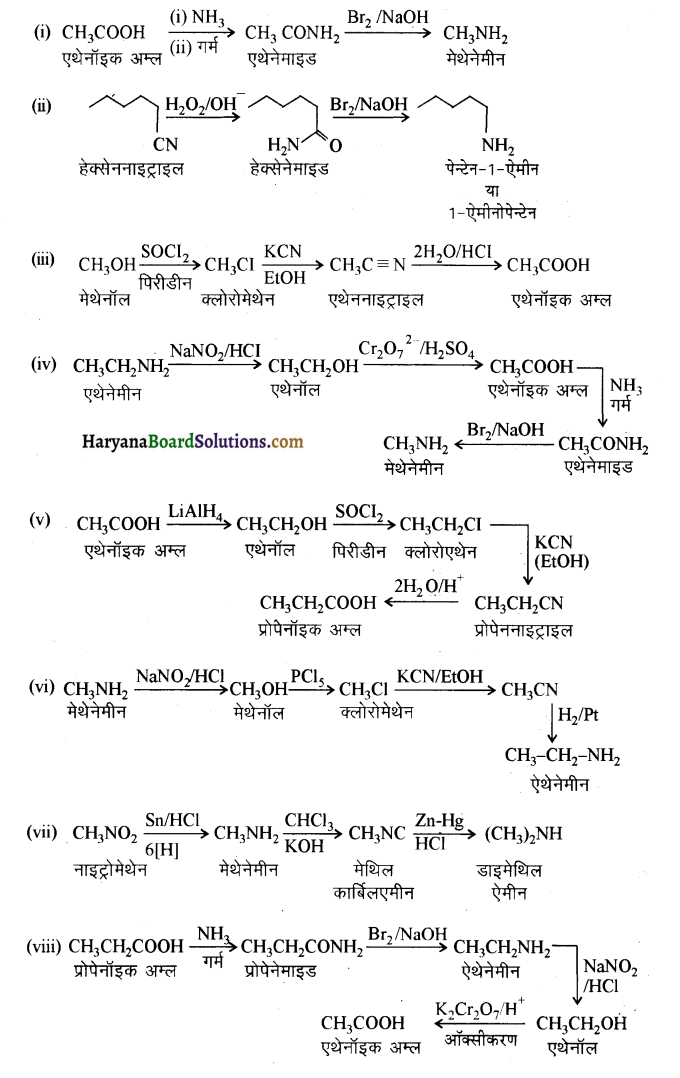
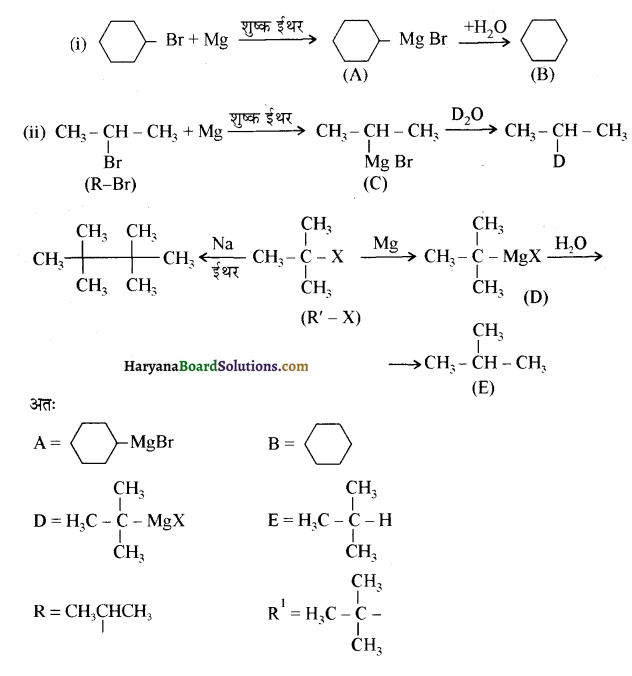
प्रश्न 13.6.
प्राथमिक, द्वितीयक एवं तृतीयक ऐमीनों की पहचान की विधि का वर्णन कीजिए। इन अभिक्रियाओं के रासायनिक समीकरण भी लिखिए।
उत्तर:
प्राथमिक, द्वितीयक एवं तृतीयक ऐमीनों की पहचान निम्नलिखित विधियों से की जाती है-
कार्बिलऐमीन अभिक्रिया – ऐलिटिक तथा ऐरोमैटिक प्राथमिक ऐमीनों को क्लोरोफ़ार्म तथा एथेनॉलिक पोटैशियम हाइड्रॉक्साइड के साथ गर्म करने पर तीक्ष्ण दुर्गंधयुक्त पदार्थ आइसोसायनाइड अथवा कर्बिलऐमीन बनता है। द्वितीयक एवं तृतीयक ऐमीन में यह अभिक्रिया नहीं होती ।

प्रश्न 13.7.
निम्न पर लघु टिप्पणी लिखिए-
(i) कार्बिलऐमीन अभिक्रिया
(ii) डाइऐजोकरण (डाइऐजोटीकरण).
(iii) हॉफमान ब्रोमाइड अभिक्रिया
(iv) युग्मन अभिक्रिया
(v) अमीनो अपघटन
(vi) ऐसीटिलन
(vii) गैब्रिएल थैलिमाइड संश्लेषण।
उत्तर:
(i) कार्बिलऐमीन अभिक्रिया – ऐलिटिक तथा ऐरोमैटिक प्राथमिक ऐमीनों को क्लोरोफ़ार्म तथा एथेनॉलिक पोटैशियम हाइड्रॉक्साइड के साथ गर्म करने पर तीक्ष्ण दुर्गंधयुक्त पदार्थ आइसोसायनाइड अथवा कर्बिलऐमीन बनता है। द्वितीयक एवं तृतीयक ऐमीन में यह अभिक्रिया नहीं होती ।

(ii) डाइऐजोकरण या डाइऐजोटीकरण (Diazotisation ) – 273-278 K (निम्न ताप) ताप पर प्राथमिक ऐरोमैटिक ऐमीन की NaNO, तथा HCI से अभिक्रिया कराने पर एरीन डाइएजोनियम लवण बनते हैं। इस अभिक्रिया को डाइऐजोटीकरण कहते हैं।
ऐनीलीन की अभिक्रिया से बेन्जीन डाइऐजोनियम क्लोराइड बनता है। यह अस्थायी होता है अतः इसका प्रयोग तुरन्त कर लिया जाता है।
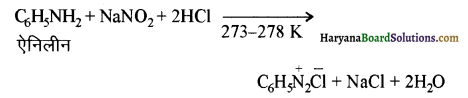
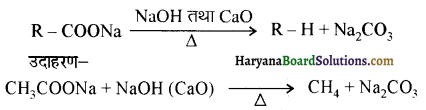
(iii) हॉफमान ब्रोमेमाइड अभिक्रिया (Hoffmann Bromamide Rcaction ) इस अधिक्रिया में किसी ऐमाइड की NaOH या KOH के जलीय अथवा ऐथेनॉलिक विलयन में ग्रोमीन से अभिक्रिया करते हैं तो प्राथमिक ऐमीन प्राप्त होती है।

(iv) युग्मन अभिक्रिया ( Coupling Reaction ) – बेन्जीन डाइरजोनियम क्लोराइड, फ़ीनॉल से अभिक्रिया करके इसकी पैरा स्थिति पर युग्मित होकर पैरा हाइड्रॉक्सीऐजोबेन्जीन देता है। इस अभिक्रिया को युग्मन अभिक्रिया कहते हैं। इसी प्रकार डऐजोनियम लवण की ऐनोलीन से अभिक्रिया द्वारा पैशाऐमीनोऐजोबेन्जीन बनती है। यह एक इलेक्ट्रॉननेही प्रतिस्थापन अभिक्रिया है। प्राप्त यौगिक रंगीन होते हैं तथा ये ऐजो रंजक होते हैं।
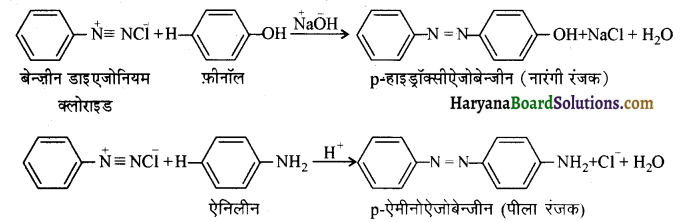
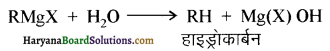
(v) अमोनी अपघटन (Ammonolysis ) – 373 K ताप पर एक बन्द नली में ऐल्किल अथवा बेन्जिल हैलाइडों की क्रिया एथ्रेनॉलिक अमोनिया के साथ करवाने पर हैलोजन परमाणु का प्रतिस्थापन ऐमीनों समूह द्वारा हो जाता है तथा प्राथमिक ऐमीन प्राप्त होता है। यह एक नाभिकस्नेही प्रतिस्थापन अभिक्रिया है। अमोनिया द्वारा ऐल्किल हैलाइड के कार्बन हैलोजन बन्ध के विखण्डन की इस प्रक्रिया को अमोनी अपघटन कहा जाता है। इस अभिक्रिया में प्राप्त प्राथमिक ऐमीन पुनः ऐल्किल हैलाइड से क्रिया करके 2° तथा 3° ऐमीन एवं अन्त में चतुष्क अमोनियम लवण बना देती है अतः यहाँ यौगिकों का मिश्रण बनता है। इस अभिक्रिया के लिए ऐल्किल हैलाइडों की क्रियाशीलता का क्रम निम्न प्रकार होता है-
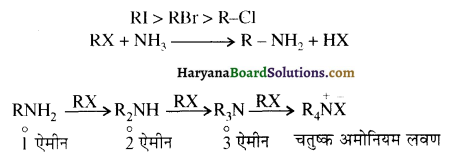
अभिक्रिया द्वारा प्राप्त ऐमीन, HX के साथ क्रिया करके लवण बना देती है जिसकी क्रिया प्रबल क्षार के साथ करवाने पर पुनः ऐमीन प्राप्त हो जाती है।
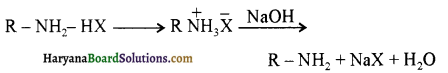
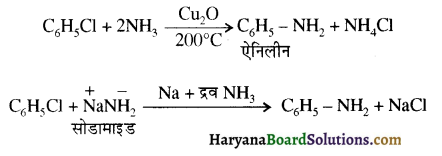
(i) इस अभिक्रिया द्वारा मुख्य उत्पाद के रूप में प्राथमिक ऐमीन प्राप्त करने के लिए अमोनिया को आधिक्य में लिया जाना चाहिए।
(ii) इस अभिक्रिया द्वारा ऐनिलीन बनाना मुश्किल होता है क्योंकि क्लोरो बेन्जीन में +M प्रभाव के कारण कार्बन क्लोरीन बन्ध में द्विबन्ध के गुण आ जाते हैं अतः इसकी क्रियाशीलता कम हो जाती है। इस कारण ऐनिलीन बनाने के लिए निम्नलिखित विशिष्ट विधियों का प्रयोग किया जाता है-
(vi) ऐसिलीकरण – ऐलीफैटिक तथा ऐरोमैटिक प्राथमिक एवं ऐसिलीकरण-द्वितीयक ऐमीन, ऐसिड क्लोराइड तथा एसिड एनहाइड्राइड के साथ नाभिकस्नेही प्रतिस्थापन अभिक्रिया करते हैं तो इसे ऐसिलीकरण अभिक्रिया कहते हैं। इस अभिक्रिया में -NH2 अथवा > NH समूह में उपस्थित हाइड्रोजन परमाणु का ऐसिल समूह द्वारा प्रतिस्थापन होता है। इस अभिक्रिया में CH3COCl लेने पर इसे ऐसिटिलीकरण (Acetylation) कहते हैं तथा यह अभिक्रिया पिरौडीन की उपस्थिति में की जाती है जिससे प्राप्त HCI का अवशोषण होकर साम्य अग्र दिशा में विस्थापित हो जाता है।
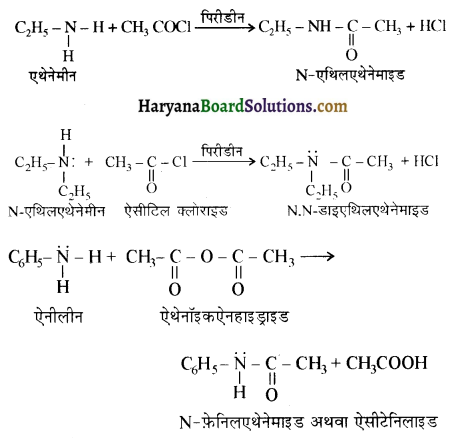
जब ऐमीनों की अभिक्रिया बेन्जॉयल क्लोराइड से करवाते हैं तो इस अभिक्रिया को बेन्जॉयलीकरण ( Benzoylation) कहते हैं तथा वैज्ञानिक के नाम के आधार पर इसे शॉटन बॉमन अभिक्रिया कहा जाता है।
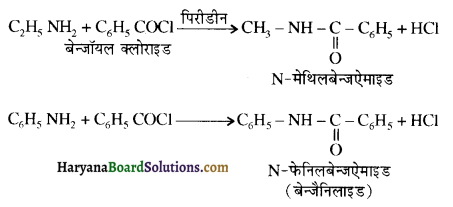
ऐमीन कमरे के ताप पर कार्बोक्सिलिक अम्लों के साथ क्रिया करके लवण बनाती हैं।
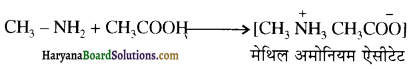
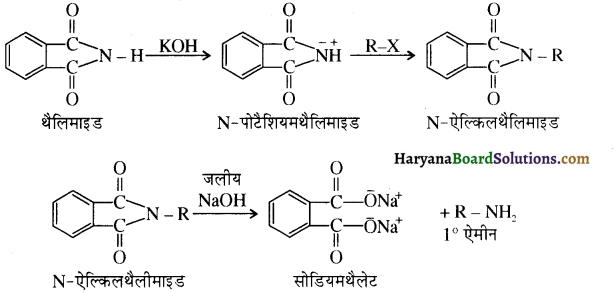
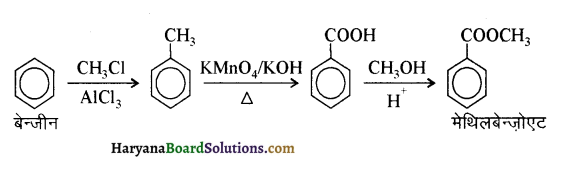
(vii) गैब्रिल थैलिमाइड संश्लेषण द्वारा (By Gabriel Pthallimide Synthesis) – ऐलिफैटक ऐमीन बनाने की यह एक उत्तम विधि है। इस विधि में थैलिमाइड की क्रिया एथेनॉलिक KOH से करवाते हैं तो इसका पोटैशियम लवण बनता है जिसे ऐल्किल हैलाइड के साथ गरम करके क्षारीय जल अपघटन कराने पर प्राथमिक ऐमीन बनते हैं। इस अभिक्रिया द्वारा ऐरोमैटिक प्राथमिक ऐमीन, जैसे ऐनिलीन, सुगमता से नहीं बनती, क्योंकि ऐरिल हैलाइडों की क्रियाशीलता ऐल्किल हैलाइडों से कम होती है।
प्रश्न 13.8.
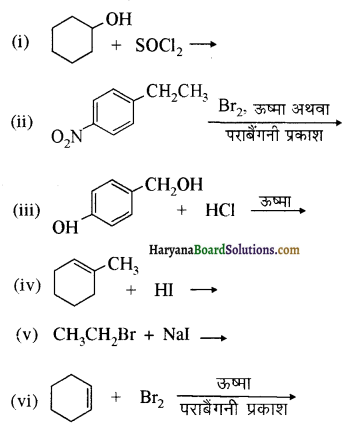
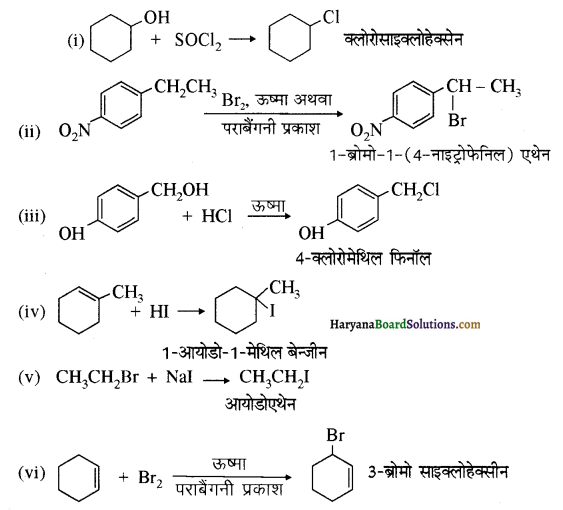
निम्न परिवर्तन निष्पादित कीजिए-
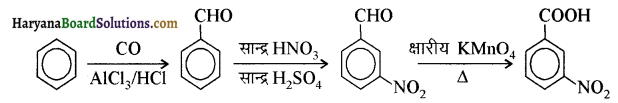
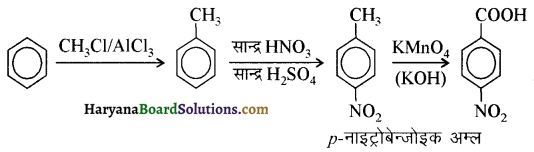
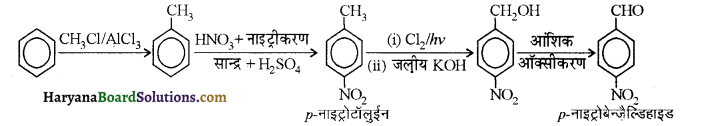
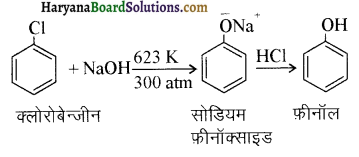
(i) नाइट्रो बेन्जीन से बेन्ज़ोइक अम्ल
(ii) बेन्जीन से m ब्रोमोफ़ीनॉल
(iii) बेन्जोइक अम्ल से ऐनिलीन
(iv) ऐनिलीन से 2,4, 6- ट्राइब्रोमोफ्लुओरोबेन्जीन
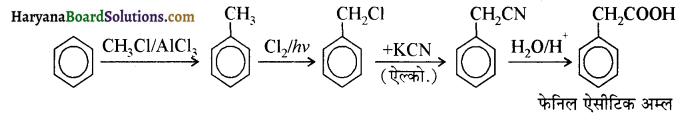
(v) बेन्जिल क्लोराइड से 2 फ्रेनिलएथेनेमीन
(vi) क्लोरोबेन्ज़ीन से p-क्लोरोऐनिलीन
(vii) ऐनिलीन से p-ब्रोमोऐनिलीन
(viii) बेन्ज़एमाइड से टॉलुईन
(ix) ऐनीलीन से बेन्ज़ाइल ऐल्कोहॉल।
उत्तर:
(i) नाइट्रोबेन्जीन से बेन्जोइक अम्ल-
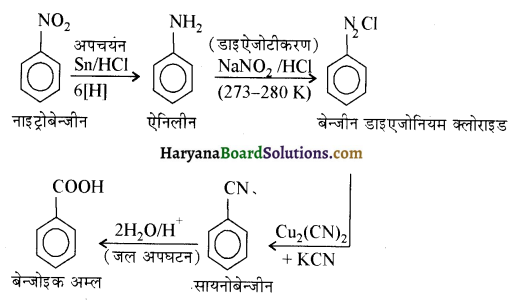
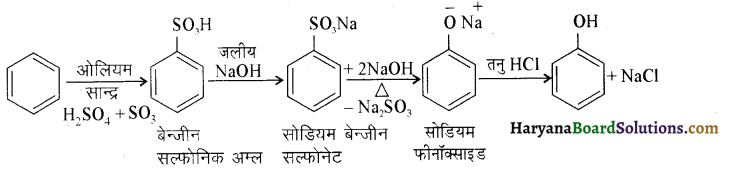
(ii) बेन्जीन से m ब्रोमोफ़ीनॉल
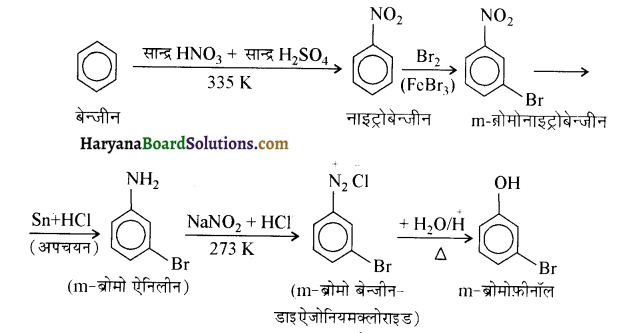
(iii) बेन्जोइक अम्ल से ऐनिलीन
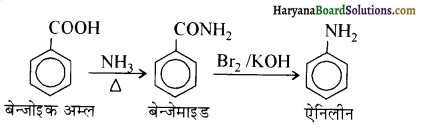
(iv) ऐनिलीन से 2,4, 6- ट्राइब्रोमोफ्लुओरोबेन्जीन
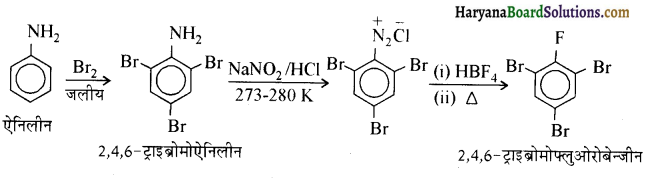
(v) बेन्जिल क्लोराइड से 2 फ्रेनिलएथेनेमीन
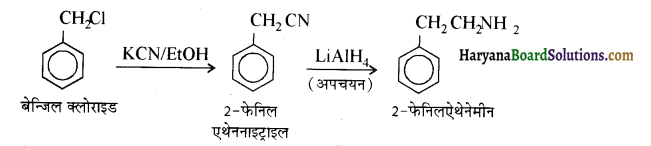
(vi) क्लोरोबेन्ज़ीन से p-क्लोरोऐनिलीन
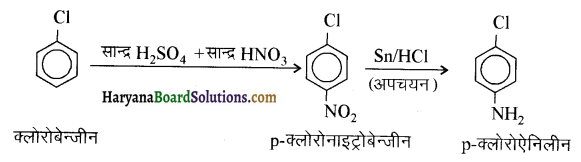
(vii) ऐनिलीन से p-ब्रोमोऐनिलीन
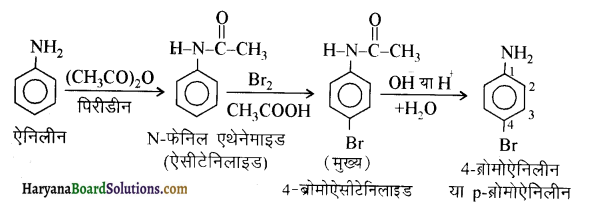
(viii) बेन्ज़एमाइड से टॉलुईन
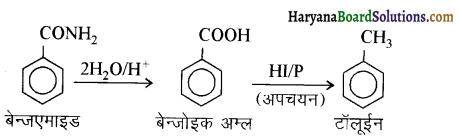
(ix) ऐनीलीन से बेन्ज़ाइल ऐल्कोहॉल।
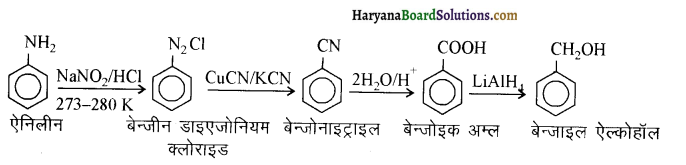
प्रश्न 13.9.
निम्न अभिक्रियाओं में A, B तथा C की संरचना दीजिए-
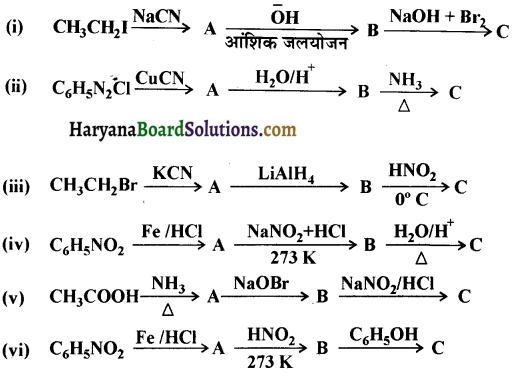
उत्तर:
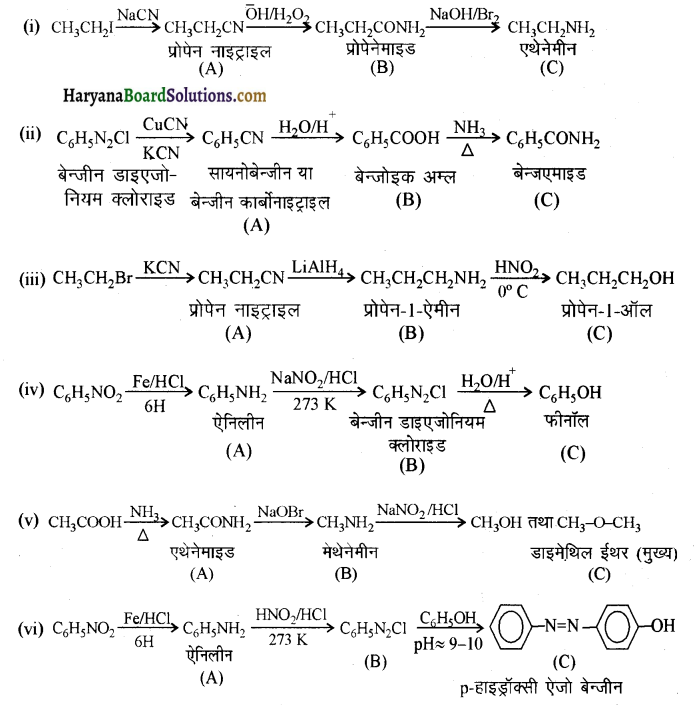
प्रश्न 13.10.
एक ऐरोमैटिक यौगिक ‘A’ जलीय अमोनिया के साथ गरम करने पर यौगिक ‘B’ बनाता है जो Br, एवं KOH के साथ गरम करने पर अणु सूत्र C. H, N वाला यौगिक ‘C’ बनाता है। A, B एवं C यौगिकों की संरचना एवं इनके आईयूपीएसी नाम लिखिए।
उत्तर:
अभिक्रिया तथा A, B, C व उनके नाम अग्र प्रकार हैं-
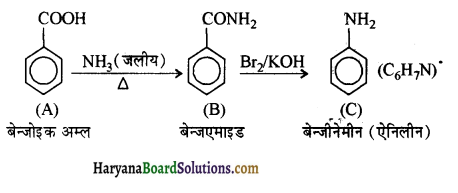
प्रश्न 13.11.
निम्नलिखित अभिक्रियाओं को पूर्ण कीजिए-
(i) C6H5NH2 + CHCl3 + ( ऐल्कोहॉली) KOH →
(ii) C6H5N2Cl + H3PO2 + H2O →
(iii) C6H5NH2 + H2SO4 सांद्र
(iv) C6H5N2Cl + C2H5OH →
(v) C6H5NH2 + Br2 (aq) →
(vi) C6H5NH2 + (CH3CO)2 O
(vii) C6H5N2Cl 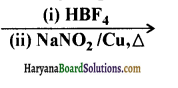
उत्तर:
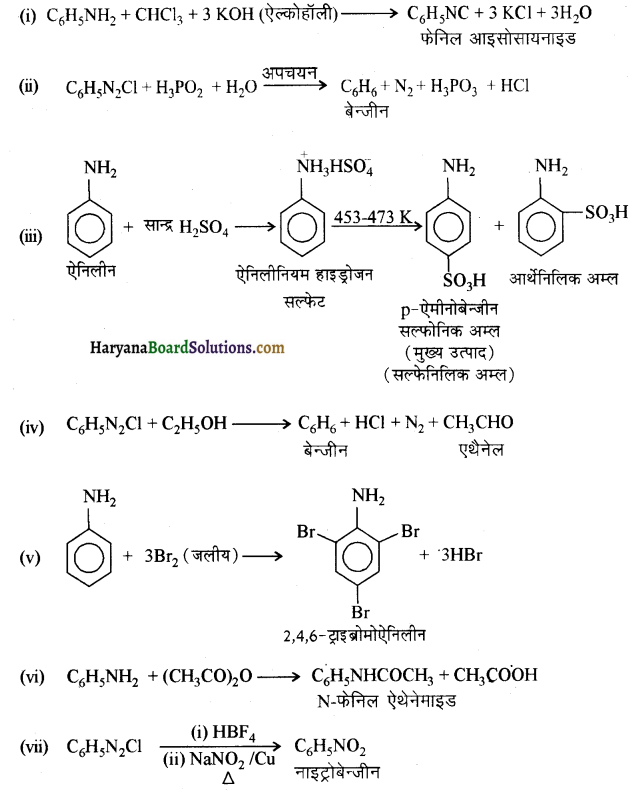
प्रश्न 13.12.
एैरोमैटिक प्राथमिक ऐमीन को गैब्रिएल थैलिमाइड संश्लेषण से क्यों नहीं बनाया जा सकता?
उत्तर:
ऐरोमैटिक प्राथमिक ऐमीन को गैब्रिएल थैलिमाइड संश्लेषण से नहीं बना सकते क्योंकि ऐरिल हैलाइड में अनुनाद (+M प्रभाव) के कारण कार्बन हैलोजन आंबन्ध में द्विआबन्ध के गुण आ जाते हैं अतः वह प्रबल हो जाता है। इस कारण ऐरिल हैलाइड थैलिमाइड से प्राप्त ऋणायन के साथ नाभिकस्नेही प्रतिस्थापन अभिक्रिया नहीं कर पाते हैं।
प्रश्न 13.13.
ऐलिफैटिक एवं ऐरोमैटिक ऐमीनों की नाइट्रस अम्ल से अभिक्रिया लिखिए।
उत्तर:
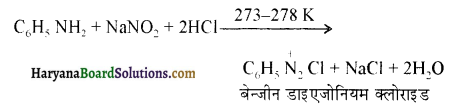
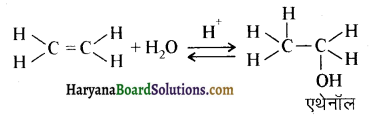
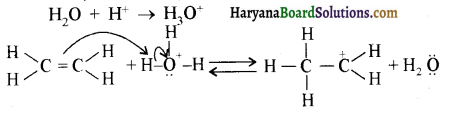
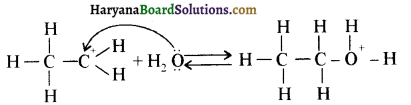
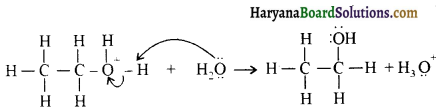
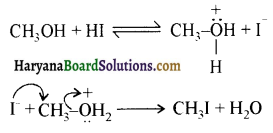
ऐलिफैटिक प्राथमिक ऐमीन नाइट्रस अम्ल के साथ अभिक्रिया’ द्वारा मुख्यतः ऐल्कोहॉल देते हैं।
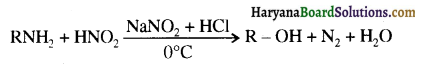
ऐरोमैटिक अम्ल नाइट्रस अम्ल (NaNO2 + HCl) से क्रिया करके डाइएजोनियम लवण बनाते हैं।
प्रश्न 13.14.
निम्नलिखित में प्रत्येक का संभावित कारण बताइए-
(i) समतुल्य अणु द्रव्यमान वाले ऐमीनों की अम्लता ऐल्कोहॉलों से कम होती है।
(ii) प्राथमिक ऐमीनों का क्वथनांक तृतीयक ऐमीनों से अधिक होता है।
(iii) ऐरोमैटिक ऐमीनों की तुलना में ऐलीफैटिक ऐमीन प्रबल क्षारक होते हैं।
उत्तर:
(i) समतुल्य अणु द्रव्यमान वाले ऐमीनों की अम्लता ऐल्कोहॉलों से कम होती है क्योंकि ऐमीनों में – NH बन्ध की ध्रुवता ऐल्कोहॉलों के – O-H बन्ध की ध्रुवता से कम होती है क्योंकि ऑक्सीजन की विद्युतऋणता, नाइट्रोजन से अधिक है अतः ऐमीनों में ऐल्कोहॉलों की तुलना में H देने की प्रवृत्ति कम होती है।
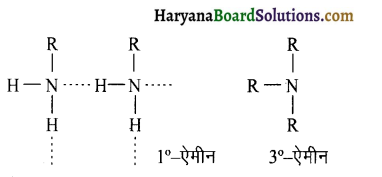
(ii) प्राथमिक ऐमीनों में नाइट्रोजन पर दो हाइड्रोजन परमाणु उपस्थित हैं जिनके कारण इनमें प्रबल अन्तराआण्विक हाइड्रोजन बन्ध होता है जिससे
आण्विक सगुणन (Molecular association) अधिक होता है जबकि तृतीयक ऐमीन में नाइट्रोजन पर हाइड्रोजन परमाणु नहीं होने के कारण हाइड्रोजन बन्ध नहीं बनता अतः प्राथमिक ऐमीनों का क्वथनांक तृतीयक ऐमीनों से अधिक होता है।
(iii) ऐलिफैटिक ऐमीन में ऐल्किल समूह के + I प्रभाव (इलेक्ट्रॉन प्रतिकर्षी प्रभाव) के कारण नाइट्रोजन पर इलेक्ट्रॉन घनत्व बढ़ जाता है अतः – NH2 समूह की इलेक्ट्रॉन युग्म देने की प्रवृत्ति बढ़ जाती है अतः ये अधिक क्षारीय होते हैं जबकि ऐरोमैटिक ऐमीन में – NH2 के नाइट्रोजन परमाणु का एकाकी इलेक्ट्रॉन युग्म बेन्जीन वलय के साथ अनुनाद करता है (+M प्रभाव) जिससे इस पर इलेक्ट्रॉन घनत्व कम हो जाता है तथा इसकी इलेक्ट्रॉन युग्म देने की प्रवृत्ति कम हो जाती है अतः ये कम क्षारीय होते हैं।
HBSE 12th Class Chemistry ऐमीन Intext Questions
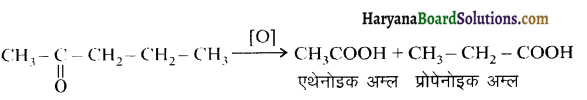
प्रश्न 12.1.
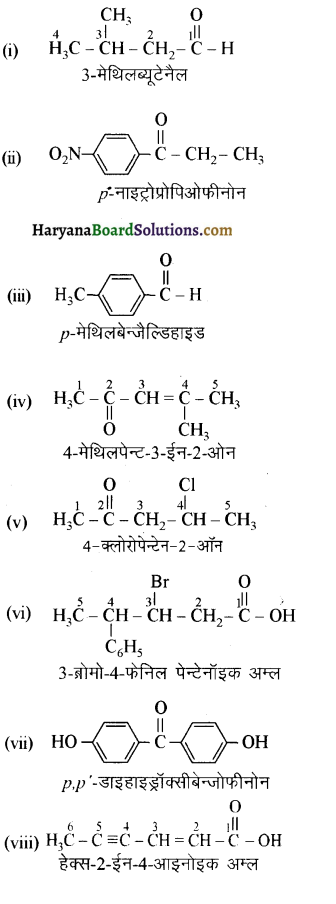
निम्न यौगिकों की संरचना लिखिए-
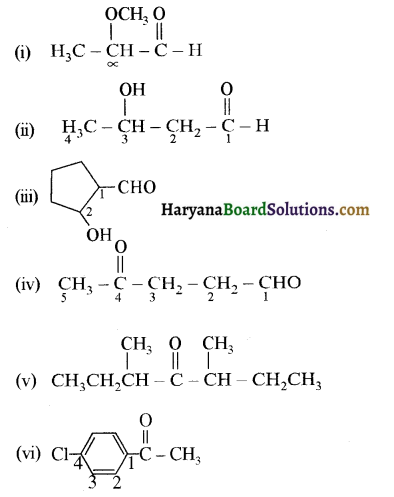
(i) α-मेथॉक्सीप्रोप्रिऑनऐल्डिहाइड
(ii) 3-हाइड्रॉक्सीब्यूटेनैल
(iii) 2-हाइड्रॉक्सीसाइक्लोपेन्टेन कार्बैल्डिहाइड
(iv) 4-ऑक्सोपेन्टेनैल
(v) डाइ-द्वितीयकब्यूटिल कीटोन
(vi) 4-क्लोरोऐसीटोफीनॉन
उत्तर:
उपरोक्त यौगिकों की संरचना निम्नलिखित है-
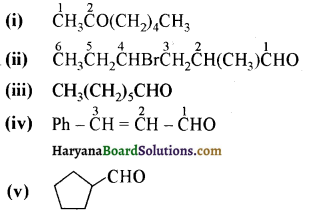
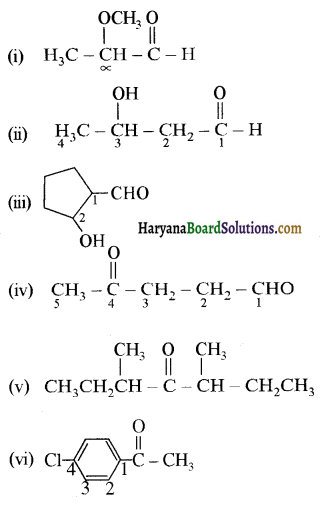
प्रश्न 12.2
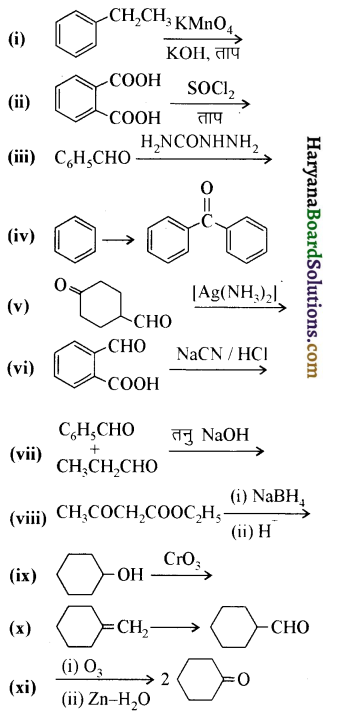
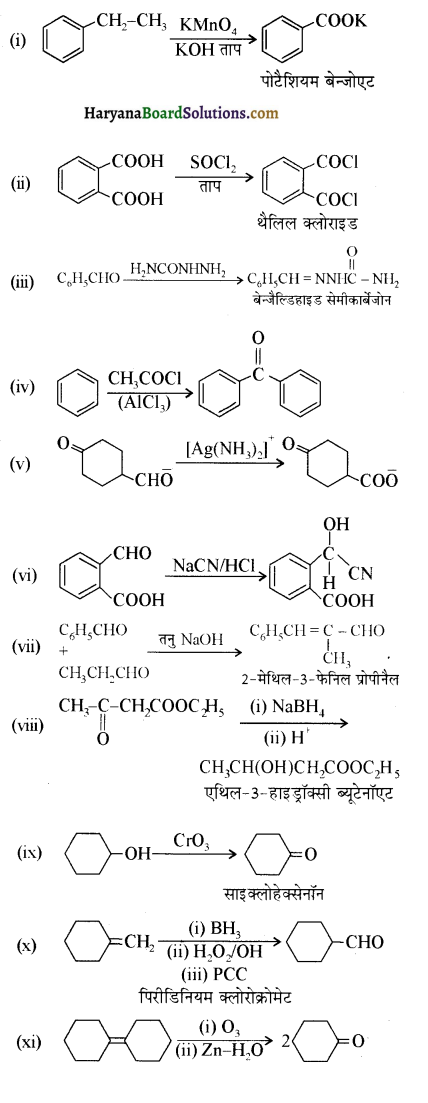
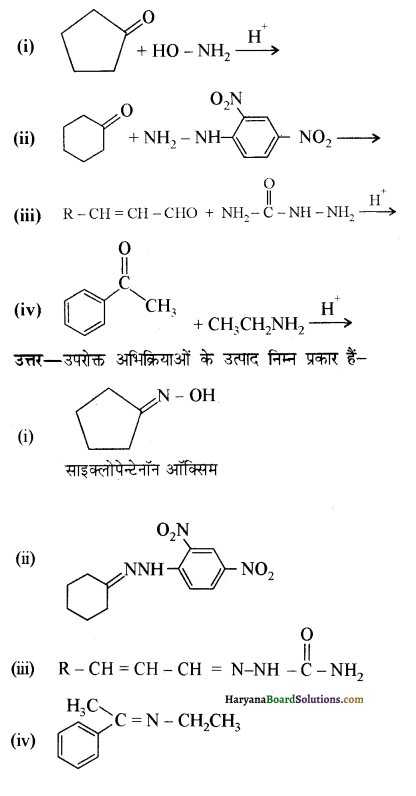
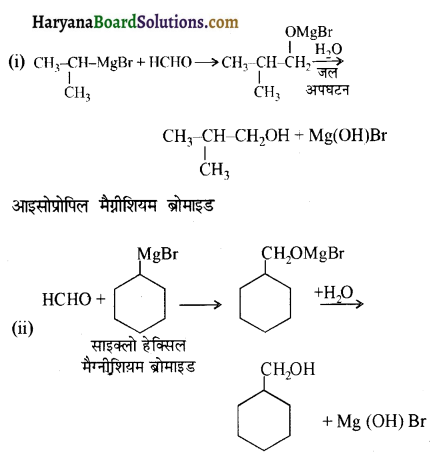
निम्न अभिक्रियाओं के उत्पादों की संरचना लिखिए-
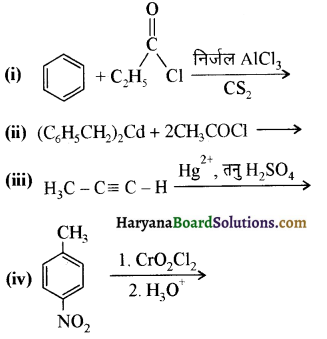
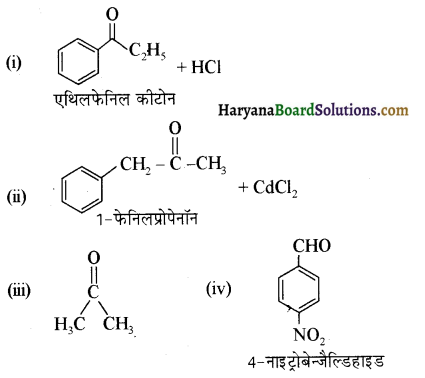
उत्तर:
उपरोक्त अभिक्रियाओं के उत्पादों की संरचना अग्र प्रकार है-
प्रश्न 12.3.
निम्नलिखित यौगिकों को उनके क्वथनांकों के बढ़ते क्रम में व्यवस्थित कीजिए-
CH3CHO, CH3CH2OH, CH3OCH3, CH3CH2CH3
उत्तर:
CH3-CH3-CH3 < CH3-O-CH3 < CH3-CHO< CH3-CH2-OH
क्वथनांकों का बढ़ता क्रम
प्रश्न 12.4.
निम्नलिखित यौगिकों को नाभिकरागी योगात्मक (Addition) अभिक्रियाओं में उनकी बढ़ती हुई अभिक्रियाशीलता के क्रम में व्यवस्थित कीजिए-
(क) एथेनैल, प्रोपेनैल, प्रोपेनोन, ब्यूटेनोन
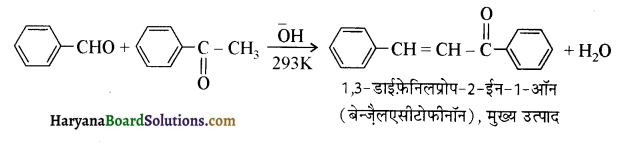
(ख) बेन्जैल्डिहाइ ड, p-टॉलू ऐल्डिहाइ ड, p-नाइट्रोबेन्जैल्डिहाइड, ऐसीटोफीनोन।
संकेत-त्रिविम प्रभाव व इलेक्ट्रॉनिक प्रभाव को ध्यान में रखें।
उत्तर:
उपर्युक्त यौगिकों की नाभिकरागी योगात्मक अभिक्रियाओं में बढ़ती हुई क्रियाशीलता का क्रम निम्न प्रकार है-
(क) ब्यूटेनोन < प्रोपेनोन < प्रोपेनैल < एथेनैल
(ख) ऐसीटोफ़ीनोन <p-टॉलूऐल्डिहाइड < बेन्जैल्डिहाइड <p-नाइट्रोबेन्जैल्डिहाइड।
![]()
प्रश्न 12.5.
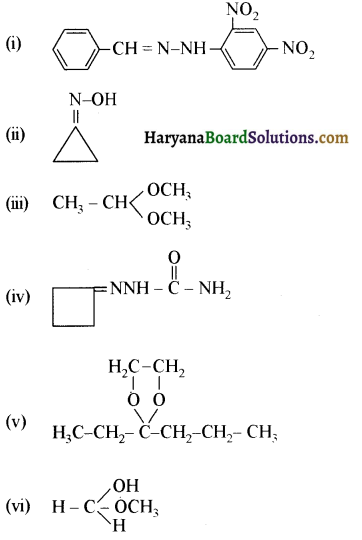
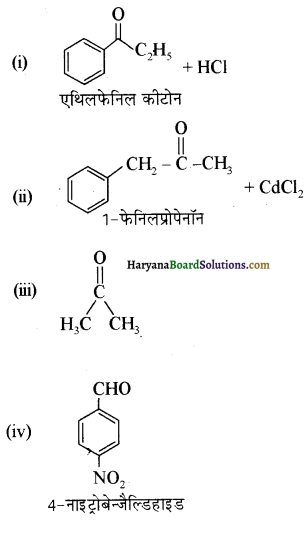
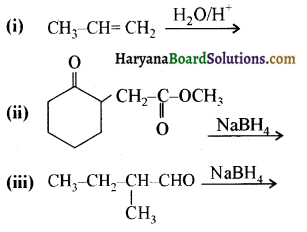
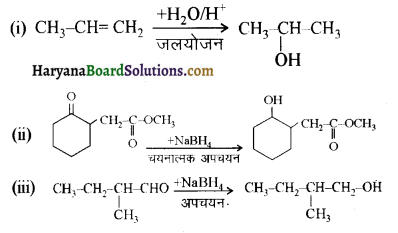
निम्नलिखित अभिक्रियाओं के उत्पादों को पहचानिए-
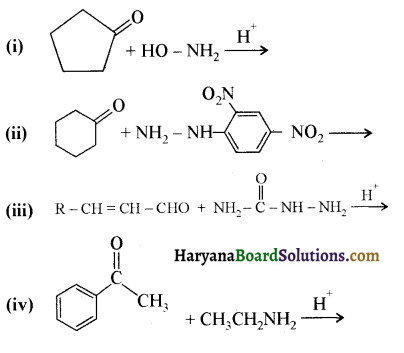
उत्तर:
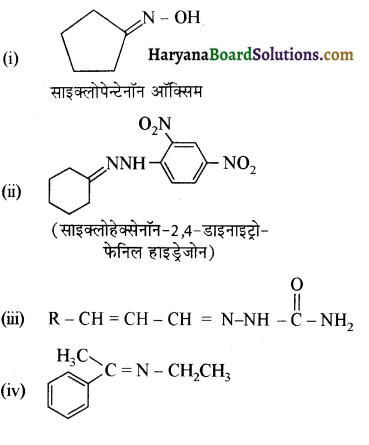
प्रश्न 12.6.
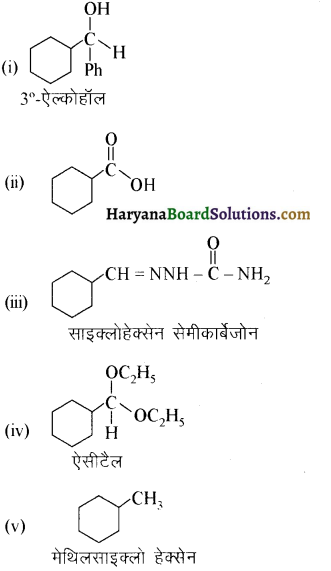
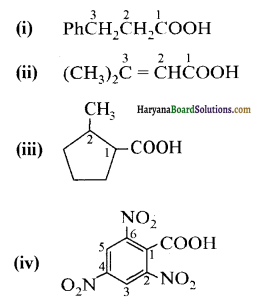
निम्नलिखित यौगिकों के आईयूपीएसी नाम दीजिए-
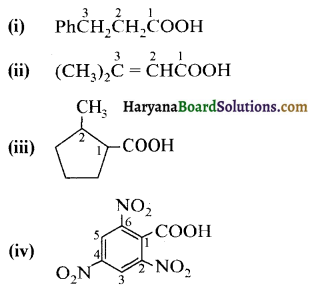
उत्तर:
उपरोक्त यौगिकों के आईयूपीएसी नाम निम्न प्रकार हैं-
(i) 3-फेनिलप्रोपेनॉइक अम्ल
(ii) 3-मेथिलब्यूट-2-इनोइक अम्ल
(iii) 2-मेथिलसाइक्लोपेन्टेनकार्बोक्सिलिक अम्ल
(iv) 2,4,6-ट्राईनाइट्रोबेन्जोइक अम्ल
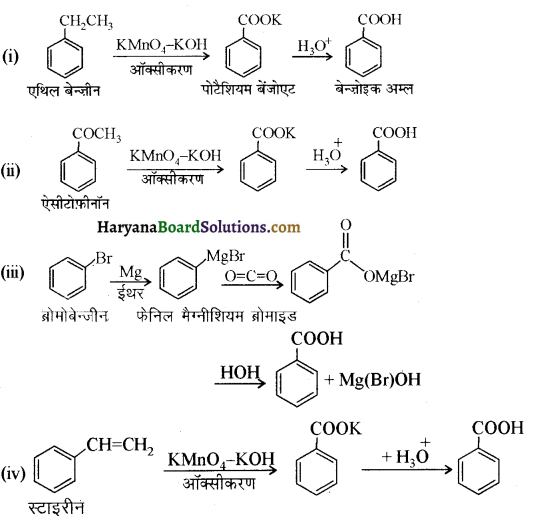
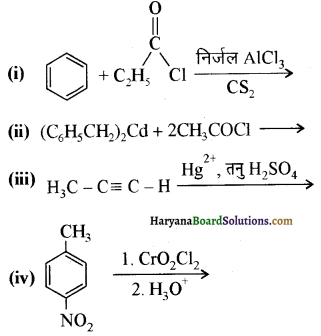
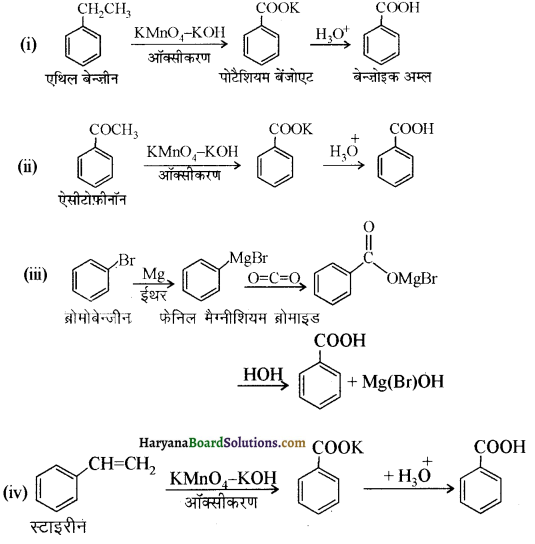
प्रश्न 12.7.
निम्नलिखित यौगिकों को बेन्जोइक अम्ल में कैसे परिवर्तित किया जा सकता है?
(i) एथिलबेन्जीन
(ii) ऐसीटोफीनोन
(iii) ब्रोमोबेन्जीन
(iv) फेनिलएथीन (स्टाइरीन)।
उत्तर:
उपर्युक्त यौगिकों को बेन्जोइक अम्ल में निम्न प्रकार परिवर्तित किया जा सकता है-
प्रश्न 12.8.
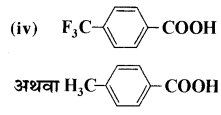
नीचे प्रदर्शित अम्लों के प्रत्येक युग्म में कौनसा अम्ल अधिक प्रबल है ?
(i) CH3CO2H अथवा CH2FCO2H
(ii) CH2FCO2H अथवा CH2ClCO2H
(iii) CH2FCH2CH2CO2H अथवा CH2CHFCH2CO2H
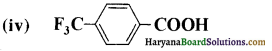
उत्तर:
उपर्युक्त युग्मों में से अधिक प्रबल अम्ल निम्नलिखित हैं-
(i) CH2FCOOH
(ii) CH2FCOOH
(iii) CH2CHFCH2COOH
HBSE 12th Class Chemistry Solutions Chapter 13 ऐमीन Read More »
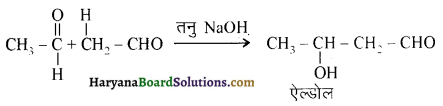
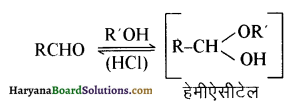
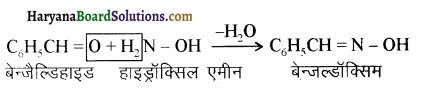
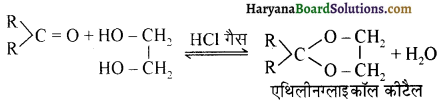
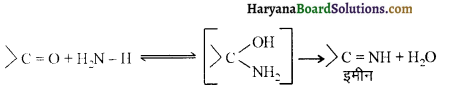
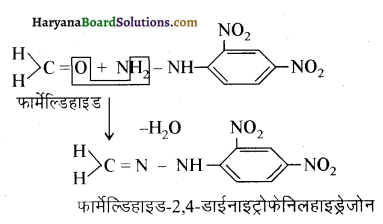
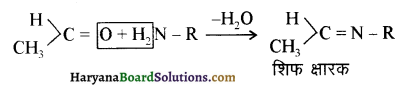
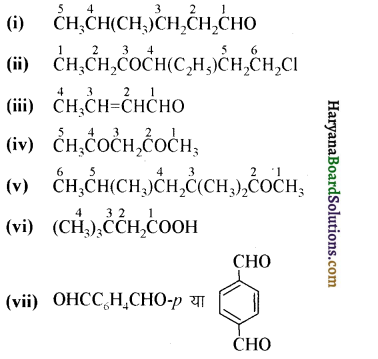
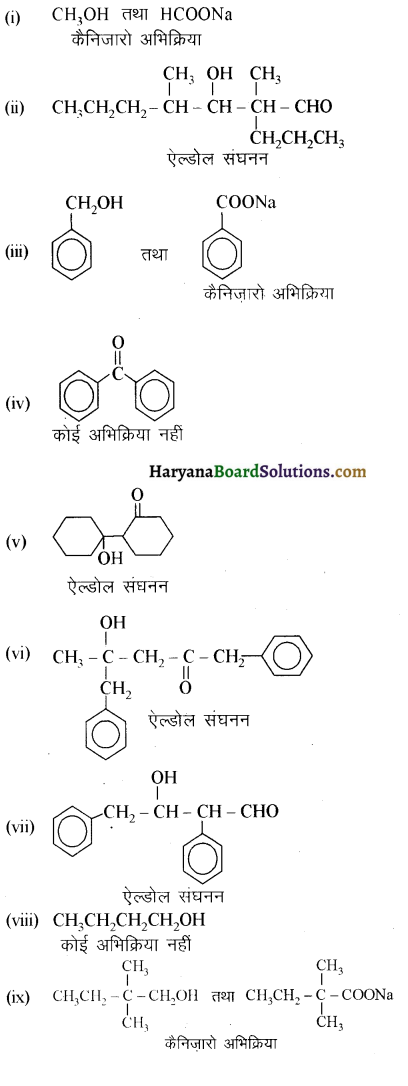
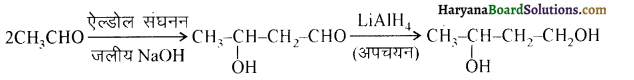
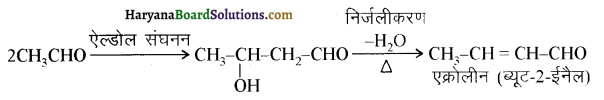
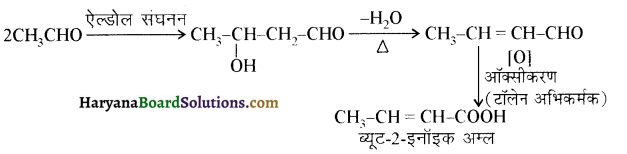
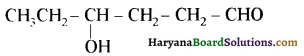
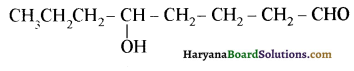
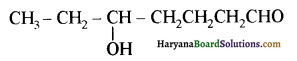
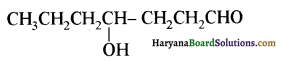
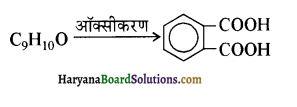

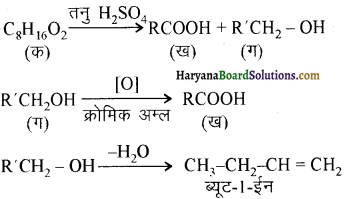
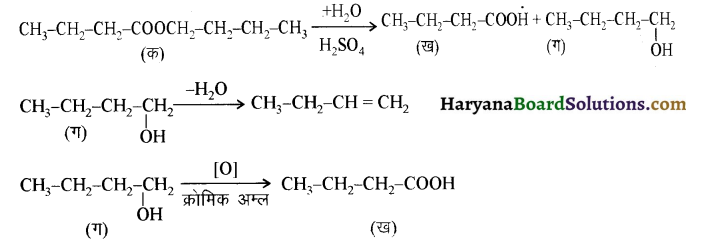
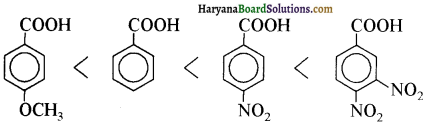
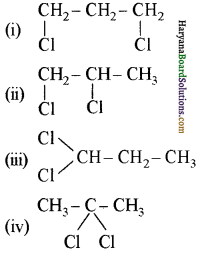
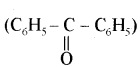 यह परीक्षण नहीं देता।
यह परीक्षण नहीं देता। एक मैथिल कीटोन है अतः यह आयोडोफॉर्म परीक्षण देता है जबकि पेन्टेन 3 ऑन
एक मैथिल कीटोन है अतः यह आयोडोफॉर्म परीक्षण देता है जबकि पेन्टेन 3 ऑन 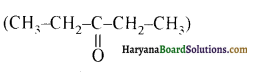 में यह परीक्षण नहीं होता।
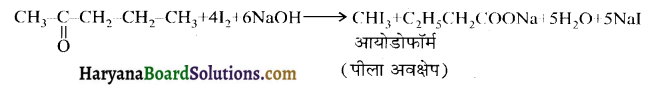
में यह परीक्षण नहीं होता। एक मैथिल कीटोन है अतः ऐसीटोफ़ीनॉन, आयोडोफॉर्म परीक्षण देता है जबकि बेन्जेल्डिहाइड यह परीक्षण नहीं देता है।
एक मैथिल कीटोन है अतः ऐसीटोफ़ीनॉन, आयोडोफॉर्म परीक्षण देता है जबकि बेन्जेल्डिहाइड यह परीक्षण नहीं देता है।
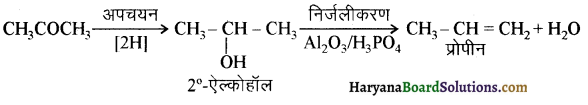
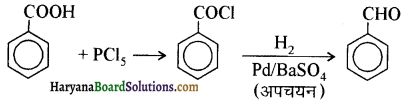

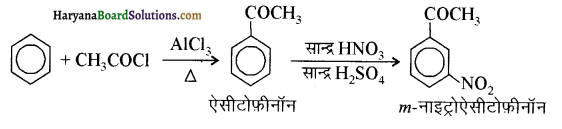
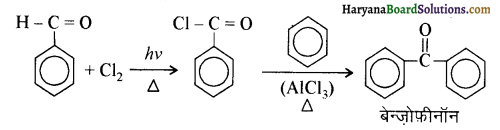
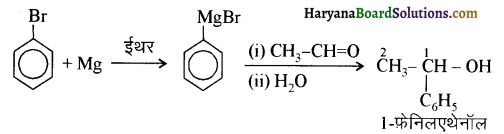

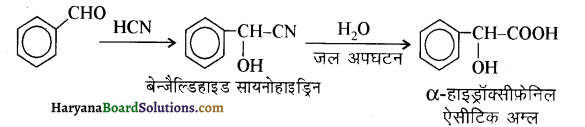
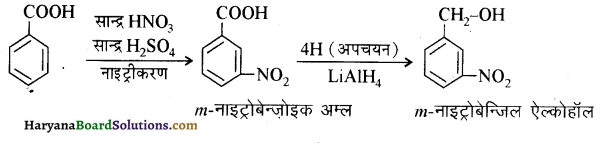

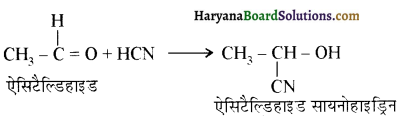
 आ जाता है। इसे ऐसीटिलन अभिक्रिया कहते हैं।
आ जाता है। इसे ऐसीटिलन अभिक्रिया कहते हैं।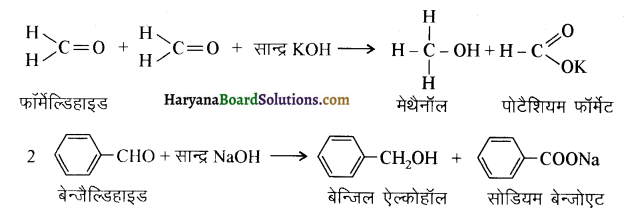
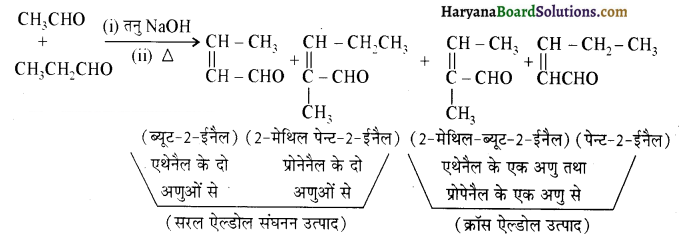

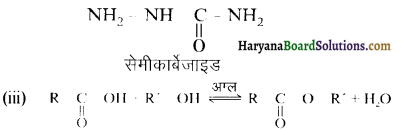
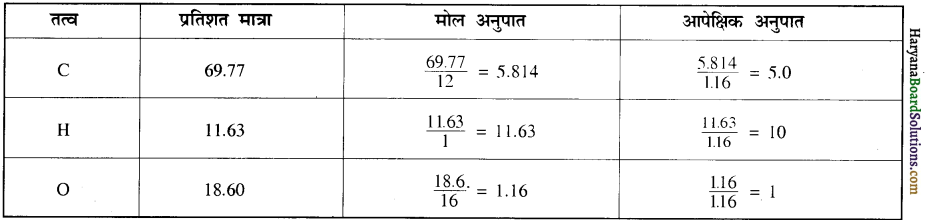
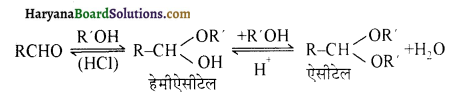
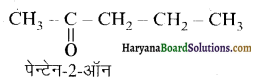 होगा ।
होगा ।
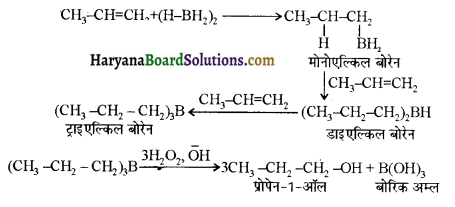
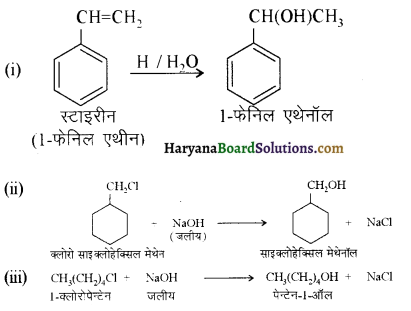
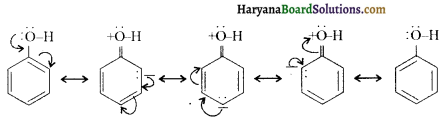
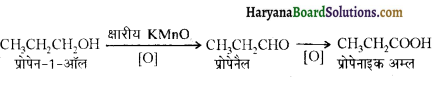
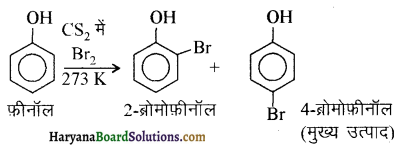
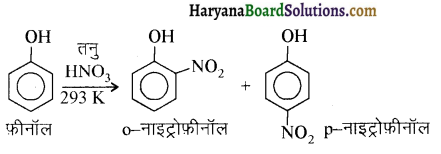
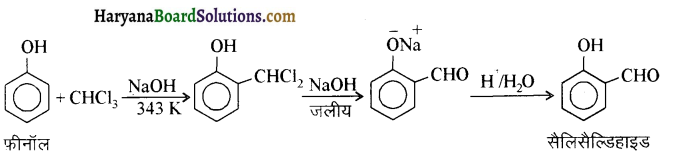
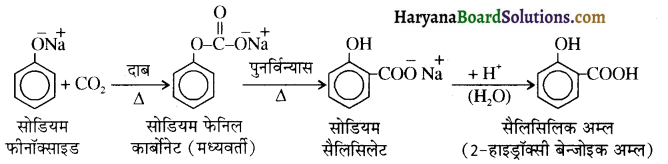
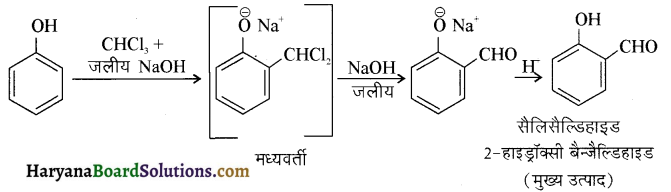
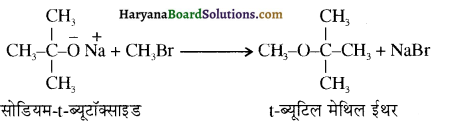
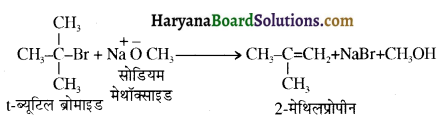

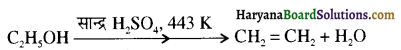
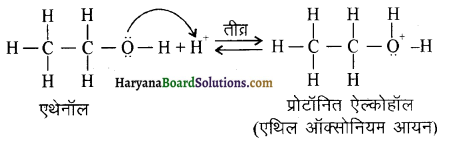
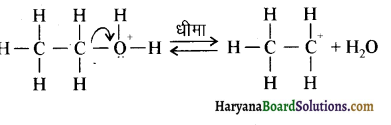
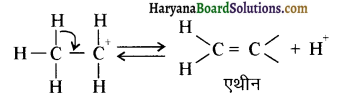
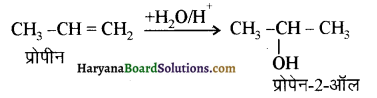

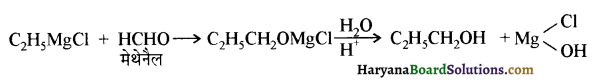
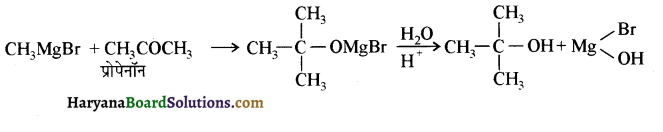
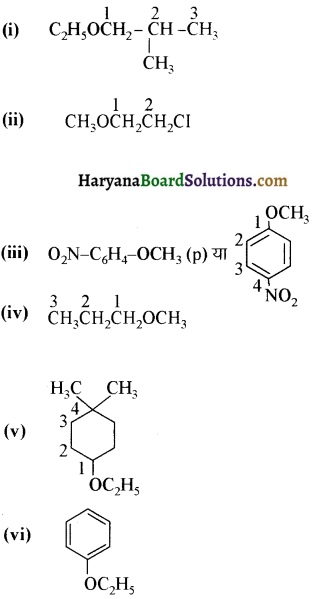
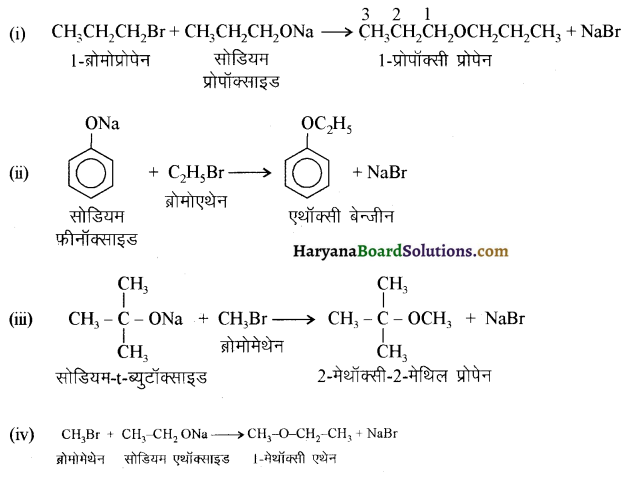
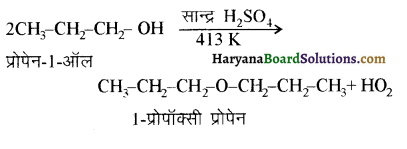
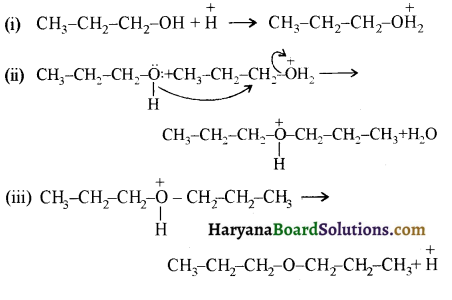
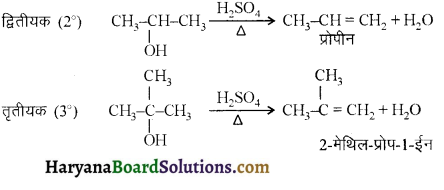
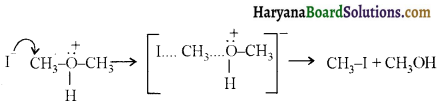
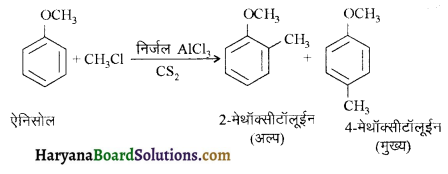
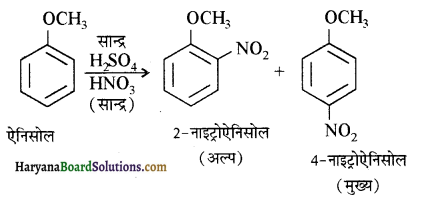
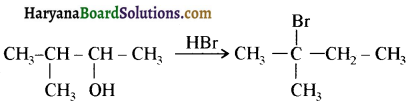
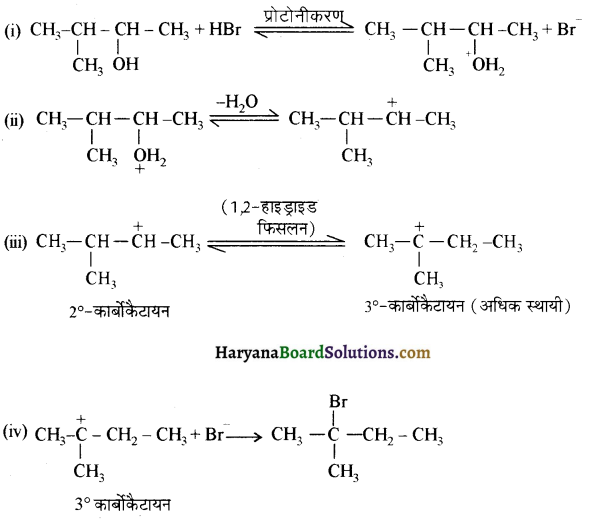
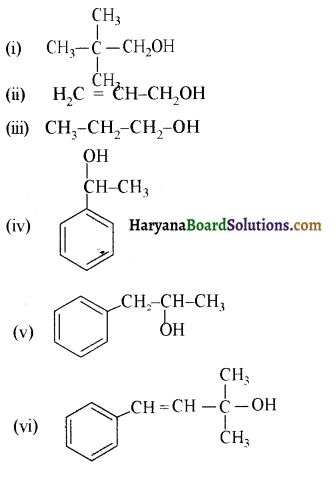
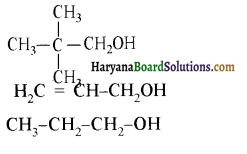
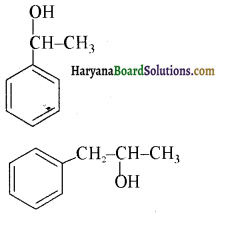
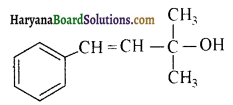
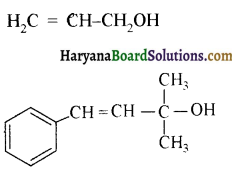
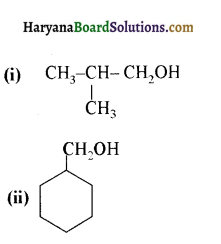
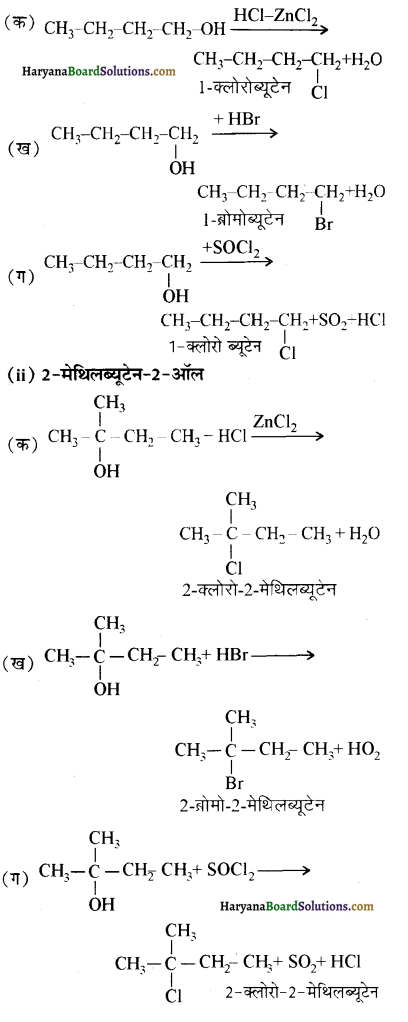
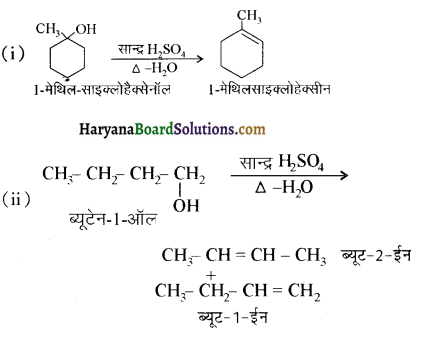
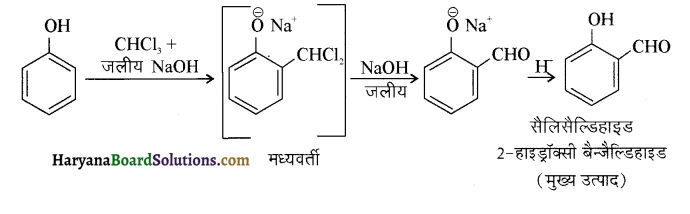
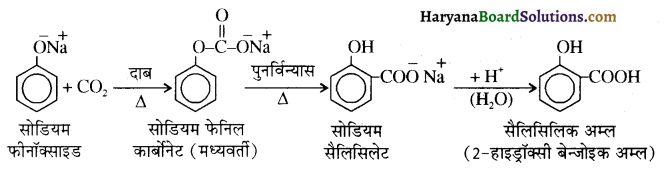
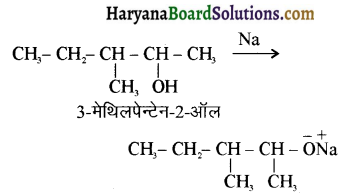
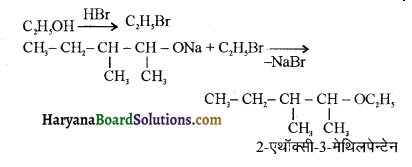
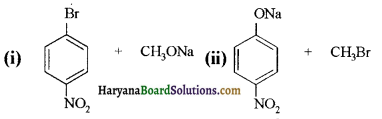
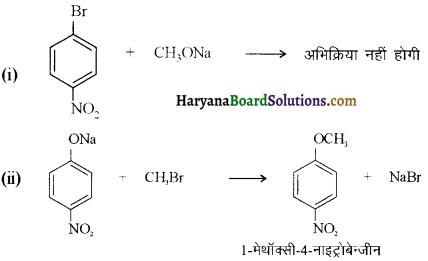
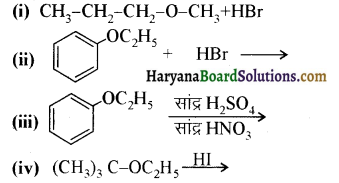
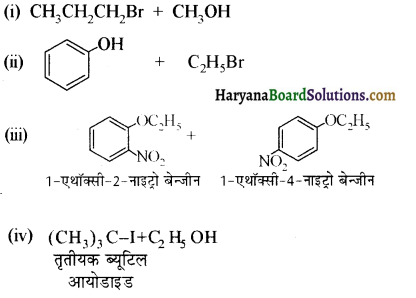

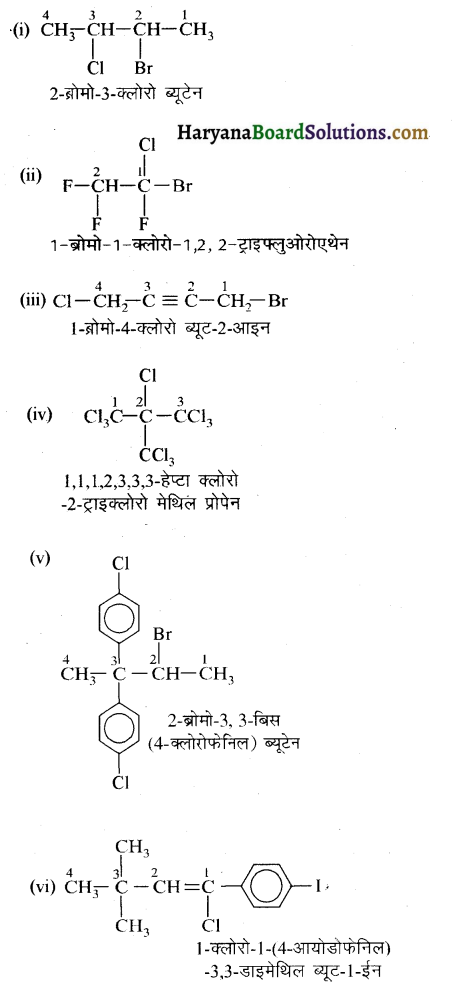
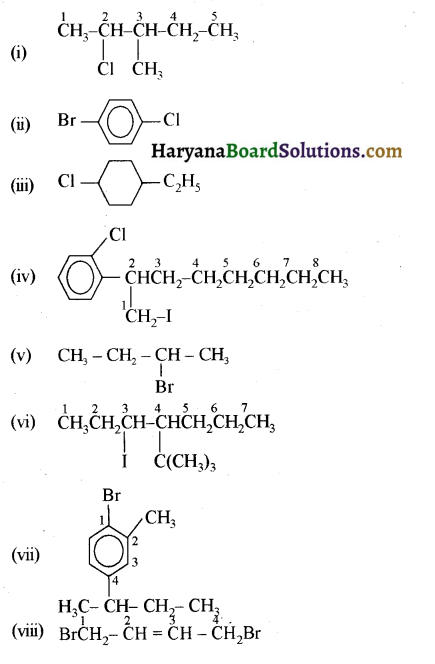
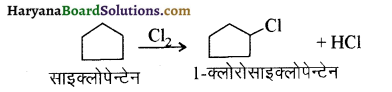
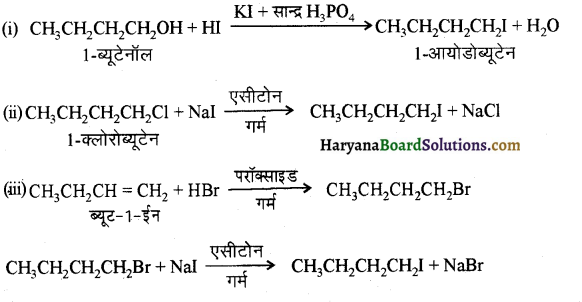
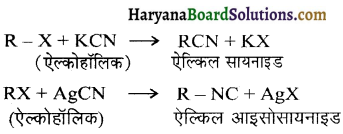
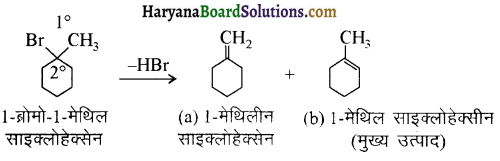
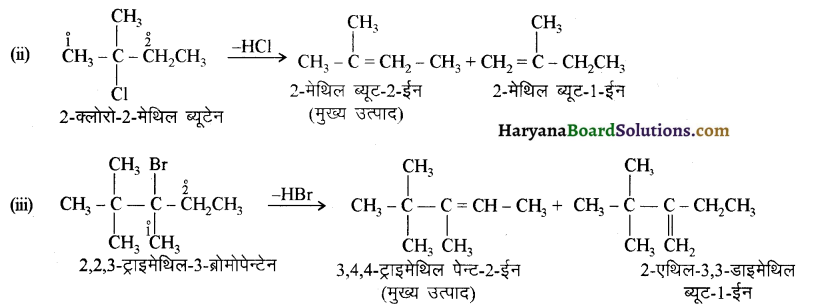
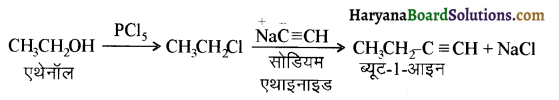
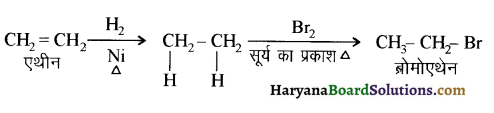

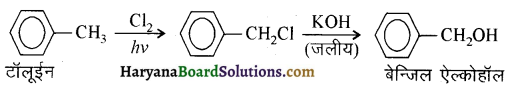
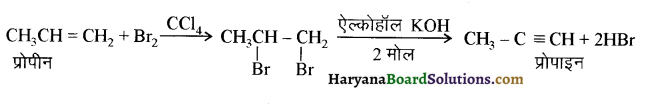
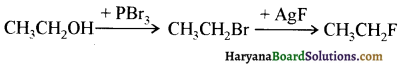
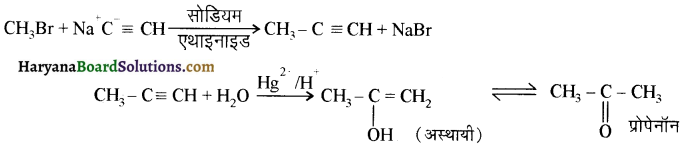
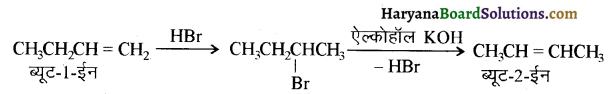
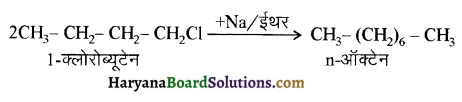
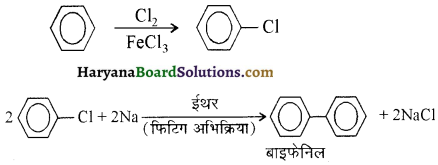
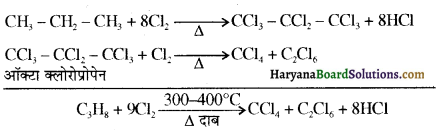
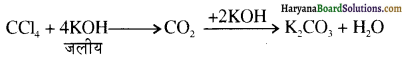
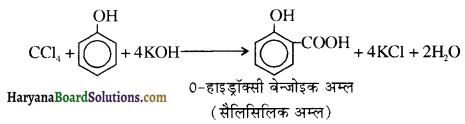
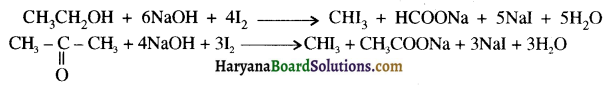
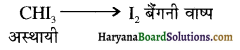


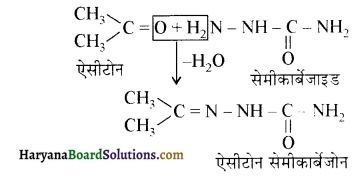
 में से
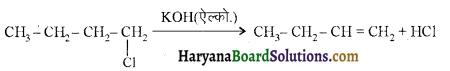
में से  का जलीय KOH से शीघ्रता से जल अपघटन होगा क्योंकि इसके जल अपघटन में बनने वाला मध्यवर्ती कार्बधनायन अधिक स्थायी होता है, क्योंकि इसमें दो बेन्जीन वलय के कारण अनुनाद अधिक होगा जबकि C6H5CH2Cl से बने कार्बधनायन में केवल एक बेन्जीनवलय ही अनुनाद में भाग लेती है।
का जलीय KOH से शीघ्रता से जल अपघटन होगा क्योंकि इसके जल अपघटन में बनने वाला मध्यवर्ती कार्बधनायन अधिक स्थायी होता है, क्योंकि इसमें दो बेन्जीन वलय के कारण अनुनाद अधिक होगा जबकि C6H5CH2Cl से बने कार्बधनायन में केवल एक बेन्जीनवलय ही अनुनाद में भाग लेती है।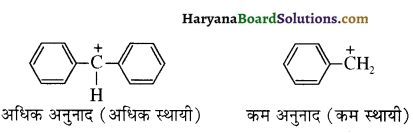
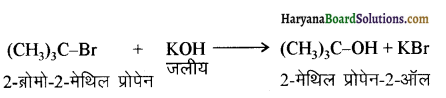
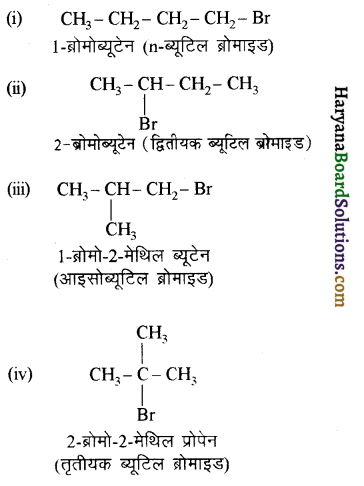
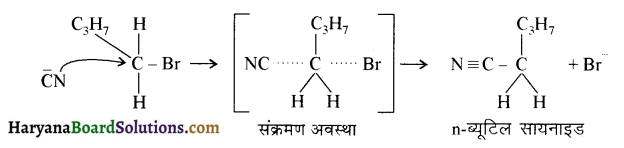
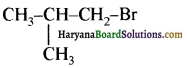 (आइसोब्यूटिल ब्रोमाइड)। प्रश्नानुसार, यौगिक ‘क’ n – ब्यूटिल ब्रोमाइड नहीं है अतः यह आइसोब्यूटिल ब्रोमाइड होगा।
(आइसोब्यूटिल ब्रोमाइड)। प्रश्नानुसार, यौगिक ‘क’ n – ब्यूटिल ब्रोमाइड नहीं है अतः यह आइसोब्यूटिल ब्रोमाइड होगा।