Haryana State Board HBSE 12th Class Chemistry Solutions Chapter 5 पृष्ठ रसायन Textbook Exercise Questions and Answers.
Haryana Board 12th Class Chemistry Solutions Chapter 5 पृष्ठ रसायन
प्रश्न 5.1.
अधिशोषण एवं अवशोषण शब्दों (पदों) के तात्पर्य में विभेद कीजिए । प्रत्येक का एक उदाहरण दीजिए ।
उत्तर:
अधिशोषण – किसी ठोस या द्रव द्वारा किसी पदार्थ के अणुओं को आकर्षित करके उन्हें पृष्ठ पर धारण करने को अधिशोषण कहते हैं।
अवशोषण – किसी पदार्थ का दूसरे पदार्थ में समान वितरण अवशोषण कहलाता है।
अधिशोषण में पदार्थ केवल पृष्ठ पर सांद्रित होता है जबकि अवशोषण में पदार्थ, दूसरे पदार्थ में समान रूप से वितरित हो जाता है। सिलिका जेल पर जल वाष्प का अधिशोषण होता है जबकि शुष्क CaCl2 पर जल वाष्प का अवशोषण होता है।
प्रश्न 5.2.
भौतिक अधिशोषण एवं रासायनिक अधिशोषण में क्या अंतर है?
उत्तर:
अधिशोषण के प्रकार:
ठोसों पर गैसों के अधिशोषण को अधिशोष्य तथा अधिशोषक के अणुओं के मध्य आकर्षण बलों के आधार पर दो भागों में वर्गीकृत किया गया है-
(a) भौतिक अधिशोषण
(b) रासायनिक अधिशोषण या रसोवशोषण
(a) भौतिक अधिशोषण – या वान्डरवाल अधिशोषण – किसी ठोस की सतह पर जब गैस का अधिशोषण वान्डरवाल बलों के कारण होता है तो इसे भौतिक अधिशोषण कहते हैं। दुर्बल वान्डरवाल बलों के कारण ताप बढ़ाने से या दाब कम करने से इसे आसानी से कम किया जा सकता है। भौतिक अधिशोषण में अधिशोष्य तथा अधिशोषक के मध्य किसी प्रकार के रासायनिक बन्ध का निर्माण नहीं होता ।
(b) रासायनिक अधिशोषण या लैंग्म्यूर अधिशोषण – जब किसी ठोस की सतह पर गैस के अधिशोषण में रासायनिक बन्ध बनते हैं तो इसे रासायनिक अधिशोषण कहते हैं। ये रासायनिक बन्ध आयनिक या सहसंयोजक हो सकते हैं, लेकिन प्रायः यह बन्ध सहसंयोजक होता है। रासायनिक अधिशोषण की सक्रियण ऊर्जा उच्च होती है अतः इसे सक्रियत अधिशोषण (activated adsorption) भी कहते हैं। भौतिक एवं रासायनिक अधिशोषण साथ-साथ भी हो सकते हैं। तब निम्न ताप पर होने वाला भौतिक अधिशोषण, ताप बढ़ाने पर रासायनिक अधिशोषण में परिवर्तित हो जाता है।
उदाहरण, H2 गैस पहले Ni की सतह पर वान्डरवाल बलों के द्वारा अधिशोषित होती है। उसके बाद हाइड्रोजन के अणु, परमाणुओं में वियोजित होकर रासायनिक अधिशोषण द्वारा निकल की सतह पर बंध जाते हैं, क्योंकि उच्च ताप पर अभिकारकों को सक्रियण ऊर्जा प्राप्त हो जाती है। रासायनिक अधिशोषण में अधिशोषक की सतह पर उत्पाद बनता है, अतः विशोषण के समय उत्पाद का ही विशोषण होता है। जैसे कार्बन की सतह पर O2 के अधिशोषण से CO तथा CO2 बनती है तथा इन्हीं CO तथा CO2 का विशोषण होता है।
![]()
प्रश्न 5.3.
कारण बताइए कि सूक्ष्म विभाजित पदार्थ अधिक प्रभावी अधिशोषक क्यों होता है?
उत्तर:
सूक्ष्म विभाजित पदार्थ का पृष्ठ क्षेत्रफल तथा सक्रिय केन्द्र अधिक होते हैं। अधिशोषक का पृष्ठीय क्षेत्रफल एवं सक्रिय केन्द्र बढ़ने पर अधिशोषण की मात्रा बढ़ती है अतः सूक्ष्म विभाजित पदार्थ अधिक प्रभावी अधिशोषक होता है।
प्रश्न 5.4.
किसी ठोस पर गैस के अधिशोषण को प्रभावित करने वाले कारक कौनसे हैं ?
उत्तर:
भौतिक अधिशोषण के अभिलक्षण – या भौतिक अधिशोषण को प्रभावित करने वाले कारक – भौतिक अधिशोषण के मुख्य लक्षण निम्नलिखित हैं-
(i) अधिशोष्य की प्रकृति किसी ठोस द्वारा अधिशोषित गैस की मात्रा गैस की प्रकृति पर निर्भर करती है। सामान्यतया, आसानी से द्रवित होने वाली गैसें, जैसे – SO2, CO2, HCl, NH2 ( उच्च क्रांतिक तापयुक्त) शीघ्रता से अधिशोषित हो जाती हैं, जबकि हल्की गैसें जो आसानी से द्रवित नहीं होतीं, जैसे- H2, N2, O2, का अधिशोषण मुश्किल से होता है क्योंकि वान्डरवाल बल क्रांतिक तापों के निकट अधिक प्रबल होते हैं। इसीलिए 1g सक्रियत चारकोल, मेथेन ( क्रांतिक ताप 190K) की अपेक्षा अधिक सल्फर डाइऑक्साइड (क्रांतिक ताप 630K) अधिशोषित करता है।
(ii) अधिशोषक की प्रकृति तथा उसका पृष्ठीय क्षेत्रफल – अधिशोषक का पृष्ठ क्षेत्रफल बढ़ने पर अधिशोषण की मात्रा बढ़ती है तथा रन्ध्रहीन एवं कठोर पदार्थों की तुलना में सरन्ध्र व महीन चूर्णित धातुओं पर अधिशोषण अधिक मात्रा में होता है क्योंकि इनका पृष्ठ क्षेत्रफल अधिक होता है जैसे H2 गैस Ni पर सतह पर आसानी से अधिशोषित हो जाती है। विभिन्न धातुओं की अधिशोषण क्षमता का क्रम निम्न प्रकार होता है-
कोलाइडी Pd > सामान्य Pd Pt Au > Ni
विशिष्ट क्षेत्रफल – किसी अधिशोषक के प्रति ग्राम पृष्ठ क्षेत्रफल को उसका विशिष्ट क्षेत्रफल कहते हैं ।
(iii) विशिष्टता की कमी- भौतिक अधिशोषण की प्रकृति विशिष्ट नहीं होती क्योंकि वान्डरवाल बल व्यापक होते हैं अतः किसी भी गैस का किसी भी अधिशोषक की सतह पर अधिशोषण हो सकता है।
(iv) अधिशोषण की एन्थेल्पी – भौतिक अधिशोषण में ऊष्मा उत्सर्जित होती है अर्थात् यह एक ऊष्माक्षेपी प्रक्रिया है लेकिन अधिशोष्य (गैस) तथा अधिशोषक (ठोस) के मध्य दुर्बल वान्डरवाल बल होने के कारण अधिशोषण एन्थैल्पी का मान कम (20-40 kJ mol-1 ) होता है। किसी धातु की सतह पर एक मोल गैस के अधिशोषण से परिवर्तन को अधिशोषण की एन्थैल्पी कहते हैं।
(v) उत्क्रमणीय प्रकृति ठोस की सतह पर गैस का अधिशोषण उत्क्रमणीय प्रकृति का होता है।
![]()
(vi) अधिशोषक सक्रियण-
(i) अधिशोषक को रासायनिक तथा यांत्रिक विधियों द्वारा खुरदरा बनाकर इसका सक्रियण किया जाता है, इससे इसका पृष्ठ क्षेत्रफल बढ़ जाता है अतः अधिशोषण बढ़ जाता है।
(ii) ठोसों को सूक्ष्म विभाजित करने पर उनकी मुक्त संयोजकता तथा पृष्ठ क्षेत्रफल बढ़ जाता है।
(iii) अधिशोषक की सतह पर पहले से उपस्थित गैसों को हटाने के लिए उसे निर्वात में अतितप्त भाप के साथ गर्म करते हैं इससे प्राप्त अधिशोषक की अधिशोषण क्षमता अधिक होती है जैसे चारकोल का सक्रियण।
(vii) ताप तथा दाब का प्रभाव – दाब बढ़ाने पर किसी गैस का अधिशोषण अधिक मात्रा में होता है क्योंकि इससे गैस का आयतन कम होता है । (ले- शातैलिए का नियम) तथा ताप कम करने पर अधिशोषण अधिक होता है क्योंकि अधिशोषण एक ऊष्माक्षेपी प्रक्रम है। अतः ताप बढ़ाकर तथा दाब कम करके अधिशोषित गैस को बाहर निकाला जा सकता है।
(viii) आण्विक परत की प्रकृति – भौतिक अधिशोषण में बहु आण्विक परत बनती है क्योंकि इसमें अधिशोषक तथा अधिशोष्य के मध्य वान्डरवाल बल होता है अतः थोड़े से अधिक दाब से ही अधिशोषित गैस की मात्रा बढ़ जाती है।
प्रश्न 5.5.
अधिशोषण समतापी वक्र क्या है? फ्रॉयन्डलिक अधिशोषण समतापी वक्र का वर्णन कीजिए।
उत्तर:
अधिशोषण समतापी वक्र – अधिशोषण की मात्रा दाब पर निर्भर करती है अतः निश्चित ताप पर अधिशोषित गैस की मात्रा का दाब के साथ सम्बन्ध अधिशोषण समतापी वक्र कहलाता है।
प्रतिग्राम अधिशोषक द्वारा अधिशोषित गैस की मात्रा तथा दाब के मध्य ग्राफ बनाने पर जो वक्र प्राप्त होते हैं, उन्हें वैज्ञानिक के नाम के आधार पर फ्रायन्डलिक समतापी वक्र कहते हैं।
फ्रायन्डलिक अधिशोषण समतापी वक्र – प्रयोगों के आधार पर यह पाया गया कि अधिशोषित गैस की मात्रा \(\left(\frac{x}{\mathrm{~m}}\right)\), दाब (p) बढ़ाने पर बढ़ती है। गणितीय रूप में-
\(\frac { x }{ m }\) = k.p1/n (n>1) ….(1)
यहाँ x अधिशोषक के m द्रव्यमान द्वारा p दाब पर अधिशोषित गैस का द्रव्यमान है। k तथा n स्थिरांक हैं जो अधिशोषक एवं गैस की प्रकृति पर निर्भर करते हैं।
समीकरण (1) का लघुगणक लेने पर
log \(\frac { x }{ m }\) = log k + \(\frac { 1 }{ n }\) log p …..(2)
यह समीकरण y = mx + c ( सरल रेखा का समीकरण) के समतुल्य है अतः log\(\frac { x }{ m }\) तथा log P के मध्य ग्राफ एक सरल रेखा होती है जिसका ढाल = \(\frac { 1 }{ n }\) तथा अन्तःखण्ड log k (y अक्ष पर ) के बराबर होगा। इससे समतापी वक्रों की वैधता की पुष्टि हो जाती है लेकिन समीकरण (2) दाब के निश्चित परिसर तक ही लागू होता है।
प्रश्न 5.6.
अधिशोषक के सक्रियण से आप क्या समझते हैं? यह कैसे प्राप्त किया जाता है?
उत्तर:
अधिशोषक के सक्रियण का अर्थ है उसकी अधिशोषण क्षमता बढ़ाना। इसे निम्न प्रकार प्राप्त किया जाता है-
(i) रासायनिक या यांत्रिक विधि से अधिशोषक की सतह को खुरदरा बनाना ।
(ii) अधिशोषण को चूर्णित ( Powdered ) या सूक्ष्म विभाजित अवस्था में परिवर्तित करना ।
(iii) ठोस पर पहले से अधिशोषित गैसों को हटाना ।
प्रश्न 5.7.
विषमांगी उत्प्रेरण में अधिशोषण की क्या भूमिका है?
उत्तर:
विषमांगी उत्प्रेरण में गैसीय अवस्था या विलयन में अभिकारक, ठोस उत्प्रेरक की सतह पर अधिशोषित हो जाते हैं । पृष्ठ पर अभिकारकों की सांद्रता में वृद्धि होने से अभिक्रिया की दर बढ़ जाती है तथा उत्पाद बनकर, उत्प्रेरक की सतह से पृथक् हो जाते हैं एवं उत्प्रेरक की सतह पुनः अभिक्रिया के लिए उपलब्ध हो जाती है।
प्रश्न 5.8.
अधिशोषण हमेशा ऊष्माक्षेपी क्यों होता है?
उत्तर:
भौतिक अधिशोषण हमेशा ऊष्माक्षेपी होता है क्योंकि गैसीय अणुओं एवं ठोस सतह के मध्य आकर्षण ( वान्डरवाल बल) होता है। यह आकर्षण बल दुर्बल होता है अतः अधिशोषण की एन्थैल्पी कम (20-40 kJ mol-1 ) होती है।
![]()
प्रश्न 5.9.
कोलॉइडी विलयनों को परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्थाओं के आधार पर कैसे वर्गीकृत किया जाता है ?
उत्तर:
परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्था के आधार पर आठ प्रकार के कोलाइडी तंत्र हो सकते हैं, क्योंकि परिक्षिप्त प्रावस्था तथा परिक्षेपण माध्यम ठोस, द्रव अथवा गैस होते हैं। लेकिन किसी गैस का किसी अन्य गैस में मिश्रण हमेशा समांगी होता है अतः वह कोलॉइड नहीं होता । विभिन्न प्रकार के कोलॉइडों के उदाहरण तथा उनके विशिष्ट नामों के लिए भाग 5.4 में सारणी (कोलॉइडी तंत्रों के प्रकार) देखें ।
प्रश्न 5.10.
ठोसों द्वारा गैसों के अधिशोषण पर दाब एवं ताप के प्रभाव की विवेचना कीजिए ।
उत्तर:
ठोसों द्वारा गैसों के अधिशोषण पर दाब का प्रभाव- दाब बढ़ाने पर ठोस की सतह पर गैसों का अधिशोषण अधिक मात्रा में होता है। क्योंकि दाब बढ़ाने पर गैस का आयतन कम होता है। (ला शातैलिए का नियम )
ताप का प्रभाव – अधिशोषण, ऊष्माक्षेपी प्रक्रम है अतः निम्न ताप पर अधिशोषण अधिक मात्रा में होता है तथा ताप बढ़ाने पर गैस का ठोस की सतह पर अधिशोषण कम होगा।
प्रश्न 5.11.
द्रवरागी एवं द्रवविरागी सॉल क्या होते हैं? प्रत्येक का एक-एक उदाहरण दीजिए। द्रवविरोधी सॉल आसानी से स्कंदित क्यों हो जाते हैं?
उत्तर:
परिक्षिप्त प्रावस्था तथा परिक्षेपण माध्यम के मध्य अन्योन्य क्रिया के आधार पर कोलॉइडी सॉल को दो वर्गों में विभाजित किया जाता है- द्रवरागी (द्रवस्नेही) अर्थात् विलायक को आकर्षित करने वाले तथा द्रवविरागी (द्रवविरोधी) अर्थात् विलायक को प्रतिकर्षित करने वाले । परिक्षेपण माध्यम जल होने पर जलस्नेही तथा जलविरोधी शब्द प्रयुक्त किया जाता है। गोंद द्रव कोलॉइड है जबकि धातुएँ एवं उनके सल्फाइडों के सॉल द्रवविरागी कोलॉइड के उदाहरण हैं। द्रवविरोधी सॉल आसानी से स्कंदित हो जाते हैं क्योंकि ये अस्थायी होते हैं एवं इनमें परिक्षिप्त प्रावस्था तथा परिक्षेपण माध्यम एक-दूसरे को प्रतिकर्षित करते हैं।
प्रश्न 5.12.
बहुञ्यणुक एवं वृहदाणुक कोलॉइड में क्या अंतर है ? प्रत्येक का एक-एक उदाहरण दीजिए । सहचारी कोलॉइड इन दोनों प्रकार के कोलॉइडों से कैसे भिन्न हैं?
उत्तर:
परिक्षिप्त प्रावस्था के कणों के प्रकार के आधार पर कोलॉइड तीन प्रकार के होते हैं-
(i) बहुआण्विक कोलॉइड
(ii) वृहदाण्विक कोलॉइड तथा
(iii) सहचारी कोलॉइड (मिसेल)।
(i) बहुआण्विक कोलॉइड – किसी पदार्थ के घोलने पर उसके बहुत सारे परमाणु या अणु एकत्रित होकर ऐसी स्पीशीज बनाते हैं जिनका आकार कोलॉइडी सीमा (व्यास < 1nm ) में होता है, तो इन्हें बहुआण्विक कोलॉइड कहते हैं। उदाहरण, एक गोल्ड सॉल में अनेक परमाणु युक्त भिन्न-भिन्न आकारों के कण होते हैं। सल्फर सॉल में एक हजार या उससे अधिक S8 (सल्फर अणु) के कण उपस्थित होते हैं। इनमें कोलॉइडी कण वान्डरवाल बल से जुड़े होते हैं।
(ii) वृहदाण्विक कोलॉइड – वृहदाणु उपयुक्त विलायकों में ऐसे विलयन बनाते हैं जिनमें वृहदाणुओं का आकार कोलॉइडी कणों के समान होता है तो ऐसे निकाय को वृहदाण्विक कोलॉइड कहते हैं। ये कोलॉइड बहुत स्थायी होते हैं तथा कभी-कभी ये वास्तविक विलयनों के समान होते हैं। प्राकृतिक वृहदाण्विक कोलाइडों के उदाहरण हैं- स्टार्च, सेलुलोज प्रोटीन तथा एन्जाइम एवं मानव निर्मित उदाहरण हैं- पॉलीथीन, नायलोन, पॉलीस्टायरीन, संश्लेषित रबर आदि ।
(iii) सहचारी कोलॉइड (मिसेल) – कुछ पदार्थ ऐसे होते हैं जो कम सांद्रता पर प्रबल वैद्युत अपघट्य के समान व्यवहार करते हैं परन्तु उच्च सांद्रता पर कणों का समूह बनने के कारण कोलॉइड की भाँति व्यवहार करते हैं, इन्हें सहचारी कोलॉइड या मिसेल कहते हैं। तनु करने पर ये कोलॉइड पुनः आयनों में टूट जाते हैं। उदाहरण – साबुन तथा अपमार्जक (पृष्ठ सक्रिय पदार्थ ) । मिसेल का निर्माण एक निश्चित ताप से अधिक ताप पर ही होता है जिसे क्राफ्ट ताप कहते हैं तथा जिस सान्द्रता के ऊपर मिसेल बनता है उसे क्रान्तिक मिसेल सान्द्रता कहते हैं। मिसेल में 100 या अधिक अणु हो सकते हैं।
प्रश्न 5.13.
एन्जाइम क्या होते हैं? एन्जाइम उत्प्रेरण की क्रियाविधि को संक्षेप में लिखिए।
उत्तर:
एन्जाइम सजीव उत्प्रेरक (Biocatalyst) होते हैं जो जटिल नाइट्रोजनी कार्बनिक यौगिक हैं तथा ये जीवित पौधों एवं जन्तुओं द्वारा उत्पन्न किए जाते हैं। इन्हें जैव-रासायनिक उत्प्रेरक (Bio chemical catalyst) भी कहते हैं तथा उत्प्रेरण की इस क्रिया को जैव-रासायनिक उत्प्रेरण कहते हैं।
एन्जाइम – एन्जाइम नाइट्रोजनयुक्त जटिल कार्बनिक यौगिक होते हैं जो पौधों तथा जन्तुओं द्वारा प्राप्त होते हैं। एन्जाइम उच्च अणुभार वाले प्रोटीन होते हैं जो कोलॉइडी अवस्था में होते हैं। जन्तुओं एवं पौधों में जीवन को व्यवस्थित रखने हेतु आवश्यक शारीरिक क्रियाएँ एन्जाइमों द्वारा ही उत्प्रेरित होती हैं, अतः एन्जाइमों को जैव-रासायनिक उत्प्रेरक भी कहते हैं। एन्जाइम बहुत प्रभावी उत्प्रेरक होते हैं, जो अनेक प्राकृतिक प्रक्रियाओं से सम्बन्धित अभिक्रियाओं का उत्प्रेरण करते हैं। सर्वप्रथम प्रयोगशाला में 1969 में एन्जाइम का संश्लेषण किया गया था।
एन्जाइम उत्प्रेरण – एन्जाइमों द्वारा विभिन्न अभिक्रियाओं को उत्प्रेरित करने की प्रक्रिया को एन्जाइम उत्प्रेरण या जैव-रासायनिक उत्प्रेरण कहते हैं। ये विषमांगी उत्प्रेरण के उदाहरण हैं।
एन्जाइम उत्प्रेरित अभिक्रियाओं के उदाहरण-
(i) स्टार्च का माल्टोस में परिवर्तन – डायस्टेज एन्जाइम स्टार्च को माल्टोस में परिवर्तित कर देता है।

प्रश्न 5.14.
कोलॉइडों को निम्न आधार पर कैसे वर्गीकृत किया गया है ?
(क) घटकों की भौतिक अवस्था
(ख) परिक्षेपण माध्यम की प्रकृति
(ग) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्य क्रिया ।
उत्तर:
कोलॉइडों का वर्गीकरण
(क) घटकों की भौतिक अवस्था के आधार पर – घटकों की भौतिक अवस्था के आधार पर कोलॉइडों को आठ प्रकारों में वर्गीकृत किया गया है । इसके विस्तृत विवेचन के लिए भाग 5.4 में सारणी देखें ।
(ख) परिक्षेपण माध्यम की प्रकृति के आधार पर – परिक्षेपण माध्यम की प्रकृति के आधार पर कोलॉइड निम्न प्रकार के होते हैं – (1) सॉल (द्रवों में ठेस) (2) जेल (ठोसों में द्रव) (3) इमल्शन (द्रव में द्रव ) । विभिन्न प्रकार के द्रवों के आधार पर सॉलों का विशिष्ट नाम दिया जाता है-
(i) एक्वासॉल या हाइड्रोसॉल (परिक्षेपण माध्यम – जल)
(ii) ऐल्कोसॉल (परिक्षेपण माध्यम – ऐल्कोहॉल)
(iii) बेन्जोसॉल) परिक्षेपण माध्यम – बेन्जीन ) ।
(ग) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्य क्रिया के आधार पर – कोलॉइडी सॉल दो प्रकार के होते हैं- (1) द्रवरागी या द्रवस्नेह विलायक को आकर्षित करने वाले, (2) द्रवविरागी या द्रवविरोधी विलयक को प्रतिकर्षित करने वाले ।
प्रश्न 5.15.
निम्नलिखित परिस्थितियों में क्या प्रेक्षण होंगे?
(i) जब प्रकाश किरण पु. कोलॉइडी सॉल में से गमन करता है ।
(ii) जलयोजित फेरिक ऑक्साइड सॉल में NaCl वैद्युत अपघट्य मिलाया जाता है।
(iii) कोलॉइडी सॉल में से विद्युतधारा प्रवाहित की जाती है।
उत्तर:
(i) जब प्रकाश किरण पुंज, कोलॉ: डी सॉल में से गमन करता है तथा उसे प्रकाश के पथ की दिशा के लम्बवत् देखने पर वह मंद से प्रबल दूधियापन दर्शाता है, अर्थात् प्रकाश किरण पुंज का पागमन पथ नीले प्रकाश से प्रदीप्त हो जाता है, इसे टिन्डल प्रभाव कहते हैं । यह कोलॉइडी कणों द्वारा प्रकाश के प्रकीर्णन के कारण होता है।
(ii) जलयोजित फेरिक ऑक्साइड Fe (OH), सॉल में NaCl वैद्युत अपघट्य मिलाया जाता है तो इस सॉल पर स्थित धनावेश, Cl के ऋणावेश द्वारा उदासीन हो जाता है जिससे कोलॉइडी कण पास-पास आकर अवक्षेपित हो जाते हैं।
(iii) कोलॉइडी सॉल में विद्युत धारा प्रवाहित करने पर कोलॉइडी कण विपरीत आवेशित इलेक्ट्रोड की ओर गमन कसं हैं एवं इलेक्ट्रॉड पर आवेश विसर्जित करके अवक्षेपित हो जाते हैं।
प्रश्न 5.16.
इमल्शन क्या है? इनके विभिन्न प्रकार क्या हैं? प्रत्येक प्रकार का उदाहरण दी जाए।
उत्तर:
इमल्शन (पस) – इमल्शन वे कोलॉइड हैं जिनमें सूक्ष्म विभाजित द्रव की बूँदों का दूसरे द्रव में परिक्षेपण होता है, अर्थात् परिक्षेपण माध्यम तथा परिक्षिप्त प्रावस्था दोनों ही द्रव होते हैं।
जब दो अमिश्रणीय या आंशिक मिश्रणीय द्रवों को मिलाकर तेजी से हिलाया जाता है, तो एक द्रव में दूसरे द्रव का परिक्षेपण प्राप्त होता है जिसे इमल्शन कहते हैं। सामान्यतया दो द्रवों में से एक जल होता है। इमल्शन दो प्रकार के होते हैं-
(i) तेल का जल में परिक्षेपण (o/w प्रकार) (जलीय इमल्शन) एवं
(ii) जल का तेल में परिक्षेपण (w/o प्रकार) (तेलीय इमल्शन)
प्रथम प्रकार में जल परिक्षेपण माध्यम का कार्य करता है। उदाहरण-
दूध एवं वेनीशिंग क्रीम दूध में, द्रव वसा जल में परिक्षिप्त होती है। दूसरे प्रकार में, तेल परिक्षेपण माध्यम का कार्य करता है। उदाहरण- मक्खन एवं क्रीम ।
प्रश्न 5.17.
पायसीकारक पायस को स्थायित्व कैसे देते हैं? दो पायसीकारकों के नाम लिखिए।
उत्तर:
पायस अस्थायी होते हैं और पड़े रखने पर दो परतों में विभक्त हो जाते हैं अतः इनके स्थायित्व के लिए इनमें एक पदार्थ मिलाया जाता है, जिसे पायसीकारक कहते हैं । पायसीकारक माध्यम एवं निलंबित कणों के मध्य एक फिल्म बनाता है जिससे वे एक-दूसरे के साथ मिलकर द्रव की सतह के रूप में पृथक् न हो सकें। प्रोटीन तथा वसीय अम्लों के भारी धातुओं के लवण पायसीकारकों के उदाहरण हैं।
प्रश्न 5.18.
“साबुन की क्रिया पायसीकरण एवं मिसेल बनने के कारण होती है ।” इस पर टिप्पणी कीजिए ।
उत्तर:
मिसेल निर्माण की क्रियाविधि – मिसेल बनने की क्रियाविधि को साबुन के उदाहरण से समझा जा सकता है। पानी में विलेय साबुन उच्च वसा अम्लों के सोडियम या पोटैशियम लवण होते हैं। उदाहरण सोडियम स्टिऐरेट (C17H35COONa) जिसे सामान्य सूत्र RCOONa से व्यक्त करते हैं। साबुन को जल में घोलने पर यह RCOO– तथा Na+ आयन बनाता है।
RCOO– आयन दो भागों से मिलकर बना है, एक लम्बी हाइड्रोकार्बन श्रृंखला (R) जो कि अध्रुवीय पूँछ या पुच्छ (Tail) कहलाती है तथा COO– को ध्रुवीय आयनिक शीर्ष या सिर (Head) कहते हैं। पूँछ वाला भाग जल प्रतिकर्षी होता है जबकि सिर वाला भाग आयनिक होने के कारण जल – आकर्षी या जलस्नेही होता है।
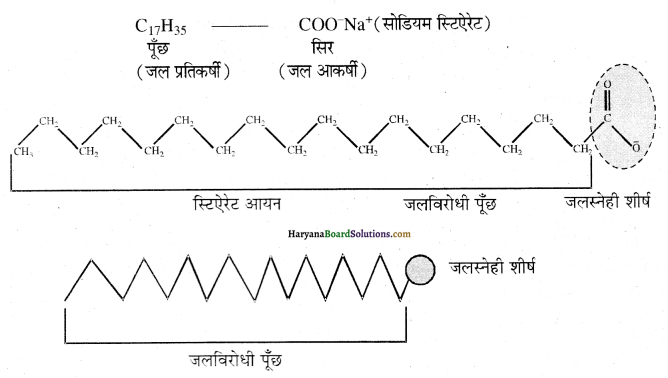
प्रश्न 5.19.
विषमांगी उत्प्रेरण के चार उदाहरण दीजिए ।
उत्तर:
विषमांगी उत्प्रेरण – किसी अभिक्रिया में जब अभिकारक एवं उत्प्रेरक भिन्न-भिन्न भौतिक अवस्था में होते हैं तो इसे विषमांगी उत्प्रेरण कहते हैं।
(i) प्लैटिनम की उपस्थिति में सल्फर डाइऑक्साइड का सल्फर ट्राइऑक्साइड में ऑक्सीकरण-
![]()
यहाँ अभिकारक गैसीय प्रावस्था में हैं जबकि उत्प्रेरक ठोस अवस्था में हैं |
(ii) सूक्ष्म विभाजित Ni की उपस्थिति में वनस्पति तेलों का हाइड्रोजनीकरण
![]()
इस अभिक्रिया में अभिकारक द्रव तथा गैस है जबकि उत्प्रेरक ठोस है।
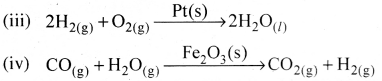
(v) ओस्टवाल्ड प्रक्रम में, प्लैटिनम की जाली पर अमोनिया का नाइट्रिक ऑक्साइड में ऑक्सीकरण-
![]()
यहाँ अभिकारक गैस हैं जबकि उत्प्रेरक ठोस हैं।
(vi) ऐल्कीनों का बहुलकीकरण में जिग्लर नट्टा उत्प्रेरक (R3Al + TiCl4) प्रयुक्त किया जाता है। यहाँ ऐल्कीन गैस तथा जिग्लर नट्टा उत्प्रेरक ठोस है।
(vii) हाबर प्रक्रम में सूक्ष्म विभाजित आयरन की उपस्थिति में अमोनिया का बनना
![]()
यहाँ अभिकारक गैसीय प्रावस्था में हैं जबकि उत्प्रेरक ठोस हैं।
प्रश्न 5.20.
उत्प्रेरक की सक्रियता एवं वरण क्षमता का क्या अर्थ है?
उत्तर:
(a) उत्प्रेरक की सक्रियता – उत्प्रेरक की किसी रासायनिक अभिक्रिया के वेग को बढ़ाने की क्षमता को ही उसकी सक्रियता कहते हैं।
(b) उत्प्रेरक की वरण क्षमता (वरणात्मकता) – उत्प्रेरक द्वारा किसी अभिक्रिया द्वारा विशिष्ट उत्पाद बनाने की क्षमता को उसकी वरण क्षमता कहते हैं।
उदाहरण – H2 तथा CO से भिन्न-भिन्न उत्प्रेरकों द्वारा भिन्न-भिन्न उत्पाद प्राप्त होते हैं।
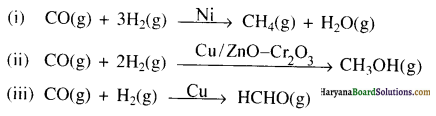
![]()
प्रश्न 5.21.
जिओलाइटों द्वारा उत्प्रेरण के कुछ लक्षणों का वर्णन कीजिए।
उत्तर:
(i) जिओलाइटों द्वारा उत्प्रेरण में उत्प्रेरकी अभिक्रिया उत्प्रेरक की रंध्र संरचना तथा अभिकारक एवं उत्पाद के अणुओं के आकार पर निर्भर करती है, अतः जिओलाइट आकार वरणात्मक उत्प्रेरक कहलाते हैं।
(ii) जिओलाइटों द्वारा उत्प्रेरण, जिओलाइटों के संरंध्रों तथा कोटरों (cavities) पर भी निर्भर करता है।
प्रश्न 5.22.
आकृति वरणात्मक उत्प्रेरण क्या है?
उत्तर:
आकृति वरणात्मक उत्प्रेरण – वह उत्प्रेरकी अभिक्रिया जो उत्प्रेरक की रंध्र संरचना एवं अभिकारक एवं उत्पाद अणुओं के आकार पर निर्भर करती है उसे आकार वरणात्मक उत्प्रेरण कहते हैं । मधुमक्खी के छत्ते जैसी संरचना के कारण जिओलाइट अच्छे आकृति वरणात्मक उत्प्रेरक होते हैं। ये सिलिकेट्स के त्रिविमीय नेटवर्क वाले सूक्ष्मरंध्री ऐलुमिनो सिलीकेट होते हैं, जिनमें कुछ सिलिकन परमाणु ऐलुमिनियम के परमाणुओं द्वारा प्रतिस्थापित होकर Al-O-Si ढाँचा बनाते हैं। जिओलाइटों में होने वाली अभिक्रियाएँ जिओलाइटों के संरंध्रों एवं कोटरों (cavities) पर भी निर्भर करती हैं। जिओलाइट प्रकृति में पाए जाते हैं तथा उत्प्रेरक वरणात्मकता के लिए इनका संश्लेषण भी किया जाता है।
प्रश्न 5.23.
निम्न पदों (शब्दों) को समझाइए –
(i) वैद्युतकणसंचलन,
(ii) स्कंदन,
(iii) अपोहन,
(iv) टिन्डल प्रभाव |
उत्तर:
(i) वैद्युत कण संचलन (Electrophoresis) – कोलॉइडी विलयन में कणों पर धनावेश या ऋणावेश होता है। जब एक कोलॉइडी विलयन में डूबे हुये दो प्लैटिनम इलेक्ट्रोडों पर विद्युत विभव लगाया जाता है तो कोलॉइडी कण विपरीत आवेशित इलेक्ट्रोड की ओर गमन करते हैं। इसे वैद्युतकणसंचलन कहते हैं। धनात्मक आवेशित कण कैथोड की ओर तथा ऋणात्मक आवेशित कण ऐनोड की ओर गति करते हैं।
(ii) स्कंदन (Coagulation) – द्रवविरागी (द्रवविरोधी) सॉल का स्थायित्व कोलॉइडी कणों पर आवेश के कारण होता है। यदि किसी प्रकार से इनका आवेश हटा दिया जाये तो कोलॉइडी कण एक-दूसरे के समीप आकर कंदित हो जाते हैं एवं गुरुत्व बल के कारण नीचे बैठ जाते हैं। कोलॉइडी कणों के स्कंदित होकर नीचे बैठने के प्रक्रम को प्रक्रम स्कंदन या अवक्षेपण कहते हैं।
(iii) अपोहन (Dialysis) – कोलॉइडी विलयन में घुले हुए विद्युत अपघट्य या अन्य विलेय पदार्थों को जांतव झिल्ली द्वारा पृथक् करने की प्रक्रिया को अपोहन कहते हैं।
(iv) टिन्डल प्रभाव (Tyndal effect ) – कोलॉइडी विलयन में प्रकाशकिरण पुंज गुजारकर उन्हें प्रकाश के पथ की दिशा के लम्बवत् देखने पर ये मंद से प्रबल दूधियापन दर्शाता है अर्थात् प्रकाश किरण पुंज का पारगमन पथ नीले प्रकाश से प्रदीप्त हो जाता है। इसे टिण्डल प्रभाव कहते हैं। यह कोलॉइडी कणों द्वारा प्रकाश के प्रकीर्णन के कारण होता है।
प्रश्न 5.24.
इमल्शनों (पायस) के चार उपयोग लिखिये ।
उत्तर:
इमल्शनों के उपयोग निम्नलिखित हैं-
(i) दूधिया मैग्नीशिया जो कि एक इमल्शन है, का उपयोग पेट की गड़बड़ दूर करने में किया जाता है। मैग्नीशिया Mg(OH)2 का पायस होता है।
(ii) साबुन एवं अपमार्जकों की शोधन क्रिया में इमल्शन ( पायस) बनता है।
(iii) दूध जो कि हमारे दैनिक जीवन में बहुत महत्वपूर्ण है, भी इमल्शन है जिसमें जल में वसा परिक्षिप्त रहती है।
(iv) धातुकर्म में अयस्क के सान्द्रण की झाग प्लवन विधि में भी पायस का योगदान होता है।
प्रश्न 5.25.
मिसेल क्या है? मिसेल निकाय का एक उदाहरण दीजिए ।
उत्तर:
मिसेल – कुछ पदार्थ विलयन में उच्च सान्द्रताओं पर कणों का एक पुंज बनाते हैं जिसे मिसेल कहते हैं। यह कोलॉइड के समान व्यवहार करता है। मिसेल सहचारी ( associated colloid) कोलॉइड द्वारा बनता है । अतः इन्हें सहचारी कोलॉइड भी कहते हैं।
मिसेल सामान्यतया पृष्ठ सक्रिय पदार्थों द्वारा बनते हैं जो कि विशिष्ट प्रकार के अणु होते हैं जिनमें द्रव – विरोधी तथा द्रवस्नेही सिरा होता है। साबुन, मिसेल बनाते हैं जैसे सोडियम ऑलिएट (C17H33 COO–Na+), इसमें हाइड्रोकार्बन भाग C17H33 – जलविरोधी सिरा है तथा COO–Na+ स्नेही सिरा है।
प्रश्न 5.26.
निम्न पदों को उचित उदाहरण सहित समझाइए –
(i) ऐल्कोसॉल,
(ii) ऐरोसॉल,
(iii) हाइड्रोसॉल।
उत्तर:
(i) ऐल्कोसॉल-वे कोलॉइडी सॉल जिनमें परिक्षेपण माध्यम ऐल्कोहॉल होता है, उन्हें एल्कोसॉल कहते हैं। उदाहरण – कोलोडियन।
(ii) ऐरोसॉल-वे कोलॉइड जिनमें द्रव, गैसीय अवस्था में परिक्षिप्त रहता है, उन्हें ऐरोसॉल कहते हैं। उदाहरण – कोहरा ।
(iii) हाइड्रोसॉल -वे कोलॉइडी सॉल जिनमें परिक्षेपण माध्यम जल होता है जिसमें ठोस के कण परिक्षिप्त रहते हैं, उन्हें हाइड्रोसॉल कहते हैं । उदाहरण – स्टार्च सॉल।
प्रश्न 5.27.
“कोलॉइड एक पदार्थ नहीं, पदार्थ की एक अवस्था है ।” इस कथन पर टिप्पणी कीजिए ।
उत्तर:
“कोलॉइड एक पदार्थ नहीं, पदार्थ की एक अवस्था है।” यह कथन सत्य है क्योंकि एक ही पदार्थ भिन्न-भिन्न परिस्थितियों में कोलॉइड तथा क्रिस्टलाभ की तरह व्यवहार दर्शाता है, अर्थात् एक परिस्थिति में वह कोलॉइड है तो दूसरी परिस्थिति में वह क्रिस्टलाभ होगा। जैसे NaCl जल में क्रिस्टलाभ (Crystalloid) की भांति व्यवहार करता है जबकि बेन्जीन में यह कोलॉइड की भांति व्यवहार करता है।
इसी प्रकार साबुन का तनु विलयन, क्रिस्टलाभ के गुण दर्शाता है। जबकि इसी का सांद्र विलयन, कोलॉइड के गुण दर्शाता है। अतः किसी पदार्थ का कोलॉइडी व्यवहार कणों के आकार पर निर्भर करता है। जब कणों का आकार 1 nm से 1000 nm की परास में होता है तो पदार्थ कोलॉइड की भांति व्यवहार करता है।
HBSE 12th Class Chemistry पृष्ठ रसायन Intext Questions
प्रश्न 5.1.
रसोवशोषण के दो अभिलक्षण दीजिए।
उत्तर:
(i) रसोवशोषण अतिविशिष्ट होता है।
(ii) रसोवशोषण अनुत्क्रमणीय होता है।
प्रश्न 5.2.
ताप बढ़ने पर भौतिक अधिशोषण क्यों घटता है?
उत्तर:
भौतिक अधिशोषण ऊष्माक्षेपी प्रक्रम होता है (△H =-ve)
अतः ली शातेलिए के नियम से ताप बढ़ाने पर साम्य पश्च दिशा में जाता है अर्थात् अधिशोषण घटता है। निम्न ताप पर भौतिक अधिशोषण आसानी सेहोता है।
प्रश्न 5.3.
अपने क्रिस्टलीय रूपों की तुलना में चूर्णित पदार्थ, अधिक प्रभावी अधिशोषक क्यों होते हैं?
उत्तर:
अधिशोषक का पृष्ठीय क्षेत्रफल बढ़ने पर अधिशोषण की मात्रा बढ़ती है। क्रिस्टलीय रूपों की तुलना में चूर्णित एवं सरन्थ्र पदार्थों का पृष्ठीय क्षेत्रफल अधिक होता है अतः ये अपने क्रिस्टलीय रूपों की तुलना में अधिक प्रभावी अधिशोषक होते हैं।
प्रश्न 5.4.
हॉबर प्रक्रम में हाइड्रोजन को NiO उत्प्रेरक की उपस्थिति में मेथेन के साथ भाप की अभिक्रिया द्वारा प्राप्त किया जाता है। प्रक्रम को भाप-पुन: संभवन कहते हैं। अमोनिया प्राप्त करने के लिए हॉबर प्रक्रम में CO को हटाना क्यों आवश्यक है?
उत्तर:
हॉबर प्रक्रम में प्रयुक्त हाइड्रोजन को निम्नलिखित अभिक्रिया द्वारा बनाया जाता है-
![]()
इस अभिक्रिया में CO भी सहउत्पाद के रूप में प्राप्त होती है। इस CO को अभिक्रिया माध्यम से हटाना आवश्यक है क्योंकि यह हॉबर प्रक्रम में प्रयुक्त Fe (उत्प्रेरक) से क्रिया करके [Fe(CO)5] बनाता है जो कि कमरे के ताप पर द्रव होता है अतः यह NH3 के बनने में बाधा उत्पन्न करता है तथा उच्च ताप पर CO, H2 से भी क्रिया करती है इसलिए CO उत्प्रेरक विष है तथा उत्प्रेरक की सक्रियता को कम कर देती है।
![]()
प्रश्न 5.5.
एस्टर का जल अपघटन प्रारंभ में धीमा एवं कुछ समय पश्चात् तीव्र क्यों हो जाता है?
उत्तर:
एस्टर के जल अपघटन की अभिक्रिया निम्नलिखित है-
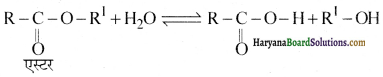
इस अभिक्रिया में उत्पन्न कार्बनिक अम्ल, उत्प्रेरक (स्वउत्प्रेरक) का कार्य करता है अतः एस्टर का जल अपघटन प्रारंभ में धीमा तथा कुछ समय पश्चात् तीव्र हो जाता है।
प्रश्न 5.6.
उत्त्रेरण के प्रक्रम में विशोषण की क्या भूमिका है?
उत्तर:
ठोस उत्प्रेरक की सतह पर गैसीय अभिकारकों के अधिशोषण से मध्यवर्ती बनता है जिसके पश्चात् बने उत्पादों का उत्प्रेरक की सतह से विशोषण हो जाता है जिससे ठोस उत्प्रेरक की सतह पुन अभिक्रिया के लिए उपलब्ध हो जाती है। यदि विशोषण नहीं होगा तो आगे अभिक्रिया नहीं होगी अर्थात् अभिक्रिया रुक जाएगी। अतः उत्प्रेरण के प्रक्रम में विशोषण की महत्वपूर्ण भूमिका होती है।
प्रश्न 5.7.
आप हार्डी-शूल्से नियम में संशोधन के लिए क्या सुझाव दे सकते हैं?
उत्तर:
हार्डी-शूल्से नियम में निम्नलिखित संशोधन किया जा सकता है अर्थात् इसे इस प्रकार व्यक्त किया जा सकता है-
किसी विद्युत अपघट्य की स्कंदन शक्ति उसके स्कंदन मान के व्युत्क्रमानुपाती होती है, अर्थात् जिस विद्युत अपघट्य का स्कंदन मान कम होगा उसकी स्कंदन शक्ति अधिक होगी। दो विद्युत अपघट्यों के लिए इसकी तुलना इस प्रकार की जा सकती है-
![]()
किसी विद्युत अपघट्य पर जितना अधिक आवेश होता है कोलाइड के अवक्षेपण के लिए उसकी उतनी ही कम मात्रा की आवश्यकता होगी।
प्रश्न 5.8.
अवक्षेप का मात्रात्मक आकलन करने से पूर्व उसे जल से धोना आवश्यक क्यों है?
उत्तर:
अवक्षेप के मात्रात्मक आकलन करने से पूर्व उसे जल से धोना आवश्यक है क्योंकि अवक्षेप की सतह पर विद्युत अपघट्य के कुछ कण अधिशोषित होते हैं जो अवक्षेप को कोलाइडी अवस्था में परिवर्तित कर सकते हैं तथा अवक्षेप का द्रव्यमान भी बढ़ सकता है, जिससे अवक्षेप का मात्रात्मक आकलन सही नहीं होगा। अतः जल से धोने से विद्युत अपघट्य के कण फिल्टर पत्र द्वारा छनित में चले जाते हैं।