Haryana State Board HBSE 11th Class Chemistry Solutions Chapter 4 रासायनिक आबंधन तथा आण्विक संरचना Textbook Exercise Questions and Answers.
Haryana Board 11th Class Chemistry Solutions Chapter 4 रासायनिक आबंधन तथा आण्विक संरचना
प्रश्न 1.
रासायनिक आबन्ध के बनने की व्याख्या कीजिए।
उत्तर:
परमाणुओं के संयोग से अणु का बनना उनके बाहरी कक्ष में स्थित इलेक्ट्रॉनों पर निर्भर करता है। जब परमाणु आपस में संयोग करते हैं तो वे पास-पास आते हैं। संयोग करने के बाद उनकी निकाय की ऊर्जा धारिता सबसे कम हो जाती है और निकाय का स्थायित्व बढ़ जाता है।
अतः एक अणु के दो परमाणुओं को एक साथ बाँधे रह सकने की आकर्षण बल क्षमता को रासायनिक आबन्धन कहते हैं।
कॉसेल-लुइस के अनुसार एक परमाणु के बाह्य कोश के इलेक्ट्रॉन दूसरे परमाणु के बाह्य कोश में स्थानान्तरित होकर अपना अष्टक पूरा करते हैं। जिससे वैद्युत संयोजक बंध बन जाता है।
प्रश्न 2.
निम्नलिखित तत्वों के परमाणुओं के लूइस बिन्दु प्रतीक लिखिए।
Mg, Na, B, O, N, Br
उत्तर:
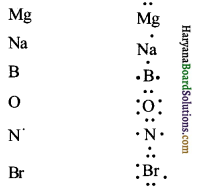
प्रश्न 3.
निम्नलिखित परमाणुओं तथा आयनों के लूइस बिन्दु प्रतीक लिखिए।
S और S2-, Al तथा Al3+ H और H–
उत्तर:
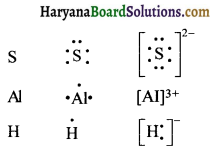
प्रश्न 4.
निम्नलिखित अणुओं तथा आयनों की लुइस संरचना लिखिए।
H2S, SiCl4, BeF2, CO32-, HCOOH
उत्तर:
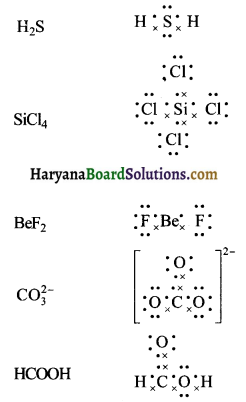
प्रश्न 5.
अष्टक नियम परिभाषित कीजिए। इस नियम का महत्त्व तथा सीमाएँ बताइ।
उत्तर:
परमाणुओं के बाह्य कोश के इलेक्ट्रॉनों का स्थानान्तरण या सहभाजन द्वारा अष्टक पूरा करने को अष्टक नियम कहते हैं।
अष्टक नियम का महत्व –
- कार्बनिक यौगिकों की संरचना समझने में अष्टक नियम महत्त्वपूर्ण है।
- अधिकांश अणु बनने में अष्टक नियम का पालन करते हैं।
अष्टक नियम की सीमाएँ –
- कुछ यौगिकों में केन्द्रीय परमाणु के चारों ओर उपस्थित इलेक्ट्रॉन 8 से कम होते हैं। जैसे – BH3, BCl3
- संक्रमण तत्वों में केन्द्रीय परमाणु के चारों ओर 8 से अधिक इलेक्ट्रॉन होते हैं। अतः ऐसे यौगिकों पर अष्टक नियम लागू नहीं होता है। जैसे SF6, PCl5 आदि।
अष्टक नियम की कुछ अन्य कमियाँ Some Other Demerits of Octel Rule:-
(1) जीनॉन के यौगिक (Compounds of xenone)-अष्टक नियम के अनुसार उत्कृष्ट गैसें यौगिक नहीं बनाती हैं, परन्तु Xe ऑक्सीजन तथा फ्लुओरीन के साथ यौगिक बनाती है जो कि काफी स्थायी होते हैं। उदाहरण- XeF2, XeF4, XeF6, XeOF2, XeOF4 आदि।
(2) अणुओं की आकृति (Shapes of molecules)-अणुओं की आकृति के सम्बन्ध में अष्टक नियम किसी भी प्रकार की व्याख्या नहीं करता है।
प्रश्न 6.
आयनिक बंध बनाने के लिए अनुकूल कारकों को लिखिये।
उत्तर:
निम्न कारक अनुकूल होते हैं –
- आयनन एन्थैल्पी का मान कम से कम होना चाहिए ।
- इलेक्ट्रॉन लब्धि एन्थैल्पी का मान अधिक ऋणात्मक होना चाहिए।
- जालक ऊर्जा का परिमाण अधिक होने पर आयनिक बंध का स्थायित्व अधिक होगा।
![]()
प्रश्न 7.
निम्नलिखित अणुओं की आकृति की व्याख्या VSEPR सिद्धान्त के अनुरूप करें।
BeCl2, BCl3, SiCl4, AsF5, H2S, PH3
उत्तर:
(1) BeCl2 में दो आबन्धी युग्म हैं, अतः आकृति = रेखीय
(2) BCl3 में तीन आबन्धी युग्म हैं, अतः आकृति = त्रिकोणीय समतलीय
(3) SiCl4 में चार आबन्धी युग्म हैं, अतः आकृति = चतुष्फलकीय
(4) AsF5 में पाँच आबन्धी युग्म हैं, अतः आकृति = त्रिकोणीय द्विपिरामिडीय
(5) H2S में दो आबन्धी युग्म तथा दो एकाकी युग्म हैं।
अतः आकृति = बंकित अणु या मुड़ी हुयी
(6) PH3 में तीन आबन्धी युग्म तथा एक एकाकी युग्म
है, अत: आकृति = पिरामिडी
प्रश्न 8.
यद्यपि NH3 तथा H2O दोनों अणुओं की ज्यामिती विकृत चतुष्फलकीय होती है। तथापि जल में आबन्ध कोण अमोनिया की अपेक्षा कम होता है। विवेचना कीजिए।
उत्तर:
NH3 तथा H2O में sp³ संकरण होता है। अतः इन अणुओं की आकृति चतुष्फलकीय होनी चाहिए। परन्तु NH3 में एक एकाकी युग्म N पर होता है जबकि H2O अणु में 0 पर दो एकाकी युग्म उपस्थित रहते हैं। VSEPR सिद्धान्त के अनुसार H2O में एकाकी युग्मों में प्रतिकर्षण अधिक होता है। अत: NH3 में आबन्ध कोण (107°) H2O के आबन्ध कोण (104.5) से अधिक होता है।
प्रश्न 9.
आबन्ध प्रबलता को आबन्ध कोटि के रूप में किस प्रकार व्यक्त करेंगे?
उत्तर:
आबन्ध प्रबलता ∝ आबन्ध कोटि
अर्थात् आबन्ध कोटि जितना अधिक होगी, आबन्ध स्थायित्व उतना ही अधिक होगा।
उदाहरण-
| अणु | आबन्ध कोटि या आबन्ध क्रम | आबन्ध स्थायित्व या आबन्ध वियोजन ऊर्जा (kJ/mol) |
| (1) नाइट्रोजन अणु (N2) | 3 | 945 |
| (2) ऑक्सीजन (O2) | 2 | 498 |
| (3) फ्लुओरीन अणु (F2) | 1 | 158 |
प्रश्न 10.
आबन्ध लम्बाई की परिभाषा दीजिए।
उत्तर:
किसी अणु में आबन्धित परमाणुओं के नाभिकों के बीच साम्यावस्था दूरी आबन्ध लम्बाई कहलाती है। इसे पिकोमीटर (1 pm = 10-12 m) में व्यक्त करते हैं।
‘आबन्ध लम्बाई’ कहलाती है। आबन्ध लम्बाई या सहसंयोजक आबन्ध की लम्बाई को स्पेक्ट्रमी, एक्स-किरण विवर्तन तथा इलेक्ट्रॉन विवर्तन (Electron Diffraction) आदि विधियों के द्वारा ज्ञात किया जा सकता है।
आबन्धित युग्म का प्रत्येक परमाणु आबन्ध की लम्बाई में योगदान करता है। सहसंयोजी आबन्ध में प्रत्येक परमाणु का योगदान उस परमाणु की सहसंयोजी त्रिज्या कहलाती है। वास्तव में सहसंयोजक आबन्ध आबन्धित परमाणुओं की सहसंयोजक त्रिज्या का योग होता है।
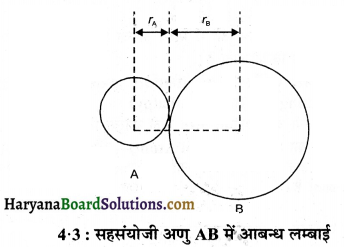
R = rA + rB
यहाँ R = आबन्ध लम्बाई है तथा rA एवं rB क्रमश: A व B परमाणुओं की सहसंयोजी त्रिज्यायें है । वाण्डर वाल त्रिज्या अनाबन्धित अवस्था में संयोजी कोश सहित परमाणु का समग्र आकार निरूपित करती है । वाण्डर वाल त्रिज्या ठोस अवस्था में विभिन्न अणुओं के दो समरूप परमाणुओं के बीच की दूरी की आधी होती है।
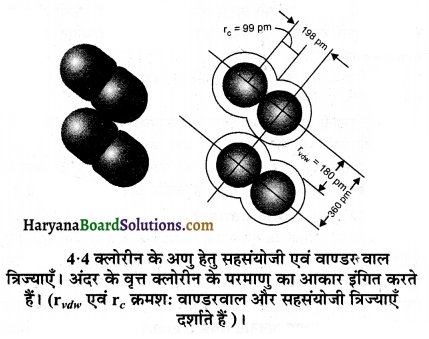
आबन्ध लम्बाई का मान सामान्यतया पिकोमीटर (1 pm = 10-12 m) में व्यक्त करते हैं। आबन्ध लम्बाई को प्रभावित करने वाले कारक निम्न प्रकार हैं-
(1) परमाणु का आकार (Size of Atom) – आबन्ध लम्बाई परमाणु के आकार से सीधे सम्बन्धित होती है।
आबन्ध लम्बाई ∝ परमाणु का आकार
उदाहरण – H – F < H – Cl < H – Br < H – I (आबन्ध लम्बाई) 2. आबन्धों की बहुलता (Multiplicity of Bonds) – आबन्धों की बहुलता बढ़ने पर आबन्ध लम्बाई कम हो जाती है क्योंकि परमाणु एक दूसरे के नजदीक आ जाते हैं।

उदाहरण – C – C > C = C > C ≡ C
3. संकरण का प्रकार (Type of Hybridisation) – आबन्ध लम्बाई संकरण के द्वारा भी प्रभावित होती है। अणु में s-अभिलक्षण बढ़ने पर आबन्ध लम्बाई कम हो जाती है।
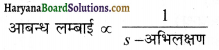
उदाहरण – sp³ (C-H आबन्ध ( 111pm) > sp² C – H आबन्ध ( 110 pm ) > sp² – C – H आबन्ध (108 pm)
कुछ सामान्य तत्वों की आबन्ध लम्बाई निम्न सारणी में दी गयी है।
सारणी 4.1 : कुछ एकल, द्वि तथा त्रि आबन्धों की औसत लम्बाई
| आबन्ध का प्रकार | सहसंयोजी आबन्ध लम्बाई (pm) |
| 1. H – H | 74 |
| 2. O – H | 96 |
| 3. C – H | 107 |
| 4. N – O | 136 |
| 5. C – O | 143 |
| 6. C – N | 143 |
| 7. C – C | 154 |
| 8. C = O | 121 |
| 9. N = O | 122 |
| 10. C = C | 133 |
| 11. C = N | 138 |
| 12. C ≡ N | 116 |
| 13. C ≡ C | 120 |
सारणी 4-2 : कुछ सामान्य अणुओं की आबन्ध लम्बाई
| अणु | आबन्ध लम्बाई (pm) |
| 1. H2 (H-H) | 74 |
| 2. F2 (FF) | 144 |
| 3. Cl2 (Cl-CI) | 199 |
| 4. Br2 (Br – Br) | 228 |
| 5. I2 (I – I) | 267 |
| 6. N2 (N = N) | 109 |
| 7. O2 (0 = 0) | 121 |
| 8. HF (H – F) | 92 |
| 9. HCl(H – Cl) | 127 |
| 10. HBr (H-Br) | 141 |
| 11. HI (H-I) | 160 |
सारणी 4.3 सहसंयोजी त्रिज्याएँ rcov(pm)
| तत्व (आबन्ध प्रकृति) | सहसंयोजी त्रिज्या rcov (pm) |
| 1. H (एकल आबन्ध) | 37 |
| 2. C (एकल आबन्ध) | 77 |
| 3. C (द्विआबन्ध) | 67 |
| 4. C (त्रिआबन्ध) | 60 |
| 5. N (एकल आबन्ध) | 74 |
| 6. N (द्वि आबन्ध) | 65 |
| 7. N (त्रि आबन्ध) | 55 |
| 8. P (एकल आबन्ध) | 110 |
| 9. As (एकल आबन्ध) | 121 |
| 10. Sb (एकल आबन्ध) | 141 |
| 11. O (एकल आबन्ध) | 66 |
| 12. O (द्वि आबन्ध) | 57 |
| 13. S (द्वि एकल आबन्ध) | 104 |
| 14. S (द्वि आबन्ध) | 95 |
| 15. Se (एकल आबन्ध) | 104 |
| 16. Te (एकल आबन्ध) | 137 |
| 17. F (एकल आबन्ध) | 64 |
| 18. Cl (एकल आबन्ध) | 99 |
| 19. Br (एकल आबन्ध) | 114 |
| 20. I (एकल आबन्ध) | 133 |
![]()
प्रश्न 11.
CO32- आयन के संदर्भ में अनुनाद के विभिन्न पहलुओं को स्पष्ट कीजिए।
उत्तर:
लूइस संरचना के अनुसार तीन कार्बन-ऑक्सीजन आबन्धों की लम्बाई भिन्न होनी चाहिए, परन्तु CO32- आयन के तीनों कार्बन – ऑक्सीजन आबन्धों की लम्बाई समान होती है। अतः कार्बोनेट आयन को तीन विहित संरचनाओं (I II III) का अनुनादी संकर माना जाता है।
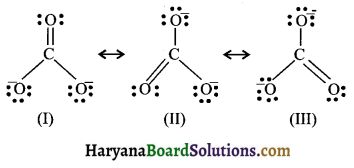
प्रश्न 12.
नीचे दी गई संरचनाओं (I) और (II) द्वारा H3PO3 को प्रदर्शित किया जा सकता है। क्या ये दो संरचनाएँ H3PO3 के अनुनाद संकर के विहित (केनॉनीकल) रूप माने जा सकते हैं? यदि नहीं तो उसका कारण बताइये।
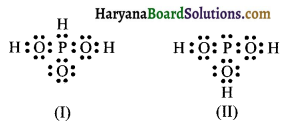
उत्तर:
उपरोक्त संरचनायें (I) व (II) अनुनादी संरचनायें नहीं हैं क्योंकि अनुनाद के लिये सामान्य नियम है कि अनुनादी संरचनाओं में इलेक्ट्रॉन युग्मों की व्यवस्था में भिन्नता होनी चाहिये न कि परमाणुओं की। संरचनायें (I) तथा (II) विहित (Canonical ) संरचनायें नहीं है क्योंकि संरचना (I) में फॉस्फोरस परमाणु H (PH आबन्ध) से जुड़ा होता है जबकि संरचना (II) में यह OH समूह ( P – OH आबन्ध) से जुड़ा है।
प्रश्न 13.
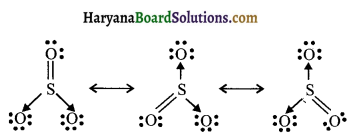
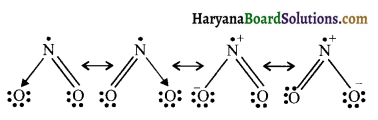
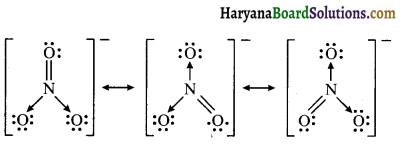
SO3, NO2 तथा NO–3 की अनुनाद संरचनाएँ लिखिए।
उत्तर:
SO3 की अनुनादी संरचना
NO2 की अनुनादी संरचना
NO–3 की अनुनादी संरचना
प्रश्न 14.
निम्नलिखित परमाणुओं से इलेक्ट्रॉन स्थानान्तरण द्वारा धनायनों तथा ऋणायनों में विरचन को लूइस बिन्दु प्रतीकों की सहायता से दर्शाइये
(क) K तथा S
(ख) Ca तथा O
(ग) AI तथा N
उत्तर:
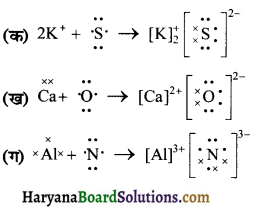
प्रश्न 15.
हालांकि CO2 तथा H2O दोनों त्रिपरमाणुक अणु हैं। परन्तु H2O अणु की आकृति बंकित होती है जबकि CO2 की रैखिक आकृति होती है। द्विध्रुव आघूर्ण के आधार पर इसकी व्याख्या कीजिए।
उत्तर:
CO2 तथा H2O दोनों त्रिपरमाणुक अणु हैं। CO2 की आकृति रेखीय होती है। जबकि H2O की आकृति बंकित होती है। CO2 अणु में दो C = O आबन्ध ध्रुवित प्रकृति के होते हैं लेकिन दोनों का प्रभाव समान व विपरीत दिशा में होने के कारण निष्क्रिय हो जाता है। अतः CO2 का अणु रेखीय अणु है।
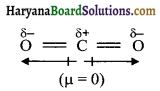
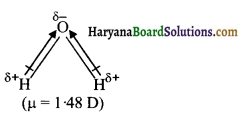
H2O-H अणु में दो OH आबन्ध होते हैं। इनकी प्रकृति भी ध्रुवीय होती है। लेकिन आबन्ध रैखिक न होने के कारण द्विध्रुव आघूर्ण दर्शाते हैं इसलिये आकृति बंकित होती है।
H2O अणु का द्विध्रुव आघूर्ण मान
μ = 1.84D होता है।
प्रश्न 16.
द्विध्रुव आघूर्ण के महत्त्वपूर्ण अनुप्रयोग बताएँ-
उत्तर:
(i) आबन्ध की घूर्णता ज्ञात करने में।
(ii) अणुओं की आण्विक संरचना ज्ञात करने में।
(iii) अणुओं की प्रकृति ज्ञात करने में।
(iv) आबन्धों की आयनिक प्रतिशतता ज्ञात करने में।
(1) द्विपरमाणुक अणु (Diatomic molecules) – द्विपरमाणुक अणुओं में आबन्ध की ध्रुवणता द्विध्रुब आघूर्ण के मान से सीधे सम्बन्धि होती है। यदि अणु का द्विध्रुव आघूर्ण मान अधिक है तो आबन्ध की ध्रुवणता भी उच्च होगी।
उदाहरण-
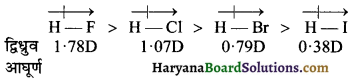
(2) बहुपरमाणुक अणु (Polyatomic molecules) बहुपरमाणुक अणुओं में एक से अधिक सहसंयोजक बन्ध होते हैं तथा द्विध्रुव आघूर्ण का मान विभिन्न आबन्धों की ध्रुवता तथा उनके संगत आबन्ध कोणों पर निर्भर करता है।
(A) त्रिपरमाणुक अणु (Triatomic molecules) – ऐसे त्रिपरमाणुक अणु जिनमें द्विध्रुव आघूर्ण उपस्थित होता है उनमें एकाकी इलेक्ट्रॉन युग्म पाया जाता है। यहाँ पर आबन्ध ध्रुवता को निरस्त नहीं कर पाता है। ऐसे अणुओं की ज्यामिति मुड़ी हुयी या V-आकृति की होती है परन्तु ऐसे त्रिपरमाणुक अणु जिनमें एकाकी युग्म उपस्थित नहीं होता है।
ऐसे अणु में दो समान आबंध द्विध्रुव विपरीत दिशा में होते हैं तथा एक दूसरे के प्रभाव को समाप्त (Cancel) कर देते हैं। इनका द्विध्रुव आघूर्ण का मान शून्य होता है एवं ज्यामितीय रेखीय होती है।
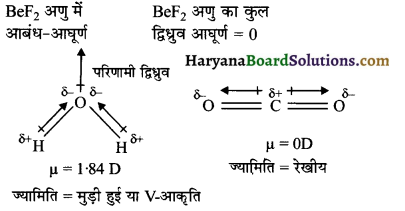
(B) चतुष्परमाणुक अणु (Tetraatomic molecule) – ऐसे अणु जिनमें द्विध्रुव आघूर्ण उपस्थित होता है तथा उनमें एकाकी युग्म होता है। यहाँ पर आबन्ध ध्रुवता को निरस्त नहीं कर पाते। इन अणुओं की ज्यामिति पिरामिडीय होती है।
जबकि शून्य द्विध्रुव आघूर्ण वाले अणुओं की ज्यामिति त्रिकोणीय होती है।
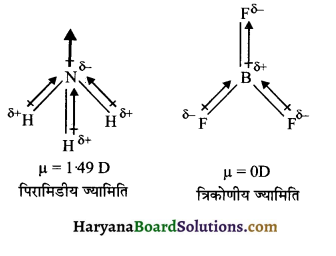
NH3 तथा NF3 अणुओं के द्विध्रुव-आघूर्ण की तुलना :
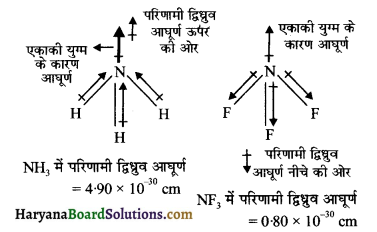
NH3 तथा NF3 दोनों अणुओं की आकृति पिरामिडीय होती है। . जबकि दोनों अणुओं में नाइट्रोजनं परमाणु पर एक एकाकी इलेक्ट्रॉन युग्म उपस्थित होता है। हालाँकि फ्लुओरीन की विद्युत ऋणात्मकता नाइट्रोजन की अपेक्षा अधिक होती है परन्तु NH3 का परिणामी द्विध्रुव आघूर्ण (4.9 × 10-30 cm) NF3 के द्विध्रुव आघूर्ण (0.80 x 10-30 cm) की अपेक्षा अधिक होता है। इसका कारण यह है कि NH3 में नाइट्रोजन पर उपस्थित एकाकी इलेक्ट्रॉन युग्म का कक्षक द्विध्रुव आघूर्ण तीन N – F आबन्धों के द्विध्रुव आघूर्णों के परिणामी द्विध्रुव आघूर्ण की विपरीत दिशा में होता है। कक्षक का द्विध्रुव आघूर्ण एकाकी इलेक्ट्रॉन युग्म के कारण N – F आबन्ध आघूर्णो के परिणामी द्विध्रुव आघूर्ण को कम कर देता है। अतः NF3 के अणु का द्विध्रुव आघूर्ण कम होता है।
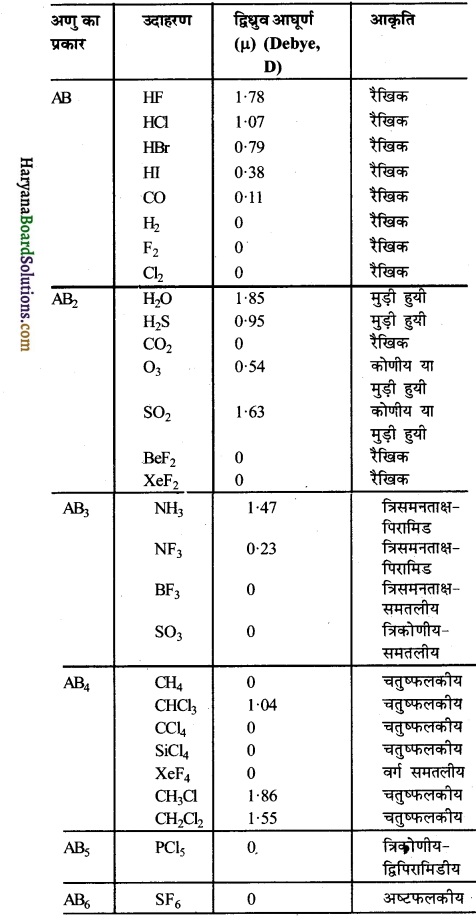
कुछ अणुओं के द्विध्रुव आघूर्ण तथा आकृति के नीचे दी गई सारणी में दर्शाया गया है-
(3) प्रतिशत आयनिक गुण ज्ञात करने में (In determining the percentage ionic character) – किसी सहसंयोजक यौगिक में हम प्रतिशत आयनिक गुण को निम्न सूत्र की सहायता से ज्ञात कर सकते हैं।

उदाहरण-HCI का प्रतिशत आयनिक लक्षण ज्ञात करो यदि HCI के द्विध्रुव आघूर्ण का प्रायोगिक मान 1.03D है तथा बन्ध लम्बाई 1-275 है।
हल:
यदि इलेक्ट्रॉन पूर्ण रूप से स्थानान्तरित हो रहा है। अर्थात् 100 प्रतिशत आयनिक अभिलक्षण के लिये H+ व Cl– आयनों पर आवेश एक इकाई (4.8 x 10-10 esu) के बराबर होता है। यहाँ H-CI आबन्ध लम्बाई =1.275 A
= 1.275 x 10-8 cm
µ (आयनिक या सैद्धान्तिक )
= q x d
= 4.8 x 10-10 x 1.275 x 108 esu cm
= 6.12 × 10-18 esu cm
= 6.12D

प्रश्न 17.
विद्युत ऋणात्मकता को परिभाषित कीजिए। यह इलेक्ट्रॉन बन्धुता से किस प्रकार भिन्न है।
उत्तर:
किसी तत्व की विद्युत ऋणात्मकता अणु में उपस्थित साझे के इलेक्ट्रॉन युग्म को अपनी ओर आकर्षित करने की क्षमता है। इसकी इकाई नहीं होती है। विद्युत ऋणात्मकता परमाणु की साझे के इलेक्ट्रॉन युग्म को आकर्षित करने की प्रवृत्ति है।
विद्युत ऋणात्मकता तथा इलेक्ट्रॉन बन्धुता में अन्तर
| विद्युत ऋणात्मकता | इलेक्ट्रॉन बन्धुता |
| 1. यह सहभाजित इलेक्ट्रॉन युग्म को अपनी ओर आकर्षित करने की किसी परमाणु की प्रवृत्ति होती है। | 1. यह किसी विलगित गैसीय परमाणु द्वारा बाहय इलेक्ट्रॉनों को आकर्षित करने पर मुक्त होने वाली ऊर्जा है। |
| 2. यह परमाणु की सापेक्ष इलेक्ट्रॉन आकर्षण की प्रवत्ति है। | 2. यह परमाणु की परिशुद्ध आकर्षण प्रवृत्ति है। |
| 3. यह आबंधित परमाणु का गुणधर्म है। | 3. यह विलगित परमाणु का गुणधर्म है। |
| 4. इसकी कोई इकाई नहीं होती। यह केवल तुलनात्मक पैमाने द्वारा व्यक्त की जाती है। | 4. इसकी इकाई होती है। इसकी इकाई KJ या eV/परमाणु है। |
प्रश्न 18.
ध्रुवीय सहसंयोजी आबन्ध से आप क्या समझते हो? उदाहरण सहित व्याख्या कीजिए।
उत्तर:
विषम परमाणुक अणु में सहसंयोजक बंध के इलेक्ट्रॉन युग्म अधिक ऋणात्मक परमाणु की ओर आकर्षित होकर विस्थापित हो जाते हैं। जिससे एक परमाणु पर धनावेश तथा दूसरे परमाणु पर ऋणावेश आ जाता है। अत: सह-संयोजक बंध ध्रुवीय हो जाता है। ऐसे बंध को ध्रुवीय सहसंयोजक बंध कहते हैं। उदाहरणार्थ-
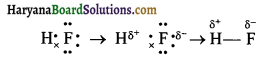
प्रश्न 19.
निम्नलिखित अणुओं को आबन्धों की बढ़ती आयनिक प्रकृति के क्रम में लिखिए-
LIF, K2O, N2, SO2 तथा CIF3
उत्तर:
अणुओं में आबन्धों की बढ़ती आयनिक प्रकृति का क्रम निम्न प्रकार है-
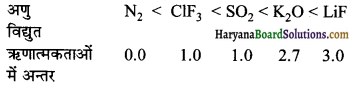
प्रश्न 20.
CH3COOH की नीचे दी गई ढाँचा संरचना सही हैं परन्तु कुछ आबन्ध त्रुटि पूर्ण दर्शाए गए हैं। ऐसीटिक अम्ल की लूइस संरचना लिखिए-

उत्तर:
उपरोक्त प्रश्न में दी गयी संरचना में केवल ढाँचा संरचना सही है, परन्तु यह लूइस संकल्पना के साथ-साथ कार्बन की चतुसंयोजी प्रकृति के अनुसार नहीं है। ऐसीटिक अम्ल की लूइस संरचना निम्नवत् होगी-
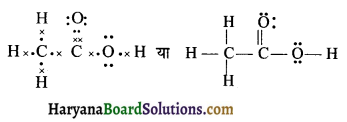
प्रश्न 21.
चतुष्फलकीय ज्यामिति के अलावा CH4 अणु की एक और संभव ज्यामिति वर्ग समतली है जिसमें हाइड्रोजन के चार परमाणु एक वर्ग के चारों कोनों पर होते हैं। व्याख्या कीजिए कि CH4 का अणु वर्ग समतली नहीं होता है।
उत्तर:
CH4 की चतुष्फलकीय एवं वर्ग समतली संरचनायें निम्न प्रकार हैं-
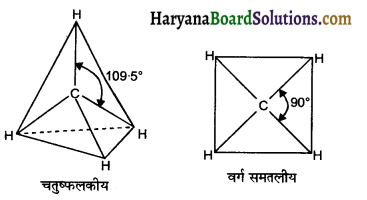
VSEPR सिद्धान्त के अनुसार, केन्द्रीय परमाणु पर स्थित इलेक्ट्रॉन युग्मों में प्रतिकर्षण कम करने के लिये उनके मध्य दूरी अधिक होनी चाहिये। CH4 की वर्ग समतली संरचना में चार C-H आबन्ध युग्म 90° कोण पर होते हैं। जबकि चतुष्फलकीय संरचना में C-H बन्ध युग्म 109.5° पर होते हैं। अतः चतुष्फलकीय संरचना में बन्ध कोण अधिक होने के कारण C-H आबन्ध युग्मों के मध्य प्रतिकर्षण भी कम होगा। अतः CH4 की ज्यामिति चतुष्फलकीय होती है न कि वर्ग समतलीय।
![]()
प्रश्न 22.
यद्यपि Be-H आबन्ध ध्रुवीय है तथा BeH2 का द्विध्रुव आघूर्ण शून्य है, स्पष्ट कीजिए ।
उत्तर:
BeH2 अणु में sp संकरण होता है जिससे अणु की आकृति रेखीय है। Be-H आबन्ध में Be तथा H की विद्युत ऋणात्मकता का अन्तर अधिक है। लेकिन BeH2 में द्विध्रुव आघूर्ण शून्य होता है। क्योंकि दोनों आबन्ध एक-दूसरे के घूर्णन को समाप्त कर देते हैं।
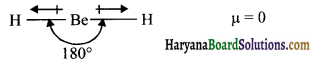
प्रश्न 23.
NH3 तथा NF3 में किस अणु का द्विध्रुव आघूर्ण अधिक है और क्यों?
उत्तर:
NH3 अणु का द्विध्रुव आघूर्ण (1.46D) NF3 के द्विध्रुव आघूर्ण (0-24 D) से बहुत अधिक है । N और F परमाणुओं की विद्युत ऋणात्मकताओं का अन्तर (4.0-3.0 = 10 ) है जोकि N, और H परमाणु के अन्तर ( 3.0 – 2.1 = 09) के बराबर है। NH3 में N – H
आबन्ध घूर्णता समान दिशा में है जबकि NF3 में आबन्ध घूर्णता विपरीत दिशा में है । अत: NH3 अणु में द्विध्रुव आघूर्ण अधिक है।
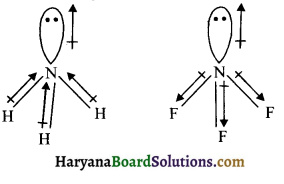
प्रश्न 24.
परमाणु कक्षकों के संकरण से आप क्या समझते हैं? sp, sp², sp³ संकर कक्षकों की आकृति का वर्णन कीजिए।
उत्तर:
संकरण समान ऊर्जा वाले कक्षकों के आपस में मिलकर ऊर्जा के पुनर्वितरण द्वारा समान ऊर्जा तथा आकार के कक्षकों के बनने की प्रक्रिया को संकरण कहते हैं।
(i) sp संकरण – एक s तथा एक p कक्षक संकरित होकर दो सम sp संकरित कक्षक बनाते हैं। यहाँ संकरित कक्षक में 50% s – लक्षण तथा 50% p-लक्षण होता है।

(ii) sp² संकरण – एक s तथा दो कक्षक संकरित होकर तीन सम sp² संकरित कक्षक बनाते हैं। इस sp² संकरित कक्षक में 33.34% s – लक्षण तथा 66.66% p- लक्षण होते हैं।
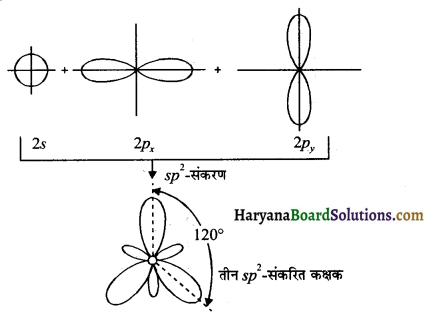
(iii) sp³ संकरण – एक s तथा तीन p कक्षक संकरित होकर चार sp³ संकरित कक्षक बनाते हैं। sp³ संकरित कक्षक में 25% s- लक्षण तथा 75% p-लक्षण पाये जाते हैं।
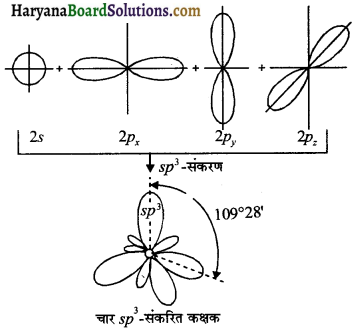
प्रश्न 25.
निम्नलिखित अभिक्रिया में Al परमाणु की संकरण अवस्था में परिवर्तन (यदि होता है तो) को समझाइये-
AlCl3 + Cl– → [AlCl4]–
उत्तर:
AlCl3 में, केन्द्रीय Al परमाणु sp² संकरित होता है। जबकि [AlCl4]– आयन में यह sp³ संकरित होता है।
AlCl3 में संकरण = 3 + 3 × 7 = \(\frac { 24 }{ 8 }\) = 3 (sp² संकरण)
[AlCl4] में संकरण = 3 + 4 × 7 + 1
= \(\frac { 32 }{ 8 }\) = 4 (sp³ संकरण)
प्रश्न 26.
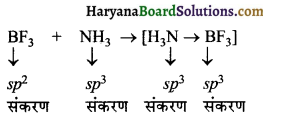
क्या निम्नलिखित अभिक्रिया के फलस्वरूप B और N परमाणुओं के संकरण में कोई परिवर्तन होता है?
BF3 + NH3 → [F3B.NH3]
उत्तर:
BF3 में B परमाणु sp² संकरित होता है जबकि NH3 में N परमाणु sp³ संकरित होता है | BF3 तथा NH, दोनों ही आपस में संयोग करके योगात्मक यौगिक बनाते हैं। योगात्मक यौगिक में NH3 एक इलेक्ट्रॉन युग्म BF3 को देता है, इस प्रकार B परमाणु का संकरण sp² से sp³ में परिवर्तित हो जाता है। जबकि N परमाणु के संकरण में कोई अन्तर नहीं होता है।
प्रश्न 27.
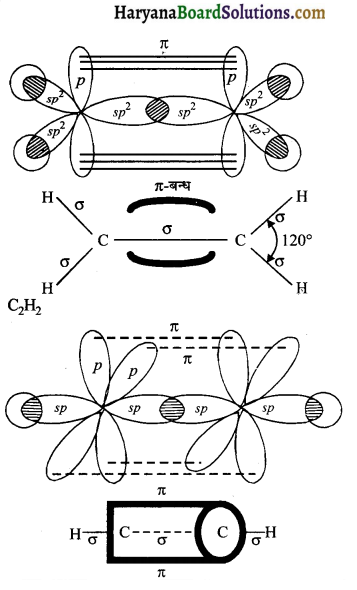
C2H4 तथा C2H4 अणुओं में कार्बन परमाणुओं के बीच क्रमशः द्वि-आबन्ध तथा त्रिआबन्ध के निर्माण को चित्र द्वारा स्पष्ट कीजिए।
उत्तर:
C2H4
प्रश्न 28.
निम्नलिखित अणुओं में सिग्मा (σ) तथा पाई (π) आबन्धों की कुल संख्या कितनी है-
(क) C2H2
(ख) C2H4
उत्तर:
(क) C2H2
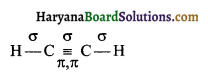
कुल तीन सिग्मा (σ) तथा दो पाई (π) बन्ध यहाँ उपस्थित हैं।
(ख) C2H4
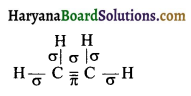
यहाँ कुल 5 सिग्मा (σ) तथा 1 पाई (π) बन्ध उपस्थित हैं।
प्रश्न 29.
X- अक्ष को अन्तरनाभिकीय अक्ष मानते हुए बताइए कि निम्नलिखित में कौन से कक्षक सिग्मा (σ) आबन्ध नहीं बनाएँगे और क्यों? (क) 1s तथा 1s (ख) 1s तथा 2px (ग) 2py तथा 2py (घ) 1s तथा 2s.
उत्तर:
(क) 1s तथा 1s
(ख) 1s तथा 2px
(घ) 1s तथा 2s, σ आबन्ध बनाएँगे क्योंकि ये अक्षीय अतिव्यापन से बनते हैं। परन्तु
(ग) 2py तथा 2py सिग्मा आबन्ध नहीं बनायेगा।
प्रश्न 30.
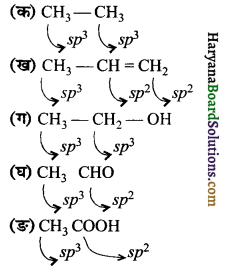
निम्नलिखित अणुओं में कार्बन परमाणु कौन-से संकर कक्षक प्रयुक्त करते हैं।
(क) CH3 – CH3
(ख) CH3CH=CH3
(ग) CH3-CH2-OH
(घ) CH3CHO
(ङ) CH3COOH
उत्तर:
इन अणुओं में कार्बन परमाणुओं द्वारा प्रयुक्त संकर कक्षक इस प्रकार हैं –
प्रश्न 31.
इलेक्ट्रॉनों के आबन्धी युग्म तथा एकाकी युग्म से आप क्या समझते हैं। प्रत्येक को एक उदाहरण द्वारा समझाइए।
उत्तर:
आबन्धी युग्म (Bond pair) तत्वों के परमाणुओं के मध्य उपस्थित इलेक्ट्रॉन का साझा युग्म आबन्धी युग्म कहलाता है।
एकाकी युग्म (Lone pair) – ये इलेक्ट्रॉन युग्म बन्ध निर्माण में प्रयुक्त नहीं होते हैं। उदाहरणार्थ – NH3

प्रश्न 32.
सिग्मा तथा पाई आबन्ध में अन्तर स्पष्ट कीजिए।
उत्तर:
| सिग्मा बन्ध | पाई बन्ध |
| (1) सिग्मा आबन्ध परमाण्विक कक्षकों के अक्ष्रीय अतिव्यापन के कारण बनता है। | (1) पाई आबन्ध परमाण्विक कक्षकों वे पाशर्व अतिव्यापन के कारण बनता है। |
| (2) यह s-s, s-p, p-p इत्यादि के अतिव्यापन द्वारा बन सकता है। | (2) यह केवल p-कक्षकों के अतिव्यापन से बनता है। |
| (3) इस प्रकार के आबन्ध में अतिव्यापन अधिक होने के कारण आबन्ध प्रबल होता है। | (3) इस प्रकार के आबन्ध में अतिव्यापन कम होता है। अतः यह आबन्ध तुलनात्मक रूप से थोड़ा दुर्बल होता है। |
| (4) इसमें कोई भी नोडल तल नहीं होता है। | (4) इसमें एक नोडल तल पाया जाता है। |
| (5) σ-आबन्ध के चारों ओर परमाणुओं का मुक्त घूर्णन सम्भव होता है। | (5) π-आबन्ध के चारों ओर परमाणुओं का मुक्त घूर्णन सम्भव नहीं हैं। |
| (6) यह कम क्रियाशील होता है। | (6) यह अधिक क्रियाशील होता है। |
| (7) अन्तरानाभिकीय अक्ष के चारों ओर आण्विक कक्षक का इलेक्ट्रॉन अभ्र सममित होता है। | (7) इलेक्ट्रॉन अभ्र असममित होता है। |
| (8) यह आबन्ध π-आबन्ध की अनुपस्थिति में भी बन सकता है। | (8) यह आबन्ध σ आबन्ध की अनुपस्थिति में नहीं बनता है। |
| (9) यह अणु की आकृति निर्धारित करता है। | (9) इसका अणुओं की आकृति पर कोई प्रभाव नहीं होता। यह बन्ध कोण को प्रभावित करता है। |
प्रश्न 33.
संयोजकता आबन्ध सिद्धान्त के आधार पर H2 अणु के विरचन की व्याख्या कीजिये।
उत्तर:
संयोजकता आबन्ध सिद्धान्त:
इस सिद्धान्त का प्रतिपादन सर्वप्रथम हाइटलर और लण्डन (Heitler and London) ने सन् 1927 में किया था। बाद में इस सिद्धान्त का संशोधन पॉलिंग और उसके सहकर्मियों (Pauling and co-workers) ने किया था।
इस सिद्धान्त का विवेचन परमाणु कक्षकों, तत्वों के इलेक्ट्रॉनिक विन्यास, कक्षकों के अतिव्यापन और संकरण तथा विचरण (Variation) एवं अध्यारोपण (Superposition) के सिद्धान्तों के ज्ञान पर आधारित है। इस सिद्धान्त के आधार पर हाइड्रोजन अणु के निर्माण की व्याख्या इस प्रकार है।
माना कि हाइड्रोजन के दो परमाणु A व B जिनके नाभिक क्रमशः NA व NB हैं तथा इनमें उपस्थित इलेक्ट्रॉन eA और और हैं। जब ये दोनों हाइड्रोजन परमाणु HA तथा HB एक दूसरे की तरफ बन्ध बनाने के लिए बढ़ते हैं तो इन पर आकर्षण व प्रतिकर्षण दोनों प्रकार के बल कार्य करते हैं।
जब ये दोनों परमाणु एक-दूसरे से अत्यधिक दूरी पर होते हैं तब उनके बीच कोई भी अन्योन्य क्रिया नहीं होती है ज्यों-ज्यों वे एक-दूसरे के समीप आते जाते हैं त्यों-त्यों उनके मध्य आकर्षण व प्रतिकर्षण बल कार्य करने लगता है।
दोनों परमाणुओं के मध्य लगने वाला आकर्षण बल निम्न प्रकार उत्पन्न होता है-
- एक परमाणु के नाभिक तथा उसके इलेक्ट्रॉनों के मध्य NA– eA, NB – eB
- एक परमाणु के नाभिक तथा दूसरे परमाणु के इलेक्ट्रॉनों के मध्य NA – eB, NB – eA
इसी प्रकार प्रतिकर्षण बल निम्न कारण से उत्पन्न होता है।
(1) दोनों परमाणुओं के इलेक्ट्रॉनों के बीच eA – eB
(2) दोनों परमाणुओं के नाभिकों के बीच NA – NB
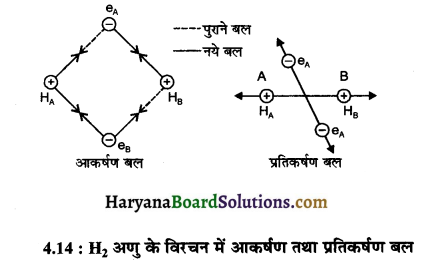
दोनों परमाणुओं के मध्य उत्पन्न आकर्षण बल दोनों को एक-दूसरे के पास लाते हैं। जबकि प्रतिकर्षण बल एक-दूसरे को दूर करने का प्रयास करते हैं। प्रयोग के द्वारा यह पाया गया है कि हाइड्रोजन अणु के बनने के दौरान नये आकर्षण बलों के मान, नये प्रतिकर्षण बलों के मान की तुलना में अधिक होते हैं। इसके परिणामस्वरूप दोनों परमाणु एक-दूसरे के करीब आने लगते हैं। इससे उनकी स्थितिज ऊर्जा के मान में कमी आ जाती है।
अंत में एक ऐसी स्थिति आ जाती है कि कुल आकर्षण बल तथा कुल प्रतिकर्षण बल आपस में बराबर हो जाते हैं और निकाय की ऊर्जा निम्न स्तर पर पहुँच जाती है।
इस अवस्था में हाइड्रोजन के परमाणु आबन्ध बनाते हैं और एक स्थायी अ में परिवर्तित हो जाते हैं। यहाँ H2 अणु की आबन्ध लम्बाई का मान 74pm होता है।
हाइड्रोजन के परमाणुओं के मध्य आबन्ध बनने से ऊर्जा मुक्त होती है। इस कारण हाइड्रोजन अणु दो पृथक हाइड्रोजन परमाणुओं की अपेक्षा अधिक स्थायी होता है। इस प्रक्रिया के दौरान मुक्त हुयी ऊर्जा को आबन्ध एन्थैल्पी (Bond enthalpy) के रूप में जाना जाता है।
हाइड्रोजन परमाणुओं से हाइड्रोजन अणु बनने का क्रम निम्न ग्राफ के द्वारा प्रदर्शित कर सकते हैं।
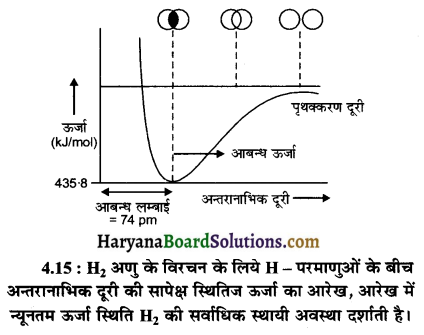
H2 अणु के सम्बन्ध में आरेख से यह निष्कर्ष निकलता है कि इसकी आबन्ध लम्बाई 74 pm तथा आबन्धन ऊर्जा का मान 435.8kJ/mol है। यह ऊर्जा या ऐन्थैल्पी ऊपर दिए गये आरेख में न्यूनतम के संगत होती है।
वहीं यदि H2 के एक मोल अणुओं के वियोजन के लिये इतनी ही ऊर्जा 435.8 kJ /mol की आवश्यकता होती है।
H2 (g) + 4358kJ /mol = H (g) + H (g)
ध्यान देने योग्य बात यह है कि किसी रासायनिक बन्ध का स्थायित्व बन्ध ऊर्जा से सम्बन्धित होता है । बन्ध ऊर्जा का मान जितना अधिक होता है आबन्ध का स्थायित्व उतना ही अधिक होगा।
उदाहरण के लिये, Cl – Cl(g) आबन्ध की आबन्ध ऊर्जा 239 kJ / mol है। जबकि H – H(g) आबन्ध की आबन्ध ऊर्जा 433kJ/mol है। इसका तात्पर्य यह है कि हाइड्रोजन परमाणुओं के मध्य आबन्ध क्लोरीन परमाणुओं के मध्य आबन्ध की अपेक्षा अधिक स्थायी है।
प्रश्न 34.
परमाणु कक्षकों के रैखिक संयोग से आण्विक कक्षक बनने के लिए आवश्यक शर्तों को लिखिए।
उत्तर:
- संयोजी कक्षक समान ऊर्जा के होने चाहिये।
- संयोजक कक्षक आण्विक कक्षक के साथ दिशात्मक गुण रखता है।
- संयोग करने वाले कक्षक अधिक दूरी तक विरचन अतिव्यापन करें।
आण्विक कक्षक भाग लेने वाले परमाण्विक कक्षकों के तरंग फलनों (wave functions) के रेखीय संयोजन के फलस्वरूप बनते हैं । परमाण्वीय कक्षक योग (Addition ) या अन्तर (Subtraction) द्वारा संयोजित होते हैं।
माना कि संयोजन में भाग लेने वाले दो परमाण्विक कक्षक A व B के तरंग फलन या आयाम (Wave function or Amplitude) क्रमश: ψA व ψB हैं तो,
गणितीय रूप से आण्विक कक्षकों को परमाणु कक्षकों के रैखिक संयोग व्यक्तिगत परमाणु कक्षकों के तरंग फलनों WA तथा WB के योग या अन्तर द्वारा किया जाता है, जैसा नीचे दर्शाया गया है।
ψMO = ψA ± ψB
इस प्रकार दो आण्विक कक्षक ० तथा * प्राप्त होते हैं।
σ = ψA + ψB
σ* = ψA – ψB
परमाणु कक्षकों के योग से बनने वाले आण्विक कक्षक σ को आबंधन आण्विक कक्षक तथा परमाणु कक्षकों के अन्तर से बनने वाले आण्विक कक्षक σ* को प्रतिआबंधन (विपरीत बन्धी) आण्विक कक्षक कहते हैं।
बन्धी अणु कक्षक की ऊर्जा हमेशा कम जबकि विपरीत बन्धी अणु कक्षक की ऊर्जा सदैव अधिक होती है। आबन्धी तथा विपरीत बन्धी आण्विक कक्षकों का परमाण्वीय कक्षकों से बनना निम्न प्रकार प्रदर्शित किया जा सकता है।
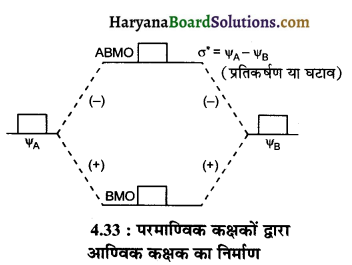
यहाँ पर (+) और (-) चिन्ह इलेक्ट्रॉन तरंग के शिखर (Crest) और गर्त (troughs) को व्यक्त करते हैं।
प्रश्न 35.
आण्विक कक्षक सिद्धान्त के आधार पर समझाइए कि Be2 अणु का अस्तित्व क्यों नहीं होता।
उत्तर:
Be का परमाणु क्रमांक 4 है। इसके आण्विक कक्षक में 8 इलेक्ट्रॉन भरे जाएँगे । इसका आण्विक कक्षक विन्यास निम्न प्रकार है-
KK (σ2s)² (σ*2s)²
आबन्ध कोटि =\(\frac { 1 }{ 2 }\)(2 – 2) = 0
बन्ध कोटि शून्य होने से Be2 का अणु अस्तित्व में नहीं होता है।
![]()
प्रश्न 36.
निम्नलिखित स्पीशीज के आपेक्षिक स्थायित्व की तुलना कीजिए तथा उनके चुम्बकीय गुण इंगित कीजिए।
O2, O2+, O2– (सुपर ऑक्साइड) तथा O22- (परऑक्साइड)
उत्तर:
इन स्पीशीज की आबन्ध कोटि निम्न है।
| स्पीशीज | इलेक्ट्रॉनों की संख्या | आबंध कोटि |
| (1) O2 | 16 | 2.0 |
| (2) O2+ | 15 | 2.5 |
| (3) O2– | 17 | 1.5 |
| (4) O22- | 18 | 1.0 |
इनका स्थायित्व का क्रम निम्न है-
O2+ > O2 > O2– > O22-
(i) O2 अनुचुम्बकीय है
(ii) O2+ अनुचुम्बकीय है
(iii) O2– अनुचुम्बकीय है
(iv) O22- प्रति चुम्बकीय है
प्रश्न 37.
कक्षकों के निरूपण में उपयुक्त धन (+) तथा ऋण (-) चिन्हों का क्या महत्त्व होता है।
उत्तर:
जब संयोजित होने वाले परमाणु कक्षकों की पालियों के चिन्ह समान (+ तथा + या तथा) होते हैं तब आबन्धी आण्विक कक्षक बनते हैं।
जब संयोजित होने वाले परमाणु कक्षकों की पालियों के चिन्ह (+ तथा -) होते हैं तब प्रतिआबन्धी आण्विक कक्षक बनते हैं। इसके अतिरिक्त + और चिन्ह को इलेक्ट्रॉन तरंगों की प्रकृति ज्ञात करने में उपयोग किया जाता है। धन (+ve) चिन्ह श्रृंग (crest ) को जबकि ऋण (-ve) चिन्ह गर्त (trough) को प्रदर्शित करता है।
प्रश्न 38.
PCl5 अणु में संकरण का वर्णन कीजिए। इसमें अक्षीय आबन्ध विषुवतीय आबन्धों की अपेक्षा अधिक लम्बे क्यों होते हैं?
उत्तर:
PCl5 में P का परमाणु क्रमांक 15 है। तथा इलेक्ट्रॉनिक विन्यास 1s² 2s² 2p6 3s² 3p³ है। यहाँ पर एक 3s कक्षक तीन 3p कक्षक व एक 3d कक्षक के इलेक्ट्रॉन तीन 3p कक्षक व एक 3d कक्षक के इलेक्ट्रॉन संकरण से sp³d संकरित कक्षक बनता है।
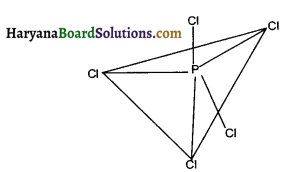
VSEPR सिद्धान्त के अनुसार संकरित आर्बिटल त्रिकोणीय द्वि-पिरामिडी के शीर्षों की ओर दिष्ट होती है। इसके एक तल के तीन-तीन आबन्धों के परस्पर बंध कोण में से प्रत्येक 120° तथा शेष दो में से प्रत्येक उस तल के लम्बवत् 90° का कोण बनाते हैं।
चूँकि अक्षीय आबन्ध इलेक्ट्रॉन युग्मों में विषुवतीय आबन्धी युग्मों से अधिक प्रतिकर्षण अन्योन्य क्रियायें होती है अतः ये आबन्ध विषुवतीय आबन्धों से लम्बाई में कुछ अधिक तथा प्रबलता में कुछ कम होते हैं। इसलिये PCl5 अधिक क्रियाशील है।
प्रश्न 39.
हाइड्रोजन आबन्ध की परिभाषा दीजिए। ये वान डर वाल्स बलों की अपेक्षा प्रबल होते हैं या दुर्बल।
उत्तर:
हाइड्रोजन आबन्ध को उस आकर्षण बल के रूप में परिभाषित कर सकते हैं जोकि एक अणु के H-परमाणु को दूसरे अणु के विद्युत ऋणात्मक परमाणु (F,O,N) से बाँधता है। हाइड्रोजन आबन्ध वान डर वाल्स बलों की अपेक्षा अधिक प्रबल- होता है क्योंकि यह प्रबल द्विध्रुवीय अन्तः क्रिया को निरूपित करता है।
प्रश्न 40.
आबन्ध कोटि से आप क्या समझते हैं। निम्नलिखित आबन्ध कोटि का परिकलन कीजिए – N2, O2, O2+ तथा O2–
उत्तर:
किसी अणु या आयन में दो परमाणुओं के बीच आबन्धों की संख्या आबन्ध कोटि कहलाती है।
आबन्ध कोटि =\(\frac { 1 }{ 2 }\) = (Nb – Na)
N2(14) : (σ1s)²(σ*1s)²(σ2s)²(σ*2s)² (π2px)²(π2py)²(σ2pz)²
आबन्ध कोटि =\(\frac { 1 }{ 2 }\)(10-4) = 6/23 = 3
O2 (16) : (σ 1s)² (σ*1s)² (σ*2s)² (π 2px)² (π 2py)² (π* 2px)1 (π* 2py)1
आबन्ध कोटि = \(\frac { 1 }{ 2 }\)(10 – 6) = 4/2 = 2
O2+(15) : (σ1s)² (σ*1s)² (σ2s)² (σ*2s)² (σ2pz)² (π2px)² (π2py)² (π*2px)1
आबन्ध कोटि = \(\frac { 1 }{ 2 }\)(10 – 5) = 5/2 = 2.5
O2 – ( 17 ) : (σ1s)² (σ*1s)² (σ2s)² (σ*2s)² (σ2pz)² (π2px)² (πpy)² (π 2px)² (π 2py)1
आबन्ध कोटि = 1/2 (10 – 7) = 3/2 = 1.5