HBSE 12th Class Chemistry Important Questions Chapter 7 p-ब्लॉक के तत्व
Haryana State Board HBSE 12th Class Chemistry Important Questions Chapter 7 p-ब्लॉक के तत्व Important Questions and Answers.
Haryana Board 12th Class Chemistry Important Questions Chapter 7 p-ब्लॉक के तत्व
बहुविकल्पीय प्रश्न:
1. PH3 (फॉस्फीन) में फॉस्फोरस परमाणु पर संकरण है-
(अ) sp
(ब) sp2
(स) sp3d
(द) sp3
उत्तर:
(द) sp3
2. ns2np5 बाह्यतम सामान्य विन्यास वाला तत्व है-
(अ) नाइट्रोजन वर्ग का
(ब) ऑक्सीजन वर्ग का
(स) हैलोजन वर्ग का
(द) अक्रिय गैस वर्ग का
उत्तर:
(स) हैलोजन वर्ग का
3. अंतराहैलोजन यौगिक है-
(अ) PCl5
(ब) SF6
(स) ICl
(द) XeF2
उत्तर:
(स) ICl
4. हैलोजनों की क्रियाशीलता का सही क्रम है-
(अ) F2 > Br2 > Cl2 > I2
(ब) F2 > Cl2 > Br2 > I2
(स) I2 > Br2 > Cl2 > F2
(द) F2 = Cl2 > Br2 = I2
उत्तर:
(ब) F2 > Cl2 > Br2 > I2
5. OF2 में ऑक्सीज़न की ऑक्सीकरण अवस्था है-
(अ) -2
(ब) +1
(स) +2
(द) -1
उत्तर:
(स) +2
6. अभिक्रिया 2SO2 + O2 → 2SO3 + x k.cal में अधिक मात्रा में उत्पाद बनाने के लिए अनुकूल शर्तें हैं-
(अ) कम ताप एवं कम दाब
(ब) कम दाब एवं अधिक ताप
(स) कम ताप एवं अधिक दाब
(द) अधिक ताप, अधिक दाब तथा O2 की कम मात्रा
उत्तर:
(स) कम ताप एवं अधिक दाब
![]()
7. वर्ग 16 के तत्व कहलाते हैं-
(अ) हैलोजन
(ब) कैल्कोजन
(स) संक्रमण तत्व
(द) उत्कृष्ट गैसें
उत्तर:
(ब) कैल्कोजन
8. सल्फर की अधिकतम सहसंयोजकता कितनी हो सकती है?
(अ) 2
(ब) 4
(स) 6
(द) 8
उत्तर:
(स) 6
9. निम्नलिखित में से कौनसा तत्व +3 ऑक्सीकरण अवस्था में अधिक स्थायी यौगिक बनाता है?
(अ) P
(ब) As
(स) Sb
(द) Bi
उत्तर:
(द) Bi
10. निम्नलिखित में से कौनसा यौगिक चिली साल्ट पीटर या चिली शोरा कहलाता है?
(अ) NaNO3
(ब) KNO3
(स) Na2SO4
(द) K2SO4
उत्तर:
(अ) NaNO3
11. निम्नलिखित में से किस तत्व में अक्रिय युग्म प्रभाव सबसे अधिक प्रभावी होता है?
(अ) N
(ब) P
(स) As
(द) Bi
उत्तर:
(द) Bi
12. निम्नलिखित में से नाइट्रोजन का कौनसा हाइड्राइड अम्लीय है?
(अ) NH3
(ब) N3H
(स) N2H4
(द) N2H2
उत्तर:
(ब) N3H
13. निम्नलिखित में से किसका क्वथनांक न्यूनतम होता है?
(अ) H2O
(ब) H2S
(स) H2Se
(द) H2Te
उत्तर:
(ब) H2S
14. H2SO4 के लिए निम्नलिखित में से कौनसा कथन असत्य है?
(अ) यह एक ऑक्सीकारक है।
(ब) यह निर्जलीकारक है।
(स) यह द्विक्षारकीय अम्ल है।
(द) यह दुर्बल अम्ल है।
उत्तर:
(द) यह दुर्बल अम्ल है।
15. विरंजक के रूप में प्रयुक्त होने वाला हैलोजन है-
(अ) F2
(ब) Cl2
(स) Br2
(द) I2
उत्तर:
(ब) Cl2
16. प्रबलतम अम्ल है-
(अ) HF
(ब) HCl
(स) HBr
(द) HI
उत्तर:
(द) HI
17. HClO है, एक-
(अ) ऑक्साइड
(ब) ऑक्सी अम्ल
(स) क्लोराइड
(द) हाइड्राइड
उत्तर:
(ब) ऑक्सी अम्ल
18. कौनसा तत्व केवल -1 ऑक्सीकरण अवस्था ही दर्शाता है?
(अ) F
(ब) Cl
(स) Br
(द) I
उत्तर:
(अ) F
19. किस तत्व की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिकतम ऋणात्मक होती है?
(अ) F
(ब) Cl
(स) Br
(द) I
उत्तर:
(ब) Cl
20. निम्नलिखित में से कौनसा ऑक्साइड सर्वाधिक अम्लीय है?
(अ) N2O5
(ब) P2O5
(स) As2O5
(द) Sb2O5
उत्तर:
(अ) N2O5
21. XeF2 में Xe पर कितने एकाकी इलेक्ट्रॉन युग्म उपस्थित हैं?
(अ) 2
(ब) 3
(स) 1
(द) 4
उत्तर:
(ब) 3
22. निम्नलिखित में से कौनसा यौगिक नहीं बनता?
(अ) XeF5
(ब) XeF
(स) XeF3
(द) उपर्युक्त सभी
उत्तर:
(द) उपर्युक्त सभी
23. निम्नलिखित में से कौनसा तत्व +1 से +5 सभी ऑक्सीकरण अवस्थाओं में ऑक्साइड बनाता है?
(अ) P
(ब) Sb
(स) N
(द) As
उत्तर:
(स) N
24. XeF3 की जल से क्रिया द्वारा कौनसा यौगिक बनाया जा सकता है?
(अ) XeO3
(ब) XeOF4
(स) XeO2F2
(द) उपर्युक्त सभी
उत्तर:
(द) उपर्युक्त सभी
25. BrF3 की आकृति है-
(अ) त्रिकोणीय समतल
(ब) बेन्ट- T आकृति
(स) पिरैमिडी
(द) वर्गाकार समतलीय
उत्तर:
(ब) बेन्ट- T आकृति
26. निम्नलिखित में से किसकी आकृति रेखीय है?
(अ) SO2
(ब) O3
(स) \(\mathrm{NO}_2^{-}\)
(द) \(\stackrel{+}{\mathrm{N}} \mathrm{O}_2\)
उत्तर:
(द) \(\stackrel{+}{\mathrm{N}} \mathrm{O}_2\)
27. निम्नलिखित में से कौनसा क्रम (उनके साथ दिए गए गुणों के आधार पर) सही नहीं है?
(अ) ऑक्सीकारक गुण F2 > Cl2 > Br2 > I2
(ब) विद्युतत्रणता F > Cl > Br > I
(स) अम्लीय गुण HI > HBr > HCl > HF
(द) बन्ध वियोजन एन्थैल्पी F2 > Cl2 > Br2 > I2
उत्तर:
(द) बन्ध वियोजन एन्थैल्पी F2 > Cl2 > Br2 > I2
28. निम्नलिखित में से किसमें सभी बन्ध समान नहीं हैं?
(अ) XeF4
(ब) SF4
(स) \(\mathrm{BF}_4^{-}\)
(द) SiF4
उत्तर:
(ब) SF4
29. वह यौगिक कौनसा है जो गैस अवस्था में आण्विक प्रकृति रखता है लेकिन ठोस अवस्था में उसमें आयनिक गुण आ जाता है?
(अ) PCl3
(ब) NCl3
(स) POCl3
(द) PCl5
उत्तर:
(द) PCl5
30. H2SO5 में सल्फर की ऑक्सीजन अवस्था है-
(अ) +8
(ब) +4
(स) +6
(द) -2
उत्तर:
(स) +6
![]()
31. कौनसा अम्ल अधिकतम वाष्पशील है?
(अ) HF
(ब) HCl
(स) HBr
(द) HI
उत्तर:
(ब) HCl
32. निम्नलिखित में से किसमें P-O-P बन्ध पाया जाता है?
(अ) H3PO3
(ब) H4P2O6
(स) H4P2O7
(द) H3PO4
उत्तर:
(स) H4P2O7
33. \(\mathrm{NO}_3^{-}\) के परीक्षण में भूरी वलय निम्नलिखित में से किसके बनने के कारण बनता है?
(अ) [Fe(H2O)5.NO]SO4
(ब) [Fe(SO4)2.NO]H2O
(स) Fe2(SO4)3. NO
(द) उपरोक्त में से कोई नहीं
उत्तर:
(अ) [Fe(H2O)5.NO]SO4
34. निम्नलिखित में से कौन-सा कथन असत्य है?
(अ) आवर्त सारणी के वर्ग 15 में हाइड्राइडों का स्थायित्व NH3 से BiH3 तक बढ़ता है।
(ब) नाइट्रोजन dπ-pπ बन्ध नहीं बना सकता।
(स) N-N एकल बन्ध P-P एकल बन्ध की अपेक्षा दुर्बल होता है।
(द) N2O4 की दो अनुनादी संरचनाएँ होती हैं।
उत्तर:
(अ) आवर्त सारणी के वर्ग 15 में हाइड्राइडों का स्थायित्व NH3 से BiH3 तक बढ़ता है।
35. निम्नलिखित में से कौन-सा यौगिक O3 द्वारा ऑक्सीकृत नहीं होता है?
(अ) KI
(ब) FeSO4
(स) K2MnO4
(द) KMnO4
उत्तर:
(द) KMnO4
36. XeF2, XeF4 तथा XeF6 में Xe के एकल इलेक्ट्रॉन युग्मों की संख्या है-
(अ) 3,2,1
(ब) 2,4,6
(स) 1,2,3
(द) 6,4,2
उत्तर:
(अ) 3,2,1
अतिलघूत्तरात्मक प्रश्न:
प्रश्न 1.
वर्ग 15 के तत्वों की सामान्य ऑक्सीकरण अवस्थाएँ बताइए।
उत्तर:
वर्ग 15 के तत्वों की सामान्य ऑक्सीकरण अवस्थाएँ – 3,+ 3 तथा +5 होती हैं।
प्रश्न 2.
नाइट्रोलियम का सूत्र बताइए।
उत्तर:
नाइट्रोलियम का सूत्र Ca CN2 होता है।
प्रश्न 3.
वर्ग 15 के तत्वों के हाइड्राइडों में बन्ध कोण का बढ़ता क्रम लिखिए।
उत्तर:
BiH3 < SbH3 < AsH3 < PH3 < NH3
प्रश्न 4.
नाइट्रोजन के उदासीन ऑक्साइड कौनसे होते हैं?
उत्तर:
N2O तथा NO
प्रश्न 5.
वर्ग 15 के तत्वों में कौनसा तत्व मुक्त अवस्था में अधिक मात्रा में पाया जाता है?
उत्तर:
नाइट्रोजन।
प्रश्न 6.
नाइट्रोजन का वह यौगिक कौनसा है जो ऑक्सीकारक, अपचायक दोनों की भाँति व्यवहार करता है?
उत्तर:
नाइट्रस अम्ल (HNO2)।
प्रश्न 7.
किसी एक समीकरण द्वारा नाइट्रिक अम्ल के ऑक्सीकारण गुण को बताइए।
उत्तर:
2HNO3 + 3SO2 + 2H2O → 3H2SO4 + 2NO
प्रश्न 8.
H3PO3 में π बन्ध की प्रकृति HNO3 के π बन्ध से किस प्रकार भिन्न है?
उत्तर:
H3PO3 में π बन्ध p-p समपाश्रिक अतिव्यापन से बनता है जबकि H3PO3 में d कक्षकों के प्रयोग से pπ-dπ अतिव्यापन होता है।
प्रश्न 9.
सान्द्र HNO3 को ऐलुमिनियम तथा क्रोमियम के पात्र में रखा जा सकता है, क्यों?
उत्तर:
ऐलुमिनियम तथा क्रोमियम धातुएँ सान्द्र HNO3 में विलेय नहीं होतीं क्योंकि इनकी सतह पर ऑक्साइड की एक निष्क्रिय परत बन जाती है अतः सान्द्र HNO3 को ऐलुमिनियम तथा क्रोमियम के पात्र में रखा जा सकता है।
प्रश्न 10.
सूर्य के प्रकाश की उपस्थिति में सान्द्र HNO3 रंगहीन न होकर पीला होता है, क्यों?
उत्तर:
सूर्य के प्रकाश में HNO3 का आंशिक विघटन हो जाता है जिससे NO2 गैस बनती है जिसके कारण HNO3 पीलुा होता है।
प्रश्न 11.
वह यौगिक कौनसा है जिससे लाल तथा श्वेत फॉस्फोरस के मिश्रण को पृथक् किया जा सकता है तथा क्यों?
उत्तर:
NaOH, लाल फॉस्फोरस से क्रिया नहीं करता जबकि श्वेत फॉस्फोरस, NaOH से क्रिया करके विलेय NaH2PO2 बनाता है अत: NaOH द्वारा लाल तथा श्वेत फॉस्फोरस के मिश्रण को पृथक् किया जा सकता है।
प्रश्न 12.
नाइट्रोजन के विभिन्न ऑक्सो अम्लों के नाम तथा सूत्र बताइए।
उत्तर:
- हाइपोनाइट्रस अम्ल (H2N2O2)
- नाइट्रस अम्ल (HNO2)
- नाइट्रिक अम्ल (HNO3)
प्रश्न 13.
फॉस्फोरस का कौनसा अपररूप विद्युत का चालक होता है?
उत्तर:
काला फॉस्फोरस।
प्रश्न 14.
ऐसे यौगिक बताइए जिनमें ऑक्सीजन की ऑक्सीकरण अवस्था क्रमशः +2, -1 तथा –\(\frac { 1 }{ 2 }\) हो।
उत्तर:
OF2 (+ 2), H2O2(- 1) तथा KO2 (-\(\frac { 1 }{ 2 }\))
प्रश्न 15.
सल्फर का एक यौगिक बताइए जिसे रसायनों का राजा कहा जाता है।
उत्तर:
सल्फ्यूरिक अम्ल (H2SO4) |
प्रश्न 16.
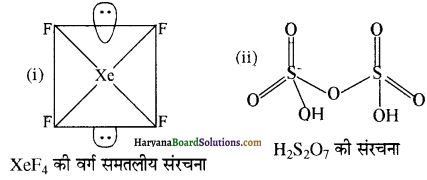
H2S2O7 (पायरो सल्फ्यूरिक अम्ल) की संरचना लिखिए।
उत्तर:
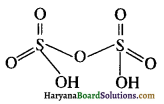
प्रश्न 17.
SO2 के अपचायक गुण को दर्शाने वाला एक समीकरण दीजिए।
उत्तर:
2Fe3+ + SO2 + 2H2O → 2Fe2+ + \(\mathrm{SO}_4^{2-}\) + \(4 \stackrel{+}{\mathrm{H}}\)
प्रश्न 18.
सल्फर के कौनसे दो ऑक्सो अम्लों में परऑक्साइड (-O-O-) बन्ध पाया जाता है?
उत्तर:
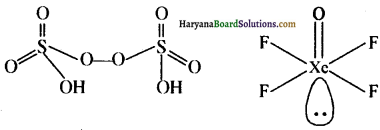
H2SO5 तथा H2S2O8
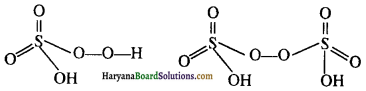
प्रश्न 19.
H2SO5 तथा H2S2O8 में सल्फर की ऑक्सीकरण अवस्था बताइए।
उत्तर:
इनमें पराक्साइड बन्ध होने के कारण सल्फर की ऑक्सीकरण अवस्था +6 होती है।
प्रश्न 20.
H2SO5 तथा H2S2O8 के विशिष्ट नाम बताइए।
उत्तर:
H2SO5 को कैरो अम्ल तथा H2S2O8 को मार्शल अम्ल कहा जाता है।
प्रश्न 21.
वर्ग 16 का वह हाइड्राइड कौनसा होता है जो रंगहीन, गंधहीन द्रव है तथा जीवन के लिए अतिआवश्यक होता है।
उत्तर:
जल (H2O)।
प्रश्न 22.
सान्द्र सल्फ्यूरिक अम्ल की श्यानता तथा क्वथनांक अधिक होते हैं, क्यों?
उत्तर:
H2SO4 के अधिक अणुभार तथा इसके अणुओं के मध्य पाए जाने वाले प्रबल अन्तराअणुक हाइड्रोजन बन्ध के कारण इसकी श्यानता तथा क्वथनांक अधिक होते हैं।
प्रश्न 23. निम्नलिखित ऑक्साइडों की प्रकृति बताइए-
(i) Al2O3
(ii) K2O
(iii) CO
(iv) P2O5
उत्तर:
(i) Al2O3 उभयधर्मी
(ii) K2O क्षारीय
(iii) CO उदासीन
(iv) P2O5 अम्लीय
प्रश्न 24.
गंधक का वह यौगिक कौनसा है जो ऑक्सीकारक तथा अपचायक दोनों की तरह व्यवहार करता है?
उत्तर:
सल्फर डाइऑक्साइड (SO2) |
प्रश्न 25.
निम्नलिखित यौगिकों के विशिष्ट नाम बताइए-
(i) H2SO4
(ii) FeS2
(iii) FeSO2. 7H2O
उत्तर:
(i) कसीस का तेल (ऑयल ऑफ विट्रियॉल )
(ii) मूर्खों का सोना (फूल्स गोल्ड)
(iii) हरा कसीस।
प्रश्न 26.
SO2 के प्रतिक्लोर गुण को दर्शाने वाला समीकरण लिखिए।
उत्तर:
Cl2 + SO2 + 2H2O → 2HCl + H2SO4
प्रश्न 27.
SF6, SeF6 तथा TeF6 की क्रियाशीलता का क्रम बताइए।
उत्तर:
SF6, < SeF6 < TeF6
प्रश्न 28.
वर्ग 16 के तत्वों की आयनन एन्थैल्पी का मान वर्ग 15 के संगत तत्वों की आयनन एन्थैल्पी से कम होता है, इसका क्या कारण है?
उत्तर:
वर्ग 15 के तत्वों का अर्धपूरित स्थायी विन्यास (ns2np3) होता है अतः उनमें से इलेक्ट्रॉन निकालना अधिक मुश्किल होता है।
प्रश्न 29.
HF, HCl, HBr तथा HI के क्वथनांक का बढ़ता क्रम लिखिए।
उत्तर:
HCl < HBr < HI < HF
प्रश्न 30.
क्लोरीन की गर्म तथा सान्द्र NaOH के साथ अभिक्रिया का समीकरण लिखिए।
उत्तर:
![]()
प्रश्न 31.
CIF5 में क्लोरीन पर संकरण बताइए।
उत्तर:
sp3d2
प्रश्न 32.
F2, Cl2, Br2 तथा I2 की बन्ध वियोजन एन्थैल्पी का घटता क्रम बताइए।
उत्तर:
CI-CI > Br-Br > F-F > I-I
![]()
प्रश्न 33.
फ्लुओरीन के अन्तराहैलोजन यौगिकों की संख्या सबसे अधिक होती है, क्यों?
उत्तर:
फ्लुओरीन के छोटे आकार, उच्च विद्युतत्तणता तथा प्रबल ऑक्सीकारक गुण के कारण इसके अन्तराहैलोजन यौगिकों की संख्या सबसे अधिक होती, है।
प्रश्न 34.
अश्रु गैस के रूप में प्रयुक्त होने वाले एक यौगिक का नाम बताइए जिसमें हैलोजन होता है।
उत्तर:
प्रश्न 35.
क्लोरीन का विरंजक गुण इसके किस गुण के कारण होता है?
उत्तर:
ऑक्सीकारक गुण।
प्रश्न 36.
हैलोजनों के ऑक्सीकारक गुण का क्रम बताइए।
उत्तर:
F2 > Cl2 > Br2 > I2
प्रश्न 37.
वह हैलोजन कौनसा होता है जिसमें ऊध्र्वपातन का गुण पाया जाता है?
उत्तर:
आयोडीन (I2) ।
प्रश्न 38.
फ्लुओरीन केवल -1 ऑक्सीकरण अवस्था ही दर्शाती है। इसका कारण बताइए।
उत्तर:
अधिक विद्युतत्रणता तथा d कक्षकों की अनुपस्थिति।
प्रश्न 39.
\(\mathrm{ClO}_4^{-}\) में Cl पर कौनसा संकरण होता है?
उत्तर:

प्रश्न 40.
जीनॉन, केवल फ्लुओरीन तथा ऑक्सीजन के साथ ही यौगिक बनाती है, क्यों?
उत्तर:
फ्लुओरोन तथा ऑक्सीजन की विद्युत्तरणता अधिक होने के कारण इनमें ऑक्सीकारक गुण पाया जाता है, अतः जीनॉन इनके साथ ही यौगिक बनाती है।
प्रश्न 41.
न्यूनतम क्वथनांक वाली उत्कृष्ट गैस कौनसी होती है?
उत्तर:
हीलियम (He)।
प्रश्न 42.
He को p-ब्लॉक में रखा गया है जबकि इसमें इलेक्ट्रॉन p-कक्षक में नहीं भरे जाते, क्यों?
उत्तर:
He के गुणों के आधार पर इसे अन्य उत्कृष्ट गैसों के साथ p-ब्लॉक में रखा गया है।
प्रश्न 43.
आवर्त सारणी में He की आयनन एन्थैल्पी अधिकतम होती है। क्यों?
उत्तर:
He के छोटे आकार तथा पूर्ण पूरित विन्यास के कारण इसकी इलेक्ट्रॉन त्यागने की प्रवृत्ति नगण्य होती है अतः इसकी आयनन एन्थैल्पी अधिकतम होती है।
प्रश्न 44.
जीनॉन के फ्लुओराइडों के स्थायित्व का क्रम लिखिए।
उत्तर:
XeF2 > XeF4 > XeF6
प्रश्न 45.
XeO3 की संरचना बताइए।
उत्तर:
XeO3 में sp3 संकरण होता है तथा इसकी ज्यामिति पिंरैमिडी होती है।
प्रश्न 46.
H2SO4 में S की संकरण अवस्था बताइए।
उत्तर:
sp3 संकरण।
प्रश्न 47.
निम्नलिखित में से कौनसे यौगिक ज्ञात नहीं हैं?
BiCl5, PCl3, SbCl3, NCl5, PCl5
उत्तर:
NCl5 तथा BiCl5
लघूत्तरात्मक प्रश्न:
प्रश्न 1.
अमोनिया की FeCl3 तथा ZnSO4 के साथ अभिक्रियाओं की व्याख्या कीजिए।
उत्तर:
रासायनिक गुण:
(i) अम्लों से क्रिया-अमोनिया की अम्लों से क्रिया कराने पर अमोनियम लवण बनते हैं। इससे इसकी दुर्बल क्षारीय प्रकृति की पुष्टि होती है।
NH3 + HCl → NH4Cl (अमोनियम क्लोराइड)
2NH3 + H2SO4 → (NH4)2SO4 (अमोनियम सल्फेट)
प्रश्न 2.
Cu2+ तथा Ag+ आयनों की NH3 द्वारा पहचान की व्याख्या कीजिए।
उत्तर:
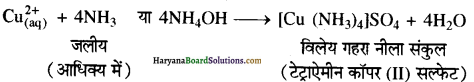
Cu2+ तथा Ag+ आयन, NH3 के साथ उपसहसंयोजी बन्ध बनाकर संकुल बना लेते हैं जिनमें NH3 धातु आयन को एकाकी इलेक्ट्रॉन युग्म प्रदान करता है (लुइस क्षार)। इन संकुल यौगिकों से ही आयनों की पहचान की जाती है। जैसे Cu+2, NH3 के साथ गहरा नीला संकुल बनाता है जबकि NH3 विलयन में AgCl का अवक्षेप विलेय हो जाता है।

प्रश्न 3.
नाइट्रोजन के विभिन्न ऑक्साइडों को कैसे बनाया जाता है? केवल अभिक्रियाएँ लिखिए।
उत्तर:
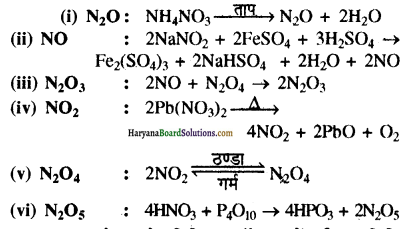
प्रश्न 4.
नाइट्रोजन के विभिन्न ऑक्साइडों की उ्यामिति बताइए।
उत्तर:
नाइट्रोजन के विभिन्न औक्साइड N2O, NO, N2O3, NO2, N2O4 तथा N2O5 होते हैं। N2O, N2O3, NO2, N2O4 तथा N2O5 की ज्यामिति क्रमशः रेखीय, समतलीय, कोणीय तथा समतलीय होती हैं।
प्रश्न 5.
अमोनिया से नमी को दूर करने के लिए निर्जल CaCl2 या P4O10 या सान्द्र H2SO4 प्रयुक्त नहीं किए जाते। क्यों?
उत्तर:
NH3 क्षारीय होती है अतः अम्लीय प्रकृति के निर्जलीकारक (जैसे P4O10 या सान्द्र H2SO4) इसमें से नमी को दूर करने के लिए प्रयुक्त नहीं किए जा सकते क्योंकि ये NH3 से क्रिया करके लवण बना लेते हैं तथा CaCl2, NH3 के साथ क्रिया करके योगोत्पाद बनाता है।
प्रश्न 6.
वर्ग 15 क एक तत्व का हाइड्राइड (Y) का जलीय विलयन (i) लाल लिटमस को नीला करता है। (ii) CuSO4 विलयन के साथ आधिक्य में प्रयुक्त करने पर गहरा नीला विलयन देता है तथा (iii) FeCl3 विलयन के साथ भूरा अवक्षेप देता है तो यौगिक Y तथा अभिक्रिया (ii) एवं (iii) के उत्पाद बताइए।
उत्तर:
(i) यौगिक Y, NH3 है जिसका जलीय विलयन (NH4 OH) क्षारीय होता है अंतः यह लाल लिटमस को नीला करता है। अभिक्रिया (ii) में प्राप्त उत्पाद [Cu(NH3 )4 ]SO4 तथा अभिक्रिया (iii) का उत्पाद Fe(OH)3 होता है।
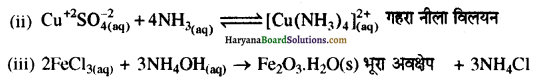
प्रश्न 7.
श्वेत फॉस्फोरस की निम्नलिखित के साथ क्रियाओं के समीकरण दीजिए-
(i) वायु
(ii) HNO3
(iii) H2SO4
(iv) NaOH
(v) Ca
उत्तर:
(i) P4 + 5O2 → P4O10 (फॉस्फोरस पेन्य ऑक्साइड)
(ii) P4 + 2oHNO3 → 4H3PO4 + 2oNO2 + 4H2O
(iii) P4 + 10H2SO4 → 4H3PO4 + 10SO2 + 4H2O
(iv) P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 (सोडियम हाइपोफॉस्फाइट)
(v) P4 + 6Ca → 2Ca3P2 (कैल्सियम फॉस्फाइड)
![]()
प्रश्न 8.
फॉस्फीन की निम्नलिखित के साथ अभिक्रिया बताइए-
(i) ऑक्सीजन
(ii) सान्द्र HNO3
(iii) कॉपर सल्फेट तथा मरक्यूरिक क्लोराइड।
उत्तर:
(i) ऑक्सीजन से क्रिया- PH3 की वायु के साथ क्रिया होने पर P2O5 बनता है।
2PH3 + 4O2 → P2O5 + 3H2O
(ii) सान्द्र HNO3 द्वारा PH3 का ऑक्सीकरण हो जाता है तथा P2O5 बनता है।
2PH3 + 16HNO3 → P2O5 + 16NO2 + 11H2O
(iii) कॉपर सल्फेट तथा मरक्यूरिक क्लोराइड, फॉस्फीन के साथ क्रिया करके संगत फॉस्फाइड बनाते हैं।
3CuSO4 + 2PH3 → Cu3P2 + 3H2SO4
3HgCl2 + 2PH3 → Hg3P2 + 6HCl
प्रश्न 9.
PCl3 तथा PCl5 की निम्नलिखित के साथ अभिक्रियाओं की तुलना कीजिए-
(i) C3H3OH
(ii) CH3COOH
उत्तर:
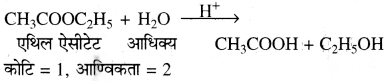
(i) C2H5OH के साथ PCl3 तथा PCl5 दोनों की क्रिया से ही मुख्य उत्पाद C5H5Cl बनता है लेकिन इसके साथ ही PCl3 द्वारा H3PO3 तथा PCl5 द्वारा POCl3 एवं HCl बनते हैं।
3C2H5OH + PCl3 → 2C2H5Cl + H3PO3
C2H5OH + PCl5 → C2H5Cl + HCl + POCl3
(ii) CH3COOH की PCl3 तथा PCl5 के साथ क्रिया द्वारा CH3COCl बनता है तथा सहउत्पाद C2H5OH के साथ क्रिया के समान ही होते हैं।
3CH3COOH + PCl3 → 3CH3COCl + H3PO3
CH3COOH + PCl5 → CH3COCl + POCl3 + HCl
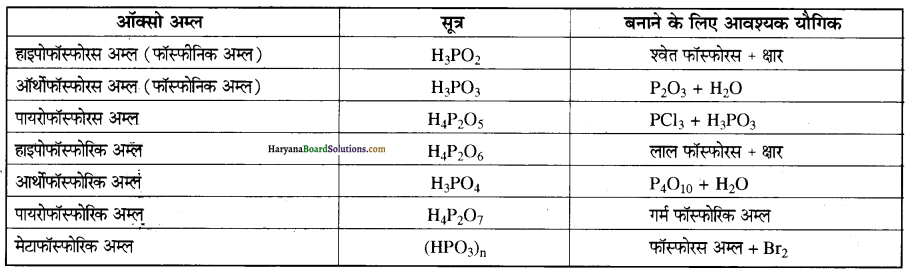
प्रश्न 10.
फॉस्फोरस के विभिन्न ऑक्सो अम्लों को बनाने के . लिए आवश्यक यौगिक बताइए।
उत्तर:
फॉस्फोरस के विभिन्न ऑक्सो अम्लों को बनाने के लिए आवश्यक यौगिक निम्नलिखित हैं-
प्रश्न 11.
(a) ठोस अवस्था में PCl5 किस रूप में पाया जाता है?
(b) H3PO2, H3PO3 तथा H3PO4 तीनों में ही हाइड्रोजन परमाणुओं की संख्या समान है फिर भी इनकी क्षारकता क्रमश: 1 , 2 तथा 3 है। क्यों?
उत्तर:
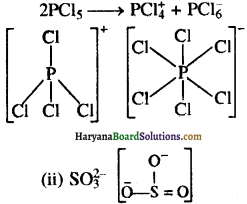
(a) ठोस अवस्था में PCl5 एक आयनिक ठोस [PCl4]+[PCl6]– के रूप में पाया जाता है, जिसमें धनायन [PCl4+] चतुष्फलकीय होता है तथा ऋणायन [PCl6]– अष्टफलकीय होता है जिनमें क्रमशः sp3 तथा sp3d2 संकरण होता है।
(b) फॉस्फोरस के ऑक्सो अम्लों में केवल वे ही हाइड्रोजन आयनित होकर H+ देते हैं जो ऑक्सीजन से जुड़े होते हैं अतः H3PO2, H3PO3 तथा H3PO4 की क्षारकता क्रमशः 1, 2 तथा 3 है क्योंकि इनमें क्रमशः एक, दो तथा तीन -OH बन्ध पाए जाते हैं।
प्रश्न 12.
SO2 के अम्लीय गुण की व्याख्या कीजिए।
उत्तर:
अम्लीय गुण:
SO2 गैस जल में विलेय होकर H2SO3 (सल्फ्यूरस अम्ल) बनाती है अतः इसे सल्फ्यूरस एन्हाइड्राइड भी कहते हैं। यह विलयन नीले लिटमस को लाल कर देता है।
![]()
यह सोडियम हाइड्रॉक्साइड विलयन के साथ अभिक्रिया कर सोडियम सल्फाइट बनाती है जो कि सल्फरडाइऑक्साइड के आधिक्य के साथ अभिक्रिया कर सोडियम हाइड्रोजन सल्फाइट में परिवर्तित हो जाता है।
2NaOH + SO2 → Na2SO2 + H2O
Na2 SO3 + H2O + SO2 → 2NaHSO3
प्रश्न 13.
सल्फर डाइऑक्साइड के अपचायक गुण का वर्णन कीजिए।
उत्तर:
अपचायक गुण-नमी की उपस्थिति में SO2 अपचायक की भाँति व्यवहार करती है।
उदाहरण-(a) यह अम्लीय पोटेशियम परमैंगनेट विलयन (गुलाबी) को रंगहीन कर देती है। इस अभिक्रिया से SO2 गैस का परीक्षण किया जा सकता है।
5SO2 + \(\begin{gathered} 2 \mathrm{MnO}_4^{-} \\ +7 \end{gathered}\) + 2H2O → 2Mn2+ + \(5 \mathrm{SO}_4^{2-}\) + 4H+
(b) यह अम्लीय पोटैशियम डाइक्रोमेट विलयन (नारंगी) को हरा कर देती है।
\(\mathrm{Cr}_2 \mathrm{O}_7^{2-}\) + 3SO2 + 2H+ → 2Cr3+ + \(3 \mathrm{SO}_4^{2-}\) + H2O
(c) सल्फरडाइऑक्साइड, Fe(III) को Fe(II) में अपचयित कर देती है।
2Fe3+ + SO2 + 2H2O → 2Fe2+ + \(\mathrm{SO}_4^{2-}\) + 4H+
(d) सल्फर डाइऑक्साइड हैलोजनों को हैलोजन अम्लों में परिवर्तित कर देती है।
Cl2 + SO2 + 2H2O → 2HCl + H2SO4
इस अभिक्रिया में क्लोरीन का गुण नष्ट हो रहा है अतः SO2 को प्रतिक्लोर (Antichlor) के रूप में प्रयुक्त किया जाता है।
प्रश्न 14.
नमी की उपस्थिति में SO2 विरंजक का कार्य करती है। इस कथन की व्याख्या उदाहरण सहित कीजिए।
उत्तर:
नमी की उपस्थिति में SO2 रंगीन वनस्पतियों आदि का रंग उड़ा देती है। यहाँ भी यह अपचायक का ही कार्य करती है। अतः SO2 को विरंजक के रूप में प्रयुक्त किया जाता है।
SO2 + 2H2O → H2SO4 + 3S
ये हाइड्रोजन परमाणु पदार्थ का विरंजन करते हैं लेकिन यह विरंजन अस्थायी होता है क्योंकि रंगहीन पदार्थ (अपचयित रूप) वायुमण्डल्भिय ऑक्सीजन के सम्पर्क में आते ही ऑक्सीकृत होकर पुनः वास्तविक रूप (रंगीन ) में आ जाता है।
प्रश्न 15.
सान्द्र H2SO4 का तनुकरण करते समय जल में H2SO4 डालना चाहिए न कि H2SO4 में जल। क्यों?
उत्तर:
सांद्र H2SO4 का तनुकरण करते समय H2SO4 की कम मात्रा को धीरे-धीरे जल में डालना चाहिए तथा इसको लगातार हिलाते रहना चाहिए क्योंकि H2SO4 का जल में विलयन बनना उच्च ऊष्माक्षेपी अभिक्रिया है, जिसमें बहुत अधिक मात्रा में ऊष्मा उत्सर्जित होती है। अतः इसका विपरीत अर्थात् H2SO4 में जल मिलाने पर विस्फोट होकर दुर्घटना हो सकती है।
प्रश्न 16.
सल्प्यूरिक अम्ल एक प्रबल अम्ल है तथा यह एक निर्जलीकारक भी होता है, व्याख्या कीजिए।
उत्तर:
सल्फ्यूरिक अम्ल के उपयोग – सल्फ्यूरिक अम्ल एक बहुत महत्वपूर्ण औद्योगिक रसायन होता है। इसके मुख्य उपयोग निम्नलिखित हैं-
- उर्वरकों के उत्पादन में (जैसे अमोनियम सल्फेट, सुपर फॉस्फेट );
- पेट्रोलियम के शुद्धिकरण में;
- अपमार्जक उद्योग में;
- संचायक बैटरियों में;
- प्रयोगशाला में महत्त्वपूर्ण अभिकर्मक के रूप में;
- वर्णकों, प्रलेपों (Paints) तथा रंजकों के मध्यवर्तियों के उत्पादन में;
- धातुकर्म में इनेमलन (enameling), वैद्युतलेपन एवं यशदलेपन (Galvanisation) प्रक्रमों से पहले धातुओं के शोधन में;
- नाइट्रोसेलुलोज उत्पादों के निर्माण में।
प्रश्न 17. H2SO4 के ऑक्सीकरण गुण को समझाइए।
उत्तर:
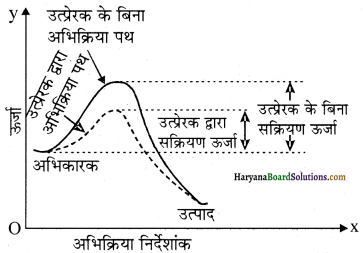
ऑक्सीकारक गुण – सांद्र H2SO4 गरम अवस्था में मध्यम आक्सीकारक होता है। यह धातुओं तथा अधातुओं को आक्सीकृत कर देता है तथा स्वयं SO2 में अपचयित हो जाता है। ऑक्सीकारक गुण में यह H3PO4 तथा HNO3 के बीच का होता है।
![]()
(a) धातुओं से क्रिया-सक्रिय धातुएँ तनु H2SO4 से क्रिया करके H2 गैस देती हैं।
![]()
(b) अधातुओं से क्रिया-सल्फर तथा कार्बन की सान्द्र H2SO4 के साथ क्रिया से संगत ऑक्साइड तथा जल प्राप्त होता है।
3S + H2SO4 (सांद्र) → 3SO2 + 2H2O
C + 2H2SO4 (सांद्र) → CO2 + 2SO2 + 2H2O
प्रश्न 18.
(a) SF6 ज्ञात है जबकि SH6 नहीं, क्यों?
(b) ऑक्सीजन का अणुसूत्र O2 है जबकि सल्फर का S8, क्यों?
उत्तर:
(a) S की उच्चतम ऑक्सीकरण अवस्था (+ 6) उच्च विद्युत ऋणी तत्वों जैसे फ्लुओरीन के साथ संयोग से प्राप्त हो जाती है, अतः SF6 ज्ञात है लेकिन हाइड्रोजन ऐसा नहीं कर सकता अतः SH6 नहीं बनता।
(b) ऑक्सीजन के छोटे परमाणु आकार के कारण इसमें pπ – pπ अतिव्यापन द्वारा यह O2 (O = O) बना लेता है जबकि सल्फर के बड़े आकार के कारण इसमें π बन्ध नहीं बनता अतः इसके परमाणु एकल बन्ध द्वारा जुड़कर S8 बनाते हैं।
प्रश्न 19.
सान्द्र H2SO4 का प्रयोग H2 तथा H2S से नमी हटाने में नहीं किया जाता। इसका कारण बताइए।
उत्तर:
(i) H2SO4 द्वारा नमी के अवशोषण के दौरान बहुत अधिक मात्रा में ऊर्जा उत्पन्न होती है, जिसके कारण हाइड्रोजन गैस जल उठती है अतः H2 के शुष्कन हेतु H2SO4 का प्रयोग नहीं किया जाता।
(ii) जब H2S से नमी के अवशोषण हेतु H2SO4 का प्रयोग करते हैं तो यह H2S का ऑक्सीकरण कर देता है अतः इसे H2S के शुष्कन हेतु भी प्रयोग नहीं किया जाता।
H2S + H2SO4 → H2O + SO2 + S
प्रश्न 20.
(a) O2 अनुचुम्बकीय होती है जबकि O3 प्रतिचुम्बकीय, क्यों?
(b) ओजोन की क्रियाशीलता, ऑक्सीजन से अधिक होती है, इसका कारण दीजिए।
उत्तर:
(a) अणु कक्षक सिद्धान्त (MOT) के अनुसार O2 में दो अयुग्मित इलेक्ट्रॉन पाए जाते हैं अतः यह अनुचुम्बकीय होती है जबकि ओजोन में सभी इलेक्ट्रॉन युग्मित होते हैं अतः यह प्रतिचुम्बकीय होती है।
(b) ओजोन का बनना एक ऊष्माशोषी अभिक्रिया होती है अतः ओजोन का अणु अधिक ऊर्जा युक्त होता है जिसके कारण इसका पुनः वियोजन हो जाता है। इसलिए इसकी क्रियाशीलता अधिक होती है जबकि O2 में O = O के कारण यह अधिक स्थायी होती है अतः इसकी क्रियाशीलता कम होती है।
![]()
प्रश्न 21.
(a) SO2 केवल गीले फूलों का रंग ही उड़ा पाती है, सूखों का नहीं, क्यों?
(b) अधिक भीड़युक्त स्थानों पर ओजोन का प्रयोग किया जाता है, क्यों?
उत्तर:
(a) SO2 का विरंजक गुण क्रियाशील हाइड्रोजन परमाणुओं के कारण होता है, जो केवल नमी की उपस्थिति में ही उत्पन्न होते हैं अतः SO2 केवल गीले फूलों का रंग ही उड़ा पाती है, सूखों का नहीं।
SO2 + 2H2O → H2SO4 + 2H
(b) ओजोन अस्थायी होती है अतः इसके विघटन से O2 प्राप्त हो जाती है इसलिए अधिक भीड़युक्त स्थान जहाँ पर ऑक्सीजन को कमी होती है, उसकी पूर्ति हो जाती है अतः इन स्थानों पर ओजोन का प्रयोग किया जाता है।
प्रश्न 22.
क्लोरीन से निम्नलिखित यौगिक प्राप्त करने के लिए समीकरण लिखिए-
(i) NaOCl
(ii) NaClO3
(iii) विरंजक चूर्ण
(iv) NH4Cl
(v) NCl3 |
उत्तर:
(i) 2NaOH + Cl2 → NaCl + NaOCl + H2O ठण्डा तथा तनु
(ii) 6NaOH + Cl2 → 5NaCl + NaClO3 + 3H2O गर्म तथा सान्द्र
(iii) Ca(OH)2 +2Cl2 → [Ca(OCl)2 + CaCl2 + 2H2O] विरंजक चूर्ण
(iv) 8NH3 + 3Cl2 → 6NH4Cl + N2 अधिक्य
(v) NH3 + 3Cl2 (आधिक्य) → NCl3 + 3HCl
प्रश्न 23.
क्लोरीन के ऑक्सीकारक गुण की व्याख्या कीजिए।
उत्तर:
क्लोरीन बनाने की औद्योगिक विधियाँ-ये विधियाँ निम्नलिखित हैं-
(i) वैद्युतअपघटन-लवण जल (सांद्र NaCl विलयन या ब्राइन ) के वैद्युतअपघटन से क्लोरीन प्राप्त की जाती है। ब्राइन के जलीय विलयन में विद्युत प्रवाहित करने पर ऐनोड पर क्लोरीन प्राप्त होती है। इस प्रक्रम में कास्टिक सोडा (NaOH) का निर्माण भी होता है। अतः क्लोरीन यहाँ अन्य उत्पाद है।
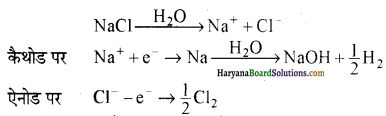
गलित NaCl के वैद्युत अपघटन से कैथोड पर सोडियम तथा ऐनोड पर क्लोरीन प्राप्त होती है।
(ii) डेकॉन विधि – हाइड्रोजन क्लोराइड गैस का CuCl2 उत्प्रेरक की उपस्थिति में 723K ताप पर वायुमंडलीय ऑक्सीजन द्वारा ऑक्सीकरण करने पर क्लोरीन प्राप्त होती है।
प्रश्न 24.
क्लोरीन का विरंजक गुण समझाइए।
उत्तर:
विरंजक गुण-क्लोरीन एक प्रबल विरंजक है। इसकी विरंजन क्रिया ऑक्सीकरण के कारण होती है, जो कि नवजात ऑक्सीजन उत्पन्न करती है।
Cl2 + H2O → 2HCl + [O]
रंगीन पदार्थ + [O] → रंगहीन पदार्थ
क्लोरीन नमी की उपस्थिति में ही वनस्पति अथवा कार्बनिक पदार्थों का विरंजन करती है तथा क्लोरीन का यह विरंजक प्रभाव स्थायी होता है। लेकिन SO2 का विरंजक प्रभाव अस्थायी होता है।
प्रश्न 25.
HCl एक अपचायक है, समझाइए।
उत्तर:
अपचायक गुण – प्रबल ऑक्सीकारकों के साथ क्रिया कराने पर यह अपचायक की तरह व्यवहार करती है। जैसे- MnO2, K2Cr2O2 तथा KMnO4 इत्यादि।
4HCl + MnO2 → MnCl2 + 2H2O + Cl2
14HCl + K2Cr2O7 → 2CrCl3 + 2KCl + 3Cl2 + 7H2O
16HCl + 2KMnO4 → 2MnCl2 + 2KCl + 5Cl2 + 8H2O
प्रश्न 26.
अम्लराज (एक्वारेजिया) कैसे बनाया जाता है? तथा इसके उपयोग भी बताइए।
उत्तर:
सान HCl त्षा यान्द्र HNO3 को 3 : 1 में मिलाने पर एक्यांजिजिया बनता है जिसे घोने तथा प्लेटिनम औैसी उल्क्ष्ट धातुओं को घोलने के लिए प्रयुक्त किया काता है।
Au + 4H+ + \(\mathrm{NO}_3^{-}\) + \(4 \mathrm{Cl}^{-}\) → \(\mathrm{AuCl}_4^{-}\) + NO + 2H2O3Pt + 16H+ + \(4 \mathrm{NO}_3^{-}\) + \(18 \mathrm{Cl}^{-}\) → \(3 \mathrm{PtCl}_6^{2-}\) + 4NO + 8H2O
प्रश्न 27.
इकृष्ट गैसों की द्रव तथा ठोस अवस्था में पाएँ जाने वाले आकर्षण बलों को समझाइए।
उत्तर:
उत्कृष्ट गैसों के परमाणु अधुखीय होते हैं लेकिन यह माना जात है कि इलेक्यान अभक्षे हिचलन से इमें धुवता उत्पन्न हो जती है तबा एक परमायु अन्य पस्मागुओं को भी पुवित कर सेत है। इन ज्ञनणुओं के मध्य उनक्षित आकर्षंग बस, परिशेपग बल या सन्द्न बल कहागता है। यह एक प्रकर का वन्डवल कल है तथा इस्ते के कारण उत्लृष्ट शैसों बदी द्रव तथा वोस अयलक्वा होती है।
प्रश्न 28.
निम्नलिखित अभिक्रियाओं के समीकरण लिखिए-
(i) XeF2 का जल अघघटन
(ii) XeF4 का अषचयन
(iii) XeF2 की PF5 से किया
(iv) XeF4 की SbF5 से लिख्या
(v) XeF6 से NaF से क्रिया।
उत्तर:
(i) 2XCF2(S) + 2H2O(l) → 2Xe(g) + 4HF(aq) + O2(g)
(ii) XeF4 + 2H2 → Xe + 4HF
(iii) XeF2 + PF5 → [XeF]+ [PF6]–
(iv) XeF4 + SbF5 → [XeF3]+ [SbF6]–
(v) XeF6 + NaF → Na+ [XeF7]–
प्रश्न 29.
XeO3, XeOF4 तथा XeO2F2 को विस्स प्रकास बनाया जाता है? समझाइए।
उत्तर:
XeO3 : XeF4 तथा XeF6 के जल अकघटन से XeO3 बना है।
6XeF4 + 12H2O → 4Xe + 2XeO3 + 24HF + 3O2
XeF6 + 3H2O → XeO3 + 6HF
XeOF4 तथा XeO2F2 :
XeF6 के आंिक क्ल अपवटन से आक्यीफ्तुओंग्ड XeOF4 तथा XeO2F2 प्राप्त होते हैं।
XeF6 + H2O → XeOF4 + 2HF
XeF6 + 2H2O → XeO2F2 + 4HF
प्रश्न 30.
XeF6 तथा XeOF4 की आकृति को समझाइए।
उ्तर:
XeF6 में Xe पर 6 खची क्लेकट्रॉन युग्म तथा एक एक्लकी इसेष्ट्रोन युग्म वपास्थित होते है अतः इस पर sp3d3 संकर्य होत है तथा झसकी अकृति विकृत अष्टफलकीय होती है। XeOF4 में Xe पर 5 बंधी इलेक्ट्रॉन युग्म तथा एक एकाकी इलेक्ट्रॉन युग्म होने के कारण sp3d2 संकरण होता है तथा इसकी आकृति वर्ग पिरैमिडी होती है।
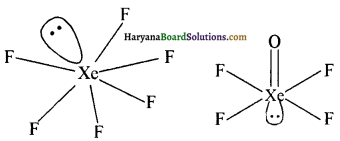
XeF6 की विकृत अष्ठल्लकीय अवृति XeOF6 की वर्ग विर्मिड्री आकृति
प्रश्न 31.
वर्ग 16 के तत्वों के हाइड़ाइडों में निम्नलिखित गुणों वाले यौगिक बताइए।
(i) अधिकतम बन्ध कोण
(ii) निम्नतम क्वथनांक
(iii) अधिकतम अम्लीय गुण।
उत्तर:
(i) H2O
(ii) H2S
(iii) H2Te
प्रश्न 32.
SF6 ज्ञात है लेकिन SCl2 नहीं, क्यों?
उत्तर:
फ्नुओरीन की विद्युतत्ताणता अधिक होने के कारण यह प्रबल औक्सीकारक होती है इसलिए यह सल्फर को + 6 औक्सीकरण अवस्था तक ऑवसीकृत कर देती है अतः SF6 ज्ञात है। लेकिन क्लोरीन की दुर्बल ऑक्सीकारक प्रवृत्ति के कारण यह सल्फर को + 4 ऑक्सीकरण अवस्था तक ही ऑक्सीकृत कर पाती है, इसलिए SCl6 ज्ञात नहीं है।
प्रश्न 33.
SO2 की विरंजक क्रिया अस्थायी होती है, जबकि Cl2 की विरंजक क्रिया स्थायी होती है, क्यों?
उत्तर:
SO2 की जल के साथ क्रिया द्वारा नवजात हाइड्रोजन उत्पन्न होती है जो कि रेगीन पदार्थ को अपचयित करके रंगहीन कर देती है, लेकिन यह पदार्थ वायु द्वारा आंक्सीकृत होकर पुनः रेगीन हो जाता है।
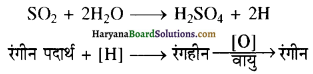
जबकि क्लोरीन, जल से क्रिया करके नवजात आंक्लीजन देती है जो कि रंगहीन पदार्थ को आंक्सीकृत करके रंगहीन कर देती है जिस पर वायु का कोई प्रभाव नर्हीं होता।

बोर्ड परीक्षा के दूष्टिकोण से सम्भावित महत्त्वपूर्ण प्रश्न:
प्रश्न 1.
सफफेद् फॉस्फोरस की अपेक्षा लाल फॉस्फोरस कम क्रियाशील क्यों होता है?
उत्तर:
सफेद फॉस्फोरस के P4 अणुओं में कोणीय तनाव के कारण (60° का कोण ) यक कम स्थायी होता है अतः यह अधिक क्रियाशील होता है जबकि लाल फॉस्फोरस में ऐसा नहीं होता इसलिए सफेद फॉस्फोरस की अपेक्ष लाल फॉर्फोरस कम क्रियाशील होता है।
प्रश्न 2.
निम्नलिखित रासायनिक अभिक्रिया समीकरणों को पूर्ण कीजिए-
(i) XeF2 + H4O →
(ii) PH3 + HgCl2 →
उत्तर:
(i) 2XeF2(s) + 2H2O(l) → 2Xe(g) + 4HF(aq) + O2(g)
(ii) PH3 + 3HgCl2 → Hg3P2 + 6HCl मरक्यूरिक फॉस्फाइड
प्रश्न 3.
(a) निम्नलिखित की संरचनाएँ आरेखित कीजिए-
(i) XeF4
(ii) H2S2O7
(b) निम्नलिखित अवलोकनों की व्याख्या कीजिए-
(i) नाइट्रोजन की अपेक्षा फॉस्फोरस में शृंखलन की प्रवृत्ति अधिक होती है।
(ii) इलेक्ट्रॉन लब्धि एन्थैल्पी का ऋणात्मक मान फ्लुओरीन के लिए, क्लोरीन के अपेक्षाकृत कम होता है।
(iii) हाइड्रोजन क्नोराइड की अपेक्षा हाइड्रोजन फ्लुओराइड का क्वथनांक बहुत अधिक होता है।
अथवा
(a) निम्नलिखित की संरचनाएँ आरेखित कीजिए-
(i) PCl3(s)
(ii) \(\mathrm{SO}_3^{2-}\)
(b) निम्नलिखित अवलोकनों के आधार स्पष्ट कीजिए-
(i) फॉस्फीन की अपेक्षा अमोनिया का क्वथनांक उच्चतर होता है।
(ii) हीलियम कोई रासायनिक योगिक नहीं बनाता है।
(iii) Sb(V) की अपेक्षा Bi(V) एक अधिक प्रबल उपचायक है।
उत्तर:
(a) XeF4 वथा H2S2O7 की संरचना निम्नलिखित है-
(b) (i) नाइट्रोजन की अवेक्षा फैस्फोरस में शृंखलन की प्रवृत्ति अधिक होती है क्योंकि फॉस्फोरस विवृत (open) तथा संवृत (closed) दोनों प्रकार की श्रंखला बनाता है तथा नाइट्रोजन के छोटे आकार के कारण यह N ≡ N बनाकर, N2 के रूप में ही पाया जाता है ल्लेकिन फॉस्फोरस के बड़े आकार के कारण यह द्विपरमाणुक अणु नहीं बनाता।
(ii) हाइड्रोजन क्लोराइड की अपेक्षा हाइड्रोजन फ्लुओराइड का क्वथनांक बहुत अधिक होता है क्योंकि HF के अणुओं के मध्य प्रबल अन्तराअणुक हाइड्रोजन बन्ध पाया जाता है जिसके कारण अणु बहुत अधिक पास आ जाते हैं जिन्हें दूर-दूर करने के लिए अधिक ऊर्जा की आवश्यकता ह्षेती है, जबकं HCl के अणुओं के मध्य दुर्बल वान्डरवाल बल पाया जाता है।
अथवा
(a) (i) PCl5(s) → ठोस अवस्था में PCl5 एक आयनिक ठोस के रूप में पाया जाता है जिसमें चतुष्फलकीय \(\mathrm{PCl}_4^{+}\) तथा अष्टफल्लकीय \(\mathrm{PCl}_6^{-}\) पाया जाता है।
(b) (i) फॉस्फीन की अपेक्षा अमोनिया का क्वधनांक उच्च होता है क्यौंकि NH3 में धुरुखीय बन्य (N-H) होने के कारण इसके अणुओं के मध्य अन्तरअणुक छाइडोजन बन्ध पाचा जाता है जिससे आण्विक संगुणन अधिक हो जाता है उबकि PH3 के अणुओं के मध्य दुर्बल बान्डरवाल बल पाया जाता है।
(ii) हीलियम कोई रुसायनिक यौगिक नहीं बनाता है ब्योकि हीलियम के इलेक्ट्रॉनिक विन्यास (1s2) में पूर्ण पूरित कोश है अतः इसके पास कोई अयुम्मित इलेक्टॉन नहैं है तथा इसके छोटे आकार के कारण इसकी आयनन एव्थैल्पी भी उच्च होती है इसलिए इसमें इलेक्ट्रॉन देने की प्रवृति भी नही होती तथा धनात्रक इ्लेक्ट्रॉन ल्यिं एन्येल्पी के कारण यह इ्लेक्ट्रॉन स्रक्षण भी नहीं करती।
(iii) Sb(V) की अपेक्षा Bi(V) अधिक प्रबल उपचायक (ऑक्सीकारक ) होता है क्योंकि Bi+5 अवस्था की अपेक्षा Bi+3 अवस्था अधिक स्थायी होती है (निक्रिय युग्म प्रभास के कारण) अतः Bi(V) आसानी से इसेक्ट्रॉन ग्रहण करके Bi(III) बनाता है जिसके कारण इसका औक्सीकारक गुण अधिक छोता है।
![]()
प्रश्न 4.
फ्तुओरीन कोई धनात्मक ऑक्सीकरण अवस्था प्रदर्शित नहीं करती। क्यों?
उत्तर:
फ्लुओरीन की विद्युप्रणता सर्वाधिक होती है तथा इसके संयोजी कोश में रिक्त d कक्षेक भी उपलय्ध नलीं है अतः इसमें अश्टक का प्रस्तर नहीं हैता इस्स कारण यह केवल -1 औक्सीकरण अवस्था दर्शाती है अधाँत् यह कोई धनात्मक ऑक्सीकरण अवस्था प्रक्रांत नहर्ती करती।
प्रश्न 5.
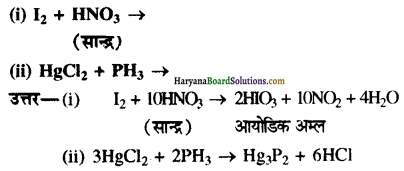
निम्नलिखित रासायनिक अभिक्रिया समीकर्णों को पूरा कीजिए-
प्रश्न 6.
निम्नलिखित योगिकों के संखचा सूत्र बनाइए-
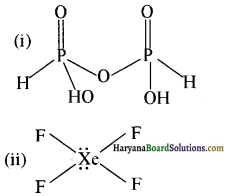
(i) H4P2O5
(ii) XeF4
उत्तर:
H4P2O5 तखा XeF4 की संरचना निम्न फ्रकार सेती है-
प्रश्न 7.
निम्नलिखित को कारण देते हुए आष कैसे समझाएंगे-
(i) NCl3 एक ऊष्माशोषी यौगिक है जलकि NF3 ऊष्चाजिया है।
(ii) XeF2 मुड्ता हुभा न द्रोका एक सीधा रेख्रिय आकार वाता क्या है।
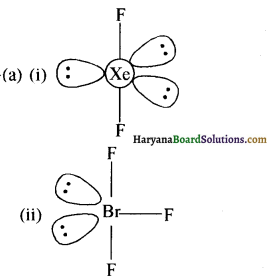
उत्तर:
(i) NCl3 एक कप्माोोी वौगिक है वबकि NF3 ऊप्यारेपी है क्योंकि NCl3 बनते समय कर्न का अवरोष्य होता है हसका कारण Cl-Cl बन्थ वियोग्यन एन्देली कर मान F-F बन्ध क्लिजन एन्थैल्पी से अधिक होना है अतः इस बन्य को तोड़ने के हिए अधिक ऊर्जा की आवस्पकता हैती है जबकि फ्लुओरीन के होटे आलार के बाएग प्रयत्त बन्य बनती है अतः NF3 बनते समख कर्जा उत्सरित होती है।
(ii) XeF2 में Xe पा दो बन्धित क्षेक्टॉन युग्म वथा तीन एकाही इलेकट्टॉन तुम्य कोते है। (sP3d स्थिकण) VSEPR स्द्धान्त के अनुसार रेखीय ज्यामिति होने पर प्रतिकर्षण न्यूनत्न होता है उतः XeF2 रेखीय ख्वामिति युक्ल अणु है।
प्रश्न 8. निम्नलिखित के वया कााएण हैं-
(i) H2O की अपेक्षा H2S अधिक अम्लीय है।
(ii) \(\mathrm{NO}_2^{-}\) में N-O आबंध \(\mathrm{NO}_3^{-}\) में N-O काजंध से छोटा होता है।
(iii) O2 और F2 दोनों ही उख्य उपषयन अवस्तुओ को स्थायित्य केते हैं परन्तु इसमें फलुओरीन की आवेक्षा औंवसीजन बक्रात है।
उत्तर:
(i) H2O की अपेक्षा H2S अधिक अम्लीय है क्योंकि सल्फर के बड़े आकार के कारण S-H बन्ध वियोजन एन्थैल्पी का मान O-H बन्ध वियोजन एन्थैल्पी से कम होता है अतः H2S की H+ देने की प्रवृत्ति अधिक होती है।
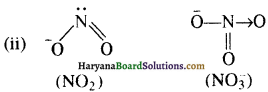
\(\mathrm{NO}_2^{-}\) में एक N = O तथा एक N-O बन्थ होता है जबकि \(\mathrm{NO}_3^{-}\) में एक N = O तथा दो N-O बन्ध होते हैं अतः \(\mathrm{NO}_2^{-}\) में औसत बन्ध क्रम (1.5), \(\mathrm{NO}_3^{-}\) में औसत बन्ध क्रम (1.33) से अधिक है अतः \(\mathrm{NO}_2^{-}\) में N-O आब्दैघ, \(\mathrm{NO}_3^{-}\) में N-O आबन्ध से छोटा होत है।
(iii) O2 तथा F2 दोनों ही उच्च उपचयन अवस्थाओं (आक्सीकरण अवस्थाओं) को स्थायित्व देते हैं लेकिन ऑक्सीजन कौ द्विन्ध बनाने की क्षमत के कारण या उच्च ओंक्सीकरण अवस्था को अंक ए्थायित्व प्रदान करता है जबक्षक फ्लुओरीन में द्विआंन्ध नहीं बनखा।
प्रश्न 9.
(a) निम्नलिखित अणुओं की संरचनाएँ आरेखित कीजिए-
(i) (HPO3)3
(ii) BrF2
(b) निम्नलिखित रासायनिक समीकरणों को पूरा कीजिए-
(i) HgCl2 + PH2 →
(ii) SO3 + H2SO4 →
(iii) XeF4 + H2O →
अथवा
(a) क्या होता है जब
(i) NaOH के सान्द्र गरम विलयन में क्लोरीन गैस प्रवाहित की जाती है?
(ii) Fe(III) लवण के जलीय विलयन में से सस्फर डाइओंक्साइड गैस प्रवाहित की जाती है ?
(b) निम्नलिखित के उत्तर दीजिए-
(i) H3PO3 की क्षार्त्ता (basicity) ब्या है और क्यों?
(ii) अन्तराहललोजन यौगिकों में फ्लुओरीन केन्द्रीय पसमाणु की भूमिका में क्यों नहीं होती है?
(iii) उत्कृष्ट (नोबल) गैसों के क्वथनांक बहुत कम क्यों होते हैं?
उत्तर:
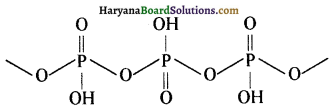
(a) (i) (HPO3)3 पौलीमेटाफॉस्पेरिक अम्ल की संरचना निम्न प्रकार होती है-
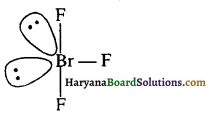
(ii) BrF3 की संरचना बंकित T जैसी होती है।
(b) (i) 3HgCl2 + 2PH3 → Hg3P2 + 6HCl
(ii) SO3 + H2SO4 → H2S2O7 (अ)लिम)
(iii) 6XeF4 + 12H2O → 4Xe + 2XeO3 + 24HF + 3O2
अधवा
(a) (i) NaOH के सान्द्र स्वम विलयन में करोरोन सैस प्रवाहित कहने का NaCl तथा NaClO3 (संडियम बलोरोट) बनल है।
6NaOH + 3Cl2 → 5NaCl + NaClO3 + 3H2O
गन् तथा बान्द्र
(ii) Fe(III) के लवण के जलीय विलयन में से सल्फर डाइऑक्साइड गैस प्रवाहित करने पर फैरस (Fe2+) तथा सल्फेट आयन बनते हैं।
2Fe3+ + SO2 + 2H2O → 2Fe2+ + \(\mathrm{SO}_4^{2-}\) + 4H+
(b) (i) H3PO3 की क्षारकता दो होती है क्योंकि इसकी संरचना में दो -O-H बन्ध होते हैं जिसके आयनन से H+ प्राप्त होते हैं, लेकिन P-H बन्ध का आयनन नहीं होता है।
(ii) अन्तराहैलोजन यौगिकों में केन्द्रीय परमाणु पर अष्टक का प्रंसार होता है चूँकि फ्लुओरीन में रिक्त $\mathrm{d}$ कक्षक उपलब्ध नहीं होते अतः इसमें अष्टक का प्रसार नहीं हो पाता। इस कारण अन्तराहैलोजन यौगिकों में फ्लुओरीन, केन्द्रीय परमाणु की भूमिका में नहीं होती है।
प्रश्न 10.
निम्नलिखित में सो प्रत्येक के लिए उषघुक्त उद्बाहला बेते हुए उनखा स्पष्टीसरण कीजिए-
(i) NF3 एक कब्मांक्षेपी चौनिक है जक्कि NCl3 एमा नहीं है।
(ii) SF4 में सभी आघन्ध समतुल्ब नहीं हैं।
उत्तर:
(i) क्सी भाग (विभिन्न पणिधाओं के प्रश्न ) में प्रश्न संख्या 7(i) क्ष उत्तर देखें।
(ii) SF4 में सल्फर पर चार बन्धित इलेक्ट्रॉन युग्म तथा एक एकाकी इलेक्ट्रॉन युग्म उपस्थित है। (sp3d संकरण) तथा इसकी ज्यामिति सी सॉं (see saw) जैसी होती है जिसमें निरक्षीय बन्धों की तुलना में विषुवतरेखीय बन्धों पर अधिक तनाव होता है अतः इनकी बन्ध लम्बाई कुछ अधिक होती है SF4 के सभी बन्य सनतात्व नली कोते।
प्रश्न 11.
SbH3 तथा BiH3 में खौन अधिक प्रबल भबचादक है और वर्खों ?
उत्तर:
SbH3 तथा BiH3 में से BiH3 अधिक प्रबल अपचायक है क्योंकि BiH3 में Bi के बड़े आकार के कारण बन्ध वियोजन एन्थैल्पी कम होती है अतः हाइड्रोजन परमाणुओं के प्राप्त होने की सम्भावना अधिक होती है।
प्रश्न 12.
(a) निम्नलिखित यौगिकों की आण्विक संरचनाएँ आरेखित कीजिए-
(i) N2O5
(ii) XeOF4
(b) निम्नलिखित अवलोकनों की व्याख्या कीजिए-
(i) ऑक्सीजन की अपेक्षा सल्फर में श्रृंखलन की प्रवृत्ति अधिक होती है।
(ii) I2 की अपेक्षा ICI अधिक क्रियाशील है।
(iii) फ्लुओरीन की इलेक्ट्रॉन प्राप्ति एन्थैल्पी ऋण चिह्न के साथ यद्यपि क्लोरीन की अपेक्षा कम है, फिर भी फ्लुओरीन (F2) अपेक्षाकृत क्लोरीन (Cl2) से प्रबल ऑक्सीकारक है।
अथवा
(a) निम्नलिखित रासायनिक समीकरणों को पूर्ण कीजिए-
(i) Cu + HNO3 (तनु) →
(ii) XeF4 + O2F2 →
(b) निम्नलिखित अवलोकनों की व्याख्या कीजिए-
(i) नाइट्रोजन की अपेक्षा फॉस्फोरस में श्रृंखलन की प्रवृत्ति अधिक होती है।
(ii) ऑक्सीजन एक गैस है जबकि सल्फर एक ठोस है।
(iii) हैलोजन रंगीन होते हैं। क्यों?
उत्तर:
(a) N2O5 तथा XeOF4 की संरचना निम्न प्रकार होती है-
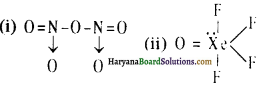
(b) ऑक्सीजन के छोटे आकार के कारण यह pπ-pπ अतिव्यापन द्वारा बन्ध बनाकर O2 के रूप में पाया जाता है। जबकि सल्फर के बड़े आकार के कारण यह π बन्ध नहीं बनाता तथा बहुत से परमाणु आपस में जुड़कर S8 बनाते हैं अर्थात् सल्फर में श्रृंखलन की प्रवृत्ति; ऑक्सीजन की अपेक्षा अधिक होती है।
अथवा

(b) हैलोजनों में दृश्य क्षेत्र में विकिरणों का अवशोषण होता है जिससे बाह्यतम कोश के इलेक्ट्रॉन उत्तेजित होकर उच्च ऊर्जा स्तर में चले जाते हैं। जब ये इलेक्ट्रॉन वापस निम्न ऊर्जा स्तर में आते हैं तो ऊर्जा उत्सर्जित होती है जिसके कारण हैलोजन रंगीन होते हैं। विकिरण के भिन्न-भिन्न क्वान्टम अवशोषित करने के कारण इनका रंग भी भिन्न-भिन्न होता है।
![]()
प्रश्न 13.
(i) ‘इंडियन साल्टपीटर’ का नाम एवं रासायनिक सूत्र लिखिए।
(ii) क्या होता है जब अमोनिया के जलीय विलयन को- (A) Cu2+ आयन युक्त जलीय विलयन में डालते हैं ( समीकरण सहित ) ।
(B) Cl– आयनों की उपस्थिति में Ag+ आयन युक्त जलीय विलयन में डालते हैं। (समीकरण सहित )
(iii) H3PO4 अम्ल की संरचना बनाइये।
अथवा
(i) किस वर्ग के तत्व चैल्कोजेन कहलाते हैं और क्यों?
(ii) (A) फ्लोरीन केवल 1 ऑक्सीकरण अवस्था दर्शाता है, क्यों?
(B) फ्लोरीन के अलावा अन्य हैलोजन धनात्मक ऑक्सीकरण अवस्थाएँ भी दर्शाते हैं, क्यों?
(iii) विषमलंबा गंधक की Ss आणविक संरचना को चित्रित कीजिए।
उत्तर:
(i) पोटैशियम नाइट्रेट (KNO3) को इंडियन साल्टपीटर कहते हैं।
(ii) (A) Cu2+ आयन युक्त जलीय विलयन में अमोनिया का जलीय विलयन डालने पर गहरे नीले रंग का विलेयशील संकुल टेट्राऐमीन कॉपर (II) सल्फेट बनता है।
(B) Cl– आयनों की उपस्थिति में Ag+ के जलीय विलयन में अमोनिया का जलीय विलयन डालने पर एक विलेय संकुल डाइऐमीन सिल्वर (I) क्लोराइड प्राप्त होता है।

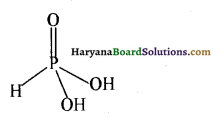
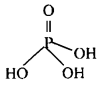
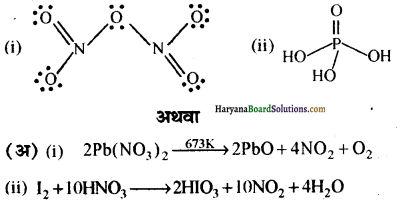
(iii) H3PO4 (आर्थो फॉस्फोरिक अम्ल) की संरचना निम्नलिखित है-
अथवा
(i) 16वें वर्ग (ऑक्सीजन परिवार) के तत्वों को चैल्कोजेन कहते हैं क्योंकि इसका अर्थ है अयस्क बनाने वाला तथा सामान्यतः अयस्कों में ऑक्सीजन तथा सल्फर होता है अर्थात् अयस्क ऑक्साइड तथा सल्फाइड के रूप में पाए जाते हैं।
(ii) (A) फ्लोरीन केवल – 1 ऑक्सीकरण अवस्था दर्शता है क्योंकि इसका परमाणु आकार छोटा होता है तथा इसमें d कक्षक अनुपस्थित है एवं इसकी विद्युत ऋणात्मकता भी सबसे अधिक होती है।
(B) फ्लोरीन के अलावा अन्य हैलोजन धनात्मक ऑक्सीकरण अवस्थाएँ भी दर्शाते हैं क्योंकि इनमें रिक्त d कक्षक उपस्थित होते हैं अतः ये अपने अष्टक का प्रसार कर सकते हैं। इनकी ये ऑक्सीकरण अवस्थाएँ + 1, + 3, + 5 तथा + 7 होती हैं।
(iii) विषम लंबा गंधक की S8 आण्विक संरचना क्राउन शेप यानी किरीटाकार वलय होती है।
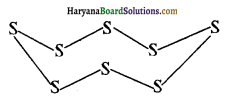
प्रश्न 14.
(अ) निम्नलिखित समीकरणों को पूर्ण कीजिए-
(i) Cl2 + NaOH (ठण्डा व तनु) →
(ii) C + सान्द्र HNO3 →
(ब) निम्नलिखित को समझाइए –
(i) 17वें वर्ग में F2 प्रबल ऑक्सीकारक है।
(ii) ऑक्सीजन गैस है जबकि सल्फर ठोस है।
(स) निम्नलिखित की संरचना बनाइए-
(i) N2O5
(ii) H3PO4
अथवा
(अ) निम्नलिखित समीकरणों को पूर्ण कीजिए-
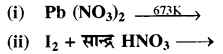
(ब) निम्नलिखित को समझाइए-
(i) नाइट्रोजन का अणुसूत्र N2 है जबकि फॉस्फोरस का P4 है।
(ii) नाइट्रोजन की तुलना में फॉस्फोरस अधिक क्रियाशील है।
(स) निम्नलिखित की संरचना बनाइए-
(i) H2S2O7
(ii) XeF2
उत्तर:
(अ) (i) Cl2 + NaOH (ठण्डा व तनु ) → NaCl + NaClO + H2O
(ii) C + 4HNO3 (सान्द्र) → CO2 + 2H2O + 4NO2
(च) (i) 17वें वर्ग में F2 प्रबल ऑक्सीकारक है क्योंकि F-F आबंध की वियोजन एन्थैगी कम है तथा F की जलयोजन एन्यैल्पी का मान उच्च होता है, अतः F में इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति अधिक होती है।
(ii) ऑक्सीजन परमाणु के छोटे आकार तथा संयोजी कोश में d कक्षकों की अनुपस्थिति के कारण इसमें pπ-pπ बन्ध बनाने की प्रबल प्रवृत्ति होती है अतः यह O = O बनाकर अपना अष्टक पूर्ण कर लेती है। तथा O2 के विविक्त अणुओं के रूप में गैस अवस्था में पायी जाती है। लेकिन सल्फर के बड़े आकार के कारण S = S बन्ध एन्पी कम होती है अतः यह S2 न बनाकर S8 के रूप में पाया जाता है जिससे अणुओं के मध्य आकर्षण बल बढ़ जाता है। इसी कारण सल्फर ठोस अवस्था में पाया जाता है।
(स) N2O5 तथा H3PO4 की संरचना निम्नलिखित है-
(ब) (i) नाइट्रोजन द्विपरमाणुक अणु N2 के रूप में पाया जाता है क्योंकि नाइट्रोजन परमाणु के छोटे आकार तथा d कक्षकों की अनुपस्थिति के कारण इसमें बहुल आबन्ध (N ≡ N) बनाने की प्रबल क्षमता होती है जबकि फॉस्फोरस P4 के रूप में पाया जाता है क्योंकि इसके बड़े आकार के कारण इसमें बहुल आबन्ध बनाने की प्रवृत्ति नहीं होती तथा आन्तरिक अबन्धित इलेक्ट्रॉनों के बीच प्रतिकर्षण होता है अतः इसमें P-P-P बन्ध कोण 60″ होता है इसलिए pπ-pπ बन्ध संभव नहीं है।
(ii) नाइट्रोजन की तुलना में फॉस्फोरस अधिक क्रियाशील है क्योंकि नाइट्रोजन का आकार बहुत छोटा होता है तथा इसकी विद्युतॠणता एवं आयनन एन्फैल्पी, फॉस्फोरस की तुलना में अधिक होती है। नाइट्रोजन के संयोजी कोश में रिक्त d कक्षक उपलब्ध नहीं हैं जबकि फॉस्फोरस के संयोजी कोश में रिक्त d कक्षक होते हैं नाइट्रोजन में pπ-pπ अतिव्यापन द्वारा त्रिआबन्ध बनाने की प्रवृत्ति होती है अतः इसकी [बन्ध एन्येपी बहुत अधिक होती है जिसके कारण वह बहुत कम क्रियाशील होता है जबकि फॉस्फोरस में pπ-pπ अतिव्यापन नहीं होता।
(स) H2S2O7 तथा XeF2 की संरचना निम्न प्रकार होती है-

प्रश्न 15.
(अ) वर्ग 15 में ऊपर से तीसरे तत्व का नाम एवं इलेक्ट्रॉनिक विन्यास लिखिए।
(ब) अमोनिया अणु की संरचना बनाइए ।
(स) NH3 लुइस क्षारक की तरह व्यवहार करती है। क्यों?
(द) तनु एवं सान्द्र HNO3 की Zn के साथ अभिक्रिया के समीकरण दीजिए।
उत्तर:
(अ) वर्ग 15 में ऊपर से तीसरे तत्व का नाम आर्सेनिक 33(As) है जिसका इलेक्ट्रॉनिक विन्यास [Ar] 3d104s24p3 है।
(ब) अमोनिया का अणु त्रिकोणीय पिरैमिडी होता है, क्योंकि इसमें नाइट्रोजन पर sp3 संकरण होता है। (3σ बन्ध तथा एक एकाकी इलेक्ट्रॉन युग्म ) इसे निम्न प्रकार दर्शाया जाता है-
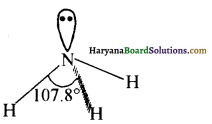
(स) अमोनिया में नाइट्रोजन परमाणु पर एक एकाकी इलेक्ट्रॉन युग्म, प्रदान करने के लिए उपलब्ध है अतः यह लूइस धारक की तरह व्यवहार करती है।
(द) 4Zn + 10 HNO3
तनु → 4Zn (NO3)2 + 5H2O + N2O
Zn + 4HNO3 (सांद्र ) → Zn (NO3)2 + 2H2O + 2NO2
प्रश्न 16.
(अ) वर्ग 15 के धातु तत्व का नाम एवं इलेक्ट्रॉनिक विन्यास लिखिए।
(ब) क्लोरीन गैस की विरंजन क्रिया का कारण समझाइए ।
(स) भूरी वलय परीक्षण के समीकरण लिखिए।
(द) PCl5 अणु की संरचना बनाइए ।
उत्तर:
(अ) वर्ग 15 का धातु तत्व बिस्मथ (88Bi) है जिसका इलेक्ट्रॉनिक विन्यास [Xe]-4f14 5d10 6s2 6p3 है।
(ब) क्लोरीन गैस की विरंजन क्रिया ऑक्सीकरण के कारण होती है। नमी की उपस्थिति में क्लोरीन नवजात ऑक्सीजन [O] देती है जो रंगीन पदार्थ का ऑक्सीकरण करके उसे रंगहीन कर देती है।
Cl2 + H2O → 2HCl + [O]
रंगीन पदार्थ + [O] → रंगहीन पदार्थ
(स) भूरी वलय परीक्षण नाइट्रेट आयन के लिए किया जाता है। इसमें प्रयुक्त समीकरण निम्नलिखित हैं-
NO3 + 3Fe2+ + 4H+ → NO + 3Fe3+ + H2O
[Fe(H2O)6]2+ + NO → [Fe(H2O)5(NO)]2+ + H2O भूरी वलय
(द) PCl5 की संरचना त्रिकोणीय द्विपिरैमिडी होती है क्योंकि इसमें फॉस्फोरस पर 5 σ बन्ध होते हैं। (sp3d संकरण) इसे निम्न प्रकार दर्शाया जाता है-

प्रश्न 17.
(i) H3PO3 की क्षारकता कितनी होती है तथा क्यों?
(ii) क्लोरीन गैस से बनाई जा सकने वाली दो जहरीली गैसों का नाम बताइए।
(iii) नाइट्रोजन +5 ऑक्सीकरण अवस्था दर्शाती है फिर भी यह पेन्टालाइड नहीं बनाती, क्यों?
उत्तर:
(i) H3PO3 की धारकता दो होती है क्योंकि इसमें दो O-H बन्ध होते हैं।
(ii) फॉस्जीन (COCl2) तथा मस्टर्ड गैस (ClCH2– CH2SCH2CH2Cl)
(iii) नाइट्रोजन में d कवक अनुपस्थित होते हैं अतः यह पेन्टालाइड नहीं बनाती।
प्रश्न 18.
R3P = O पाया जाता है जबकि R3N = O नहीं क्यों ? (R= ऐल्किल समूह)
उत्तर:
वर्ग 15 के तत्वों में अतिरिक्त स्थायित्व प्राप्त अर्धपूरित इलेक्ट्रॉनिक विन्यास के p-कक्षक होते हैं। अतः वर्ग 16 के तत्वों की तुलना में इनमें से इलेक्ट्रॉन को निकालने में बहुत अधिक मात्रा में ऊर्जा की आवश्यकता होती है, अतः वर्ग 15 के तत्वों की तुलना में वर्ग 16 के तत्वों की प्रथम आयनन एन्थैल्पी का मान कम होता है।
प्रश्न 19.
(a) निम्नलिखित की संरचनाएँ बताइए-
(i) XeF2
(ii) BrF3
(b) H3PO3 की अपेक्षा H2PO2 अधिक प्रबल अपचायक है, क्यों?
(b) H3PO2 में ऐ P-H बन्ध होते हैं तथा इसमें की ऑक्सीकरण अवस्था निम्न (+1) है। अतः यह उच्च ऑक्सीकरण अवस्था में परिवर्तित हो सकता है। जबकि H3PO3 में एक P-H बन्ध एवं P की ऑक्सीकरण अवस्था उच्च (+ 3) है अतः H3PO3 की अपेक्षा H3PO2 अधिक प्रबल अपचायक है।
प्रश्न 20.
(अ) क्लोरीन के चार ऑक्सो अम्लों के रासायनिक सूत्र लिखिए।
(ब) उत्कृष्ट गैस समूह का सामान्य इलेक्ट्रॉन विन्यास लिखिए। चुम्बकीय अनुनाद प्रतिविम्ब (MRI) में इस समूह का कौन-सा तत्व उपयोगी है?
(स) C2H5OH की PCl3 एवं PCl5 के साथ पृथक् पृथक् रासायनिक अभिक्रियाएँ लिखिए।
अथवा
(अ) सल्फर के चार ऑक्सो अम्लों के रासायनिक सूत्र लिखिए।
(ब) केल्कोजेन समूह का सामान्य इलेक्ट्रॉन विन्यास लिखिए। एप्सम लवण का रासायनिक सूत्र लिखिए।
(स) अमोनिया एक लुइस क्षारक की तरह व्यवहार करता है। समझाइए |
उत्तर:
(अ) क्लोरीन के चार ऑक्सो अम्ल निम्नलिखित हैं- HOCl (हाइपोक्लोरस अम्ल) HClO2 (क्लोरस अम्ल), HClO3 (क्लोरिक अम्ल) तथा HCIO4 (परक्लोरिक अम्ल)।
(ब) उत्कृष्ट गैस समूह का सामान्य इलेक्ट्रॉनिक विन्यास ns2 np2 होता है जहाँ n = 2 से 6 [He (1s2) के अतिरिक्त), चुम्बकीय अनुनाद प्रतिषिध (MRI) में हीलिंगम प्रयुक्त होती है।
(स) C2H5OH + PCl5 → C2H5Cl + HCl + POCl3
2C2H5OH + PCl3 → 3C2H5Cl + P(OH)3 या H3PO3
अथवा
(अ) सल्फर के चार ऑक्सो अम्ल निम्नलिखित है-
H2SO3 (सल्फ्यूरस अम्ल), H2SO4 (सल्फ्यूरिक अम्ल), H2S2O8 (परॉक्सो डाइसल्फ्यूरिक अम्ल) तथा H2S2O7 (पायरो सल्फ्यूरिक अम्ल )।
(ब) केल्कोजेन समूह ऑक्सीजन समूह होता हैं जिसका सामान्य इलेक्ट्रॉनिक विन्यास ns2 np4 है जहाँ n = 2 से 61 एप्सम लवण का रासायनिक सूत्र MgSO4 . 7H2O होता है।
(स) अमोनिया में नाइट्रोजन पर एक एकाकी इलेक्ट्रॉन युग्म प्रदान करने के लिए उपलब्ध है अतः यह लुइस क्षारक की तरह व्यवहार करता है।
![]()
प्रश्न 21.
Ba(N3)2 के तापीय अपघटन से क्या होता है? (केवल अभिक्रिया की समीकरण लिखिए।)
उत्तर:
Ba(N3)2 के तापीय अपघटन से बेरियम तथा नाइट्रोजन गैस प्राप्त होती है-
![]()
प्रश्न 22.
H3PO3 की क्षारकता क्या है?
उत्तर:
H3PO3 में दो P-OH बन्ध उपस्थित हैं अतः इसकी क्षारकता 2 है।

प्रश्न 23.
(अ) क्लोरीन के ठण्डे व तनु NaOH विलयन से अभिक्रिया की समीकरण लिखिए।
(ब) H3PO2 की अपचायक प्रकृति को समझाइए |
अथवा
(अ) क्लोरीन की गरम व सान्द्र NaOH विलयन से अभिक्रिया की समीकरण लिखिए।
(ब) PCl5 के पाँचों बन्ध समतुल्य क्यों नहीं हैं? समझाइए |
उत्तर:
(अ) क्लोरीन की ठण्डे व तनु NaOH मिलयन से अभिक्रिया कराने पर सोडियम क्लोराइड (NaCl) तथा सोडियम हाइपोक्लोराइट (NaClO) बनते हैं।
Cl2 + 2NaOH → NaCl + NaClO + H2O
(ब) H3PO2 में दो P-H बन्ध होने के कारण वह एक अच्छा अपचायक होता है। इसी कारण वह AgNO3 को Ag में अपचारित कर देता है।

अथवा
OH
(अ) क्लोरीन की गरम व सान्द्र NaOH विलयन से अभिक्रिया कराने पर सोडियम क्लोराइड (NaCl) तथा सोडियम क्लोरेट (NaClO3) प्राप्त होते हैं।
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
(ब) PCl5 के पाँच बन्धों में से तीन निरक्षीय बन्ध समान होते हैं। जबकि वे अक्षय बन्यों की बन्ध लम्बाई अधिक होती है क्योंकि निरखीय बन्ध युग्मों की अपेक्ष अक्षीय बन्ध युग्मों पर प्रतिकर्षण अधिक होता है। PCl5 की त्रिकोणीय द्विपिरैमिडी संरचना होती है (sp3d संकरण ) ।
प्रश्न 24.
(a) निम्नलिखित के कारण देते हुए स्पष्ट कीजिए-
(i) \(\mathrm{NH}_4^{+}\) में आबन्ध कोण अपेक्षाकृत NH3 वाले कोण से बड़ा है।
(ii) अपचायक व्यवहार SO3 से TeO2 की ओर घटता है।
(iii) HClO की अपेक्षा HClO4 प्रबलतर अम्ल है।
(b) निम्नलिखित की संरचनाएँ आरेखित कीजिए—
(i) H2S2O8
(ii) XeOF4
अथवा
(a) जब सफेद फॉस्फोरस को सान्द्र NaOH के विलयन के साथ गर्म किया जाता है तो कौनसी जहरीली गैस निकलती है? रासायनिक समीकरण लिखिए।
(b) एन. बेर्टलेट द्वारा बनाए गए उत्कृष्ट गैस के प्रथम यौगिक का सूत्र लिखिए। इस यौगिक को बनाने के लिए एन. बैर्टलेट की प्रेरणा क्या थी?
(c) क्लोरीन की अपेक्षा फ्लुओरीन प्रबलतर उपचाचक है क्यों?
(d) क्लोरीन गैस का एक उपयोग लिखिए।
(e) निम्नलिखित समीकरण को पूर्ण कीजिए-
CaF2 + H2SO4 →
उत्तर:
(a) (i) NH3 तथा \(\mathrm{NH}_4^{+}\) दोनों में से नाइट्रोजन sp3 संकरित है। लेकिन \(\mathrm{NH}_4^{+}\) में आबन्ध कोण अपेक्षाकृत NH3 वाले बन्ध कोण से बड़ा है क्योंकि इसमें चारों ही बन्धित इलेक्ट्रॉन युग्म है जबकि NH3 में N पर एक एकाकी इलेक्ट्रॉन युग्म है जो कि एकाकी युग्म आबंध युग्म प्रतिकर्षण के लिए उत्तरदायी है, जिससे NH3 में आबन्ध कोण कम हो जाता है।
(ii) अपचायक व्यवहार SO2 से TeO2 की ओर घटता है, क्योंकि इस वर्ग में नीचे जाने पर 6 ऑक्सीकरण अवस्था का स्थायित्व कम होता है तथा 4 ऑक्सीकरण अवस्था का स्थायित्व बढ़ता है। अतः इनकी इलेक्ट्रॉन देने की प्रवृत्ति भी कम होती जाती है।
(iii) HClO की अपेक्षा HClO4 प्रबलतम अम्ल है क्योंकि HClO में Cl का ऑक्सीकरण अंक + 1 है जबकि HClO4 में Cl का ऑक्सीकरण अंक + 7 है अतः HClO4 में Cl की इलेक्ट्रॉन को आकर्षित करने की प्रवृत्ति अधिक होती है जिससे इसका आयनन होकर H+ आसानी से प्राप्त हो जाते हैं।
(b) (i) H2S2O8
(ii) XeOF4
अथवा
(a) जब सफेद फॉस्फोरस को सान्द्र NaOH के विलयन के साथ गर्म किया जाता है तो फाल्जीन (PH3) गैस निकलती है।
![]()
(b) इस प्रश्न के उत्तर के लिए पाठ्यपुस्तक के अभ्यास प्रश्न संख्या 7.30 का उत्तर देखें।
(c) क्लोरीन की अपेक्षा फ्लुओरीन प्रबलतर उपचायक (ऑक्सीकारक) है क्योंकि क्लोरीन के मानक अध्ययन विभव का मान फ्लुओरीन के मानक अपचयन विभव के अपेक्षा कम होता है। इसी कारण फ्लुओरीन जल को ऑक्सीजन में ऑक्सीकृत कर देती है जबकि क्लोरीन, जल के साथ अभिक्रिया करके HCl तथा HClO बनाती है।
(d) क्लोरीन को पीने के जल को जीवाणुरहित करने में प्रयुक्त किया जाता है।
(e) CaF2 + H2SO4 → CaSO4 + 2HF
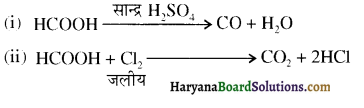
HBSE 12th Class Chemistry Important Questions Chapter 7 p-ब्लॉक के तत्व Read More »
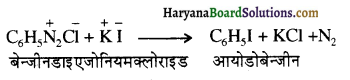
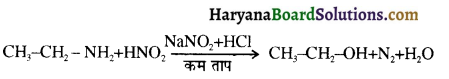
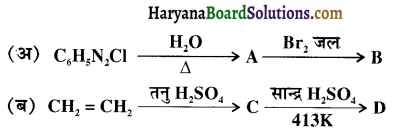
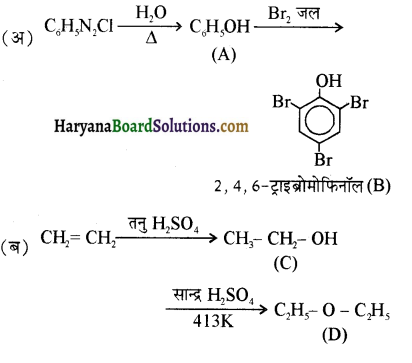
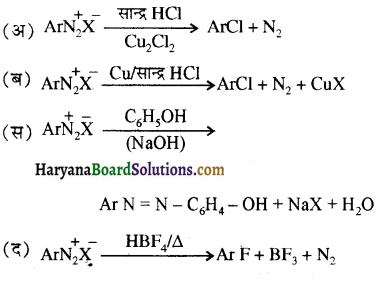
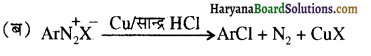
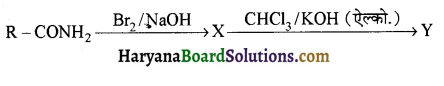
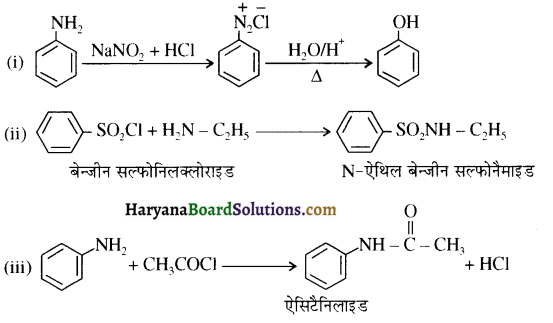
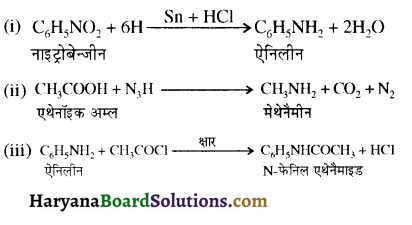
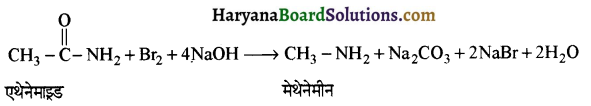
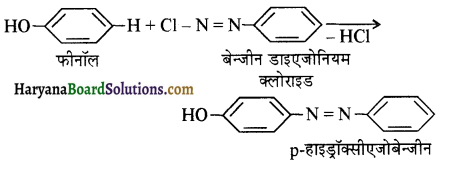
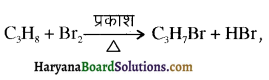 , यह अभिक्रिया है-
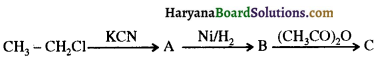
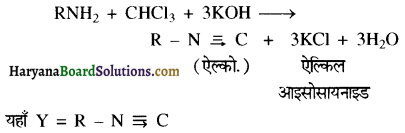
, यह अभिक्रिया है-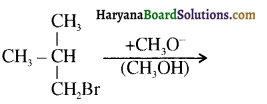 B, में यौगिक B मुख्य रूप से क्या होगा ?
B, में यौगिक B मुख्य रूप से क्या होगा ?
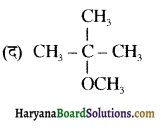
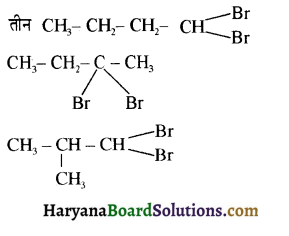
 का IUPAC का नाम होगा-
का IUPAC का नाम होगा-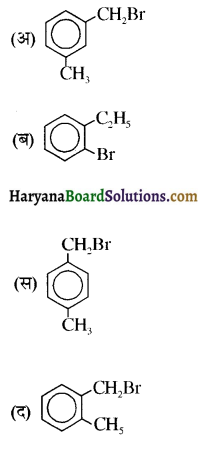

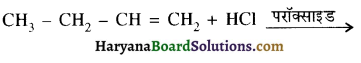
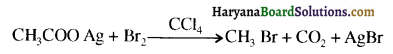
 क्योंकि HCl के संकलन में परॉक्साइड प्रभाव नहीं लगता है।
क्योंकि HCl के संकलन में परॉक्साइड प्रभाव नहीं लगता है।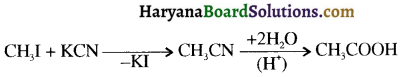

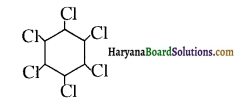


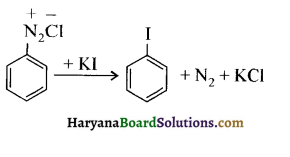
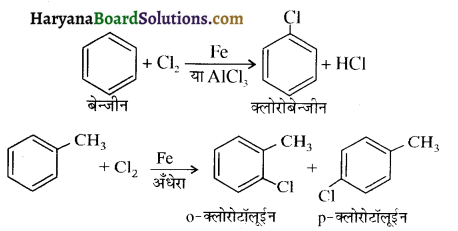
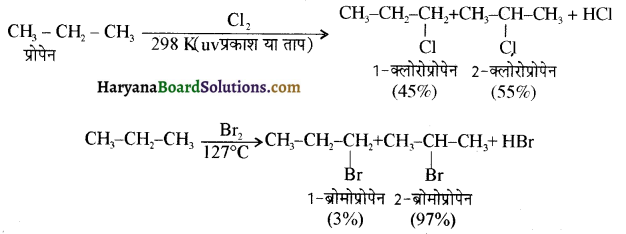
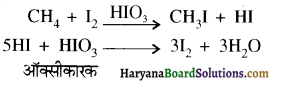
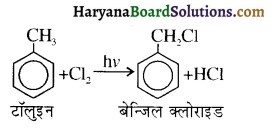

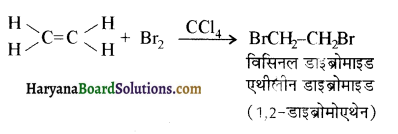
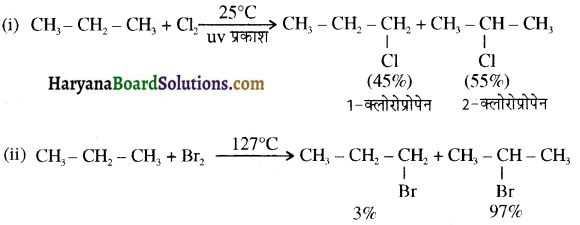

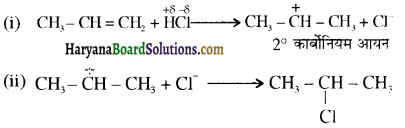
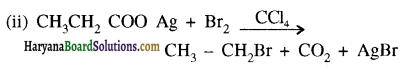
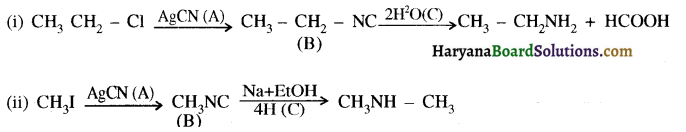
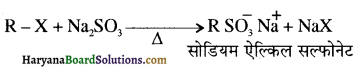
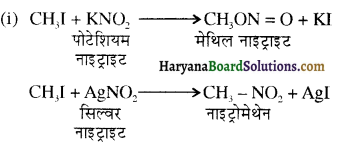

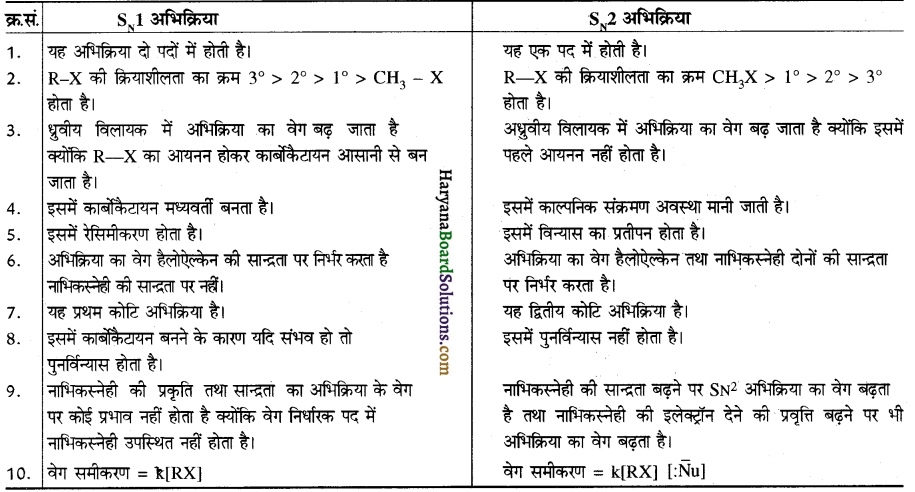



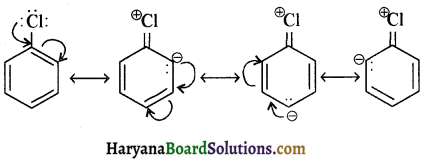
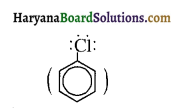 में क्लोरीन के एकाकी इलेक्ट्रॉन युग्म, बेन्जीन वलय के इलेक्ट्रॉनों के साथ संयुग्मन में होते हैं अतः इसमें वलय की तरफ अनुनाद ( + M प्रभाव) होता है जिसके कारण C-CI बन्ध बन्ध के गुण आ जाते हैं। इसलिए C-Cl बन्ध लम्बाई कम हो जाती है जबकि C2H5Cl में कोई अनुनाद नहीं होता अतः इसमें C-Cl बन्ध लम्बाई अधिक होती है।
में क्लोरीन के एकाकी इलेक्ट्रॉन युग्म, बेन्जीन वलय के इलेक्ट्रॉनों के साथ संयुग्मन में होते हैं अतः इसमें वलय की तरफ अनुनाद ( + M प्रभाव) होता है जिसके कारण C-CI बन्ध बन्ध के गुण आ जाते हैं। इसलिए C-Cl बन्ध लम्बाई कम हो जाती है जबकि C2H5Cl में कोई अनुनाद नहीं होता अतः इसमें C-Cl बन्ध लम्बाई अधिक होती है।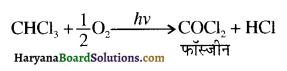
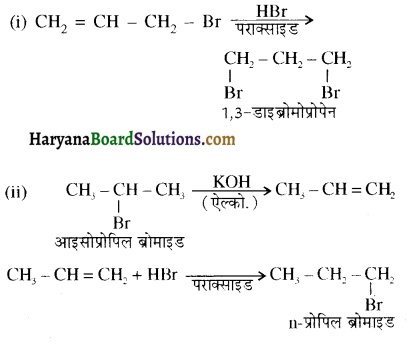
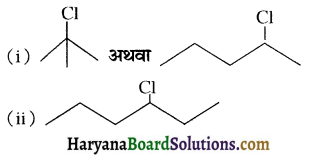

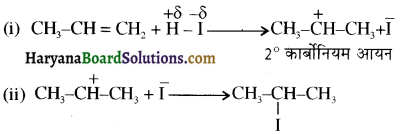
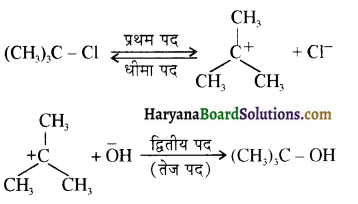
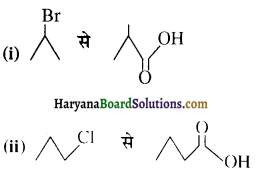
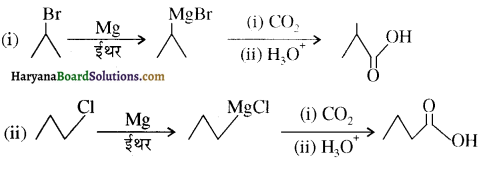
 , क्योंकि प्राथमिक कार्बोकैटायन की तुलना में द्वितीयक कार्बोकैटायन का स्थायित्व अधिक होने के कारण इसमें SN1 अभिक्रिया अधिक तीव्रता से होगी।
, क्योंकि प्राथमिक कार्बोकैटायन की तुलना में द्वितीयक कार्बोकैटायन का स्थायित्व अधिक होने के कारण इसमें SN1 अभिक्रिया अधिक तीव्रता से होगी।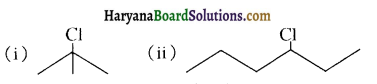
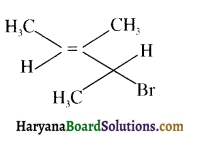
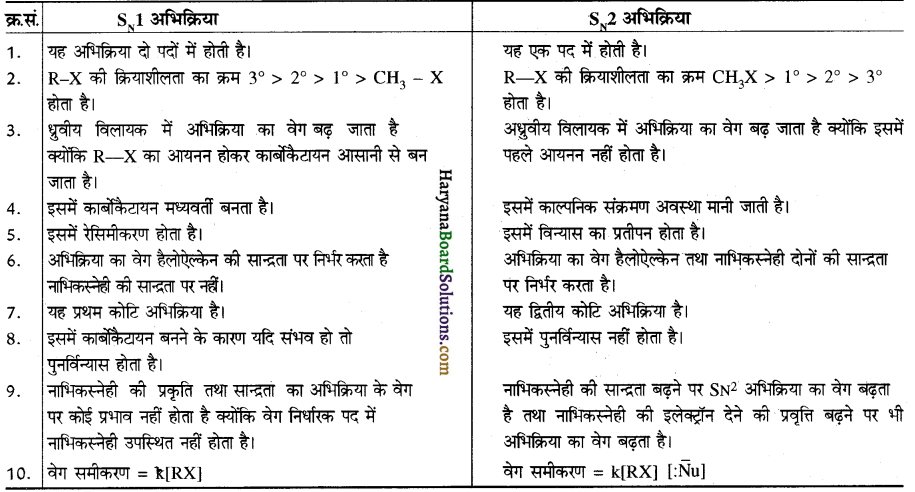
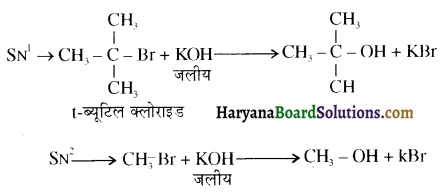

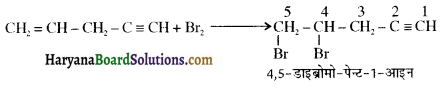

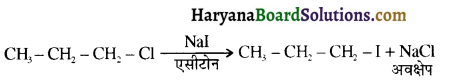
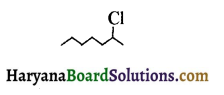
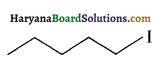 में SN2 अभिक्रिया अधिक तेजी से होगी क्योंकि क्लोरीन की तुलना में आयोडीन का आकार बड़ा होने के कारण C – I बन्ध सुगमता से टूट जाता है।
में SN2 अभिक्रिया अधिक तेजी से होगी क्योंकि क्लोरीन की तुलना में आयोडीन का आकार बड़ा होने के कारण C – I बन्ध सुगमता से टूट जाता है।

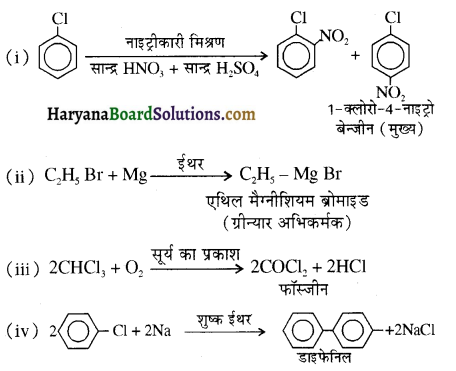
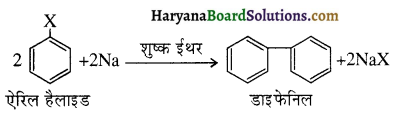


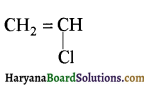
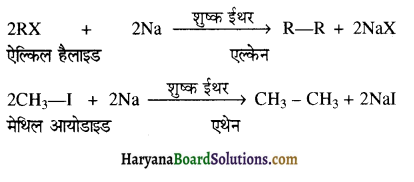

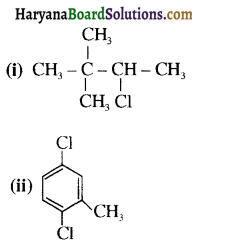
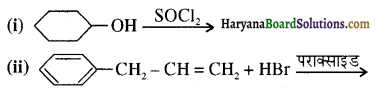
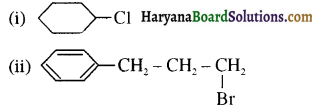

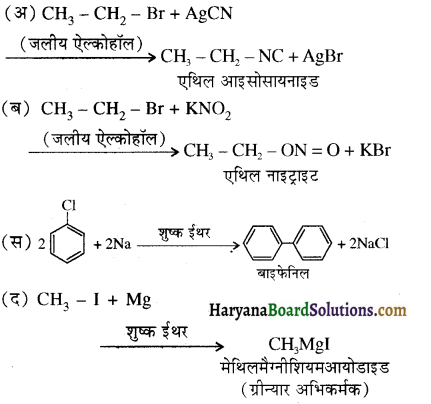
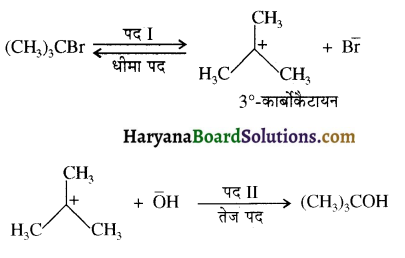
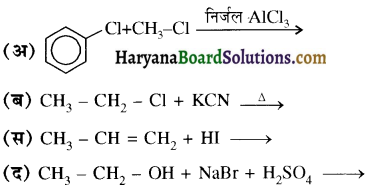
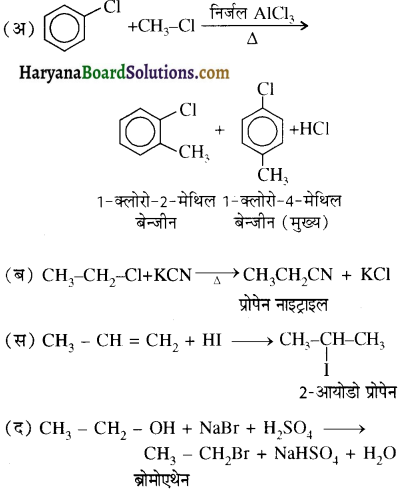
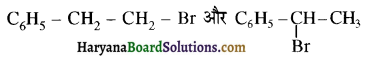
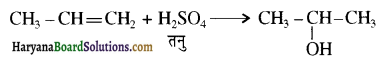



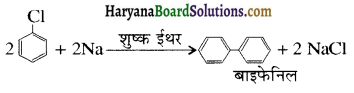









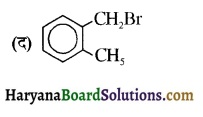
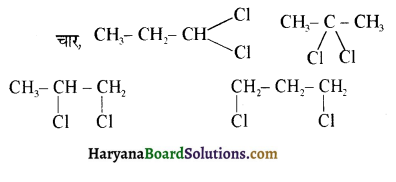
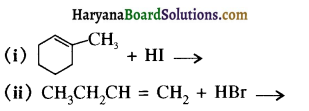
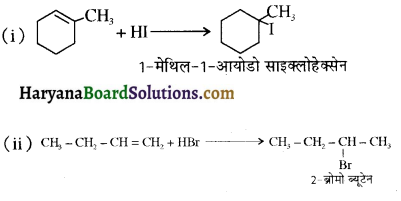
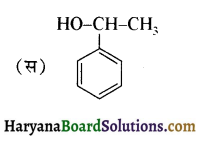
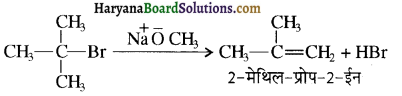
 का IUPAC नाम है-
का IUPAC नाम है-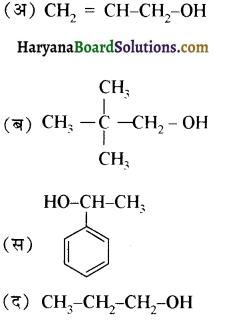
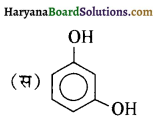
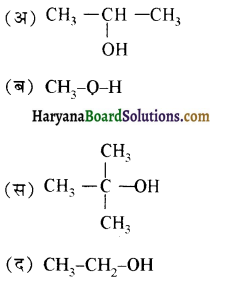
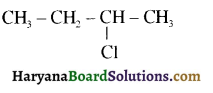
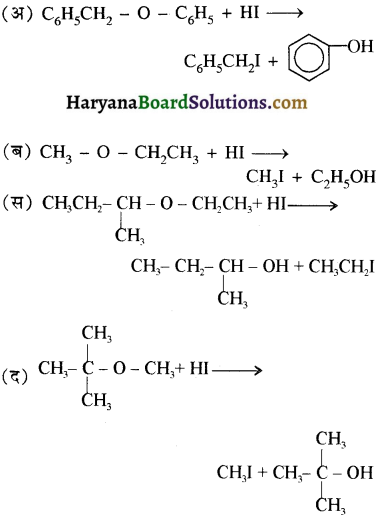
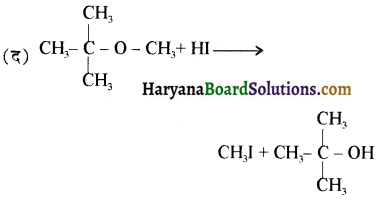
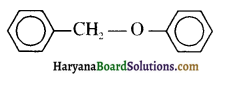 की HI से अभिक्रिया के उत्पाद हैं-
की HI से अभिक्रिया के उत्पाद हैं-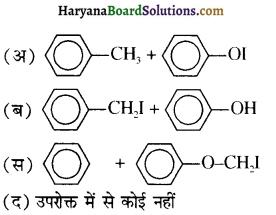
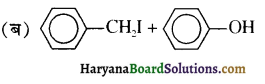
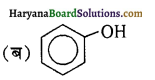
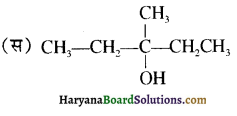
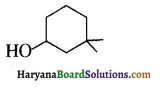 का IUPAC नाम है-
का IUPAC नाम है-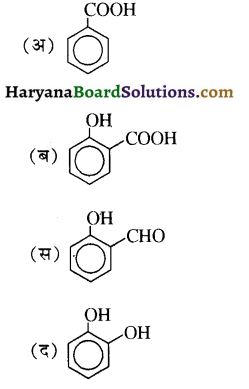
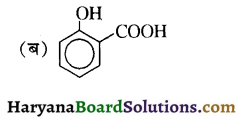
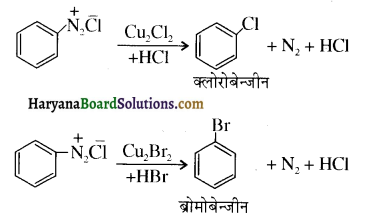
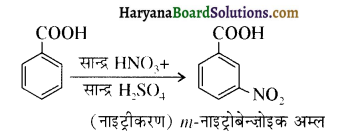
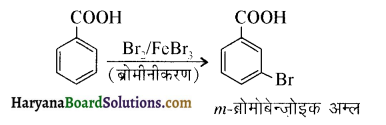
 में निम्न में से कौनसा इलेक्ट्रॉनस्नेही बेन्जीन वलय पर आक्रमण करता है?
में निम्न में से कौनसा इलेक्ट्रॉनस्नेही बेन्जीन वलय पर आक्रमण करता है?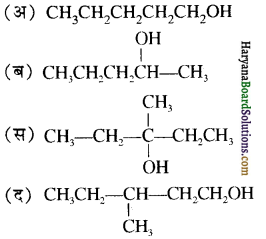



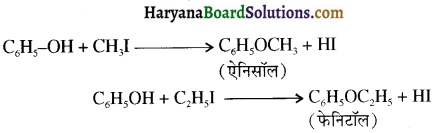

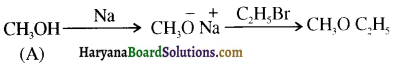
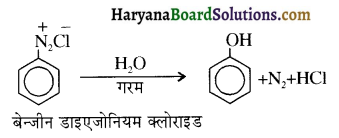
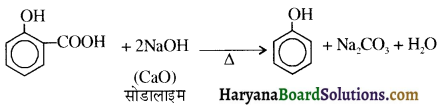
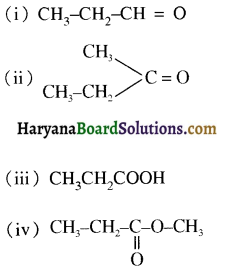
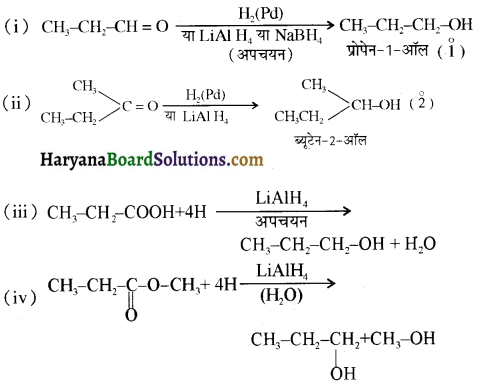
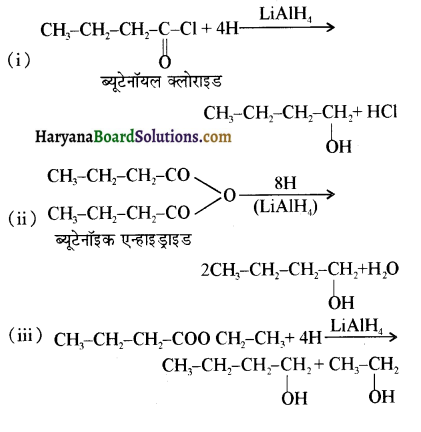
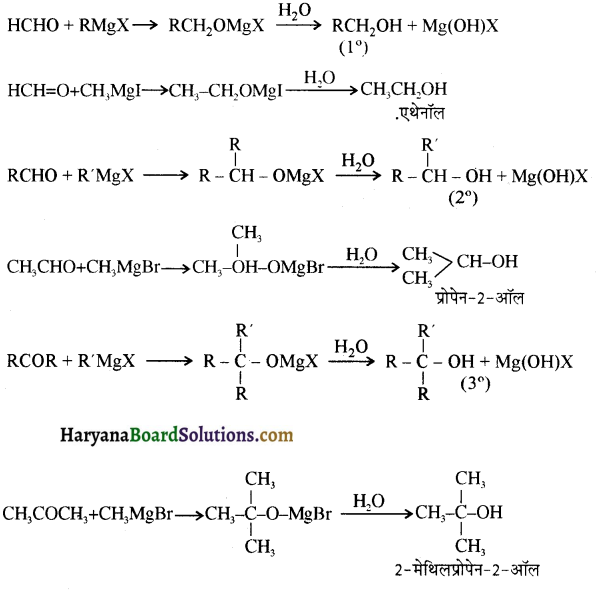
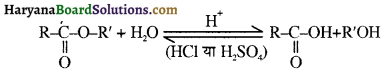
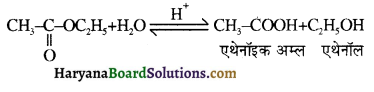
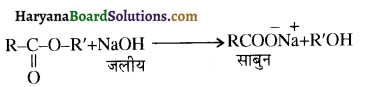
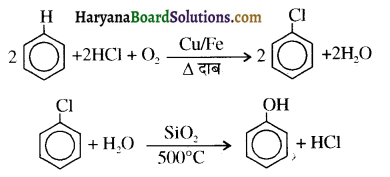
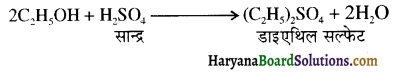
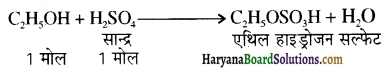
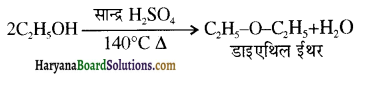
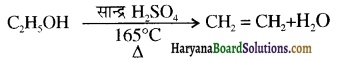
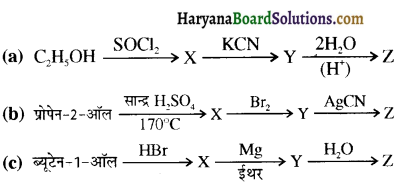
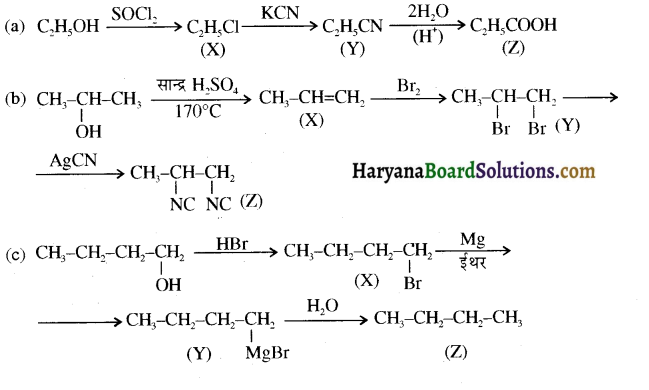
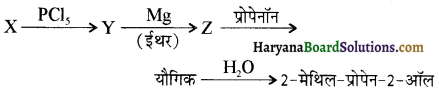
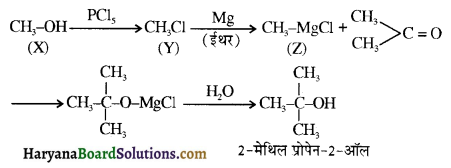
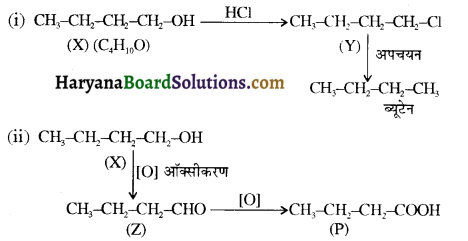
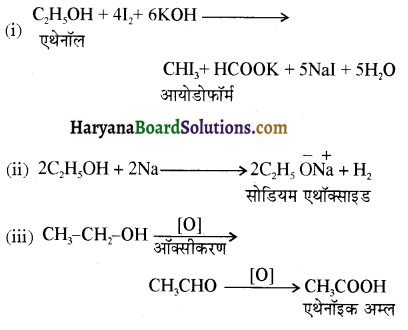
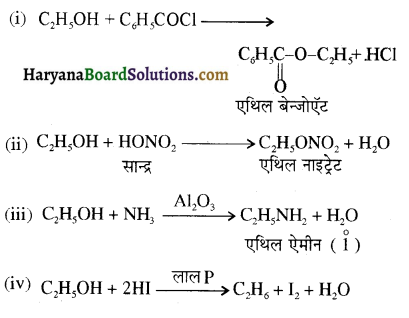
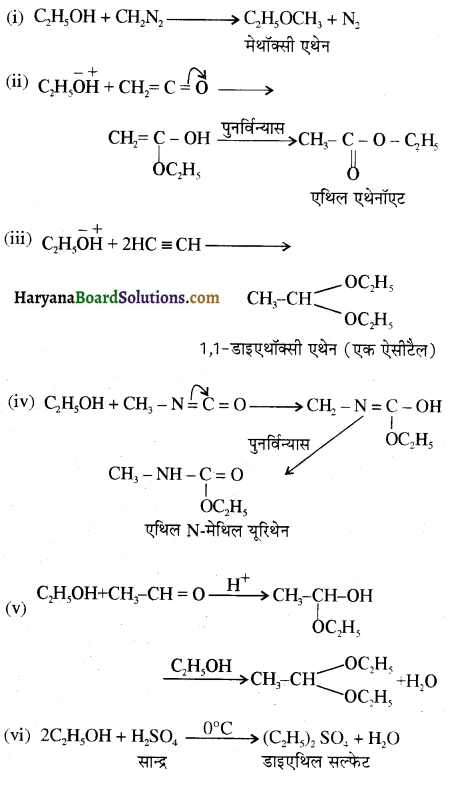
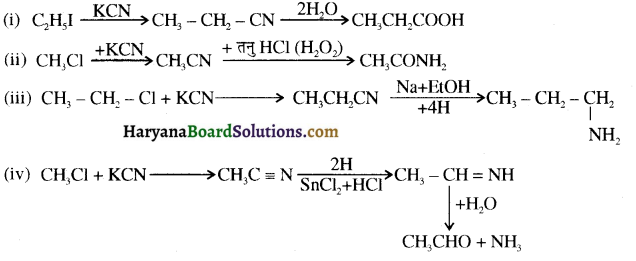
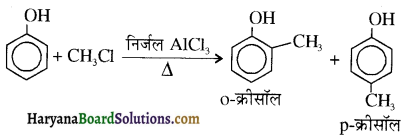
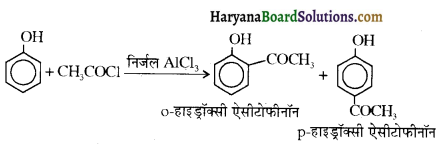
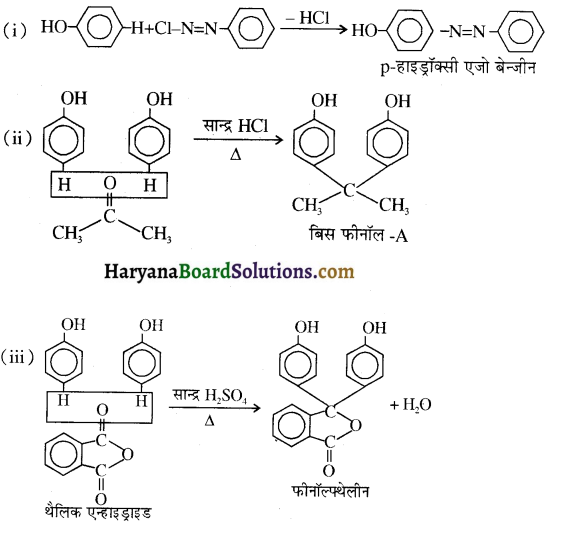
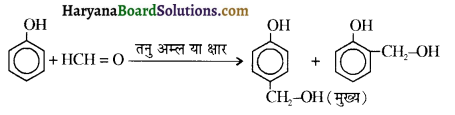
 समूह, युक्त ऐल्कोहॉलों की क्षार की उपस्थिति में हैलोजन से क्रिया करवाने पर हैलोफॉर्म बनते हैं, इसे हैलोफॉर्म अभिक्रिया कहते हैं। उदाहरण-
समूह, युक्त ऐल्कोहॉलों की क्षार की उपस्थिति में हैलोजन से क्रिया करवाने पर हैलोफॉर्म बनते हैं, इसे हैलोफॉर्म अभिक्रिया कहते हैं। उदाहरण-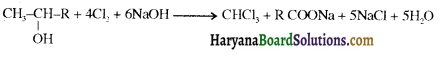
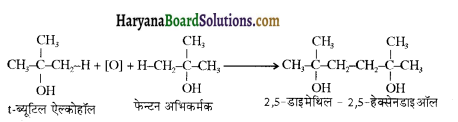
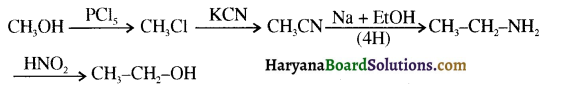
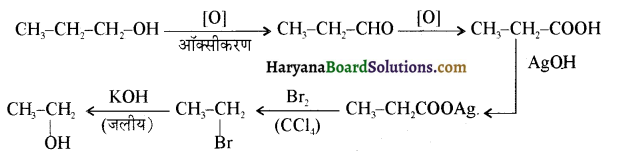
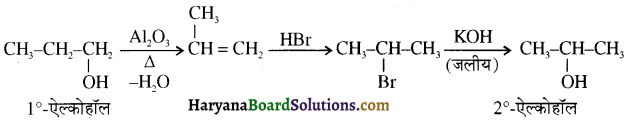
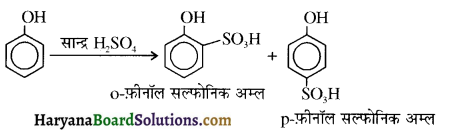
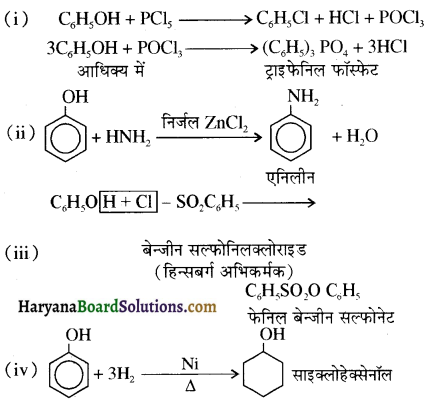
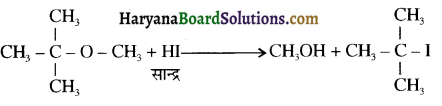

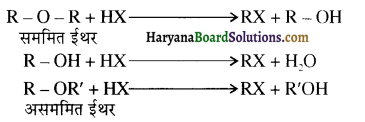
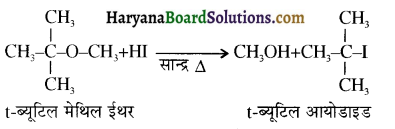
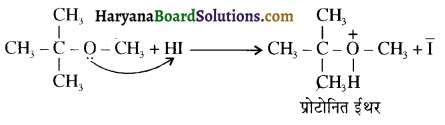
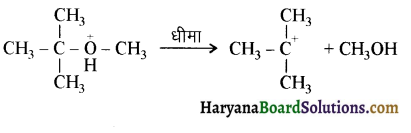


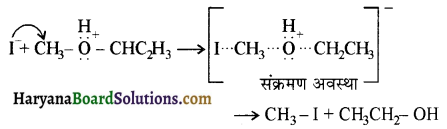
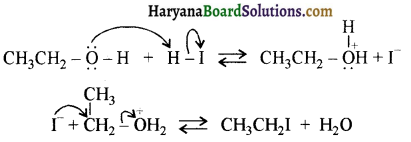
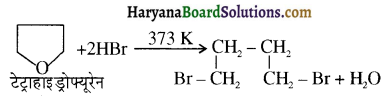
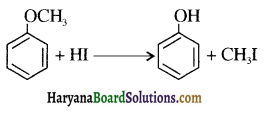

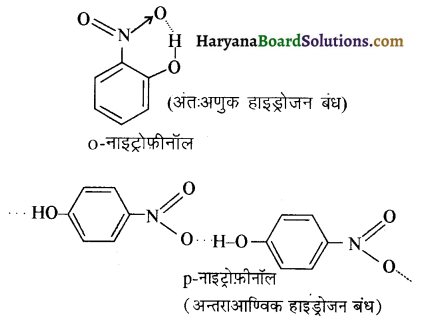
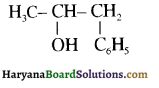
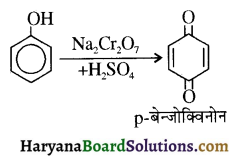
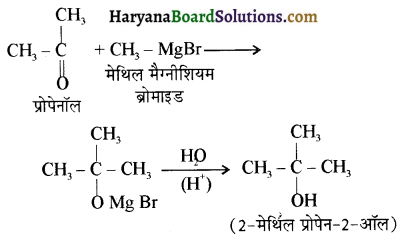
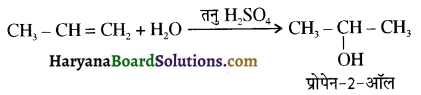
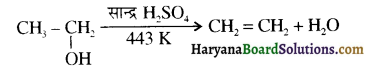
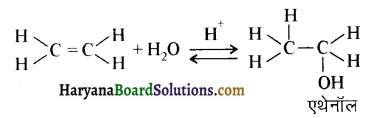
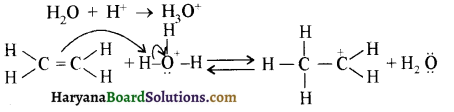
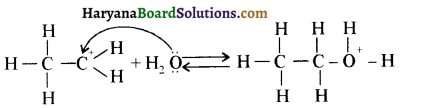
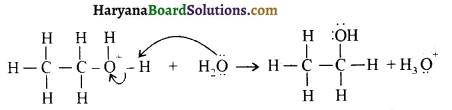
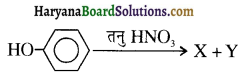
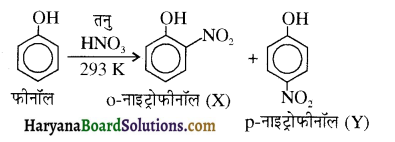
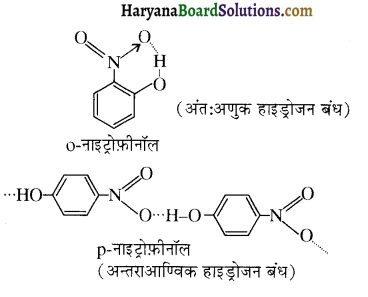
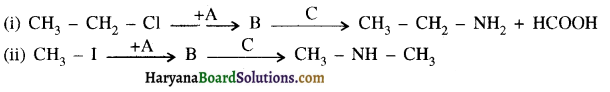
 उपर्युक्त अभिक्रिया को पूर्ण कीजिए एवं अभिक्रिया की क्रियाविधि समझाइए।
उपर्युक्त अभिक्रिया को पूर्ण कीजिए एवं अभिक्रिया की क्रियाविधि समझाइए।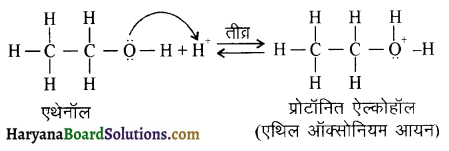
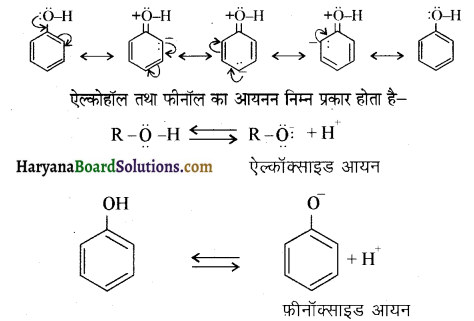
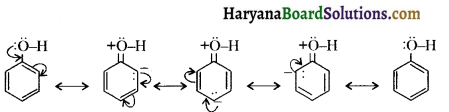
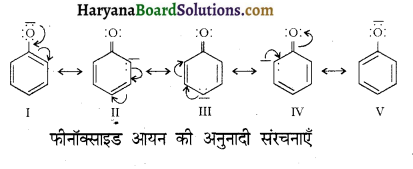
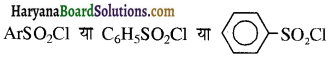
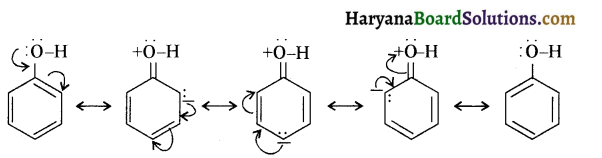
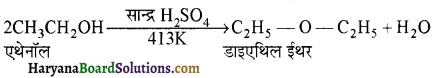
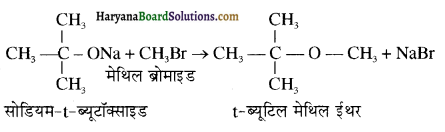
 होता है तथा इसका IUPAC नाम
होता है तथा इसका IUPAC नाम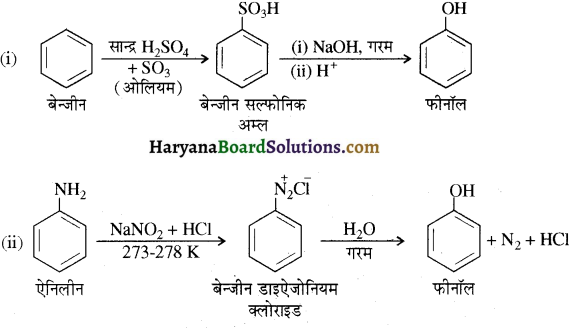
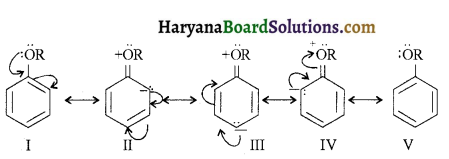
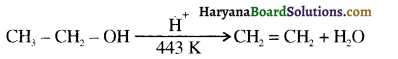
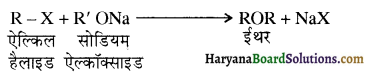


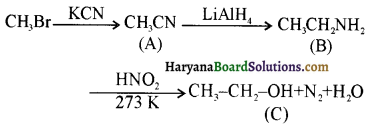
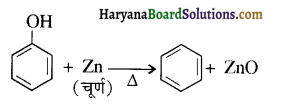
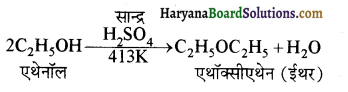
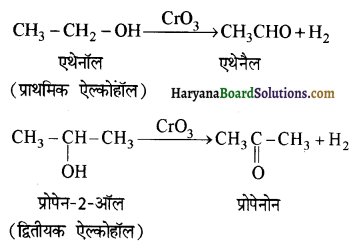
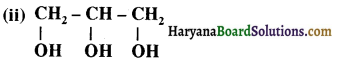




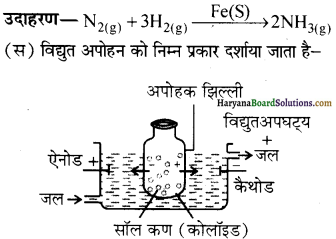

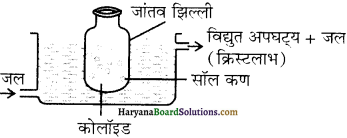


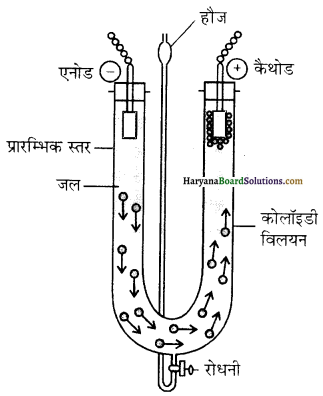

 प्राणियों में एकलिंगी व द्विलिंगी अवस्था होती है। केंचुए (Earthworm), स्पंज, टेपवर्म तथा जोंक (Leech) द्विलिंगी प्राणियों के उदाहरण हैं; इनमें दोनों प्रकार के जनन अंग एक ही प्राणी में मिलते हैं। तिलचट्टा (Cockroach) एकलिंगी प्राणी है।
प्राणियों में एकलिंगी व द्विलिंगी अवस्था होती है। केंचुए (Earthworm), स्पंज, टेपवर्म तथा जोंक (Leech) द्विलिंगी प्राणियों के उदाहरण हैं; इनमें दोनों प्रकार के जनन अंग एक ही प्राणी में मिलते हैं। तिलचट्टा (Cockroach) एकलिंगी प्राणी है।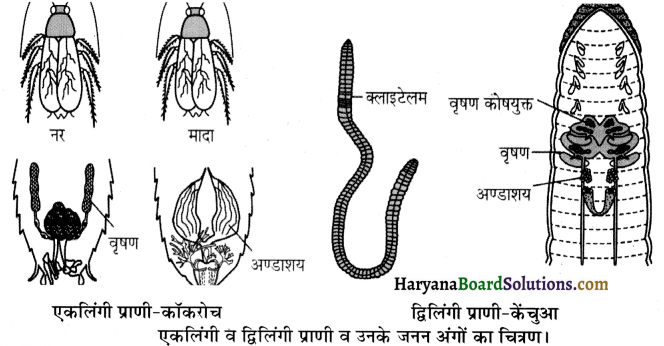
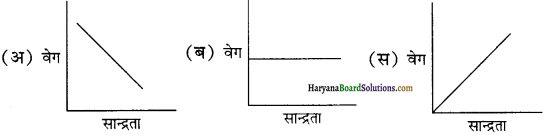
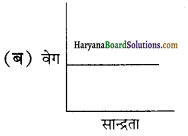
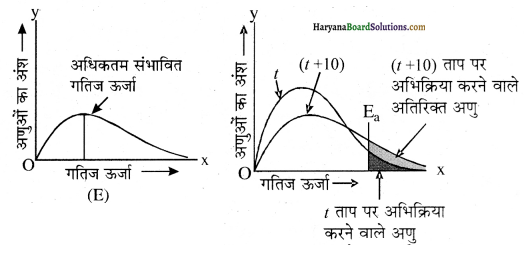
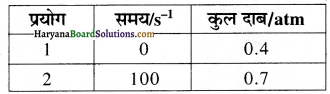
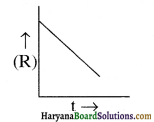
 यह ग्राफ किस कोटि की अभिक्रिया को दर्शाता है?
यह ग्राफ किस कोटि की अभिक्रिया को दर्शाता है?


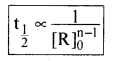

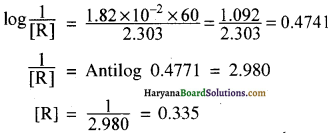




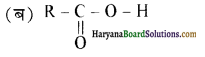
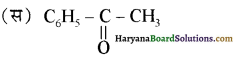
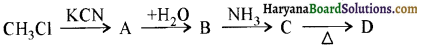
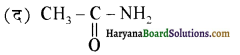
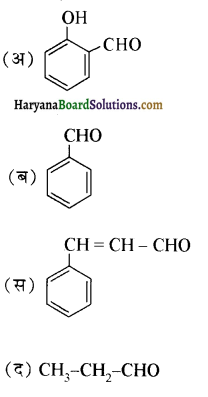
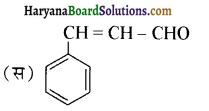
 का IUPAC नाम है-
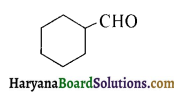
का IUPAC नाम है-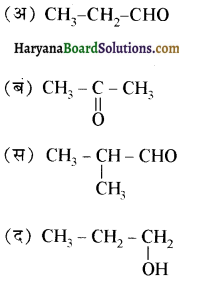
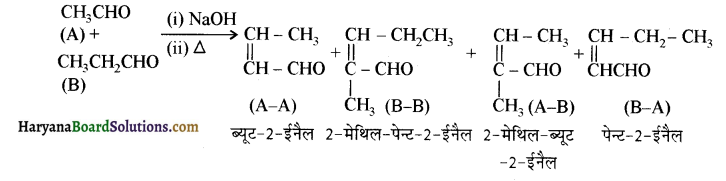
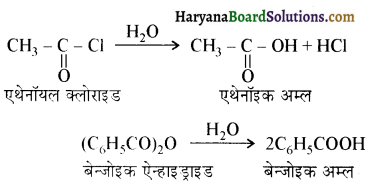
 से प्राप्त यौगिक है-
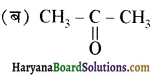
से प्राप्त यौगिक है-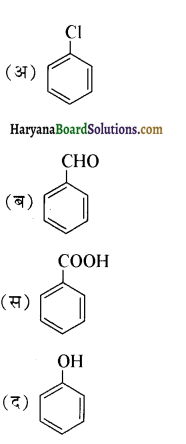
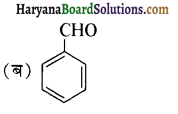
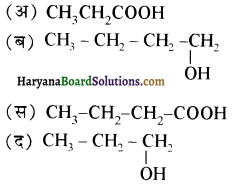
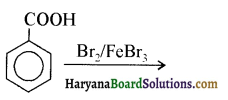 का उत्पाद है-
का उत्पाद है-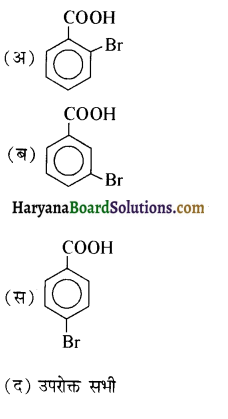
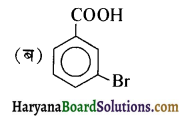
 है-
है-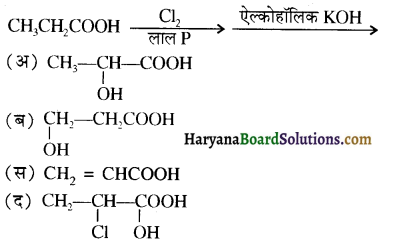
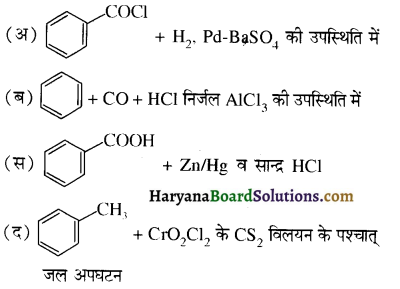

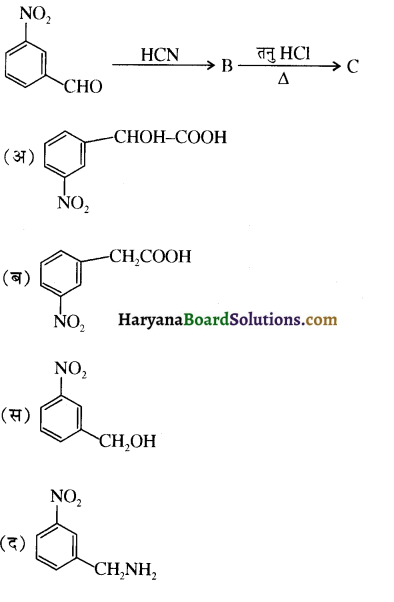
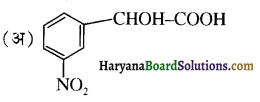
 का IUPAC नाम है-
का IUPAC नाम है-
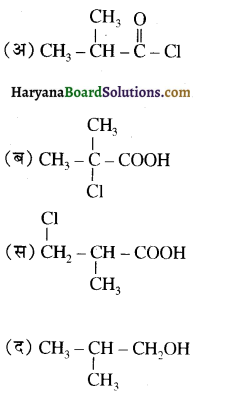

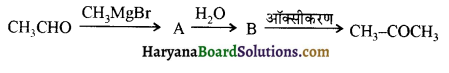
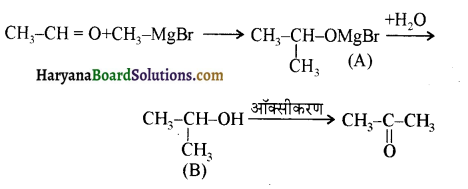
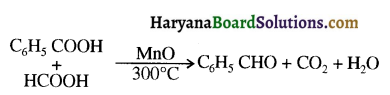
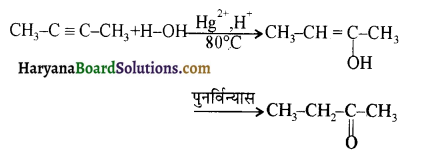
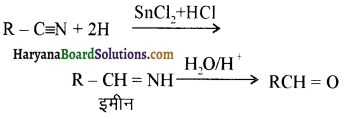
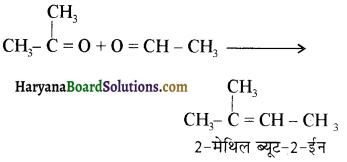
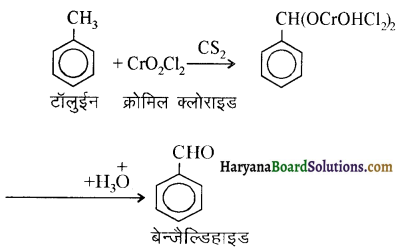


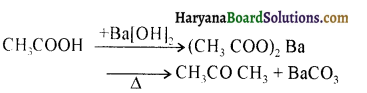
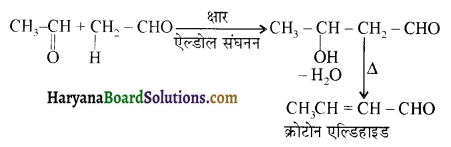
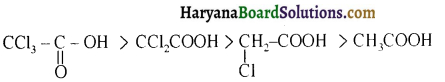
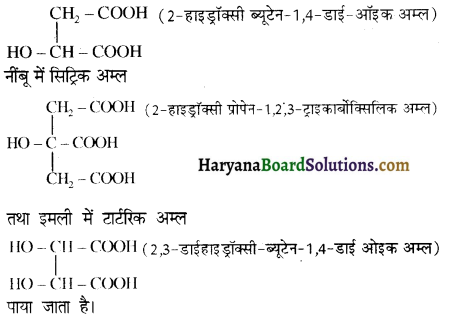
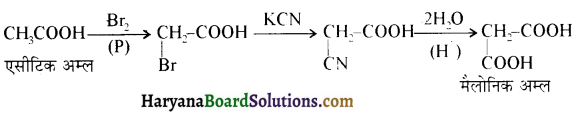

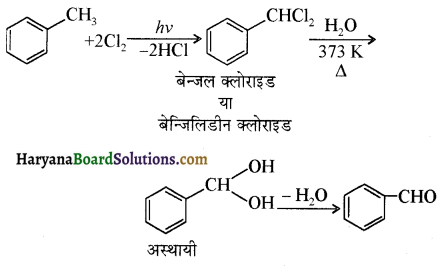
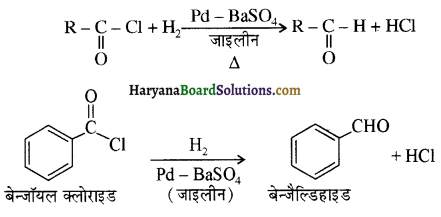
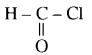

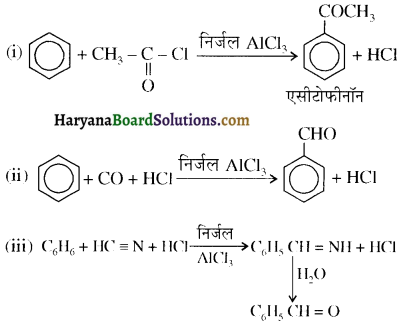
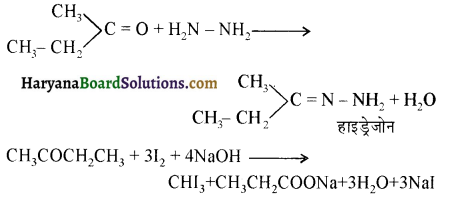
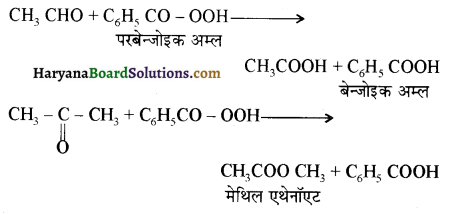
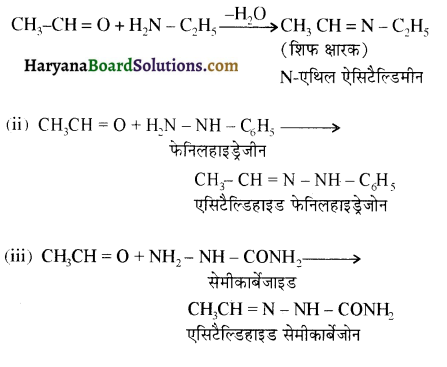
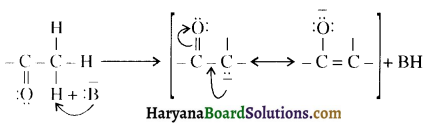
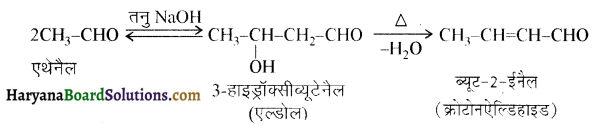
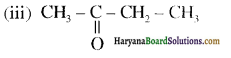
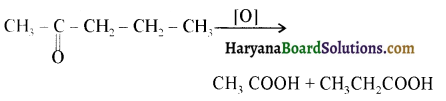
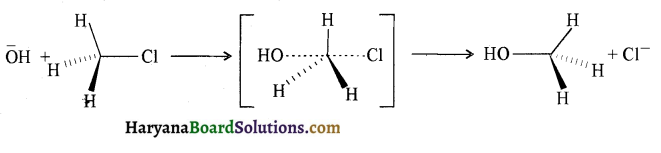
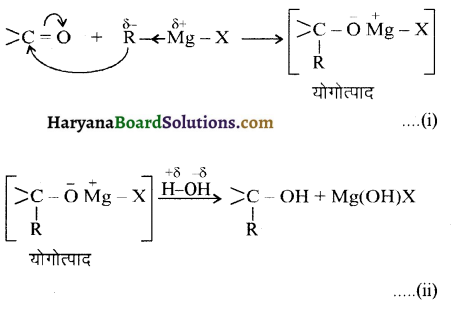
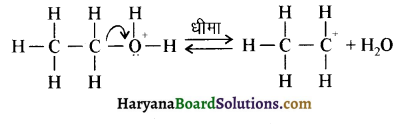
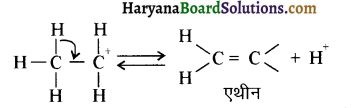
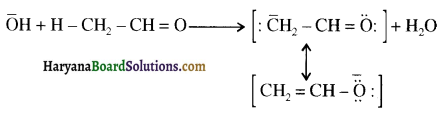
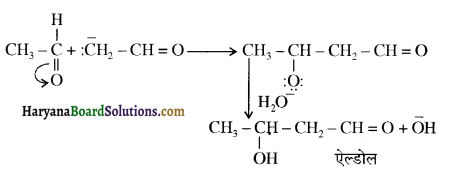
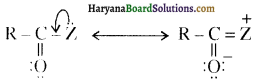
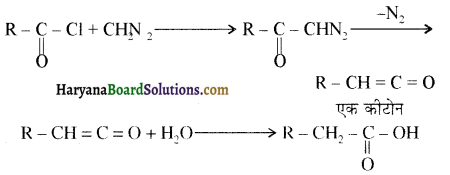
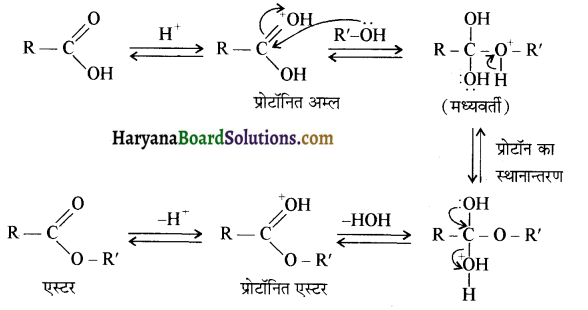
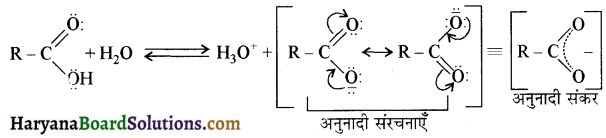
 प्रथम पद में नाभिकस्नेही का आक्रमण धनावेशित (इलेक्ट्रॉन न्यून) कार्बन पर होता है इसी कारण इसे नाभिकस्नेही योगात्मक अभिक्रिया कहते हैं। प्रथम पद में नाभिकस्नेही के आक्रमण की व्याख्या निम्न प्रकार की जा सकती है-
प्रथम पद में नाभिकस्नेही का आक्रमण धनावेशित (इलेक्ट्रॉन न्यून) कार्बन पर होता है इसी कारण इसे नाभिकस्नेही योगात्मक अभिक्रिया कहते हैं। प्रथम पद में नाभिकस्नेही के आक्रमण की व्याख्या निम्न प्रकार की जा सकती है-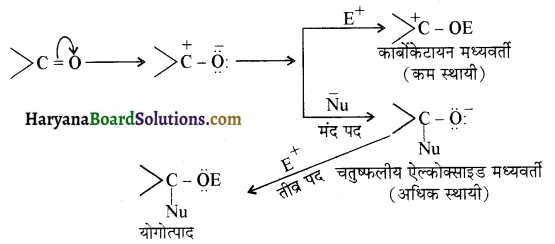
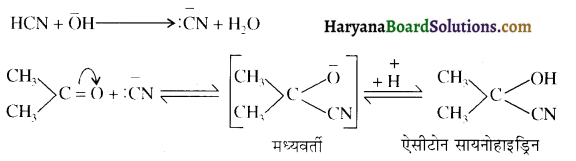
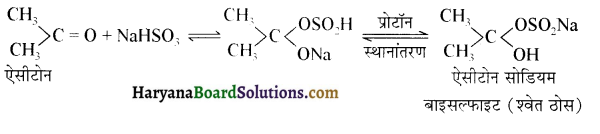
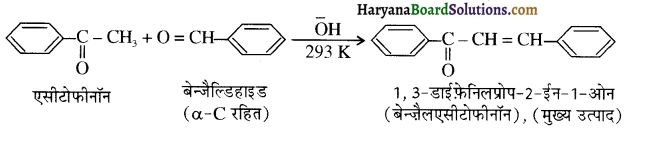
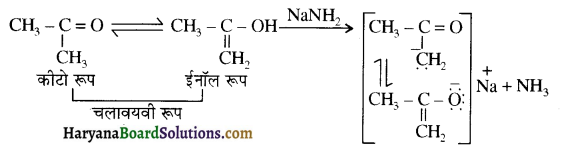
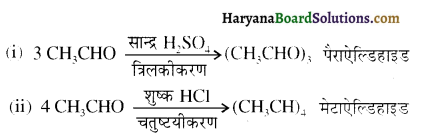


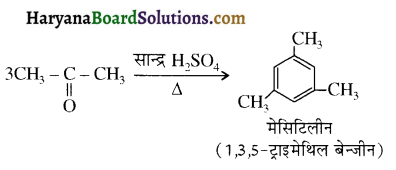
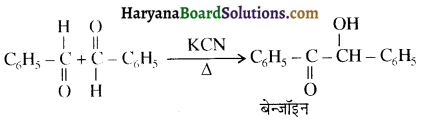
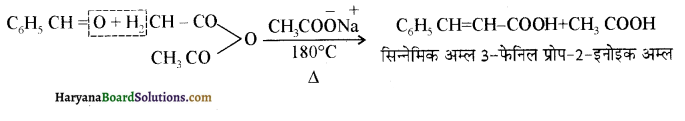
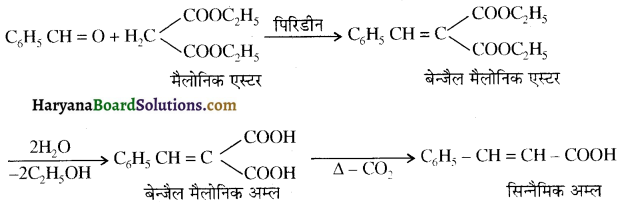
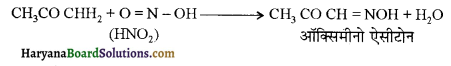
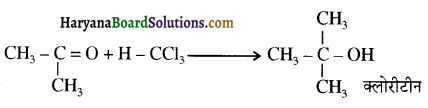
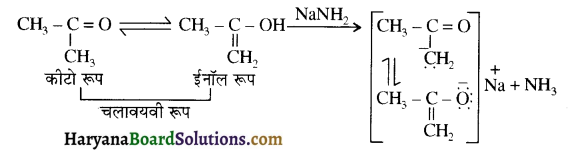
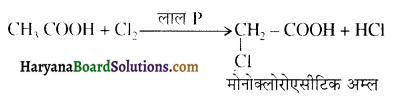
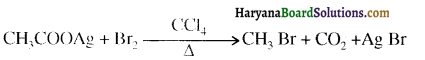





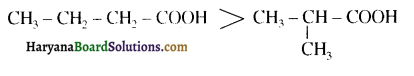
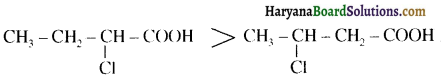
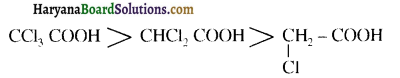
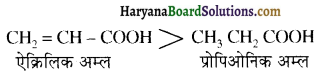
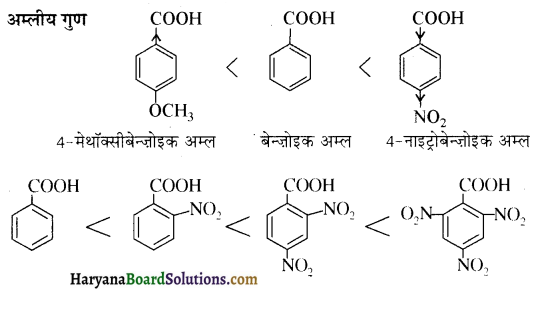
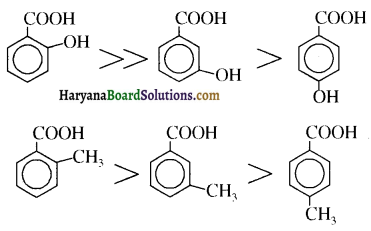

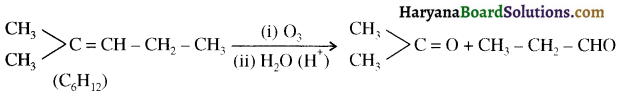
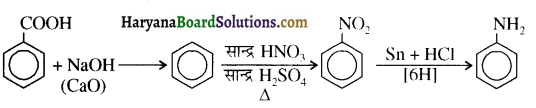
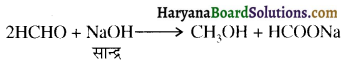
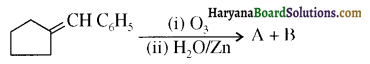
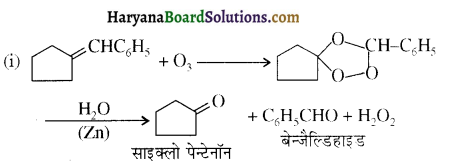
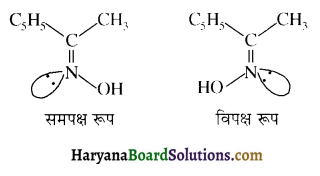
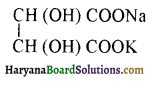 होता है, तथा इस अभिक्रिया में पहले गहरे नीले रंग का संकुल बनता है जिससे Cu2+ आयनों का अवक्षेप [Cu(OH)2] बनने के बजाय ये विलयन में आ जाते हैं। सकुल की संरचना निम्नलिखित है-
होता है, तथा इस अभिक्रिया में पहले गहरे नीले रंग का संकुल बनता है जिससे Cu2+ आयनों का अवक्षेप [Cu(OH)2] बनने के बजाय ये विलयन में आ जाते हैं। सकुल की संरचना निम्नलिखित है- 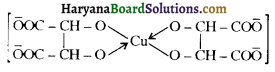 क्यूरिट आयन (गहरा नीला)
क्यूरिट आयन (गहरा नीला)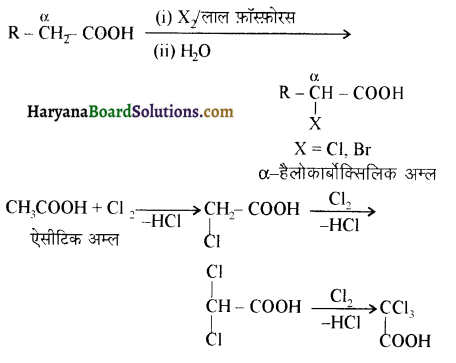
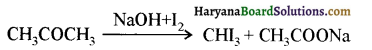
 यह परीक्षण नहीं देता।
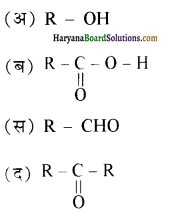
यह परीक्षण नहीं देता।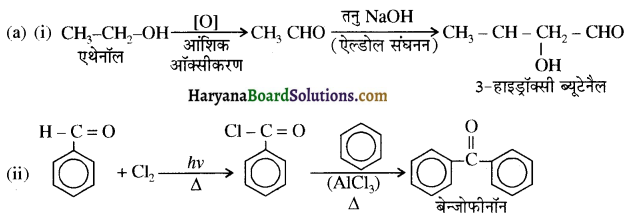

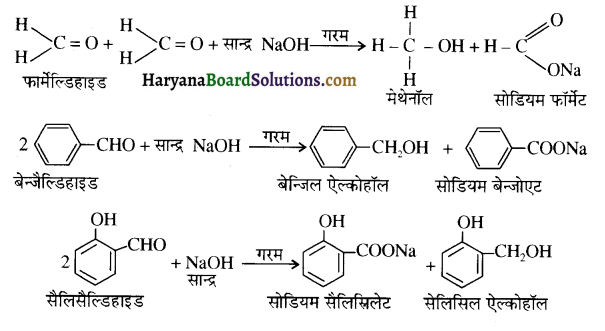
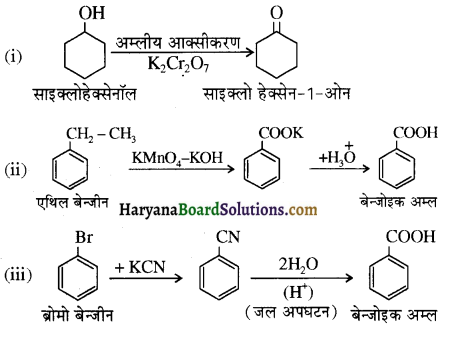
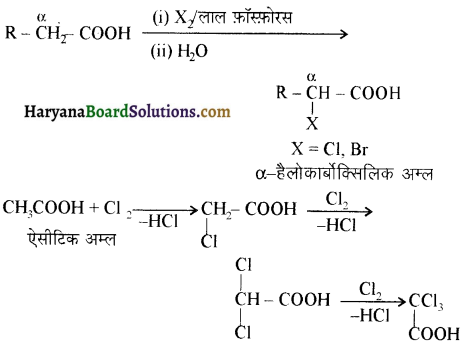
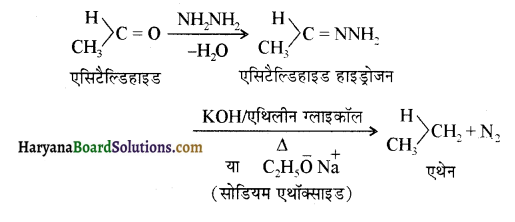
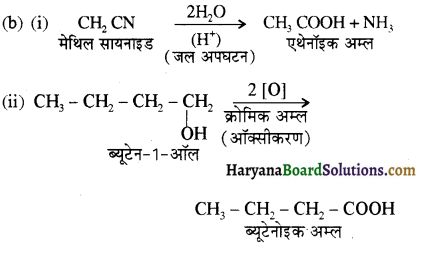
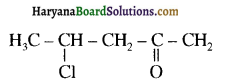
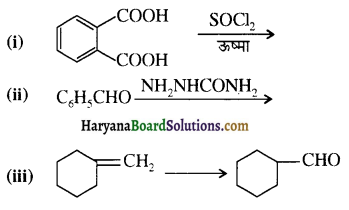
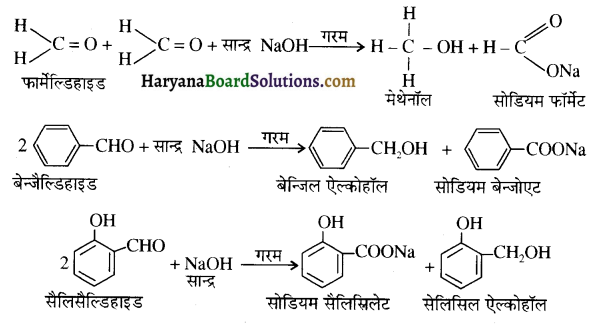
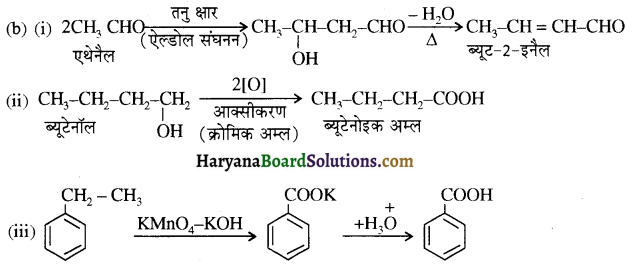

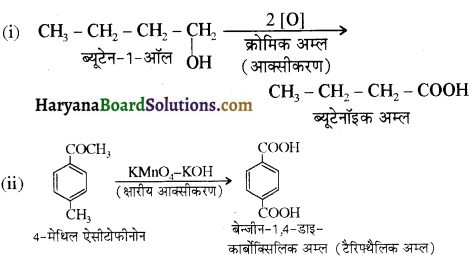


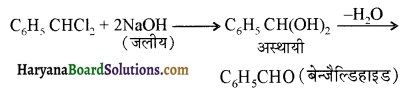
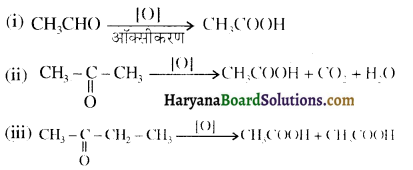
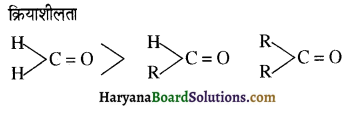
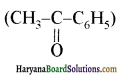 एक मेथिल कीटोन है अतः ऐसीटोफ़ीनॉन, आयोडोफॉर्म परीक्षण देता है जबकि बेन्ज़ैल्डिहाइड यह परीक्षण नहीं देता है।
एक मेथिल कीटोन है अतः ऐसीटोफ़ीनॉन, आयोडोफॉर्म परीक्षण देता है जबकि बेन्ज़ैल्डिहाइड यह परीक्षण नहीं देता है।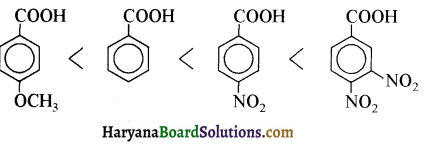
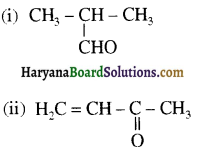
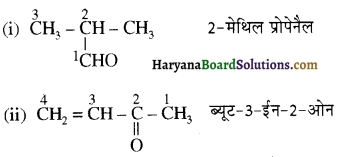
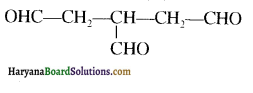
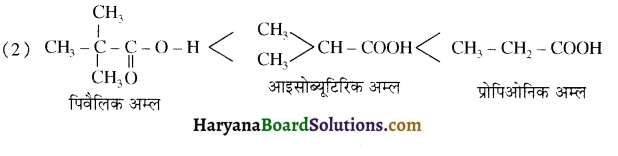
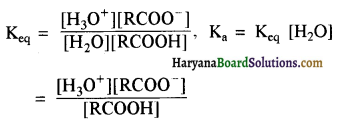
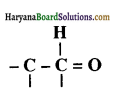 संरचना में α हाइड्रोजन परमाणु की अम्लीय प्रकृति को समझाइए।
संरचना में α हाइड्रोजन परमाणु की अम्लीय प्रकृति को समझाइए।
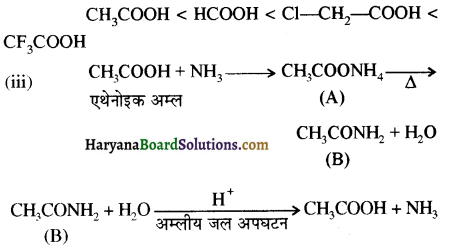
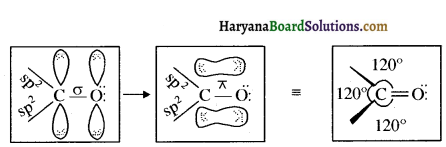
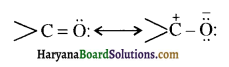
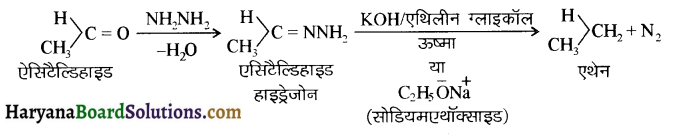
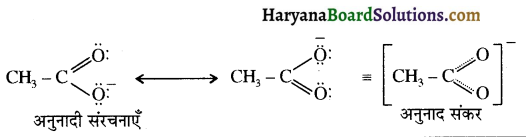
 संरचना में कार्बोनिल समूह है तथा कार्बोनिल यौगिकों के alpha-हाइड्रोजन परमाणु की अम्लता कार्बोनिल समूह के इलेक्ट्रॉन आकर्षित करने के प्रबल प्रभाव तथा संयुग्मी क्षार के अनुनाद द्वारा स्थायित्व प्राप्त कर लेने के कारण होती है।
संरचना में कार्बोनिल समूह है तथा कार्बोनिल यौगिकों के alpha-हाइड्रोजन परमाणु की अम्लता कार्बोनिल समूह के इलेक्ट्रॉन आकर्षित करने के प्रबल प्रभाव तथा संयुग्मी क्षार के अनुनाद द्वारा स्थायित्व प्राप्त कर लेने के कारण होती है।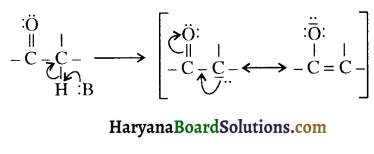

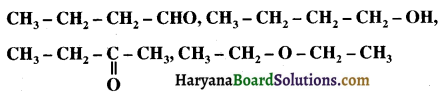
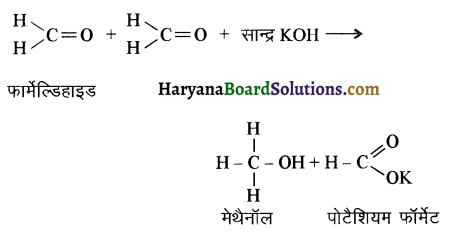
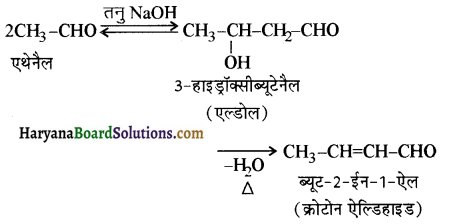
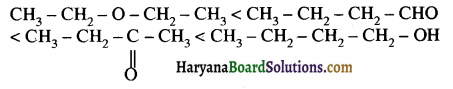
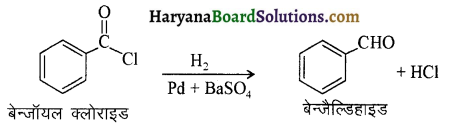
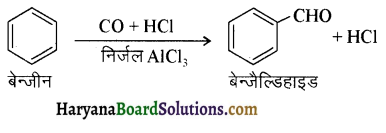
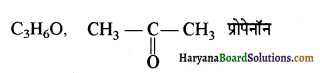

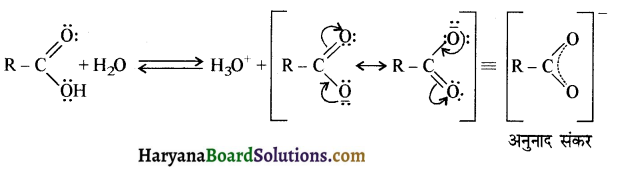
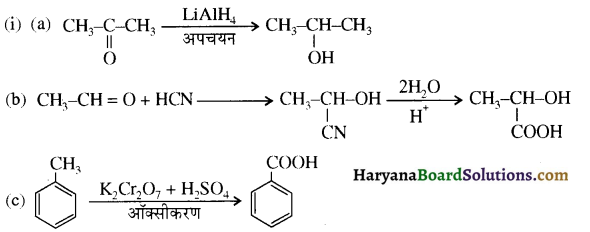
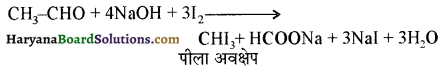
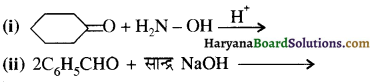
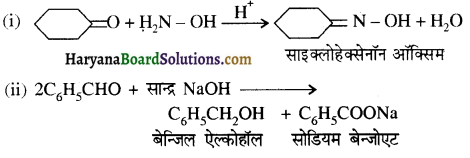
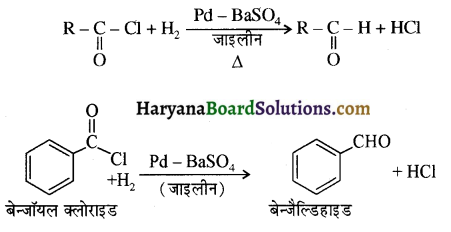

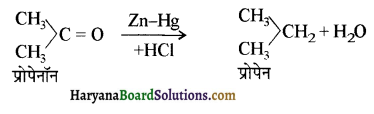
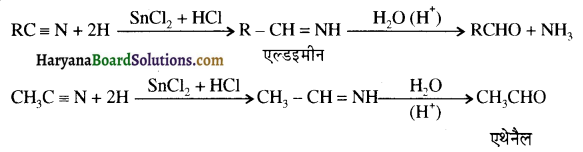
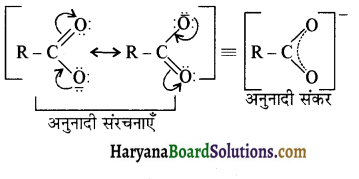
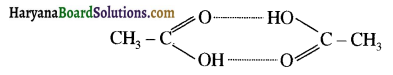
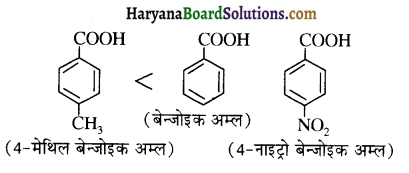
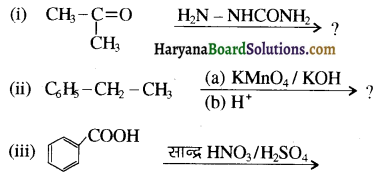
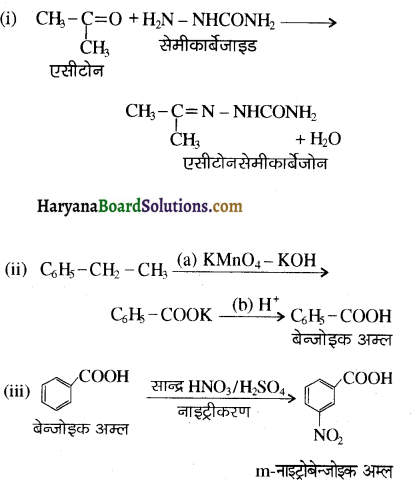
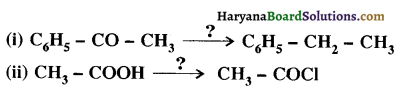

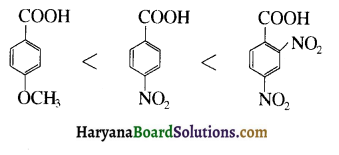








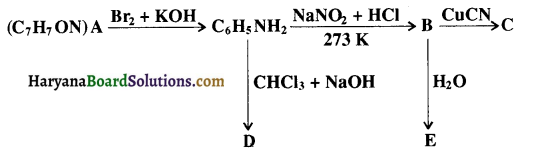
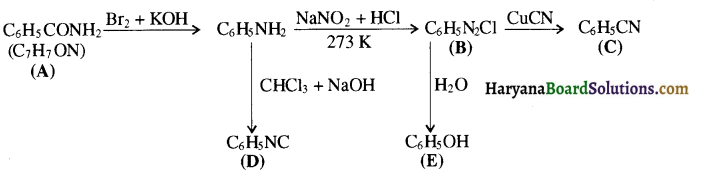
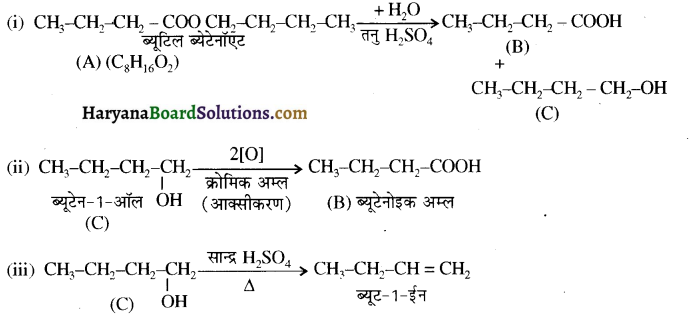
 का LiAlH4 / H2O से अपचयन कराने पर प्राप्त यौगिक है-
का LiAlH4 / H2O से अपचयन कराने पर प्राप्त यौगिक है-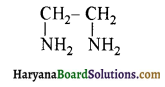 का आई.यू.पी.ए.सी. नाम है-
का आई.यू.पी.ए.सी. नाम है-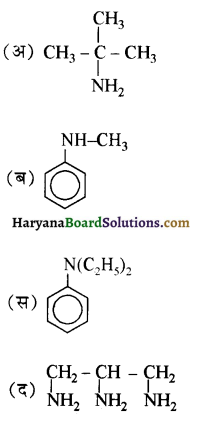
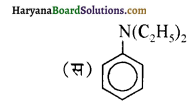
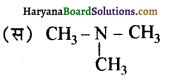
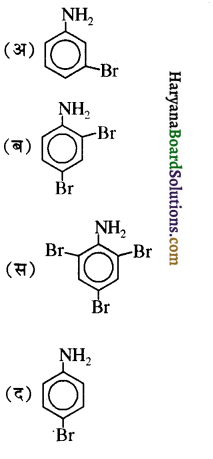
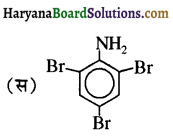

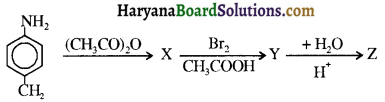
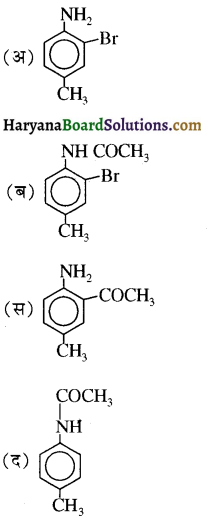
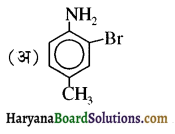

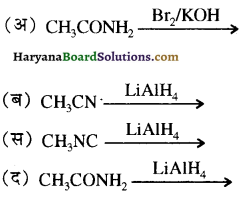

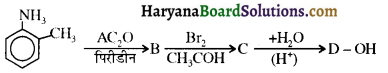
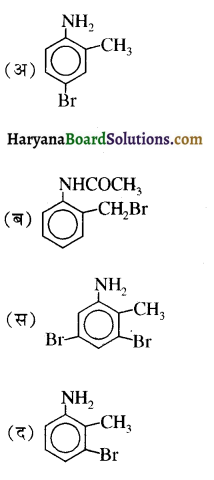
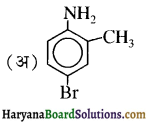
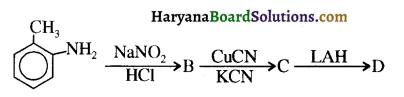
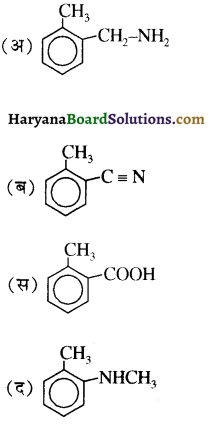
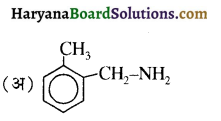
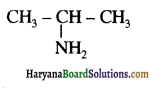

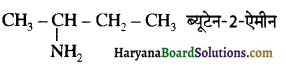
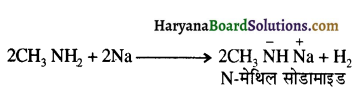
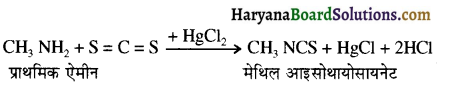
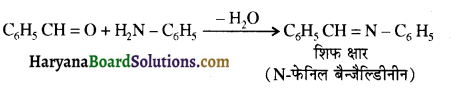
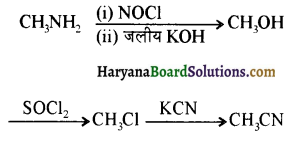
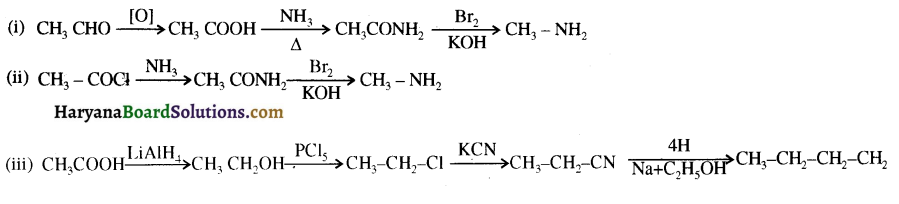
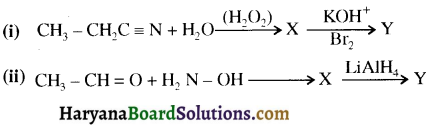
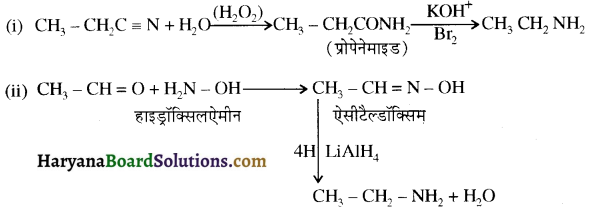
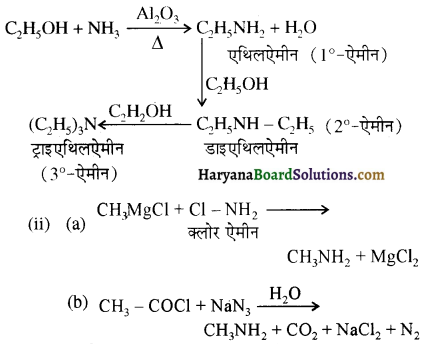
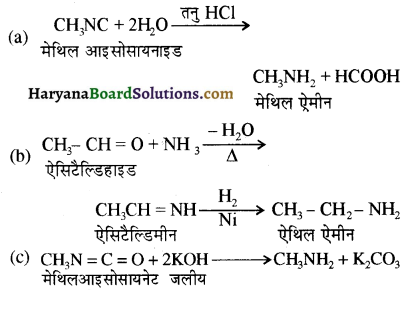
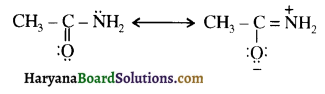
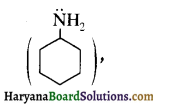 बेन्जीनेमीन
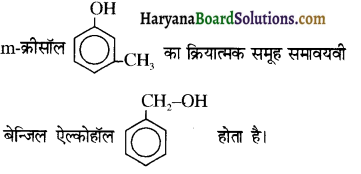
बेन्जीनेमीन 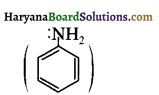 की तुलना में अधिक क्षारीय होती है, क्यों?
की तुलना में अधिक क्षारीय होती है, क्यों?
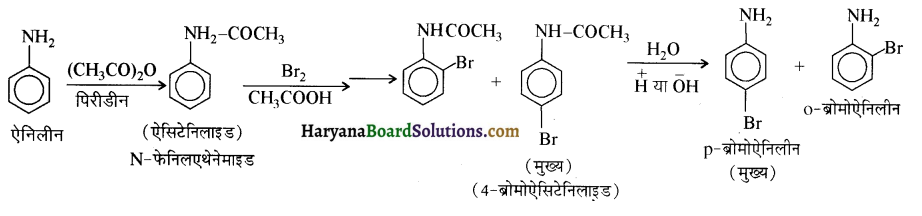
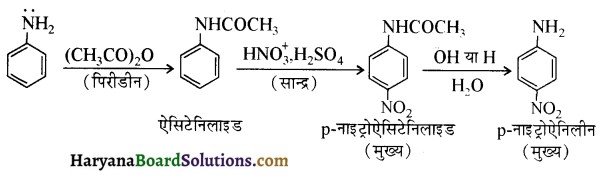
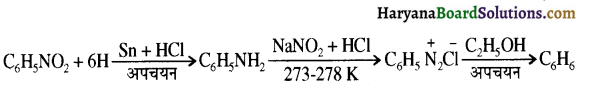
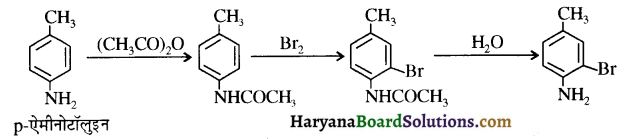
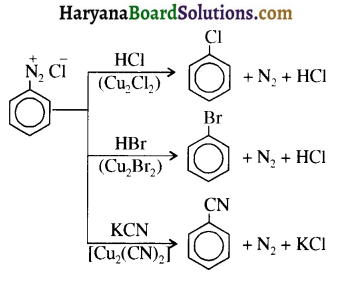
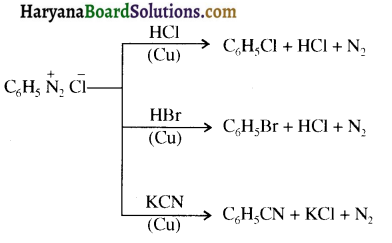
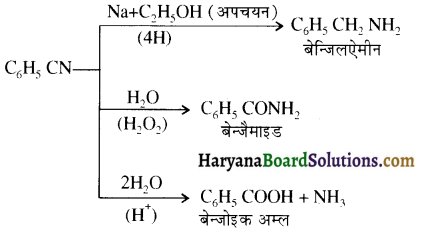
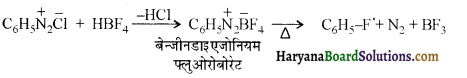
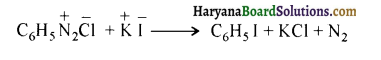
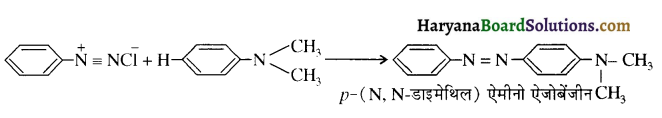
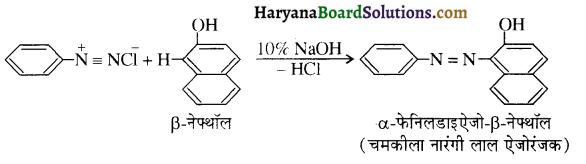
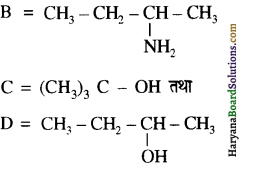
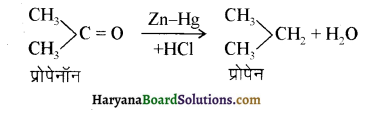
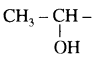 समूह के कारण यह हैलोफॉर्म अभिक्रिया देता है।
समूह के कारण यह हैलोफॉर्म अभिक्रिया देता है।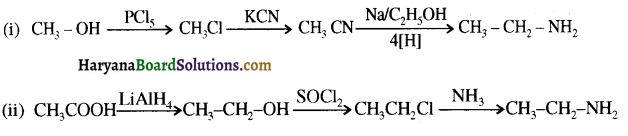
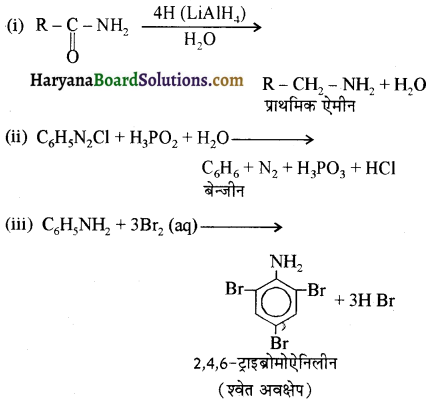
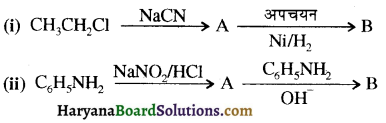
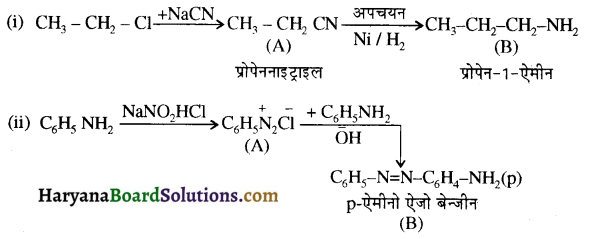
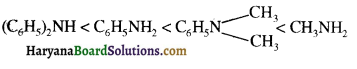
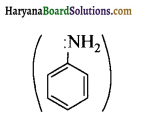 में नाइट्रोजन का एकाकी इलेक्ट्रॉन युग्म बेन्जीन वलय के साथ अनुनाद (+M प्रभाव) करता है जिससे इसके नाइट्रोजन पर इलेक्ट्रॉन घनत्व कम हो जाता है अतः इसकी इलेक्ट्रॉन देने की प्रवृत्ति कम हो जाती है इसलिए इसका क्षारीय गुण कम होता है। इसी कारण ऐनिलीन का pKb मेथिलऐमीन की तुलना में अधिक होता है क्योंकि क्षारीय गुण \(\propto \frac{1}{pK}{b} \propto K{b}\) (क्षार वियोजन स्थिरांक)
में नाइट्रोजन का एकाकी इलेक्ट्रॉन युग्म बेन्जीन वलय के साथ अनुनाद (+M प्रभाव) करता है जिससे इसके नाइट्रोजन पर इलेक्ट्रॉन घनत्व कम हो जाता है अतः इसकी इलेक्ट्रॉन देने की प्रवृत्ति कम हो जाती है इसलिए इसका क्षारीय गुण कम होता है। इसी कारण ऐनिलीन का pKb मेथिलऐमीन की तुलना में अधिक होता है क्योंकि क्षारीय गुण \(\propto \frac{1}{pK}{b} \propto K{b}\) (क्षार वियोजन स्थिरांक)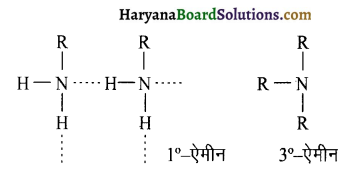
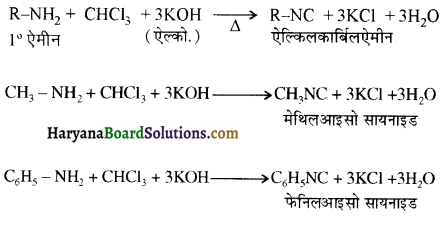
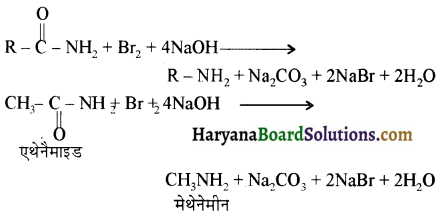
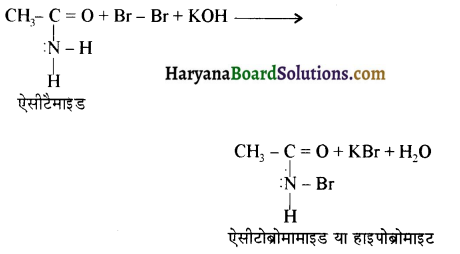
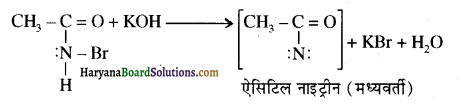
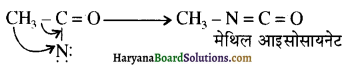
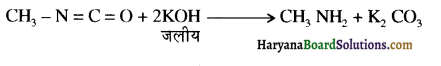

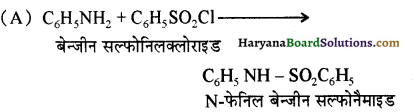
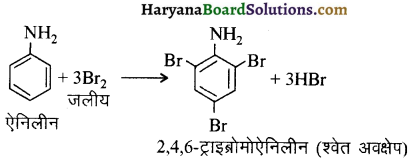
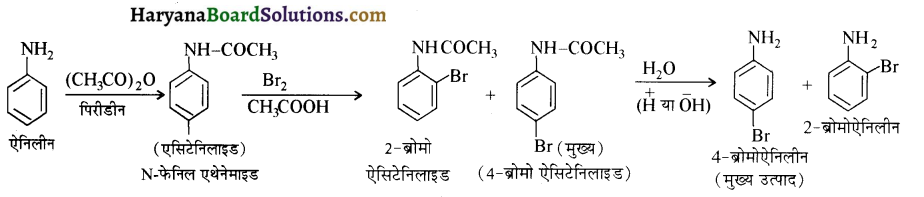
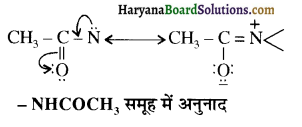
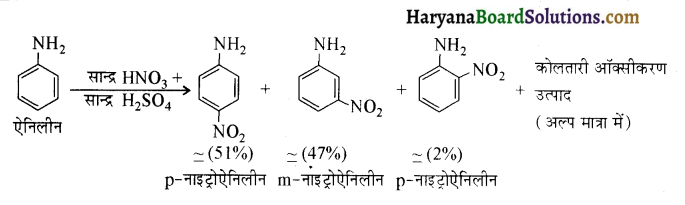
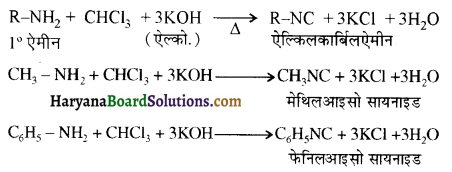
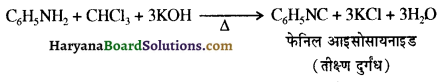
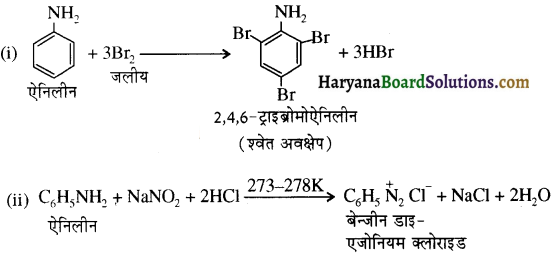
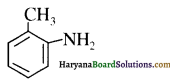
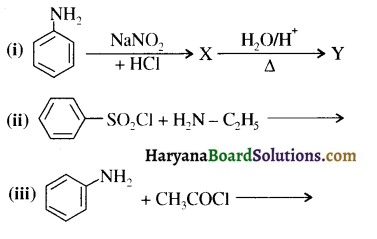
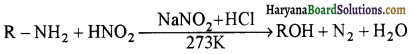

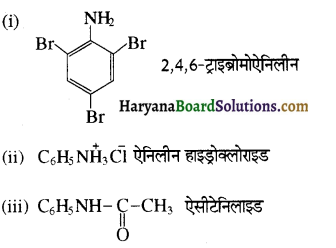
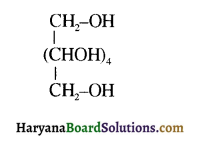
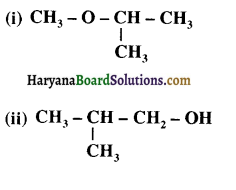
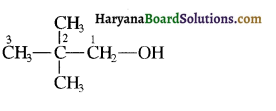
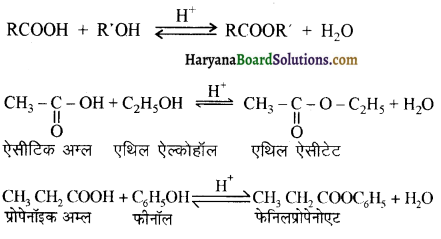
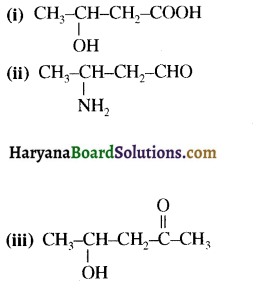
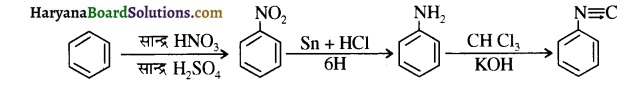
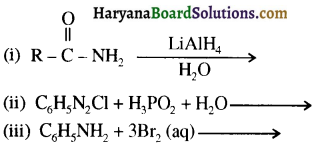
 का IUPAC नाम लिखिए।
का IUPAC नाम लिखिए।