Haryana State Board HBSE 11th Class Chemistry Solutions Chapter 8 अपचयोपचय अभिक्रियाएँ Textbook Exercise Questions and Answers.
Haryana Board 11th Class Chemistry Solutions Chapter 8 अपचयोपचय अभिक्रियाएँ
प्रश्न 1.
निम्नलिखित स्पीशीज में प्रत्येक रेखांकित तत्व की ऑक्सीकरण संख्या का निर्धारण कीजिए-

उत्तर:
(क) NaH2PO4 में माना कि P की ऑक्सीकरण संख्या x है।
Na H2 P O4
(+1) + 2 × (+1) + x + 4 × (- 2) = 0
या + 1 + 2 + x – 8 = 0
या x + 5 = 0
x = + 5
(ख) NaHSO4 में माना कि S की आ. सं. x है।
Na H SO4
+ 1 + 1 + x + 4 × (- 2) = 0
या + 2 + x – 8 = 0
या x – 6 = 0
∴ x = + 6
(ग) H4P2O7 में माना कि P की आ. सं. x है।
H4 P2 O7
4 × (+ 1) + 2 × x + 7 (- 2) = 0
या + 4 + 2x – 14 = 0
या 2x – 10 = 0
या 2x = +10
∴ x = \(\frac { 10 }{ 2 }\) = +5
(घ) K2MnO4 में माना कि Mn की आ. सं. x है
K2 Mn O4
2 × (+ 1) + x + 4 × (- 2) = 0
या + 2 + x – 8 = 0
या x – 6 = 0
∴ x = +6
(ङ) CaO2 में माना कि O की आ. सं. x है।
Ca O2
+ 2 + 2 × x = 0
या 2x = – 2
या x = \(\frac { -2 }{ 2 }\)
∴ x = -1
(च) NaBH4 में माना कि B की आ. सं. x है।
Na B H4
+ 1 + x + 4 × (-1) = 0
या + 1 + x – 4 = 0
या x – 3 = 0
∴ x = +3
![]()
(छ) H2S2O7 में माना कि S की आ. सं. x है।
H2 S2 O7
2 ×(+1) + 2 × x + 7 ×(- 2) = 0
या + 2 + 2x – 14 = 0
या 2x – 12 = 0
या 2x =+ 12
या x = \(\frac { +12 }{ 2 }\)
∴ x = +6
(ज) KAl(SO4)2.12H2O में माना S की आ. सं. x है।
K Al (SO4)2. 12H2O
+ 1 + 3 + 2[x + 4 (-2)] + 12 (2 × 1 + (-2) = 0
या 2x – 12 = 0
या 2x = + 12
या x = \(\frac { +12 }{ 2 }\)
x = +6
प्रश्न 2.
निम्नलिखित यौगिकों के रेखांकित तत्वों की ऑक्सीकरण संख्या क्या है तथा इन परिणामों को आप कैसे प्राप्त करते हैं ?
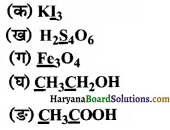
उत्तर:
(क) माना कि KI3 में I की ऑक्सीकरण संख्या x है।
K I3
(+1) + x × 3 = 0
या 3x = -1
∴ x = \(\frac { +1 }{ 3 }\)
स्पष्टीकरण-उपर्युक्त उदाहरण में आयोडीन की ऑक्सीकरण संख्या भिन्नात्मक अर्थात् \(\left(-\frac{1}{3}\right)\) आयी है, जो कि सम्भव प्रतीत नहीं होती है। यदि हम \(\mathrm{I}_3^{-}\) की संरचना पर विचार करें तो हम पायेंगे कि आयोडीन के दो परमाणु सहसंयोजक आबन्ध (I – I) के द्वारा जुड़े हुए हैं तथा आयोडीन आयन (I–) इस अणु से उपसहसंयोजक बन्ध (I–) के द्वारा जुड़ा हुआ है। [I – I ← I]– इस प्रकार KI3 को हम निम्न रूप से प्रदर्शित कर सकते हैं-
K+[I – I ← I]–
अब \(\mathrm{I}_3^{-}\) आयन में दो आयोडीन परमाणुओं की ऑक्सीकरण संख्या शून्य एवं एक I– आयन की ऑक्सीकरण संख्या -1 है। अतः \(\mathrm{I}_3^{-}\) आयन की औसत ऑक्सीकरण संख्या इस प्रकार आयेगी-
\(\frac{0+0+(-1)}{3}\) = \(-\frac{1}{3}\)
(ख) H2S4O6 में माना कि S की ऑक्सीकरण संख्या x है।
H2 S4 O6
2 × (+1) + 4 × x + 6 × (-2) = 0
या + 2 + 4 x – 12 = 0
या 4x – 10 = 0
या 4x = +10
या x = \(\frac { +10 }{ 4 }\)
∴ x = +\(\frac { 5 }{ 2 }\) या + 2.5
स्पष्टीकरण-यहाँ सल्फर की ऑक्सीकरण संख्या भिन्नात्मक है। इस भिन्नात्मक मान को हम अम्ल की संरचना के द्वारा ही स्पष्ट कर सकते हैं। H2S4O6 की संरचना निम्न प्रकार है-
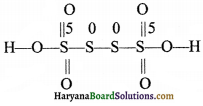
संरचना से स्पष्ट है कि दो मध्यवर्ती सल्फर परमाणुओं की ऑक्सीकरण संख्या शून्य है जबकि सीमान्त स्थिति में स्थित सल्फर परमाणुओं की ऑक्सीकरण संख्या +5 है।
अतः सल्फर की औसत ऑक्सीकरण संख्या
= \(\frac { 1 }{ 4 }\) [5 + 0 + 0 + 5] = \(\frac { 10 }{ 4 }\) = \(\frac { 5 }{ 2 }\)
(ग) Fe3O4 में माना कि Fe की ऑक्सीकरण संख्या x है।
Fe3 O4
3 × x + 4 × (-2) = 0
या 3x – 8 = 0
या 3x = +8
∴ = \(\frac { +8 }{ 3 }\)
स्पष्टीकरण- Fe3 O4 में Fe की ऑक्सीकरण संख्या भिन्नात्मक है। इसका कारण है कि Fe3 O4 एक मिश्रित ऑक्साइड है। यह FeO तथा Fe2 O3 का सममोलर मिश्रण होता है।
FeO में Fe की ऑक्सीकरण संख्या +2 है जबकि Fe2 O3 में दोनों Fe की ऑक्सीकरण संख्या +3 है। अतः
Fe की औसत ऑक्सीकरण संख्या
= \(\frac { 1 }{ 3 }\) [+ 2 + 3 + 3] = \(\frac { 8 }{ 3 }\)
(घ) माना कि CH3CH2OH में C की ऑक्सीकरण संख्या x है।
CH3 CH2 OH
x + 3 + x + 2 + (-2) + 1 = 0
या 2x + 4 = 0
या 2x = -4
या x = \(\frac { -4 }{ 2 }\)
x = -2
स्पष्टीकरण – अब हम CH3CH2OH में C1 तथा C2 परमाणुओं की ऑक्सीकरण संख्या की गणना करते हैं।
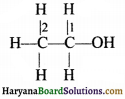
C2 कार्बन परमाणु तीन हाइड्रोजन परमाणुओं के साथ जुड़ा है। ये हाइड्रोजन परमाणु कम वैद्युत ऋणात्मक होते हैं साथ ही यही C2 कार्बन परमाणु एक CH2OH समूह से भी जुड़ा हुआ है। यह समूह कार्बन से अधिक वैद्युत ॠणात्मक है। अतः C2 की ऑक्सीकरण संख्या = 3 × (+1) + x + 1 ×(-1) = 0; x = -2
C1 कार्बन परमाणु जैसा कि चित्र से स्पष्ट है कि, यह एक OH समूह से (जिसकी ऑक्सीकरण संख्या -1 है) तथा दो H परमाणु से (जिसकी ऑक्सीकरण संख्या +1) एवं एक CH3 समूह से (ऑक्सीकरण संख्या = +1) से जुड़ा है, अत:
C1 की ऑक्सीकरण संख्या =
1 × (+1) + x + 1 × (-2) + 1 ×(-1) = 0
या +1 + x – 2 – 1 = 0
∴ x = + 2
कार्बन की औसत ऑक्सीकरण संख्या
= \(\frac { 1 }{ 2 }\) [+2 + -2] = 0
प्रश्न 3.
निम्नलिखित अभिक्रियाओं का अपचयोपचय अभिक्रियाओं के रूप में औचित्य स्थापित करने का प्रयास करें-
(क) CuO(s) +H2(g) → Cu(s) + H2O(g)
(ख) Fe2O3(s) + 3CO(g) → 2Fe(s) + 3 CO2(g)
(ग) 4BCl3(g) + 3LiAlH4(s) → 2 B2H6(g) + 3LiCl(g) + 3 AlCl3(s)
(घ) 2K(s) + F2(g) → 2K2F–(s)
(ङ) 4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
उत्तर:
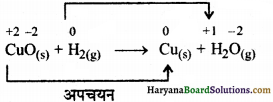
उपर्युक्त अभिक्रिया में CuO से ऑक्सीजन निकल रही है और यह Cu में अपचयित हो रहा है, इसी के साथ-साथ Cu की ऑक्सीकरण संख्या +2 से 0 हो रही है अत: CuO, Cu में अपचयित हो रहा है। इसके साथ-साथ हाइड्रोजन से ऑक्सीजन जुड़ रही है और यह H2 से H2O में परिवर्तित हो रहा है, इसी के साथ-साथ हाइड्रोजन की आ. स. 0 से बढ़कर +1 हो रही है अत: इसका ऑक्सीकरण हो रहा है। इसलिए यह एक अपचयोपचय अभिक्रिया है।
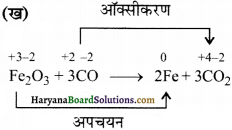
यहाँ Fe की आ. सं. +3 से 0 में परिवर्तित हो रही है। अतः इसका अपचयन हो रहा है जबकि कार्बन की आ. सं. +2 से +4 में परिवर्तित हो रही है अतः इसका ऑक्सीकरण हो रहा है। चूंकि अभिक्रिया में ऑक्सीकरण तथा अपचयन दोनों हो रहे हैं अतः यह एक अपचयोपचय अधिक्रिया है।
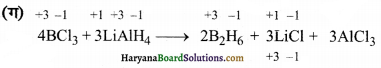
चूंकि उपर्युक्त अभिक्रिया में आ. सं. में कोई परिवर्तन नहीं हो रहा है अतः अपचयोपचय अभिक्रिया नहीं है।
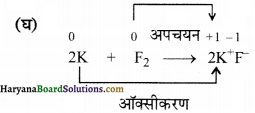
उपर्युक्त अभिक्रिया में K की ऑक्सीकरण संख्या 0 से +1 हो रही है अतः इसका ऑक्सीकरण हो रहा है तथा F की ऑक्सीकरण संख्या 0 से -1 हो रही है अतः इसका अपचयन हो रहा है चूंकि यहाँ ऑक्सीकरण और अपचयन दोनों हो रहे हैं। अतः यह एक अपचयोपचय अभिक्रिया है।

यहाँ ऑक्सीजन का अपचयन हो रहा है क्योंकि ऑक्सीकरण संख्या 0 से -2 में बदल रही है तथा नाइट्रोजन का ऑक्सीकरण हो रहा है क्योंकि इसकी ऑक्सीकरण संख्या -3 से +2 में परिवर्तित हो रही है। अतः यह एक अपचयोपचय अभिक्रिया है। है-
प्रश्न 4.
फ्लोरीन बर्फ से अभिक्रिया करके यह परिवर्तन लाती
H2O(s) + F2(g) → HF(g) + HOF(g)
इस अभिक्रिया का अपचयोपचय औचित्य स्थापित कीजिए।
उत्तर:
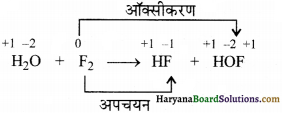
उपर्युक्त अभिक्रिया में फ्लोरीन का अपचयन और ऑक्सीकरण दोनों हो रहा है। यह अपचयोपचय अभिक्रिया के असमानुपात प्रकार का उदाहरण है।
प्रश्न 5.
H2SO5, Cr2O72- तथा NO3– में सल्फर, क्रोमियम तथा नाइट्रोजन की ऑक्सीकरण संख्या की गणना कीजिए। साथ ही इन यौगिकों की संरचना बताइए तथा इसमें हेत्वाभास (Fallacy) का स्पष्टीकरण कीजिए।
उत्तर:
(i) H2SO5 में सल्फर की आ. सं. :
H2 S O5
2 × (+1) + x + 5 × (-2) = 0
+2 + x – 10 = 0
x = +8
परन्तु सल्फर की आ. सं. यहाँ +8 गलत है क्योंकि सल्फर की अधिकतम आ. सं. +6 हो सकती है इससे अधिक नहीं। परन्तु यहाँ सल्फर की आ. सं. +8 इसलिए आयी है क्योंकि यहाँ ऑक्सीजन की आ. सं. को गलत लिखा गया है, यहाँ ऑक्सीजन परऑक्साइड के रूप में उपस्थित है जिसकी आ. सं. (-1) होगी।
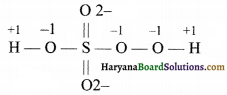
H2 SO2 O3
2 × (+1) + x + 2 × (-1) + 3 × (-2) = 0
या + 2 + x – 2 – 6 = 0
∴ x = +6
अत: सल्फर की आ. सं. +6 है।
(ii) Cr2O72- में क्रोमियम की आ. सं. :
Cr2O72-
2 × x + 7 × (-2) = – 2
या 2x – 14 = – 2
या 2x = +12
∴ x = +6
यह आ. संख्या सही है क्योंकि चित्र के अनुसार प्रत्येक ऑक्सीजन की ऑक्सीकरण संख्या (-2) है।
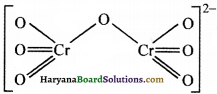
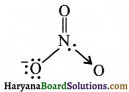
(iii) NO3– में N की ऑक्सीकरण संख्या-
NO3–
x + 3 ×(-2) = -1
या x – 6 = -1
x = +5
यह ऑक्सीकरण संख्या सही है क्योंकि प्रत्येक ऑक्सीजन की ऑक्सीकरण संख्या का मान यहाँ -2 ही है।
प्रश्न 6.
निम्नलिखित यौगिकों के सूत्र लिखिए-
(क) मरकरी (II) क्लोराइड
(ख) निकिल (II) सल्फेट
(ग) टिन (IV) ऑक्साइड
(घ) थैलियम (I) सल्फेट
(ङ) आयरन (III) सल्फेट
(च) क्रोमियम (III) ऑक्साइड
उत्तर:
(क) HgCl2
(ख) NiSO4
(ग) SnO2
(घ) Tl2SO4
(ङ) Fe2(SO4)3
(च) Cr2O3
प्रश्न 7.
उन पदार्थों की सूची तैयार कीजिए जिनमें कार्बन की -4 से +4 तक तथा नाइट्रोजन -3 से +5 तक की ऑक्सीकरण अवस्था होती है।
उत्तर:
कार्बन की परिवर्ती ऑक्सीकरण अवस्थाएँ (-4 से +4 तक)
Table
प्रश्न 8.
अपनी अभिक्रियाओं में सल्फर डाइ- ऑक्साइड तथा हाइड्रोजन परऑक्साइड ऑक्सीकारक तथा अपचायक दोनों ही रूपों में क्रिया करते हैं जबकि ओजोन तथा नाइट्रिक अम्ल केवल ऑक्सीकारक के रूप में ही। क्यों ?
उत्तर:
सल्फर डाइऑक्साइड SO2 तथा हाइड्रोजन परऑक्साइड (H2O2) में सल्फर तथा ऑक्सीजन की ऑक्सीकरण अवस्थाएँ क्रमश: +4 तथा -1 हैं। ये यौगिक रासायनिक अभिक्रियाओं में भाग लेने के दौरान अपनी ऑक्सीकरण संख्याएँ घटा या बढ़ा सकते हैं अर्थात् ऑक्सीकारक तथा अपचायक दोनों ही रूपों में क्रिया कर सकते हैं।

ओजोन (O3) में ऑक्सीजन की ऑक्सीकरण अवस्था शून्य है, जबकि नाइट्रिक अम्ल में नाइट्रोजन की ऑक्सीकरण अवस्था +5 है। चूँकि ये दोनों ऑक्सीकरण अवस्था में कमी तो प्रदर्शित कर सकते हैं, परन्तु वृद्धि नहीं कर सकते; अतः ये केवल ऑक्सीकारक की भाँति कार्य करते है, अपचायक के रूप में नहीं।
प्रश्न 9.
इन अभिक्रियाओं को देखिए-
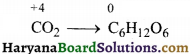
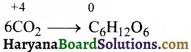
(क) 6CO2(g) + 6H2O(l) → C6H12O6(aq) + 6O2(g)
(ख) O3(g) + H2O2(l) → H2O(l) + 2O2(g)
बताइए कि इन्हें निम्नलिखित ढंग से लिखना ज्यादा उचित क्यों है ?
(क) 6CO2(g) + 12H2O(l) → C6H12O6(aq) + 6H2O(l) + 6O2(g)
(ख) O3(g) + H2O2(l) → H2O(l) + O2(g) + O2(g)
उपर्युक्त अपचयोपचय अभिक्रियाओं (क) तथा (ख) के अन्वेषण की विधि सुझाइए।
उत्तर:
(क) 6CO2(g) + 6H2O(l) → C6H12O6(aq) + 6O2(g)
उपर्युक्त समीकरण को असन्तुलित अवस्था में लिखते हैं-
CO2(g) + H2O(l) → C6H12O6(aq) + O2(g)
अब इस समीकरण को अर्द्ध-अभिक्रिया या आयन इलेक्ट्रॉन विधि से सन्तुलित करने पर-
पद 1. सर्वप्रथम सभी की आक्सीकरण संख्या लिखते हैं। अपचयन
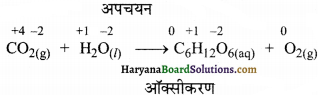
पद 2. अब इन्हें ऑक्सीकरण अर्द्ध-अभिक्रिया तथा अपचयन अर्द्ध-अभिक्रिया के रूप में लिखने पर,
(A) ऑक्सीकरण अर्द्ध अभिक्रिया-
![]()
पद (a) ऑक्सीजन को सन्तुलित करने
![]()
पद (b) ऑक्सीकरण संख्या सन्तुलित करने पर,
2H2O → O2 + 4e–
पद (c) हाइड्रोजन सन्तुलित करने पर,
2H2O → O2 + 4e– + 4H+
(B) अपचयन अर्द्ध-अभिक्रिया
पद (a) कार्बन सन्तुलित करने पर,
पद (b) ऑक्सीकरण संख्या सन्तुलित करने पर,
6CO2 + 24e– → C6H12O6
पद (c) ऑक्सीजन संतुलित करने पर,
6CO2 + 24e– → C6H12O6 + 6H2O
पद (d) हाइड्रोजन की संख्या संतुलित करने पर,
6CO2 + 24e– + 24H+ → C6H12O6 + 6H2O
पद 3. अब सन्तुलित ऑक्सीकरण तथा अपचयन अर्द्ध-अभिक्रियाओं को जोड़ने पर तथा इलेक्ट्रॉन की संख्या सन्तुलित करने के लिए ऑक्सीकरण अर्द्ध-अभिक्रिया में 6 का गुणा करने पर,

उपर्युक्त लिखी अपचयोपचय अभिक्रिया की अन्वेषण की विधि बताती है कि किस प्रकार इलेक्ट्रॉन त्यागे या स्रहण किये जाते हैं, तथा इसके साथ-साथ इस अभिक्रिया को संशोधित रूप में किस तरह लिखते हैं, यह भी बताती है।
(ख) O3(g) + H2O2(l) → H2O(l) + 2O2(g)
इस समीकरण को आयन-इलेक्ट्रॉन विधि द्वारा सन्तुलित करते हैं-

सन्तुलित ऑक्सीकरण तथा अपचयन अर्द्ध-अभिक्रियाएँ लिखकर उन्हें जोड़ने पर,
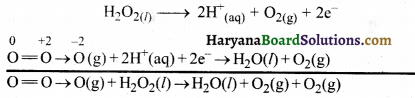
- इस अभिक्रिया में O3 ऑक्सीकारक की भाँति तथा H2O2 अपचायक की भाँति कार्य करते हैं।
- यदि दो समान परमाणुओं के मध्य एक उपसहसंयोजी आबन्ध उपस्थित होता है तो दाता परमापु +2 ऑक्सीकरण संख्या प्राप्त करता है तथा ग्राही -2 ऑक्सीकरण संख्या प्राप्त करता है।
इस प्रकार अभिदि के अन्बेषण की विधि स्पष्ट हो जाती है तथा इसे संशोधित रूप में लिखने का कारण भी स्पष्ट हो जाता है।
प्रश्न 10.
AgF2 एक अस्थिर यौगिक है। यदि यह बन जाए तो यह यौगिक एक अति शक्तिशाली ऑक्सीकारक की भाँति कार्य करता है। क्यों ?
उत्तर:
AgF2 वियोजित होकर Ag2+ तथा 2F– देता है। Ag2+, अपचायक द्वारा एक इलेक्ट्रॉन ग्रहण करके Ag+ में अपचयित हो जाता है।
Ag2+ + 6– → Ag+
Ag+ का इलेक्ट्रॉनिक विन्यास पूर्णतया भरे हुए d-कक्षकों के कारण स्थायी होता है।
Ag+(46) : 1s2, 2s2 2p6, 3s23p63d10, 4s24p64d10, 5s0
अतः AgF2 एक अति शक्तिशाली ऑक्सीकारक की भाँति कार्य करता है।
![]()
प्रश्न 11.
“जब भी एक ऑक्सीकारक तथा अपचायक के बीच अभिक्रिया सम्पन्न की जाती है, तब अपचायक के आधिक्य में निम्नतर ऑक्सीकरण अवस्था का यौगिक तथा ऑक्सीकारक के आधिक्य में उच्चतर ऑक्सीकरण अवस्था का यौगिक बनता है।” इस वक्तव्य का औचित्य तीन उदाहरण देकर दीजिए।

प्रश्न 12.
इन प्रेक्षणों की अनुकूलता को कैसे समझायेंगे ?
(क) यद्यपि क्षारीय पोटैशियम परमैंगनेट तथा अम्लीय पोटैशियम परमैंगनेट दोनों ही ऑक्सीकारक हैं। फिर भी टॉलुईन से बेन्जोइक अम्ल बनाने के लिए हम ऐल्कोहॉलिक पोटैशियम परमैंगनेट का प्रयोग ऑक्सीकारक के रूप में क्यों करते हैं? इस अभिक्रिया के लिए सन्तुलित अपचयोपचय समीकरण दीजिए।
(ख) क्लोराइड युक्त अकार्बनिक यौगिक में सान्द्र सल्फ्यूरिक अम्ल डालने पर हमें तीक्ष्ण गन्ध वाली HCl गैस प्राप्त होती है, परन्तु यदि मिश्रण में ब्रोमाइड उपस्थित हो तो हमें ब्रोमीन की लाल वाष्प प्राप्त होती है, क्यों ?
उत्तर:
(क) उदासीन माध्यम में KMnO4 निम्नलिखित प्रकार से ऑक्सीकारक की भाँति कार्य करता है-
MnO4– + 2H2O + 3e– → MnO2 + 4OH–
प्रयोगशाला में टॉलुईन को बेन्जोइक अम्ल में ऑक्सीकृत करने के लिए क्षारीय $\mathrm{KMnO}_4$ का प्रयोग किया जाता है-

औद्योगिक निर्माण के दौरान ऐल्कोहॉलिक KMnO4 को प्रयोग करने के निम्नलिखित दो कारण हैं-
- अभिक्रिया के दौरान क्षार (OH– आयन स्वतः उत्पन्न हो जाता है; अतः क्षार मिलाने का अतिरिक्त व्यय नहीं होता।
- एक कार्बनिक ध्रुवी विलायक, एथिल ऐल्कोहॉल, दोनों अभिकारकों, $\mathrm{KMnO}_4$ (इसकी ध्रुवी प्रकृति के कारण) तथा टॉलुईन (इसके कार्बनिक यौगिक होने के कारण) को मिश्रित करने में सहायता प्रदान क्रता है।
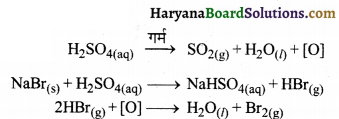
(ख) एक क्लोराइडयुक्त अकार्बनिक यौगिक; जैसे- NaCl, जब सान्द्र सल्फ्यूरिक अम्ल के साथ अभिक्रिया करता है, तब हाइड्रोजन क्लोराइड गैस उत्पन्न होती है।
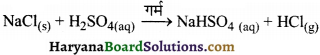
ब्रोमाइड (जैसे- NaBr) की H2SO4 से अभिक्रिया पर भी HBr की वाष्प उत्पन्न होती है, परन्तु HBr के प्रबल अपचायक होने के कारण, यह सल्फ्यूरिक अम्ल द्वारा ऑक्सीकृत होकर ब्रोमीन की लाल वाष्प मुक्त करता है।
प्रश्न 13.
निम्नलिखित अभिक्रियाओं में ऑक्सीकृत, अपचयित, ऑक्सीकारक तथा अपचायक पदार्थ पहचानिए-
(क) 2AgBr(s) + C6H6O2(aq) → 2Ag(s) + 2HBr(aq) + C6H4O2(aq)
(ख) HCHO(l) + 2[Ag(NH3)2]+(aq) + 3OH–(aq) → 2Ag(aq) + HCOO–(aq) + 4NH3(aq) + 2H2O(l)
(ग) HCHO(l) + 2Cu2+(aq) + 5OH–(aq) → Cu2O(s) + HCOO–(aq) + 3H2O(l)
(घ) N2H4(l) + 2H2O2(l) → N2(g) + 4H2O(l)
(ङ) Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(s) + 2H2O(l)
उत्तर:
(क) 2AgBr(s) + C6H6O2(aq) → 2Ag(s) + 2HBr(aq) + C6H4O2(aq)
ऑक्सीकारक : AgBr (अपचयित पदार्थ)
अपचायक : C6H4O2(aq) (ऑक्सीकृत पदार्थ)
(ख) HCHO(l) + 2[Ag(NH3)2]+(aq) + 3OH–(aq) → 2Ag(s) + HCOO–(aq) + 4NH3(aq) + 2H2O(l)
ऑक्सीकारक : [Ag(NH3)2]+ (अपचयित पदार्थ)
अपचायक : HCHO (ऑक्सीकृत पदार्थ)
(ग) HCHO(l) + 2Cu2+(aq) + 5OH–(aq) + 3H2O(l)
ऑक्सीकारक : Cu2+ (अपचयित पदार्थ)
अपचायक : HCHO (ऑक्सीकृत पदार्थ)
(घ) N2H4(l) + 2H2O2(l) → N2(g) + 4H2O(l)
ऑक्सीकारक : H2O2 (अपचयित पदार्थ)
अपचायक : N2H4 (ऑक्सीकृत पदार्थ)
(ङ) Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(s) + 2H2O(l)
ऑक्सीकारक : PbO2 (अपचयित पदार्थ)
अपचायक : Pb (ऑक्सीकृत पदार्थ)
प्रश्न 14.
निम्नलिखित अभिक्रियाओं में एक ही अपचायक थायोसल्फेट, आयोडीन तथा ब्रोमीन से अलग-अलग प्रकार से अभिक्रिया क्यों करता है?
2S2O32-(aq) + I2(s) → S4O62-(aq) + 2I–(aq)
S2O32-(aq) + 2Br2(l) + 5H2O(l) → 2SO42-(aq) + 4Br–(aq) + 10H+(aq)
उत्तर:
आयोडीन (I2) थायोसल्फेट आयन को टेट्राथायोनेट आयन में ऑक्सीकृत कर देती है अर्थात् S2O32- में S की ऑक्सीकरण संख्या +2 से S4O62- आयन में S की ऑक्सीकरण संख्या (\(\frac { 5 }{ 2 }\)) में परिवर्तित हो जाती है।
ब्रोमीन (Br2) थायोसल्फेट आयन को सल्फेट आयन में ऑक्सीकृत कर देती है अर्थात् S की ऑक्सीकरण संख्या +2 (S2O32- में) से +6(SO42- आयन में ) में परिवर्तित हो जाती है। इसका कारण यह है कि ब्रोमीन, आयोडीन की तुलना में प्रबल ऑक्सीकारक है।
E0(Br2/2Br– = 1.09 V, E0(I2/2I–) = 0.54 V |
प्रश्न 15.
अभिक्रिया देते हुए सिद्ध कीजिए कि हैलोजन में फ्लुओरीन श्रेष्ठ ऑक्सीकारक तथा हाइड्रो हैलिक यौगिकों में हाइड्रो आयोडिक अम्ल श्रेष्ठ अपचायक है।
उत्तर:
हैलोजनों में इलेक्ट्रॉन ग्रहण करने की क्षमता बहुत प्रबल होती है। अतः ये शक्तिशाली ऑक्सीकारक होते हैं। हैलोजनों की ऑक्सीकारक क्षमता इलेक्ट्रोड विभव के आधार पर निम्न प्रकार होती है।
F2(+2.87V)>Cl2(+1.36V) > Br2(+1.09V)>I2(+0.54V)
इलेक्ट्रोड विभव के आधार पर हम कह सकते हैं कि F2 सर्वश्रेष्ठ ऑक्सीकारक है तथा यह अन्य हैलोजनों को उनके यौगिकों से मुक्त कर देता है।
F2 + 2Cl– → 2F– + Cl2
F2 + 2Br– → 2F– + Br2
F2 + 2I– → 2F– + I2
तथा Cl2 अपने से नीचे वाले हैलोजनों को उनके यौगिकों से विस्थापित कर देता है।
Cl2 + 2Br– → 2Cl– + Br2
Cl2 + 2I– → 2Cl– + I2
जबकि हैलाइड आयनों की प्रकृति इलेक्ट्रॉन को मुक्त करने की होती है। अतः वे अपचायक की तरह कार्य करते हैं। हैलाइड आयनों के इलेक्ट्रोड विभव निम्न प्रकार से हैं-
I–(-0.54V) > Br–(-1.09V) > Cl–(-1.36V) > F–(-2.87V)
अतः इनकी अपचायक प्रकृति निम्न प्रकार है-
HI > HBr > HCl > HF
अतः हाइड्रोआयोडिक एसिड सबसे प्रबल अपचायक है।
उदाहरण:
(i) HI तथा HBr, H2SO4 को SO2 में अपचयित कर देते हैं परन्तु HCl तथा HF नहीं कर सकते।
2HBr + H2SO4 → Br2 + SO2 + 2H2O
2HI + H2SO4 → I2 + SO2 + 2H2O
(ii) I–, Cu2+ को Cu+ में अपचयित कर सकता है परन्तु Br– नहीं
2Cu2+ +4I– → Cu2I2 + I2
Cu2++ 2Br– → कोई भी अभिक्रिया नहीं
अतः HI सबसे प्रबल अपचायक है।
प्रश्न 16.
निम्नलिखित अभिक्रिया क्यों होती है?
XeO64-(aq) + 2F–(aq) + 6H+(aq) → XeO3(g) + F2(g) + 3H2O(l)
यौगिक Na4XeO6 (जिसका एक भाग XeO64- है) के बारे में आप इस अभिक्रिया में क्या निष्कर्ष निकाल सकते हैं?
उत्तर:
XeO64-(aq) + 2F–(aq) + 6H+(aq) → XeO3(g) + F2(g) + 3H2O(l)
F2 के रासायनिक विधियों द्वारा निर्माण की हाल ही में यह अभिक्रिया विकसित की गई रासायनिक विधियों की श्रेणी में से एक है। यह प्रचलित विद्युत्-रासायनिक विधि नहीं है। इस अभिक्रिया में XeO64- एक प्रबल ऑक्सीकारक के रूप में कार्य करते हुए F– को F2 ऑक्सीकृत कर देता है जो विद्युत्-रासायनिक श्रेणी में सर्वाधिक अपचायक क्षमता वाला तत्व है।
F2 के निर्माण की एक अन्य रासायनिक विधि में अन्य प्रबल ऑक्सीकारक K2MnF6 प्रयुक्त होता है।
2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2 ↑
प्रश्न 17.
निम्नलिखित अभिक्रियाओं में-
(क) H3PO2(aq) + 4AgNO3(aq) + 2H2O(l) → H3PO4(aq) + 4Ag(s) + 4HNO3(aq)
(ख) H3PO2(aq) + 2CuSO4(aq) + 2H2O(l) → H3PO4(aq) + 2Cu(s) + 2H2SO4(aq)
(ग) C6H5CHO(l) + 2[Ag(NH3)2]+(aq) + 3OH–(aq) → C6H5COO–(aq) + 2H2O(l)
(घ) C6H5CHO(l) + 2Cu2+(aq) + 5OH–(aq) → कोई परिवर्तन नहीं।
इन अभिक्रियाओं से Ag+ तथा Cu2+ के व्यवहार के विषय में निष्कर्ष निकालिए।
उत्तर:
(क) Ag+ आयन Ag में अपचयित होकर अवक्षेपित हो जाते हैं।
(ख) Cu2+ आयन Cu में अपचयित होकर अवक्षेपित हो जाते हैं।
(ग) संकुल में उपस्थित Ag+(aq),Ag में अपचयित हो जाता है जो चमकदार दर्पण की भाँति अवक्षेपित हो जाता है।
(घ) Cu2+(aq) आयन C6H5CHO (बेन्जैल्डिाइड) द्वारा अपचयित नहीं होते जो एक दुर्बल अपचायक है।
![]()
प्रश्न 18.
आयन-इलेक्ट्रॉन विधि द्वारा निम्नलिखित रेडॉक्स अभिक्रियाओं को सन्तुलित कीजिए-
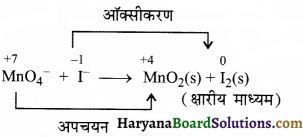
(क) MnO4–(aq) + I–(aq) → MnO2(s) + I2(s) (क्षारीय माध्यम)
(ख) MnO4–(aq) + SO2(g) → Mn2+(aq) + HSO4–(aq) (अम्लीय माध्यम)
(ग) H2O2(aq) + Fe2+(aq) → Fe3+(aq) + H2O(l) (अम्लीय माध्यम)
(घ) Cr2O72+ + SO2(g) → Cr+3(aq) + SO42-(aq) (अम्लीय माध्यम)
उत्तर:
(क) आयन इलेक्ट्रॉन विधि-
पद 1. सभी की ऑक्सीकरण संख्या लिखने पर-
पद 2. अभिक्रिया को ऑक्सीकरण व अपचयन अर्द्ध अभिक्रिया में विभाजित करने पर,
अपचयन अर्द्ध-अभिक्रिया-
पद (a) ऑक्सीकरण की संख्या सन्तुलित करने पर,
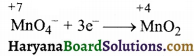
पद (b) ऑक्सीजन की संख्या सन्तुलित करने पर,
MnO4– + 3e– → MnO2 + 2H2O
पद (c) हाइड्रोजन की संख्या को क्षारीय माध्यम में सन्तुलित करने के लिए दाईं तरफ 4OH– तथा बाईं तरफ 4H2O को जोड़ने पर,
MnO4– + 3e– + 4H2O → MnO2 + 2H2O + 4OH– (सन्तुलित अपचयन अर्द्ध-अभिक्रिया)
ऑक्सीकरण अर्द्ध-अभिक्रिया-
![]()
पद (a) आयोडीन की संख्या बराबर करने पर,
2I– → I2
पद (b) आवेश बराबर करने पर,
2I– → I2 + 2e– (सन्तुलित ऑक्सीकरण अर्द्ध-अभिक्रिया)
पद 3. अब सन्तुलित ऑक्सीकरण तथा अपचयन अर्द्ध-अभिक्रियाओं को जोड़ें तथा इलेक्ट्रॉनों की संख्या सन्तुलित करने के लिए अपचयन अर्द्ध-अभिक्रिया में 2 का तथा ऑक्सीकरण अर्द्ध-अभिक्रिया में 3 का गुणा करें।
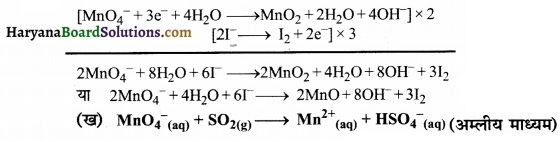
उत्तर:
आयन इलेक्ट्रॉन विधि-
पद 1. सर्वप्रथम प्रत्येक की ऑक्सीकरण संख्या लिखिए-
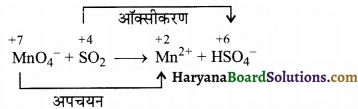
पद 2. अंब अभिक्रिया को अपचयन तथा ऑक्सीकरण अर्द्ध-अभिक्रिया में विभाजित करें।
अपचयन अर्द्ध-अभिक्रिया-
MnO4– → Mn2+
पद (a) इस पद में आवेश सन्तुलित करने पर,
MnO4– + 5e– → Mn2+
पद (b) ऑक्सीजन की संख्या सन्तुलित करने पर,
MnO4– + 5e– → Mn2+ + 4H2O
पद (c) अम्लीय माध्यम में हाइड्रोजन की संख्या सन्तुलित करने पर,
MnO4– + 5e– + 8H+ → Mn2+ + 4H2O
ऑक्सीकरण अर्द्ध-अभिक्रिया-
SO2 → HSO4–
पद (a) इस पद में आवेश सन्तुलित करने पर,
SO2 → HSO4– + 2e–
पद (b) इस पद में ऑक्सीजन की संख्या सन्तुलित करने पर,
SO2 + 2H2O → HSO4– + 2e–
पद (c) अम्लीय माध्यम में हाइड्रोजन की संख्या संतुलित करने पर,
SO2 + 2H2O → HSO4– + 2e– + 3H+
पद 3. अब ऑक्सीकरण व अपचयन अर्द्ध-अभिक्रिया को जोड़ने पर तथा इलेक्ट्रॉन की संख्या को सन्तुलित करने के लिए ऑक्सीकरण अर्द्ध-अभिक्रिया में 5 का तथा अपचयन अर्द्ध-अभिक्रिया में 2 का गुणा करने पर,
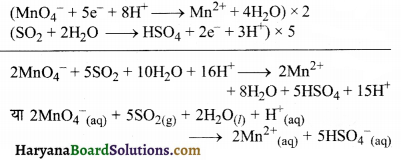
(ग) H2O2(aq) + Fe2+(aq) → Fe3+(aq) + H2O(l) (अम्लीय माध्यम)
उत्तर:
आयन इलेक्ट्रॉन विधि-
पद 1. सर्वप्रथम प्रत्येक की ऑक्सीकरण संख्या लिखने पर-
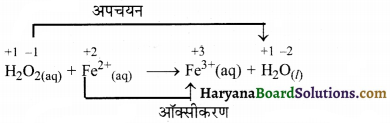
पद 2. अब अपचयन व ऑक्सीकरण अर्द्ध-अभिक्रिया में विभाजित करने पर,
अपचयन अर्द्ध-अभिक्रिया
![]()
पद (a) ऑक्सीजन की संख्या सन्तुलित करने पर,
![]()
पद (b) ऑक्सीकरण संख्या सन्तुलित करने पर,
H2O2 + 2e– → 2H2O
पद (c) अम्लीय माध्यम में हाइड्रोजन की संख्या सन्तुलित करने पर,
H2O2 + 2e– + 2H+ → 2H2O
ऑक्सीकरण अर्द्ध-अभिक्रिया
Fe2+ → Fe3+
पद (d) ऑक्सीकरण संख्या सन्तुलित करने पर-
Fe2+ → Fe3+ + e–
पद 3. इस पद में ऑक्सीकरण व अपचयन अर्द्ध-अभिक्रियाओं को जोड़ने पर तथा इलेक्ट्रॉन की संख्या को सन्तुलित करने के लिए ऑक्सीकरण अर्द्ध-अभिक्रिया में 2 का गुणा करने पर,
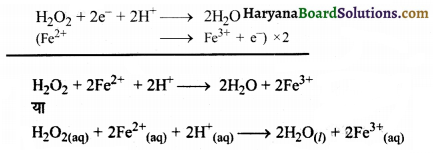
(घ) Cr2O72+(aq) + SO2(g) → Cr3+(aq) + SO42-(aq) (अम्लीय माध्यम)
सर्वप्रथम आ. संख्या लिखने पर,
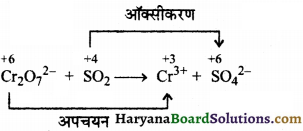
पद 1. अभिक्रिया को अपचयन व ऑक्सीकरण अर्द्ध- अभिक्रिया में विभाजित करने पर,
ऑसीकरण अर्द्ध-अभिक्रिया
SO2 → SO42-
(a) आ. सं. को सन्तुलित करने पर,
SO2 → SO42- + 2e–
(b) ऑक्सीजन की संख्या सन्तुलित करने पर,
SO2 + 2H2O → SO42- + 2e–
(c)अम्लीय माध्यम में हाइड्रोजन संतुलित करने पर-
SO2 + 2H2O → SO42- + 2e– + 4H+
अपचयन अर्द्ध-अभिक्रिया
![]()
(a) क्रोमियम की संख्या सन्तुलित करने पर,
![]()
(b) ऑक्सीकरण संख्या व्यवस्थित करने पर,
6e– + Cr2O22- → 2Cr3+
(c) ऑक्सीजन की संख्या संतुलित करने पर-
Cr2O22- + 6e– → 2Cr3+ + 7H2O
(d) हाइड्रोजन की संख्या अम्लीय माध्यम में व्यवस्थित करने पर,
Cr2O72- + 6e– + 14H+ → 2Cr3+ + 7H2O
पद 2. संतुलित ऑक्सीकरण व अपचयन अर्द्ध-अभिक्रिया को जोड़ने पर तथा इलेक्ट्रॉन की संख्या सन्तुलित करने के लिए ऑक्सीकरण अर्द-अभिक्रिया में 3 का गुणा करने पर,

प्रश्न 19.
निम्नलिखित अभिक्रियाओं के समीकरणों को आयन-इलेक्ट्रॉन तथा ऑक्सीकरण संख्या विधि (क्षारीय माध्यम में) द्वारा सन्तुलित कीजिए तथा इनमें ऑक्सीकारक और अपचायकों की पहचान कीजिए-
(क) P4(s) + OH–(aq) → PH3(g) + H2PO–2(aq)
(ख) N2H4(l) + ClO3–(aq) → NO(g) + Cl–(g)
(ग) Cl2O7(g) + H2O2(aq) → ClO2–(aq) + O2(g) + H+(aq)
उत्तर:
(क) आयन इलेक्ट्रॉन विधि से समीकरण सन्तुलित करना-
पद 1. पहले ढाँचा समीकरण लिखते हैं-
P4(s) + OH–(aq) → PH3(g) + H2PO2–(aq)
पद 2. दो अर्द्ध-अभिक्रियाएँ इस प्रकार हैं-
(i) ऑक्सीकरण अर्द्ध-अभिक्रिया :
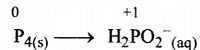
(ii) अपचयन अर्द्ध-अभिक्रिया :
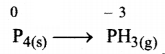
(P) ऑक्सीकारक तथा अपचायक दोनों की भाँति कार्य करता है)
पद 3. ऑक्सीकरण अर्द्ध-अभिक्रिया में पहले $P$ परमाणुओं को सन्तुलित करके O परमाणुओं के सन्तुलन के लिए हम बाईं ओर आठ जल अण जोडते हैं।
P4(s) + 8H2O(l) → 4H2PO2–(aq)
इस अभिक्रिया में H परमाणु सन्तुलित करने के लिए आठ H+ आयन दाई ओर जोड़ते हैं।
P4(s) + 8H2O(l) → 4H2PO2–(aq) + 8H+(aq)
अब चूँकि अभिक्रिया क्षारीय माध्यम में होती है; अतः दोनों ओर OH– आयन जोड़ते हैं-
P4(s) + 8H2O(l) + 8OH–(aq) → 4H2PO2–(aq) + 8H2O(l)
या P4(s) + 8H2O(l) + 8OH–(aq) → 4H2PO2–(aq) + 8H2O(l)
या P4(s) + 8OH–(aq) → 4H2PO2–(aq)
पद 4. अपचयन अर्द्ध-अभिक्रिया में P परमाणुओं को सन्तुलित करते हैं-
P4(s) → 4PH3(g)
H-परमाणुओं के सन्तुलन के लिए हम उपर्युक्त अभिक्रिया में बाई ओर बारह (6)H+ आयन जोड़ देते हैं-
P4(s) + 12H+(aq) → 4PH3(g)
क्योंकि अभिक्रिया क्षारीय माध्यम में होती है; अत: 12H+ आयनों के लिए 12OH– आयन समीकरण के दोनों ओर ज़ड़ते हैं-
P4(s) + 12H+(aq) + 12OH–(aq) → 4PH3(g) + 12OH–(aq)
H+ तथा OH– के संयोग से जल अणु बनने के कारण परिणामी समीकरण निम्नलिखित होगी-
P4(s) + 12H2O(l) → 4PH3(g) + 12OH–(aq)
पद 5. इस पद में हम दोनों अर्द्ध-अभिक्रियाओं में आवेश का सन्तुलन निम्नवत् करते हैं-
P4(s) + 8OH–(aq) → 4H2PO2–(aq) + 4e–
P4(s) + 12H2O(l) + 12e– → 4PH3(g) + 12OH–(aq)
पद 6. उपर्युक्त दोनों अर्द्ध-अभिक्रियाओं को जोड़ने पर-
4P4(s) + 12H2O(l) + 12OH–(aq) → 4PH3(g) + 12H2PO2–(aq)
या P4(s) + 3H2O(l) + 3OH–(aq) → PH3(g) + 3H2PO2–(aq)
अन्तिम सत्यापन दर्शाता है कि समीकरण में दोनों ओर के परमाणुओं की संख्या तथा आवेश की दृष्टि से समीकरण सन्तुलित है।
![]()
ऑक्सीकरण संख्या विधि से समीकरण सन्तुलित करना-
पद 1. अभिक्रिया का ढाँचा इस प्रकार है-
P4(s) + OH–(aq) → PH3(g) + H2PO2–(aq)
पद 2. अभिक्रिया में P की ऑक्सीकरण संख्या लिखते हैं-
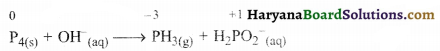
यह इस बात का सूचक है कि P ऑक्सीकारक तथा अपचायक दोनों रूपों में कार्य करता है।
पद 3. P की ऑक्सीकरण अवस्था 3 घटती है तथा 1 बढ़ती है। अतः हमें H2PO2– को 3 से गुणा करना होगा।
P4(s) + OH–(aq) → PH3(g) + 3H2PO2–(aq)
पद 4. चूँकि अभिक्रिया क्षारीय माध्यम में हो रही है तथा दोनों ओर के आयनों का आवेश एकसमान नहीं है। अतः हम बाई ओर तीन OH– आयन जोड़ेंगे जिससे आवेश एकसमान हो जाए।
P4(s) + 3OH–(aq) → PH3(g) + 3H2PO2–(aq)
पद 5. इस पद में हाइड्रोजन आयनों को संतुलित करने के लिए हम तीन जल अणुओं को बाईं ओर जोड़ते हैं-
P4(s) + 3OH–(aq) + 3H2O(l) → PH3(g) + 3H2PO2–(aq)
यह सन्तुलित अभिक्रिया है।
(ख) आयन-इलेक्ट्रॉन विधि से समीकरण सन्तुलित करना-
पद 1. पहले ढाँचा समीकरण लिखते हैं-
N2H4(l) + ClO3–(aq) → NO(g) + Cl–(g)
पद 2. दो अर्द्ध-अभिक्रियाएँ इस प्रकार हैं-
(i) ऑक्सीकरण अर्द्ध-अभिक्रिया :
![]()
(ii) अपचयन अर्द्ध-अभिक्रिया :
![]()
(N2H4 अपचायक तथा ClO3– ऑक्सीकारक की भाँति कार्य करता है।)
पद 3. ऑक्सीकरण अर्द्ध-अभिक्रिया में N-परमाणुओं को सन्तुलित करते हैं-
N2H4(l) → 2NO(g)
अब O परमाणुओं को सन्तुलित करने के लिए समीकरण में बाईं ओर दो जल अणु जोड़ते हैं-
N2H4(l) + 2H2O(l) → 2NO(g)
अब H परमाणुओं को सन्तुलित करने के लिए समीकरण में दाईं ओर 8H+ जोड़ते हैं-
N2H4(l) + 2H2O(l) → 2NO(g) + 8H+(aq)
चूँकि अभिक्रिया क्षारीय माध्यम में हो रही है; अतः समीकरण के दोनों ओर 8OH– आयन जोड़ते हैं-
N2H4(l) + 2H2O(l) + 8OH–(aq) → 2NO(g) + 8H+ + 8OH–(aq)
H+ तथा OH– आयनों के संयोग पर जल अणु बनने के कारण समीकरण निम्नवत् होगी-
N2H4(l) + 8OH–(aq) → 2NO(g) + 6H2O(l)
पद 4. अपचयन अर्द्ध-अभिक्रिया में O परमाणुओं के सन्तुलन के लिए समीकरण के दाई ओर तीन जल अणु जोड़ते हैं-
ClO3–(aq) → Cl–(g) + 3H2O(l)
H परमाणुओं को सन्तुलित करने के लिए समीकरण के बाईं ओर छ: H+ आयन जोड़ते हैं-
ClO3–(aq) + 6H+(aq) + 6OH–(aq) → Cl–(g) + 3H2O(l)
चूँकि अभिक्रिया क्षारीय माध्यम में होती है; अतः समीकरण में दोनों ओर छः OH– आयन जोड़ते हैं-
ClO3–(aq) + 6H+(aq) + 6OH–(aq) → Cl–(g) + 3H2O(l) + 6OH–(aq)
H+ तथा OH– के संयोग से जल अणु बनने पर,
ClO3–(aq) + H2O(l) → Cl–(g) + 6OH–(aq)
पद 5. इस पद में हम दोनों अर्द्ध-अभिक्रियाओं के आवेश का सन्तुलन निम्नवत् करते हैं-
N2H4(l) + 8OH–(aq) → 2NO(g) + 6H2O(l) + 8e–
ClO3–(aq) + 3H2O(l) + 6e– → Cl–(g) + 6OH–(aq)
इलेक्ट्रॉनों की संख्या समान करने के लिए ऑक्सीकरण अर्द्धअभिक्रिया को 3 से तथा अपचयन अर्द्ध-अभिक्रिया को 4 से गुणा करते हैं-
3N2H4(l) + 24OH–(aq) → 6NO(g) + 18H2O(l) + 24e–
4ClO3–(aq) + 12H2O(l) + 24e– → 4Cl–(g) + 24OH–(aq)
पद 6. दोनों अर्द्ध-अभिक्रियाओं को जोड़ने पर-
3N2H4(l) + 4ClO3–(aq) → 6NO(g) + 4Cl–(g) + 6H2O(l)
अन्तिम सत्यापन दरांता है कि उपर्युक्त समीकरण परमाणुओं की संख्या तथा आवेश की दृष्टि से सन्तुलित हैं।
ऑक्सीकरण संख्या विधि से समीकरण सन्तुलित करना-
पद 1. अभिक्रिया का ढ्वाँचा इस प्रकार है-
N2H4(l) + ClO3–(aq) → NO(g) + Cl–(g)
पद 2. अभिक्रिया में N तथा Cl की ऑक्सीकरण संख्या लिखते हैं-
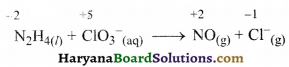
स्पष्ट है कि N2H4 अपचायक तथा ClO3– ऑक्सीकारक के रूप में कार्य करते हैं।
पद 3. ऑक्सीकरण संख्या में होने वाली वृद्धि तथा कमी की गणना करते हैं तथा इन्हें एकसमान बनाते हैं।
3N2H4(l) + 4ClO3–(aq) → 6NO(g) + 4Cl–(g)
पद 4. चूँकि अभिक्रिया क्षारीय माध्यम में हो रही है तथा अभिक्रिया आवेश की दृष्टि से सन्तुलित है; अतः O तथा H परमाणुओं के सन्तुलन के लिए अभिक्रिया में दाईं ओर 6 जल अणु जोड़ देने पर पूर्णतया सन्तुलित समीकरण प्राप्त हो जायेगी।
3N2H4(l) + 4ClO3–(aq) → 6NO(g) + 4Cl–(g) + 6H2O(l) यह सन्तुलित समीकरण है।
(ग) आयन इलेक्ट्रॉन विधि से समीकरण सन्तुलित करना-
पद 1. पहले ढाँचा समीकरण लिखते हैं-
Cl2O7(g) + H2O2(aq) → ClO–(aq) + O2(aq) + H+(aq)
पद 2. दो अर्द्ध-अभिक्रियाएँ इस प्रकार हैं-
(i) ऑक्सीकरण अर्द्ध-अभिक्रिया :
![]()
(ii) अपचयन अर्द्ध-अभिक्रिया :
![]()
(H2O2 अपचायक तथा Cl2O7ऑक्सीकारक की भाँति कार्य करते है।)
पद 3. ऑक्सीकरण अर्द्ध अभिक्रिया में H परमाणुओं के सन्तुलन के लिए हम दो H+ दाईं ओर जोड़ते हैं-
H2O2(aq) → O2(g) + 2H+(aq)
चूँकि अभिक्रिया क्षारीय माध्यम में सम्पन्न होती है; अतः दोनों ओर दो-दो OH– आयन जोड़ने पर,
2OH–(aq) + H2O2(aq) → O2(g) + 2H+(aq) + 2OH–(aq)
H+ तथा OH– आयन के संयोग से जल अणु बनने पर परिणामी समीकरण निम्नवत् होगी-
H2O2(aq) + 2OH–(aq) → O2(aq) + 2H2O(l)
पद 4. अपचयन अर्द्ध-अभिक्रिया में सर्वप्रथम Cl परमाणुओं को सन्तुलित करते हैं-
Cl2O7(g) → 2ClO2–(aq)
O परमाणुओं के सन्तुलन के लिए हम दाईं ओर तीन जल-अणु जोड़ते हैं-
Cl2O7(g) → 2ClO2–(aq) + 3H2O(l)
H परमाणुओं के सन्तुलन के लिए हम 6H+ बाईं ओर जोड़ते हैं-
Cl2O7(g) + 6H+(aq) → 2ClO–2(aq) + 3H2O(l)
चूँकि अभिक्रिया क्षारीय माध्यम में सम्पन्न होती है; अतः 6H+ के लिए दोनों ओर 6OH– जोड़ते हैं-
Cl2O7(g) + 6H+(aq) + 6OH–(aq) → 2ClO2–(aq) + 3H2O(l) + 6OH–(aq)
H+ तथा OH– के संयोग से जल अणु बनने पर परिणामी समीकरण निम्नवत् होगी-
Cl2O7(g) + 3H2O(l) → 2ClO2–(aq) + 6OH–(aq)
पद 5. इस पद में हम दोनों अर्द्ध-अभिक्रियाओं में आवेश का सन्तुलन निम्नवत् करते हैं-
H2O2(aq) + 2OH–(aq) → O2(g) + 2H2O(l) + 2e–
Cl2O7(g) + 3H2O(l) + 8e– → 2ClO2–(aq) + 6OH–(aq)
इलेक्ट्रॉनों की संख्या एकसमान करने के लिए ऑक्सीकरण अर्द्ध-अभिक्रिया में 4 से गुणा करते हैं।
4H2O2(aq)+ 8OH–(aq) → 4O2(g) + 8H2O(l) + 8e–
Cl2O7(aq) + 3H2O(l) + 8e– → 2ClO2–(aq) + 6OH–(aq)
पद 6. उपर्युक्त दोनों अर्द्ध-अभिक्रियाओं को जोड़ने पर,
Cl2O7(g) + 4H2O2(aq) + 2OH–(aq) → 2ClO2–(aq) + 4O2(g) + 5H2O(l)
अन्तिम सत्यापन दर्शाता है कि समीकरण में दोनों ओर के परमाणुओं की संख्या तथा आवेश की दृष्टि से समीकरण सन्तुलित है।
ऑक्सीकरण संख्या विधि से समीकरण सन्तुलित करना-
पद 1. अभिक्रिया का ढाँचा इस प्रकार है-
Cl2O7(g) + H2O2(aq) → ClO2–(aq) + O2(aq) + H+(aq)
पद 2. अभिक्रिया में Cl तथा O की ऑक्सीकरण संख्या लिखते हैं-
![]()
स्पष्ट है कि H2O2 अपचायक तथा Cl2O2 ऑक्सीकारक के रूप में कार्य करते हैं।
पद 3. ऑक्सीकरण संख्या में होने वाली कमी तथा वृद्धि की गणना करते हैं तथा इन्हें एकसमान बनाते हैं-
Cl2O7(g) + 4H2O2(aq) → 2ClO2–(aq) + 4O2(g)
पद 4. चूँकि अभिक्रिया क्षारीय माध्यम में हो रही है तथा दोनों ओर के आयनों का आवेश एकसमान नहीं है; अतः हम दो OH– आयन बाईं ओर जोड़ देते हैं-
Cl2O7(g) + 4H2O2(aq) + 2OH–(aq) → 2ClO2–(aq) + 4O2(g)
H परमाणुओं के सन्तुलन के लिए दाईं ओर पाँच जल-अणु जोड़ते हैं।
Cl2O7(g) + 4H2O2(aq) + 2OH–(aq) → 2ClO2–(aq) + 4O2(g) + 5H2O(l)
यह सन्तुलित समीकरण है।
प्रश्न 20.
निम्नलिखित अभिक्रिया से आप कौन-सी सूचनाएँ प्राप्त कर सकते हैं-
(CN)2(g) + 2OH–(aq) → CN–(aq) + CNO–(aq) + H2O(l)
उत्तर:
(CN)2(g) + 2OH–(aq) → CN–(aq) + CNO–(aq) + H2O(l)
इस अभिक्रिया से निम्नलिखित सूचनाएँ प्राप्त होती हैं-
- अभिक्रिया में क्षारीय माध्यम में सायनोजन (CN)2 का वियोजन हो रहा है।
- (CN)2 तथा CN– दोनों प्रकृति में छद्म हैलोजेन (pseudo halogen) हैं अर्थात् इनके गुण हैलोजनों के समान हैं।
- यह एक असमानुपातन अभिक्रिया है। इसमें एक पदार्थ का ऑक्सीकरण तथा अपचयन होता है। सायनोजन (CN})2 का CNO– में ऑक्सीकरण तथा CN– में अपचयन होता है।
![]()
प्रश्न 21.
Mn3+ आयन विलयन में अस्थायी होता है तथा असमानुपातन द्वारा Mn2+, MnO2 और H+ आयन देता है। इस अभिक्रिया के लिए सन्तुलित आयनिक समीकरण लिखिए।
उत्तर:
प्रश्नानुसार असमानुपातन अभिक्रिया निम्नवत् होगी –
Mn3+ → Mn2+ + MnO2 + H+
इस अभिक्रिया को आयन-इलेक्ट्रॉन विधि द्वारा निम्नांकित पदों में सन्तुलित किया जाता है-
पद 1. पहले हम ढाँचा समीकरण लिखते हैं-
Mn3+ → Mn2+ + MnO2 + H+
पद 2. दो अर्द्ध-अभिक्रियाएँ इस प्रकार हैं-
(i) ऑक्सीकरण अर्द्ध-अभिक्रिया :
Mn3+ → MnO2
(ii) अपचयन अर्द्ध-अभिक्रिया :
Mn3+ → Mn2+
पद 3. ऑक्सीकरण अर्द्ध-अभिक्रिया को सन्तुलित करने के लिए इसमें बाईं ओर दो जल अणु जोड़ते हैं। इससे O-परमाणु सन्तुलित हो जाते हैं।
Mn3+ + 2H2O → MnO2
अब H परमाणुओं को सन्तुलित करने के लिए चार H+ दाई ओर जोड़ देते हैं-
Mn3+ + 2H2O → MnO2 + 4H+
पद 4. सन्तुलित अपचयन अर्द्ध-अभिक्रिया निम्नलिखित है-
Mn3+ + 2H2O → Mn2+ + 4H+
पद 5. इस पद में हम दोनों अर्द्ध-अभिक्रियाओं में आवेश का सन्तुलन निम्नलिखित प्रकार करते हैं-
Mn3+ + 2H2O → MnO2 + 4H+ + le–
Mn3+ + le– → Mn2+
पद 6. उपर्युक्त दोनों अर्द्ध-अभिक्रियाओं को जोड़ने पर,
2Mn3+ + 2H2O → MnO2 + Mn2+ + 4H+
यही सन्तुलित समीकरण है।
प्रश्न 22.
Cs, Ne, I तथा F में ऐसे तत्व की पहचान कीजिए, जो
(क) केवल ऋणात्मक ऑक्सीकरण अवस्था प्रदर्शित करता है।
(ख) केवल धनात्मक ऑक्सीकरण अवस्था प्रदर्शित करता है।
(ग) ऋणात्मक तथा धनात्मक दोनों ऑक्सीकरण अवस्था प्रदर्शित करता है।
(घ) न ऋणात्मक और न ही धनात्मक ऑक्सीकरण अवस्था प्रदर्शित करता है।
उत्तर:
(क) F (फ्लुओरीन) केवल ऋणात्मक ऑक्सीकरण अवस्था प्रदर्शित करता है।
(ख) Cs (सीजियम) केवल धनात्मक ऑक्सीकरण अवस्था प्रदर्शित करता है।
(ग) I (आयोडीन) ऋणात्मक तथा धनात्मक दोनों ऑक्सीकरण अवस्था प्रदर्शित करता है।
(घ) Ne ( निऑन) न ऋणात्मक और न ही धनात्मक ऑक्सीकरण अवस्था प्रदर्शित करता है।
प्रश्न 23.
जल के शुद्धिकरण में क्लोरीन को प्रयोग में लाया जाता है। क्लोरीन की अधिकता हानिकारक होती है। सल्फर डाइ-ऑक्साइड से अभिक्रिया करके इस अधिकता को दूर किया जाता है। जल में होने वाले इस अपचयोपचय परिवर्तन के लिए सन्तुलित समीकरण लिखिए।
उत्तर:
क्लोरीन तथा सल्फर डाइऑक्साइड की अभिक्रिया निम्नलिखित समीकरण द्वारा व्यक्त की जा सकती है-
Cl2 + SO2 → Cl– + SO42-
इस अपचयोपचय अभिक्रिया को आयन-इलेक्ट्रॉन विधि से निम्नांकित पदों में सन्तुलित करते हैं-
पद 1. पहले ढाँचा समीकरण लिखते हैं-
Cl2 + SO2 → Cl– + SO42-
पद 2. दो अर्द्ध-अभिक्रियाएँ निम्नवत् हैं-
(i) ऑक्सीकरण अर्द-अभिक्रिया :
SO2 → SO42-
(ii) अपचयन अर्द्ध-अभिक्रिया :
Cl2 → Cl–
पद 3. ऑक्सीकरण अर्द्ध-अभिक्रिया में O परमाणुओं को सन्तुलित करने के लिए समीकरण में बाई ओर दो जल अणु जोड़ते हैं-
SO2 + 2H2O → 4H+
पद 4. सन्तुलित अपचयन अर्द्ध-अभिक्रिया निम्नवत् होगी-
Cl2 → 2Cl–
पद 5. इस पद में हम दोनों अर्द्ध-अभिक्रियाओं में आवेश का सन्तुलन इस प्रकार करेंगे-
SO2 + 2H2O → SO42- + 4H+ + 2e–
पद 6. उपर्युक्त दोनों अर्द्ध-अभिक्रियाओं को जोड़ने पर,
Cl2 + SO2 + 2H2O → 2Cl– + SO42- + 4H+
अन्तिम सत्यापन दर्शाता है कि समीकरण परमाणुओं की संख्या एवं आवेश की दृष्टि से सन्तुलित है।
प्रश्न 24.
आवर्त सारणी की सहायता से निम्नलिखित प्रश्नों के उत्तर दीजिए-
(क) सम्भावित अधातुओं के नाम बताइए, जो असमानुपातन की अभिक्रिया प्रदर्शित कर सकती हों।
(ख) किन्हीं तीन धातुओं के नाम बताइए, जो असमानुपातन अभिक्रिया प्रदर्शित कर सकती हों।
उत्तर:
(क) वे अधातुएँ जो परिवर्ती ऑक्सीकरण अवस्थाओं में रह सकती हैं, असमानुपातन अभिक्रिया प्रदर्शित कर सकती हैं। फॉस्फोरस, क्लोरीन तथा सल्फर ऐसी ही अधातुएँ हैं।
(ख) संक्रमण श्रेणी (d-ब्लॉक तत्व) से सम्बद्ध धातुएँ असमानुपातन अभिक्रियाएँ प्रदर्शित कर सकती हैं। उदाहरणार्थ-मैंगनीज, आयरन तथा कॉपर।
प्रश्न 25.
नाइट्रिक अम्ल निर्माण की ओस्टवाल्ड विधि के प्रथम पद में अमोनिया गैस के ऑक्सीजन गैस द्वारा ऑक्सीकरण से नाइट्रिक ऑक्साइड गैस तथा जलवाष्प बनती है। 10.0 g अमोनिया तथा 20.00 g ऑक्सीजन द्वारा नाइट्रिक ऑक्साइड की कितनी अधिकतम मात्रा प्राप्त हो सकती है?
उत्तर:
ओस्टवाल्ड विधि में अमोनिया गैस निम्न प्रकार ऑक्सीजन से क्रिया करके नाइट्रिक ऑक्साइड गैस तथा जलवाष्प बनाती है।
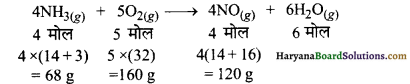
68 g अमोनिया अभिक्रिया करती है = 160 g ऑक्सीजन से अतः
10 g अमोनिया अभिक्रिया करेगी = \(\frac { 160 × 10 }{ 68 }\) = 23.6 g ऑक्सीजन;
परन्तु ऑक्सीजन की उपलब्ध मात्रा 20g है जो आवश्यक मात्रा से कम है अतः ऑक्सीजन सीमान्त अभिकर्मक है।
अत: 160 g ऑक्सीजन बनाती है = 120 g NO
20 g ऑक्सीजन बनायेगी = \(\frac { 120 × 20 }{ 160 }\) = 15 g NO
प्रश्न 26.
पाठ्य-पुस्तक की सारणी 8.1 में दिए गए मानक विभवों की सहायता से अनुमान लगाइए कि क्या इन अभिकारकों के बीच अभिक्रिया सम्भव है?
(क) Fe3+ तथा I–(aq)
(ख) Ag+ तथा Cu(s)
(ग) Fe3+(aq) तथा Br–(aq)
(घ) Ag(s) तभा Fe3+(aq)
(ङ) Br2(aq) तथा Fe2+
उत्तर:
(क) Fe3+ तथा I–(aq)

(ख) Ag+ तथा Cu(s)
सारणी के अनुसार, E0Ag+/Ag = +0.80 V E0Cu++/Cu = 0.34V
2Ag+ + 2e– → 2Ag (अपचयन, कैथोड पर)

(ग) Fe3+(aq) तथा Br–(aq)

(घ) Ag(s) तभा Fe3+(aq)

(ङ) Br2(aq) तथा Fe2+

प्रश्न 27.
निम्नलिखित में से प्रत्येक के विद्युत्-अपघटन से प्राप्त उत्पादों के नाम बताइए।
(क) सिल्वर इलेक्ट्रोड के साथ AgNO3 का जलीय विलयन
(ख) प्लैटिनम इलेक्ट्रोड के साथ AgNO(s) का जलीय विलयन
(ग) प्लैटिनम इलेक्टोड के साथ H2SO4 का तनु विलयन
(घ) प्लैटिनम इलेक्ट्रोड के साथ CuCl2 का जलीय विलयन
उत्तर:
(क) सिल्वर इलेक्ट्रोड के साथ AgNO3 का जलीय विलयन
ऐनोड पर, Ag → Ag+ + e–
कैथोड पर, Ag+ + e– → Ag
ऐनोड पर सिल्वर छड़ घुल जायेगी तथा कैथोड पर सिल्वर छड़ पर जमा होने लगेगा।
(ख) प्लैटिनम इलेक्ट्रोड के साथ AgNO3 का जलीय विलयन-
AgNO3 → Ag+ + NO3–
H2O → H+ + OH–
ऐनोड पर, 4OH– → 2H2O + O2 + 4e–
कैथोड पर, Ag+ + e– → Ag
कैथोड पर सिल्वर जमा होगा तथा ऐनोड पर ऑक्सीजन गैस प्राप्त होगी।
(ग) प्लैटिनम इलेक्ट्रोड के साथ H2SO4 का तनु विलयन
H2SO4 → 2H+ + SO42-
H2O → H+ + OH–
ऐनोड पर, 4OH– → 2H2O + O2 + 4e–
कैथोड पर, 2H+ + 2e– → H2
कैथोड पर हाइड्रोजन तथा ऐनोड पर ऑक्सीजन गैस प्राप्त होती है।
(घ) प्लैटिनम इलेक्ट्रोड के साथ CuCl2 का जलीय विलयन
CuCl2 → Cu2+ + 2Cl–
H2O → H+ + OH–
ऐनोड पर, 2Cl– → Cl2 + 2e–
कैथोड पर, Cu2+ + 2e– → Cu
कैथोड पर कॉपर जमा होगा तथा ऐनोड पर क्लोरीन गैस प्राप्त होगी।
![]()
प्रश्न 28.
निम्नलिखित धातुओं को उनके लवणों के विलयन में से विस्थापन की क्षमता के क्रम में लिखिए-
Al, Cu, Fe, Mg तथा Zn
उत्तर:
Mg > Al > Zn > Fe > Cu.
प्रश्न 29.
नीचे दिए गए मानक इलेक्ट्रोड विभवों के आधार पर धातुओं को उनकी बढ़ती अपचायक क्षमता के क्रम में लिखिए-
K+/K = -2.93 V,
Ag+/Ag = 0.80V,
Hg2+/Hg = 0.79 V
Mg2+/Mg = -2.37 V,
Cr3+/Cr = -0.74V
उत्तर:
Ag < Hg < Cr < Mg < K .
प्रश्न 30.
उस गैल्वेनिक सेल को चित्रित कीजिए, जिसमें निम्नलिखित अभिक्रिया होती है-
Zn(s) + 2Ag+(aq) → Zn2+(aq) + 2Ag(s)
अब बताइए कि-
(क) कौन-सा इलेक्ट्रोड ऋण आवेशित है?
(ख) सेल में विद्युत्-धारा के वाहक कौन हैं?
(ग) प्रत्येक इलेक्ट्रोड पर होने वाली अभिक्रियाएँ क्या हैं?
उत्तर:
Zn(s)| Zn2+(aq) | | Ag+(aq) | Ag(s)
(क) Zn इलेक्ट्रोड ऋण आवेशित है।
(ख) इलेक्ट्रॉन।
(ग) ऐनोड पर, Zn → Zn2+ + 2e–
कैथोड पर, Ag+ + e– → Ag