Haryana State Board HBSE 11th Class Chemistry Solutions Chapter 7 साम्यावस्था Textbook Exercise Questions and Answers.
Haryana Board 11th Class Chemistry Solutions Chapter 7 साम्यावस्था
प्रश्न 1.
एक द्रव को सील बन्द पात्र में निश्चित ताप पर उसके वाष्प के साथ साम्य में रखा जाता है। पात्र का आयतन अचानक बढ़ा दिया जाता है-
(क) वाष्प दाब परिवर्तन का प्रारम्भिक परिणाम क्या होगा ?
(ख) प्रारम्भ में वाष्पन एवं संघनन की दर कैसे बदलती है?
(ग) क्या होगा जबकि साम्य पुन: अन्तिम रूप से स्थापित हो जायेगा तब अन्तिम वाष्प दाब क्या होगा ?
उत्तर:
(क) पात्र का आयतन बढ़ाने पर वाष्प दाब प्रारम्भिक रूप से घटेगा क्योंकि इस स्थिति में वाष्पों की समान मात्रा अधिक स्थान पर वितरित रहती है।
(ख) पात्र का आयतन बढ़ाने पर प्रारम्भ में वांष्पन दर बढ़ेगी, क्योंकि अब अधिक स्थान उपलब्ध होगा। चूँक प्रति इकाई आयतन में वाष्प की मात्रा आयतन बढ़ाने पर घटेगी। अतः प्रारम्भ में संघनन की दर कम होगी।
(ग) साम्यावस्था पर वाष्पन दर संघनन दर के बराबर होती है। अन्तिम वाष्प दाब समान होगा क्योंक यह ताप पर निर्भर करता है।
प्रश्न 2.
निम्नलिखित साम्य के लिये Kc क्या होगा यदि साम्य पर प्रत्येक पदार्थ की सान्द्रतायें हैं-
[SO2] = 0.60M, [O2] = 0.82 M, [SO3] = 1.90M
2SO2(g) + O2 (g) \(\rightleftharpoons\) 2SO3 (g)
हल:
अभिक्रिया
2SO2(g) + O2(g) \(\rightleftharpoons\) 2SO3(g)
Kc = \(\frac{\left[\mathrm{SO}_3\right]^2}{\left[\mathrm{SO}_2\right]^2\left[\mathrm{O}_2\right]}\)
Kc = \(\frac{(1.90)^2}{(0.60)^2(0.82)}\)
Kc = 12.229 mol L-1
प्रश्न 3.
एक निश्चित ताप एवं कुल दाब 105Pa पर आयोडीन वाष्प में आयतानुसार 40% आयोडीन परमाणु होते हैं।
I2(g) = 2I(g)
साम्य के लिए Kp की गणना कीजिए।
हल:
साम्य पर कुल दाब = 105Paa
आयोडीन परमाणु I का आंशिक दाब
Pi = \(\frac { 40 }{ 100 }\) x (105Pa) = 0.4 x 105Pa
आयोडीन अणुओं (12) का आंशिक दाब
Pi2 = \(\frac { 60 }{ 100 }\) × (105Pa) = 0.6 × 105Pa
Kp = \(\frac{\left(\mathrm{P}_{\mathrm{I}}\right)^2}{P_{\mathrm{I}_2}}=\frac{\left(0.4 \times 10^5\right)^2}{\left(0.6 \times 10^5\right)}\)
= 2.67 × 104 Pa
प्रश्न 4.
निम्नलिखित में से प्रत्येक अभिक्रिया के लिए साम्य स्थिरांक KC का व्यंजक लिखिए-
(i) 2NOCl(g) ⇌ 2NO (g) + Cl1⁄2 (g)
(ii) 2Cu(NO3)2(s) ⇌ 2CuO(s) + 4NO2(g) + O2(g)
(iii) CH3COOC2H5(g) + H2O(l) ⇌ C3COOH(aq) + C2H5OH(aq)
(iv) Fe3+(aq) + 3OH–(aq) ⇌ Fe(OH)3(s)
(v) I2(s) + 5F2 ⇌ 2IF5
हल:
(i) Kc = \(\frac{\left[\mathrm{NO}^2\left[\mathrm{Cl}_2\right]\right.}{[\mathrm{NOCl}]^2}]\)
(ii) Kc = \(\frac{\left[\mathrm{NO}_2\right]^4[\mathrm{CuO}]^2\left[\mathrm{O}_2\right]}{\left[\mathrm{Cu}\left(\mathrm{NO}_3\right)_2\right]^2}=\left[\mathrm{NO}_2\right]^4\left[\mathrm{O}_2\right]\)
(iii) Kc = \(\frac{\left[\mathrm{CH}_3 \mathrm{COOH}\right]\left[\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}\right]}{\left[\mathrm{CH}_3 \mathrm{COOC}_2 \mathrm{H}_5\right]\left[\mathrm{H}_2 \mathrm{O}\right]}\)
(iv) Kc = \(\frac{\left[\mathrm{Fe}(\mathrm{OH})_3\right]}{\left[\mathrm{Fe}^{3+}\right]\left[\mathrm{OH}^{-}\right]^3}=\frac{1}{\left[\mathrm{Fe}^{3+}\right]\left[\mathrm{OH}^{-}\right]^3}\)
(v) Kc = \(\frac{\left[\mathrm{IF}_{\mathrm{s}}\right]^2}{\left[\mathrm{~F}_2\right]^5}\)
![]()
प्रश्न 5.
K के मान से निम्नलिखित में से प्रत्येक साम्य के लिए Kc का मान ज्ञात कीजिए।
(i) 2NOCl (g) ⇌ 2NO(g) + Cl2 (g)
Kp = 1·8 × 10-2 500K ताप पर
(ii) CaCO3 (g) ⇌ CaO ( s) + CO2 (g)
Kp = 1.67, 1073K ताप पर
हल:
(i) 2NOCl(g) ⇌ 2NO(g) + Cl2(g)
Kp = 1.8 × 10-2
∆n = (2 + 1) – 2 = 1
Kc = \(\frac{\mathrm{K}_p}{(\mathrm{RT})^{\Delta n}}=\frac{1.8 \times 10^{-2}}{(0.0821 \times 500)^1}\)
= 4.4 × 10-4 mol L-1
(ii) CaCO3(s) ⇌ CaO (s) + CO2(g)
Kp = 167 ∆n = 1
Kc = \(\frac{\mathrm{K}_p}{(\mathrm{RT})^{\Delta n}}=\frac{167}{0.0821 \times 1073}\)
= 1.90 mol L-1
प्रश्न 6.
NO(g) + O3(g) ⇌ NO2(g) + O2(g) के लिए 1000 K पर KC = 6.3 x 1014 है। साम्य में अग्र एवं प्रतीप दोनों अभिक्रियाएँ प्राथमिक रूप से द्विअणुक हैं। प्रतीप अभिक्रिया के लिए K’C क्या है?
उत्तर:
प्रतीप अभिक्रिया के लिये.
K’c = \(\frac{1}{6.3 \times 10^{14}}\) = 1.59 × 10-15
प्रश्न 7.
साम्य स्थिरांक का व्यंजक लिखते समय समझाइए कि शुद्ध द्रवों एवं ठोसों को उपेक्षित क्यों किया जा सकता है?
उत्तर:
सुविधा के लिए शुद्ध ठोस के लिए द्रव्यमान स्थिर होता है यदि शुद्ध द्रव अधिक मात्रा में है तब इसका त्रिज्या द्रव्यमान भी स्थिर होगा अतः क्रिया द्रव्यमान एक लिया जा सकता है।

घनत्व एक गहन गुण है तथा पदार्थ के द्रव्यमान पर निर्भर नहीं करता है। इसके अतिरिक्त एक शुद्ध पदार्थ (ठोस या द्रव) की मोलर सान्द्रता के मान सदैव समान रहते हैं तथा इन्हें साम्य स्थिरांक का मान लिखते समय उपेक्षित किया जा सकता है। यद्यपि गैसीय अवस्था या जलीय विलयन में, पदार्थों लिए दिये गये आयतन में उनकी मात्रा परिवर्तनीय हो सकती है तथा उनकी मोलर सान्द्रता स्थिर नहीं रहती जिससे साम्य स्थिरांक के लिए व्यंजक लिखते समय इसे उपेक्षित नहीं किया जा सकता।
प्रश्न 8.
N2 और O2 के मध्य निम्नलिखित अभिक्रिया होती है-
2N2(g) + O2(g) ⇌ 2N2O(g)
यदि एक 101 के पात्र में 0.48 mol N2 एवं 0.933 mol O2 रखे जायें तथा एक ताप जिस पर N2O बनने दिया जाये तो साम्य मिश्रण का संघटन ज्ञात कीजिए। (Kc = 20 x 10-37)
हल:
माना कि N2(g) के X मोल अभिक्रिया में भाग लेते हैं। अभिक्रिया के अनुसार O2 के \(\frac { X }{ 2 }\) मोल अभिक्रिया करके N2O(g) के X मोल बनायेंगे। उस स्पीशीज की अभिक्रिया के पहले तथा साम्य बिन्दु पर प्रति लीटर मोलर सान्द्रतायें हैं-

साम्य स्थिरांक का मान अत्यन्त कम है अतः अभिकारकों को केवल कुछ मात्रा ही अधिकृत हुई है। इसलिए X अत्यन्त कम होगा तथा अभिकारकों के सम्बन्ध में इसे उपेक्षणीय माना जा सकता है।
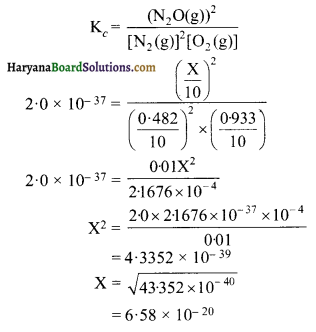
उत्तर-अतः साम्य मिश्रण में
N2 की मोलर सान्द्रता = 0.0482 mol L-1
O2 की मोलर सान्द्रता = 0.0433 mol L-1
N2O की मोलर सान्द्रता = 6.58 x 10-20 mol L-1
![]()
प्रश्न 9.
निम्नलिखित अभिक्रिया के अनुसार नाइट्रिक ऑक्साइड Br2 से अभिक्रिया करके नाइट्रोसिल ब्रोमाइड बनाती हैं।
2NO(g) + Br2(g) ⇌ 2NOBr(g)
जब स्थिर ताप पर एक बन्द पात्र में 0-087 mol NO एवं 0.0437 mol Br2 मिश्रित किए जाते हैं तब 0.0518 mol NOBr प्राप्त होती है। NO तथा Br2 की साम्य मात्रा ज्ञात कीजिए।
हल:
2NO(g) + Br2(g) ⇌ 2NOBr(g)
NO(g) के 2 मोल, Br2(g) के मोल से अभिक्रिया करके 2 मोल NOBr(g) बनाते हैं। साम्य मिश्रण के संगठन निम्नवत् हैं-
साम्य पर निर्मित NOBr(g) के मोलों की संख्या = 0.0518 mol
NO(g) के मोलों की संख्या = 0.0518 मोल
साम्य पर NO (g) के शेष मोलों की संख्या
= 0.087 – 0.0518 = 00352 मोल
Br2(g) के मोलों की संख्या =\(\frac { 1 }{ 2 }\) x 0.0518 = 0.0259
साम्य पर Br2(g) के शेष मोलों की संख्या
= 0.437 – 0.0259
= 0.0178 mol
उत्तर-विभिन्न स्पीशीज की प्रारम्भिक मोलर सान्द्रताएँ तथा साम्य मोलर सान्द्रताओं को निम्न प्रकार निरूपित कर सकते हैं।
2NO(g) + Br2(g) ⇌ 2NOBr(g)
प्रारम्भिक मोल 0-087 0.0437 0
साम्य पर मोल 0.0352 00178 0.0518
प्रश्न 10.
साम्य 2SO2(g) + O2(g) ⇌ 2SO3(g) के लिये 450K पर Kp = 2.0 × 10+10 bar-1 है। इस ताप पर KC के मान की गणना करो।
हल:
दिया गया है
Kp = 2 × 1010 bar-1
R = 0.0831 L bar K-1 mol-1
T = 450K
2SO2(g) + O2(g) ⇌ 2SO3(g)
∆n = 2 – 3 = – 1
Kc = \(\frac{\mathrm{K}_p}{(\mathrm{RT})^{\Delta n}}\)
Kc = \(\frac{2.0 \times 10^{10}}{(0.0831 \times 450)^{-1}}\)
Kc = 2.0 x 1010 x 0.0831 x 450
Kc = 7.47 x 1010 mol L-1
प्रश्न 11.
HI (g) का एक नमूना 0.2 atm दाब पर एक फ्लास्क में रखा जाता है। साम्य पर H2(g) का आंशिक दाब 0.08 atm है। दिये गये साम्य के लिए Kp का मान क्या होगा?
2HI (g) ⇌ H2 (g) + I2 (g)
हल:
PHI = 0.04 atm
PH2 = 0.08 atm
PI2 = 0.08 atm
Kp = \(\frac{\mathrm{P}_{\mathrm{H}_2} \times \mathrm{P}_{1_2}}{\mathrm{P}_{\mathrm{HI}}^2}\)
= \(\frac{(0.08)(0.08)}{(0.04)(0.04)}\)
Kp = 4
प्रश्न 12.
500 K ताप पर एक 20 L पात्र में Ng के 1.57 मोल H2 के 1.92 मोल एवं NH3 के 8.13 मोल को लिया जाता है। अभिक्रिया
N2(g) + 3 H2 (g) ⇌ 2NH3 (g) के लिए KC का मान 1.7 x 10² है। क्या अभिक्रिया मिश्रण साम्य में है? यदि नहीं तो नेट अभिक्रिया की दिशा क्या होगी?
हल:

यहाँ अभिक्रिया भागफल (QC) का मान Kc से अधिक है। अर्थात् QC > Kc अतः अभिक्रिया साम्य में न होकर विपरीत दिशा में अग्रसरित होगी।
प्रश्न 13.
एक गैसीय अभिक्रिया के लिए
Kc = \(\frac{\left[\mathrm{NH}_3\right]^4\left[\mathrm{O}_2\right]^5}{\left[\mathrm{NO}^4\left[\mathrm{H}_2 \mathrm{O}\right]^6\right.}\) है तो
इस व्यंजक के लिए संतुलित समीकरण लिखिए।
उत्तर:
4 NO(g) + 6H2O(g) → 4 (4NH3) NH3 (g) + 5O2 (g)
प्रश्न 14.
H2O का एक मोल एवं CO का एक मोल 725 K ताप पर 101 के पात्र में लिए जाते हैं। साम्य पर 40% जल भारात्मक CO के साथ निम्नलिखित समीकरण के अनुसार अभिक्रिया करता है।
H2O (g) + CO (g) ⇌ H2 (g) + CO2 (g)
अभिक्रिया के लिए साम्य स्थिरांक की गणना कीजिए।
हल:
वास्तविक रूप से उपस्थित जल के मोलों की संख्या = 1 mol
अधिकृत जल का प्रतिशत = 40%
अधिकृत जल के मोलों की संख्या = (1.0 0.4)
समीकरण के अनुसार जल के 0.4ml, CO के 0.4 ml के साथ अभिक्रिया करके 0.4 ml H2 तथा 0.4 mol CO2 बनाएँगे। अतः अभिक्रिया से पहले तथा साम्य बिन्दु पर अभिकारकों तथा उत्पादों की मोलर सान्द्रता प्रति लीटर निम्न प्रकार होगी-

प्रश्न 15.
700K ताप पर अभिक्रिया
H2 (g) + I2 (g) = 2HI (g)
के लिए साम्य स्थिरांक 54.8 है। यदि हमने शुरू में HI (g) लिया हो, 700K ताप पर साम्य स्थापित हो तथा साम्य पर 0.5 ml L-1 HI (g) उपस्थित हो तो साम्य पर H2 (g) एवं I2 (g) की सान्द्रता क्या होगी ?
हल:
माना H2 (g) तथा I2 (g) की साम्यावस्था पर सान्द्रता X mol L-1 है।

साम्यावस्था पर [H2] = 0.068 mol L-1
[I2] = 0.068 mol L-1
प्रश्न 16.
ICl की सान्द्रता प्रारम्भ में 0.78 M को यदि साम्य पर दिया जाये प्रत्येक की साम्य सान्द्रतायें क्या होंगी।
2 ICl(g) ⇌ I2(g) + Cl2(g) Kc = 0.14
हल:
अभिक्रिया

प्रश्न 17.
नीचे दर्शाये गये साम्य में 899 K पर Kp का मान 0.04 atm है। C2H6 (g) साम्य पर सान्द्रता क्या होगी यदि 4.0 atm दाब पर C2H 6को एक फ्लास्क में रखा गया है एवं साम्यावस्था पर आने दिया जाता है।
C2H6(g) ⇌ C2H4(g) + H2(g)
हल:
अभिक्रिया में,
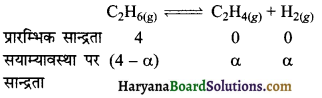
साम्यावस्था पर मोलों की कुल संख्या,
= 4 – α + α + α
= 4 + α
C2H6 के मोल अंश xC2H6 = \(\frac{(4-\alpha)}{(4+\alpha)}\)
C2H4 के मोल अंश xC2H6 = \(\frac{\alpha}{(4+\alpha)}\)
H2 के मोल अंश HH2 = \(\frac{\alpha}{(4+\alpha)}\)
PC2 = XC2H6 x कुल दाब
= \(\frac{(4-\alpha)}{(4+\alpha)}\) x 1 atm
= \(\frac{(4-\alpha)}{(4+\alpha)}\) atm
PC2H4 = xC2H4 x कुल दाब
= \(\frac{\alpha}{(4+\alpha)}\) x 1 atm
= \(\frac{\alpha}{(4+\alpha)}\)atm
PH2 = XH2 x कुल दाब
= \(\frac{\alpha}{(4+\alpha)}\) x 1 atm
= \(\frac{\alpha}{(4+\alpha)}\) atm
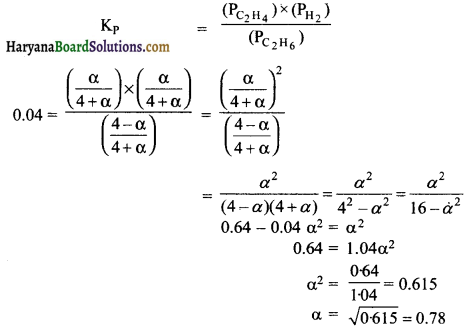
अत: C2H6 की सान्द्रता (4 – α) = 4 – 0.78 = 3.22
प्रश्न 18.
एथेनॉल एवं ऐसीटिक अम्ल की अभिक्रिया में ऐथिल ऐसीटेट बनाया जाता है एवं साम्य को इस प्रकार दर्शाया जा सकता है।
CH3COOH(l) + C2H5OH(l) ⇌ CH3COOC2H5(l) + H2O
(i) इस अभिक्रिया के लिए सान्द्रता अनुपात (अभिक्रिया भागफल) Qc लिखिए।
(ii) यदि 293 K पर 1.00 mol ऐसीटिक अम्ल एवं 0.18 mol ऐथेनॉल प्रारम्भ लिया जाय तो अन्तिम साम्य मिश्रण में 0.171 mol एथिल ऐसीटेट है। साम्य स्थिरांक की गणना कीजिए।
(iii) 0.5mol ऐथेनॉल 1.0 mol ऐसीटिक अम्ल से प्रारम्भ करते हुए 293 K ताप पर कुछ समय पश्चात् एथिल ऐसीटेट के 0.214 मोल पाए गये तो क्या साम्य स्थिरांक स्थाई हो गया।
हल:
(i) अभिक्रिया के लिए सान्द्रता अनुपात

चूँकि QC का मान K से कम है (QC < Kc) अतः साम्यावस्था प्राप्त नहीं होगी परन्तु अभिकारक अभिक्रिया में भाग लेंगे तथा उत्पाद बनाएँगे।
प्रश्न 19.
437 K ताप पर निर्वात में PCl5 का एक नमूना एक फ्लास्क में लिया गया। साम्य स्थापित होने पर PCI5 की सान्द्रता 0.5 x 10-1 mol L-1 पाई गई, यदि Kc का मान 8.3 x 10-3 है। तो साम्य पर PCI3 एवं CI2 की सान्द्रताएँ क्या होंगी।
PCI5 (g) ⇌ PCI3 (g) + CI2 (g)
हल:
माना PCl5 की मोलर सान्द्रता प्रति लीटर = X मोल L-1
साम्यावस्था पर PCI5 की मोलर सान्द्रता = 0.05 mol L-1
PCI3 के वियोजित मोल = (X – 0.05) mol L-1
CI2 के प्राप्त मोल = (X – 0.05) mol L-1

साम्य बिन्दु पर PCI3 की मोलर सान्द्रता
= (0.07 – 0.05) = 0.02 mol L-1
![]()
प्रश्न 20.
लौह अयस्क से स्टील बनाते समय जो अभिक्रिया होती है वह आयरन (II) ऑक्साइड का कार्बन मोनो ऑक्साइड द्वारा अपचयन है एवं इससे धात्विक लौह एवं CO2 मिलते हैं।
FeO (s) + CO (g) ⇌ Fe (s) + CO2 (g)
Kp = 0.265 atm at 1050K
1050 K पर CO एवं CO2 के साम्य पर आंशिक दाब क्या होंगे यदि उनके प्रारम्भिक आशिक दाब हैं।
PCO = 14 atm एवं PCO2 = 0.80 atm
हल:
FeO(s) + CO (g) ⇌ Fe (s) + CO2(g)
अभिक्रिया के लिये, Qp = \(\frac{\mathrm{P}_{\mathrm{CO}_2}}{\mathrm{P}_{\mathrm{CO}}}\)
दिया गया है। PCO2 = 0.80atm
PCO = 1.4 atm
Kp = 0.265 atm
Qp = \(\frac{\mathrm{P}_{\mathrm{CO}_2}}{\mathrm{P}_{\mathrm{CO}}}=\frac{0 \cdot 81}{1 \cdot 40}\) = 0.571
परन्तु Kp = 0.265
चूँकि Qp, Kp से अधिक है अतः अभिक्रिया पश्चगामी दिशा में अग्रसारित होगी। अत: CO2 का दाव घटेगा तथा CO का दाब बढ़ेगा जिससे साम्यावस्था प्राप्त हो सके। अतः यदि CO2 के दाब में होने वाली कमी p है तो CO के दाव में वृद्धि होगी।
साम्यावस्था पर PCO2 = (0.80 – p) atm
PCO = (1.4 + p) atm
Kp = \(\frac{\mathrm{P}_{\mathrm{CO}_2}}{\mathrm{P}_{\mathrm{CO}}}\)
0.265 = \(\frac{0 \cdot 80-p}{1 \cdot 40+p}\)
0.265 (1.4+p) = 0.80 – p
0.371 + 0.265p = 0.80 – p
1.265p = 0.429
P = \(\frac { 0.429 }{ 1.265 }\) = 0.339 atm
अतः साम्यावस्था पर PCO = 1.4 + 0.339
= 1.739 atm
PCO2 = 0.80 – 0.339 = 0.461 atm
प्रश्न 21.
अभिक्रिया N2 (g) + 3H2 ⇌ 2 NH3 के लिए (500 K पर) साम्य स्थिरांक KC = 0.061 है एक विशेष समय पर मिश्रण का संघटन इस प्रकार है-
[N2] = 3.0 mol L-1 [H2] = 2.0 mol L-1
एवं [NH3] = 0.5 mol L-1
क्या अभिक्रिया साम्य में है? यदि नहीं तो साम्य स्थापित करने के लिए अभिक्रिया किस दिशा में अग्रसरित होगी?
हल:
N2 (g) + 3H2 ⇌ 2 NH3 (g)
[N2] = 3.0 mol L-1
[H2] = 2.0 mol L-1
[NH3] = 0.5 mol L-1
QC = \(\frac{\left[\mathrm{NH}_{3(\mathrm{~g})}\right]^2}{\left[\mathrm{~N}_{2(\mathrm{~g})}\right]\left[\mathrm{H}_{2(\mathrm{~g})}\right]^3}=\frac{(0.5)^2}{(3.0)(2.0)^3}\)
= \(\frac{0.25}{(3.0)(2.0)^3}=\frac{0.25}{24}\)
= 0.0104
चूँकि QC का मान K के मान (0.061) से कम है अतः अभिक्रिया साम्यावस्था में नहीं है। यह तब तक अग्रगामी दिशा में अग्रसरित होगी जब तक कि QC का मान Kc के समान न हो जाये।
प्रश्न 22.
ब्रोमीन मोनो क्लोराइड (BrCI) विघटित होकर ब्रोमीन एवं क्लोरीन देता है तथा साम्य स्थापित होता है ।
2 BrCl (g) ⇌ Br2 (g) + Cl2(g)
इसके लिए 500 K पर KC = 32 है। यदि प्रारम्भ में BrCl की सान्द्रता 3.3 x 10-3 mol L-1 हो तो साम्य पर मिश्रण में इसकी सान्द्रता क्या होगी?
हल:
माना साम्यावस्था प्राप्त करने के लिये BrCl के x मोल वियोजित होते हैं। विभिन्न स्पीशीज की प्रारम्भिक व साम्य बिन्दु पर मोलर सान्द्रतायें निम्न प्रकार होंगी।

साम्य बिन्दु पर BrCl की मोलर सान्द्रता
= 3.3 x 10-3 – 3.0 x 10-3
= 3.0 x 10-4 mol/L-1
प्रश्न 23.
1127 K एवं 1 atm दाब पर CO तथा CO2 के गैसीय मिश्रण में साम्यावस्था पर ठोस कार्बन में 90.55% (भारात्मक) CO है।
C(s) + CO2(g) ⇌ 2CO(g)
उपर्युक्त ताप पर अभिक्रिया के लिए Kc के मान की गणना कीजिए।
हल:
अभिक्रिया के लिए Kp की गणना-
माना गैसीय मिश्रण का कुल द्रव्यमान = 100 g
मिश्रण में CO का द्रव्यमान = 90.55 g
मिश्रण में CO2 का द्रव्यमान = (100 – 90.55) = 9.45 g
CO के मोलों की संख्या = \(\frac { 90.55 }{ 28 }\)
= 3.234 mol
CO2 के मोलों की संख्या =\(\frac { 9.45 }{ 44 }\)
= 0.2l5 mol
मिश्रण में CO का आंशिक दाब
PCO = \(\frac{3.234}{3.234+0.215}\)
= 0.938 atm
मिश्रण में CO2 का आंशिक दाब
PCO2 = \(\frac{0.215}{(3.234+0.215)}\) x 1 atm
= 0.062 atm
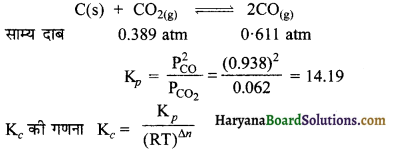
Kp = 0.959 atm R = 0.082 L atm K-1 mol-1
= 1127K
∆n = 2 – 1 = 1
Kc = \(\frac{14.19}{(0.082) \times(1127 K)}\)
= 0.153 mol L-1
प्रश्न 24.
298 K पर NO एवं O2 से NO2 बनती है।
NO (g) + \(\frac { 1 }{ 2 }\) O2 (g) ⇌ NO2 (g)
अभिक्रिया के लिए (क) ∆G° एवं (ख) साम्य स्थिरांक की गणना कीजिए –
∆fG° (NO2) = 52.0KJ/mol
∆fG° (NO) = 87.0kJ/mol
∆fG° (O2) = 0.0kJ/mol
हल:
(क) ∆G° की गणना –
∆G° = ∑ ∆G° (उत्पाद) – ∑ ∆G°(अधिकारक)
∆G° = [∆fG° (NO2)] – [∆fG°(NO) + \(\frac { 1 }{ 2 }\) ∆fG°(O2)]
∆G° = 52.0 (87.0 + \(\frac { 1 }{ 2 }\) x 0)
∆G° = 52 – 87
∆G° = – 35 kJ mol-1
(ख) Kc की गणना ∆fG° = – 2.303 RT log Kc
log Kc = \(\frac{-\Delta_f \mathrm{G}^{\mathrm{o}}}{2 \cdot 303 \mathrm{RT}}\)
log Kc = \(\frac{-\left(-35 \times 10^3\right)}{2 \cdot 303 \times 8.314 \times 298}\)
log Kc = 6.134
Kc = Antilog 6.134
Kc = 1.36 x 106
प्रश्न 25.
निम्नलिखित में से प्रत्येक साम्य में जब आयतन बढ़ाकर दाब कम किया जाता है तब बतलाइए कि अभिक्रिया के उत्पादों के मोलों की संख्या बढ़ती है या घटती है या समान रहती है –
(क) PCl5 (g) ⇌ PCI (g) + Cl2 (g)
(3) CaO (s) + CO2 (g) ⇌ CaCO3 (s)
(ग) 3Fe (s) + 4H2O (g) ⇌ Fe3O4 (s) + 4H2 (g)
उत्तर:
(क) दाब में कमी अग्रगामी अभिक्रिया को बढ़ा देगी तथा उत्पादों के मोलों की संख्या बढ़ेगी।
(ख) दाब में कमी पश्चगामी अभिक्रिया को बढ़ा देगी तथा उत्पादों के मोलों की संख्या घटेगी।
(ग) साम्यावस्था स्थिरांक पर दाब परिवर्तन का कोई प्रभाव नहीं पड़ता है। क्योंकि उत्पादों के मोलों की संख्या समान है।
प्रश्न 26.
निम्नलिखित में से दाब बढ़ाने कौन-कौन सी अभिक्रिया प्रभावित होगी? यह भी बताइए कि दाब परिवर्तन करने पर अभिक्रिया अग्र या प्रतीप दिशा में गतिमान होगी।
(i) COCl2 (g) ⇌ CO (g) + Cl2 (g)
(ii) CH4 (g) + 2S2 (g) ⇌ CS2 (g) + 2H2S (g)
(iii) CO2 (g) + C(s) ⇌ 2 CO (g)
(iv) 2H2 (g) + CO (g) ⇌ CH3OH (g)
(v) CaCO3 (s) ⇌ CaO (s) + CO2 (g)
(vi) 4NH (g) + 5O2(g) ⇌ 4NO (g) + 6H2O (g)
उत्तर:
(i) मोलों की संख्या में अन्तर ∆n = 1 + 1 – 1 – 1 दाब वृद्धि पश्चगामी अधिक्रिया का समर्थन करेगी चूँकि पश्चगामी दिशा में गैसीय घटकों के मोलों की संख्या की प्रति इकाई आयतन में कमी हो रही है।
(ii) मोलों की संख्या में अन्तर ∆n = (1 + 2) – (1 + 2) = 0
दाब वृद्धि साम्यावस्था को प्रभावित नहीं करती है क्योंकि अभिक्रिया के फलस्वरूप मोलों की संख्या में कोई अन्तर नहीं हो रहा है।
(iii) मोलों की संख्या में अन्तर ∆n = 2 – 1 = 1
दाब में वृद्धि पश्चगामी अभिक्रिया का समर्थन करेगी चूँकि पश्चगामी दिशा में गैसीय घटकों के मोलों की संख्या की प्रति इकाई आयतन में कमी हो रही है।
(iv) मोलों की संख्या में अन्तर ∆n = 1 – (2 + 1) = – 2
दाब में वृद्धि अग्रगामी क्रिया का समर्थन करेगी चूँकि अग्रगामी दिशा में गैसीय घटकों के मोलों की संख्या की प्रति इकाई आयतन में कमी हो रही है।
(v) मोलों की संख्या में अन्तर = ∆n = 1
दाब में वृद्धि पश्चगामी अभिक्रिया का समर्थन करेगी चूँकि पश्चगामी दिशा में गैसीय घटकों के मोलों की संख्या की प्रति इकाई आयतन में कमी हो रही है।
(vi) मोलों की संख्या में अन्तर ∆n = (4 + 6) – (4 + 5) = 1
दाब में वृद्धि पश्चगामी अभिक्रिया का समर्थन करेगी चूँकि पश्चगामी दिशा में गैसीय घटकों के मोलों की संख्या की प्रति इकाई आयतन में कमी हो रही है।
![]()
प्रश्न 27.
निम्नलिखित अभिक्रिया के लिए 1024 K पर साम्य स्थिरांक 1.6 x 105 है।
H2(g) + Br2(g) ⇌ 2HBr(g)
यदि HBr के 10.0 bar सील युक्त पात्र में डाले जाएँ तो सभी गैसों के 1124 K पर साम्य दाब ज्ञात कीजिए।
हल:
Kp की गणना-
H2(g) + Br2(g) ⇌ 2HBr(g)
Kp = Kc(RT)∆n ∆n = 0
Kp = Kc = 1.6 x 105
गैसों के आंशिक दाब-

उत्तर-PH2 = 0.050/2 = 0.025 bar
PBr2 = 0.025 bar
PHBr = (10 – 0.050) = 9.95 bar
प्रश्न 28.
निम्नलिखित ऊष्माशोषी अभिक्रियाओं के अनुसार ऑक्सीकरण द्वारा डाई हाइड्रोजन गैस प्राकृतिक गैस से प्राप्त की जाती है।
CH4(g) + H2O(g) ⇌ CO(g) + 3H2(g)
(क) उपर्युक्त अभिक्रिया के लिए Kp का व्यंजक लिखिए।
(ख) Kp एवं अभिक्रिया मिश्रण का साम्य पर संघटन किस प्रकार प्रभावित होगा यदि –
(i) दाब बढ़ा दिया जाय।
(ii) ताप बढ़ा दिया जाय।
(iii) उत्प्रेरकं प्रयुक्त किया जाय।
उत्तर:
(क) CH4(g) + H2O(g) ⇌ CO(g) + 3H2(g) के लिए Kp का व्यंजक
Kp = \(\frac{\left(\mathrm{P}_{\mathrm{CO}}\right)\left(\mathrm{P}_{\mathrm{H}_2}\right)^3}{\left(\mathrm{P}_{\mathrm{CH}_4}\right)\left(\mathrm{P}_{\mathrm{H}_2 \mathrm{O}}\right)}\)
(ख) (i) दाब बढ़ाने पर मोलों की संख्या प्रति इकाई आयतन बढ़ेगी। अतः दाब बढ़ाने पर साम्यावस्था बायीं ओर अर्थात् पश्चगामी दिशा में स्थानान्तरित होगी। परिणामस्वरूप अभिकारकों की अधिक मात्रा बनेगी तथा Kp का मान घट जायेगा।
(ii) यदि ताप बढ़ाया जाता है तो अग्रगामी अभिक्रिया बढ़ेगी चूँकि यह ऊष्माशोषी है इसलिए साम्यावस्था दाई ओर अग्रगामी दिशा में स्थानान्तरित होगी तथा Kp का मान घटेगा।
(iii) उत्प्रेरक के प्रयोग से साम्यावस्था परिवर्तित नहीं होगी क्योंकि यह अग्रगामी तथा पश्चगामी दोनों अभिक्रियाओं को समान रूप से प्रभावित करता है।
प्रश्न 29.
साम्य 2H2 (g) + CO (g) ⇌ CH3OH (g) पर (i) H2 मिलाने पर (ii) CH3OH मिलाने पर (iii) CO हटाने पर (iv) CH3OH हटाने पर साम्यावस्था किस प्रकार प्रभावित होगी?
उत्तर:
(i) साम्यावस्था अग्रगामी दिशा में स्थानान्तरित होगी।
(ii) साम्यावस्था पश्चगामी दिशा में स्थानान्तरित होगी।
(iii) साम्यावस्था पश्चगामी दिशा में स्थानान्तरित होगी।
(iv) साम्यावस्था अग्रगामी दिशा में स्थानान्तरित होगी।
प्रश्न 30.
473 K पर PCl5 के विघटन के लिए K का मान 8.3 x 10-3 है। यदि विघटन इस प्रकार दर्शाया जाये तो
PCI5 (g) ⇌ PCl3 (g) + Cl2 (g)
∆rH° = 124.0 kJ mol-1
(क) अभिक्रिया के लिए Kc का व्यंजक लिखिए।
(ख) प्रतीप अभिक्रिया के लिए समान ताप पर Kc का मान क्या होगा?
(ग) यदि
(i) और अधिक PCl5 मिलाया जाये।
(ii) दाब बढ़ाया जाये।
(iii) ताप बढ़ाया जाये तो Kc पर क्या प्रभाव पड़ेगा ?
उत्तर:
(क) Kc = \(\frac{\left[\mathrm{PCl}_3\right]\left[\mathrm{Cl}_2\right]}{\left[\mathrm{PCl}_5\right]}\)
यहाँ दिया है Kc = 8.3 × 10-3
(ख) प्रतीप अभिक्रिया के लिये,
Kc‘ = \(\frac{\left[\mathrm{PCl}_5\right]}{\left[\mathrm{PCl}_3\right]\left[\mathrm{Cl}_2\right]}\)
Kc‘ = \(\frac{1}{\mathrm{~K}_{\mathrm{C}}}\)
Kc‘ = \(\frac{1}{8.3 \times 10^{-3}}\) = 120.48
(ग) (i) यदि और अधिक PCl5 मिलाया जायेगा तो Kc का मान नियत रहता है।
(ii) जब दाब बढ़ाया जाता है तो अभिक्रिया कम आयतन की दिशा में अग्रसर होती है अतः अभिक्रिया पश्चगामी दिशा में विस्थापित हो जायेगी परिणामस्वरूप Kc का मान घट जायेगा।
(iii) ताप बढ़ाने पर अग्रगामी अभिक्रिया तीव्र होगी चूँकि अभिक्रिया ऊष्माशोषी है। इसलिए साम्यावस्था स्थिरांक Kc का मान बढ़ जायेगा।
प्रश्न 31.
हैबर विधि में प्रयुक्त हाइड्रोजन को प्राकृतिक गैस से प्राप्त मेथेन को उच्च ताप की भाप से क्रिया कर बनाया जाता है। दो पदों वाली अभिक्रिया में प्रथम पद में CO तथा H2 बनती है। दूसरे पद में प्रथम पद में बनने वाली CO और अधिक भाप से क्रिया करती है।
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
यदि 400°C पर अभिक्रिया पात्र में CO एवं भाप का सममोलर मिश्रण इस प्रकार लिया जाये कि PCO = PH2O = 4.0 bar, H2 का साम्यावस्था पर आंशिक दाब क्या होगा?
400°C पर Kp = 10.1 है।
हल:

प्रश्न 32.
बताइए कि निम्नलिखित में से किस अभिक्रिया में अभिकारकों एवं उत्पादों की सान्द्रता सुप्रेक्ष्य होगी –
(क) Cl2 (g) ⇌ 2Cl (g) Kc = 5 × 10-39
(ख) Cl2 (g) + 2NO (g) ⇌ 2NOCl (g) Kc = 3.7 x 108
(ग) Cl2 (g) + 2 NO2 (g) ⇌ 2 NO2 Cl (g) Kc = 1.8
उत्तर:
(क) Kc = 5 x 10-9 यह मान अत्यन्त कम है। इसलिये साम्यावस्था पर अभिकारकों की मात्रा बहुत अधिक है।
(ख) Kc = 3.7 x 108 यह मान अत्यधिक उच्च है इसलिए साम्यावस्था पर उत्पादों की मात्रा बहुत अधिक है तथा अभिक्रिया पूर्णता के निकट है।
(ग) Kc = 1.8 यह मान 1 से अधिक है। इसलिए अभिकारकों की मात्रा उत्पादों की मात्रा से कम होगी। अतः इस अभिक्रिया में अभिकारकों एवं उत्पादों की सान्द्रता सप्रेक्ष्य होगी।
प्रश्न 33.
25°C पर अभिक्रिया 3O2 (g) ⇌ 2O3 (g) के लिए K का मान 2.0 x 10-50 है यदि वायु में 25°C ताप पर O2 की साम्यावस्था सान्द्रता 1.6 x 10-2 है तो O3 की सान्द्रता क्या होगी?
हल:
3O2 (g) ⇌ 2O3 (g)
Kc = \(\frac{\left[\mathrm{O}_3\right]^2}{\left[\mathrm{O}_2\right]^3}\)
2.0 x 10-50 = \(\frac{\left[\mathrm{O}_3\right]^2}{\left(1.6 \times 10^{-2}\right)^3}\)
[O3]² = 2.0 x 10-50 x 2.56 x 1.6 × 10-6
= 8.19 × 10-56
[O3] = 2.9 x 10-28 mol L-1
प्रश्न 34.
CO(g) + 3H2(g) ⇌ CH4 (g) + H2O(g) अभिक्रिया एक लीटर फ्लास्क में 1300 K पर साम्यावस्था में है। इसमें CO के 0.3 mol, H2,के 0.01 mol, H2 O के 0.01 mol एवं CH4, की अज्ञात
मात्रा है दिये गये ताप पर अभिक्रिया के लिए Kc का मान 3.90 है। मिश्रण में CH4 की मात्रा ज्ञात कीजिए।
हल:

प्रश्न 35.
संयुग्मी अम्ल-क्षारक युग्म का क्या अर्थ है। निम्नलिखित स्पीशीज के लिए संयुग्मी अम्ल / क्षारक बताइए-
HNO2 CN–, HClO4, F–, OH–, CO32-, एवं S2-
उत्तर:
अम्ल तथा क्षारक के वे युग्म जो क्रमश: एक प्रोटॉन की उपस्थिति या अनुपस्थिति के कारण एक-दूसरे से भिन्न होते हैं, संयुग्मी अम्ल-क्षारक युग्म कहलाते हैं अतः संयुग्मी अम्ल में एक अतिरिक्त प्रोटॉन होता है तथा प्रत्येक क्षारक में एक प्रोटॉन कम होता है।

प्रश्न 36.
निम्नलिखित में कौन लूइस अम्ल हैं?
H2O, BF3, H+ एक NH4+
उत्तर:
BF3, H+ लूईस अम्ल हैं।
प्रश्न 37.
निम्नलिखित ब्रॉन्स्टेड अम्लों के लिए संयुग्मी क्षारकों के सूत्र लिखिए-
HF, H2SO4 एक HCO3–
उत्तर:
| ब्रॉन्स्टेड अम्ल | संयुग्मी क्षारक |
| HF | F– |
| H2SO4 | HSO4– |
| HCO3– | CO32- |
प्रश्न 38.
ब्रॉन्स्टेड क्षारकों NH2–, NH3 तथा HCOO– के संयुग्मी अम्ल लिखिए।
उत्तर:
| ब्रॉन्स्टेड क्षारक | संयुग्मी अम्ल |
| NH2– | NH3 |
| NH3 | NH4+ |
| HCOO– | HCOOH |
प्रश्न 39.
स्पीशीज H2O, HCO3–, HSO4 तथा NH3 ब्रॉन्स्टेड अम्ल तथा क्षारक दोनों की भाँति व्यवहार करते हैं, प्रत्येक के संयुग्मी अम्ल तथा क्षारक बताइए।
उत्तर:
| स्पीशीज | संयुग्मी अम्ल | संयुग्मी क्षारक |
| H2O | H3O+ | OH– |
| HCO3– | H2CO3 | CO32- |
| HSO4– | H2SO4 | SO42- |
| NH3 | NH4+ | NH2- |
प्रश्न 40.
निम्नलिखित स्पीशीज को लूइस अम्ल तथा क्षारक में वर्गीकृत कीजिए तथा बताइए कि ये किस प्रकार लूईस अम्ल-क्षारक का कार्य करते हैं-
(क) OH– (ख) F– (ग) H+ (घ) BCl3
उत्तर:
(कं) OH– लुईस क्षारक, यह इलेक्ट्रॉन युग्म दाता है।
(ख) F– लूईस क्षारक, एक इलेक्ट्रॉन युग्म दान कर सकता है।
(ग) H+ लुईस अम्ल, एक इलेक्ट्रॉन युग्म ग्रहण कर सकता है।
(घ) BCl3 लूइस अम्ल, एक इलेक्ट्रॉन युग्म ग्रहण कर सकता है।
![]()
प्रश्न 41.
एक मृदु पेय के नमूने में हाइड्रोजन आयन की सान्द्रता 3.8 x 10-3 M है, उसकी pH ज्ञात कीजिए।
हल:
pH = – log [H+]
= – log (3.8 x 10-3)
= 2.4202
प्रश्न 42.
सिरके के एक नमूने की pH 3. 76 है। इसमें हाइड्रोजन आयन की सान्द्रता ज्ञात कीजिए।
हल:
pH = – log [H+]
= \(\frac{1}{\log \left[\mathrm{H}^{+}\right]}=3.76\)
= 3.76
\(\frac{1}{\left[\mathrm{H}^{+}\right]}\) = anti log 3.76 = 5754.4
[H+] = 1.74 × 104M
प्रश्न 43.
HF, HCOOH तथा HCN का 298 K का आयनन स्थिरांक क्रमश: 6.8 × 10-4, 1.8 × 104 तथा 4.8 x 10-9 है। इनके संगत संयुग्मी क्षारकों के आयनन स्थिरांक ज्ञात कीजिए।
हल:
HF के लिए,
Kw = 10-14
Ka = 6.8 × 10-4
Kb = \(\frac{\mathrm{K}_w}{\mathrm{~K}_a}=\frac{10^{-14}}{6.8 \times 10^{-4}}\)
= 1.47 × 10-11
HCOOH के लिए
Ka = 1.8 × 10-4
Kb = \(\frac{\mathrm{K}_w}{\mathrm{~K}_a}\)
= \(\frac{10^{-14}}{4.8 \times 10^{-4}}\)
= 5.55 x 10-9
HCN के लिए
Ka = 4.8 × 10-9
Kb = \(\frac{\mathbf{K}_w}{\mathbf{K}_a}\)
= \(\frac{10^{-14}}{1.8 \times 10^{-9}}\)
= 2.08 x 10-6
प्रश्न 44.
फीनॉल का आयनन स्थिरांक 1.0 x 10-10 है। 0.05 M फीनॉल के विलयन में फीनॉलेट आयन की सान्द्रता तथा 0.01 M सोडियम फीनेट विलयन में उसके आयनन की मात्रा ज्ञात कीजिए।
हल:
माना फीनॉल के C mol जल में घुलकर विलयन बनाते हैं तथा फीनॉल के वियोजन की मात्रा α है । साम्य बिन्दु पर विभिन्न स्पीशीज की सान्द्रता निम्न प्रकार होगी-

जब फीनॉल (PhOH) को 0.01 M सोडियम फीनेट विलयन में मिलाया जाता है तब
PhOH ⇌ PhO– + H+
PhONa ⇌ PhO– + Na+
सोडियम फीनेट के आयनन के कारण PhO– की सान्द्रता की पूर्णता (पूर्ण आयनन) = 0.01 M
PhOH से PhO– आयनों की सान्द्रता = x M
PhO– आयनों की कुल सान्द्रता PhO– = 0.01 + x
= 0.01 M (x अत्यन्त कम होने के कारण नगण्य है)
अनायनित PhOH की सान्द्रता = 0.05 – x = 0.05 M
PhOH के लिए आयनन स्थिरांक

प्रश्न 45.
H2S का प्रथम आयनन विभव स्थिरांक 9.1 x 10-8 है। इसके 0.1 M विलयन में HS– आयनों की सान्द्रता की गणना कीजिए तथा बताइए कि यदि इसमें 0.1 M HCl भी उपस्थित हो तो सान्द्रता किस प्रकार प्रभावित होगी। यदि H2S का द्वितीय वियोजन स्थिरांक 1.2 x 10-13 हो तो सल्फाइड S2- आयनों की दोनों स्थितियों में सान्द्रता की गणना कीजिए।
उत्तर:
0.1 M H2S विलयन में [HS– ] की गणना-
माना H2S के विलयन की मात्रा = α

0.1 M HCl विलयन में [HS–] सान्द्रता-
जब 0.1 M HCl विलयन में H2S मिलाई जाती है तब वियोजन निम्न प्रकार होता है-
H2S ⇌ H+ + HS–
HCl → H+ + Cl–
HCl के वियोजन से प्राप्त (H+] = 0.1 M
माना H2S (दुर्बल अम्ल) के वियोजन के कारण [H+] = xM
H+ आयनों की कुल सान्द्रता = 0.1 x 0.1 M
(x अत्यन्त कम होने के कारण उपेक्षणीय है)
विलयन में [HS–] = xM
अवियोजित H2S की सान्द्रता = [H2S] = 0.1 – x = 0.1 M
Kαl = \(\frac{\left[\mathrm{H}^{+}\right]\left[\mathrm{HS}^{-}\right]}{\left[\mathrm{H}_2 \mathrm{~S}\right]}\)
9.1 × 10-8 = \(\frac{(0.1 \times x)}{(0.1)}\)
x = 9.1 × 10-8
HCl की अनुपस्थिति में [S2-] की गणना-
H2S ⇌ H+ + HS–, Kα1 = 9.1 × 10-8
HS– ⇌ H+ + S2-, Kα2 = 1.2 × 10-13
सम्पूर्ण अभिक्रिया के लिए Kα गणना हेतु दोनों समीकरणों से
Kα = Kα1 × Kα2 = (9.1 × 10-8) × (1.2 × 10-13)
= 1.092 × 10-20
H2S का समीकरण निम्न प्रकार होता है-

0.1 MHCI की उपस्थिति में [S2-] की गणना-
माना H2S के वियोजन के कारण [S2-] = zM.

प्रश्न 46.
ऐसीटिक अम्ल का आयनन स्थिरांक 1.74 x 10-5 है इसके 0.05M विलयन में वियोजन की मात्रा, ऐसीटेट आयन सान्द्रता तथा pH का परिकलन कीजिए।
उत्तर:

प्रश्न 47.
0.01 M कार्बनिक अम्ल (HA) के विलयन की PH 4.15 है। इसके ऋणायन की सान्द्रता, अम्ल का आयनन स्थिरांक तथा pKa मान परिकलित कीजिए।
हल:
HA ⇌ H+ + A–
pH = 4.15, C = [HA–] = 0.01 M
[H+] = 10-PH
– log [H+] = 4.15
log [H+] = – 4.15 = \(\overline{5}\).85
[H+] = antilog \(\overline{5}\).85 = 7.079 × 10–5
ऋणायन की सान्द्रता [A–] = [H+] = 7.08 x 10-5 M
Ka = (7.08 × 10-5)²/0.01 = 5.8 × 10-7
pKa = – log Ka
= – log 5.08 × 10-7 = 6.29
प्रश्न 48.
पूर्ण वियोजन मानते हुए निम्नलिखित विलयनों के pH मान ज्ञात कीजिए।
(क) 0.003 M HCl
(ख) 0.005 M NaOH
(ग) 0.002 M HBr
(घ) 0.002 M KOH
हल:
(क) HCl(aq) → H+(aq) + Cl– (g)
[HCl] = 0.003 M
[H+] = [HCl] = 0.003
pH = – log [H+] = – log 3 × 10-3 = 2.528
(ख) NaOHaq → Na+aq + OH–aq
[NaOH] = 0.005 = 5 × 10-3 M
[OH–] = [NaOH] = 5 × 10-3 M
[H+] = \(\frac{\left[\mathrm{K}_w\right]}{\left[\mathrm{OH}^{-}\right]}=\frac{10 \times 10^{-14}}{5.0 \times 10^{-3}}\) = 2 × 10-12
pH = – log 2 x 10-12 = 11.70
(ग) HBr → H+ + Br–
[HBr] = 0.002M = [H+]
|pH = – log [H+] = – log 2 × 10-3 = 2.70
(घ) KOH → K+ + OH–
[OH] = 0.002 M
[H+] = \(\frac{\left[\mathrm{K}_w\right]}{\left[\mathrm{OH}^{-}\right]}=\frac{1 \times 10^{-14}}{0.002}\) = 5 × 10-12 M
pH = – log [H+] = 11.30
प्रश्न 49.
निम्नलिखित में विलयनों के pH ज्ञात कीजिए-
(क) 2g TiOH को जल में घोलकर 2 L विलयन बनाया जाए।
(ख) 0.3 g Ca(OH)2 को जल में घोलकर 500 ml विलयन बनाया जाए।
(ग) 0.3 g NaOH को जल में घोलकर 200 ml विलयन बनाया जाए।
(घ) 13.6 M HCl के ml को जल से तनुकरण करके कुल आयतन 1 L किया जाए।
हल:
(क) Ti(OH) विलयन की मोलरता

pOH = – log [OH–]
= – log (3.75 × 10-2 ) = 1.426
pH = 14 – pOH
= 14 – 1.426 = 12.574
(घ) M1V1 = M2V2
13.6M × 1 = M2 x 1000
M2 = \(\frac { 13.6 }{ 1000 }\)
= 1.36 × 10-2 M
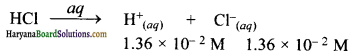
pH = – log [H+]
= – log (1.36 × 10-2)
= 1.866.
![]()
प्रश्न 50.
ब्रोमो ऐसीटिक अम्ल की आयनन की मात्रा 0.132 है। 0.1 M अम्ल की pH तथा pka का मान ज्ञात कीजिए।
हल:
ब्रोमो ऐसीटिक अम्ल की आयनन की मात्रा (α) = 0.132
अम्ल की सान्द्रता = 0.1 M
[H+] = C × α = 0.1 x 0.132
= 00132 M
PH = – log [H+] = – log 0.0132
= – log (1.32 × 10-2)
= 1.88.
Ka = \(\frac { Ca² }{ 1-α }\)
[CH3COO] = Cα तथा [CH3COOBr] =C(1 – α)
= \(\frac{0.1 \times(0.0132)^2}{1-0.0132}\)
= 2.01 x 10-3
pKa = – log Ka = – log (2.01 × 10-3)
= 2.71
प्रश्न 51.
0.005 M कोडीन C18H21 NO3 विलयन की PH 9.95 है। इसका आयनन स्थिरांक ज्ञात कीजिए।
हल:

प्रश्न 52.
0.001 M एनिलीन विलयन का pH क्या है एनिलीन का आयनन स्थिरांक 4.27 x 10-10 है। इसके संयुग्मी अम्ल का आयनन स्थिरांक ज्ञात कीजिए।
हल:

प्रश्न 53.
यदि 0.05 M ऐसीटिक अम्ल के pKa का मान 4.74 है तो आयनन की मात्रा ज्ञात कीजिए। यदि इसे
(अ) 0.01 M HCl
(ब) 0.1 M HCl विलयन में डाला जाए तो वियोजन की मात्रा किस प्रकार प्रभावित होती है।
हल:
PKa = – log Ka
4.74 = – log Ka
log Ka = – 4.74 + 1 – 1
log Ka = \(\overline{5}\).26
Ka = anti log (\(\overline{5}\).26)
= 1.8 × 10-5
Ka = Cα²
α = \(\sqrt{\frac{\mathrm{K}_a}{\mathrm{C}}}=\sqrt{\frac{\left(1.8 \times 10^{-5}\right)}{0.05}}\)
= \(\sqrt{3.6 \times 10^{-4}}\)
= 1.9 x 10-2
= 0.019 = 1.9 %

इस स्थिति में वियोजन की मात्रा 0.01 M HCl से 10 गुना कम हो जाती है।
प्रश्न 54.
डाइ मेथिल एमीन का आयनन स्थिरांक 5.4 x 10-4 है। इसके 0.02 M विलयन की आयनन की मात्रा की गणना करिए यदि यह विलयन NaOH के प्रति 0.1M हो तो डाड़ मेथिल एमीन का प्रतिशत आयनन क्या होगा?
हल:

NaOH की अनुपस्थिति में वियोजन की मात्रा 0.164 से अत्यन्त कम है।
प्रश्न 55.
निम्नलिखित जैविक द्रवों जिनकी PH दी गई है की हाइड्रोजन आयन सान्द्रता परिकलित कीजिए।
(क) मानव पेशीय द्रव 6.83
(ख) मानव उदर द्रव 1.2
(ग) मानव रुधिर 7.38
(घ) मानव लार 6.4
हल:
(क) मानव पेशीय द्रव की [H+]
pH = 6.83
log\(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = 6.83
= antilog 6.83
[H+] = antilog (6.83)
= 1.48 × 10-7 M
(ख) मानव उदर द्रव की [H+]
pH = 1.2 या log \(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = 1.2
\(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = anti log (1.2)
= anti log (- 1.2)
= 6.309 × 10-2 M
(ग) मानव रुधिर की [H+]
pH = 7.38 या \(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = 73.8
\(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = anti log (7.38)
[H+] = anti log (- 7.38)
= 4.168 × 10-8 M
(घ) मानव लार की [H+]
\(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = anti log (6.4)
[H+] = anti log ( – 6.4)
= 3.981 × 107M.
प्रश्न 56.
दूध, कॉफी, टमाटर रस, नीबू रस तथा अण्डे की सफेदी के pH का मान क्रमश: 6.8, 5.0, 4.2 2.2 तथा 7.8 हैं। प्रत्येक के संगत H+ आयन की सान्द्रता ज्ञात कीजिए।
हल:
दूध की [H+]
pH = 6.8
या log \(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = 6.8
\(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = antilog (6.8)
[H+] = antilog (- 6.8)
= 1.585 x 10-7 M
कॉफी की [H+]
pH = 5.0
या log \(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = 5.0
\(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = antilog (5.0)
[H+] = antilog (-5.0)
= 1.0 x 10-5 M
टमाटर रस की [H+]
pH = 4.2
या log \(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = 4.2
\(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = anti log 4.2
[H+] = anti log (4.2)
= 6.309 × 10-5 M
नीबू रस की [H+]
pH = 2.2
या log \(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = 2.2
\(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = anti log (2.2)
[H+] = anti log (2.2)
= 6.309 × 10-3 M
अण्डे की सफेद जर्दी की [H+]
pH = 7.8
या \(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = 7.8
\(\left[\frac{1}{\mathrm{H}^{+}}\right]\) = anti log (7.8)
[H+] = anti log ( 7.8)
= 1.585 × 10-8 M.
प्रश्न 57.
298K पर 0.561 g KOH जल में घोलने पर प्राप्त 200 ml विलयन की pH तथा पोटैशियम, हाइड्रोजन तथा हाइड्रोक्सिल आयनों की सान्द्रताऐं ज्ञात कीजिए।
हल:
विलयन की मोलर सान्द्रता
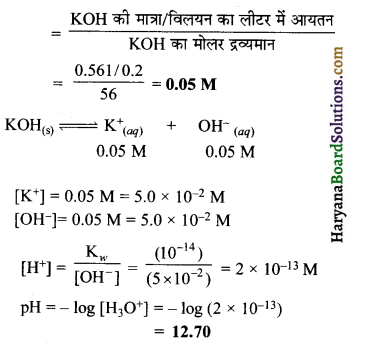
प्रश्न 58.
298 K पर Sr (OH)2 विलयन की विलेयता 19.23g/ L है स्ट्रॉन्शियम तथा हाइड्रोक्सिल आयन की सान्द्रता एवं विलयन की pH ज्ञात कीजिए।
हल:
विलयन की मोलरता

प्रश्न 59.
प्रोपेनोइक अम्ल का आयनन स्थिरांक 1.32 × 105 है, 0.05 M अम्ल विलयन के आयनन की मात्रा तथा PH ज्ञात कीजिए। यदि विलयन में 0.01 M HCI मिलाया जाये तो उसके आयनन की मात्रा ज्ञात कीजिए।
हल:
यदि आयनन की मात्रा है तो
α = \(\sqrt{\frac{\mathrm{K}_a}{\mathrm{C}}}\)
= \(\sqrt{\frac{1.32 \times 10^{-5}}{0.05}}\)
= 1.62 × 10-2
[H+] = Cα
= 0.05 x 1.62 × 10-2
= 8.12 x 10-4
pH = – log [H+]
= – log (8.12 x 10-4)
= 3.09
0.01 M HCl की उपस्थिति में आयनन की मात्रा घटेगी क्योंकि HCl की उपस्थिति में साम्य बाँयी तरफ जायेगा अतः प्रोपेनोइक अम्ल की सान्द्रता बढ़ेगी।
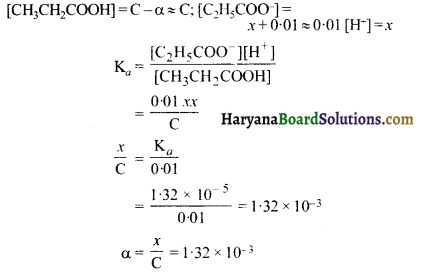
प्रश्न 60.
यदि सायनिक अम्ल (HCNO) के 0.1M विलयन की pH = 2.34 हो तो अम्ल के आयनन स्थिरांक तथा आयनन की मात्रा ज्ञात कीजिए।
हल:

प्रश्न 61.
यदि नाइट्स अम्ल का आयनन स्थिरांक 4.5 x 10-4 है तो 0.04 M सोडियम नाइट्राइट विलयन की pH तथा जलयोजन की मात्रा ज्ञात कीजिए।
हल:
सोडियम नाइट्राइट प्रबल क्षार NaOH तथा दुर्बल अम्ल HNO का लवण है। इसके जलयोजन की मात्रा निम्न प्रकार होगी –

PH की गणना-जलीय विलयन में NaNO2 का जलयोजन निम्न प्रकार होता है-

प्रश्न 62.
यदि पिरीडीनियम हाइड्रोजन क्लोराइड के 0.02 M विलयन का pH 3.44 है तो पिरीडीन का आयनन स्थिरांक ज्ञात कीजिए ।
हल:
पिरीडीनियम हाइड्रोजन क्लोराइड [C6H5N+ HCl–) का
pH = – \(\frac { 1 }{ 2 }\) [log Kw – log Kb + log c]
pH = 3.44, Kw = 1 x 10-14, C = 0.02 M
3.44= – \(\frac { 1 }{ 2 }\)[log(1 × 10-14) – log Kb + log(2 x 10-2)]
3.44 = – \(\frac { 1 }{ 2 }\)[- 14 – log Kb – 1.70]
6.88 = 14 + log Kb + 1.70
log Kb = 6.88 – 14 – 1.70 = – 8.82
Kb = antilog (- 8.82) = 1.51 x 10-9
प्रश्न 63.
निम्नलिखित लवणों के जलीय विलयनों के उदासीन अम्लीय तथा क्षारीय होने की प्रागुक्ति कीजिए।
NaCl, KBr, NaCN, NH4NO3, NaNO3 तथा KF
हल:
अम्लीय – NH4NO3
क्षारीय – NaCN, NaNO3, KF
उदासीन NaCl, KBr
प्रश्न 64.
क्लोरोऐसीटिक अम्ल का आयनन स्थिरांक 1.35 x 10-3 है 0.1 M अम्ल तथा इसके 0.1 M सोडियम लवण की pH ज्ञात कीजिए।
हल:
अम्ल विलयन का pH
Ka = 1.35 x 10-3
C = 0.1 M
[H+] = (Ka × C)1/2
= (1.35 × 10-3 x 0.1) 1⁄2
= 1.16 × 10-2 M
pH = – log [H+] = – log (1.16 × 10-2) = 1.94
अम्ल के सोडियम लवण का pH
Kh = \(\frac{\mathrm{K}_w}{\mathrm{~K}_a}=\frac{1.0 \times 10^{-14}}{1.35 \times 10^{-3}}=7.4 \times 10^{-12}\)
जलयोजन मात्रा h = \(\sqrt{\frac{\mathrm{K}_h}{\mathrm{C}}}\)
= \(\sqrt{\frac{\left(7.4 \times 10^{-12}\right)}{0.1}}\)
= 8.6 x 10-7
अम्ल का सोडियम लवण जलयोजन द्वारा क्षारीय विलयन बनाता है
[OH–] = Ch = 0.1 x 8.6 × 10– = 8.6 × 10-7
[H+] = \(\frac{\mathrm{K}_w}{\left[\mathrm{OH}^{-}\right]}=\frac{1.0 \times 10^{-14}}{8.6 \times 10^{-7}}\) = 1.16 x 10-8
pH = – log[H+] = log (1.16 × 10-8)
= 7.94
प्रश्न 65.
310K ताप पर यदि जल का आयनन स्थिरांक 2.7 x 10-14 है तो ताप पर उदासीन जल की pH क्या होगी?
हल:
उदासीन जल के लिए [H+] = [OH–]
[H+] [OH–] = Kw = 2.7 x 10-14
[H+]² = 2.7 x 10-14
[H+] = (2.7 x 10-14)1/2 = 1.643 × 10-7
जल का pH = – log [H+] = log (1.643 x 10-7) = 6.78
![]()
प्रश्न 66.
निम्नलिखित मिश्रणों की pH परिकलित कीजिए-
(क) 0.2 M Ca(OH) का 10 ml + 0.1 M HCl का 25 ml
(ख) 0.01 M H2 SO4 का 10ml + 0.01 M Ca(OH)2 का 10 ml
(ग) 0.1 M H2SO4 का 10ml + 0.1 M KOH का 10ml
हल:
(क) मिश्रित करने पर Ca(OH)2 विलयन की मोलरता
= \(\frac{(0.2 \mathrm{M}) \times(10 \mathrm{ml})}{(35 \mathrm{ml})}\)
= 0.057 M
विलयन में [OH–] = 2 x 0.057 M = 0.114 M
मिश्रित करने पर HCl की मोलरता
= \(\frac{(0.1 \mathrm{M}) \times(25 \mathrm{ml})}{(35 \mathrm{ml})}\)
= 0.071 M
विलयन में [H+] = 0.071 M
उदासीनीकरण के पश्चात् [OH–] = (0114 – 0.071) = 0.043 M
[OH–] = = log[OH–]
= – log (4.3 x 10-2)
= 1.367 = 1.37
pH = 14 – POH = 14 – 1.37 = 12.63
(ख) मिश्रित करने पर H2 SO4 विलयन की मोलरता
= \(\frac{(0.01 \mathrm{M} \times 10 \mathrm{ml})}{(20 \mathrm{ml})}\)
= 0.005 M
विलयन में [H+] = 2 × 0.005 = 0.01 M
मिश्रित करने पर Ca(OH)2 विलयन की मोलरता
= \(\frac{(0.01 \mathrm{M} \times 10 \mathrm{ml})}{(20 \mathrm{ml})}\)
= 0.005 M
विलयन में [OH–] = 0.005 × 2 = 0.01 M
चूँकि विलयन में [H+] तथा [OH–] समान हैं अतः विलयन उदासीन है।
अतः विलयन का pH = 7
(ग) मिश्रित करने पर H2SO4 की मोलरता
= \(\frac{(0.1 \times 0.1)}{20}\)
= 0.05 M
विलयन में [H+] = (0.05 x 2 ) = 0.10 M
मिश्रित करने पर KOH की मोलरता
= \(\frac{(0.1 \times 0.1)}{20}\)
= 0.05 M
विलयन में [OH–] = 0.05 M
उदासीनीकरण के पश्चात् [H+] = 0.05 M
= 0.1 – 0.05 = 0.05 M
pH = – log [H+] = – log (5 x 10-2)
= 1.301
प्रश्न 67.
सिल्वर क्रोमेट, बेरियम क्रोमेट, फैरिक हाइड्रोक्साइड, लैंड क्लोराइड तथा मरक्यूरस आयोडाइड विलयन के 298 K पर निम्नलिखित दिये गये विलेयता गुणनफल स्थिरांक की सहायता से विलेयता ज्ञात कीजिए तथा प्रत्येक आयन की मोलरता भी ज्ञात कीजिए।
Ksp(Ag2CrO4) = 1.1 × 10-12
Ksp (BaCr O4) = 1.2 × 10-10
Ksp = (Fe(OH3) = 1.0 × 10-38
Ksp = (PbCl2) = 1.6 x 10-5
Ksp(Hg2I2) = 45 × 10-29
उत्तर:
(i) (Ag2CrO4)
(Ag2CrO4) ⇌ 2Ag+(aq) + CrO42- (aq)
माना जल में लवण की विलेयता = S
[Ag+(aq)]= 2S
[CrO4-2(aq)] = S
Ksp = [Ag+ (aq)]² [CrO42- (aq)
1.1 x = 10-12 = (2S)² × S = 4s³
S³ = \(\frac{\left(1.1 \times 10^{-12}\right)}{4}\)
= 0.275 x 10-12
S = \(\sqrt[3]{0.275 \times 10^{-12}}\)
S = 6.5 × 10-5 M
Ag+ आयनों की मोलरता
= 2S = 2 × 6.5 x 10-5 M
= 1.3 × 10-4 M
CrO42- आयनों की मोलरता
= S = 6.5 x 10-5 M
(ii) (BaCrO4)
BaCrO4 ⇌ Ba2+ (aq) + CrO42- (aq)
माना जल में लवण की विलेयता S है।
[Ba2+(aq)] = S
[CrO42-] = S
Ksp = [Ba2+ (aq)] [CrO42-(aq)]
1.2 × 10-10 = S x S = S²
S = (1.2 × 10-10)1/2
S = 1.10 × 105- M
Ba2+ (aq) आयनों की मोलरता = 1.1 x 105- M
CrO42- आयनों की मोलरता = 1.1 × 105- M
(iii) (Fe(OH)3)
Fe(OH)3(aq) ⇌ Fe3+(aq) + 3OH–(aq)
माना जल में लवण की विलेयता S है।
Fe3+(aq) = S
[OH–] (aq) = 3S
Ksp = [Fe3+(aq)] [OH–(aq)]³
1.0 × 10-38 = S × (3S)³ = 27S4
S = \(\left(\frac{1.0 \times 10^{-38}}{27}\right)^{1 / 4}\)
= 1.387 x 10-10 M
Fe3+(aq) आयनों की मोलरता
= 1.387 × 10-10 M
OH– (aq) आयनों की मोलरता
= 3 × 1.387 × 10-10 M
= 4.16 × 10-10 M
(iv) (PbCl2)
PbCl2 ⇌ Pb2+ + 2Cl–(aq)
माना लवण की जल में विलेयता = S
Pb2+(aq) = S
Cl– (aq) = 2S
Ksp = [Pb2+aq] [CI–(aq)]²
1.6 × 10-5 = (S) × (2S)² = 4S³
S³ = \(\frac{1.6 \times 10^{-5}}{4}\) = 4.0 x 10-6
S = (4.0 × 10-6)1/3 = 1.58 × 10-2 M
Pb2+ (aq) आयनों की मोलरता
= 1.58 x 10-2 M
Cl–(aq) आयनों की मोलरता
= 3.16 × 10-2 M
(v) (Hg2I2)
Hg2I2 ⇌ Hg22+ + 2I– (aq)
माना जल में Hg2I2 की विलेयता = S
Hg2I2+(aq) = S
I– (aq) = 2S
Ksp= [Hg22+(aq)] [I–(aq)]²
45 × 10-29 = (S) × (2S)² = 4S³
S³ = \(\frac{4.5 \times 10^{-29}}{4}\) = 1.125 × 10-29
S = (1.125 × 10-29)1/3
= 2.24 x 10-10 M
Hg22+ (aq) आयनों की मोलरता
= 2.24 x 10-10 M
I– (aq) आयनों की मोलरता
= 4.48 × 10-10 M
प्रश्न 68.
Ag2CrO4 तथा AgBr का विलेयता गुणनफल क्रमशः 1.1 × 10-12 तथा 5.0 x 10-13 है। उनके संतृप्त विलयन की मोलरता का अनुपात ज्ञात कीजिए।
हल:
Ag2CrO4 ⇌ = 2Ag+(aq) + CrO42-(aq)
माना लवण की जल में विलेयता S है।
[Ag+(aq)] = 2S
[CrO42-(aq)] = S
Ksp = [Ag+(aq)]² [CrO42-(aq)]
= (2S)² × S = 4S³
S = \(\left(\frac{\mathrm{K}_{s p}}{4}\right)^{1 / 3}=\left(\frac{1.1 \times 10^{-12}}{4}\right)^{1 / 3}\)
= 0.65 × 10-4 mol L-1

प्रश्न 69.
यदि 0.002 M सान्द्रता वाले सोडियम आयोडेट तथा क्यूप्रिक क्लोरेट विलयन के समान आयतन को मिलाया जाए तो क्या कॉपर आयोडेट का अवक्षेपण होगा?
(कॉपर आयोडेट के लिए Ksp = 7.4 x 10-6)
हल:
मिश्रण के पश्चात् NaIO3 की सान्द्रता
= \(\frac { 0.002 }{ 2 }\) = 0.001 M
Cu (ClO3)2 की सान्द्रता मिश्रण के पश्चात्
= \(\frac { 0.002 }{ 2 }\) = 0.001 M
NaIO3 ⇌ Na+ + IO3–
[IO3–] = 0.001 M
Cu (ClO3)2 ⇌ Cu2+ + 2 ClO3–
[Cu2+] = 0.001 M
Cu (IO3)2 का आयनिक गुणनफल= [Cu2+][IO3–]²
= (0.001) (0.001)²
= (0.001) (0.001)²
= 1 × 10-9
चूँकि Kp (7.4 x 10-4) का मान आयनिक गुणनफल (1 × 10-9) की तुलना में काफी अधिक है अतः अवक्षेपण नहीं होगा। आयनिक गुणनफल विलेयता गुणनफल से कम है। अतः कोई अवक्षेप नहीं बनेगा।
प्रश्न 70.
बैन्जोइक अम्ल का आयनन स्थिरांक 6.46 x 10-5 तथा सिल्वर बैन्जोएट का Ksp2.5 x 10-13 है। 3.19 pH वाले बफर विलयन में सिल्वर बॅन्जोएट जल की तुलना में कितना विलेय होगा?
हल:
C6H5COOAg ⇌ C6H5COO– + Ag+
माना सिल्वर वैन्जोएट की विलेयता X mol L–
Ksp = [C6H5COO–][Ag+]
X² = Ksp = 2.5 × 10-13
X = \(\sqrt{\mathrm{K}_{S P}}=\sqrt{2.5 \times 10^{-13}}\)
= 5.0 x 10-7 mol L-1
बफर का pH = 3.19
PH = – log [H+]
3.19 = – log [H–] = 3.19 = \(\overline{4}\).81
[H+] = antilog \(\overline{4}\).81 = 6.457 x 10-4
C6H5COO ⇌ आयन H+ आयन के साथ बैन्जोइक अम्ल बनाता है। परन्तु H+ आयन स्थिर रहता है बफर विलयन के कारण
C6H5COOH ⇌ C6H5COO– + H+
Ka = \(\frac{\left[\mathrm{C}_6 \mathrm{H}_5 \mathrm{COO}^{-}\right]\left[\mathrm{H}^{+}\right]}{\left[\mathrm{C}_6 \mathrm{H}_5 \mathrm{COOH}\right]}\)
= \(\frac{6.457 \times 10^{-4}}{6.46 \times 10^{-5}}\) = 10
माना बफर विलयन में विलेयता Y मोल/लीटर है।
तब लगभग सारा बैजोएट आयन बैन्जोइक अम्ल में बदल जायेगा।
Y = [Ag+] = [C6H5COO–] + [C6H5COOH]
= [C6H5COO–] + 10[C6H5COO–]
= 11[C6H5COO–]
या [C6H5COO–] = \(\frac { y }{ 11 }\)
Ksp = [C6H5COO–] [Ag+]
2.5 × 10-13 = \(\frac { y }{ 11 }\) x y
y² = 11 x 2.5 x 10-13 = 2.75 × 10-12
y = (2.75 x 10-12)1/2 = 166 x 10-6 mol L-1
बफर तथा जल में सिल्वर बैन्जोएट की विलेयताओं का अनुपात
\(\frac { y }{ x }\) = \(\frac{\left(1.66 \times 10^6\right)}{5.0 \times 10^7}\) = 3.32
![]()
प्रश्न 71.
फेरस सल्फेट तथा सोडियम सल्फाइड के सममोलर विलयनों की अधिकतम सान्द्रता बताइए जब उनके समान आयतन मिलाने पर आयरन सल्फाइड अवक्षेपित न हो।
(आयरन सल्फाइड के लिये Ksp = 6.3× 10-18)
हल:
माना FeSO4 तथा Na2S दोनों विलयनों की सान्द्रताएँ मिलाने से पहले x mol L-1 या xM है विलयनों के समान आयतन मिलाने पर विलयन तथा आयनों की सान्द्रता घटकर आधी अर्थात् \(\frac { x }{ 2 }\) रह जाती है।
FeS का विलेयता गुणनफल Ksp = 6.3 × 10-18
FeS(s) ⇌ Fe2+ (aq) + S2- (aq)
\(\frac { x }{ 2 }\) \(\frac { x }{ 2 }\)
\(\frac { x }{ 2 }\) x \(\frac { x }{ 2 }\) = 6.3 x 10-18
x² = 4 × 6.3 × 10-18
= 25.2 x 10-18 M
x = (25.2 × 10-18)1/2
= 5.02 x 10-9 M
दोनों विलयनों की अधिकतम सान्द्रताएँ 5-02 x 10-9 M हैं
प्रश्न 72.
1g कैल्सियम सल्फेट को घोलने के लिए कम से कम कितने आयतन जल की आवश्यकता होगी?
(CaSO4 के लिए Ksp 9.1 x 10-6)
हल:
CaSO4 (s) ⇌ Ca2+(aq) + SO42-(aq)
यदि CaSO4 की विलेयता S है, तो
S = \(\sqrt{\mathrm{K}_{s p}}\)
= \(\sqrt{9.1 \times 10^{-6}}\)
= 3.02 x 10-3 mol L-1
CaSO4 का मोलर द्रव्यमान = 40 + 32 + 64
= 136 g mol-1
CaSO4 का द्रव्यमान
= (3.02 x 10-3) × 136
= 0.411 g L-1
0.411 g CaSO4 को घोलने के लिये आवश्यक जल
= 1 L
1 g CaSO4 को घोलने के लिये आवश्यक जल का आयतन
= \(\frac { 1×1 }{ 0.411 }\)
= 2.43 L
प्रश्न 73.
0.1 M HCl में हाइड्रोजन सल्फाइड से संतृप्त विलयन की सान्द्रता 1.0 x 10-19 M है। यदि इस विलयन का 10 mL निम्नलिखित 0.04 M विलयन के 5mL में डाला जाये तो किन विलयनों से अवक्षेप प्राप्त होगा?
FeSO4, MnCl2, ZnCl2 एवं CdCl2
हल:
प्रश्नानुसार
सल्फाइड (S2-) आयनों की सान्द्रता
= 1.0 × 10-19M
M = 1.0 × 10-19M
M2 = ?
V1 = 10mL
V2 = 15ml
M1 V1 = M2V2
1.0 × 10-19 × 10 = M2 × 15
M2 = \(\frac{1.0 \times 10^{-19} \times 10}{15}\)
= 0.67 × 10-19
= 6.7 × 10-20
धातु आयनों [M2-] की सान्द्रता
= 5 × 0.04 × 103- mol L-1
= 2 × 10-4 mol L-1
M1V1 = M2V2
M1 = 2 × 10-4 M
M2 = ?
V1 = 5 mL
V1 = 15 ml
M1V1 = M2V2
2 × 10-4 × 5 = M2 × 15
M2 = \(\frac { 5 }{ 15 }\) x 2 x 104-
= 6.7 x 10-5 mol L-1
आयनिक गुणनफल
= [M2+] [S2-]
= 6.7 × 10-5 × 6.7 x 10-20
= 44.89 × 10-25
= 4.5 × 10-24
चूँकि Zn S का Ksp 2.0 x 10-23 है जो आयनिक गुणनफल से अधिक है, अत: यह अवक्षेपित नहीं होगा। FeS का Ksp 6.3 x 10-18 है, MnS का Ksp 2.5 × 10-3 तथा Cds का Ksp 8.0 x 10-27 है। चूंकि Cds का Ksp आयनिक गुणनफल से कम है इसलिये CdCl2 में अवक्षेपण हो जायेगा।