Haryana State Board HBSE 10th Class Science Important Questions Chapter 5 तत्वों का आवर्त वर्गीकरण Important Questions and Answers.
Haryana Board 10th Class Science Important Questions Chapter 5 तत्वों का आवर्त वर्गीकरण
अतिलघु उत्तरीय प्रश्न (Very Short Answer Type Questions)
प्रश्न 1.
तत्वों का वर्गीकरण किस आधार पर किया गया है?
उत्तर-
तत्वों के गुणों के आधार पर।
प्रश्न 2.
डॉबेराइनर ने तत्वों का वर्गीकरण कब किया था?
उत्तर-
सन् 1817 में।
प्रश्न 3.
डॉबेराइनर के त्रिक की क्या विशेषता है?
उत्तर-
इसकी विशेषता यह है कि त्रिक के मध्य तत्व का परमाणु भार अन्य दो तत्वों के परमाणु भार का लगभग माध्य है।
प्रश्न 4.
अष्टक नियम की परिभाषा क्या है? (RBSE 2016)
उत्तर-
जब तत्वों को उनके बढ़ते परमाणु भार के आधार पर व्यवस्थित किया जाता है तो प्रत्येक आठवें तत्व के गुण पहले तत्व के गुणों के समान होते हैं।
प्रश्न 5.
न्यूलैंड्स कितने द्रव्यमान तक के तत्वों का वर्गीकरण कर पाया? .
उत्तर-
परमाणु द्रव्यमान 40 तक।
![]()
प्रश्न 6.
मेन्डेलीफ का आवर्त नियम लिखिए।
उत्तर-
तत्वों के भौतिक एवं रासायनिक गुण उनके परमाणु भार के आवर्ती फलन होते हैं।
प्रश्न 7.
लघु एवं दीर्घ आवर्त किसे कहते हैं? .
उत्तर-
पहले तीन आवर्तों को तत्वों की संख्या कम होने के कारण लघ आवर्त कहते हैं तथा तत्वों की अधिकता के कारण चौथे से सातवें तक के आवर्तों को दीर्घ आवर्त कहते हैं।
प्रश्न 8.
निष्क्रिय तत्व क्या हैं?
उत्तर-
निष्क्रिय तत्व वे होते हैं जो अन्य तत्वों से संयोजित होने के लिए सक्रिय नहीं होते। ऐसे तत्व के सबसे बाहरी कोश में 8 इलेक्ट्रॉन विद्यमान होते हैं।
प्रश्न 9.
समूहों के गुण लिखिए।
उत्तर-
- परमाणु का निश्चित संख्या अन्तराल,
- इलेक्ट्रॉनों की संरचना,
- संयोजकता,
- परमाणु भार,
- धात्वीय प्रकृति,
- रासायनिक गुण।
प्रश्न 10.
आवर्त सारणी का आधुनिक रूप क्या है?
उत्तर-
बोहर ने ज्ञात तत्वों को परमाणु क्रमांक के बढ़ते — क्रम में रखकर एक सारणी बनाई जिसे आवर्त सारणी का दीर्घ रूप या आधुनिक रूप कहते हैं।
प्रश्न 11.
दीर्घ आवर्त सारणी का आधार क्या है?
उत्तर-
परमाणु संख्या और इलेक्ट्रॉन का वितरण।
![]()
प्रश्न 12.
निष्क्रिय तत्व आवर्त सारणी के किस समूह में हैं?
उत्तर-
सभी निष्क्रिय तत्व आवर्त सारणी के शून्य समूह में हैं।
प्रश्न 13.
दीर्घ आवर्त सारणी में क्या दोष हैं?
उत्तर-
इसमें हाइड्रोजन की स्थिति निश्चित नहीं है तथा यह परमाणुओं में इलेक्ट्रॉनों का वितरण नियमित नहीं दिखाती।
प्रश्न 14.
परमाणु का आकार कम कब होता है?
उत्तर-
जब नाभिक में बढ़ा धन आवेश इलेक्ट्रॉनों को नाभिक की ओर आकृष्ट करता है तब परमाणु के आकार में कमी आती है।
प्रश्न 15.
वैद्युत ऋणात्मकता से क्या तात्पर्य है?
उत्तर-
किसी परमाणु के द्वारा इलेक्ट्रॉन को आकर्षित करने की प्रवृत्ति उसकी वैद्युत ऋणात्मकता कहलाती है।
प्रश्न 16.
Ei, Be, B, Na को बढ़ती आयनन ऊर्जा के क्रम में व्यवस्थित करें।
उत्तर-
Na <Li<B
प्रश्न 17.
(i) समस्थानिक किसे कहते हैं?
(ii) आधुनिक आवर्त नियम लिखिए।
(iii) दो उत्कृष्ट गैसों के नाम लिखिए। (RBSE 2017)
उत्तर-
(i) वो तत्व जिनमें प्रोटॉन की संख्या समान परन्तु न्यूट्रॉनों की संख्या भिन्न होती है, समस्थानिक कहलाते हैं।
(ii) तत्वों के गुणधर्म उनकी परमाणु संख्या का आवर्त फलन होते हैं।
(iii) आर्गन व क्रिप्टॉन।
प्रश्न 18.
Lit, Nat, K+ में किसकी आयनिक त्रिज्या सबसे कम है?.
उत्तर-
Lit.
प्रश्न 19.
वैद्युत ऋणात्मकता किस अवस्था में सारणी में घटती है?
उत्तर-
समूह में ऊपर से नीचे जाने पर।
प्रश्न 20.
आयनन ऊर्जा से क्या तात्पर्य है?
उत्तर-
किसी तत्व के उदासीन गैसीय परमाणु की तटस्थ अवस्था से उसकी बाह्यतम कक्षा से इलेक्ट्रॉन अलग करने के लिए आवश्यक ऊर्जा को उस तत्व की आयनन ऊर्जा कहते हैं।
![]()
प्रश्न 21.
आधुनिक आवर्त सारणी में आवर्त एवं समूहों की संख्या लिखिए। [राज. 2015]
उत्तर-
आवर्त – सात ।
समूह – अठारह
प्रश्न 22.
मेन्ड्रेलीफ की आवर्त सारणी में समूहों तथा आवतों की संख्या लिखिए।
उत्तर-
मेन्डेलीफ की आवर्त सारणी में नौ समूह तथा सात आवर्त हैं।
प्रश्न 23.
उन तत्वों को बताइए जिनकी खोज मेन्डेलीफ की आवर्त सारणी बनने के बाद हुई।
उत्तर-
स्कैण्डियम (Sc), गैलियम (Ga) तथा जर्मेनियम (Ge) आदि ऐसे उदाहरण हैं जिन्हें आवर्त सारणी बनने के बाद खोजा गया था।
प्रश्न 24.
उपधातु.क्या होती है?
उत्तर-
वे तत्व जो धातुओं तथा अधातुओं दोनों के अभिलाक्षणिक गुण प्रदर्शित करते हैं, उपधातु कहलाते हैं।
प्रश्न 25.
किसी आवर्त में बाईं से दाईं ओर चलने पर परमाणु आकार किस प्रकार बदलता है?
उत्तर-
किसी आवर्त में बाईं ओर से दाईं ओर चलने पर परमाणु आकार घटता जाता है परन्तु आवर्त के अन्तिम तत्व का परमाणु आकार अपने से पहले तत्व से अधिक होता है।
प्रश्न 26.
शून्य समूह के तत्वों के नाम लिखिए।
उत्तर-
उक्ता हीलियम (He), नीऑन (Ne), आर्गन (Ar), क्रिप्टॉन (Kr), जीनॉन (Xe), रेडॉन (Rn)।
प्रश्न 27.
न्यूलैंड्स अष्टक नियम के क्या दोष थे?
उत्तर-
यह नियम केवल Ca जिसका परमाणु द्रव्यमान 40 है तक ही सीमित रहा। इसके बाद के भारी तत्व इस नियम से वर्गीकृत नहीं किये जा सके।
प्रश्न 28.
किसी आवर्त और समूह में तत्वों के धात्विक गुण किस प्रकार बदलते हैं?
उत्तर-
आवर्त में बाएं से दाएँ जाने पर धात्विक गुण घटता है तथा वर्ग में ऊपर से नीचे जाने पर धात्विक गुण बढ़ता है।
प्रश्न 29.
किसी समूह में सबसे नीचे पाये जाने वाले तत्व में कौन-सा गुण अधिक होता है?
उतर-
धात्विकता का गुण।
प्रश्न 30.
संशोधित आवर्त सारणी में किन-किन आवों में उपसमूह नहीं हैं?
उतर-
तेर संशोधित आवर्त सारणी के प्रथम, द्वितीय, तृतीय तथा सप्तम आवर्तों में उपसमूह नहीं होते हैं।
![]()
प्रश्न 31.
निम्नलिखित के नाम बताइए-
(i) आवर्त सारणी के तीसरे वर्ग में स्थित कोई धातु,
(ii) हैलोजेन परिवार में स्थित कोई दो अधातु,
(ii) सर्वाधिक सक्रिय हैलोजेन।
उत्तर-
(i) ऐलुमिनियम,
(ii) क्लोरीन तथा ब्रोमीन,
(iii) फ्लु ओरीन।
प्रश्न 32.
आवर्त सारणी में किसी आवर्त में बायें से दायें जाने पर निम्नलिखित में क्या परिवर्तन होता है?
(1) परमाणु आकार,
(ii) धात्विक गुण,
(iii) संयोजकता इलेक्ट्रॉनों की संख्या। [राज. 2015]
उत्तर-
(i) परमाणु आकार – घटता है।
(ii) धात्विक गुण – घटता है।
(iii) संयोजकता इलेक्ट्रॉनों की संख्या – बढ़ती है।
प्रश्न 33.
आवर्त सारणी के दीर्घ रूप में कौन-कौन से तत्वों को रखा गया है?
उत्तर-
आवर्त सारणी के तल में परमाणु संख्या 58 से 71 तक लैन्थेनॉइड तथा 90 से 103 तक ऐक्टिनॉइड के तत्वों को दो श्रेणियों में रखा गया है।
प्रश्न 34.
तीन तत्वों A,B,C में से A और C के परमाणु भार 35.5 तथा 127 हैं। डॉबेराइनर के त्रिक के आधार पर B का परमाणु भार ज्ञात करो।
उत्तर-
![]()
प्रश्न 35.
निम्नलिखित को बढ़ती आयमिक त्रिज्या के क्रम में व्यवस्थित कीजिए-. ..’,
Al3+,Mg2+,Na+,O2-,F–
उत्तर-
Al3+ < Mg2+<Na+,F– <O2-
लघु उत्तरीय प्रश्न (Short Answer Type Questions)
प्रश्न 1.
तत्वों के आवर्त वर्गीकरण के लिए परमाणु द्रव्यमान संख्या की अपेक्षा परमाणु सँख्यो को अच्छा आधार क्यों माना गया है?
उत्तर-
किसी तत्व का परमाणु द्रव्यमान नाभिक के कारण है। नाभिक तत्व के केन्द्र में स्थित है तथा इसमें प्रोटॉन व न्यूट्रॉन स्थित होते हैं। वास्तव में तत्वों के गुण इलेक्ट्रॉनिक वितरण से सम्बन्धित हैं, जैसे-जैसे परमाणु संख्या बदलती है वैसे-वैसे इलेक्ट्रॉनिक वितरण भी परिवर्तित होता जाता है। इस कारण से परमाणु संख्या तत्वों के वर्गीकरण का अच्छा आधार है।
प्रश्न 2.
आवर्तिता से क्या तात्पर्य है? क्या किसी एक समूह के तत्वों के गुणधर्म समान होते हैं? इस कथन की उदाहरण सहित व्याख्या कीजिए।
उत्तर-
आवर्तिता -किसी निश्चित समय के बाद तत्वों के गुणों की पुनरावृत्ति, आवर्तिता कहलाती है। आवर्त सारणी में तत्वों के गुणों में प्रदर्शित समता-विषमता का अध्ययनं करना आवर्ती गुण के नाम से जाना जाता है। गुण इलेक्ट्रॉन पर निर्भर करते हैं जो नाभिक के चारों ओर लगातार गति करते हैं। बाह्यतम कक्ष में समान इलेक्ट्रॉन संख्या वाले तत्व समान गुण प्रकट करते हैं। किसी भी वर्ग के सभी तत्वों के गुण समान होते हैं, जैसे-लीथियम और सोडियम के सबसे बाहरी कक्ष में एक-एक इलेक्ट्रॉन है, इसलिए इनके गुण समान हैं।
प्रश्न 3.
संक्रमण तत्व किन्हें कहते हैं? इनकी विभिन्न. श्रेणियाँ बताइए।
उत्तर-
आधुनिक आवर्त सारणी के s ब्लॉक तथा p-ब्लॉक के मध्य के तत्वों को संक्रमण तत्व कहते हैं। इन तत्वों में परमाणु क्रमांक वृद्धि के साथ-साथ इलेक्ट्रॉन भरे जाने का क्रम, बाह्यतम कक्ष से पहली कक्ष के d-उपक्ष से सम्बन्धित होता है। इसलिए इन्हें d- ब्लॉक तत्व कहते हैं। इसमें III-B, IV-B (4), V-B (5),VI-B (6), VII-B (7), VIII (8, 9, 10) तथा II-B आदि दस ऊर्ध्वाधर श्रेणियाँ हैं।
प्रश्न 4.
मेन्डेलीफका आवर्त नियम क्या है? मेन्डेलीफ आवर्त सारणी की दो विशेषताएँ लिखिए। .
उत्तर-
मेन्डेलीफ का आवर्त नियम-इस नियम के अनुसार, “तत्वों के भौतिक तथा रासायनिक गुण उनके परमाणु भारों के आवर्ती फलन होते हैं।”
मेन्डेलीफ आवर्त सारणी की दो विशेषताएँ-
- प्रत्येक आवर्त में तत्व अपने बढ़ते परमाणु भारों के क्रम में व्यवस्थित हैं।
- एक ही समूह के सभी तत्वों के गुणधर्म समान होते हैं।
![]()
प्रश्न 5.
निम्नलिखित को परिभाषित कीजिए
(i) लैन्थेनॉइड्स
(ii) ऐक्टिनॉइड्स।
उत्तर-
(i) लैन्थेनॉइड्स-परमाणु क्रमांक 58 से 71 वाले तत्वों (Ce से Lu) के गुण समान होते हैं। परमाणु क्रमांक 57 वाले तत्व लैन्थेनम (La) के बाद आते हैं, अतः इन्हें लैन्थेनॉइड्स कहा जाता है।
(ii) ऐक्टिनॉइड्स-परमाणु क्रमांक 90 से 103 वाले तत्वों (Th से Lr) के गुण समान होते हैं। ये परमाणु क्रमांक 89 वाले तत्व ऐक्टिनियम (Ac) के बाद आते हैं, अतः इन्हें ऐक्टिनॉइड्स कहा जाता है।
प्रश्न 6.
नये तत्वों की खोज में मेन्डेलीफ की आवर्त सारणी की क्या उपयोगिता है?
उत्तर-
मेन्डेलीफ ने अपनी मूल आवर्त सारणी में नये तत्वों के लिये कई खाली स्थान छोड़ दिये थे तथा इन तत्वों के गुणों के बारे में जानकारी भी दी थी। इस सारणी के ज्ञान से ही नये तत्वों को खोजने में काफी सहायता मिली। इन तत्वों की खोज के बाद पाये गये इन तत्वों के गुण मेन्डेलीफ के द्वारा बताये गये गुणों के समान ही थे। उदाहरण- स्कैण्डियम (Sc), गैलियम (Ga), जर्मेनियम (Ge), आदि की खोज काफी समय बाद हुई थी।
प्रश्न 7.
मेन्डेलीफ की आवर्त सारणी के सामान्य लक्षण लिखिए।
उत्तर-
मेन्डेलीफ की आवर्त सारणी के सामान्य लक्षण निम्नलिखित हैं-
- प्रत्येक आवर्त में तत्व अपने परमाणु भारों के बढ़ते हुए क्रम में व्यवस्थित हैं।
- एक ही समूह के सभी तत्वों के गुणधर्म समान होते
- प्रत्येक आवर्त में बाएँ से दाएँ जाने पर तत्वों की ऋण विद्युत संयोजकता कम होती है जबकि धन विद्युत संयोजकता बढ़ती जाती है।
- तत्वों का परमाणु भार उसका मौलिक गुण होता है।
- आवर्त सारणी में रिक्त स्थानों के तत्वों के गुणधर्मों को पहले ही बताया जा सकता है।
प्रश्न 8.
आवर्त सारणी के चतुर्थ समूह में आयनिक त्रिज्या का क्रम स्पष्ट कीजिए तथा आयनन विभव पर इसके प्रभाव का उदाहरण सहित वर्णन कीजिए।
उत्तर-
आवर्त सारणी के चतुर्थ समूह में परमाणु क्रमांक बढ़ने के साथ समान आवेश धनायनों की आयनिक त्रिज्याओं में वृद्धि होती हैं क्योंकि तत्वों के बाह्य कोश की मुख्य क्वाण्टम संख्या में वृद्धि होती है, जैसे –
| आयन | C4+ | Si4+ | Sn4+ |
| आयनिक त्रिज्या (Å में) | 0.16 | 0.40 | 0.69 |
आयनन विभव का मान जितना कम होता हैं परमाणु त्रिज्या उतनी ही बड़ी होती है अर्थात् आयनन विभव के घटने पर आयनिक त्रिज्या बढ़ती है।
प्रश्न 9.
आवर्त सारणी के एक ही आवर्त में परमाणु आकार किस प्रकार परिवर्तित होता है?
उत्तर-
आवर्त सारणी में किसी आवर्त में बाईं ओर से दाईं ओर चलने पर तत्वों के परमाणु क्रमांक में वृद्धि के साथ-साथ तत्वों के परमाणुओं के आकार घटते हैं।
| Li | Be | B | C | N | O | F |
| 1.23 | 0.89 | 0.80 | 0.77 | 0.75 | 0.73 | 0.72 (Å में) |
प्रश्न 10.
लघु आवर्त तथा दीर्घ आवर्त से क्या तात्पर्य है? आवर्त सारणी में कितने लघु आवर्त तथा कितने दीर्घ आवर्त होते हैं।
उत्तर-
लघ आवर्त जिन आवों में तत्वों की संख्या 8 होती है। उन्हें लघु आवर्त कहते हैं। दीर्घ आवर्त जिन आवर्तों में तत्वों की संख्या 8 से अधिक होती है, उन्हें दीर्घ आवर्त कहते हैं। आवर्त सारणी में प्रथम तीन आवर्त (प्रथम, द्वितीय व तृतीय) लघु आवर्त कहलाते हैं। इनमें प्रथम आवर्त में दो तत्व हैं, जबकि द्वितीय व तृतीय आवर्त में आठ-आठ तत्व हैं। आवर्त सारणी में बाद के चार आवर्त (चतुर्थ, पंचम, षष्ठम तथा सप्तम) दीर्घ आवर्त कहलाते हैं। इनमें चतुर्थ व पंचम आवों में 18-18 तत्व हैं, जबकि षष्ठम आवर्त में 32 तत्व हैं और सप्तम आवर्त अपूर्ण है।
प्रश्न 11.
बेरियम (परमाणु क्रमांक 56) की आवर्त सारणी में स्थिति की विवेचना कीजिए तथा निम्नलिखित के उत्तर दीजिए
(i) यह धातु है या अधातु।
(ii) यह सीजियम से बड़ा है या छोटा।
(iii) इसकी संयोजकता क्या है?
(iv) बेरियम क्लोराइड का सूत्र लिखिए।
उत्तर-
Ba (परमाणु क्रमांक 56)= 2, 8, 18, 18, 8, 2। यह छठे आवर्त तथा II A समूह में स्थित है। (∵ कोशों की – संख्या 6 है तथा संयोजी इलेक्ट्रॉन की संख्या 2 है।)
- यह धातु है क्योंकि यह आवर्त सारणी में बाईं ओर – तथा समूह में नीचे की ओर स्थित है।
- यह सीजियम (Cs) से छोटा होता है क्योंकि आवर्त में बाईं से दाईं ओर चलने पर परमाणु आकार घटता है। Ba तथा Cs एक ही आवर्त में स्थित हैं तथा Ba, Cs के दाईं ओर स्थित है।
- इसमें 2 संयोजी इलेक्ट्रॉन हैं। यह दो इलेक्ट्रॉनों को त्यागकर द्विसंयोजक धनायन बना सकता है।
- बेरियम क्लोराइड का सूत्र BaCl2 है।
प्रश्न 12.
आवर्त सारणी के द्वितीय आवर्त में निम्नलिखित गुणों में किस प्रकार परिवर्तन होता है? समझाइए-(i) धात्विक गुण, (ii) हाइड्रोजन से सम्बन्धित संयोजकता।
उत्तर-
(i) धात्विक गुण-एक आवर्त में बाएँ से दाएँ जाने पर परमाणु का आकार कम होता है जबकि आयनन विभव में वृद्धि होती है अतः धनविद्युती गुण या धात्विक गुणों में कमी आती है, जैसे-द्वितीय आवर्त में Li एवं Be कार्बन से अधिक धनविद्युती हैं तथा कार्बन फ्लुओरीन की तुलना में अधिक धनविद्युती है। सामान्यतः आवर्त सारणी के निचले भाग के तत्व अधिक धात्विक तथा ऊपरी दाएँ भाग के तत्व अधिक अधात्विक होते हैं।
(ii) हाइड्रोजन से सम्बन्धित संयोजकता-हाइड्रोजन के अनुसार संयोजकता प्रथम वर्ग 1 से 4 तक बढ़ती है तथा उसके उपरान्त 4 से 1 तक घटती है।
![]()
प्रश्न 13.
निम्नलिखित गुण एक आवर्त तथा वर्ग में किस प्रकार परिवर्तित होते हैं
(i) धात्वीयता,
(ii) परमाणु आकार या परमाणु त्रिज्या,
(iii) विद्युत ऋणात्मकता,
(iv) इलेक्ट्रॉन बन्धुता।
उत्तर-
(i) धात्वीयता-किसी आवर्त में आगे की ओर जाने पर धात्विक लक्षण क्रमशः घटता जाता है और अधात्विक लक्षण क्रमशः बढ़ता है। किसी वर्ग में नीचे की ओर जाने पर धात्विक गुण बढ़ता है तथा अधात्विक गुण घटता है।
(ii) परमाणु आकार-आवर्त में आगे की ओर जाने से परमाणु आकार (परमाणु त्रिज्या) घटता है (शून्य वर्ग को छोड़कर) तथा वर्ग में नीचे की ओर जाने से परमाणु आकार बढ़ता है।
(iii) विद्युत ऋणात्मकता-आवर्त में बाईं से दाईं ओर जाने पर विद्युत ऋणात्मकता बढ़ती है। शून्य वर्ग को छोड़कर तथा वर्ग में नीचे की ओर जाने पर इसका मान घटता है।
(iv) इलेक्ट्रॉन बन्धुता-आवर्त में आगे की ओर जाने से इलेक्ट्रॉन बन्धुता बढ़ती है तथा वर्ग में नीचे की ओर जाने पर यह घटती है।
प्रश्न 14.
किसी आवर्त के तत्वों की ऋणविद्युती प्रकृति तथा हाइड्रोजन के प्रति संयोजकता में किस प्रकार परिवर्तन होता है?
उत्तर-
ऋणविद्युती प्रकृति में परिवर्तन-किसी आवर्त में बाएँ से दाएँ चलने पर तत्वों की ऋणविद्युती प्रकृति या विद्युत-ऋणात्मकता परमाणु क्रमांक बढ़ने के साथ-साथ क्रमशः बढ़ती है।
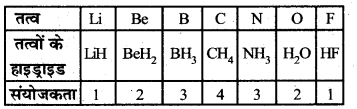
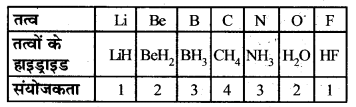
| तत्व | Li | Be | B | C | N | O | F |
| विद्युत् ऋणात्मकता | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
संयोजकता में परिवर्तन-किसी आवर्त में बाएँ से दाएँ चलने पर हाइड्रोजन के सापेक्ष तत्वों की संयोजकताएँ क्रमशः 1 से 4 तक बढ़ती हैं। पुनः 4 से 1 तक क्रमशः घटती हैं।
प्रश्न 15.
निम्नलिखित गुण एक आवर्त तथा वर्ग में किस प्रकार परिवर्तित होते हैं
(a) परमाणु आकार
(b) विद्युत ऋणात्मकता।
उत्तर-
(a) परमाणु आकार-आवर्त में आगे की ओर जाने से परमाणु आकार (परमाणु त्रिज्या) घटता है (शून्य वर्ग को छोड़कर) तथा वर्ग में नीचे की ओर जाने से परमाणु आकार बढ़ता है।
(b) विद्युत ऋणात्मकता-आवर्त में बाईं से दाईं ओर जाने पर विद्युत ऋणात्मकता बढ़ती है।(शून्य वर्ग को छोड़कर) तथा वर्ग में नीचे की ओर जाने पर इसका मान घटता है।
प्रश्न 16.
यह कैसे सत्यापित किया जा सकता है कि आधुनिक आवर्त सारणी विभिन्न तत्वों के परमाणुओं के इलेक्ट्रॉनिक विन्यास पर आधारित है?
अथवा
किसी तत्व का इलेक्ट्रॉनिक विन्यास 2, 8,4 है :
(a) आधुनिक आवर्त सारणी में इस तत्व की समूह संख्या और आवर्त संख्या लिखिए।
(b) इस तत्व का नाम और इसका एक भौतिक गुणधर्म लिखिए। (CBSE 2019)
उत्तर-
आधुनिक आवर्त सारणी में तत्वों को उनके बढ़ते हुए परमाणु क्रमांक के आधार पर रखा है जिसमें विभिन्न तत्वों के परमाणु जिनके बाहरी कोष की संख्या समान है, उन्हें एक ही आवर्त में रखा गया है तथा जिनके अंतिम कोष में इलेक्ट्रॉन संख्या समान है, उन्हें एक ही समूह में रखा गया हैं अतः आधुनिक आवर्त सारणी विभिन्न तत्वों के परमाणु के इलेक्ट्रॉनिक विन्यास पर आधारित है।
अथवा
(a) आधुनिक आवर्त सारणी में इस तत्व को समूह (ग्रुप) 14 तथा 3 आवर्त में रखा गया है।
(b) यह तत्व सिलिकॉन है। यह एक उपधातु है।
प्रश्न 17.
तत्वों के समूह की संयोजकता के आधार पर, प्रत्येक के लिए कारण सहित पुष्टि करते हुए, नीचे दिए गए यौगिकों के आण्विक-सूत्र लिखिए।
(i) समूह (ग्रुप) 1 के तत्वों का ऑक्साइड
(ii) समूह 13 के तत्वों का हैलाइड
(iii) समूह 2 के तत्व A और समूह 17 के तत्व B के संयोजन से बने यौगिक।
उत्तर-
(i) समूह 1 के तत्वों के अंतिम कोष में एक इलेक्ट्रॉन है। अत: इनकी संयोजकता एक है। इसलिए M2O ऑक्साइड बनायेंगे।
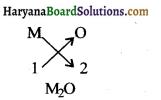
(ii) समूह 13 के तत्वों की संयोजकता 3 है क्योंकि अंतिम कोष में 3 इलेक्ट्रॉन है। अतः ये M2O3, प्रकार के हैलाइड बनायेंगे।
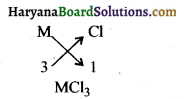
(iii) समूह 2 के तत्व A की संयोजकता 2 है तथा समूह 17 के तत्व B की संयोजकता 1 है। अतः इनके संयोग से बना तत्व AB2, होगा।
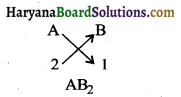
प्रश्न 18.
उस तत्व X का नाम, प्रतीक और इलेक्ट्रॉनिक विन्यास लिखिए जिसकी परमाणु संख्या 11 है।
अथवा
क्या नीचे दिए गए तत्वों के समूह डॉबेराइनर के प्रिक के रूप में वर्गीकृत किए जा सकते हैं?
(a) Na, Si, CI
(b) Be, Mg, Ca : इन तत्वों के परमाणु द्रव्यमान इस प्रकार हैं –
Be-9,Na-23, Mg-24, Si-28, CI-35, Ca-40 प्रत्येक प्रकरण में अपने उत्तर की पुष्टि कीजिए। (CBSE 2019)
उत्तर-
यह सोडियम तत्व है जिसका प्रतीक Na है तथा इलेक्ट्रॉनिक विन्यास 2, 8, 1 है।।
अथवा
(a) नहीं, क्योंकि इन तत्वों के गुण अलग-अलग हैं। हालांकि S1, का परमाणु द्रव्यमान Be और Ca के औसत द्रव्यमान के बराबर है।
(b) हाँ, क्योंकि इनके गुण समान है तथा Mg (मैग्नीशियम) का द्रव्यमान Be तथा Ca का औसत द्रव्यमान है।
प्रश्न 19.
आधुनिक आवर्त सारणी में आवर्तों और समूहों की संख्या लिखिए।
(i) किसी आवर्त में बायीं ओर से दायीं ओर जाने पर, तथा
(ii) किसी समूह में ऊपर से नीचे जाने पर तत्वों के धात्विक अभिलक्षणों में किस प्रकार परिवर्तन होता है? अपने उत्तर की कारण सहित पुष्टि कीजिए। (CBSE 2017)
उत्तर-
आधुनिक आवर्त सारणी में 7 आवर्त और 18 समूह होते हैं।
(i) आवर्त में बाईं से दाईं ओर जाने पर संयोजकता कोश के इलेक्ट्रॉनों पर कार्य करने वाला प्रभावी नाभिकीय आवेश बढ़ता जाता है जिससे तत्वों की इलेक्ट्रॉन त्यागने की प्रवृत्ति घटती जाती है।
| Mg | Al | Si | P | S | Cl |
| 2,8,2 | 2,8,3 | 2,8,4 | 2,8,5 | 2, 8,6 | 2,8,7 |
(ii) समूह में ऊपर से नीचे की ओर जाने पर संयोजी इलेक्ट्रॉनों पर कार्य करने वाला प्रभावी नाभिकीय आवेश घटता जाता है, क्योंकि सबसे बाहरी इलेक्ट्रॉन नाभिक से दूर होते हैं। इसलिए यह इलेक्ट्रॉन सुगमतापूर्वक निकल जाते हैं। अतः धात्विक अभिलक्षण आवर्त में बायीं से दायीं ओर घटता जाता है और समूह में ऊपर से नीचे जाने पर बढ़ता जाता है।
Li(2,1)
Na (2,8, 1)
प्रश्न 20.
Na, Mg और AI आधुनिक आवर्त सारणी के तीसरे आवर्त के तत्व हैं जिनकी समूह संख्या क्रमशः 1, 2 और 13 है। इनमें से किस तत्व की
(a) संयोजकता अधिकतम,
(b) परमाणु त्रिज्या अधिकतम, तथा
(c) रासायनिक अभिक्रियाशीलता अधिकतम है? प्रत्येक के लिए अपने उत्तर की कारण सहित पुष्टि कीजिए। (CBSE 2017)
उत्तर-
Na-2,8,1
Mg – 2, 8,2
Al-2, 8,3
(a) अधिकतम संयोजकता Al की होगी, क्योंकि इसके बाहरी कोश में 3 इलेक्ट्रॉन होते हैं। अत: यह तीन इलेक्ट्रॉन त्याग सकता है।
(b) Na की परमाणु त्रिज्या अधिकतम होगी, क्योंकि आवर्त में बायीं से दायीं ओर जाने पर परमाणु त्रिज्या घटती हैं क्योंकि संयोजी इलेक्ट्रॉनों का नाभिकीय आवेश बढ़ जाता है, जिससे तत्वों का आकार घटता जाता है।
(c) रासायनिक अभिक्रियाशीलता Na की अधिकतम होती है, क्योंकि इसके बाहरी कोश में एक इलेक्ट्रॉन होता है
और वह इसका आसानी से त्याग कर सकता है। आवर्त में बायें से दाईं ओर जाने पर तत्वों की क्रियाशीलता में वृद्धि होती है।
![]()
प्रश्न 21.
दीर्घाकार आवर्त सारणी की प्रमुख विशेषताएँ लिखिए।
उत्तर-
दीर्घाकार आवर्त सारणी की प्रमुख विशेषताएँ निम्नलिखित हैं
- इस आवर्त सारणी में 7 आवर्त तथा 18 वर्ग हैं।
- इसमें धातु तथा अधातु तत्वों को अलग-अलग स्थान पर रखा गया है।
- अक्रिय गैस तत्वों को आंवर्त सारणी के दाईं ओर शून्य वर्ग में रखा गया है।
- A तथा B उपवर्गों को अलग-अलग कर दिया गया है।
- लैन्थेनॉइड तथा ऐक्टिनॉइड तत्वों को आवर्त सारणी के बाहर स्थान दिया गया है।
प्रश्न 22.
आवर्त सारणी के द्वितीय आवर्त में तत्वों के निम्नलिखित गुणों में किस प्रकार परिवर्तन होता है
(i) धात्विक गुण
(ii) आयनन विभव।
उत्तर-
(i) धात्विक गुण-एक आवर्त में बाएँ से दाएँ जाने पर परमाणु का आकार कम होता है जबकि आयनन विभव में वृद्धि होती है। अतः धनविद्युती या धात्विक गुणों में कमी आती है, जैसे-द्वितीय आवर्त में Li तथा Be कार्बन से अधिक धनविद्युती हैं तथा कार्बन फ्लुओरीन की तुलना में अधिक धनविद्युती है।
(ii) आयनन विभव-द्वितीय आवर्त के तत्वों का आयनन विभव कम होता है, परन्तु वर्ग IA के तत्वों के आयनन विभव से अधिक होता है। द्वितीय आवर्त में बाएँ से दाएँ चलने पर आयनन विभव बढ़ता जाता है।
प्रश्न 23.
तत्व X का इलेक्ट्रॉनिक विन्यास है-
| K | L | M |
| 2 | 8 | 6. |
(i) आवर्त सारणी में तत्व X की वर्ग संख्या क्या है?
(ii) आवर्त सारणी में तत्व की आवर्त संख्या क्या है?
(iii) X के परमाणु में संयोजकता इलेक्ट्रॉनों की संख्या क्या है?
(iv) X की संयोजकता क्या है?
(v) क्या यह धातु है या अधातु?
उत्तर-
(i) तत्व X में 6 संयोजकता इलेक्ट्रॉन हैं इसलिए आवर्त सारणी में तत्व X की वर्ग संख्या 6 + 10 = 16 है।
(ii) तत्व X में उनके परमाणु में 3 इलेक्ट्रॉन कोश (K, L और M) हैं। इसलिए तत्व X की आवर्त संख्या 3 है अर्थात् यह आवर्त सारणी के तीसरे आवर्त का तत्व है।
(iii) तत्व X में 6 संयोजकता इलेक्ट्रॉन हैं।
(iv) तत्व X में 6 संयोजकता इलेक्ट्रॉन हैं इसलिए इसे अपना अष्टक पूरा करने तथा स्थायी होने के लिए 2 इलेक्ट्रॉनों की आवश्यकता है। अतः तत्व की संयोजकता 2 हैं।
(v) वर्ग 16 के तत्व अधातु हैं इसलिए X अधातु है।
प्रश्न 24.
दो तत्व A तथा B आधुनिक आवर्त सारणी के तीसरे आवर्त में क्रमशः समूह 2 और 13 में स्थित है। तालिका के रूप में, इन दोनों तत्वों की नीचे दी गई विशेषताओं की तुलना कीजिए। (CBSE 2016)
(a) इनके परमाणुओं में इलेक्ट्रॉनों की संख्या
(b) इनके परमाणुओं के आकार
(c) इलेक्ट्रॉनों को त्यागने की प्रवृत्ति
(d) इनके ऑक्साइडों के सूत्र
(e) इनके धात्विक लक्षण
(f) इनके क्लोराइडों के सूत्र
उत्तर-
(a) इनमें से A है Mg B = AI इलेक्ट्रॉनों की व्या A में 12 है। इलेक्ट्रॉनों की या B में 13 है।
(b) Mg के परमाणु का आकार AI के परमाणु से बड़ा होगा।
(c) Mg= 2, 8,2 यह दो इलेक्ट्रॉनों का त्याग करेगा।
(d) Al= 2, 8,3 यह 3 इलेक्ट्रॉनों का त्याग करता है।
Mg की इलेक्ट्रॉन त्यागने की प्रवृत्ति अधिक होती है। इनके ऑक्साइड सूत्र हैं –
Mgo – मैग्नीशियम ऑक्साइड
Al2O3 – ऐल्युमीनियम ऑक्साइड
(e) Mg का धात्विक लक्षण AI से ज्यादा होता है, क्योंकि यह 2 इलेक्ट्रॉनों का त्याग आसानी से करता है। .
(f) इनके क्लोराइडों के सूत्र MgCl2, AlCl2.
प्रश्न 25.
दो तत्त्व ‘P’ और ‘Q’ आधुनिक आवर्त सारणी के एक ही आवर्त के क्रमश: समूह-1 और समूह-2 के सदस्य हैं। इनके निम्नलिखित लक्षणों/गुणधर्मों की तालिका के रूप में तुलना कीजिए : [CBSE.2015]
(a) इनके परमाणुओं में इलेक्ट्रॉनों की संख्या
(b) इनके परमाणुओं का साइज़
(c) इनकी धात्विक प्रवृत्ति
(d) इनकी इलेक्ट्रॉन त्यागने की प्रवृत्ति
(e) इनके ऑक्साइडों के सूत्र ए
(f) इनके क्लोराइडों के सूत्र।
उत्तर-
(a)
| समूह-1 | समूह-2 |
| समूह-1 के तत्वों में सह संयोजी कोश में एक इलेक्ट्रॉन उपस्थित होता है। | समूह – 2 के तत्वों के सह संयोजी कोश में 2 इलेक्ट्रॉन उपस्थित होता है। |
(b) परमाणु का साइज-समूह एक के तत्वों के परमाणु गों का आकार समूह दो के तत्वों की तुलना में बड़ा होता है।
(c) धात्विक प्रकृति-दोनों समूह के तत्व धातु होते हैं। समूह एक के तत्वों का धात्विक गुण समूह 2 के तत्वों की तुलना में अधिक होता है। ..
(d) इलेक्ट्रॉन त्यागने की प्रकृति-समूह एक के तत्वों की इलैक्ट्रॉन त्यागने की प्रकृति समूह दो की तुलना में अधिक होती है।
(e) ऑक्साइडों के सूत्र-समूह-1- P2O
समूह-2-QO
(f) समूह-1 -PCl
समूह-2-QCl
प्रश्न 26.
मेन्डेलीफ की आवर्त सारणी का सिद्धान्त लिखिए। इसकी एक उपलब्धि व दो कमियाँ लिखें।
उत्तर-
मेन्डेलीफ़ की आवर्त सारणी का सिद्धान्ततत्वों के गुणधर्म उनके परमाणु द्रव्यमान के आवर्ती फलन होते हैं। उपलब्धि-मेन्डेलीफ के आवर्त नियम में उस समय तक न खोजे गये तत्वों, जैसे-गैलियम (Ga), स्कैण्डियम (Sc), और जर्मेनियम (Ge), के लिये आवर्त सारणी में रिक्त स्थान छोड़ दिये व उनके गुणों के बारे में भी बताया था, जो बाद में सही सिद्ध हुये।
कमियाँ-
- मेन्डेलीफ ने हाइड्रोजन की सही स्थिति के बारे में नहीं बताया।
- मेन्डेलीफ की आवर्त सारणी में अक्रिय गैसों की स्थिति स्पष्ट नहीं थी।
![]()
प्रश्न 27.
आवर्त सारणी के द्वितीय आवर्त में निम्नलिखित गुणों में क्या परिवर्तन होता है.
(i) धनविद्युती गुण
(ii) ऑक्साइडों की प्रकृति।
उत्तर-
(i) धनविद्युती गुण-द्वितीय आवर्त में बाएँ से दाएँ चलने पर क्षार धातु (Li) से हैलोजेन फ्लु ओरीन (F) तक तत्वों का धनविद्युती लक्षण या विद्युत्-धनात्मक गुण क्रमशः घटता है। .
(ii) ऑक्साइडों की प्रकृति-द्वितीय आवर्त में बाएँ से दाएँ चलने पर तत्वों के ऑक्साइडों का क्षारीय गुण क्रमशः घटता है।
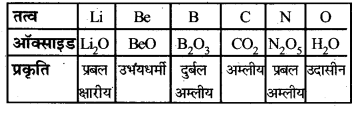
प्रश्न 28.
पहले समूह के किन्हीं दो तत्वों के नाम और उनके इलेक्ट्रॉन-विन्यास लिखिए। इन इलेक्ट्रॉन-विन्यासों में आपको क्या समानता दिखाई देती है? इन तत्वों में से किसी एक तत्व के ऑक्साइड का सूत्र लिखिए। (CBSE 2016)
उत्तर-
वह दो तत्व जो पहले समूह में आते हैं, वह हैं, Li और Na
Li लीथियम 2,1 Na
सोडियम 2,8,1
इन दोनों के संयोजी कोश में सिर्फ एक ही इलेक्ट्रॉन है। सोडियम के ऑक्साइड का सूत्र है

प्रश्न 29.
आधुनिक आवर्त सारणी में आठ तत्वों की स्थितियाँ नीचे दिए अनुसार हैं। यहाँ तत्वों की परमाणु संख्या कोष्ठक में दर्शायी गयी है। (CBSE 2016)
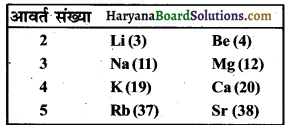
(i) Ca का इलेक्ट्रॉन विन्यास लिखें।
(ii) Rb में संयोजी इलेक्ट्रॉनों की संख्या का अनुमान लगाइए।
(iii) Sr में कोशों की संख्या क्या है?
(iv) अनुमान लगाइए कि K धातु है अथवा अधातु।
(v) इन तत्वों में किसका आकार सबसे बड़ा है?
(vi) Be,Ca,Mg और Rb को इनके परमाणु के साइज के बढ़ते क्रम में व्यवस्थित कीजिए।
उत्तर-
(i) Ca का इलेक्ट्रॉन विन्यास है. K L M N 28.8 2
(ii) Rb में संयोजी इलेक्ट्रॉन की संख्या = 1
(iii) Sr में कोशों की संख्या = 5
(iv) K धातु है, क्योंकि यह अपने बाहरी कोश में से एक इलेक्ट्रॉन का त्याग करता है।
(v) इन तत्वों में से Rb का आकार सबसे बड़ा है।
(vi) Be
प्रश्न 30.
कोई तत्व ‘X’ आधुनिक आवर्त सारणी के आवर्त 3 तथा समूह 13 में स्थित है।
(a) ‘X’ में संयोजकता इलेक्ट्रॉनों की संख्या तथा इसकी संयोजकता निर्धारित कीजिए।
(b) ‘x’ की तत्व ‘Y’ (परमाणु संख्या = 8) से अभिक्रिया द्वारा बने यौगिक का अणुसूत्र लिखिए।
(c) ‘X’ की क्लोरीन (CI) से अभिक्रिया द्वारा बने यौगिक का नाम और सूत्र लिखिए। (Cbse 2016)
उत्तर-
(a) X= 13, 2, 8,3
संयोजकता इलेक्ट्रॉन तथा संयोजकता = 3
(b)Y=8, 2, 6 संयोजकता = 2.
X2Y3
(c) XCl3
प्रश्न 31.
कोई तत्व P (परमाणु संख्या 20) किसी अन्य तत्व Q (परमाणु संख्या 17) से अभिक्रिया करके कोई यौगिक बनाता है। नीचे दिए गए प्रश्नों का कारण सहित उत्तर दीजिए : आधुनिक आवर्त सारणी में P और की स्थितियाँ, तथा P और Q की अभिक्रिया द्वारा बने यौगिक का अणु सूत्र लिखिए। (Cbse 2017)
उत्तर-
P परमाणु संख्या 20
P=2,8,8,2
P की स्थिति : समूह ऊर्ध्व स्तंभ-2
क्षैतिज पंक्ति -4
Q की स्थिति-परमाणु संख्या 17
Q=2,8,7
ऊर्ध्व स्तंभ-7
क्षैतिज पंक्ति-3

प्रश्न 32.
आधुनिक आवर्त सारणी के ऊर्ध्व स्तम्भों और क्षैतिज पंक्तियों के नाम लिखिए। किसी ऊर्ध्व स्तम्भ में ऊपर से नीचे जाने पर तत्वों के धात्विक अभिलक्षण में क्या परिवर्तन होता है? किसी क्षैतिज पंक्ति में बायीं ओर से दायीं ओर जाने पर परमाणु त्रिज्या के साइज में क्या परिवर्तन होता है? उपर्युक्त दोनों प्रकरणों के उत्तरों के पक्ष में कारण दीजिए। (Cbse 2017)
उत्तर-
आधुनिक आवर्त सारणी में 18 ऊर्ध्व स्तंभ हैं, जिन्हें समूह कहा जाता है तथा 7 क्षैतिज पंक्तियाँ हैं, जिन्हें आवर्त कहते हैं। किसी ऊर्ध्व स्तम्भ में ऊपर से नीचे जाने पर धात्विक अभिलक्षण में वृद्धि होती हैं क्योंकि तत्वों में कोशों की सख्या बढ़ती है जिससे नाभिक और संयोजी इलेक्ट्रॉन के बीच आकर्षण कम हो जाता है जिससे तत्व आसानी से इलेक्ट्रॉन त्याग कर देते हैं।
आवर्त में बायीं से दायीं ओर जाने पर परमाणु त्रिज्या घटती है क्योंकि आवर्त में बायीं ओर से दायीं ओर जाने पर कोशों की संख्या समान रहती है। जिससे प्रभावी नाभिकीय आवेश का मान बढ़ता जाता है। नाभिकीय आवेश बढ़ने से तत्व का नाभिक इलेक्ट्रॉन को अपनी ओर अधिक आकर्षण बल से खींचता है। अतः तत्वों का आकार घटता जाता है।
प्रश्न 33.
आधुनिक आवर्त सारणी के संदर्भ में तत्वों के गुणधर्म में आवर्तिता क्या है? समान समूह के सभी तत्वों के गुणधर्म समान क्यों होते हैं? किसी आवर्त में बायीं ओर से दायीं ओर जाने पर तत्वों की इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति में क्या परिवर्तन होता है? इस परिवर्तन का कारण लिखिए। (Cbse 2017)
उत्तर-
आधुनिक आवर्त नियम के अनुसार, तत्वों को उनके परमाणु क्रमांक के बढ़ते हुए क्रम में क्षैतिज पंक्तियों में व्यवस्थित करने पर नियमित अन्तर में गुणों की पुनरावृत्ति होती है, इसे गुणों में आवर्तिता कहते हैं। समान समूह के सभी तत्वों के गुणधर्म समान होते हैं, क्योंकि इनके बाहरी कोश में समान इलेक्ट्रॉन होते हैं।
किसी आवर्त में बार्थी ओर से दायीं ओर जाने पर तत्वों के इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति बढ़ती जाती है। क्योंकि आवर्त में बायीं से दायीं ओर जाने पर संयोजकता कोश के इलेक्ट्रॉनों पर कार्य करने वाला प्रभावी नाभिकीय आवेश बढ़ता जाता है।
दीर्घ उत्तरीय प्रश्न (Long Answer Type Questions)
प्रश्न 1.
मेन्डेलीफ आवर्त सारणी के प्रमुख दोष लिखिए।
उत्तर-
मेन्डेलीफ की आवर्त सारणी के दोषमेन्डेलीफ की आवर्त सारणी में अनेक दोष पाए गए। मुख्य दोष निम्न थे-
1. हाइड्रोजन का स्थान (Position of hydrogen)मेन्डेलीफ की आवर्त सारणी में हाइड्रोजन का स्थान अनिश्चित है। हाइड्रोजन प्रथम समूह के क्षारीय धातु तथा सप्तम समूह के हैलोजनों तत्वों से गुणों में समानता प्रदर्शित करता है। अतः यह निश्चित नहीं हो पाया कि हाइड्रोजन को प्रथम समूह में रखा जाए अथवा सप्तम समूह में।
2. समस्थानिकों का स्थान (Position of isotopes)आवर्त सारणी में समस्थानिकों को कोई स्थान नहीं दिया गया है। परमाणु क्रमांक के आधार पर वर्गीकरण करने पर यह दोष दूर हो गया।
3. दुर्लभ मृदा तत्वों का स्थान (Position of rare earth elements) आवर्त सारणी में समूह के एक आवर्त में एक ही तत्व को स्थान दिया गया है लेकिन तृतीय समूह के छठवें आवर्त में 14 दुर्लभ मृदा तत्वों (Ce-,,Lu) को एक साथ रखा गया है। इन तत्वों के गुण आपस में अत्यधिक समान होते हैं।
4. ऐक्टिनॉइड्स का स्थान (Position of actinides) दुर्लभ मृदा तत्वों के समान तृतीय समूह के सप्तम आवर्त में 14 ऐक्टिनॉइड्स ( Th-Lu) को एक साथ रखा गया है।
5. आठवें समूह के तत्वों का स्थान (Position of eighth group elements)-आठवें समूह में एक खाने में तीन तत्वों को एक साथ रखा गया है जबकि अन्य समूहों में एक खाने में एक ही तत्व को रखा गया है।
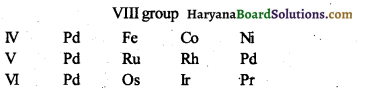
6. कुछ समान गुणों वाले तत्वों को पृथक् समूहों में स्थान (Some elements similar in properties placed in different groups)-कुछ समान गुणों वाले तत्वों को एक ही समूह के बजाए अलग-अलग समूहों में रखा गया है। उदाहरणार्थ, कॉपर तथा मरकरी, सिल्वर तथा थैलियम, बेरियम तथा लैड।
7. कुछ असमान गुणों वाले तत्वों को एक ही समूह में स्थान (Some elements dissimilar in propertiés placed in same group)-कुछ असमान गुणों वाले तत्वों को एक ही समूह में स्थान दिया गया है। उदाहरणार्थ, सिक्का धातुओं (Coinage metals) तथा क्षारीय धातु, मैंगनीज तथा हैलोजन।
8. कुछ अधिक परमाणु भार वाले तत्वों को कम परमाणु भार वाले तत्वों से पहले रखना (Some elements with more atomic weight placed before to lighter elements)-कुछ अधिक परमाणु भार वाले तत्वों को कम परमाणुओं वाले तत्वों से पहले स्थान दिया गया है।
उदाहरणार्थ-
- आर्गन (39.9) को पोटैशियम (39.1) से पहले।
- कोबाल्ट (58.9) को निकल (58.7) से पहले।
- टेलुरियम (127.6) को आयोडीन (126.9) से पहले।
- थोरियम (232.1) को प्रोटेक्टीनियम (231) से पहले रखा गया है।
![]()
प्रश्न 2.
मेन्डेलीफ की आधुनिक आवर्त सारणी के दोष बताइए। दीर्घाकार अथवा प्रवर्तित आवर्त सारणी की प्रमुख विशेषताएँ लिखिए।
उत्तर-
मेन्डेलीफ की आधुनिक आवर्त सारणी के दोष-परमाणु भार के बजाए परमाणु क्रमांक को आधार मानकर बनाई गई आवर्त सारणी में अनेक दोष स्वयं दूर हो गए।
उदाहरणार्थ-
- समस्थानिकों को स्थान
- अधिक परमाणु भार वाले तत्व की कम परमाणु भार वाले तत्व से पहले स्थिति।
लेकिन निम्न दोष अभी भी शेष हैं-
- हाइड्रोजन की स्थिति-हाइड्रोजन की स्थिति अनिश्चित है क्योंकि यह IA क्षारीय धातुओं तथा VIIA (हैलोजनों) दोनों उप-समूहों के तत्वों से गुणों में समानता प्रदर्शित करती है।
- असमान तत्वों को एक ही समूह में तथा समान तत्वों को विभिन्न समूहों में रखना-उदाहरणार्थ, IA तथा IB के तत्वों को एक ही समूह में तथा Cu, Hg तथा Pt को अलग-अलग समूहों में रखा गया है।
- आठवें समूहके साथ तीन तत्वों को रखना-आठवें समूह में एक ही आवर्त में एक साथ तीन तत्वों को रखा गया है। उदाहरणार्थ, Fe Co Ni, Ru Rh Pd, Os Ir Pt
- दुर्लभ मृदा तत्वों तथा ऐक्टिनॉइड्स की स्थिति-दुर्लभ मृदा तत्वों तथा ऐक्टिनॉइड्स को सारणी से पृथक् नीचे स्थान, दिया गया है।
- धातु तथा अधातुओं की स्थिति-एक ही समूह में धातु तथा अधातु दोनों को एक साथ रखा गया है।
दीर्घाकार अथवा प्रवर्धित आवर्त सारणी (Oblong Form or Extended Formof Periodic Table)-यह आवर्त सारणी बोर (Bohr) सारणी भी कहलाती है, क्योंकि यह बोर के द्वारा दिए गए परमाणुओं के इलेक्ट्रॉनों के विन्यास पर आधारित है। रॉग (Raug), वर्नर (Werner), तथा बरी (Bury) ने इलेक्ट्रॉनों के विन्यास के आधार पर इस सारणी को प्रस्तुत किया जिसे दीर्घाकार अथवा प्रवर्धित आवर्त सारणी कहते हैं।
इस आवर्त सारणी में प्रथम दो आवतों को विभाजित कर दिया गया है तथा उप-समूहों को अलग करके 18 ऊवधिर (Vertical) खानों में विभाजित किया गया है जिन्हें समूह (Groups) कहते हैं। IA तथा IIA समूह के तत्वों को बाई तरफ रखा गया है। यह तत्व अत्यधिक धनात्मक प्रकृति के होते हैं। सारणी के दाई ओर IIHA, IVA, VA, VIA, VIIA तथा शून्य समूह के तत्वों को रखा गया है। VIIA समूह के हैलोजन तत्व अत्यधिक ऋणात्मक प्रकृति के होते हैं। आवर्त सारणी के मध्य भाग में संक्रमण तत्वों (IIIB से VIIB, VII, IB, IIB) को रखा गया है। लैन्थेनॉइड्स तथा ऐक्टिनॉइड्स को सारणी से नीचे अलग स्थान दिया गया है।
दीर्घाकार आवर्त सारणी की विशेषताएँ-
- यह सारणी सरल है तथा याद रखने में आसान है।
- इस आवर्त सारणी में तत्वों के इलेक्ट्रॉनिक विन्यास तथा स्थिति में एक समन्वय है।
- इसमें उप-समूहों को अलग कर देने से भिन्न-भिन्न गुणों वाले तत्व एक ही समूह में नहीं हैं।
- इसमें धातु तथा अधातु सारणी में पृथक् हो गए हैं। धातु (धनात्मक) बाईं तरफ, अधातु (ऋणात्मक) दाईं तरफ तथा संक्रमण तत्व सारणी के मध्य भाग में स्थित हैं।
- परमाणु क्रमांक के बढ़ने पर तत्वों के गुणों में क्रमिक परिवर्तन होता है।
प्रश्न 3.
मेन्डेलीफ के आवर्त नियम का उल्लेख कीजिए। (Rbse 2017)
उत्तर-
रूसी रसायनशास्त्री डिमित्री एनवानोवीच मेन्डेलीफ (Dimitri Invanovich Mendeleev) – ने सन् 1869 में माना कि “तत्वों के भौतिक और रासायनिक गुण उनके परमाणु भार के आवर्ती फलन होते हैं।” इसके अनुसार यदि विभिन्न तत्वों को उनके परमाणु भार के बढ़ते हुये क्रमानुसार रखा जाए तो निश्चित अन्तर के बाद समान गुणों वाले तत्व प्रकट होते हैं।
मेन्डेलीफ ने 63 कार्ड लेकर उस समय उपलब्ध 63 तत्वों के नाम एवं गुण लिखकर समान गुणों वाले तत्वों के काड़ों को पृथक् करके उनको दीवार पर एक पिन से लगा दिया। तत्वों के परमाणु भार के क्रम में व्यवस्थित करने पर प्रत्येक वर्ग के सभी तत्व अनेक गुणों में समान थे। प्रत्येक सातवें तत्व के बाद आने वाले तत्व के गुण पहले वाले तत्व के समान पाए गए। इस आधार पर तत्वों की व्यवस्था धात्वीय गुण, घनत्व अथवा किसी अन्य गुण पर आधारित व्यवस्था से अच्छी पाई गई। इस प्रकार उन्होंने नियम दिया कि “तत्वों के गुण उनके परमाणु भार के आवर्ती फलन होते हैं।”
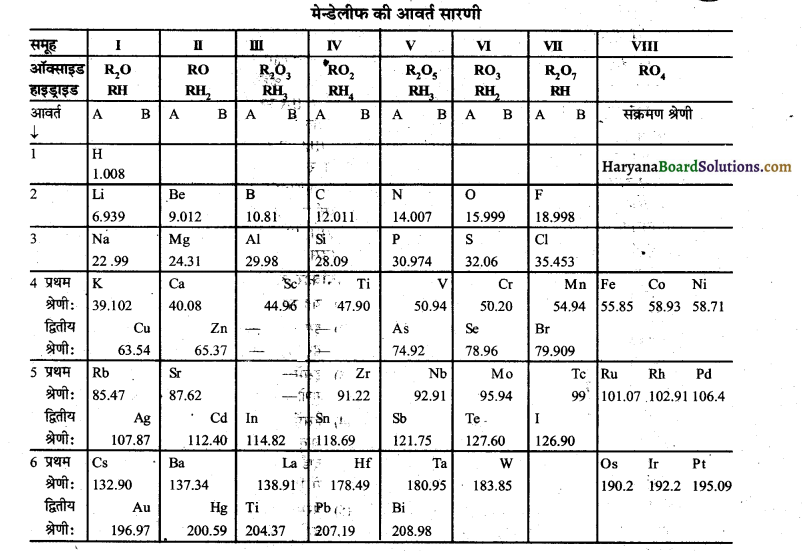
प्रश्न 4.
(a) मेन्डेलीफ के आवर्त नियम को चुनौती देने वाले किन्हीं तीन प्रेक्षणों की सूची बनाइए।
(b) आधुनिक आवर्त सारणी में,
(i) किसी आवर्त में बाएं से दाएँ जाने पर,
(ii) किसी समूह (ग्रुप) में ऊपर से नीचे जाने पर, तत्वों के धात्विक लक्षणों में किसी प्रकार विचरण होता है?
अथवा
चार तत्वों A, BC और D के परमाणुओं में इलेक्ट्रॉनों का तीन कोशों में वितरण इस प्रकार है कि इन तत्वों के बाह्यतम कोशों में इलेक्ट्रॉनों की संख्या क्रमशः 1, 3, 5 और 7 है। आधुनिक आवर्त सारणी में इन तत्वों की समूह (गुप) संख्या लिखिए। B और D परमाणुओं का इलेक्ट्रॉनिक विन्यास तथा B और D के संयोग से बने योगिक का आण्विक सूत्र लिखिए। (Cbse 2019)
उत्तर-
(a) मैण्डलीव के नियम को चुनौती देने वाले तीन बिन्दु निम्नवत् हैं-
- आवर्त सारणी में हाइड्रोजन का स्थान विवादास्पद है, इसे एल्कली समूह के साथ एवं हेलोजन समूह के साथ रखा गया है।
- समस्थानिकों को स्थान देना सम्भव नहीं है। .
- कहीं-कहीं तत्वों के परमाणु भार का क्रम टूट गया है। अधिक परमाणु भार वाले तत्वों को कम परमाणु भार वाले तत्वों से पहले रखा गया है। जैसे-सिलिकॉन (28Si) से पहले एल्युमिनियम (29Al) CO के बाद Ni को।
- अंतिम समूह चौथे, पाँचवें एवं छठवें आवर्त में एक साथ तीन-तीन तत्वों को रखा गया है-Fe, Co, Ni.
(b) आधुनिक आवर्त सारणी में धात्विक लक्षणों में परिवर्तन
- बायें से दायें जाने पर तत्वों के धात्विक गुण में कमी होती है क्योंकि तत्वों द्वारा इलेक्ट्रॉन को छोड़ने की प्रवृत्ति कम होती है। तत्वों के परमाणु के नाभिक में नाभिकीय बल बढ़ता है।
- ऊपर से नीचे जाने पर तत्वों के धात्विक गुण बढ़ते हैं क्योंकि नाभिकीय बल घटता है तथा इलेक्ट्रॉन के छोड़ने की प्रवृत्ति बढ़ती है।
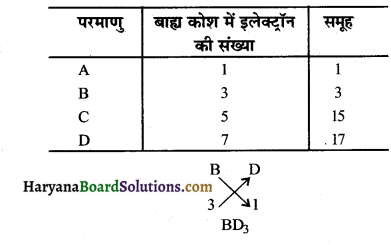
∴ B, D.के संयोग से बने यौगिक का अणुसूत्र BD3 है।
प्रश्न 5.
(a) आधुनिक आवर्त सारणी का विकास डॉबेराइनर, न्यूलैण्ड तथा मेण्डलीफ के प्रारम्भिक प्रयासों के कारण हो पाया है। इन तीनों प्रयासों की एक-एक उपलब्धि और एक-एक सीमा की सूची बनाइए।
(b) उस वैज्ञानिक का नाम लिखिए जिसने सर्वप्रथम यहदर्शाया कि किसी तत्व की परमाणु संख्या उसके परमाणु द्रव्यमान की तुलना में अधिक आधारभूत गुणधर्म है।
(c) आधुनिक आवर्त नियम लिखिए। (CBSE 2018)
उत्तर-
(a)
(1) डॉबेराइनर की उपलब्धि और सीमाइन्होंने तीन-तीन तत्वों के समूह बनाए। इन समूहों को डॉबेराइनर का त्रिक/त्रय कहा गया। डॉबेराइनर ने बताया कि इन तत्वों को इनके परमाणु द्रव्यमान के आरोही क्रम में व्यवस्थित करने पर बीच वाले तत्व का परमाणु द्रव्यमान अन्य दो परमाणुओं के द्रव्यमान का लगभग औसत होता है।
Li 6.9
Na 23
K 39
सीमा-डॉबेराइनर का सिद्धान्त प्रत्येक त्रिक पर लागू नहीं हो सका।
उदाहरण : यह सिद्धान्त N, P As पर लागू नहीं हो पाया।
वह उस समय उपस्थित तत्वों के तीन ही त्रय को पहचान पाया था।
(2) न्यूलैंड्स का अष्टक सिद्धान्त-न्यूलैंड्स ने तत्वों को उनके परमाणु द्रव्यमान के आरोही क्रम में व्यवस्थित किया तथा यह बताया कि प्रत्येक आठवाँ तत्व पहले तत्व से गुणों में समानता दिखाता है।
सीमाएँ-
(i) यह सिद्धान्त केवल कैल्शियम तत्व तक ही लागू हो सका।
(ii) न्यूलैंड्स का अष्टक नियम केवल हल्के तत्वों के लिए ही लागू हो सका। यह नियम भारी परमाणु के भारी तत्वों का स्थान निर्धारित करने में असफल रहा।
(3) मेण्डलीफ की उपलब्धियाँ-
- मेण्डलीफ ने अपनी आवर्त सारणी में भविष्य में ज्ञात होने वाले तत्वों के लिए अनुमानित रिक्त स्थान दिए हैं।
- मेण्डलीफ की आवर्त सारणी के ज्ञान से ही नए तत्वों को खोजने में काफी सहायता मिली।
सीमाएँ-
- मेण्डलीफ की आवर्त सारणी में हाइड्रोजन को नियत स्थान नहीं दिया जा सका।
- समस्थानिक मैण्डलीफ के आवर्त नियम के लिए एक चुनौती थी।
(b) हेनरी मोज्ले ने सर्वप्रथम दर्शाया कि किसी तत्व की परमाणु संख्या उसके परमाणु द्रव्यमान की तुलना में अधिक आधारभूत गुणधर्महै।
(c) आधुनिक आवर्त सारणी-इस नियम के अनुसार तत्वों को उनके परमाणु क्रमांक के अनुसार व्यवस्थित किया गया है।
आधुनिक आवर्त नियम-
- तत्वों के रासायनिक और भौतिक गुण उनके परमाणु संख्या के आवर्ती फलन होते हैं।
- आधुनिक आवर्त सारणी में तत्वों को उनके परमाणु क्रमांक के बढ़ते क्रम में व्यवस्थित किया गया है।
- आधुनिक आवर्त सारणी में 18 समूह तथा 7 आवर्त हैं।
बहुविकल्पीय प्रश्न (Objective Type Questions)
1. न्यूलैंड्स अष्टक सिद्धान्त कैसे तत्वों के लिए ठीक से लागू हो पाया
(a) भारी
(b) कठोर
(c) हल्के
(d) इनमें से कोई नहीं।
उत्तर-
(c) हल्के।
2. मेन्डेलीफ की आवर्त सारणी में क्षैतिज पंक्तियों को क्या कहा गया –
(a) ग्रुप
(b) आवर्त
(c) रेखीय
(d) इनमें से कोई नहीं।
उत्तर-
(b) आवर्त।
![]()
3. समूह में ऊपर से नीचे जाने पर परमाणु आकार कैसे प्रभावित होता है –
(a) घटता है
(b) बढ़ता है
(c) समान रहता है
(d) इनमें से कोई नहीं।
उत्तर-
(b) बढ़ता है।
4. मेन्डेलीफ के वर्गीकरण का आधार है
(a) परमाणु संख्या
(b) परमाणु द्रव्यमान
(c) भौतिक अवस्था
(d) धातु एवं अधातु।
उत्तर-
(b) परमाणु द्रव्यमान।
5. आधुनिक आवर्त सारणी में समूहों की संख्या है –
(a) 8
(b) 18
(c) 7
(d) 17.
उत्तर-
(b) 18.
6. AI(परमाणुसंख्या 13) को किस समूह में रखा गया है –
(a) तीसरे
(b) 13वें
(c) दूसरे
(d) आठवें।
उत्तर-
(b) 13वें।
7. A, B और C डॉबेराइनर के त्रिक तत्व हैं। यदि A का परमाणु द्रव्यमान 7 तथा C का 39 है तो B का परमाणु द्रव्यमान होगा –
(a) 32
(b) 11
(c) 23
(d) 46.
उत्तर-
(c) 23.
8. मेन्डेलीफ की आवर्त सारणी में किस तत्व को सही स्थान नहीं मिला?
(a) सोडियम
(b) पौटेशियम
(c) नीऑन
(d) हाइड्रोजन।
उत्तर-
(d) हाइड्रोजन।
9. L-कोश द्वितीय आवर्त में कितने तत्व हैं?
(a) 4
(b) 8
(c) 12
(d) 16.
उत्तर-
(b) 8.
10. F, CI, Br, I तथा A कौन-से समूह के तत्व हैं? .
(a) 2
(b) 7
(c) 12
(d) 17.
उत्तर-
(d) 17.
![]()
11. निम्न में से किसमें अधिकतम अधात्विक गुण हैं ?
(a) Cl
(b) F
(c) Br
(d) I.
उत्तर-
(b) E
12. एक तत्व का इलेक्ट्रॉनिक विन्यास 2,8,8,1 है। इसके लिए कौन-सा तथ्य सही नहीं है?
(a) इसकी संयोजकता – 1 है
(b) इसकी संयोजकता + 1 है
(c) यह I A समूह में उपस्थित है
(d) यह चौथे (IV) आवर्त में आता है।
उत्तर-
(c) यह IA समूह में उपस्थित है।
13. किसी कोश में इलेक्ट्रॉनों की अधिकतम संख्या हो सकती है –
(a) n2
(b) 2n2
(c) 5n2
(d) 4n2.
उत्तर-
(b) 2n2
14.
तत्वों का प्रथम आवर्ती वर्गीकरण किसने प्रस्तुत किया. था?
(a) डॉबेराइनर
(b) जे. ए. आर. न्यूलैंड्स
(c) मेन्डेलीफ
(d) लोथर मेयर।
उत्तर-
(c) मेन्डेलीफ।
15. आधुनिक आवर्त सारणी तत्वों के किस लक्षण पर आधारित है?
(a) संयोजकता
(b) परमाणु द्रव्यमान
(c) परमाणु आकार
(d) इलेक्ट्रॉनिक विन्यास।
उत्तर-
(d) इलेक्ट्रॉनिक विन्यास।
16. आवर्त सारणी का दीर्घाकार रूप आधारित है
(a) परमाणु भार परं
(b) परमाणु द्रव्यमान पर
(c) परमाणु क्रमांक पर
(d) परमाणु त्रिज्या पर।
उत्तर-
(c) परमाणु क्रमांक पर।
17. आधुनिक आवर्त सारणी को किसने विकसित किया था –
(a) लोथर मेयर
(b) नील बोर
(c) मेन्डेलीफ
(d) मोजले।
उत्तर-
(d) मोजले।
![]()
18. मेन्डेलीफ का आवर्त नियम आधारित है
(a) संयोजकता पर
(b) परमाणु भार पर
(c) परमाणु क्रमांक पर
(d) परमाणु आयतन पर।
उत्तर-
(b) परमाणु भार पर।
रिक्त स्थानों की पूर्ति कीजिए (Fill In the blanks)
1. मेण्डेलीफ की आवर्त सारणी को ……………………. तथा ……………………. में बाँटा गया है।
उत्तर-
आवर्तों, वर्गों,
2. तीसरे आवर्त में Na; Mg व AI ……………………. है तथा P, S, Clव Ar ……………………. ।
उत्तर-
धातुएँ, अधातुएँ,
3. सारणी में तिरछी रेखा के दाईं ओर ……………………. स्थित हैं।
उत्तर-
अधातुएँ,
4. धातुओं के ऑक्साइड ……………………. तथा अधातुओं के ऑक्साइड सामान्यतः ……………………. होते हैं।
उत्तर-
क्षारकीय, अम्लीय,
5. आधुनिक आवर्त सारणी में 18 ऊर्ध्व स्तंभ हैं जिन्हें ……………………. कहते हैं।
उत्तर-
समूह।
सुमेलन संबंधी प्रश्न (Matrix Type Questions)
निम्न को सुमेलित कीजिए –
| कॉलम A | कॉलम B | कॉलम C |
| 1. यूरेनियम | समूह 17 | सिक्का धातु |
| 2. चाँदी | ऑक्सीजन समूह | गैस |
| 3. एल्युमीनियम | संक्रमण तत्व | पीला ठोस |
| 4. फ्लु ओरीन | बोरॉन समूह | रेडियोएक्टिव |
| 5. सल्फर | एक्टिनॉइड | उभयधर्मी |
उत्तर-
1. यूरेनियम – एक्टिनाइड – रेडियोएक्टिव
2. चाँदी – संक्रमण तत्व – सिक्का धातु
3. ऐल्युमीनियम – बोरॉन समूह – उभयधर्मी
4. फ्लु ओरीन – समूह 17 – गैस
5. सल्फर – ऑक्सीजन समूह – पीला ठोस।