Haryana State Board HBSE 9th Class Science Important Questions Chapter 4 परमाणु की संरचना Important Questions and Answers.
Haryana Board 9th Class Science Important Questions Chapter 4 परमाणु की संरचना
अति लघूत्तरात्मक प्रश्न
प्रश्न 1.
पदार्थ कैसे बनते हैं?
उत्तर:
पदार्थ परमाणुओं एवं अणुओं से मिलकर बनते हैं।
प्रश्न 2.
परमाणु किसे कहते हैं?
उत्तर:
परमाणु पदार्थ का सूक्ष्मतम अविभाज्य कण होता है जिसका स्वतंत्र अस्तित्व होता है।
प्रश्न 3.
डॉल्टन ने किस शताब्दी में परमाणु को अविभाज्य माना था?
उत्तर:
डॉल्टन ने 19वीं शताब्दी में परमाणु को अविभाज्य माना था।
प्रश्न 4.
परमाणु के मूल कण कौन-कौन से हैं?
उत्तर:
परमाणु के मूल कण इलेक्ट्रॉन, प्रोटॉन व न्यूट्रॉन हैं।
प्रश्न 5.
क्या परमाणुओं द्वारा उत्सर्जित प्रकाश में अभिलाक्षणिक वर्ण या तरंगदैर्ध्य होती है?
उत्तर:
हाँ, परमाणुओं द्वारा उत्सर्जित प्रकाश में अभिलाक्षणिक वर्ण या तरंगदैर्ध्य होती है।
प्रश्न 6.
इलेक्ट्रॉन से क्या अभिप्राय है?
उत्तर:
परमाणु में नाभिक के चारों ओर घूमने वाला ऋण आवेशित कण जिसका द्रव्यमान प्रोटॉन के द्रव्यमान का \(\frac { 1 }{ 2000 }\) वां भाग होता है, इलेक्ट्रॉन कहलाता है।
प्रश्न 7.
इलेक्ट्रॉन की खोज का श्रेय किस वैज्ञानिक को दिया जाता है?
उत्तर:
जेजे० टॉमसन को।
![]()
प्रश्न 8.
इलेक्ट्रॉन पर कौन-सा आवेश उपस्थित होता है?
उत्तर:
ऋणं आवेश।
प्रश्न 9.
किस वैज्ञानिक ने केनाल किरणों की खोज की?
उत्तर:
जर्मन वैज्ञानिक ई० गोल्डस्टीन (E. Goldstein) ने।
प्रश्न 10.
केनाल किरणों को किस अन्य नाम से पुकारा जाता है?
उत्तर:
केनाल किरणों को धनात्मक किरणों के नाम से भी पुकारा जाता है।
प्रश्न 11.
वैद्युत क्षेत्र में केनाल किरणें किस इलेक्ट्रॉड की ओर आकर्षित होती हैं?
उत्तर:
ऋण इलेक्ट्रॉड की ओर।
प्रश्न 12.
इलेक्ट्रॉन और प्रोटॉन को कैसे दर्शाया जाता है?
उत्तर:
इलेक्ट्रॉन को e तथा प्रोटॉन को p+ द्वारा दर्शाया जाता है।
प्रश्न 13.
प्रोटॉन का द्रव्यमान और आवेश कितना होता है?
उत्तर:
प्रोटॉन का द्रव्यमान 1 इकाई और आवेश +1 होता है।
प्रश्न 14.
इलेक्ट्रॉन पर कितना आवेश होता है?
उत्तर:
इलेक्ट्रॉन पर -1 आवेश होता है।
प्रश्न 15.
परमाणु विद्युत उदासीन क्यों होता है?
उत्तर:
क्योंकि परमाणु में प्रोटॉनों व इलेक्ट्रॉनों की संख्या परस्पर आवेशों को संतुलित कर देती है।
प्रश्न 16.
जे.जे. टॉमसन को किस खोज के कारण भौतिक शास्त्र में नोबेल पुरस्कार मिला?
उत्तर:
इलेक्ट्रॉन की खोज के कारण।
प्रश्न 17.
जे.जे. टॉमसन का जन्म कब हुआ?
उत्तर:
जे.जे. टॉमसन का जन्म 18 दिसंबर, 1856 को हुआ।
प्रश्न 18.
अल्फा कण का द्रव्यमान कितना होता है?
उत्तर:
अल्फा कण का द्रव्यमान 4u होता है।
प्रश्न 19.
अल्फा कण क्या होते हैं?
उत्तर:
अल्फा कण द्वि-आवेशित हीलियम कण होते हैं।
प्रश्न 20.
किस वैज्ञानिक को नाभिकीय भौतिकी का जनक माना जाता है?
उत्तर:
ई० रदरफोर्ड को नाभिकीय भौतिकी का जनक माना जाता है।
प्रश्न 21.
ई० रदरफोर्ड का जन्म कब हुआ?
उत्तर:
ई० रदरफोर्ड का जन्म 30 अगस्त, 1871 को हुआ।
प्रश्न 22.
रदरफोर्ड के अनुसार परमाणु का समस्त द्रव्यमान कहाँ स्थित होता है?
उत्तर:
परमाणु के सूक्ष्म नाभिक में।
प्रश्न 23.
नाभिक के आकार की परमाणु के आकार से तुलना कीजिए।
उत्तर:
नाभिक का आकार परमाणु के आकार से 10 गुना छोटा होता है।
प्रश्न 24.
परमाणु-नाभिक पर कौन-सा आवेश होता है?
उत्तर:
धनावेश।
प्रश्न 25.
कौन-से तत्त्व के नाभिक को प्रोटॉन कहा जाता है?
उत्तर:
हाइड्रोजन के नाभिक को।
प्रश्न 26.
इलेक्ट्रॉन के घूर्णन के बारे में नील्स बोर का क्या प्रस्ताव था?
उत्तर:
नील्स बोर के अनुसार इलेक्ट्रॉन निश्चित ऊर्जा कक्ष में गति करता है।
प्रश्न 27.
नील्स बोर के मॉडल अनुसार जब एक इलेक्ट्रॉन उच्च ऊर्जा स्तर से एक निम्न ऊर्जा स्तर की कक्षा में आता है तो ऊर्जा का अंतर किस रूप में विकरित होता है?
उत्तर:
विद्युत् चुंबकीय विकिरण अथवा प्रकाश के रूप में।
प्रश्न 28.
परमाणु के नाभिक में कौन-कौन से कण होते हैं?
उत्तर:
प्रोटॉन व न्यूट्रॉन।
प्रश्न 29.
परमाणु के प्रथम व द्वितीय कोश में अधिकतम कितने इलेक्ट्रॉन आ सकते हैं?
उत्तर:
प्रथम कोश में दो तथा द्वितीय कोश में अधिकतम आठ इलेक्ट्रॉन आ सकते हैं।
प्रश्न 30.
सबसे हल्के परमाणु का नाम लिखें।
उत्तर:
हाइड्रोजन।
प्रश्न 31.
उस परमाणु का नाम लिखिए जिसमें कोई न्यूट्रॉन नहीं होता।
उत्तर:
प्रोटियम (H) जोकि हाइड्रोजन का समस्थानिक है।
प्रश्न 32.
हीलियम के नाभिक में उपस्थित प्रोटॉन तथा न्यूट्रॉन की संख्या लिखें।
उत्तर:
हीलियम के नाभिक में दो प्रोटॉन तथा दो न्यूट्रॉन होते हैं।
प्रश्न 33.
न्यूट्रॉन की खोज कब और किसने की?
उत्तर:
न्यूट्रॉन की खोज सन् 1932 में चैडविक ने की।
![]()
प्रश्न 34.
परमाणु संरचना में किस कोश के इलेक्ट्रॉन परमाणुओं के रासायनिक गुणधर्म निर्धारित करते हैं?
उत्तर:
अंतिम कोश के इलेक्ट्रॉन।
प्रश्न 35.
जल के एक अणु में हाइड्रोजन व ऑक्सीजन के कितने परमाणु होते हैं?
उत्तर:
जल के एक अणु में हाइड्रोजन के दो तथा ऑक्सीजन का एक परमाणु होता है।
प्रश्न 36.
कौन-से परमाणु रासायनिक रूप से सक्रिय होते हैं?
उत्तर:
जिन परमाणुओं के बाह्य कोश पूर्ण नहीं होते, वे परमाणु रासायनिक रूप से सक्रिय होते हैं।
प्रश्न 37.
कौन-से परमाणु रासायनिक रूप से उदासीन होते हैं?
उत्तर:
वे परमाणु जिनके बाह्य कोश पूर्ण होते हैं, रासायनिक रूप से उदासीन होते हैं; जैसे हीलियम व निऑन।
प्रश्न 38.
दो संयोजकता वाले दो परमाणुओं के नाम लिखो।
उत्तर:
- कैल्शियम (Ca)
- बेरिलियम (Be)।
प्रश्न 39.
क्लोरीन की संयोजकता कितनी है?
उत्तर:
एक।
प्रश्न 40.
उस तत्त्व के परमाणु में न्यूट्रॉन की संख्या क्या होगी जिस तत्त्व की परमाणु संख्या 19 तथा द्रव्यमान संख्या 39 है।
उत्तर:
न्यूट्रॉन = द्रव्यमान संख्या – परमाणु संख्या
= 39 – 19 = 20
प्रश्न 41.
परमाणु M तथा उसके आयन M+ का द्रव्यमान क्यों समान होता है?
उत्तर:
क्योंकि दोनों में न्यूट्रॉनों व प्रोटॉनों की संख्या समान होती है।
प्रश्न 42.
यूरेनियम के दो समस्थानिक लिखिए।
उत्तर:
\({ }_{92}^{235} \mathrm{U}\) व \({ }_{238}^{92} \mathrm{U}\).
प्रश्न 43.
निम्नलिखित में से कौन-से दो नाभिक परस्पर समस्थानिक हैं?
\({ }_{90} Z^{231},{ }_{91} Z^{230},{ }_{88} Z^{230},{ }_{90} Z^{233}\)
उत्तर:
\({ }_{90} Z^{231}\) तथा \({ }_{90} Z^{233}\)
प्रश्न 44.
कार्बन के कितने समस्थानिक हैं?
उत्तर:
कार्बन के दो समस्थानिक \({ }_6^{12} \mathrm{C}\) व \({ }_6^{14} \mathrm{C}\) ।
प्रश्न 45.
एक ही तत्त्व के ऐसे परमाणु जिसकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न होती है, क्या कहलाते हैं?
उत्तर:
समस्थानिक।
प्रश्न 46.
क्लोरीन के समस्थानिकों का औसत द्रव्यमान कितना होता है?
उत्तर:
क्लोरीन के समस्थानिकों का औसत द्रव्यमान 35.5u होता है।
प्रश्न 47.
निम्नलिखित में से कौन-से नाभिक समस्थानिक हैं?
\({ }_{88} \mathrm{Z}^{226},{ }_{87} \mathrm{Z}^{236},{ }_{88} \mathrm{Z}^{238},{ }_{82} \mathrm{Z}^{238}\)
उत्तर:
\({ }_{88} Z^{226},{ }_{88} Z^{238}\)
प्रश्न 48.
कैंसर के उपचार के लिए किस रेडियोऐक्टिव समस्थानिक का उपयोग किया जाता है?
उत्तर:
द्रव्यमान संख्या 60 वाले कोबाल्ट समस्थानिक का।।
प्रश्न 49.
परमाणु भट्टी में किस ईंधन का प्रयोग किया जाता है?
उत्तर:
परमाणु भट्टी में यूरेनियम के समस्थानिक (U-235) का प्रयोग ईंधन के रूप में किया जाता है।
प्रश्न 50.
पेंघा रोग के इलाज में किस तत्त्व के समस्थानिक का उपयोग होता है?
उत्तर:
पेंघा रोग के इलाज में आयोडीन के समस्थानिक का उपयोग होता है।
प्रश्न 51.
समभारिक किसे कहते हैं? उदाहरण सहित लिखें।
उत्तर:
समभारिक वे परमाणु होते हैं जिनकी द्रव्यमान संख्या समान लेकिन परमाणु संख्या भिन्न-भिन्न होती है; जैसे कैल्शियम (\({ }_{20} \mathrm{Ca}^{40}\)) तथा ऑर्गन (\({ }_{18} \mathrm{Ar}^{40}\)) समभारिक हैं।
लघूत्तरात्मक प्रश्न
प्रश्न 1.
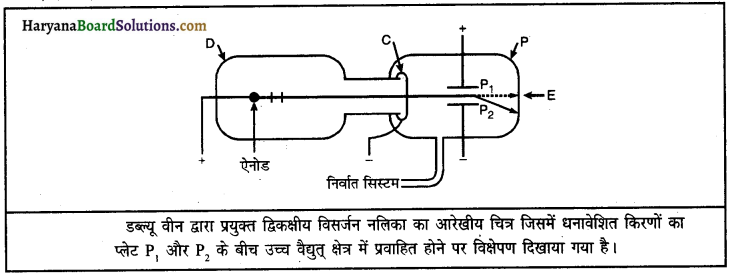
केनाल किरणों को धनावेशित किरणें क्यों कहा जाता है?
उत्तर:
केनाल किरणों का वैद्युत् क्षेत्र में ऋण इलेक्ट्रॉड की ओर विक्षेपण दर्शाता है कि ये किरणें धनावेशित कणों से मिलकर बनी हैं, इसलिए इन्हें धनावेशित किरणें भी कहा जाता है।
प्रश्न 2.
केनाल किरणों के गुण लिखिए।
उत्तर:
केनाल किरणों के गुण निम्नलिखित हैं-
- ये किरणें सीधी रेखा में चलती हैं।
- ये किरणें वैद्युत् तथा चुंबकीय क्षेत्र में ऋण इलेक्ट्रॉड की ओर विचलित होती हैं।
- इनका द्रव्यमान इलेक्ट्रॉन के द्रव्यमान से कई गुना होता है।
प्रश्न 3.
परमाणु में इलेक्ट्रॉनों को नक्षत्रीय इलेक्ट्रॉन क्यों कहते हैं?
उत्तर:
परमाणु में इलेक्ट्रॉन अपनी-अपनी निश्चित दीर्घ वृत्तीय कक्षाओं में ठीक उसी प्रकार चक्कर लगाते हैं जिस प्रकार आकाश में नक्षत्र सूर्य के चारों ओर दीर्घ वृत्तीय कक्षाओं में चक्कर लगाते हैं। इसलिए इलेक्ट्रॉनों को नक्षत्रीय इलेक्ट्रॉन कहते हैं।
प्रश्न 4.
प्रोटॉन एवं न्यूट्रॉन में समानताएँ एवं असमानताएँ बताइए।
उत्तर:
प्रोटॉन तथा न्यूट्रॉन में समानताएँ-
- प्रोटॉन तथा न्यूट्रॉन दोनों का भार लगभग एक परमाणु द्रव्यमान इकाई (a.m.u) के बराबर होता है।
- प्रोटॉन तथा न्यूट्रॉन दोनों परमाणु के नाभिक में विद्यमान होते हैं।
प्रोटॉन और न्यूट्रॉन में असमानताएँ-
- प्रोटॉन धनावेशित कण होते हैं, जबकि न्यूट्रॉन उदासीन कण हैं।
- न्यूट्रॉन का द्रव्यमान प्रोटॉन के द्रव्यमान से थोड़ा-सा अधिक होता है।
प्रश्न 5.
इलेक्ट्रॉन व न्यूट्रॉन में अंतर लिखें।
उत्तर:
इलेक्ट्रॉन व न्यूट्रॉन में निम्नलिखित अंतर हैं-
| इलेक्ट्रॉन | न्यूट्रॉन |
| 1. इलेक्ट्रॉन पर ऋण आवेश होता है। | 1. न्यूट्रॉन पर कोई आवेश नहीं होता। |
| 2. ये नाभिक के बाहर भिन्न-भिन्न कक्षाओं में घूमते हैं। | 2. ये नाभिक में रहते हैं। |
| 3. इनका भार हाइड्रोजन के एक परमाणु के भार का 1/2000 वाँ भाग होता है। | 3. इसका भार हाइड्रोजन के एक परमाणु के भार के लगभग समान होता है। |
प्रश्न 6.
इलेक्ट्रॉन व प्रोटॉन में अंतर लिखें।
उत्तर:
इलेक्ट्रॉन व प्रोटॉन में निम्नलिखित अंतर हैं-
| इलेक्ट्रॉन | प्रोटॉन |
| 1. इन पर इकाई ऋण आवेश होता है। | 1. इन पर इकाई धन आवेशं होता है। |
| 2. इनका भार हाइड्रोजन के परमाणु के भार का 1/2000 वाँ भाग होता है। | 2. इनका भार हाइड्रोजन के परमाणु के भार के समान होता है। |
| 3. ये नाभिक के बाहर भिन्न-भिन्न कक्षाओं में घूमते हैं। | 3. ये नाभिक में रहते हैं। |
प्रश्न 7.
परमाणु नाभिक के आवश्यक गुण धर्मों की व्याख्या कीजिए।
उत्तर:
परमाणु नाभिक के आवश्यक गुणधर्म निम्नलिखित हैं-
- परमाणु नाभिक का आकार परमाणु के आकार से 10 गुना छोटा होता है अर्थात इसका आकार 10-5A या 10-15m होता है।
- परमाणु नाभिक धन-आवेशित होता है।
- परमाणु का संपूर्ण द्रव्यमान उसके नाभिक में स्थित होता है।
- परमाणु नाभिक के आस-पास अधिकतम स्थान खाली होता है।
![]()
प्रश्न 8.
परमाणु नाभिक व इलेक्ट्रॉन के गुण धर्मों की तुलना कीजिए।
उत्तर:
परमाणु नाभिक व इलेक्ट्रॉन के गुणधर्मों की तुलना निम्नलिखित प्रकार से है-
| परमाणु नाभिक | इलेक्ट्रॉन |
| 1. इस पर धन आवेश होता है। | 1. इस पर ऋण आवेश होता है। |
| 2. यह केंद्रीय भाग में स्थित होता है। | 2. यह नाभिक के चारों ओर चक्कर लगाता है। |
| 3. इसका द्रव्यमान परमाणु के द्रव्यमान के लंभग बराबर होता है। | 3. इसका द्रव्यमान हाइड्रोजन के परमाणु के \(\frac{1}{2000}\) वां भाग के बराबर होता है। |
प्रश्न 9.
परमाणु की संरचना को समझने में ई० रदरफोर्ड के क्या-क्या आधारभूत योगदान हैं?
उत्तर:
परमाणु की संरचना को समझने में ई० रदरफोर्ड ने परमाणु का एक मॉडल दिया जिसके अनुसार इलेक्ट्रॉन को नाभिक के चारों ओर पूर्व नियोजित कक्षाओं में ऐसे घूमते हुए माना गया था जिस प्रकार कि हमारे सौरमंडल में ग्रह सूर्य के चारों ओर निश्चित कक्षाओं में घूमते हैं। इसके अतिरिक्त उन्होंने बताया कि परमाणु का संपूर्ण द्रव्यमान उसके धन-आवेशित नाभिक में होता है जिसका आकार 10-15m होता है।
प्रश्न 10.
परमाणु के विभिन्न कोशों में इलेक्ट्रॉनों की संख्या सीमित होती है या असीमित? कृपया उदाहरण सहित विस्तार से समझाइए।
उत्तर:
परमाणु के विभिन्न कोशों में इलेक्ट्रॉनों की संख्या सीमित होती है। विभिन्न कोशों में इलेक्ट्रॉनों का वितरण क्वांटम समीकरण 2n- के आधार पर किया जाता है जहाँ n कोश के क्रमांक को दर्शाता है; जैसे-
| क्वांटम क्रमांक | कक्ष | अधिकतम इलेक्ट्रॉन |
| 1 | K | 2 x 1² = 2 |
| 2 | L | 2 x 2² = 8 |
| 3 | M | 2 x 3² = 18 |
| 4 | N | 2 x 4² = 32 |
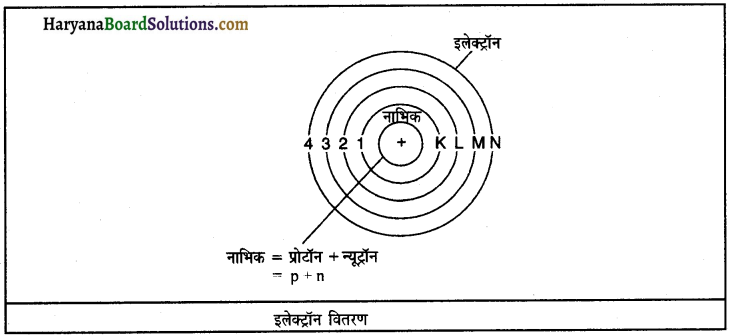
इलेक्ट्रॉन का यह वितरण बोर व बरी ने किया था। उनके अनुसार परमाणु के सबसे बाहरी कोश में आठ से अधिक इलेक्ट्रॉन नहीं समा सकते और बाह्यतम कोश से पहले कोश में 18 से अधिक इलेक्ट्रॉन नहीं समा सकते।
उदाहरण – हाइड्रोजन का एक ही कोश होता है जिसमें 1 इलेक्ट्रॉन होता है। हीलियम के 2 इलेक्ट्रॉन प्रथम कोश में चक्कर लगाते हैं। लीथियम के 3 इलेक्ट्रॉन हैं जिनमें से तीसरा इलेक्ट्रॉन दूसरे कोश में चला जाता है। इसी प्रकार कैल्शियम के परमाणु में 20 इलेक्ट्रॉन होते हैं जिनमें से प्रथम कोश में 2, दूसरे व तीसरे कोश में 8-8 तथा चौथे कोश में 2 इलेक्ट्रॉन होते हैं।
प्रश्न 11.
संयोजकता को परिभाषित कीजिए। यह परमाणु संरचना से कैसे संबंधित है?
उत्तर:
संयोजकता (Valency)-संयोजकता-इलेक्ट्रॉनों की संख्या परमाणु की संयोजकता कहलाती है, जबकि संयोजकता इलेक्ट्रॉन किसी परमाणु के बाह्यतम कोश के इलेक्ट्रॉन होते हैं। किसी तत्त्व की संयोजकता और उसके बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संयोजकता में निम्नलिखित संबंध हैं
- जिन तत्त्वों के बाह्यतम कोश में 1 से 4 इलेक्ट्रॉन होते हैं, उनकी संयोजकता बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संख्या के बराबर होती है।
- जिन तत्त्वों के बाह्यतम कोश में 5 से 8 इलेक्ट्रॉन होते हैं, उनकी संयोजकता (8-तत्त्व के बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों) की संख्या के बराबर होती है।
- हीलियम के बाह्यतम कोश में 2 इलेक्ट्रॉन होने के कारण इसका बाह्य कोश पूर्ण रूप से भरा होता है इसलिए हीलियम की संयोजकता शून्य होती है। इसी प्रकार अन्य सक्रिय गैसों की संयोजकता बाह्यतम कोश भरे होने के कारण शून्य है।
साधारणतः धातुओं की संयोजकता = बाह्य कोश में उपस्थित इलेक्ट्रॉनों की संख्या तथा अधातुओं की संयोजकता = B–बाह्य कोश में उपस्थित इलेक्ट्रॉनों की संख्या।
अतः हम कह सकते हैं कि संयोजकता परमाणु संरचना से संबंधित होती है, क्योंकि बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संयोजकता केवल परमाणु संरचना द्वारा पता चलती है।
प्रश्न 12.
संयोजी इलेक्ट्रॉन क्या होते हैं? Mg और AI में कितने संयोजी इलेक्ट्रॉन हैं?
उत्तर:
बाह्यतम कोश में विद्यमान इलेक्ट्रॉन संयोजी इलेक्ट्रॉन कहलाते हैं।
Mg तथा A1 के परमाणु क्रमांक क्रमशः 12 तथा 13 हैं। इनके इलेक्ट्रॉनिक विन्यास हैं-
Mg 2, 8, 2
Al 2, 8, 3
अतः हमें ज्ञात होता है कि Mg तथा A1 में संयोजी इलेक्ट्रॉनों की संख्या क्रमशः 2 तथा 3 है।
प्रश्न 13.
निम्नलिखित परमाणुओं के विभिन्न कोशों में इलेक्ट्रॉनों के वितरण का वर्णन कीजिए-
लीथियम, नाइट्रोजन, निऑन, मैग्नीशियम और सिलिकन।
उत्तर:
| तत्त्व | परमाणु संख्या | विभिन्न कोर्शों में इलेक्ट्रॉन वितरण | |||
| K | L | M | N | ||
| लीथियम (Li) | 3 | 2 | 1 | ||
| नाइट्रोजन (N) | 7 | 2 | 5 | ||
| निऑन (Ne) | 10 | 2 | 8 | ||
| मैग्नीशियम (Mg) | 12 | 2 | 8 | 2 | |
| सिलिकन (Si) | 14 | 2 | 8 | 4 | |
प्रश्न 14.
दिए गए संकेत \({ }_{20}^{40} \mathrm{Ca}\) में कैल्शियम की द्रव्यमान संख्या, परमाणु संख्या, इलेक्ट्रॉनिक विन्यास तथा नाभिक की संरचना लिखिए।
उत्तर:
द्रव्यमान संख्या = 40
परमाणु संख्या = 20
इलेक्ट्रॉनिक विन्यास = 2, 8, 8, 2
नाभिक की संरचना-
प्रोटॉनों की संख्या = 20
न्यूट्रॉनों की संख्या = 40 – 20 = 20
प्रश्न 15.
निम्नलिखित में कितने प्रोटॉन तथा कितने न्यूट्रॉन हैं?
(i) \({ }^{14} \mathrm{~N}_7\)
(ii) \({ }^{14} \mathrm{~C}_6\)
(iii) \({ }^{31} \mathbf{P}_{15}\)
उत्तर:
(i) \({ }^{14} \mathrm{~N}_7\)
परमाणु द्रव्यमान = 14
परमाणु क्रमांक = 7
प्रोटॉनों की संख्या = 7
न्यूट्रॉनों की संख्या = परमाणु द्रव्यमान – परमाणु क्रमांक
= 14 – 7 = 7
(ii) \({ }^{14} \mathrm{~C}_6\)
परमाणु द्रव्यमान = 14
परमाणु क्रमांक = 6
प्रोटॉनों की संख्या = 6
न्यूट्रॉनों की संख्या = परमाणु द्रव्यमान – परमाणु क्रमांक
= 14 – 6 = 8
(iii) \({ }^{31} \mathbf{P}_{15}\)
परमाणु द्रव्यमान = 31
परमाणु क्रमांक = 15
प्रोटॉनों की संख्या = 15
न्यूट्रॉनों की संख्या = परमाणु द्रव्यमान-परमाणु क्रमांक
31 – 15 = 16
प्रश्न 16.
परमाणु की रासायनिक उदासीनता तथा रासायनिक क्रियाशीलता का वर्णन करो।
उत्तर:
किसी परमाणु के रासायनिक गुण इस बात पर निर्भर करते हैं कि उसमें इलेक्ट्रॉन किस प्रकार व्यवस्थित हैं। जब किसी तत्त्व के परमाणु का बाह्यतम कोश पूर्ण रूप से भरा हुआ होता है तो वह तत्त्व रासायनिक क्रिया में भाग नहीं लेता अर्थात परमाणु रासायनिक रूप से उदासीन होता है; जैसे निऑन, आर्गन आदि।
जब किसी तत्त्व के परमाणु का बाह्यतम कोश पूर्ण रूप से भरा हुआ नहीं होता तो वह रासायनिक दृष्टि से क्रियाशील होता है। रासायनिक क्रियाशीलता का नियम इलेक्ट्रॉन वितरण प्रणाली पर निर्भर करता है।
प्रश्न 17.
उत्कृष्ट गैसें (निष्क्रिय गैसें) व्यवहार में निष्क्रिय क्यों होती हैं?
उत्तर:
निष्क्रिय गैसों का बाह्यतम कोश पूर्ण होता है। हीलियम में यह प्रथम कोश होने के कारण दो इलेक्ट्रॉनों के साथ पूर्ण हो जाता है। शेष उत्कृष्ट गैसों में यह 8-इलेक्ट्रॉनों से पूर्ण हो जाता है। इस प्रकार उत्कृष्ट गैसों की इलेक्ट्रॉन संरचना स्थायी होती है। इन तत्त्वों की निष्क्रियता का कारण इलेक्ट्रॉन के प्रवेश अथवा इलेक्ट्रॉन के निकलने में कठिनाई का होना है। इनमें से इलेक्ट्रॉन निकालने के लिए अत्यधिक ऊर्जा लगानी पड़ती है तथा इनकी इलेक्ट्रॉनों को ग्रहण करने की क्षमता भी नहीं होती।
प्रश्न 18.
अगर बोरॉन परमाणु दो समस्थानिकों \({ }_5 \mathbf{B}^{\mathbf{1 0}}\) (19%) तथा \({ }_5 \mathbf{B}^{\mathbf{1 1}}\) (81%) के रूप में है, तो बोरॉन के औसत परमाणु द्रव्यमान की गणना कीजिए।
उत्तर:
बोरॉन परमाणु दो समस्थानिकों \({ }_5 \mathbf{B}^{\mathbf{1 0}}\) (19%) तथा \({ }_5 \mathbf{B}^{\mathbf{1 1}}\) (81%) के रूपों में पाया जाता है जिनका द्रव्यमान क्रमशः 19% व 81% है।
इसलिए बोरॉन का औसत परमाणु द्रव्यमान होगा
= \(\left[10 \times \frac{19}{100}+11 \times \frac{81}{100}\right]\)
= \(\left[\frac{190}{100}+\frac{891}{100}\right]\)
= [1.90 + 8.91]
= [10.81] = 11
प्रश्न 19.
समस्थानिकों के मुख्य अभिलक्षण क्या-क्या हैं?
उत्तर:
समस्थानिकों के मुख्य अभिलक्षण-
- समस्थानिकों में प्रोटॉनों व इलेक्ट्रॉनों की संख्या समान होती है, परंतु न्यूट्रॉनों की संख्या भिन्न होती है।
- समस्थानिकों के रासायनिक गुण समान होते हैं।
- समस्थानिकों के भौतिक गुण भिन्न होते हैं जो परमाणु द्रव्यमान पर निर्भर करते हैं।
- समस्थानिकों के नाभिक पर समान आवेश होता है।
प्रश्न 20.
प्रकृति में क्लोरीन के समस्थानिक किस अनुपात में पाए जाते हैं तथा इनका औसत द्रव्यमान कैसे ज्ञात किया जाएगा?
उत्तर:
प्रकृति में क्लोरीन दो समस्थानिक रूपों में पाया जाता है, जिसका द्रव्यमान 35u और 37u, जो 3 : 1 के अनुपात में होते हैं।
क्लोरीन का औसत परमाणु द्रव्यमान होगा,
\(\left[\left(35 \times \frac{75}{100}+37 \times \frac{25}{100}\right)=\left(\frac{105}{4}+\frac{37}{4}\right)=\frac{142}{4}=35.5 \mathrm{u}\right]\)
इसका मतलब यह नहीं होता है कि क्लोरीन के परमाणु का द्रव्यमान एक भिन्नात्मक संख्या 35.5u है। इसका तात्पर्य यह हुआ कि अगर आप क्लोरीन की कुछ मात्रा लेते हैं, तो इसमें क्लोरीन के समस्थानिक होंगे और औसत द्रव्यमान 35.5u होगा।
निबंधात्मक प्रश्न
प्रश्न 1.
परमाणु के नाभिक की खोज किसने व कैसे की?
उत्तर:
परमाणु के नाभिक की खोज अरनेस्ट रदरफोर्ड नामक वैज्ञानिक ने अल्फा-कणों के प्रकीर्णन प्रयोग द्वारा की। इस प्रयोग में रदरफोर्ड ने सोने (स्वण) की पतली पन्नी पर तीव्रगामी अल्फा-कणों की बौछार की तथा उन्होंने पाया कि पत्ती से निकलकर अल्फा-कण सामान्यतः अपने मार्ग से एक डिग्री के चाप से विक्षेपित हो जाते हैं। अल्फा-कणों का एक छोटा भाग बड़े कोणीय विक्षेपण (चित्र में C1 व C2) से प्रकीर्णित होता है और बहुत कम प्रकीर्णित होकर वापस आ जाता है। यह सर्वविदित है
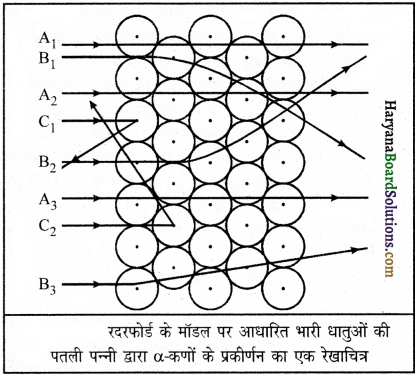
कि अल्फा-कण अत्यधिक ऊर्जावान कण हैं। उनका बड़े कोण का प्रकीर्णन यह प्रदर्शित करता है कि उनका प्रदार्थ के परमाणु के संपूर्ण द्रव्यमान से टकराव हुआ। इस प्रदर्शन के आधार पर उन्होंने निष्कर्ष निकाला कि-
- परमाणु का केंद्रीय भाग ठोस है तथा धन आवेशित है। नाभिक में परमाणु का लगभग संपूर्ण द्रव्यमान होता है।
- परमाणु के इस केंद्रीय भाग का आकार परमाणु की तुलना में बहुत कम है। रदरफोर्ड ने इस केंद्रीय भाग को नाभिक (केंद्रक) का नाम दिया।
प्रश्न 2.
नील्स बोर द्वारा प्रस्तावित परमाणु के मॉडल में उसके द्वारा कौन-सी नई संकल्पना स्थापित की गई?
उत्तर:
नील्स बोर ने सन् 1912 में परमाणु का एक मॉडल प्रस्तावित किया, जोकि मूल रूप से नई संकल्पना पर आधारित था। ये संकल्पनाएँ हैं-
1. इलेक्ट्रॉन नाभिक के चारों ओर निश्चित कक्षों में चक्कर लगाते हैं तथा प्रत्येक कक्ष का अर्धव्यास भिन्न होता है।
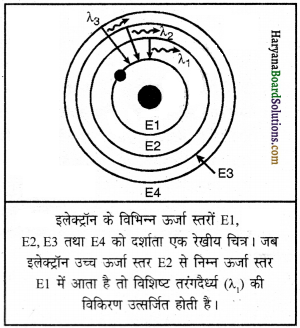
2. प्रत्येक कक्ष की एक निश्चित ऊर्जा होती है। इसके अनुसार नाभिक के पास वाले कोश में न्यूनतम तथा सबसे दूर वाले कोश में अधिकतम ऊर्जा होती है।
3. जब एक इलेक्ट्रॉन उच्च ऊर्जा स्तर से एक निम्न ऊर्जा स्तर की कक्षा में आता है तो ऊर्जा का अंतर विद्युत् चुंबकीय विकिरण अथवा प्रकाश के रूप में विकरित होता है।
4. नाभिक के चारों ओर विभिन्न कक्षाओं अथवा कोशों (Shells) में भरने के लिए इलेक्ट्रॉनों की संख्या निश्चित होती है; जैसे प्रथम में दो, दूसरे में आठ व तीसरे में अठारह इत्यादि।
5. इलेक्ट्रॉन विदुयत् चुंबकीय तरंगों के रूप में लगातार ऊर्जा विकिरण किए बिना स्थायी कक्षा में घूम सकता है।
6. एक निश्चित ऊर्जा स्तर वाले इलेक्ट्रॉन को यदि ऊर्जा प्रदान की जाए तो वह उच्च ऊर्जा स्तर वाले कक्ष या कोश में जा सकता है।
प्रश्न 3.
निम्नलिखित परमाणुओं की इलेक्ट्रॉनिक संरचनाओं में क्या-क्या समानताएं हैं?
(i) लीथियम, सोडियम, पोटैशियम
(ii) हीलियम, निऑन, ऑर्गन
(iii) बेरिलियम, मैग्नीशियम और कैल्शियम।
उत्तर:
(i) लीथियम, सोडियम व पोटैशियम-
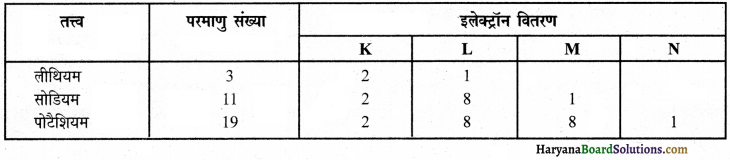
उपर्युक्त इलेक्ट्रॉन वितरण से पता चलता है कि लीथियम, सोडियम व पोटैशियम तीनों तत्त्वों के परमाणुओं के बाह्यतम कोश में केवल 1 इलेक्ट्रॉन पाया जाता है जिस कारण इन सब तत्त्वों की संयोजकता 1 है।
(ii) हीलियम, निऑन व ऑर्गन
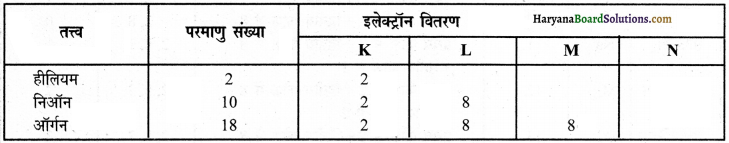
उपर्युक्त इलेक्ट्रॉन वितरण से पता चलता है कि हीलियम, निऑन व ऑर्गन तीनों तत्त्वों के परमाणुओं के बाह्यतम कोश पूर्ण भरे हुए हैं जिस कारण इनकी संयोजकता शून्य है अर्थात ये तीनों तत्त्व निष्क्रिय हैं।
(iii) बेरिलियम, मैग्नीशियम और कैल्शियम
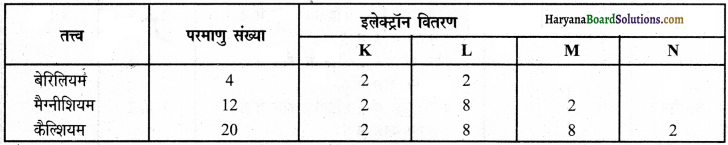
उपर्युक्त इलेक्ट्रॉन वितरण से पता चलता है कि बेरिलियम, मैग्नीशियम व कैल्शियम तीनों तत्त्वों के परमाणुओं के बाह्यतम कोश में 2 इलेक्ट्रॉन पाए जाते हैं, जिस कारण इन सब तत्त्वों की संयोजकता 2 है।
प्रश्न 4.
रेडियोऐक्टिव समस्थानिकों के प्रायोगिक अनुप्रयोगों को विशिष्ट उदाहरणों सहित समझाइए।
उत्तर:
रेडियोऐक्टिव समस्थानिकों के प्रायोगिक अनुप्रयोग निम्नलिखित हैं-
- इनसे पृथ्वी, चट्टान, पर्वत, उल्काओं आदि की आयु निर्धारित की जा सकती है।
- पेपर, काँच, प्लास्टिक आदि की मोटाई ज्ञात करने के लिए इनका उपयोग किया जाता है।
- पाइपों में दरारों का पता लगाने के लिए इनका प्रयोग किया जाता है।
- मशीनों में टूट-फूट का पता लगाने के लिए इनका प्रयोग किया जाता है।
- चिकित्सा क्षेत्र में विभिन्न रोगों के इलाज के लिए समस्थानिकों का प्रयोग किया जाता है; जैसे Co-60 कैंसर के लिए; आयोडीन का समस्थानिक थायरॉइड के लिए, फॉस्फोरस का समस्थानिक रक्त कैंसर के लिए आदि।
- रेडियोऐक्टिव समस्थानिकों से निकले विकिरणों को उच्च बीमारी प्रतिरोधक के रूप में गेहूँ, धान, पटसन तथा मूंगफली की खेती में प्रयोग किया जाता है।
- उर्वरकों को सुधारने के लिए समस्थानिकों का प्रयोग किया जाता है। Fe-59 समस्थानिक का प्रयोग अरक्तता की जाँच के लिए किया जाता है।
![]()
प्रश्न 5.
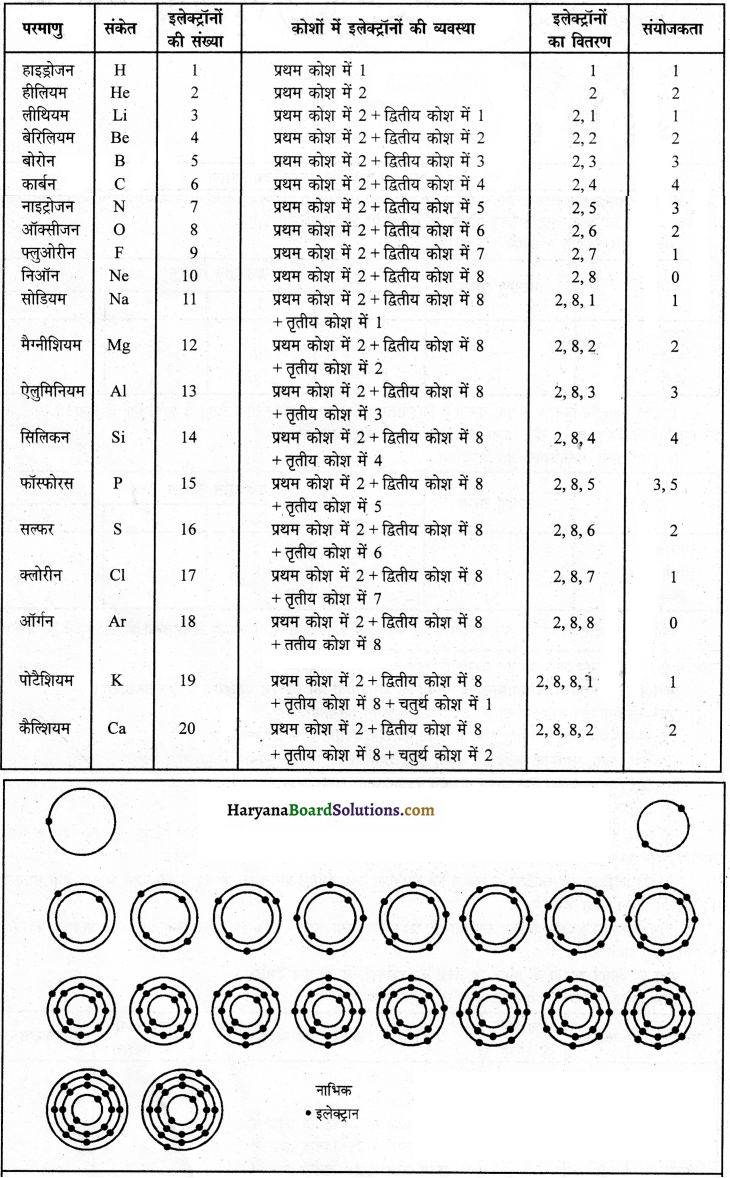
आवर्त सारणी के प्रथम 20 तत्त्वों का इलेक्ट्रॉनिक वितरण दर्शाइए।
उत्तर:
आवर्त सारणी के प्रथम 20 तत्त्वों का इलेक्ट्रॉनिक वितरणइलेक्ट्रॉनों
प्रयोगात्मक कार्य
क्रियाकलाप 1.
दो उदाहरण देकर स्पष्ट करें कि दो वस्तुओं को रगड़ने पर आवेश उत्पन्न होता है?
कार्य-विधि-
(i) एक कंघी लेकर उसे सूखे बालों से रगड़ो। अब कागज के छोटे-छोटे टुकड़ों के पास उसे ले जाने पर आप देखेंगे कि वह कागज के टुकड़ों को अपनी ओर आकर्षित करती है। इससे सिद्ध होता है कि दो वस्तुओं को आपस में रगड़ने पर आवेश उत्पन्न होता है।
(ii) एक काँच की छड़ को सिल्क के कपड़े पर रगड़िए और उस छड़ को हवा के गुब्बारे के पास लाने पर वह उसकी ओर आकर्षित हो जाएगा। इससे सिद्ध होता है कि काँच की छड़ को सिल्क के कपड़े पर रगड़ने से काँच की छड़ आवेशित हो जाती है।
क्रियाकलाप 2.
रदरफोर्ड के अल्फा कण-प्रकीर्णन को एक क्रियाकलाप द्वारा समझाएँ।
कार्य-विधि-रदरफोर्ड के अल्फा कण-प्रकीर्णन को समझने के लिए खुले मैदान में एक क्रियाकलाप करते हैं। मान लें कि एक बच्चा अपनी आँखों को बंद किए हुए एक दीवार के सामने खड़ा है। उसे दीवार पर कुछ दूरी से पत्थर फेंकने को कहें। प्रत्येक पत्थर के दीवार से टकराने के साथ ही वह एक आवाज सुनेगा।
अगर वह इसे दस बार दोहराएगा तो वह दस बार आवाज़ सुनेगा। लेकिन जब आँख बंद किया हुआ बच्चा तार से घिरी हुई चारदीवारी पर पत्थर फेंकेगा, तो अधिकतर पत्थर उस घेरे पर नहीं टकराएंगे और कोई आवाज़ सुनाई नहीं पड़ेगी। क्योंकि घेरे के बीच में बहुत सारे खाली स्थान हैं, जिनके बीच से पत्थर निकल जाता है।
अध्याय का तीव्र अध्ययन
1. केनाल रे की खोज किस वैज्ञानिक ने की?
(A) डाल्टन
(B) जे.जे. टॉमसन
(C) ई. गोल्डस्टीन ने
(D) बोर ने
उत्तर:
(C) ई. गोल्डस्टीन ने
2. इलेक्ट्रॉन की खोज किस वैज्ञानिक ने की?
(A) टॉमसन ने
(B) डाल्टन ने
(C) गोल्डस्टीन ने
(D) नील्स बोर ने
उत्तर:
(A) टॉमसन ने
3. जे.जे. टॉमसन को नोबेल पुरस्कार कब मिला?
(A) 1878 में
(B) 1902 में
(C) 1906 में
(D) 1912 में
उत्तर:
(C) 1906 में
4. यह किस वैज्ञानिक ने प्रस्तावित किया कि परमाणु धन आवेशित गोले का बना होता है और इलेक्ट्रॉन उसमें फँसे होते हैं?
(A) रदरफोर्ड ने
(B) टॉमसन ने
(C) डाल्टन ने
(D) नील्स बोर ने
उत्तर:
(B) टॉमसन ने
5. ई. रदरफोर्ड ने ………………….. की खोज की।
(A) परमाणु
(B) नाभिक
(C) प्रोटॉन
(D) न्यूट्रॉन
उत्तर:
(B) नाभिक
6. नाभिक की त्रिज्या, परमाणु की त्रिज्या से ………………….. गुणा छोटी होती है।
(A) 105
(B) 104
(C) 103
(D) 102
उत्तर:
(A) 105
7. किस वैज्ञानिक ने बताया कि जब इलेक्ट्रॉन विविक्त कक्षा में चक्कर लगाते हैं तो उनकी ऊर्जा का विकिरण नहीं होता?
(A) नील्स बोर ने
(B) रदरफोर्ड ने
(C) डाल्टन ने
(D) टॉमसन ने
उत्तर:
(A) नील्स बोर ने
8. ‘एटॉमिक थ्योरी’ नामक पुस्तक का लेखक कौन है?
(A) रदरफोर्ड
(B) टॉमसन
(C) नील्स बोर
(D) (A) और (B) दोनों
उत्तर:
(C) नील्स बोर
9. परमाणु के नाभिक पर पाया जाने वाला आवेश होता है-
(A) शून्य आवेश
(B) ऋण आवेश
(C) धन आवेश
(D) कोई आवेश नहीं
उत्तर:
(C) धन आवेश
10. न्यूट्रॉन की खोज कब हुई?
(A) सन् 1902 में
(B) सन् 1912 में
(C) सन् 1922 में
(D) सन् 1932 में
उत्तर:
(D) सन् 1932 में
11. न्यूट्रॉन की खोज किसने की?
(A) जे. चैडविक ने
(B) रदरफोर्ड ने
(C) टॉमसन ने
(D) नील्स बोर ने
उत्तर:
(A) जे. चैडविक ने
12. न्यूट्रॉन का गुण नहीं है-
(A) अनावेशित
(B) द्रव्यमान प्रोटॉन के समान
(C) नाभिक में पाया जाता है
(D) इस पर ऋणावेश होता है
उत्तर:
(D) इस पर ऋणावेश होता है
![]()
13. इलेक्ट्रॉन का गुण नहीं है-
(A) धनावेशित
(B) e– के द्वारा दर्शाया जाता है
(C) ऋणावेशित
(D) द्रव्यमान नगण्य होता है
उत्तर:
(A) धनावेशित
14. प्रोटॉन का गुण नहीं है-
(A) नाभिक में पाया जाता है
(B) p+ के द्वारा दर्शाया जाता है
(C) द्रव्यमान 1 इकाई
(D) ऋणावेशित
उत्तर:
(D) ऋणावेशित
15. परमाणु के पहले इलेक्ट्रॉन कक्ष में अधिक से अधिक ………………….. इलेक्ट्रॉन समा सकते हैं।
(A) 2
(B) 8
(C) 18
(D) 32
उत्तर:
(A) 2
16. तीसरे इलेक्ट्रॉन कक्ष में इलेक्ट्रॉनों की अधिकतम संख्या हो सकती है-
(A) 8
(B) 12
(C) 18
(D) 32
उत्तर:
(C) 18
17. चौथे इलेक्ट्रॉन कक्ष में इलेक्ट्रॉनों की संख्या हो सकती है-
(A) 8
(B) 18
(C) 32
(D) 2
उत्तर:
(C) 32
18. उस तत्त्व की परमाणु संख्या क्या होगी जिसके M कोश में 6 इलेक्ट्रॉन हैं?
(A) 8
(B) 16
(C) 24
(D) 34
उत्तर:
(B) 16
19. निऑन के बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संख्या क्या होती है?
(A) 2
(B) 8
(C) 18
(D) 32
उत्तर:
(B) 8
20. निम्न में से कौन-सा तत्त्व उत्कृष्ट गैस है-
(A) निऑन
(B) ऑर्गन
(C) क्रिप्टॉन
(D) उपर्युक्त सभी
उत्तर:
(D) उपर्युक्त सभी
21. फ्लोरीन के सबसे बाहरी कोश में उपस्थित इलेक्ट्रॉनों की संख्या होती है-
(A) 2
(B) 5
(C) 7
(D) 17
उत्तर:
(C) 7
22. सबसे बाहरी कक्ष में इलेक्ट्रॉनों की संख्या हो सकती है-
(A) 2
(B) 8
(C) 18
(D) 32
उत्तर:
(B) 8
23. हाइड्रोजन में न्यूट्रॉनों की संख्या कितनी होती है?
(A) शून्य
(B)
(C) दो
(D) चार
उत्तर:
(A) शून्य
24. प्रोटियम किस तत्त्व का समस्थानिक है?
(A) हीलियम का
(B) हाइड्रोजन का
(C) लीथियम का
(D) नाइट्रोजन का
उत्तर:
(B) हाइड्रोजन का
25. ट्राइटियम का प्रतीक है-
(A) \({ }_1^1 \mathrm{H}\)
(B) \({ }_2^1 \mathrm{H}\)
(C) \({ }_3^1 \mathrm{H}\)
(D) \({ }_4^1 \mathrm{H}\)
उत्तर:
(C) \({ }_3^1 \mathrm{H}\)
26. ड्यूटीरियम किस तत्त्व का समस्थानिक है?
(A) यूरेनियम का
(B) लीथियम का
(C) हीलियम का
(D) हाइड्रोजन का
उत्तर:
(D) हाइड्रोजन का
27. …………………. का उपयोग परमाणु भट्ठी में ईंधन के रूप में किया जाता है।
(A) लीथियम
(B) हीलियम
(C) यूरेनियम
(D) बेरिलियम
उत्तर:
(C) यूरेनियम
28. किस तत्त्व के समस्थानिक का उपयोग कैंसर के उपचार में किया जाता है?
(A) कोबाल्ट
(B) आयोडीन
(C) क्लोरीन
(D) बोरॉन
उत्तर:
(A) कोबाल्ट
29. …………………… रोग के इलाज में आयोडीन के समस्थानिक का उपयोग होता है।
(A) कैंसर
(B) थैलीसिमिया
(C) अरक्तता
(D) घेघा
उत्तर:
(D) घेघा
30. किसी परमाणु का K और L कोश भरा हो तो इसमें इलेक्ट्रॉन होंगे
(A) 2
(B) 8
(C) 10
(D) 18
उत्तर:
(C) 10
31. रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग किसकी खोज के लिए उत्तरदायी है?
(A) परमाणु केंद्रक
(B) इलेक्ट्रॉन
(C) प्रोटॉन
(D) न्यूट्रॉन
उत्तर:
(A) परमाणु केंद्रक
32. CF आयन में इलेक्ट्रॉनों की संख्या है-
(A) 16
(B) 8
(C) 17
(D) 18
उत्तर:
(D) 18
33. ‘दि डिस्क्रिप्शन ऑफ नेचर’ नामक पुस्तक के लेखक कौन हैं?
(A) ई० रदरफोर्ड
(B) जेजेन्टॉमसन
(C) नील्स बोर
(D) उपर्युक्त सभी
उत्तर:
(C) नील्स बोर
34. परमाणु का मूल कण नहीं है-
(A) इलेक्ट्रॉन
(B) पोजिट्रॉन
(C) प्रोटॉन
(D) न्यूट्रॉन
उत्तर:
(B) पोजिट्रॉन
35. क्लोरीन का सही इलेक्ट्रॉनिक विन्यास निम्न में से कौन-सा है?
(A) 2, 7, 8
(B) 2, 8, 7
(C) 7, 8, 2
(D) 1, 8, 8
उत्तर:
(B) 2, 8, 7