Haryana State Board HBSE 11th Class Chemistry Solutions Chapter 10 s-ब्लॉक तत्त्व Textbook Exercise Questions and Answers.
Haryana Board 11th Class Chemistry Solutions Chapter 10 s-ब्लॉक तत्त्व
प्रश्न 1.
क्षारीय धातुओं के सामान्य भौतिक तथा रासायनिक गुण क्या हैं ?
उत्तर:
क्षार धातुओं के भौतिक गुण:
(1) क्षार धातुएँ बहुत ही नरम तथा चाँदी के समान श्वेत होती है।
(2) घनत्व (Density) – क्षार धातुओं का बड़ा आकार होने के कारण इनका घनत्व कम होता है, जो लीथियम से सीजियम की ओर नीचे जाने पर कम होता जाता है, यद्यपि पोटैशियम धातु सोडियम की तुलना में हल्की होती है।
(3) क्वथनांक एवं गलनांक (Boiling and melting point) – क्षार धातुओं के क्वथनांक एवं गलनांक बहुत कम होते हैं क्योंकि क्षार धातुओं का परमाण्विक आकार अधिक होता है। इस कारण क्रिस्टल जालक में इनकी आबन्धन ऊर्जा का मान भी कम होता है। वर्ग में नीचे जाने पर परमाणुओं का आकार बढ़ता जाता है फलस्वरूप इनके क्वथनांक एवं गलनांक के मान भी कम होते जाते हैं।
Li > Na > K > Rb > Cs > Fr (क्वथनांक एवं गलनांक)
(4) ज्वाला परीक्षण (Flame test) – जब क्षार धातुओं के लवण ज्वाला में गर्म किये जाते हैं तो ये एक विशेष प्रकार के रंग देते हैं। ज्वाला की ऊष्मा से बाह्यतम् कक्ष का इलेक्ट्रॉन उत्तेजित हो जाता है तथा निम्न ऊर्जा स्तर से उच्च ऊर्जा स्तर में पहुँच जाता है। जब यह उत्तेजित इलेक्ट्रॉन वापस अपने कक्ष में पहुँचता है तो ऊर्जा को प्रकाश के रूप में निकालता है तथा ज्वाला में एक विशेष रंग दिखाई देता है।

क्षार धातुओं में लीथियम का आकार सबसे छोटा होता है। इस कारण इलेक्ट्रॉनों को उत्तेजित करने के लिये अधिकतम ऊर्जा की आवश्यकता होती है जबकि सोडियम के लिये इस ऊर्जा का मान लीथियम से कम होता है। इस प्रकार वर्ग में नीचे जाने पर उत्तेजन के लिए आवश्यक ऊर्जा के मान में कमी आती जाती है। यही कारण है कि तत्वों की ज्वाला का रंग भिन्न-भिन्न होता है।
(5) ऑक्सीकरण अवस्था (Oxidation state) – समूह-1 के तत्व संयोजी कोश में एक इलेक्ट्रॉन की उपस्थिति होने के कारण +1 ऑक्सीकरण अवस्था को प्रदर्शित करते हैं।
![]()
(6) धन विद्युती गुण (Electropositive Property) – किसी भी तत्व की इलेक्ट्रॉनों को त्यागने की प्रवृत्ति धन विद्युती गुण (Electropositive Property) कहलाती है। क्षार धातुओं के धन विद्युती गुण का मान आवर्त सारणी में अधिकतम होता है क्योंकि इनकी आयनन एन्थैल्पी काफी कम होती है। इलेक्ट्रॉनों को त्यागने की प्रवत्ति वर्ग में ऊपर से नीचे जाने पर अधिक होती जाती है क्योंकि क्षार धातुओं का परमाण्विक आकार बढ़ता जाता है इसके साथ-साथ आयनन विभव भी कम होता जाता है।
Li < Na < K < Rb < Cs < Fr (धन विद्युती गुण)
नोट – आवर्त सारणी में ‘Fr’ सबसे अधिक धन विद्युती होता है।
क्षार धातुएँ एक इलेक्ट्रॉन को त्याग कर एकल संयोजी धनायन बनाती हैं।
M → M+ + e–
(7) वैद्युत ॠणात्मकता (Electro negativity) – किसी भी तत्व की वैद्युत ऋणात्मकता उस तत्व द्वारा किसी यौगिक में आबन्धित इलेक्ट्रॉनों को अपनी ओर खींचने की प्रवृत्ति होती है। क्षार धातुओं की वैद्युत ऋणात्मकता सबसे कम होती है। समूह में ऊपर से नीचे आने पर विद्युत ऋणात्मकता का मान घटता जाता है क्योंकि परमाण्विक त्रिज्या का मान बढ़ता जाता है।
Li > Na > K > Rb > Cs > Fr ( वैद्युत ऋणात्मकता)
(8) अपचायक गुण (Reducing property) – क्षार धातुओं के आयनन विभव निम्न होते हैं। इसलिये ये आसानी से इलेक्ट्रॉन त्याग देते हैं, अत: ये प्रबल अपचायक हैं। ऊपर से नीचे आने पर अपचायक गुण बढ़ता जाता है।
Na < K < Rb < Cs < Li
अपवाद – Li क्षार धातुओं में सबसं प्रबलतम अपचायक है। इसके इस अपवाद को हम निम्न प्रकार समझ सकते हैं। इस पूरी प्रक्रिया में तीन तरह की ऊर्जा मुख्य रूप से उत्तरदायी होती है।
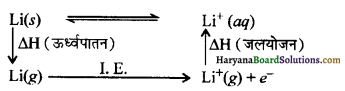
इस पूरी प्रक्रिया में तीन तरह की ऊर्जा मुख्य रूप से उत्तरदायी होरी है।
- ऊर्ध्वपातन ऊर्जा (Sublimation energy)
- आयनन ऊर्जा (Ionisation energy)
- जलयोजन ऊर्जा (Hydration energy)
इन सभी ऊर्जाओं में से ऊर्ध्वपातन एवं आयनन ऊर्जा हमारे द्वारा प्रदान की जाती है जबकि जलयोजन ऊर्जा अभिक्रिया से निकलती है। अत: यह ऊष्माक्षेपी ऊर्जा है। Li में जलयोजन ऊर्जा का मान ऊर्ध्वपातन तथा आयनन ऊर्जा की अपेक्षा बहुत अधिक होता है जिससे पूर्ण अभिक्रिया ऊष्माक्षेपी हो जाती है तथा Li सबसे प्रबल अपचायक बन जाता है।
(9) प्रकाश वैद्युत प्रभाव (Photo electric effect) – Li के अतिरिक्त सभी क्षार धातुएँ प्रकाश विद्युत प्रभाव प्रदर्शित करती हैं। “जब किसी धातु की सतह पर निश्चित आवृत्ति की किरणें टकराती हैं तो धातु की सतह से इलेक्ट्रॉन उत्सर्जित होकर निकलते हैं, इसे प्रकाश विद्युत प्रभाव कहते हैं।”
या
“धातु की सतह पर फोटॉन के प्रहार से इलेक्ट्रॉनों का उत्सर्जन प्रकाश विद्युत प्रभाव कहलाता है।” प्रकाश विद्युत प्रभाव का कारण क्षार धातुओं की न्यूनतम आयनन ऊर्जा है। लीथियम यह प्रभाव नहीं दिखाता क्योंकि इसकी आयनन ऊर्जा का मानु अधिक होता है। क्षार धातुओं के भौतिक गुणों को हम सारणी 10.1 में सूचीबद्ध कर सकते हैं।
क्षार धातुओं के रासायनिक गुण:
क्षार धातुएँ बहुत अधिक क्रियाशील होती हैं क्योकि इनकी आयनन ऊर्जा का मान बहुत कम होता है। क्षार धातुओं के रासायनिक गुण निम्न हैं-
(1) डाई हाइड्रोजन से अभिक्रिया (Reaction with dihydrogen) – लगभग 673K (लीथियम के लिए 1073K) पर क्षार धातुएँ डाइहाइड्रोजन से अभिक्रिया करके हाइड्राइड बनाती हैं। सभी क्षार धातुओं के हाइड्राइड रंगहीन, क्रिस्टलीय एवं आयनिक होते हैं। इन हाइड्राइडों के गलनांक उच्च होते हैं।

क्षार धातुओं के हाइड्राइडों की अपचायक क्षमता नीचे जाने पर बढ़ती जाती है क्योंकि बन्ध ऊर्जा का मान कम होता जाता है जिसके कारण धातु तथा हाइड्रोजन के मध्य का बन्ध आसानी से टूट जाता है।
LiH < NaH < KH < RbH < CsH (अपचायक गुण)
क्षार धातुओं के हाइड्राइड कार्बनिक यौगिकों के लिये प्रबल अपचायक का कार्य करते हैं। एक प्रबल अपचायक लीथियम एल्युमीनियम हाइड्राइड को निम्न प्रकार बनाया जा सकता है-

क्षार धातुओं के हाइड्राइड जल से अभिक्रिया करने पर डाइहाइड्रोजन गैस उत्पन्न करते हैं।

क्षार धातुओं के हाइड्राइडों का आयनिक अभिलक्षण Li से Cs तक बढ़ता जाता है।
LiH < NaH < KH < RbH < CsH (आयनिक अभिलक्षण)
इसका कारण कम आयनन ऊर्जा है। कम आयनन ऊर्जा के कारण क्षार धातुओं के परमाणु संयोजी इलेक्ट्रॉनों को आसानी से मुक्त कर हाइड्रोजन परमाणु को दे देते हैं जिसके कारण आयनिक हाइड्राइड (MH) बनता है।
(2) द्रव अमोनिया में विलेयता (Solubility in liquid ammonia)-क्षार धातुएँ द्रव अमोनिया में घुलनशील होती हैं। ये अमोनिया के साथ गहरे नीले रंग का विलयन बनाती हैं जो कि विद्युत का सुचालक होता है। क्षार धातुएँ कम आयनन ऊर्जा के कारण द्रव अमोनिया में आयनीकृत हो जाती हैं तथा अमोनीकृत धनायन एवं अमोनीकृत ऋणायन बनाती हैं।

क्षार धातुओं का अमोनिया में नीले रंग के विलयन के बनने का कारण अमोनीकृत इलेक्ट्रॉन होते हैं जो कि दृश्य प्रकाश क्षेत्र की संगत ऊर्जा का अवशोषण करके विलयन को नीला रंग प्रदान करते हैं। अमोनीकृत विलयन अनुचुम्बकीय (paramagnetic) होता है, जो कुछ समय पड़े रहने पर हाइड्रोजन को मुक्त करता है। फलस्वरूप विलयन में ऐमाइड बनता है।
M+(am) + e– + NH3(l) → MNH2(am) + 1/2H2(g)
जहाँ ‘am’ अमोनीकृत विलयन दर्शाता है। सान्द्र विलयन में नीला रंग ब्रॉन्ज रंग में बदल जाता है और विलयन प्रतिचुम्बकीय (diamagnetic) हो जाता है।
(3) वायु के साथ अभिक्रियाशीलता (Reactivity with air) – क्षार धातुएँ वायु की उपस्थिति में मलिन (exposed) हो जाती हैं; क्योंकि वायु की उपस्थिति में इन पर ऑक्साइड तथा हाइड्रॉक्साइड की पर्त बन जाती है। ये ऑक्सीजन में तीव्रता से जलकर ऑक्साइड बनाती हैं। लीथियम और सोडियम क्रमशः मोनोऑक्साइड तथा परॉक्साइड का निर्माण करती हैं, जबकि अन्य धातुओं द्वारा सुपर ऑक्साइड आयन का निर्माण होता है। सुपर ऑक्साइड \(\mathrm{O}_2^{-}\) बड़े धनायनों; जैसे K+, Rb+ तथा Cs+ की उपस्थिति में स्थायी होता है।
4Li + O2 → 2Li2O (ऑक्साइड)
2Na +O2 → Na2O2 (परॉक्साइड)
M + O2 → MO2 (सुपर ऑक्साइड) (M = K, Rb, Cs)
इन सभी ऑक्साइडो में क्षार की ऑक्सीकरण अवस्था +1 होती है। लीथियम अपवाद स्वरूप वायु में उपस्थित नाइट्रोजन से अभिक्रिया करके नाइट्राइड, Li3N बना लेता है। इस प्रकार लीथियम भिन्न स्वभाव प्रदरित करता है। क्षार धातुओं की ऑक्सीजन के साथ अभिक्रियाशीलता Li से Cs तक बढ़ती जाती है क्योंकि आयनन ऊर्जा का मान कम होता जाता है।
क्षार धातुओं के ऑक्साइडों का स्थायित्व अभिक्रिया में भाग लेने वाले धनायनों एवं ऋणायनों के आकार एवं इन पर उपस्थित आवेशों पर निर्भर करता है। एक बड़े आकार का धनायन सदैव बड़े आकार के ऋणायन को स्थायी करेगा जबकि एक छोटे आकार का धनायन, एक छोटे आकार के ऋणायन को स्थायी करेगा। यही कारण है कि लीथियम आयन (Li+) आकार में छोटा होने के कारण एक छोटे ऋणायन जैसे ऑक्साइड आयन (O2-) के साथ संयोजन कर ऑक्साइड बनाता है। इसी प्रकार सोडियम आयन (Na+) का आकार बड़ा होता है।
इस कारण यह बड़े “आकार के परॉक्साइड आयन (\(\mathrm{O}_2{ }^{2-}\)) के साथ संयोजन करके परॉक्साइड बनाता है जबकि K+, Rb+, Cs+ अधिक बड़े आकार के होने के कारण सुपर ऑक्साइड आयन (\(\mathrm{O}_2^{-}\)) से क्रिया कर सुपर ऑक्साइड बनाते हैं।
ऑक्साइड, परऑक्साइड एवं सुपर ऑक्साइड आयनों की संरचना निम्न है-

ऑक्साइड एवं परॉक्साइड आयन अयुग्मित इलेक्ट्रॉनों की अनुपस्थिति के कारण प्रतिचुम्बकीय प्रकृति के होते हैं जबकि सुपर ऑक्साइड आयन अयुग्मित इलेक्ट्रॉन की उपस्थिति के कारण अनुचुम्बकीय प्रकृति का होता है।
(4) हैलोजनों से अभिक्रियाशीलता (Reactivity with halogens)-क्षार धातुएँ हैलोजन से प्रबल अभिक्रिया करके आयनिक हैलाइड बनाती हैं।
![]()
(M = Li, Na, K, Rb, Cs)
धातु की क्रियाशीलता का क्रम :
Li < Na < K < Rb <Cs
आयनन ऊर्जा कम होने के कारण क्रियाशीलता समूह में नीचे जाने पर बढ़ती है।
हैलोजनों की क्रियाशीलता का क्रम :
F2 > Cl2 > Br2 > I2
विद्युत ऋणात्मकता का मान वर्ग में नीचे जाने पर घटता जाता है अतः क्रियाशीलता कम होती जाती है।
यद्यपि लीथियम के हैलाइड आंशिक रूप से सहसंयोजक होते हैं। इसका कारण लीथियम की उच्च ध्रुवण-क्षमता है। (धनायन के कारण ऋणायन के इलेक्ट्रॉन अभ्र का विकृत होना ‘ध्रुवणता’ (polarisation) कहलाता है।) लीथियम आयन का आकार छोटा होता है; अतः यह हैलाइड आयन के इलेक्ट्रॉन अभ्र को विकृत करने की अधिक क्षमता दर्शाता है।
चूँकि बड़े आकार का ऋणायन आसानी से विकृत हो जाता है, इसलिए लीथियम आयोडाइड सहसंयोजक प्रकृति सबसे अधिक दर्शां हैं। अन्य क्षार धातुएँ आयनिक प्रवृत्ति की होती हैं। इनके गलनांक तथा क्वथनांक उच्च होते हैं। गलित हैलाइड विद्युत के सुचालक होते है। इनका प्रयोग क्षार धातुएँ बनाने में किया जाता है।
ध्रुवणता को हम फर्जॉन के नियम (Fajan’s Rule) द्वारा समझ सकते हैं। इसके अनुसार जिन यौगिको में निम्न प्रकृति होती है वे अधिक ध्रुवणता को प्रदर्शित करते हैं अर्थात् उनमें सहसंयोजक प्रकृति अधिकत। में पायी जाती है।
- धनायन का आकार छोटा होना चाहिये।
- ऋणायन का आकार बड़ा होना चाहिये।
- धनायन एवं ऋणायन पर आवेश अधिक होना चाहिये।
उपरोक्त नियम के आधार पर हम हैलाइडों में उपस्थित आयनिक प्रवृत्ति को आसानी से समझ सकते हैं।
आयनिक प्रवृत्ति-
LiCl < NaCl < KCl < RbCl < CsCl < FrCl सहसंयोजक प्रवत्ति- LiCl > NaCl > KCl > RbCl > CsCl > FrCl
(5) जल से अभिक्रिया (Reaction with water) – क्षार धातुओं के ऑक्साइड, परॉक्साइड तथा सुपर ऑक्साइड जल में विलेय होकर घुलनशील हाइड्रॉक्साइड बनाते हैं, जिन्हें क्षारक (Alkalies) कहा जाता है। उदाहरणार्थ-

यद्यपि लीथियम के मानक इलेक्ट्रोड विभव (EΘ) का मान अधिकतम ऋणात्मक होता है, परन्तु जल के साथ इसकी अभिक्रियाशीलता सोडियम की तुलना में कम है, लीथियम के इस व्यवहार का कारण इसका छोटा आकार तथा अत्यधिक जलयोजन ऊर्जा का होना है। अन्य क्षार धातुएँ जल के साथ विस्फोटक अभिक्रिया करती हैं।
चूँकि अभिक्रिया उच्च ऊष्माक्षेपी होती है तथा विमुक्त होने वाली हाइड्रोजन आग पकड़ लेती है, इसलिए क्षार धातुओं को जल के सम्पर्क में नहीं रखते। यही कारण है कि लीथियम को छोड़कर सभी क्षार धातुओं को मिट्टी के तेल में रखते है। चूँक लीथियम का घनत्व कम होता है जिसके कारण यह मिट्टी के तेल की सतह पर तैरने लगता है, इस कारण इसे पैराफीन मोम में रखा जाता है।
क्षार धातुओं के हाइड्रॉक्साइड प्रबल क्षारीय प्रकृति के होते हैं। क्योंकि इनकी आयनन ऊर्जा कम होती है।
LiOH < NaOH < KOH < RbOH < CsOH (क्षारीय प्रकृति)
(6) क्षार धातुओं के अपचायक गुण (Reducing properties of slkali metals) – क्षार धातुएँ प्र बल अपचायक होती हैं क्योंकि जो तत्व जितनी आसानी से इलेक्ट्रॉनों का त्याग करता है वह उतना १े अच्छा अपचायक होता है। क्षार धातुओं की आयनन ऊर्जा का मान कम होता है अतः ये अच्छी अपचायक होती हैं।
उदाहरणार्थ-

![]()
प्रश्न 2.
क्षारीय मृदा धातुओं के सामान्य अभिलक्षण एवं गुणों में आवर्तिता की विवेचना कीजिए।
उत्तर:
क्षारीय मृदा धातुओं के यौगिकों के सामान्य अभिलक्षण निम्न प्रकार होते हैं।
(1) ऑक्साइड (Oxides)-ऑक्साइडों में BeO, जोकि सहसंयोजी है को छोड़ शेष सभी धातुओं के ऑक्साइड सफेद क्रिस्टलीय आयनिक ठोस हैं। ऑक्साइडों की क्षारीय प्रबलता समूह से नीचे जाने पर बढ़ती है। BeO < MgO < CaO < SrO < BaO ( क्षारीय प्रबलता)
ऑक्साइड जल से क्रिया कर अल्प विलेय हाइड्रॉक्साइड बनाते हैं।
MO + H2O → M(OH)2
यहाँ (M = Mg, Ca, Sr, Ba, Ra)
(2) हाइड्रॉक्साइड (Hydroxides) – इनके हाइड्रॉक्साइड प्रबल क्षारीय होते हैं। ये जल में विलेय होते हैं। क्षारीय मृदा धातुओं के हाइड्रॉक्साइडों को गर्म करने पर ये धातु ऑक्साइड एवं जल में अपघटित हो जाते हैं।
![]()
क्षारीय मृदा धातुओं के हाइड्रांक्साइडों के जलीय विलयन में CO2 गैस प्रवाहित करने से उनके कार्बोनेट अवक्षेपित हो जाते हैं। CO2 गैस की अधिकता में प्रवाहित करने से उनके कार्बोनेट जल में विलेय बाई कार्बोनेटों में बदल जाते हैं।

क्षारीय मृदा धातुओं के ऑक्साइड धातुओं के संगत हाइड्रॉक्साइडों की तुलना में कम स्थायी होते हैं। हाइड्रॉक्साइडों का तापीय स्थायित्व, क्षारीय गुण, पानी में विलेयता ग्रुप में नीचे जाने पर बढ़ती जाती है क्योंकि धनायन का आकार नीचे बढ़ने पर बढ़ता जाता है जिससे M-OH बन्ध क्षीण होता जाता है और क्षारीय गुण बढ़ जाता है।
Be(OH)2 < Mg(OH)2 < Ca(OH)2 < Sr(OH)2 < Ba(OH)2
समूह में नीचे जाने पर आयनिक प्रवृति बढ़ती जाती है अतः जालक ऊर्जा बढ़ती है और तापीय स्थायित्व भी बढ़ जाता है।
(3) हैलाइड (Halide) – बेरीलियम हैलाइड के अतिरिक्त अन्य धातुओं के हैलाइडों की प्रकृति आयनिक होती है। बेरीलियम के हैलाइड सह संयोजक होते हैं। एवं कार्बनिक विलायकों में विलेय होते हैं। ठोस अवस्था में बेरीलियम क्लोराइड की शृखला संरचना होती है।
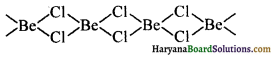
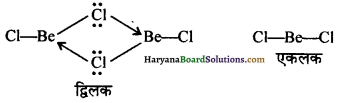
वाष्प अवस्था में BeCl2 क्लोरो-सेतु द्विलक बनाता है जो 1200K के उच्च ताप पर रेखीय एकलक में वियोजित हो जाता है।

हैलाइडों की हाइड्रेट बनाने की प्रवृति नीचे जाने पर कम होती जाती है क्योंकि जलयोजन ऊर्जा का मान कम हो जाता है।
MgCl2 . 8H2O
CaCl2 . 6H2O
SrCl2 . 6H2O
BaCl2 . 2H2O
हैलाइडों की विलेयता पानी में नीचे जाने पर घटती जाती है क्योंकि जलयोजन ऊर्जा घटती है तथा जालक ऊर्जा बढ़ती है। यही कारण है कि फ्लुओराइड क्लोराइड की तुलना में कम विलेय होते हैं।
(4) ऑक्सी अम्लों के लवण (Salts of oxyacids) – ऑक्सी अम्लों के लवण निम्न हैं-
(A) कार्बोनेट (Carbonates) – क्षारीय मृदा धातुओं के कार्बोनेट जल में अविलेय होते हैं जिन्हें इन तत्वों के विलेय लवणों के विलयन में सोडियम या अमोनियम कार्बोनेट विलयन मिलाकर अवक्षेपित किया जा सकता है। कार्बोनेट की विलेयता पानी में नीचे समूह में जाने पर घटती जाती है क्योंकि जालक ऊर्जा बढ़ती है परन्तु जलयोजन ऊर्जा घटती है।
BeCO3 > MgCO3 > CaCO3 > SrCO3 > BaCO3 (घुलनशीलता)
जल में कार्बोनेटों की घुलनशीलता CO2 को प्रवाहित करने पर बढ़ जाती है क्योंक कार्बोनेट बाइकार्बोनेट में परिवर्तित हो जाते हैं।
MCO3 + H2O + CO2 → M(HCO3)2 (बाइकार्बोनेट)
कार्बोनेटों का तापीय स्थायित्व BeCO3 से BaCO3 तक बढ़ता है। BeCO3 इतना अधिक अस्थायी होता है कि अग्र अभिक्रिया को न्यूनतम करने हेतु इसे CO2 के वातावरण में रखना पड़ता है।
BeCO3 < MgCO3 < CaCO3 < SrCO3 < BaCO3 (तापीय स्थायित्व)
इसका कारण यह है कि ऑक्साइडों का स्थायित्व जितना अधिक होगा, कार्बोनेटों की ऑक्साइड बनाने की प्रवृत्ति भी उतनी ही अधिक होगी अर्थात् BeO अधिकतम एवं BaO न्यूनतम स्थायो होता है।
(B) सल्फेट (Sulphate) – क्षारीय मृदा धातुओं के सल्फेट श्वेत एवं ठोस होते हैं तथा ताप के प्रति स्थायी होते हैं। यद्यपि उच्च ताप पर ये अपघटित होकर SO2 तथा O2 दे सकते हैं।
![]()
BeSO4 एवं MgSO4 शीघ्रता से जल में विलेय हो जाते हैं। CaSO4 से BaSO4 तक विलेयता कम होती जाती है। Be2+ तथा Mg2+ आयनों की जलयोजन एन्थैल्पी इनकी जालक एन्थैल्पी की तुलना में अधिक होती है। अतः इनके सल्फेट जल में विलेय होते हैं।
BeSO4 > MgO > CaSO4 > SrSO4 > BaSO4

BeSO4 < MgSO4 < CaSO4 > SrSO4 > BaSO4 (तापीय स्थायित्व )
(C) नाइट्रेट (Nitrate) – इन धातुओं के कार्बोनेटों को तनु नाइट्रिक अम्ल में घोलकर इनके नाइट्रेट प्राप्त किए जाते हैं। उदाहरणार्थ-
MCO3 + 2HNO3 → M(NO3)2 + H2O + CO2 ↑(M = Be, Mg, Ca, Sr, Ba)
मैग्नीशियम नाइट्रेट जल के छह अणुओं के साथ क्रिस्टलित होता है, जबकि बेरियम नाइट्रेट निर्जल लवण के रूप में क्रिस्टलित होता है। यह फिर बढ़ते आकार के साथ घटती जलयोजन एन्थैल्पी के कारण कम जलयोजित लवण बनाने की प्रवृत्ति को पुन: दर्शाता है। लीथियम नाइट्रेट के समान सभी नाइट्रेट गर्म करने पर अपघटित होकर ऑक्साइड बनाते है।
![]()
इनकी विलेयता नीचे जाने पर घटती जाती है क्योंकि जालक ऊर्जा बढ़ती है तथा जलयोजन ऊर्जा घटती है।
Be(NO3)2 > Mg(NO3)2 > Ca(NO3)2 >Sr(NO3)2 > Ba(NO3)2 (विलेयता)
Be(NO3)2 < Mg(NO3)2 < Ca(NO3)2 < Sr(NO3)2 < Ba(NO3)2 (तापीय स्थायित्व)
आवर्त सारणी में s-ब्लॉक के तत्वों का द्वितीय समूह क्षारीय मृदा धातुएँ (Alkaline earth metals) कहलाता है क्योंकि इस समूह के सभी तत्वों के ऑक्साइड क्षारीय एवं मृदा की तरह अगलनीय होते हैं एवं ये . सामान्यतः भू-पर्पटी (earth crust) में पाये जाते हैं। क्षारीय मृदा धातुएँ अत्यधिक क्रियाशील होती हैं अतः इस कारण ये स्वतन्त्र अवस्था में नहीं पायी जाती हैं। द्वितीय समूह में कुल छः क्षारीय मृदा धातुएँ होती हैं जो कि इस प्रकार हैं-
- बेरीलियम (Be)
- मैग्नीशियम (Mg)
- कैल्सियम (Ca)
- स्ट्रॉन्शियम (Sr)
- बेरियम (Ba)
- रेडियम (Ra)
इन सभी क्षारीय मृदा धातुओं में भू-पर्पटी में उपस्थिति के आधार पर कैल्सियम व मैग्नीशियम का स्थान क्रमशः पाँचवाँ व छठवाँ है। स्ट्रॉन्शियम एवं बेरियम की उपलब्धता बहुत कम है। बेरीलियम एक दुर्लभ धातु है जबकि रेडियम की मात्रा आग्नेय शैल में केवल 10-10% है।
इलेक्ट्रानिक विन्यास: क्षारीय मृदा धातुओं का सामान्य इलेक्ट्रॉनिक विन्यास (उत्कृष्ट गैस) ns2 होता है। क्षारीय मृदा धातुओं का इलेक्ट्रॉनिक विन्यास इस प्रकार होता है-
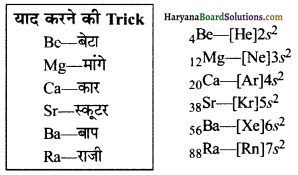
4Be – 1s2, 2s2
12Mg – 1s2, 2s22p6, 3s2
20Ca – 1s2, 2s22p6, 3s23p6, 4s2
38Sr – 1s2, 2s22p6, 3s23p63d10, 4s24p6, 5s2
56Ba – 1s2, 2s22p6, 3s23p63d10, 4s24p6,4d10, 5s25p6, 6s2
88Ra – 1s2, 2s22p6, 3s23p63d10, 4s24p6,4d10, 5s25p6, 6s26p6, 7s1
(1) परमाण्विक त्रिज्या (Atomic Radius) – क्षारीय मृदा धातुओं की परमाण्विक त्रिज्याएँ समूह में ऊपर से नीचे आने पर बढ़ती हैं क्योंकि कक्षकों की संख्या बढ़ जाती है।
Be < Mg < Ca < Sr Ba Ra (परमाण्विक त्रिज्याएँ)
क्षारीय मृदा धातुओं की त्रिज्याएँ अधिक होती हैं परन्तु ये समान आवर्त में उपस्थित क्षार धातुओं से कम होती हैं। चूँकि इन तत्वों के परमाणुओं में मात्र दो संयोजी इलेक्ट्रॉन होते हैं तथा नाभिकीय आकर्षण बल काफी कम होता है अतः क्षारीय मृदा धातुओं का परमाण्विक आकार पर्याप्त रूप से अधिक होता है।
(2) आयनिक त्रिज्या (lonic Radius) – ये सभी तत्व दो इलेक्ट्रॉनों को त्यागकर द्वि-संयोजी धनायन (M2+ ) बनाते हैं। आयनिक त्रिज्या का मान समूह में नीचे जाने पर बढ़ता जाता है पर आयनिक त्रिज्याएँ परमाण्विक त्रिज्याओं से छोटी होती हैं।
Be2+ < Mg2+ < Ca2+ < Sr2+ < Ba2+
(3) आयनन एन्थैल्पी (lonisation Enthelpy ) – क्षारीय मृदा धातुओं के प्रथम आयनन विभव (I1) क्षार धातुओं से ऊँचे होते हैं क्योंकि क्षारीय मृदा धातुओं के तत्वों का आकार क्षार धातुओं के तत्वों के आकार से छोटा होता है। इनके आयनन विभव के मान वर्ग में ऊपर से नीचे जाने पर घटते जाते हैं क्योंकि परमाण्विक आकार बढ़ता जाता है।
M + I.E. (1) → M+(g) + e–
M(g) + I.E. (1) → M++(g) + e–
Be > Mg > Ca > Sr> Ba (आयनन ऊर्जा )
इन तत्वों के प्रथम द्वितीय व तृतीय आयनन विभवों के मान निम्न
| धातु | Be | Mg | Ca | Sr | Ba |
| IE (1) (eV) | 9.32 | 7-64 | 6.11 | 5.70 | 5-2 |
| IE (2) (eV) | 18.21 | 15.03 | 11-87 | 11-0 | 10-0 |
| IE (3) (eV) | 153-85 | 80-12 | 51.21 | 43-6 | 35.5 |
जैसा कि उपरोक्त मानों से स्पष्ट है कि क्षारीय मृदा धातुओं के प्रथम और द्वितीय आयनन विभवों के मानों में अन्तर कम है और उनके द्वि-संयोजक यौगिकों की जालक ऊर्जा एक संयोजक यौगिकों से उच्च है। अतः क्षारीय मृदा धातुएँ M+ प्रकार के धनायनों का निर्माण न करके M2+ प्रकार के धनायन बनाती हैं। क्षारीय मृदा धातुओं के IE 2 व IE 3 का अन्तर बहुत अधिक होने के कारण क्षारीय मृदा धातुएँ M3+ आयन नहीं बनाती हैं।
(4) जलयोजन ऊर्जा (Hydration Energy ) – ऊपर से नीचे आने पर आकार बड़ा होता जाता है। अतः जलयोजन एन्थैल्पी का मान घटता जाता है। क्षारीय मृदा धातुओं की जलयोजन ऊर्जा क्षार धातुओं की तुलना में ज्यादा होती है। इसलिये मृदा धातुओं के यौगिक क्षार धातुओं की तुलना में अधिक जलयोजित होते हैं।
Be2+ > Mg2+ > Ca2+ > Sr2+ > Ba2+ > Ra2+
क्षारीय मृदा धातुओं के गुणों को सारणी 10-2 में प्रदर्शित किया गया है।
क्षारीय मृदा धातुओं के परमाण्विक एवं भौतिक
| गुण | बेरीलियम Be | मैग्नीशियम Mg | कैल्सियम Ca | स्ट्रॉन्शियम Sr | बेरियम Ba | रेडियम Ra |
| परमाणु क्रमांक | 4 | 12 | 20 | 38 | 56 | 88 |
| परमाणु द्रव्यमान /g mol-1 | 9.01 | 24.31 | 40.08 | 87.62 | 137.33 | 226.03 |
| इलेक्ट्रॉनिक विन्यास | [He]2s2 | [Ne]3s2 | [Ar]4s2 | [Kr]5s2 | [Xe]6s2 | [Rn]7s2 |
| आयनन एन्थैल्पी (I) kJ mol-1 | 899 | 737 | 590 | 549 | 503 | 509 |
| आयनन एन्थैल्पी (II) kJ mol-1 | 1757 | 1450 | 1145 | 1064 | 965 | 979 |
| जलयोजन एन्थैपी (kJ mol-1) | -2494 | -1921 | -1577 | -1443 | -1305 | – |
| धात्विक त्रिज्या/pm | 112 | 160 | 197 | 215 | 222 | – |
| आयनी त्रिज्या M2+/pm | 31 | 72 | 100 | 118 | 135 | 148 |
| गलनांक/K | 1560 | 924 | 1124 | 1062 | 1002 | 973 |
| क्वथनांक/K | 2745 | 1363 | 1767 | 1655 | 2078 | (1973) |
| घनत्व / g cm-3 | 1.84 | 1.74 | 1.55 | 2.63 | 3.59 | (5.5) |
| मानक विभव EΘ/V (M2+/M) | -1.97 | -2.36 | -2.84 | -2.89 | -2.92 | -2.92 |
| स्थलमण्डल में प्राप्ति | 2* | 2.76** | 4.6** | 384* | 390* | 10-6 |
मृदा धातुओं के भौतिक गुण –
(1) क्षारीय मृदा धातुएँ सामान्यतया चाँदी की भाँति सफेद, चमकदार एवं गरम, परन्तु अन्य धातुओं की तुलना में कठोर होती हैं।
(2) बेरीलियम तथा मैग्नीशियम लगभग धूसर रंग (Greyish) के होते हैं।
(3) क्वथनांक एवं गलनांक (Boiling and Melting Point)- क्षारीय मृदा धातुओं के क्वथनांक एवं गलनांक क्षार धातुओं से अधिक होते हैं क्योंकि इनका आकार छोटा होता है।
(4) घनत्व (Density) – क्षारीय मृदा धातुओं का घनत्व उसी आवर्त मैं उपस्थित क्षार धातुओं से अधिक होता है। घनत्व पहले Be से Ca तक बढ़ता है और बाद में Ca से Ba तक घटता है। घनत्व की यह अनियमित प्रकृति उनकी क्रिस्टलीय संरचना के कारण होती है।
(5) ज्वाला परीक्षण (Flame test) – Be तथा Mg को छोड़कर अन्य सभी तत्व ज्वाला में रंग देते हैं। Be तथा Mg ज्वाला में कोई भी रंग नहीं देते हैं क्योंकि इनकी आयनन ऊर्जा का मान बहुत अधिक होता है। अन्य सभी तत्व निम्न रंग देते हैं-
| Ca | Sr | Ba |
| ईंट जैसा | किरमिजी | हरा |
| लाल | लाल |
ज्वाला में उच्च ताप पर वाष्प अवस्था में क्षारीय मृदा धातुओं के बाह्यतम कोश के इलेक्ट्रॉन उत्तेजित होकर उच्च ऊर्जा स्तर में चले जाते हैं। ये उत्तेजित इलेक्ट्रॉन जब पुनः अपनी तलस्थ अवस्था में लौटते हैं, तब दृश्य प्रकाश के रूप में ऊर्जा उत्सर्जित करते हैं, जिससे ज्वाला रंगीन दिखायी देती है।
(6) ऑक्सीकरण अवस्था (Oxidation state) – समूह दो के तत्व संयोजी कोश में दो इलेक्ट्रॉनों की उपस्थिति के कारण +2 ऑक्सीकरण अवस्था को प्रदर्शित करते हैं।
![]()
(7) विद्युत ऋणात्मकता (Electronegativity) – क्षारीय मृदा धातुओं की विद्युत ऋणात्मकताओं के मान कम होते हैं। विद्युत ऋणात्मकता समुह में नीचे जाने पर घटती जाती है।
| तत्व | Be | Mg | Ca | Sr | Ba |
| विद्युत ऋणात्मकता | 1.5 | 1.2 | 1.0 | 1.0 | 0.9 |
प्रश्न 3.
क्षार धातुएँ प्रकृति में क्यों नहीं पायी जाती हैं ?
उत्तर:
क्षार धातुएँ कम आयनन एन्थैल्पी तथा प्रबल धन-विद्युती गुण के कारण उच्च क्रियाशील होती हैं। ये प्रकृति में मुक्त अवस्था में नहीं पाई जार्ती तथा सदैव अन्य तत्वों के साथ संयुक्त रहती हैं। इसलिए सामान्यतया क्षार धातुएँ प्रकृति में नहीं पाई जाती हैं।
![]()
प्रश्न 4.
Na2O2 में सोडियम की ऑक्सीकरण अवस्था ज्ञात कीजिए।
उत्तर:
माना Na2O2 में सोडियम की ऑक्सीकरण अवस्था x है। तब
x – 1
Na2O2
2 x+2(-1) & =0
x =+1
अत: Na2O2 में सोडियम की ऑक्सीकरण अवस्था + 1 है।
प्रश्न 5.
पोटैशियम की तुलना में सोडियम कम अभिक्रियाशील क्यों है ? बताइये ।
उत्तर:
सोडियम कम अभिक्रियाशील होता है क्योंकि इसकी आयनन एन्थैल्पी पोटैशियम की तुलना में कम हैं। तथा पोटैशियम सोडियम की तुलना में अधिक धन-विद्युती तथा प्रबल अपचायक होता है। यह सोडियम की तुलना में जल से अधिक तीव्रता के साथ अभिक्रिया करता है।
प्रश्न 6.
निम्नलिखित के सन्दर्भ में क्षार धातुओं एवं क्षारीय मृदा धातुओं की तुलना कीजिए-
(क) आयनन एन्थैल्पी,
(ख) ऑक्साइडों की क्षारकता,
(ग) हाइड्रॉक्साइडों की विलेयता।
उत्तर:
(क) आयनन एन्थैल्पी-क्षारीय मृदा धातुओं (वर्ग 2) की आयनन एन्थैल्पी समान आवर्त में उपस्थित क्षार धातुओं (वर्ग 1) की तुलना में अधिक होती है। इसका कारण क्षारीय मृदा धातुओं के परमाणुओं का छोटा आकार तथा अधिक सममिताकार विन्यास है। उदाहरणार्थ-
सोडियम (Na) की प्रथम आयनन एन्थैल्पी = 496 kJ mol-1
मैग्नीशियम (Mg) की प्रथम आयनन एन्थैल्पी = 737 kJ mol-1
(ख) ऑक्साइडों की क्षारकता-क्षार धातुओं के ऑक्साइड समान आवर्त में उपस्थित क्षारीय मृदा धातुओं के ऑक्साइडों की तुलना में प्रबल क्षारक होते हैं। उदाहरणार्थ- जब Na2O को जल में घोला जाता है, NaOH प्राप्त होता है जो एक प्रबल क्षारक है, जबकि MgO को जल में घोलने पर दुर्बल क्षारक, Mg(OH)2 प्राप्त होता है।
(ग) हाइड्रॉक्साइडों की विलेयता- क्षार धातु हाइड्रॉक्साइड समान आवर्त में उपस्थित क्षारीय मृदा धातु हाइड्रॉक्साइडों की तुलना में जल में अधिक विलेय होते हैं। ऐसा इसलिए होता है कि क्षारीय मृदा धातुओं के हाइड्रॉक्साइडों की जालक ऊर्जा (Lattice energy) क्षार धातुओं के हाइड्रॉक्साइडों की तुलना में उच्च होती है।
प्रश्न 7.
लीथियम किस प्रकार मैग्नीशियम से रासायनिक गुणों में समानताएँ दर्शाता है ?
उत्तर:
लीथियम एवं मैग्नीशियम के रासायनिक गुणों में समानता के प्रमुख बिन्दु निम्नवत् हैं-
(1) लीथियम एवं मैग्नीशियम जल के साथ धीमी गति से अभिक्रिया करते हैं। इनके ऑक्साइड एवं हाइड्रॉक्साइड बहुत कम घुलनशील हैं। हाइड्रॉक्साइड गर्म करने पर विघटित हो जाते हैं। दोनों ही नाइट्रोजन से सीधे संयोग करके क्रमश: Li3N एवं Mg3N2 नाइट्राइड बनाते हैं।
(2) Li2O एवं MgO औक्सीजन के आधिक्य से अभिक्रिया करके सुपर ऑक्साइड नहीं बनाते हैं।
(3) लीथियम एवं वैग्नीशियम धातुओं के कार्बोनेट गम करने पर सरलतापूर्वंक बिघटित के का उनके आक्साद्ड एवं CO2 बनाते हैं। दोनों
(4) LiCl एवं MgCl2 एहधन में विलेय हैं।
(5) LiCl एवं MgCl2 दोनों ही प्रस्वेद्य (deliquescent) यौगिक हैं। ये जलीय विलयन से LiCl.2H2O एवं MgCl2.8H2O के रूप में क्रिस्टलीकृत होते हैं। नोट-अधिक जानकारी के लिए कृपया अनुच्छेद संख्या 10.6 को पृष्ठ संख्या 153 पर देखें।
प्रश्न 8.
क्षार धातुएँ तथा क्षारीय मृदा धातुएँ रासायनिक अपचयन विधि से क्यों नहीं प्राप्त की जा सकती हैं ? समझाइए।
उत्तर:
क्षार धातु तथा क्षारीय मृदा धतु परिवार के सदस्य अत्यन्त प्रबल अपचायक होते हैं। इसलिए इनके ऑक्साइडों को साधारण अपचायकों; जैसे-कार्बन (कोक), जिंक आदि की अभिक्रिया द्वारा अपचयित करना सम्भव नहीं है। इन्हें सामान्यतया इनके लवणों का गलित अवस्था में विद्युत-अपघटन कराने पर पृथक्कृत किया जा सकता है।
प्रश्न 9.
प्रकाश-विद्युत सेल में लीथियम के स्थान पर पोटैशियम एवं सीजियम क्यों प्रयुक्त किए जाते हैं ?
उत्तर:
लीथियम की आयनन एन्थैल्पी अत्यन्त उच्च होती है। इस कारण प्रकाश के फोटॉन लीथियम धातु की सतह से इलेक्ट्रॉन निष्कासित नहीं कर पाते हैं। अतः लीथियम धातु को प्रयोग करने पर प्रकाश-विद्युत प्रभाव नहीं देखा जाता है। पोटैशियम तथा सीजियम की आयनन एन्थैल्पी अपेक्षाकृत कम होती है, इसलिए जब निश्चित न्यूनतम आवृत्ति के फोटॉन इन धातुओं की सतह से टकराते हैं तो इन धातुओं की सतह से इलेक्ट्रॉन सरलता से उत्सर्जित हो जाते हैं।
प्रश्न 10.
जब एक क्षार धातु को द्रव अमोनिया में घोला जाता है, तब विलयन विभिन्न रंग प्राप्त कर सकता है। इस प्रकार के रंग-परिवर्तन का कारण बताइए।
उत्तर:
क्षार धातुएँ द्रव अमोनिया में घुलनशील हैं। अमोनिया में इनके विलयन का रंग गहरा नीला होता है एवं विलयन प्रकृति में विद्युत का सुचालक होता है-
M + (x + y) NH3 → [M(NH3)x]+ + [e(NH3)y]–
विलयन का नीला रंग अमोनीकृत इलेक्ट्रॉनों के कारण होता है, जो दृश्य प्रकाश क्षेत्र की संगत ऊर्जा का अवशोषण करके विलयन को नीला रंग प्रदान करते हैं। अमोनीकृत विलयन अनुचुम्बकीय (paramagnetic) होता है, जो कुछ समय पड़े रहने पर हाइड्रोजन को मुक्त करता है। फलस्वरूप विलयन में ऐमाइड बनता है।
M+(am) + e– + NH3(l) → MNH2(am) + 1/2H2(g)
(यहाँ ‘am’ अमोनीकृत विलयन दर्शाता है।)
सान्द्र विलयन का नीला रंग ब्रॉन्ज में बदल जाता है और विलयन प्रतिचुम्बकीय हो जाता है।
प्रश्न 11.
ज्वाला को बेरिलियम एवं मैग्नीशियम कोई रंग नहीं प्रदान करते हैं, जबकि अन्य क्षारीय मृदा धातुएँ ऐसा करती हैं। क्यों ?
उत्तर:
बेरिलियम एवं मैग्नीशियम के परमाणुओं में इनके छोटे आकार के कारण बाह्यतम कोशों के इलेक्ट्रॉन इतनी प्रबलता से बँधे रहते हैं कि यदाला की ऊर्जा द्वारा इनका उत्तेजित होना कठिन हो जाता है। अतः ज्वाला में इन दोनों धातुओं का अपना कोई अभिलाक्षणिक रंग नहीं होता है। इन दोनों तत्वों के अतिरिक्त क्षारीय मृदा धातु परिवार के अन्य सदस्य, कैल्सियम, स्ट्रॉन्शियम एवं बेरियम ज्वाला को क्रमशः ईंट जैसा लाल (brick red) रंग, किरमिजी लाल (Crimson red) एवं हरा (apple green) रंग प्रदान करते हैं।
ज्वाला में उच्च ताप पर वाष्प-अवस्था में क्षारीय मृदा धातुओं के बाह्यतम कोश के इलेक्ट्रॉन उत्तेजित होकर उच्च ऊर्जा स्तर पर चले जाते हैं। ये उत्तेजित इलेक्ट्रॉन जब पुन: अपनी तलस्थ अवस्था में लौटते हैं, तब दृश्य प्रकाश के रूप में ऊर्जा उत्सर्जित होती है। फलस्वरूप ज्वाला रंगीन दिखाई देने लगती है।
![]()
प्रश्न 12.
सॉल्वे प्रक्रम में होने वाली विभित्र अभिक्रियाओं की विवेचना कीजिए।
उत्तर:
साधारणतया सोडियम कार्बोनेट ‘सॉल्वे विधि’ द्वारा बनाया जाता है। इस प्रक्रिया में लाभ यह है कि सोडियम हाइड्रोजन कार्बोनेट जो अमोनियम हाइड्रोजन कार्बोनेट एवं सोडियम क्लोराइड के संयोग से अवक्षेपित होता है, अल्प विलेय होता है। अमोनियम हाइड्रोजनकार्बोनेट CO2 गैस को सोडियम क्लोराइड के अमोनिया से संतृप्त सान्द्र विलयन में प्रवाहित कर बनाया जाता है। इस प्रक्रिया में पहले अमोनियम कार्बोनेट और फिर अमोनियम हाइड्रोजन कार्बोनेट बनता है। सम्पूर्ण प्रक्रम की अभिक्रियाएँ निम्नलिखित हैं-
2NH3 + H2O + CO2 → (NH4)2 CO3
(NH4)2 CO3 + H2O + CO2 → 2NH4HCO3 अमोनियम हाइड्रोजन कार्बोनेट
NH4HCO3 + NaCl → NH4Cl + NaHCO3 सोडियम हाइड्रोजन कार्बोनेट
इस प्रकार सोडियम बाइकार्बोनेट के क्रिस्टल पृथक् हो जाते हैं जिन्हें गर्म करके सोडियम कार्बोनेट प्राप्त किया जाता है-
2NaHCO3 → Na2CO3 + CO2 ↑ + H2O
इस प्रक्रम में NH4Cl युक्त विलयन की Ca(OH)2 से अभिक्रिया पर NH3 को पुनः प्राप्त किया जा सकता है। कैल्सियम क्लोराइड सह-उत्पाद के रूप में प्राप्त होता है-
2NH4Cl + Ca(OH)2 → 2NH3 ↑ + CaCl2 + 2H2O
प्रश्न 13.
पोटैशियम कार्बोनेट सॉल्वे विधि द्वारा नहीं बनाया जा सकता है। क्यों ?
उत्तर:
सॉल्वे विधि का उपयोग पोटैशियम कार्बोनेट के निर्माण में नहीं किया जा सकता है; क्योंकि पोटैशियम हाइड्रोजन कार्बोनेट की अधिक विलेयता के कारण इसे पोटैशियम क्लोराइड के संतृप्त विलयन में अमोनियम हाइड्रोजन कार्बोनेट के संयोग द्वारा अवक्षेपित करना सम्भव नहीं है।
प्रश्न 14.
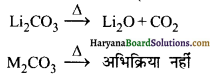
LI2CO3 कम ताप पर एवं Na2CO3 उच्च ताप पर क्यों विघटित होता है?
उत्तर:
गर्म करने पर, Li2CO3 विघटित होकर Li2O तथा CO2 बनाता है। Li+ आयन का छोटा आकार Li2O के जालक को Li2CO3 के जालक से अधिक स्थायी बना देता है क्योंकि यहाँ पर Li+ तथा O2- दोनों ही छोटे आकार के होते हैं, परन्तु Na+ आयन का बड़ा आकार Na2O के जालक को Na2CO3 के जालक से कम स्थायी कर देता है क्योंकि Na+ तथा \(\mathrm{CO}_3^{2-}\) दोनों ही बड़े आकार के हैं। फलस्वरूप Na2CO3 उच्च ताप पर भी विघटित नहीं होता है, जबकि Li2CO3 कम ताप पर ही विघटित हो जाता है।
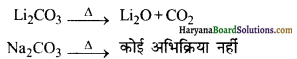
प्रश्न 15.
क्षार धातुओं के निम्नलिखित यौगिकों की तुलना क्षारीय मृदा धातुओं के संगत यौगिकों से विलेयता एवं तापीय स्थायित्व के आधार पर कीजिए-(क) नाइट्रेट (ख) कार्बोनेट (ग) सल्फेट।
उत्तर:
विलेयता एवं तापीय स्थायित्व के आधार पर क्षार धातुओं के यौगिकों की तुलना क्षारीय मृदा धातुओं के संगत यौगिकों से अग्रलिखित प्रकार की जा सकती है-
क्षार धातुओं के यौगिक
(क) नाइट्रेट-
(i) विलेयता-आयनिक प्रकृति के कारण ये यौगिक जल में विलेय होते हैं। इनकी विलेयता ग्रुप में नीचे जाने पर बढ़ती जाती है क्योंकि जालक ऊर्जा घटती जाती है तथा जलयोजन ऊर्जा बढ़ती जाती है।
LiNO3 < NaNO3 <KNO3 < RbNO3 < CsNO3 <FrNO3
(ii) तापीय स्थायित्व – गर्म करने पर ये नाइट्रेट में विघटित हो जाते है तथा ऑक्साइड एवं ऑक्सीजन देते हैं।
4LiNO3 → 2Li2O + 4NO2 ↑+ O2 ↑
2NaNO3 → 2NaNO2 + O2
(ख) कार्बोनेट-
(i) विलेयता-ये जल में विलेय होते है तथा समूह में नीचे जाने पर विलेयता बढ़ती जाती है।
Li2CO3 < Na2CO3 < K2CO3 <Rb2CO3 < Cs2CO3 < Fr2CO3
(ii) तापीय स्थायित्व-गर्म करने पर कार्बोनेट विघटित नहीं होते हैं। ये ऊष्मा के प्रति उच्च स्थायी होते हैं अर्थात् तापीय रूप से स्थायी होते हैं।
(M = Na, K, Rb, Cs, Fr)
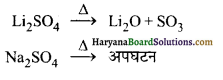
(ग) सल्फेट-
(i) विलेयता-ये जल में अल्प विलेय होते हैं। सोडियम तथा पोटैशियम के लवण जल में तीव्र विलेय होते हैं।
(ii) तापीय स्थायित्व-लीथियम को छोड़कर क्षार धातुओं के अन्य सभी तत्वों के सल्फेट तापीय रूप से स्थायी होते हैं।
क्षारीय मृदा धातुओं के यौगिक
(क) नाइट्रेट-
(i) विलेयता-सभी क्षारीय मृदा धातुओं के नाइट्रेट जल में विलेय होते हैं। उनकी विलेयता समूह में नीचे जाने पर कम होती जाती है। क्योंकि जलयोजन ऊर्जा घटती है तथा जालक ऊर्जा बढ़ती है।
Be(NO3)2 < Mg(NO3)2 < Ca(NO3)2 < Sr(NO3)2 < Ba(NO3)2
(ii) तापीय स्थायित्व-गरम करने पर ये विघटित होकर ऑक्साइड देते हैं।
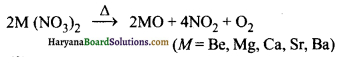
(ख) कार्बोनेट-
(i) विलेयता- \(\mathrm{CO}_3^{2-}\) ॠणायन का आकार धनायन की अपेक्षा बहुत बड़ा होता है अत: इसकी जालक ऊर्जा समूह में नीचे जाने पर लगभग समान होती है। जबकि जलयोजन ऊर्जा का मान नीचे जाने पर पर घटता जाता है। अतः इनकी विलेयता नीचे जाने पर घटती जाती है।
BeCO3 > MgCO3 > CaCO3 > SrCO3 > BaCO3
(ii) तापीय स्थायित्व-गर्म करने पर ये विधटित हो जाते हैं।
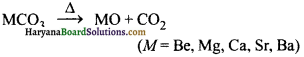
नीचे जाने पर इनका स्थायित्व बढ़ता जाता है क्योंकि इनका धन विद्युती गुण नीचे जाने पर बढ़ता जाता है।
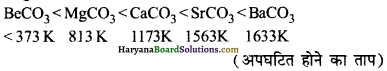
(ग) सल्फेट-
(i) विलेयता-इनकी विलेयता समूह में नीचे जाने पर घटती जाती है। Be तथा Mg के सल्फेट जल में विलेय होते हैं। Ca तथा Sr के सल्फेट जल में अल्प विलेय होते हैं जबकि BaSO4 अविलेय होता है।
BeSO4 > MgSO4 > CaSO4 > SrSO4 > BaSO3(विलेयता)
(ii) तापीय स्थायित्व-नीचे जाने पर इनका तापीय स्थायित्व बढ़ता जाता है क्योंकि इनका घन विद्युती गुण बढता जाता है।

प्रश्न 16.
सोडियम क्लोराइड से प्रारम्भ करके निम्नलिखित को आप किस प्रकार बनाएँगे ?
(i) सोडियम धातु (ii) सोडियम हाइड्रॉक्साइड (iii) सोडियम पर्रॉक्साइड (vi) सोडियम कार्बोनेट।
उत्तर:
(i) सोडियम क्लोराइड से सोडियम धातु प्राप्त करना-सोडियम क्लोराइड लवण का गलित अवस्था में विद्युत-अपघटनी अपचयन कराने पर सोडियम धातु प्राप्त होती है।

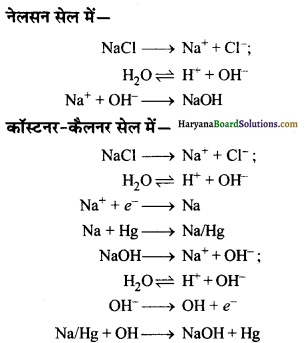
(ii) सोडियम क्लोराइड से सोडियम हाइड्रॉक्साइड प्राप्त करना-सोडियम क्लोराइड के जलीय विलयन का नेलसन सेल अथवा कॉस्टनर-कैलनर सेल में विद्युत-अपघटन करने पर सोडियम हाइड्रॉक्साइड प्राप्त होता है।
(iii) सोडियम क्लोराइड से सोडियम परॉक्साइड प्राप्त करनापहले सोडियम क्लोराइड के विद्युत-अपघटनी अपचयन द्वारा सोडियम प्राप्त करते हैं, इसके बाद धातु को 573K पर ऑक्सीजन के आधिक्य के साथ नमी तथा CO2 से मुक्त वायुमण्डल में गर्म करने पर सोडियम परॉक्साइड बनता है।
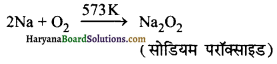
(iv) सोडियम क्लोराइड से सोडियम कार्बोनेट प्राप्त करना-सोडियम क्लोराइड से सोडियम कार्बोनेट बनाने के लिए सॉल्वे-अमोनिया प्रक्रम का प्रयोग किया जाता है। इस प्रक्रम में सोडियम क्लोराइड अथवा ब्राइन के सान्द्र विलयन (लगभग 30%), जिसे अमोनिया द्वारा संतृप्त कर लिया जाता है, में कार्बन डाइऑक्साइड प्रवाहित करने पर सोडियम बाइकार्बोनेट प्राप्त होता है।

विलयन में Na+ आयनों की उपस्थिति में सोडियम बाइकार्बोनेट अवक्षेपित जाता है। अवक्षेप को छानकर अलग करने पर सोडियम कार्बोनेट प्राप्त होता है।
2NaHCO3 → Na2CO3 + CO2 ↑ + H2O
प्रश्न 17.
क्या होता है, जब-
- मैग्नीशियम को हवा में जलाया जाता है।
- बिना बुझे चूने को सिलिका के साथ गर्म किया जाता है।
- क्लोरीन बुझे चूने से अभिक्रिया करती है।
- कैल्सियम नाइट्रेट को गर्म किया जाता है।
उत्तर:
(i) मैग्नीशियम ऑक्साइड तथा मैग्नीशियम नाइट्राइड का मिश्रण बनता है।

![]()
प्रश्न 18.
निम्नलिखित में प्रत्येक के दो-दो उपयोग लिखिए-
- कॉस्टिक सोडा,
- सोडियम कार्बोनेट
- बिना बुझा चूना।
उत्तर:
1. कॉस्टिक सोडा के उपयोग (Uses of caustic soda)-
- साबुन, कागज, कृत्रिम रेशम तथा कई अन्य रसायनों के निर्माण में।
- पेट्रोलियम के परिष्करण में।
2. सोडियम कार्बोनेट के उपयोग (Uses of sodium carbonate) –
- जल के मृदुकरण, धुलाई एवं निर्मलन में।
- पेट्रोलियम के परिष्करण में।
- काँच, साबुन, बोरेक्स एवं कॉस्टिक सोडा के निर्माण में।
3. बिना बुझा चूना के उपयोग (Uses of Quick lime) –
- सीमेन्ट के निर्माण के लिए प्राथमिक पदार्थ के रूप में तथा क्षारक के सबसे सस्ते रूप में।
- शर्करा के शुद्धिकरण में रंजकों (dye stuffs) के निर्माण में।
प्रश्न 19.
निम्नलिखित की संरचना बताइए-
- BeCl2 (वाष्प),
- BeCl2 (ठोस) ।
उत्तर:
1. वाष्प अवस्था में (In vapour state) – वाष्प अवस्था में यह यौगिक द्विलक (dimer) के रूप में पाया जाता है। (Be परमाणु sp2- संकरित होता है) जो लगभग 1000K ताप पर अपघटित होकर एक एकलक (monomer) देता है जिसमें Be परमाणु sp-संकरण अवस्था में होता है।
2. ठोस अवस्था में (In solid state)-ठोस अवस्था में बेरिलियम क्लोराइड की शृंखला संरचना (बहुलक) होती है जिसमें समीपवर्ती अणुओं पर उपस्थित क्लोरीन परमाणुओं से इलेक्ट्रॉन-युग्म इलेक्ट्रॉन न्यून Be परमाणु को दान करके उपसहसंयोजी बन्ध निम्नवत् बनता है-
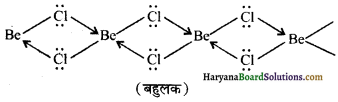
उपर्युक्त शृंखला संरचना में Be परमाणु sp3- संकरित होता है, परन्तु Cl-Be-Cl बन्ध कोण सामान्य चतुष्फलकीय बन्ध कोण (109.5°) से अत्यधिक कम (98°) होता है।
प्रश्न 20.
सोडियम एवं पोटैशियम के हाइड्रॉक्साइड एवं कार्बोनेट जल में विलेय हैं, जबकि मैग्नीशियम एवं कैल्सियम के संगत लवण जल में अल्प विलेय हैं, समझाइए।
उत्तर:
दिए गए सभी यौगिक क्रिस्टलीय ठोस हैं तथा इनकी जल में विलेयता जालक एन्थैल्पी तथा जलयोजन एन्थैल्पी दोनों के द्वारा निर्धारित होती है। सोडियम तथा पोटैशियम यौगिकों की स्थिति में जालक एन्थैल्पी का परिमाण जलयोजन एन्थैल्पी की तुलना में अत्यन्त कम होता है। चूँकि धनायनों का आकार बड़ा होता है, इसलिए सोडियम तथा पोटैशियम के यौगिक जल में तुरन्त विलेय हो जाते हैं।
यद्रपि संगत मैग्नीशियम तथा कैल्सियम यौगिकों की स्थिति में धनायनों का आकार कम होता है तथा धनावेश का परिमाण अधिक होता है। इसका अर्थ है कि इनकी जालक ऊर्जा (एन्थैल्पी) सोडियम तथा पोटैशियम के यौगिकों की तुलना में अधिक होती है। इसलिए इन धातुओं के हाइड्रॉक्साइड तथा कार्बोनेट जल में अल्प विलेय होते हैं।
सोडियम तथा पोटेशियम के हाइड्रॉक्साइड एवं कार्बोनेट जल में विलेय हैं क्योंकि,
जलयोजन ऊर्जा > जालक ऊर्जा
मैग्नीशियम तथा कैल्शियम के हाइड्रॉक्साइड एवं कार्बोनेट जल में अल्पविलेय हैं क्योंकि,
जलयोजन ऊर्जा ≤ जालक ऊर्जा
प्रश्न 21.
निम्नलिखित की महत्ता बताइए-
- चूना पत्थर,
- सीमेन्ट,
- प्लास्टर ऑफ पेरिस
उत्तर:
1. चूना पत्थर की महत्ता (Importance of Limestone)
- संगमरमर के रूप में भवन-निर्माण में।
- बुझे हुए चूने के निर्माण में।
- कैल्सियम कार्बोनेट, मैग्नीशियम कार्बोनेट के साथ लोहे जैसी धातुओं के निष्कर्षण में फ्लक्स (flux) के रूप में।
- विशेष रूप से अवक्षेपित CaCO3 के प्रयोग से वृहद् रूप में उच्च गुणवत्ता वाले कागज के निर्माण में।
- एन्टासिड, टूथपेस्ट में अपघर्षक के रूप में, चूइंगम के संघटक एवं सौन्दर्य प्रसाधनों में पूरक के रूप में।
2. सीमेन्ट की महत्ता: लोहा तथा स्टील के अतिरिक्त सीमेन्ट भी एक ऐसा ही पदार्थ है जो किसी राष्ट्र की उपयोगी वस्तुओं की श्रेणी में रखा जा सकता है। इसका उपयोग कंक्रीट, प्रबलित कंक्रीट, प्लास्टरिंग, पुल-निर्माण आदि में किया जाता है।
3. प्लास्टर ऑफ पेरिस की महत्ता: ग्लास्टर ऑफ पेरिस का वृहत्तर उपयोग भवन-निर्माण उद्योग के साथ-साथ टूटी हुई हड्डियों के प्लास्टर में भी होता है। इसका उपयोग दन्त-चिकित्सा, अलंकरण-कार्य एवं मूर्तियों तथा मूर्तियों के साँचे बनाने में भी होता है।
प्रश्न 22.
लीथियम के लवण साधारणतया जलयोजित होते हैं, जबकि अन्य क्षार धातुओं के लवण साधारणतया निर्जलीय होते हैं। क्यों?
उत्तर:
लीथियम लवणों में लीथियम आयन (Li+) अपने छोटे आकार के कारण नमी अथवा जल के सम्पर्क में आने पर तुरन्त जलयोजित हो जाता है। इसलिए लीथियम के लवण साधारणतया जलयोजित होते हैं, जबकि अन्य क्षार धातु आयन अपेक्षाकृत बड़े आकार के होने के कारण जलयोजित नहीं होते। अतः ये निर्जलीय होते हैं।
प्रश्न 23.
LiF जल में लगभग अविलेय होता है, जबकि LiCl न सिर्फ जल में, बल्कि ऐसीटोन में भी विलेय होता है। कारण बताइए।
उत्तर:
LiF की जल में अल्प विलेयता इसकी उच्च जालक एन्थैल्पी के कारण होती है (F– आकार में अत्यन्त छोटा होता है )। दूसरी ओर लीथियम क्लोराइड (LiCl) में जालक एन्थैल्पी अपेक्षाकृत कम होती है। इसका अर्थ है कि जलयोजन ऊर्जा का परिमाण अधिक है। इसलिए लीथियम क्लोराइड द्विध्रुवी आकर्षण के कारण न केवल जल में, अपितु ऐसीटोन में भी विलेय होता है (ऐसीटोन प्रवृत्ति में ध्रुवीय होता है)।
प्रश्न 24.
जैव द्रवों में सोडियम, पोटैशियम, मैग्नीशियम एवं कैल्सियम की सार्थकता बताइए।
उत्तर:
सोडियम एवं पोटैशियम की जैव उपयोगिता : सोडियम आयन मुख्यतः अंतराकाशीय द्रव में उपस्थित रक्त प्लाज्मा, जो कोशिकाओं को घेरे रहता है, में पाया जाता है। यह आयन शिरा संकेतों के संचरण में भाग लेते है, जो कोशिका झिल्ली में जल प्रवाह को नियमित करते हैं तथा कोशिकाओं में शर्करा और एमीनो अम्लों के प्रवाह को भी नियन्त्रित करते हैं। Na और K रासायनिक रूप से समान होते हुए भी कोशिका झिल्ली को पार करने की क्षमता एवं एन्जाइम को सक्रिय करने में मात्रात्मक रूप से भिन्न हैं।
इसलिये कोशिका द्रव में पोटैशियम धनायन बहुतायत में होते हैं, जहाँ ये एन्जाइम को सक्रिय करते हैं एवं ग्लूकोज के ऑक्सीकरण से ATP बनने में भाग लेते है। सोडियम आयन शिरा-संकेतों के संचरण के लिये उत्तरदायी हैं । कोशिका झिल्ली के अन्य हिस्सों में पाये जाने वाले Na एवं K आयनों की सांद्रता में उल्लेखनीय भिन्नता पाई जाती है।
उदाहरण – रक्त प्लाज्मा में लाल रक्त कोशिकाओं में Na की मात्रा 143 m mol L-1 जबकि K का स्तर केवल 5 m mol L-1 है। यह सान्द्रता 10 m mol L-1(Na+) एवं 105 mmolL-1(K+) तक परिवर्तित होती है। इसी असाधारण उतार चढ़ाव को सोडियम पोटैशियम पम्प कहते हैं । सेल झिल्ली पर कार्य करता है, जो मनुष्य की विश्रामावस्था के कुल उपभोगिता की एक-तिहाई के ज्यादा का उपयोग कर लेता है, जो मात्रा लगभग 15 किलो प्रति 24 घंटे तक हो सकती है।
मैग्नीशियम और कैल्सियम का जैविक महत्व: एक वयस्क व्यक्ति में लगभग 25 ग्राम मैग्नीशियम एवं 1200 ग्राम कैल्सियम होता है, जबकि लोहा मात्र 5 ग्राम एवं ताँबा 0.06 ग्राम होता है। मानव-शरीर में इनकी दैनिक आवश्यकता 200-300 मिलीग्राम अनुमानित की गई हैं। समस्त एन्जाइम, जो फॉस्फेट के संचरण में ATP का उपयोग करते हैं, मैग्नीशियम का उपयोग सह-घटक के रूप में करते हैं। पौधों में प्रकाश-संश्लेषण के लिए मुख्य रंजक (pigment) क्लोरोफिल में भी मैग्नीशियम होता है। शरीर में कैल्सियम का 99% दाँतों तथा हड्डियों में होता है।
यह अन्तरतांत्रिकीय पेशीय कार्यप्रणाली, अन्तरतांत्रिकीय प्रेषण कोशिका झिल्ली अखण्डता (cell membrane integrity) तथा रक्त-स्कन्दन (blood-coagulation)में भी महत्त्वपूर्ण भूमिका निभाता है। प्लाज्मा में कैल्सियम की सान्द्रता लगभग 100 mg L-1 होती है। दो हॉमाकैल्सिटोनिन एवं पैराथायरॉइड इसे बनाए रखते हैं। चूँकि हड्डु अक्रिय तथा अपरिवर्तनशील पदार्थ नहीं है, यह किसी मनुष्य में लगभग 400 मिग्रा प्रतिदिन के अनुसार विलेयित और निक्षेपित होती है। इसका सारा कैल्सियम रक्त प्लाज्मा में ही गुजरता है।
![]()
प्रश्न 25.
क्या होता है जब-
- सोडियम धातु को जल में डाला जाता है।
- सोडियम धातु को हवा की अधिकता में गर्म किया जाता है।
- सोडियम परॉक्साइड को जल में घोला जाता है।
उत्तर:
1. सोडियम धातु को जल में डालने पर उच्च ऊष्माक्षेपी अभिक्रिया होती है तथा हाइड्रोजन मुक्त होती है जो आग पकड़ लेती है।
2 Na + 2H2O → 2NaOH + H2 ↑
2. सोडियम धातु को वायु की अधिकता में गर्म करने पर सोडियम परॉक्साइड बनता है।
2Na + O2 → Na2O2
3. सोडियम परॉक्साइड को जल में घोलने पर ऑक्सीजन मुक्त होता है।
2Na2O2 + 2H2O → 4NaOH + O2 ↑
प्रश्न 26.
निम्नलिखित में से प्रत्येक प्रेक्षण पर टिप्पणी लिखिए-
(क) जलीय विलयनों में क्षार धातु आयनों की गतिशीलता Li+ <Na+ <K+ <Rb+ <Cs+ क्रम में होती है।
(ख) लीथियम ऐसी एकमात्र क्षार धातु है, जो नाइट्राइड बनाती है।
(ग) M2+(aq) + 2e– → M(s) हेतु EΘ (जहाँ M = Ca, Sr या Ba) लगभग स्थिरांक है।
उत्तर:
(क) जलीय विलयनों में क्षार धातु आयनों की गतिशीलता निम्नलिखित क्रम में होती हैं-
Li+ < Na+ < K+ < Rb+ < Cs+
इसे धनायनों के जल में जलयोजित होने के आधार पर समझाया जा सकता है। इसके परिणामस्वरूप धनायन का आकार बढ़ने पर इसकी गतिशीलता घटती है। Li+ आयन छोटे आकर के कारण अधिकतम जलयोजित होता है तथा न्यूनतम गतिशीलता रखता है, जबकि Cs+ न्यूनतम जलयोजन के कारण अधिकतम गतिशीलता रखता है।
(ख) लीथियम एक प्रबल अपचायक है; अतः यह नाइट्रोजन से सीधे संयोग करके नाइट्राइड (Li3N) बनाता है।
6Li + N2 → 2Li3N लीथियम नाइटाइड
(ग) क्षार धातुओं के इलेक्ट्रोड विभव (EΘ), जो M(s) से M+(aq) तक सभी परिवर्तनों में अन्य धातुओं द्वारा प्रदर्शित अपचायक क्षमता को मापते हैं, तीन कारकों पर निर्भर करते हैं-(a) ऊर्ध्वपातन, (b) आयनन एन्थैल्पी तथा (c) जलयोजन एन्थैल्पी। क्योंकि Ca, Sr तथा Ba के लिये इन तीनों कारकों का सामूहिक प्रभाव लगभग समान होता है अतः इनका इलेक्ट्रोड विभव भी लगभग स्थिरांक होता है।
प्रश्न 27.
समझाइए कि क्यों-
(क) Na2CO3 का विलयन क्षारीय होता है।
(ख) क्षार धातुएँ उनके संगलित क्लोराइडों के विद्युत-अपघटन से प्राप्त की जाती हैं।
(ग) पोटैशियम की तुलना में सोडियम अधिक उपयोगी है।
उत्तर:
(क) सोडियम कार्बोनेट (Na2CO3), जो प्रबल क्षार (NaOH) तथा दुर्बल अम्ल (H2CO3) का एक लवण है जल-अपघटन करने पर पर क्षारीय विलयन बनाता है।
![]()
(ख) क्षार धातुएँ उच्च अभिक्रियाशील तथा प्रबल अपचायक होती हैं; अतः इन्हें साधारण विधियों द्वारा निष्कर्षित नहीं किया जा सकता है। इन्हें जलीय विलयनों के विद्युत-अपघटन द्वारा निष्कर्षित नहीं किया जा सकता है; क्योंकि तब बनने वाली धातुएँ जल से अभिक्रिया करके हाइड्रॉक्साइड बना लेंगी। इसलिए इन धातुओं को सामान्यता इनके संगलित क्लोराइडों के विद्युत अपघटन द्वारा प्राप्त किया जाता है।
(ग) पोटैशियम की तुलना में सोडियम अधिक उपयोगी है। इसे निम्नलिखित बिन्दुओं के आधार पर स्पष्ट किया जा सकता है-
- सोडियम का उपयोग Na/Pb मिश्रधातुओं में होता है जो PbEt4 तथा PbMe4 के निर्माण के लिए आवश्यक हैं। इन कार्बलेड यौगिकों का उपयोग पेट्रोल में अपस्फोटरोधी के रूप में होता है।
- यह प्रबल अपचायक सोडियम अमलगम के रूप में प्रयुक्त होता है।
- सोडियम धातु का उपयोग सोडियम यौगिकों; जैसे-परॉक्साइड, ऐमाइड तथा सोडियम सायनाइड बनाने में किया जाता है।
- यह रंजक उद्योग में प्रयोग किया जाता है।
- द्रव सोडियम धातु का उपयोग नाभिकीय रिऐक्टर में शीतलक (coolant) के रूप में होता है।
- इसका उपयोग कार्बनिक यौगिकों में नाइट्रोजन, सल्फर तथा हैलोजेनों की उपस्थिति निर्धारित करने में किया जाता है।
प्रश्न 28.
निम्नलिखित के मध्य क्रियाओं के सन्तुलित समीकरण लिखिए-
(क) Na2CO3 एवं जल
(ख) KO2 एवं जल
(ग) Na2O एवं CO2.
उत्तर –
(ख) 2KO2 + 2H2O → 2KOH + H2O2 + O2
(ग) Na2O + CO2 → Na2CO3
प्रश्न 29.
आप निम्नलिखित तथ्यों को कैसे समझाएँगे-
(क) BeO जल में अविलेय है, जबकि BeSO4 विलेय है।
(ख) BaO जल में विलेय है, जबकि BaSO4 अविलेय है।
(ग) एथेनॉल में LiI, KI की तुलना में अधिक विलेय है।
उत्तर:
(क) छोटे आकार, उच्च आयनन विभव तथा उच्च इलैक्ट्रॉन ऋणात्मकता के कारण BeO अत्यधिक संहसयोजक गुण रखता है इसी कारण यह जल में अविलेय होता है जबकि BeSO4 आयनिक होता है एवं Be2+ आयन अत्यधिक छोटे आकार का होता है जिसके कारण इसकी जलयोजन ऊर्जा का मान अधिक होता है तथा जालक ऊर्जा का मान काफी कम। यही कारण है कि BeSO4 जल में विलेय होता है।
(ख) BaO तथा BaSO4 दोनों ही आयनिक यौगिक होते हैं। बेरियम ऑक्साइड (BaO) जल में विलेय होता है; क्योंकि इसकी जलयोजन ऊर्जा इसकी जालक ऊर्जा से अधिक होती है। दूसरी ओर BaSO4 की जालक ऊर्जा इसके द्विसंयोजी आवेशों के कारण उच्च होती है; इसलिए मुक्त होने वाली जलयोजन ऊर्जा जालक ऊर्जा से अधिक नहीं हो पाती तथा बन्ध टूट नहीं पाते हैं। इस कारण BaSO4 अविलेय होता है।
(ग) लीथियम आयोडाइड प्रवृत्ति में थोड़ा सहसंयोजी होता है। इसका कारण इसकी ध्रुवणता है (Li+ छोटे आकार के कारण सर्वाधिक ध्रुवण-क्षमता रखता है तथा आयोडाइड आयन बड़े आकार के कारण अधिकतम ध्रुवित किया जा सकता है) Li+ आयन की जलयोजन ऊर्जा K+ आयन से अधिक होती है; अत: Li+ आयन K+ आयन से बहुत अधिक जलयोजित हो जाते हैं। इसलिए Lil, KI की तुलना में अधिक विलेय है।
प्रश्न 30.
इनमें से किस क्षार धातु का गलनांक न्यूनतम है?
(क) Na
(ख) K
(ग) Rb
(घ) Cs.
उत्तर:
(घ) Cs.
प्रश्न 31.
निम्नलिखित में से कौन-सी क्षार धातु जलयोजित लवण देती है?
(क) Li
(ख) Na
(ग) K
(घ) Cs.
उत्तर:
(क) Li
प्रश्न 32.
निम्नलिखित में से कौन-सी क्षारीय मृदा धातु कार्बोनेट ताप के प्रति सबसे अधिक स्थायी है ?
(क) MgCO3
(ख) CaCO3
(ग) SrCO3
(घ) BaCO3
उत्तर:
(घ) BaCO3