Haryana State Board HBSE 12th Class Chemistry Solutions Chapter 1 ठोस अवस्था Textbook Exercise Questions and Answers.
Haryana Board 12th Class Chemistry Solutions Chapter 1 ठोस अवस्था
प्रश्न 1.1.
‘अक्रिस्टलीय’ पद को परिभाषित कीजिए। अक्रिस्टलीय ठोसों के कुछ उदाहरण दीजिए।
उत्तर:
वे ठोस जिनमें अवयवी कणों (परमाणुओं, अणुओं या आयनों) की व्यवस्था केवल लघु परासी (short range) होती है तथा इनमें केवल कुछ दूरी तक ही नियमित एवं पुनरावृत्त पैटर्न (Repeating Pattern) होता है, उन्हें अक्रिस्टलीय ठोस कहते हैं। काँच, रबर तथा प्लास्टिक अक्रिस्टलीय ठोसों के उदाहरण हैं।
प्रश्न 1.2.
काँच, क्वार्ट्ज जैसे ठोस से किस प्रकार भिन्न है? किन परिस्थितियों में क्वार्ट्ज को काँच में रूपांतरित किया जा सकता है?
उत्तर:
काँच, सिलिका का अक्रिस्टलीय रूप है। इसका गलनांक निश्चित नहीं होता क्योंकि इसमें दीर्घ परासी नियमित संरचना नहीं होती। गर्म करने पर यह मुलायम हो जाता है। क्वार्ट्ज सिलिका (SiO2) का क्रिस्टलीय रूप है। इसका गलनांक निश्चित होता है तथा इसमें दीर्घ परासी नियमित व्यवस्था होती है। जब क्वार्ट्ज को गर्म करते हैं तथा गलित अवस्था में इसको तेजी से ठंडा किया जाता है तो यह काँच में रूपान्तरित हो जाता है।
![]()
प्रश्न 1.3.
निम्नलिखित ठोसों का वर्गीकरण आयनिक, धात्विक, आण्विक, सहसंयोजक या अक्रिस्टलीय में कीजिए:
(i) टेट्राफॉस्फोरस डेकॉक्साइड (P4O10)
(ii) अमोनियम फॉस्फेट, (NH4)3PO4
(iii) SiC
(iv) I2
(v) P4
(vi) प्लास्टिक
(vii) ग्रेफाइट
(viii) पीतल
(ix) Rb
(x) LiBr
(xi) Si
उत्तर:
(i) टेट्राफॉस्फोरस डेकॉक्साइड (P4O10) – आण्विक ठोस
(ii) अमोनियम फॉस्फेट, (NH4)3 PO4 – आयनिक ठोस
(iii) SiC (सिलिकन कार्बाइड) – सहसंयोजी ठोस (नेटवर्क ठोस)
(iv) I2 ( आयोडीन ) – आण्विक ठोस
(v) P4 (फॉस्फोरस) – आण्विक ठोस
(vi) प्लास्टिक – अक्रिस्टलीय
(vii) ग्रेफाइट – सहसंयोजी ठोस (नेटवर्क ठोस)
(viii) पीतल – धात्विक ठोस
(ix) Rb (रूबिडियम ) – धात्विक ठोस
(x) LiBr ( लीथियम ब्रोमाइड) – आयनिक ठोस
(xi) Si ( सिलिकन) – सहसंयोजी ठोस ( नेटवर्क ठोस )।
प्रश्न 1.4.
(i) उपसहसंयोजन संख्या का क्या अर्थ है ?
(ii) निम्नलिखित परमाणुओं की उपसहसंयोजन संख्या क्या होती है?
(क) एक घनीय निविड संकुलित संरचना
(ख) एक अंत: केंद्रित घनीय संरचना।
उत्तर:
(i) किसी ठोस संरचना में एक कण (परमाणु, अणु या आयन) के निकटतम कणों (गोलों) की संख्या को उपसहसंयोजन संख्या कहते हैं।
(ii) (क) एक घनीय निविड संकुलित संरचना में उपसहसंयोजन संख्या 12 होती है।
(ख) एक अंत: केंद्रित घनीय संरचना में उपसहसंयोजन संख्या 8 होती है।
प्रश्न 1.5.
यदि आपको किसी अज्ञात धातु का घनत्व एवं एकक कोष्ठिका की विमाएं ज्ञात हैं तो क्या आप उसके परमाण्विक द्रव्यमान की गणना कर सकते हैं? स्पष्ट कीजिए ।
उत्तर:
जब किसी अज्ञात धातु का घनत्व एवं एकक कोष्ठिका की विमाएं (dimension) ज्ञात हैं तो उसके परमाणु द्रव्यमान की गणना निम्नलिखित सूत्र से कर सकते हैं-
घनत्व (d) = \(\frac{\mathrm{z} \times \mathrm{M}}{\mathrm{a}^3 \times \mathrm{N}_{\mathrm{A}}}\)
यहाँ z = एक एकक कोष्ठिका में परमाणुओं की संख्या
M = परमाणु द्रव्यमान a= एकक कोष्ठिका के कोर की लम्बाई
NA = आवोगाद्रो संख्या
M के अलावा अन्य, मान सूत्र में रखकर, परमाणु द्रव्यमान (M) ज्ञात किया जा सकता है।
प्रश्न 1.6.
किसी क्रिस्टल की स्थिरता उसके गलनांक के परिमाण (magnitude) द्वारा प्रकट होती है’, टिप्पणी कीजिए। किसी आँकड़ा पुस्तक (data book) से जल, एथिल ऐल्कोहॉल, इथिल ईथर तथा मेथेन के गलनांक एकत्र करें। इन अणुओं के मध्य अंतराआण्विक बलों के बारे में आप क्या कह सकते हैं?
उत्तर:
किसी ठोस में कणों के मध्य आकर्षण बल अधिक होगा तो उसका गलनांक भी उच्च होगा तथा वह अधिक स्थायी होगा। इस प्रकार हम क्रिस्टल के स्थायित्व को गलनांक के परिमाण से समझा सकते हैं। अत: क्रिस्टलों का स्थायित्व, उसके गलनांक के समानुपाती होता है।
जल, एथिल ऐल्कोहॉल, डाइएथिल ईथर तथा मेथेन के गलनांक का क्रम निम्न प्रकार होता है:
मेथेन < डाइएथिल ईथर < एथिल ऐल्कोहॉल < जल।
अतः इन यौगिकों में अन्तराआण्विक आकर्षण बल का क्रम भी गलनांक जैसा ही होगा। जल में प्रबलतम अन्तराअणुक आकर्षण बल हाइड्रोजन बन्ध है अतः इसका गलनांक उच्चतम है, जबकि मेथेन में अन्तराअणुक आकर्षण बल सबसे दुर्बल है अतः इसका गलनांक न्यूनतम है।
प्रश्न 1.7.
निम्नलिखित युग्मों के पदों में कैसे विभेद करोगे?
(i) षट्कोणीय निविड संकुलन एवं घनीय निविड संकुलन
(ii) क्रिस्टल जालक एवं एकक कोष्ठिका
(iii) चतुष्फलकीय रिक्ति एवं अष्टफलकीय रिक्ति।
उत्तर:
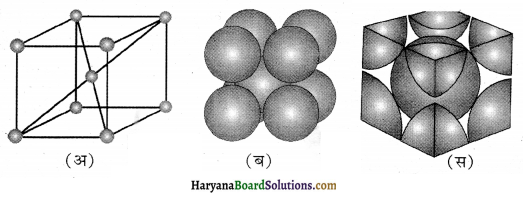
(i) षट्कोणीय निविड संकुलन ( hexagonal close. packing) में प्रत्येक तीसरी परत, पहली परत के समान होती है अतः इसे AB, AB….. संरचना भी कहते हैं। इसमें एक गोला, 6 गोलों से घिरा होता है जिनके केन्द्रों को मिलाने पर षट्कोण बनता है, अतः इसे षट्कोणीय निविड संकुलन कहते हैं; जबकि घनीय निविड संकुलन (cubic close packing) में प्रत्येक चौथी परत, पहली परत के समान होती है अत: इसे ABC, ABC….. संरचना कहते हैं।
(ii) जब क्रिस्टल में प्रत्येक कण को बिन्दु द्वारा दर्शाया जाए तब इन अवयवी कणों की त्रिविमीय व्यवस्था के आरेख को क्रिस्टल जालक कहते हैं अर्थात् अन्तराल या दिक् स्थान (space) में कणों (बिन्दुओं) की नियमित त्रिविमीय व्यवस्था को क्रिस्टल जालक कहते हैं जबकि एकक कोष्ठिका (unit cell) किसी क्रिस्टल जालक का वह सबसे छोटा भाग है जिसकी विभिन्न दिशाओं में पुनरावृत्ति से पूर्ण जालक का निर्माण होता है।
(iii) चार गोलों से बनी रिक्ति को चतुष्फलकीय रिक्ति कहते हैं। इन चार गोलों के केन्द्र को मिलाने पर एक चतुष्फलक बनता है। दो त्रिकोणीय रिक्तियों से बनी रिक्ति को अष्टफलकीय रिक्ति कहते हैं । यह रिक्ति छः गोलों से घिरी होती है लेकिन इसमें दो त्रिकोणीय रिक्तियों का अतिव्यापन नहीं होता।
प्रश्न 1.8.
निम्नलिखित जालकों में से प्रत्येक की एकक कोष्ठिका में कितने जालक बिंदु होते हैं?
(i) फलक-केंद्रित घनीय,
(ii) फलक – केंद्रित चतुष्कोणीय,
(iii) अंतःकेन्द्रित।
उत्तर:
(i) फलक- केन्द्रित घनीय तथा
(ii) फलक – केन्द्रित चतुष्कोणीय दोनों जालकों की एकक कोष्ठिका में चार जालक बिन्दु (परमाणु) होते हैं लेकिन
(iii) अन्तः केन्द्रित जालक की एकक कोष्ठिका में दो जालक बिन्दु होते हैं ।
अंतः केन्द्रित घनीय एकक कोष्ठिका (Body Centred Cubic Unit Cell):
अंतः केन्द्रित घनीय जालक की एकक कोष्ठिका में कुल दो परमाणु होते हैं जिसको निम्न प्रकार समझा सकते हैं
एक अंत: केंद्रित घनीय (bcc) एकक कोष्ठिका में एक परमाणु उसके प्रत्येक कोने पर और इनके अतिरिक्त एक परमाणु उसके अंत: केंद्र में होता है। इसमें अंत: केंद्र का परमाणु पूर्णतया उस एकक कोष्ठिका से ही सम्बन्धित होता है तथा कोने के परमाणु एकक कोष्ठिकाओं के मध्य सहभाजित होते हैं अतः
(a) 8 कोने के परमाणु × \(\frac { 1 }{ 8 }\) परमाणु प्रति एकक कोष्ठिका = 8 × \(\frac { 1 }{ 8 }\) = 1 परमाणु
(b) 1 अंत: केंद्र परमाणु = 1 × 1 = 1 परमाणु
अतः एक एकक कोष्ठिका में परमाणुओं की कुल संख्या = 2 परमाणु
फलक- केन्द्रित घनीय एकक कोष्ठिका (Face Centred Cubic Unit Cell):
फलक – केन्द्रित घनीय जालक की एकक कोष्ठिका में कुल चार परमाणु होते हैं जिसे निम्न प्रकार समझा सकते हैं।
फलक- केंद्रित घनीय (fcc) एकक कोष्ठिका में एक-एक परमाणु- सभी कोनों पर और घन के सभी फलकों के केंद्रों पर पाए जाते हैं। फलक के केंद्र पर उपस्थित प्रत्येक परमाणु दो निकटवर्ती एकक कोष्ठिकाओं के मध्य सहभाजित होता है अतः प्रत्येक परमाणु का केवल 1/2 भाग एक एकक कोष्ठिका में सम्मिलित होता है तथा कोने के परमाणु 8 एकक कोष्ठिकाओं के मध्य सहभाजित होते हैं अतः
(a) 8 कोने के परमाणु × \(\frac { 1 }{ 8 }\) परमाणु प्रति एकक कोष्ठिका = 8 × \(\frac { 1 }{ 8 }\) = 1 परमाणु
(b) 6 फलक-केंद्रित परमाणु × \(\frac { 1 }{ 2 }\) परमाणु प्रति एकक कोष्ठिका = 6 × \(\frac { 1 }{ 2 }\) = 3 परमाणु
अतः एक एकक कोष्ठिका में परमाणुओं की कुल संख्या = 1 + 3 = 4 परमाणु

![]()
प्रश्न 1.9.
समझाइए:
(i) धात्विक एवं आयनिक क्रिस्टलों में समानता एवं विभेद का आधार।
(ii) आयनिक ठोस कठोर एवं भंगुर होते हैं।
उत्तर:
(i) धात्विक एवं आयनिक क्रिस्टलों में समानता एवं विभेद निम्नलिखित हैं।
समानताएँ:
(1) धात्विक ठोस तथा आयनिक ठोस दोनों ही कठोर होते हैं।
(2) धात्विक ठोस तथा आयनिक ठोस दोनों के गलनांक उच्च होते हैं।
(3) धात्विक ठोस तथा आयनिक ठोस दोनों ही गलित अवस्था में विद्युत के चालक होते हैं।
विभेद:
(1) धात्विक क्रिस्टल में अवयवी कण धनायन होते हैं जो मुक्त तथा गतिशील इलेक्ट्रॉनों के समुद्र में डूबे रहते हैं। जबकि आयनिक ठोस में अवयवी कण धनायन तथा ऋणायन होते हैं।
(2) धात्विक ठोस में धात्विक बन्ध होता है जबकि आयनिक ठोस में आयनिक बन्ध होता है।
(3) धात्विक ठोस आघातवर्धनीय एवं तन्य होते हैं जबकि आयनिक ठोस भंगुर होते हैं।
(4) धात्विक ठोस विद्युत के अच्छे चालक होते हैं जबकि आयनिक ठोस कुचालक होते हैं, क्योंकि आयन गतिशील नहीं होते।
(ii) आयनिक ठोस कठोर तथा भंगुर होते हैं क्योंकि इनमें आयनों के मध्य प्रबल स्थिर विद्युत आकर्षण बल होता है तथा बल लगाने पर समान आवेश की पर्तें एक-दूसरे के सामने आ जाती हैं जिससे प्रतिकर्षण होता है तथा यौगिक टुकड़े-टुकड़े हो जाता है अर्थात् भंगुर होता है।
प्रश्न 1.10.
निम्नलिखित के लिए धातु के क्रिस्टल में संकुलन क्षमता की गणना कीजिए:
(i) सरल घनीय,
(ii) अंत: केंद्रित घनीय,
(iii) फलक के न्द्रित घनीय।
( यह मानते हुए कि परमाणु एक-दूसरे के संपर्क में हैं ।)
उत्तर:
(i) सरल घनीय धातु क्रिस्टल की संकुलन क्षमता 52.4%,
(ii) अन्तः केन्द्रित घनीय धातु क्रिस्टल की संकुलन क्षमता 68% तथा
(iii) फलक- केन्द्रित घनीय धातु क्रिस्टल की संकुलन क्षमता 74% होती है।
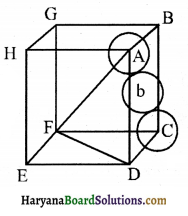
षट्कोणीय निविड संकुलन (hcp) तथा घनीय निवि संकुलन (ccp या fcc) संरचनाओं में संकुलन क्षमता:
घनीय निविड संकुलन (ccp) क्रिस्टल की संकुलन क्षमता 74% होती है जिसकी गणना निम्न प्रकार की जाती है
hcp तथा fcc (ccp) की संकुलन क्षमता समान होती है। चित्र के अनुसार एकक कोष्ठिका के कोर (Edge) या किनारे की लम्बाई ‘a’ हो तथा फलक विकर्ण AC = b हो, तो
△ABC में,
AC2 = b2 = BC2 + AB2
= a2 + a2 = 2a2
या b = √2 a
यदि गोले का अर्धव्यास (त्रिज्या ) r हो, तो
b = 4r = √2 a
या a = \(\frac { 4r }{ √2 }\) = 2√2r
या r = \(\frac { a }{ 2√2 }\)
ccp संरचना में प्रति एकक कोष्ठिका 4 गोले होते हैं । अतः चार गोलों का कुल आयतन 4 × (4/3) πr3 के बराबर होगा और घन का आयतन a3 या (2√2r)3 होता है । अतः
संरचना की संकुलन क्षमता

अन्तःकेन्द्रित ( काय- केन्द्रित ) (bec) घनीय संरचनाओं की संकुलन क्षमता (Packing Efficiency of Body- centred Cubic Structure):
अंत: केंद्रित घनीय क्रिस्टल की संकुलन क्षमता 68% होती है जिसकी गणना निम्न प्रकार की जाती है
चित्र से स्पष्ट है कि केंद्र में स्थित परमाणु विकर्ण पर स्थित अन्य दो परमाणुओं के संपर्क में हैं।
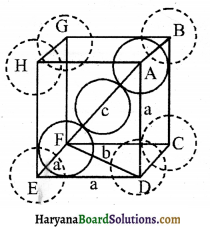
△EFD में,
b2 = a2 + a2 = 2a2
b = √2 a
अब △AFD में,
c2 = a2 + b2 = a2 + 2a2 = 3a2
c=√3a
काय विकर्ण (Body diagonal) ‘c’ की लंबाई 4r के बराबर है, जहाँ गोले का अर्धव्यास (त्रिज्या) है, क्योंकि विकर्ण पर स्थित तीनों गोले एक-दूसरे के संपर्क में हैं । अतः
√3a = 4r
a = \(\frac { 4r }{ √3 }\)
अतः r = \(\frac { √3 }{ 4 }\)a
इस संरचना में परमाणुओं की कुल संख्या 2 है अतः उनका आयतन
2 × (4/3)πr3 होगा तथा घन का आयतन a3 = \(\left(\frac{4}{\sqrt{3}} \mathrm{r}\right)^3\) है।
अतः, संरचना की संकुलन क्षमता

![]()
सरल घनीय संरचना की संकुलन क्षमता (Packing Efficiency of Simple Cubic Structure):
सरल घनीय क्रिस्टल की संकुलन क्षमता 52.4 प्रतिशत होती है जिसकी गणना निम्नलिखित है।
एक सरल घनीय जालक में परमाणु केवल घन के कोनों पर स्थित होते हैं। घन के किनारों पर स्थित कण एक-दूसरे के सम्पर्क में रहते हैं।
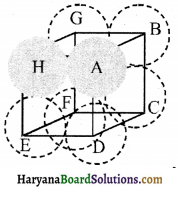
इसलिए घन की भुजा की लंबाई ‘a’ और प्रत्येक कण की त्रिज्या, r में निम्न संबंध है।
a = 2r
अतः घनीय एकक कोष्ठिका का आयतन = a3 = (2r)3 = 8r3 चूँकि सरल घनीय एकक कोष्ठिका में केवल 1 परमाणु उपस्थित व्होता है।
इसलिए घेरे गए त्रिविमीय स्थान का आयतन = \(\frac { 4 }{ 3 }\)πr3
अतः, संरचना की संकुलन क्षमता

प्रश्न 1.11.
चाँदी का क्रिस्टलीकरण fice जालक में होता है। यदि इसकी कोष्ठिका के कोरों की लंबाई 4.07 × 10-8cm तथा घनत्व 10.5 g cm-3 हो तो चाँदी का परमाण्विक द्रव्यमान ज्ञात कीजिए।
उत्तर:
प्रश्नानुसार, एकक कोष्ठिका के कोर (edge) की लम्बाई a = 4.07 × 10-8 cm तथा घनत्व (d) = 10.5 g cm-3
z = 4 क्योंकि fcc की एकक कोष्ठिका में परमाणुओं की संख्या 4 होती है। NA = आवोगाद्रो संख्या = 6.022 × 10-23
घनत्व (d) = \(\frac{\mathrm{zM}}{\mathrm{a}^3 \mathrm{~N}_{\mathrm{A}}}\)
परमाणु द्रव्यमान ज्ञात करना है अतः 10-23
M = \(\frac{\mathrm{d} \times \mathrm{a}^3 \times \mathrm{N}_{\mathrm{A}}}{\mathrm{z}}\) = \(\frac{10.5 \times\left(4.07 \times 10^{-8}\right)^3 \times 6.022 \times 10^{23}}{4}\) = 106.57
अतः चाँदी का परमाणु द्रव्यमान = 106.57
प्रश्न 1.12.
एक घनीय ठोस दो तत्वों P एवं Q से बना है। घन के कोनों पर Q परमाणु एवं अंत:- केंद्र पर P परमाणु स्थित हैं । इस यौगिक का सूत्र क्या है? P एवं Q की उपसहसंयोजन संख्या क्या है?
उत्तर:
एकक कोष्ठिका में घन के कोनों पर स्थित परमाणु का योगदान \(\frac { 1 }{ 8 }\) होता है जबकि अंत: केन्द्र पर स्थित परमाणु का योगदान 1 होता है।
अतः एक एकक कोष्ठिका में:
Q परमाणुओं की संख्या = 8 ( कोनों पर ) × \(\frac { 1 }{ 8 }\) = 1
P परमाणुओं की संख्या = 1 ( कायकेन्द्रित या अन्तः केन्द्रित ) × 1 = 1
अतः यौगिक का सूत्र PQ होगा।
अंत:केन्द्र (कायकेन्द्रित) पर स्थित परमाणु, कोनों पर स्थित सभी परमाणुओं के सम्पर्क में रहता है अतः P की उपसहसंयोजन संख्या 8 होगी। इसी प्रकार Q की उपसहसंयोजन संख्या भी 8 होगी।
प्रश्न 1.13.
नायोबियम का क्रिस्टलीकरण अंतःकेन्द्रित घनीय संरचना में होता है । यदि इसका घनत्व 8.55 g cm-3 हो तो इसके परमाण्विक द्रव्यमान 93 u का प्रयोग करके परमाणु त्रिज्या की गणना कीजिए।
उत्तर:
अंतःकेंद्रित घनीय संरचना ( bcc) में एक एकक कोष्ठिका में परमाणुओं की संख्या 2 होती है।
अतः
z = 2, M = 93 u, NA = 6.022 × 1023
d = 8.55 g cm-3
घनत्व (d) = \(\frac{z \times M}{a^3 \times N_A}\)
चूंकि परमाणु त्रिज्या ज्ञात करनी है अतः
a3 = \(\frac{\mathrm{z} \times \mathrm{M}}{\mathrm{d} \times \mathrm{N}_{\mathrm{A}}}\)
a3 = \(\frac{2 \times 93}{8.55 \times 6.022 \times 10^{23}}\)
a3 = 3.61 × 10-23 cm3
a = 3.305 × 10-8 cm = 3.305 × 10-10 m
a = 3.305 × 102 pm (पिकोमीटर) = 330.5 pm
लेकिन bcc की एकक कोष्ठिका में विकर्ण, परमाणु की त्रिज्या का चार गुना होता है।
अतः
4r = √3a
4r = √3 × 330.5
r = \(\frac{\sqrt{3} \times 330.5}{4}\) = 143.1 pm.
अतः नायोबियम की परमाणु त्रिज्या = 143.1pm
प्रश्न 1.14.
यदि अष्टफलकीय रिक्ति की त्रिज्या हो तथा निविड संकुलन में परमाणुओं की त्रिज्या R हो, तो r एवं R में संबंध स्थापित कीजिए।
उत्तर:
संलग्न चित्र में एक अष्टफलकीय रिक्ति को दिखाया गया है। सुविधा के लिए 6 में से केवल 4 गोलों को ही दिखाया गया है। रिक्ति के ऊपर व नीचे के गोलों को नहीं दर्शाया गया है।
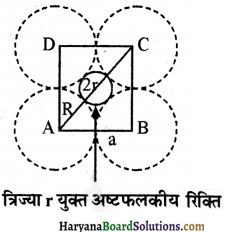
माना कि वर्ग ABCD की प्रत्येक भुजा की लम्बाई = a cm समकोण त्रिभुज ABC में, विकर्ण AC है तो-
AC = \(\sqrt{A B^2+B C^2}\) = \(\sqrt{a^2+a^2}\) = √2.a.
लेकिन AC = 2R + 2r
∴ 2R + 2r = √2a
लेकिन a = 2R
∴ 2R + 2r = √2.2R
इस समीकरण को 2R से भाग देने पर,
1 + \(\frac { r }{ R }\) = √2
\(\frac { r }{ R }\) = √2 – 1 = 1.414 – 1 = 0.414
अतः = \(\frac { r }{ R }\) = 0.414
r = अष्टफलकीय रिक्ति की त्रिज्या
R = परमाणु (गोले ) की त्रिज्या
![]()
प्रश्न 1.15.
कॉपर fcc जालक के रूप में क्रिस्टलीकृत होता है जिसके कोर की लंबाई 3.61 × 10-8 cm है। यह दर्शाइए कि गणना किए गए घनत्व के मान तथा मापे गए घनत्व 8.92 g cm-3 में समानता है।
उत्तर:
fcc संरचना में z = 4 (एकक कोष्ठिका में परमाणुओं की संख्या)
Cu का परमाणु द्रव्यमान (M) = 63.5 होता है।
कोर की लम्बाई a = 3.61 × 10-8 cm
घनत्व (d) = \(\frac{M \times z}{N_A \times a^3}\)
d = \(\frac{63.5 \times 4}{\left(6.022 \times 10^{23}\right) \times\left(3.61 \times 10^{-8}\right)^3}\)
d = \(\frac{63.5 \times 4}{6.022 \times 10^{23} \times 47.04 \times 10^{-24}},\)
d = 8.966 = 8.97 g cm-3
चूंकि मापा गया घनत्व 8.92 g cm-3 है। अतः गणना किए गए घनत्व तथा मापे गए घनत्व में समानता है।
प्रश्न 1.16.
विश्लेषण द्वारा ज्ञात हुआ कि निकैल ऑक्साइड का सूत्र Ni0.98O1.00 है । निकैल आयनों का कितना अंश Ni2+ और Ni-3+ के रूप में विद्यमान है?
उत्तर:
निकल ऑक्साइड का सूत्र Ni0.98O1.00 है जिसमें Ni2+ तथा Ni3+ दोनों आयन उपस्थित हैं।
सूत्रानुसार Ni = 98 तथा O-2 = 100 है।
माना Ni2+ आयन = x
अतः Ni3+ आयन = 98 – x
अतः कुल धनावेश = (x × 2) + [(98 – x) × 3]
तथा कुल ऋणावेश = 100 × 2
यौगिक उदासीन होता है अतः कुल धनावेश = कुल ऋणावेश होगा
(x × 2) + [(98 – x) × 3] = 100 × 2
(2x) + (294 – 3x) = 200
– x = – 94
x = 94
अतः Ni2+ आयनों का अंश (प्रतिशत)
\(\frac { 94 }{ 98 }\) × 100 = 95.9 = 96%
Ni3+ आयनों का अंश (प्रतिशत) = 100 – 96 = 4%
प्रश्न 1.17.
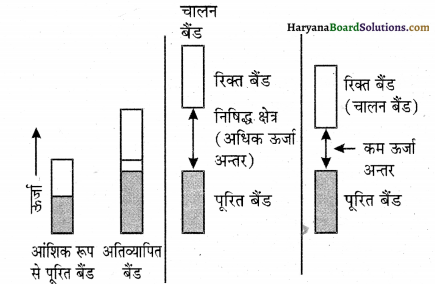
अर्धचालक क्या होते हैं? दो मुख्य अर्धचालकों का वर्णन कीजिए एवं उनकी चालकता – क्रियाविधि में विभेद कीजिए।
उत्तर:
अर्धचालक (Semiconductors) – अर्धचालक वे ठोस होते हैं जिनकी चालकता 10-6 से 104 ohm m-1 के बीच की होती है अर्थात् इनकी चालकता चालकों से कम तथा विद्युतरोधी से अधिक होती है। अर्धचालकों में संयोजक बैंड एवं चालक बैंड के मध्य ऊर्जा अंतराल कम होता है। अतः कुछ इलेक्ट्रॉन चालक बैंड में जा सकते हैं अतः ये अल्प चालकता दर्शा सकते हैं। ताप बढ़ने के साथ अर्धचालकों की विद्युत चालकता बढ़ती है, क्योंकि अधिक संख्या में इलेक्ट्रॉन चालक बैंड में चले जाते हैं। उदाहरण-सिलिकन एवं जरमेनियम, इन्हें आंतर या नैज अर्धचालक (Intrinsic semiconductors) कहते हैं। नैज-अर्धचालकों की चालकता व्यवहारिक उपयोग की दृष्टि से बहुत कम होती है।
प्रश्न 1.18.
नानस्टॉइ कियोमीट्री क्यूप्रस ऑक्साइड, (Cu2O) प्रयोगशाला में बनाया जा सकता है। इसमें कॉपर तथा ऑक्सीजन का अनुपात 2 : 1 से कुछ कम है। क्या आप इस तथ्य की व्याख्या कर सकते हैं कि यह पदार्थ p- प्रकार का अर्धचालक है?
उत्तर:
नॉनस्टॉइकियोमीट्री क्यूप्रस ऑक्साइड (Cu2O) में कॉपर तथा ऑक्सीजन का अनुपात 2:1 से कुछ कम है। अतः कुछ क्यूप्रस आयन (Cu+) अपने स्थान से गायब होकर पीछे धनात्मक छिद्र छोड़ देते हैं, लेकिन विद्युत उदासीनता को बनाए रखने के लिए कुछ Cu+1 आयन, Cu+2 में परिवर्तित हो जाते हैं। (Cu, Cu+ तथा Cu+2 दोनों ऑक्सीकरण अवस्था दर्शाता है।) इसमें धनात्मक छिद्र होते हैं अतः यह p-प्रकार का चालक है।
प्रश्न 1.19.
फेरिक ऑक्साइड, ऑक्साइड आयन के षट्कोणीय निविड संकुलन में क्रिस्टलीकृत होता है जिसकी तीन अष्टफलकीय रिक्तियों में से दो पर फेरिक आयन होते हैं । फेरिक ऑक्साइड का सूत्र ज्ञात कीजिए ।
उत्तर:
फेरिक ऑक्साइड में ऑक्साइड आयन षट्कोणीय निविड संकुलन व्यवस्था में है जिसमें प्रत्येक ऑक्साइड आयन के लिए एक अष्टफलकीय रिक्ति होती है जिनमें तीन में से दो रिक्तियाँ Fe+3 आयन द्वारा भरी होती हैं । अतः प्रत्येक O2- आयन के लिए Fe+3 आयनों की संख्या =2/3
अतः Fe+3 तथा O-2 का अनुपात = \(\frac { 2 }{ 3 }\):1 (Fe: O)
अतः फेरिक ऑक्साइड का सूत्र Fe2O3 होगा।
प्रश्न 1.20.
निम्नलिखित को p- प्रकार या n – प्रकार के अर्धचालकों में वर्गीकृत कीजिए।
(i) In से डोपित Ge
(ii) B से डोपित Si
उत्तर:
(i) In से डोपित Ge, p-प्रकार का अर्धचालक होता है क्योंकि Ge के संयोजी कोश में चार इलेक्ट्रॉन हैं (14वां वर्ग)। जब इसको In (13वें वर्ग) से डोपित करते हैं जिसके बाह्यतम कोश में तीन इलेक्ट्रॉन हैं, तो Ge केवल तीन बन्ध ही बनाता है अतः बन्ध बनाने के लिए एक इलेक्ट्रॉन की कमी है इसलिए यह इलेक्ट्रॉन न्यून (धनात्मक) छिद्र होगा, अतः यह p – प्रकार का अर्धचालक होगा।
(ii) यह भी (i) के समान p-प्रकार का अर्धचालक ही होगा क्योंकि B 13वें वर्ग का तथा Si. 14वें वर्ग का तत्व है।
प्रश्न 1.21.
सोना (परमाणु त्रिज्या = 0.144 nm ) फलक- केंद्रित एकक कोष्ठिका में क्रिस्टलीकृत होता है। इसकी कोष्ठिका के कोर की लंबाई ज्ञात कीजिए।
उत्तर:
प्रश्नानुसार सोने (Au) की परमाणु त्रिज्या r = 0.144 nm. फलक – केन्द्रित एकक कोष्ठिका में, फलक विकर्ण =4r=√2a
अतः a = \(\frac { 4r }{ √2 }\) = 2√2 r
= 2 × 1.414 × 0.144 nm = 0.407 nm
अतः एकक कोष्ठिका के कोर (Edge) की लम्बाई = 0.407
प्रश्न 1.22.
बैंड सिद्धांत के आधार पर (i) चालक एवं रोधी (ii) चालक एवं अर्धचालक में क्या अंतर होता है?
उत्तर:
(i) चालक वे ठोस होते हैं जिनकी चालकता 104 से 107 ohm-1 m-1 के मध्य होती है तथा रोधी (विद्युतरोधी) वे ठोस होते हैं जिनकी चालकता बहुत ही कम 10-20 से 10-10 ohm-1 m-1 की परास में होती है।
चालकों में बैंड आंशिक रूप से भरा होता है या यह एक उच्च ऊर्जा वाले रिक्त चालकता बैंड के साथ अतिव्यापन करता है अतः विद्युत क्षेत्र में इलेक्ट्रॉन आसानी से प्रवाहित हो जाते हैं जिससे धातु (चालक) चालकता दर्शाती हैं। जबकि विद्युतरोधी में पूर्ण पूरित संयोजी बैंड एवं उच्च रिक्त बैंड (चालकता बैंड) में ऊर्जा अन्तराल अधिक होता है जिससे इलेक्ट्रॉन चालकता बैंड में नहीं जा सकते, अतः इनकी चालकता नगण्य होती है।
(ii) चालक में आंशिक भरे बैंड होते हैं या अतिव्यापित बैंड होते हैं जिनमें इलेक्ट्रॉन का प्रवाह आसानी से हो जाता है जबकि अर्धचालकों में संयोजी बैंड तथा चालन बैंड के मध्य अंतराल कम होता है अतः कुछ इलेक्ट्रॉन चालन बैंड में चले जाते हैं, अतः इनकी चालकता कम होती है।
प्रश्न 1.23.
उचित उदाहरणों द्वारा निम्नलिखित पदों को परिभाषित कीजिए:
(i) शॉट्की दोष,
(ii) फ्रेंकेल दोष,
(iii) अंतराकाशी दोष,
(iv) F-केंद्र।
उत्तर:
(b) शॉट्की दोष या शॉट्की त्रुटि (Schottky defect) – यह मुख्य रूप से आयनिक ठोसों का रिक्तिका दोष (vacancy defect) है। विद्युत उदासीनता को बनाए रखने के लिए क्रिस्टल से गायब होने वाले धनायनों और ऋणायनों की संख्या बराबर होती है अर्थात् धनायन तथा ऋणायन दोनों ही अपने स्थान से गायब हो जाते हैं। सरल रिक्तिका दोष की भाँति, शॉट्की दोष से भी पदार्थ का घनत्व कम हो जाता है। आयनिक ठोसों के ऐसे दोषों में संख्या महत्वपूर्ण हो ती है।
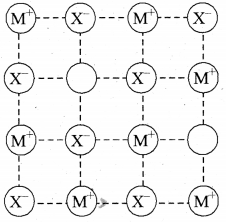
जैसे NaCl में कमरे के ताप पर लगभग 106 शॉट्की युगल प्रति cm3 होते हैं। एक cm3 में करीब 1022 आयन होते हैं। इस प्रकार प्रति 1016 आयनों में एक शॉट्की दोष होता है। शॉट्की दोष उन आयनिक पदार्थों में होता है जिनमें धनायन और ऋणायन लगभग समान आकार के होते हैं तथा जिनकी समन्वयी संख्या उच्च होती है। उदाहरण NaCl, KCl, CsCl | AgBr में फ्रेंकेल तथा शॉट्की दोनों ही प्रकार के दोष होते हैं।
(ii) किसी क्रिस्टल जालक में जब कुछ अवयवी कण अंतरांकाशी स्थल पर उपस्थित होते हैं तो इसे अंतराकाशी दोष कहते हैं। इससे पदार्थ का घनत्व बढ़ जाता है। रिक्तिका दोष तथा अंतराकाशी दोष अनआयनिक ठोसों में पाए जाते हैं। आयनिक ठोसों में विद्युत उदासीनता रहना आवश्यक है। अतः इन दोषों को फ्रेंकेल तथा शॉट्की दोषों के रूप में वर्गीकृत किया जाता है।

(iii) अन्तराकाशी दोष (Interstitial defect ) – किसी क्रिस्टल जालक में जब कुछ अवयवी कण अंतरांकाशी स्थल पर उपस्थित होते हैं तो इसे अंतराकाशी दोष कहते हैं। इससे पदार्थ का घनत्व बढ़ जाता है। रिक्तिका दोष तथा अंतराकाशी दोष अनआयनिक ठोसों में पाए जाते हैं। आयनिक ठोसों में विद्युत उदासीनता रहना आवश्यक है। अतः इन दोषों को फ्रेंकेल तथा शॉट्की दोषों के रूप में वर्गीकृत किया जाता है।
(iv) F- केन्द्र–नानस्टॉइकियोमीट्री दोष में धातु का आधिक्य हो F-केन्द्र उत्पन्न होता है, जैसे NaCl के क्रिस्टल को सोडियम वाष्प के साथ गर्म करते हैं तो सोडियम परमाणु क्रिस्टल की सतह पर जम जाते हैं। Cl– आयन क्रिस्टल की सतह में विसरित हो जाते हैं तथा Na के साथ मिलकर NaCl बनाते हैं, ऐसा होने पर Na, इलेक्ट्रॉन देकर Na+ बनाता है। यह निकला हुआ इलेक्ट्रॉन विसरण द्वारा क्रिस्टल के ऋणायनिक स्थान (CI– के कारण रिक्त) में चला जाता है। इस अयुग्मित इलेक्ट्रॉनयुक्त ऋणायनिक रिक्तिका को F-केन्द्र कहते हैं। (यह रंग केंद्र के लिए जर्मन शब्द फारबेनजेनटर से आया है) इससे NaCl के क्रिस्टलों का रंग पीला हो जाता है।
![]()
प्रश्न 1.24.
ऐलुमिनियम घनीय निविड संकुलित संरचना में क्रिस्टलीकृत होता है। इसका धात्विक अर्धव्यास 125 pm है।
(i) एकक कोष्ठिका के कोर की लंबाई ज्ञात कीजिए ।
(ii) 1.0 cm3 ऐलुमिनियम में कितनी एकक कोष्ठिकाएं होंगी?
उत्तर:
(i) घनीय निविड संकुलित संरचना में एकक कोष्ठिका का फलक विकर्ण (Face diagonal) परमाणु त्रिज्या (अर्धव्यास) का चार गुना होता है।
लेकिन, फलक विकर्ण = √2 × कोर की लम्बाई
कोर की लम्बाई = \(\frac { फलक विकर्ण }{ √2 }\)
फलक विकर्ण = 4 × 125 pm = 500 pm
अतः एकक कोष्ठिका के कोर की लम्बाई
= \(\frac { 500 }{ √2 }\) = 353.6 = 354 pm = a
(ii) एक एकक कोष्ठिका का आयतन = a3
a = 354 pm = 354 × 10-8 m
= 3.54 × 10-8 cm
अत: a3 = (3.54 × 10-8 cm)3
अत: 1cm3 ऐलुमिनियम में एकक कोष्ठिकाओं की संख्या
= \(\frac{1.00}{\left(3.54 \times 10^{-8}\right)^3}\) = 2.25 × 1022
प्रश्न 1.25.
यदि NaCl को SrCl2 के 103 मोल % से डोपित किया जाए तो धनायनों की रिक्तियों का सांद्रण क्या होगा?
उत्तर:
Na का आवेश +1 है जबकि Sr का आवेश +2 है अतः NaCl में SrCl2 मिलाने पर प्रति Sr2+ एक धनायन रिक्ति होगी क्योंकि 2Na+ के स्थान पर एक Sr2+ आएगा।
अतः 100 मोल NaCl में 10-3 मोल SrCh मिलाने पर 10-3 मोल धनायन रिक्ति उत्पन्न होगी। ( SrCl2 10-3 मोल % मिलाया गया है।) अतः NaCl के एक मोल में धनायन रिक्तियों की संख्या
= \(\frac{10^{-3}}{100}\) × 6.022 × 1023 ( आवोगाद्रो संख्या )
= 6.022 × 1018 धनायन रिक्ति प्रति मोल
प्रश्न 1.26.
निम्नलिखित को उचित उदाहरणों से समझाइए:
(i) लोहचुंबकत्व
(iii) फेरीचुंबकत्व
(ii) अनुचुंबकत्व
(iv) प्रतिलोहचुंबकत्व
(v) 12-16 और 13-15 वर्गों के यौगिक।
उत्तर:
(i) अनुचुम्बकीय (Paramagnetic): वे पदार्थ जो चुंबकीय क्षेत्र की ओर दुर्बलता से आकर्षित होते हैं उन्हें अनुचुंबकीय पदार्थ कहते हैं। ये चुम्बकीय क्षेत्र की दिशा में ही चुम्बकित हो जाते हैं। ये चुंबकीय क्षेत्र की अनुपस्थिति में अपना चुंबकत्व खो देते हैं अतः इनका चुम्बकीय गुण अस्थायी होता है, इस गुण को अनुचुम्बकत्व कहते है । अनुचुंबकत्व गुण के लिए पदार्थ में एक अथवा अधिक अयुग्मित इलेक्ट्रॉनों की उपस्थिति आवश्यक है। जो कि चुम्बकीय क्षेत्र की ओर आकर्षित होते हैं। उदाहरण – O2, TiO, CuO, Cu2+, Fe3+, VO2, TiO2, Cr3+ आदि।
(ii) प्रतिचुंबकीय (Dimagnetic ): प्रतिचुंबकीय पदार्थ वे होते हैं जो चुंबकीय क्षेत्र में रखने पर दुर्बल रूप से प्रतिकर्षित होते हैं। ये चुंबकीय क्षेत्र की विपरीत दिशा में दुर्बल रूप से चुंबकित होते हैं। प्रतिचुंबकत्व उन पदार्थों में होता है जिनमें सभी इलेक्ट्रॉन युग्मित होते हैं। इलेक्ट्रॉनों के युग्मन के कारण इनके चुंबकीय आघूर्ण आपस में निरस्त हो जाते हैं क्योंकि इलेक्ट्रॉनों का चक्रण विपरीत होता है, अतः इनका चुंबकीय गुण नष्ट हो जाता है । उदाहरण – V2O5, TiO2, Zn+2, Na+, K+, Mg2+, बेन्जीन (C6H6), सोडियम क्लोराइड (NaCl) तथा जल (H2O) आदि।
(iii) लोहचुम्बकीय (Ferromagnetic ): वे पदार्थ जिन्हें चुम्बकीय क्षेत्र में रखने पर उसकी ओर बहुत प्रबलता से आकर्षित होते हैं, उन्हें लोहचुम्बकीय पदार्थ तथा पदार्थों के इस गुण को लोहचुम्बकत्व कहते हैं। प्रबल आकर्षणों के अतिरिक्त ये स्थायी रूप से चुम्बकित किए जा सकते हैं। इनमें भी अयुग्मित इलेक्ट्रॉन पाए जाते हैं। ठोस अवस्था में, लोहचुम्बकीय पदार्थों के धातु आयन छोटे खण्डों के रूप में एक साथ समूह बना लेते हैं, इन्हें डोमेन कहते हैं।
प्रत्येक डोमेन छोटे चुम्बक की भाँति व्यवहार करता है। लोहचुम्बकीय पदार्थ के अचुम्बकीय भाग में डोमेन अनियमित रूप से व्यवस्थित होते हैं और उनका चुम्बकीय आघूर्ण निरस्त हो जाता है। पदार्थ को चुम्बकीय क्षेत्र में रखने पर सभी डोमेन चुम्बकीय क्षेत्र की दिशा में अभिविन्यासित ( Oriented) हो जाते हैं और प्रबल चुम्बकीय प्रभाव उत्पन्न करते हैं । चुम्बकीय क्षेत्र हटा लेने पर भी डोमेनों का क्रम वही रहता है और लोहचुम्बकीय पदार्थ स्थायी चुम्बक बन जाते हैं। उदाहरण– Fe, Co, Ni, Gd तथा CrO2 आदि। लोहचुम्बकीय गुण के कारण ही CrO2 को कैसेट की टेप बनाने में प्रयुक्त करते हैं।

(iv) प्रतिलोहचुम्बकीय (Antiferromagnetic): ये पदार्थ भी डोमेन संरचना में लोहचुम्बकीय पदार्थों के ही समान होते हैं लेकिन इनके डोमेन एक-दूसरे की विपरीत दिशाओं में अभिविन्यासित होने के कारण इनका चुम्बकीय आघूर्ण नष्ट हो जाता है। इस गुण को प्रति लोहचुम्बकत्व कहा जाता है।
उदाहरण – V2O3, Cr2O3, Fe2O3, FeO, Col, NiO, MnO, Mn2O2, Mn2O3 आदि।

(v) 12-16 और 13-15 वर्गों के यौगिक- वर्ग 13 तथा 15 एवं वर्ग 12 तथा 16 के तत्वों के मिश्रण से अनेक प्रकार के ठोस पदार्थ बनाए गए हैं। वर्ग 13-15 के यौगिक InSb, AlP तथा GaAs हैं। गैलियम आर्सेनाइड (GaAs) तथा त्वरित प्रतिसंवेदी (Fast response) अर्धचालक होते हैं; ZnS, Cas, Case तथा HgTe, वर्ग 12-16 के यौगिकों के उदाहरण हैं। इन यौगिकों में बंध पूर्णतया सहसंयोजक नहीं होते तथा इनके आयनिक गुण दोनों तत्वों की विद्युत ऋणता पर निर्भर करते हैं। ये भी अर्धचालक होते हैं।
HBSE 12th Class Chemistry ठोस अवस्था Intext Questions
प्रश्न 1.1.
ठोस कठोर क्यों होते हैं?
उत्तर:
ठोसों में उपस्थित अवयवी कणों का निविड संकुलन (Close packing) होता है जिसके कारण इनमें कण पास-पास होते हैं तथा ये कण गति नहीं करते, केवल अपनी माध्य स्थिति के दोनों ओर कम्पन करते हैं; अतः ठोस कठोर होते हैं।
प्रश्न 1.2.
ठोसों का आयतन निश्चित क्यों होता है?
उत्तर:
ठोसों में कणों की व्यवस्था निश्चित दूरी पर होती है तथा इनके कणों में कोई गति नहीं होती एवं कणों के मध्य रिक्त स्थान बहुत ही कम होता है। इन पर दाब का भी कोई प्रभाव नहीं होता, अतः इनका आयतन निश्चित होता है।
प्रश्न 1.3.
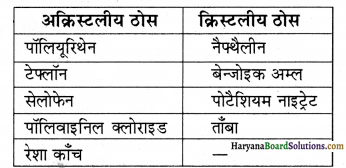
निम्नलिखित को अक्रिस्टलीय तथा क्रिस्टलीय ठोसों में वर्गीकृत कीजिए।
पॉलियूरिथेन, नैफ्थैलीन, बेन्जोइक अम्ल, टेफ्लॉन, पोटैशियम नाइट्रेट, सेलोफेन, पॉलिवाइनिल क्लोराइड, रेशा काँच, ताँबा।
उत्तर:
प्रश्न 1.4.
एक ठोस के अपवर्तनांक का सभी दिशाओं में समान मान प्रेक्षित होता है। इस ठोस की प्रकृति पर टिप्पणी कीजिए। क्या यह विदलन गुण प्रदर्शित करेगा?
उत्तर:
ठोस के अप्रवर्तनांक (भौतिक गुण) का मान सभी दिशाओं में समान प्रेक्षित हो रहा है, अतः यह ठोस समदैशिक (Isotropic) है इसी कारण यह अक्रिस्टलीय ठोस है। यह विदलन का गुण प्रदर्शित नहीं करेगा।
प्रश्न 1.5.
उपस्थित अंतराआण्विक बलों की प्रकृति के आधार पर निम्नलिखित ठोसों को विभिन्न संवर्गों में वर्गीकृत कीजिए-
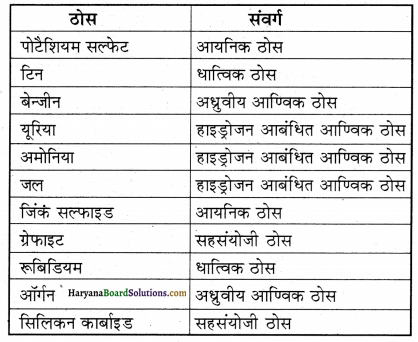
पोटैशियम सल्फेट, टिन, बेन्जीन, यूरिया, अमोनिया, जल, जिंक सल्फाइड, ग्रेफाइट, रूबिडियम, ऑर्गन, सिलिकन कार्बाइड।
उत्तर:
अंतराआण्विक बलों की प्रकृति के आधार पर उपर्युक्त ठोसों के विभिन्न संवर्ग निम्न प्रकार होंगे-
प्रश्न 1.6.
ठोस A, अत्यधिक कठोर तथा ठोस एवं गलित दोनों अवस्थाओं में विद्युतरोधी है और अत्यंत उच्च ताप पर पिघलता है। यह किस प्रकार का ठोस है?
उत्तर:
ठोस A, सहसंयोजक ठोस है तथा इसका उदाहरण हीरा है जो कि अत्यधिक कठोर है। यह ठोस एवं गलित दोनों ही अवस्थाओं में विद्युतरोधी है अर्थात् विद्युत का चालन नहीं करता और अत्यंत उच्च ताप पर पिघलता है क्योंकि इसका गलनांक उच्च होता है।
प्रश्न 1.7.
आयनिक ठोस गलित अवस्था में विद्युत चालक होते हैं परंतु ठोस अवस्था में नहीं, व्याख्या कीजिए।
उत्तर:
आयनिक ठोस में, ठोस अवस्था में भी आयन तो होते हैं लेकिन ये आयन स्वतंत्र नहीं होते हैं, अत: ठोस अवस्था में ये विद्युत का चालन नहीं करते। गलित अवस्था में आयन स्वतंत्र हो जाते हैं, अत: इस अवस्था में इन स्वतंत्र आयनों के कारण ही विद्युत का चालन होता है।
![]()
प्रश्न 1.8.
किस प्रकार के ठोस विद्युत चालक, आघातवध्र्य और तन्य होते हैं?
उत्तर:
धात्विक ठोस विद्युत चालक, आघातवर्ध्य तथा तन्य होते हैं क्योंकि धात्विक ठोस के उदाहरण धातुएँ हैं तथा धातुओं में ये सभी गुण पाए जाते हैं।
प्रश्न 1.9.
‘जालक बिन्दु’ से आप क्या समझते हैं?
उत्तर:
किसी क्रिस्टल में अवयवी कणों (परमाणु, अणु या आयन) की त्रिविमीय व्यवस्था में प्रत्येक कण को एक बिंदु (point) द्वारा दर्शाया जाता है। इसे जालक बिन्दु कहते हैं।
प्रश्न 1.10.
एकक कोष्ठिका (unit cell) को अभिलक्षणित (characterise) करने वाले पैरामीटरों के नाम बताइए।
उत्तर:
एकक कोष्ठिका को अभिलक्षणित करने के लिए निम्नलिखित पैरामीटर आवश्यक होते हैं-
- एकक कोष्ठिका में अवयवी कणों की संख्या
- संकुलन क्षमता (packing efficiency)
- उपसहसंयोजन संख्या (coordination number)
- किनारे की लम्बाई या अक्षीय दूरी a,b तथा c.
- अक्ष्षीय कोण α, β तथा γ ।
प्रश्न 1.11.
निम्नलिखित में विभेद कीजिए-
(i) षट्कोणीय और एकनताक्ष एकक कोष्ठिका
(ii) फलक-केंद्रित और अंत्य-कें द्रित एकक कोष्ठिका।
उत्तर:
(i) षट्कोणीय एकक कोष्ठिका केवल आद्य (primitive) प्रकार की होती है। इसमें एक भुजा की लंबाई दो अन्य भुजाओं से भिन्न होती है (a = b ≠ c) । इसमें अक्षीय कोण α = β = 90° तथा γ = 120° होता है। इसके फलकों पर चिह्नित कोण 60° हैं। एकनताक्ष कोष्ठिका में आद्य तथा अंत्य-केन्द्रित (end centred) विविधताएं होती हैं। इसमें भी एक भुजा की लंबाई, दो अन्य भुजाओं से भिन्न होती है (a = b ≠ c) । अक्षीय कोण α = β = 90° तथा β ≠ 120° होता है। इसमें असमान भुजाएँ दो फलकों के मध्य 90° से भिन्न हैं।
(ii) फलक-केन्द्रित एकक कोष्ठिका में अवयवी परमाणु सभी कोनों पर और घन के सभी फलकों के केंद्रों पर पाए जाते हैं जबकि अन्त्य-केन्द्रित एकक कोष्ठिका में अवयवी परमाणु सभी कोनों पर और घन के केवल दो समानान्तर फलकों के केंद्रों पर पाए जाते हैं। अतः फलक-केन्द्रित एकक कोष्ठिका में परमाणुओं की कुल संख्या 4 होती है जबकि अंत्य-केन्द्रित एकक कोष्ठिका में परमाणुओं की कुल संख्या 2 होती है।
प्रश्न 1.12.
स्पष्ट कीजिए कि एक घनीय एकक कोष्ठिका के-
(i) कोने और
(ii) अंतःकेन्द्र पर उपस्थित परमाणु का कितना भाग सन्निकट कोष्ठिका से सहभाजित होता है।
उत्तर:
एक घनीय एकक कोष्ठिका के कोने पर स्थित परमाणु आठ एकक कोष्ठिका से सम्पर्क में रहता है। अत: उसका एक एकक कोष्ठिका में योगदान \(\frac { 1 }{ 8 }\) होता है। अत: कोने वाले परमाणुओं का कुल योगदान
(i) 8 कोने × \(\frac { 1 }{ 8 }\) प्रति कोना परमाणु = 8 × \(\frac { 1 }{ 8 }\) = 1 परमाणु
(ii) अंतः केंद्र का परमाणु पूर्णतया उसी एकक कोष्ठिका से संबंधित होता है जिसमें वह उपस्थित होता है।
अत: 1 अंत:केन्द्र परमाणु = 1 × 1 = 1 परमाणु
प्रश्न 1.13.
एक अणु (परमाणु) की वर्ग निविड संकुलित परत में द्विविमीय उपसहसंयोजन संख्या क्या है?
उत्तर:
एक अणु की वर्ग निविड संकुलित (square close packing) परत में द्विविमीय उपसहसंयोजन संख्या 4 होती है क्योंक इसमें प्रत्येक गोला चार निकटवर्ती गोलों के सम्पर्क में रहता है।
प्रश्न 1.14.
एक यौगिक षट्कोणीय निविड संकुलित संरचना बनाता है। इसके 0.5 मोल में कुल रिक्तियों की संख्या कितनी है? उनमें से कितनी रिक्तियाँ चतुष्फलकीय हैं?
उत्तर:
षट्कोणीय निविड संकुलित संरचना (Hexagonal close packed structure) में प्रत्येक कण के लिए 2 चतुष्फलकीय रिक्तियाँ तथा एक अष्टफलकीय रिक्ति होती है। अत: इसके 0.5 मोल में-
रिक्तियों की कुल संख्या
= 0.5 × NA × 3, (NA = आवोगाद्रो संख्या)
= 1.5 × 6.022 × 1023
≈ 9.033 × 1023
तथा इनमें से चतुष्फलकीय रिक्तियाँ
= 0.5 × NA × 2
= 1 NA = 1 × 6.022 × 1023
≈ 6.022 × 1023
प्रश्न 1.15.
एक यौगिक, दो तत्वों M और N से बना है। तत्व N, ccp संरचना बनाता है और M के परमाणु चतुष्फलकीय रिक्तियों के 1/3 भाग को अध्यासित (ग्रहण) करते हैं। यौगिक का सूत्र क्या है?
उत्तर:
ccp संरचना में एकक कोष्ठिका में परमाणुओं की कुल संख्या 4 होती है। परमाणु N,ccp संरचना बना रहा है। अत: परमाणु N की संख्या = 4
चतुष्फलकीय रिक्तियों की कुल संख्या = 2 × 4 = 8
(क्योंक चतुष्फलकीय रिक्तियों की संख्या, परमाणुओं की संख्या की दुगुनी होती है।)
चूंकि चतुष्फलकीय रिक्तियों के \(\frac { 1 }{ 3 }\) भाग को परमाणु M अध्यासित कर रहा है अत: परमाणु M की संख्या = 8 × \(\frac { 1 }{ 3 }\)
इसलिए N : M
4 : \(\frac { 8 }{ 3 }\) = 12 : 8 = 3 : 2
अत: यौगिक का सूत्र N3M2 या M2N3 होगा।
प्रश्न 1.16.
निम्नलिखित में से किस जालक में उच्यतम संकुलन क्षमता है?
(i) सरल घनीय,
(ii) अंतःकेन्द्रित घन और
(iii) षट्कोणीय निविड संकुलित जालक।
उत्तर:
उपर्युक्त में से षट्कोणीय निविड संकुलित जालक की संकुलन क्षमता उच्चतम (74%) होती है। सरल घन की संकुलन क्षमता 52.4% तथा अन्तःकेन्द्रित घन की संकुलन क्षमता 68% होती है।
![]()
प्रश्न 1.17.
एक तत्व का मोलर द्रव्यमान 2.7 × 10-2kg mol-1 है, यह 405 pm लंबाई की भुजा वाली घनीय एकक कोष्ठिका बनाता है। यदि उसका घनत्व 2.7 × 10-3 kg m-3 है तो घनीय एकक कोष्ठिका की प्रकृति क्या है?
उत्तर:
घनत्व, d = \(\frac{\mathrm{zM}}{\mathrm{a}^3 \cdot \mathrm{N}_{\mathrm{A}}}\)
घनत्व, d = 2.7 × 103 kg m-3
z = एक एकक कोष्ठिका में उपस्थित परमाणुओं की संख्यां
a3 = एकक कोष्ठिका का आयतन
a = एकक कोष्ठिका के कोर की लम्बाई = 405 pm
= 405 × 10-12m
NA = आवोगाद्रो संख्या = 6.022 × 1023
M = मोलर द्रव्यमान = 2.7 × 10-2 kg mol-1 मान रखने पर
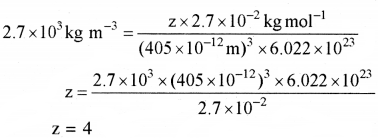
चूंकि एक एकक कोष्ठिका में परमाणुओं की संख्या 4 है अतः एकक कोष्ठिका ccp या fcc होगी।
प्रश्न 1.18.
जब एक ठोस को गरम किया जाता है तो किस प्रकार का दोष उत्पन्न हो सकता है ? इससे कौनसे भौतिक गुण प्रभावित होते हैं और किस प्रकार?
उत्तर:
जब एक ठोस को गर्म किया जाता है तो रिक्तिका दोष (vacancy defect) या शॉट्की दोष उत्पन्न हो सकता है। इससे कुछ जालक स्थल (lattice site) रिक्त हो जाते हैं इसलिए ठोस का घनत्व कम हो जाता हैं क्योंकि द्रव्यमान की तुलना में आयतन अधिक हो जाता है।
प्रश्न 1.19.
निम्नलिखित किस प्रकार का स्टॉइकियोमीट्री दोष दर्शाते हैं?
(i) ZnS
(ii) AgBr
उत्तर:
(i) ZnS में फ्रेंकेल दोष पाया जाता है क्योंकि धनायन तथा ऋणायन के आकार में अन्तर अधिक है।
(ii) AgBr फ्रेंकेल तथा शॉट्की दोनों प्रकार के दोष दर्शाता है।
प्रश्न 1.20.
समझाइए कि एक उच्च संयोजी धनायन को अशुद्धि की तरह मिलाने पर आयनिक ठोस में रिक्तिकाएं किस प्रकार प्रविष्ट होती हैं?
उत्तर:
एक उच्च संयोजी धनायन को अशुद्धि की तरह मिलाने पर आयनिक ठोस में रिक्तिकाएं प्रविष्ट हो जाती हैं क्योंक उच्च संयोजी धनायन मिलाने पर वह निम्न संयोजी धनायन की अधिक संख्या को विस्थापित करता है। जैसे NaCl में SrCl2 मिलाने पर एक Sr2+ दो Na+ को विस्थापित करता है जिसमें से एक Na+ के स्थान पर तो एक Sr2+ आ जाता है लेकिन एक रिक्तिका उत्पन्न हो जाती है।
प्रश्न 1.21.
जिन आयनिक ठोसों में धातु आधिक्य दो के कारण ऋणायनिक रिक्तिका होती हैं, वे रंगीन होते हैं। इं उपयुक्त उदाहरण की सहायता से समझाइए।
उत्तर:
जिन आयनिक ठोसों में धातु आधिक्य दोष के कार ऋणायनिक रिक्तिका होती हैं, वे रंगीन होते हैं। इसे निम्नलिखि उदाहरण द्वारा समझा सकते हैं-
जब NaCl के क्रिस्टल को सोडियम वाष्प के साथ किया जाता है, तो सोडियम परमाणु क्रिस्टल की सतह पर जम जा हैं। Cl– आयन क्रिस्टल की सतह में विसरित हो जाते हैं और Na परमाणुओं के साथ मिलकर NaCl बना देते हैं। Na+ आयन बनाने लिए Na से एक इलेक्ट्रॉन निकलकर क्रिस्टल के ऋणायनिक स्था को ग्रहण करता है ।
जिससे क्रिस्टल में सोडियम का आधिक्य होता है अयुग्मित इलेक्ट्रॉनों युक्त ऋणायनिक रिक्तिकाओं को F- केन्द्र कह हैं। ये NaCl के क्रिस्टलों को पीला रंग प्रदान करते हैं क्यों क्रिस्टल पर पड़ने वाले प्रकाश से ये इलेक्ट्रॉन ऊर्जा को अवशोष्षि करके उत्तेजित हो जाते हैं। इसी प्रकार लीथियम का आधिक्य LiCl क्रिस्टल को गुलाबी रंग देता है और पोटैशियम का आधिक्य KCl क्रिस्टल को बैंगनी बनाता है।
प्रश्न 1.22.
वर्ग 14 के तत्व को n – प्रकार के अर्धचालक में उपयुक्त अशुद्धि द्वारा अपमिश्रित (doping) करके रूपान्तरित करना है। यह अशुद्धि किस वर्ग से संबंधित होनी चाहिए?
उत्तर:
वर्ग 14 के तत्व को n- प्रकार के अर्धचालक में रूपान्तरित करने के लिए 15 वें वर्ग के तत्व के साथ अपमिश्रित करना होगा। जैसे Si के साथ P (फॉस्फोरस) मिलाते हैं क्योंक 15 वें वर्ग के बाह्यतम कोश में 5 इलेक्ट्रॉन होते हैं, उनमें से 4 इलेक्ट्रॉन तो बन्ध बनाने में प्रयुक्त हो जाते हैं तथा बचा हुआ पांचवाँ इलेक्ट्रॉन विस्थापित होता है। यहाँ चालकता में वृद्धि ऋणावेशित (Negative) इलेक्ट्रॉन के कारण होती है। अत: इसे n- प्रकार का अर्धचालक कहते हैं।
प्रश्न 1.23.
किस प्रकार के पदार्थों से अच्छे स्थायी चुंबक बनाए जा सकते हैं, लोह चुम्बकीय अथवा फेरीचुम्बकीय? अपने उत्तर का औचित्य बताइए।
उत्तर:
लौहचुंबकीय पदार्थों से अच्छे स्थायी चुंबक बनाए जाते हैं क्योंक ये चुंबकीय क्षेत्र की ओर प्रबलता से आकर्षित होते हैं। ठोस अवस्था में, लोहचुंबकीय पदार्थों के धातु आयन छोटे खंडों में एक साथ समूहित हो जाते हैं, इन्हें डोमेन कहते हैं।
प्रत्येक डोमेन एक छोटे चुंबक की तरह व्यवहार करता है। लोहचुंबकीय पदार्थ के अचुंबकीय टुकड़े में डोमेन अनियमित रूप से अभिविन्यासित (oriented) होते हैं अत: उनका चुंबकीय आघूर्ण निरस्त हो जाता है। इस पदार्थ को चुंबकीय क्षेत्र में रखने पर सभी डोमेन चुंबकीय क्षेत्र की दिशा में अभिविन्यासित हो जाते हैं जिससे प्रबल चुंबकीय प्रभाव उत्पन्न होता है तथा चुंबकीय क्षेत्र को हटा लेने पर भी डोमेनों का क्रम बना रहता है अतः लोहचुंबकीय पदार्थ (ferromagnetic substance) स्थायी चुंबक बन जाते हैं।
![]()